Method Article
Комплексный анализ прокоагулянтных тромбоцитов, проявляющих признаки некроза, апоптоза и активации тромбоцитов
В этой статье
Резюме
Настоящий протокол предоставляет полный набор процедур, необходимых для анализа прокоагулянтных тромбоцитов, которые демонстрируют перекрывающиеся признаки некроза, апоптоза и активации тромбоцитов.
Аннотация
Тромбоциты, циркулирующие в кровотоке, относительно спокойны, но становятся «активируемыми» при встрече со стимуляторами или «агонистами» в месте повреждения кровеносных сосудов. Проагрегаторные и прокоагулянтные тромбоциты представляют собой две различные популяции активированных тромбоцитов. В то время как проагрегаторные тромбоциты способствуют остановке кровотечения, или «гемостаза», образуя пробку из тромбоцитов, слипшихся через фибриногеновые мостики, прокоагулянтные тромбоциты резко ускоряют коагуляционный каскад, достигая кульминации в образовании фибринового сгустка. Интересным аспектом прокоагулянтных тромбоцитов является то, что их морфология проявляет определенные черты «некроза» и «апоптоза». Таким образом, они могут представлять собой форму клеточной смерти тромбоцитов, хотя и играют важную роль в тромбозе и гемостазе. В данной статье представлено понятие прокоагулянтных тромбоцитов, их значение для здоровья и заболевания, а также сравнение существующих методов их анализа. Затем он предоставляет исчерпывающие протоколы для анализа прокоагулянтных тромбоцитов, изучения механизмов их образования и оценки их протромботической роли в содействии коагуляции. Статья завершается обсуждением ключевых шагов, ограничений и принципов устранения неполадок для описанных методов.
Введение
Существует, по крайней мере, две различные популяции активированных тромбоцитов 1,2. Проагрегационные тромбоциты характеризуются высокой активацией интегринов и низким, если таковой имеется, экспозицией PS. С другой стороны, прокоагулянтные тромбоциты характеризуются низкой интегринной активностью и высокой экспозицией ПС 1,2, обеспечивая поверхность для сборки комплексов теназы и протромбиназы3, которая в 105-10 раз в6 и 300000 раз активнее отдельных растворимых фазовых факторов IXa и Xa соответственно4. Таким образом, прокоагулянтные тромбоциты резко ускоряют свертывание крови. Интересным аспектом прокоагулянтных тромбоцитов является то, что их морфология напоминает некоторые признаки «некроза», такие как микровезикуляция, раздувание клетки с нарушением цитоскелета и потеря целостности мембраны, а также «апоптоза», такого как потеря фосфолипидной асимметрии мембраны при воздействии фосфатидилсерина на наружный листок 5,6. Другими словами, образование прокоагулянтных тромбоцитов может представлять собой форму гибели клеток тромбоцитов, хотя и с важной физиологической функцией в гемостазе.
Прокоагулянтные тромбоциты в значительной степени связаны с тромботическими нарушениями. В то время как большинство здоровых людей не имеют циркулирующих прокоагулянтных тромбоцитов, ~30% нормальных донорских тромбоцитов принимают прокоагулянтный фенотип ex vivo после воздействия сильных агонистов, таких как тромбин и коллаген7. Сообщалось о циркулирующих прокоагулянтных тромбоцитах при травме, где их образование может отражать активацию гистоном H4 8,9. Однако при большинстве протромботических расстройств повышенный уровень прокоагулянтных тромбоцитов обнаруживается только после стимуляции ex vivo10. Например, пациенты с острым инсультом, у которых >51,1% тромбоцитов были преобразованы в прокоагулянтные тромбоциты (также известные как тромбоциты COAT) с помощью коллагена и тромбина, имели отношение рисков 10,72 для повторного инсульта в течение 30 дней по сравнению с пациентами с меньшим образованием прокоагулянтных тромбоцитов11. Аналогичные результаты были зарегистрированы у пациентов с транзиторными ишемическими атаками и каротидным атеросклерозом12. Напротив, синдром Скотта с нарушением свертываемости крови является результатом мутации ANO6, которая кодирует фосфолипидскрамблазу TMEM-16F, что приводит к недостаточному воздействию тромбоцитарного PS13. Идиопатические нарушения свертываемости крови и внутричерепные кровотечения могут быть связаны со снижением способности вырабатывать прокоагулянтные тромбоциты14.
Таким образом, оценка прокоагулянтных тромбоцитов является частью любого анализа функции тромбоцитов не только при базовом исследовании механизмов активации тромбоцитов и последующего тромбоза и гемостаза, но и при клиническом анализе риска тромбоза или кровотечения у пациентов при различных патологических состояниях. Группа экспертов Международного общества по тромбозу и гемостазу (ISTH) рекомендовала использовать связывание Аннексина V и экспрессию Р-селектина методом проточной цитометрии для дифференциации прокоагулянтов из других субпопуляций тромбоцитов15. В статье также обсуждаются различные методы, которые могут быть использованы для анализа прокоагулянтных и апоптотических тромбоцитов, но подробно описываются процессы. Эти методы включают обнаружение (1) активации тромбоцитов с помощью PAC1/JonA или связывания фибриногена (проточная цитометрия); (2) секреция альфа-гранул с помощью экспрессии Р-селектина (проточная цитометрия); (3) воздействие ФС путем связывания аннексина V/лактадерина (проточная цитометрия); (4) потеря целостности мембраны при мечении GSAO (проточная цитометрия); (5) морфологические изменения, такие как баллонирование (микроскопия); (6) обнаружение активации каспазы с помощью анализа каспазы (иммуноблоттинг/люминометрия/проточная цитометрия) или деградации цитоскелетного субстрата гелсолина (иммуноблоттинг); (7) потеря потенциала митохондриальной мембраны митохондриальными потенциал-чувствительными красителями, такими как JC-1/Mitotracker (проточная цитометрия); (8) митохондриальные внутренние апоптотические маркеры Bax, Bak и высвобождение цитохрома с (иммуноблоттинг); (9) функция прокоагулянтов по анализу генерации тромбина и связыванию фактора свертывания крови Xa/Va (проточная цитометрия, микроскопия); (10) цитозольный и митохондриальный кальций повышаются с помощью флуоресцентных кальций-чувствительных красителей (проточная цитометрия, флуориметрия, микроскопия).
В настоящем исследовании подробно рассматриваются протоколы анализа прокоагулянтных тромбоцитов, а также их отличия от проагрегационных и апоптотических тромбоцитов. Большинство описанных процедур основаны на проточной цитометрии, которая имеет следующие преимущества: (1) она легко доступна и проста в использовании, (2) требует небольшого объема образца и (3) позволяет одновременно обнаруживать несколько субпопуляций тромбоцитов (проагрегационных, прокоагулянтных и апоптотических)15. Эти протоколы, основанные на проточной цитометрии, дополнены функциональными анализами активности прокоагулянтов на основе связывания с фактором свертывания крови и анализами генерации тромбина на основе тромбов.
протокол
Люди были набраны для забора крови из периферических вен после получения письменного информированного согласия, строго следуя рекомендациям и одобрению Институционального наблюдательного совета Научно-исследовательского института Лернера Кливлендской клиники, при этом все методологии исследования соответствовали стандартам, установленным Хельсинкской декларацией. Были включены здоровые взрослые участники старше 18 лет, в то время как лица моложе 18 лет, лица с недавним анамнезом тромботических событий в течение последних шести месяцев, лица с историей алкоголизма или злоупотребления наркотиками, а также участники, которые использовали антитромбоцитарные или антикоагулянтные препараты в течение последних четырех недель, были исключены. С подробным описанием материалов и реагентов, используемых в протоколах, можно ознакомиться в Таблице материалов.
1. Подготовка тромбоцитов
- Забор образцов периферической венозной крови в антикоагулянт ACD (1:9 v/v) у участников после получения письменного информированного согласия, строго следуя рекомендациям, утвержденным Институциональным наблюдательным советом.
- Центрифугируйте кровь, собранную в ACD при 100 x g, в течение 20 мин при 22 °C с получением обогащенной тромбоцитами плазмы (PRP) в качестве надосадочной жидкости.
- Центрифугируйте PRP при 800 x g в течение 7 мин при 22 °C после добавления 3 мкМ PGE1 и 2 мМ ЭДТА.
- Выбросьте надосадочную жидкость и ресуспендируйте тромбоцитарную гранулу в буфере А (см. Таблицу материалов) с помощью осторожного пипетирования.
- Центрифугируйте тромбоциты, ресуспендированные в буфере А при 800 x g в течение 7 мин при 22 °C.
- Ресуспендируйте тромбоцитарную гранулу в буфере В (см. Таблицу материалов) с помощью щадящего пипетирования.
- Отрегулируйте итоговое количество тромбоцитов до 1 × 107/мл с помощью автоматического счетчика клеток.
ПРИМЕЧАНИЕ: Выполняйте все шаги в стерильных условиях и принимайте меры предосторожности для поддержания тромбоцитов в состоянии покоя, избегая воздействия чрезмерного сдвига во время пипетирования.
2. Анализ прокоагулянтных тромбоцитов методом проточной цитометрии
- Дополните промытые тромбоциты человека 2,5 мМ кальцием (0,5 мкл стокового раствора CaCl2 0,5 М в 100 мкл тромбоцитарной суспензии).
- Не стимулируйте одну фракцию тромбоцитов и стимулируйте остальные фракции тромбином (0,1 Ед/мл, 0,25 Ед/мл, 0,5 Ед/мл), конвульксином (20 нг/мл, 50 нг/мл, 100 нг/мл) или их комбинацией в течение 15 мин при комнатной температуре.
- После стимуляции добавьте по 1 мкл PE-аннексина V, FITC-PAC1 и антитела APC-античеловеческого CD62P к 100 мкл стимулированных тромбоцитарных суспензий.
- Инкубируйте тромбоциты в темноте при комнатной температуре в течение 30 минут.
- Зафиксируйте тромбоциты, добавив равный объем (1:1) 2% формалина.
- Анализ образцов с помощью проточной цитометрии для количественного определения прокоагулянтных тромбоцитов15,16.
- Нарисуйте аморфный затвор, чтобы охватить тромбоциты, отделив их от шума и мультитромбоцитарных частиц.
- Соберите все флуоресцентные данные с помощью четырехквадрантной логарифмической амплификации для 10 000 событий в тромбоцитарном затворе из каждого образца.
- Определите области для тромбоцитов на основе положительной или отрицательной флуоресцентной способности к воздействию фосфатидилсерина (PS) (связывание с аннексином V), экспрессии P-селектина (CD62P) и активации интегрина αIIbβ3 (связывание PAC1).
- Рассматривайте тромбоциты положительными как для воздействия PS (связывание с аннексином V), так и для экспрессии P-селектина (CD62P), но отрицательными для активации интегрина αIIbβ3 (связывание PAC1) в качестве прокоагулянтных тромбоцитов (рис. 1) (табл. 1).
- Аналогичным образом, рассматривайте тромбоциты положительными как для активации интегрина αIIbβ3 (связывание PAC1), так и с экспрессией P-селектина (CD62P), но отрицательными для экспозиции PS (связывание с аннексином V) в качестве проагрегаторных тромбоцитов.
ПРИМЕЧАНИЕ: Тромбоциты, отрицательные как по активации интегрина αIIbβ3 (связывание PAC1), так и по экспрессии P-селектина (CD62P), но положительные по воздействию PS (связывание с аннексином V), вероятно, являются апоптотическими тромбоцитами15,16.
3. Анализ митохондриального кальция методом проточной цитометрии
- Разведите промытые тромбоциты человека до 1 × 106/мл и добавьте 2,5 мМ кальция (0,5 мкл стокового раствора CaCl2 0,5 М в 100 мкл тромбоцитарной суспензии).
- Пометьте тромбоциты 5 мкМ Rhod-2 AM (для митохондриального кальция) в течение 30 минут в темноте.
- Загатите тромбоциты соответствующим образом, как описано в шаге 2.
- Проанализируйте события в тромбоцитарном затворе на предмет зависящих от времени изменений средней флуоресценции зарегистрированных событий в течение 5 мин с помощью диаграммы плотности рассеяния флуоресценции ПЭ (для Rhod-2 AM) в зависимости от времени.
- Запишите исходный уровень кальция в течение первой 1 минуты.
- Добавьте тромбин (0,1 ЕД/мл, 0,25 ЕД/мл или 0,5 ЕД/мл), конвульксин (20 нг/мл, 50 нг/мл или 100 нг/мл) или их комбинацию и продолжайте сбор данных еще 4 мин17.
4. Анализ потенциала митохондриальной мембраны методом проточной цитометрии
- Дополните промытые тромбоциты человека 2,5 мМ кальцием (0,5 мкл стокового раствора CaCl2 0,5 М в 100 мкл тромбоцитарной суспензии).
- Не стимулируйте одну фракцию тромбоцитов и стимулируйте остальные фракции тромбином (0,1 Ед/мл, 0,25 Ед/мл или 0,5 Ед/мл), конвульксином (20 нг/мл, 50 нг/мл или 100 нг/мл) или их комбинацией в течение 15 минут при комнатной температуре.
- После стимуляции к стимулированным взвесям тромбоцитов добавляют краситель для мечения митохондрий (см. Таблицу материалов) в конечной концентрации 500 нМ.
- Инкубируйте тромбоциты в течение 30 минут в темноте.
- Зафиксируйте тромбоциты, добавив равный объем 2% формалина.
- Анализ образцов методом проточной цитометрии17.
- Загатите тромбоциты соответствующим образом, как описано в шаге 2.
- Проанализируйте события в тромбоцитарном затворе на предмет снижения флуоресценции в ПЭ-канале (для красителя для мечения митохондрий) проточного цитометра.
5. Анализ активности каспазы 3 и каспазы 8 методом проточной цитометрии
- Дополните промытые тромбоциты человека 2,5 мМ кальцием (0,5 мкл стокового раствора CaCl2 0,5 М в 100 мкл тромбоцитарной суспензии).
- Не стимулируйте одну фракцию тромбоцитов и стимулируйте остальные фракции тромбином (0,1 Ед/мл, 0,25 Ед/мл или 0,5 Ед/мл), конвульксином (20 нг/мл, 50 нг/мл или 100 нг/мл) или их комбинацией в течение 15 минут при комнатной температуре.
- После стимуляции добавьте к стимулированным тромбоцитарным суспензиям реагент для обнаружения апоптоза в соотношении 1:1000 (v/v) (см. Таблицу материалов) (для внутренних и внешних путей апоптоза) или 1:300 (v/v) FITC-IETD-FMK (для каспазы 8 внешнего пути апоптоза).
- Инкубируйте тромбоциты в течение 30 минут в темноте.
- Зафиксируйте тромбоциты, добавив равный объем 2% формалина.
- Анализ образцов методом проточной цитометрии17.
- Загатите тромбоциты соответствующим образом, как описано в шаге 2.
- Проанализируйте события в тромбоцитарном затворе на флуоресценцию в канале FITC (для каспазы 3/7 или каспазы 8) проточного цитометра.
6. Анализ связывания протромбина методом проточной цитометрии
- Конъюгировать бычий протромбин с красителем Alexa Fluor 488 с помощью набора для маркировки белка (см. Таблицу материалов), следуя инструкциям производителя.
- Дополните промытые тромбоциты человека 2,5 мМ кальцием (0,5 мкл стокового раствора CaCl2 0,5 М в 100 мкл тромбоцитарной суспензии).
- Не стимулируйте одну фракцию тромбоцитов и стимулируйте остальные фракции тромбином (0,1 Ед/мл, 0,25 Ед/мл или 0,5 Ед/мл), конвульксином (20 нг/мл, 50 нг/мл или 100 нг/мл) или их комбинацией в течение 15 минут при комнатной температуре.
- После стимуляции добавьте AF488-конъюгированный бычий протромбин (100 мкг/мл) и по 1 мкл антител PE-аннексин V и APC против человеческого CD62P к 100 мкл стимулированных тромбоцитарных суспензий.
- Зафиксируйте тромбоциты, добавив равный объем 2% формалина.
- Анализируйте образцы с помощью проточной цитометрии17 для количественного определения связывания протромбина с тромбоцитами.
- Нарисуйте аморфный затвор, чтобы охватить тромбоциты, отделенные от шума и многотромбоцитарных частиц.
- Соберите все флуоресцентные данные с помощью четырехквадрантной логарифмической амплификации для 10 000 событий в тромбоцитарном затворе из каждого образца.
- Нарисуйте области для тромбоцитов с положительной или отрицательной флуоресценцией на воздействие PS (связывание с аннексином V), экспрессию P-селектина (CD62P) и AF488-протромбина (связывание с протромбином).
- Определите долю всех тромбоцитарных событий, а также долю тромбоцитов, положительных как на воздействие PS (связывание с Аннексином V), так и на экспрессию P-селектина (CD62P) (прокоагулянтные тромбоциты), которые являются положительными на связывание с протромбином.
7. Анализ связывания протромбина методом конфокальной микроскопии
- Конъюгировать бычий протромбин с красителем Alexa Fluor 488 с помощью набора для маркировки белка (см. Таблицу материалов), следуя инструкциям производителя.
- Дополните промытые тромбоциты человека 2,5 мМ кальцием (0,5 мкл стокового раствора CaCl2 0,5 М в 100 мкл тромбоцитарной суспензии).
- Не стимулируйте одну фракцию тромбоцитов и стимулируйте остальные фракции тромбином (0,1 Ед/мл, 0,25 Ед/мл или 0,5 Ед/мл), конвульксином (20 нг/мл, 50 нг/мл или 100 нг/мл) или их комбинацией в течение 15 минут при комнатной температуре.
- После стимуляции добавьте AF488-конъюгированный бычий протромбин (100 мкг/мл) и по 1 мкл антител PE-аннексин V и APC против человеческого CD62P к 100 мкл стимулированных тромбоцитарных суспензий.
- Зафиксируйте тромбоциты, добавив равный объем 2% формалина.
- Гранулируйте зафиксированные тромбоциты на покровные стекла, покрытые поли-D-лизином.
- Закрепите покровные стекла на предметных стеклах для микроскопии с помощью решения против выцветания.
- В качестве альтернативы можно нанести покровные салфетки с коллагеном (100 мкг/мл) на 1 час во влажной камере.
- Заблокируйте покровные стекла с покрытием 0,5% BSA в PBS на 1 час.
- Пометьте тромбоциты AF488-конъюгированным бычьим протромбином (100 мкг/мл) и по 1 мкл PE-аннексина V и антитела APC против человеческого CD62P.
- Дайте меченым тромбоцитам прилипнуть в течение 20 минут на покровных стеклах, покрытых коллагеном.
- Промойте покровные листы с прилипшими тромбоцитами три раза с PBS.
- Закрепить покровные стекла 2% параформальдегидом на 1 ч.
- Закрепите покровные стекла на предметных стеклах для микроскопии с помощью решения против выцветания.
- Наблюдайте за предметными стеклами под конфокальным микроскопом при увеличении объектива 63×.
- Анализируйте изображения с помощью программного обеспечения Fiji для количественной оценки флуоресценции.
8. Анализ фосфолипид-зависимого образования тромбина на основе тромбов
- Дополните промытые тромбоциты человека 2,5 мМ кальцием (0,5 мкл стокового раствора CaCl2 0,5 М в 100 мкл тромбоцитарной суспензии).
- Не стимулируйте одну фракцию тромбоцитов и стимулируйте остальные фракции тромбином (0,1 Ед/мл, 0,25 Ед/мл или 0,5 Ед/мл), конвульксином (20 нг/мл, 50 нг/мл или 100 нг/мл) или их комбинацией в течение 15 минут при комнатной температуре.
- Добавьте 100 мкл обработанных тромбоцитов к смеси из 50 мкл объединенной нормальной плазмы и 50 мкл раствора каолина с низкой мутностью (20 мг/мл), предварительно инкубированной при 37 °C в течение 5 мин.
- Добавьте в смесь 5 мМ CaCl2 .
- Контролируйте образование тромба с помощью мутиметрии на микропланшетном ридоре, измеряя поглощение при длине волны 660 нм каждые 60 с в течение 1 ч.
Результаты
Часть активированных тромбоцитов становится «прокоагулянтной» с характерным увеличением поверхностной экспрессии как фосфатидилсерина (ФС), так и Р-селектина, что отличает их от «апоптотических» тромбоцитов, положительных только на воздействие ФС, а также от «проагрегаторных» тромбоцитов, положительных на экспрессию Р-селектина. Мы обнаружили, что тромбин индуцирует дозозависимое увеличение доли прокоагулянтных тромбоцитов, положительных как на экспрессию P-селектина, так и на PS, что обнаруживается при связывании антител FITC-анти-CD62P и PE-аннексина V соответственно (рис. 2). Генерация прокоагулянтных тромбоцитов зависит от притока митохондриального кальция18,19 вдоль электрохимического градиента через внутреннюю митохондриальную мембрану, от индуцированного агонистами повышения цитозольного кальция, а также от последующего образования циклофилина D (CypD)-зависимого от митохондриальной проницаемости переходной поры (mPTP)20. В целом, индуцированное тромбином увеличение активности прокоагулянтов было связано с увеличением митохондриального кальция (рис. 3) и снижением потенциала митохондриальной мембраны (рис. 4), измеренным с помощью красителей Rhod-2 и Mitotracker Red соответственно. Стимулированные тромбоциты демонстрируют признаки апоптоза, включая накопление Bax/Bak21,22; Активирует ли это каспазу23,24 и способствует ли это воздействию PS25, остается спорным. Стимуляция тромбином тромбоцитов была связана с активацией каспазы 8, но не терминальных каспаз 3 и 7 (рис. 5), что было проанализировано с помощью FITC-IETD-FMK и реагента для обнаружения апоптоза, соответственно.

Рисунок 1: Анализ прокоагулянтных тромбоцитов. Принципиальная диаграмма, изображающая анализ прокоагулянтных тромбоцитов методом проточной цитометрии с использованием антител FITC-PAC1, APC-anti-CD62P и PE-Annexin V в качестве флуоресцентных зондов для определения активации интегрина, экспрессии P-селектина и экспозиции PS соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
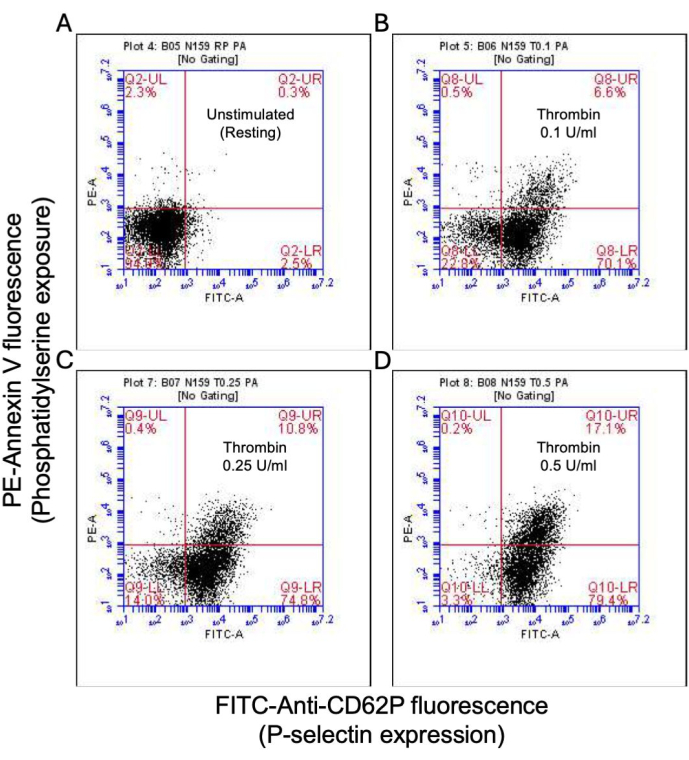
Рисунок 2: Экспрессия P-селектина и экспозиция фосфатидилсерина в тромбоцитах при стимуляции тромбином. Репрезентативные точечные диаграммы, показывающие положительные результаты тромбоцитов на экспрессию P-селектина и/или экспозицию PS в (A) нестимулированных тромбоцитах и при воздействии тромбина в дозах (B) 0,1 Ед/мл, (C) 0,25 Ед/мл и (D) 0,5 Ед/мл, обнаруженных с помощью флуоресценции FITC-anti-CD62P и PE-аннексина V с помощью проточной цитометрии. Цифры в скобках указывают на долю общего количества тромбоцитов в каждом квадранте графика. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
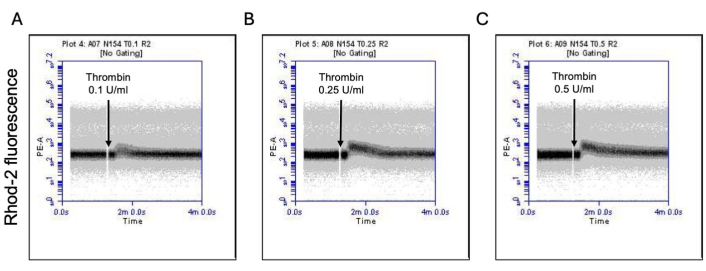
Рисунок 3: Зависящие от времени изменения уровня кальция в митохондриях в тромбоцитах при воздействии тромбина. Репрезентативные графики плотности, показывающие зависящие от времени изменения флуоресценции под действием красителя Rhod-2, указывающие на уровни митохондриального кальция в тромбоцитах при воздействии тромбина в дозах (A) 0,1 Ед/мл, (B) 0,25 Ед/мл и (C) 0,5 Ед/мл, обнаруженных с помощью проточной цитометрии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
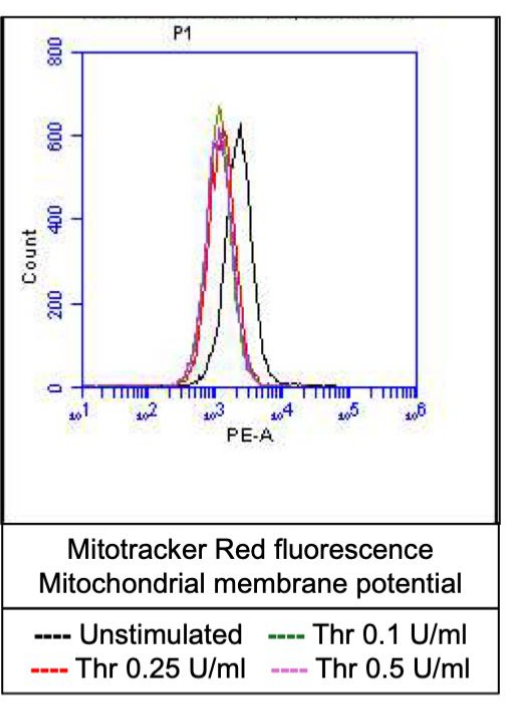
Рисунок 4: Потенциал митохондриальной мембраны в тромбоцитах при стимуляции тромбином. На этом рисунке показаны репрезентативные наложения гистограммы, изображающие флуоресценцию из-за мечения митохондрий красителем, указывающим на потенциал митохондриальной мембраны в тромбоцитах при воздействии различных доз тромбина, как это обнаруживается с помощью проточной цитометрии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
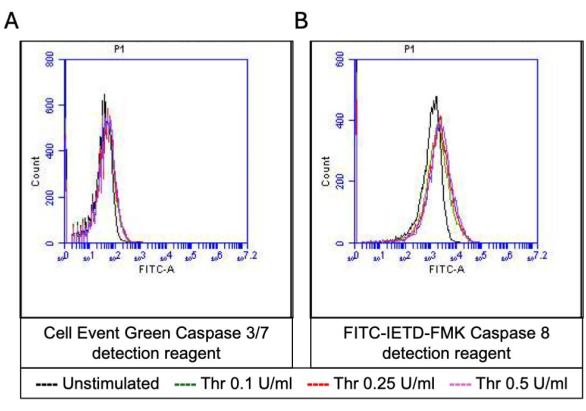
Рисунок 5: Активность каспазы 3/7 и каспазы 8 в тромбоцитах при стимуляции тромбином. Репрезентативные наложения гистограммы, показывающие флуоресценцию под действием (A) реагента для обнаружения апоптоза и (B) FITC-IETD-FMK, соответственно, указывают на активность каспазы 3/7 и каспазы 8 в тромбоцитах при воздействии различных доз тромбина, обнаруженных с помощью проточной цитометрии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Маркер | Прокоагулянтные тромбоциты | Проагрегаторные тромбоциты | Апоптотические тромбоциты |
| Активация интегрина (связывание PAC1) | Нет | Да | Нет |
| Секреция гранул | Да | Да | Нет |
| (выражение P-selectin) | |||
| Воздействие PS | Да | Нет | Да |
| (Приложение V переплет) |
Таблица 1: Маркеры проточной цитометрии для идентификации популяций тромбоцитов после стимуляции. В этой таблице представлены маркеры проточной цитометрии, используемые для обнаружения различных популяций тромбоцитов, которые появляются после стимуляции тромбоцитов сильными агонистами, такими как тромбин и конвульксин.
Обсуждение
Прокоагулянтные тромбоциты демонстрируют заметное и устойчивое повышение внутриклеточного кальция при стимуляции26, но могут быть получены с помощью различных механизмов. Они образуются при сильной стимуляции агонистами коллагеном и тромбином через различные медиаторы, включая наиболее заметный приток митохондриального кальция18,19 вдоль электрохимического градиента через внутреннюю митохондриальную мембрану при индуцированном агонистами повышении цитозольного кальция. Как только митохондриальный кальций достигает определенного порога, он активирует образование переходных пор митохондриальной проницаемости (mPTP) циклофилином D (CypD)-зависимым образом. Когда митохондрии проникают в кальций и больше не могут служить поглотителями для цитозольного кальция, сверхмаксимальная передача сигналов кальция наблюдается после образования mPTP26. Устойчиво высокие уровни цитозольного кальция, в свою очередь, активируют активацию TMEM16F кальций-зависимой фосфолипидскрамлазы, что приводит к воздействию PS27,28. Экспозиция ФС сопровождается инактивацией интегринаα IIbβ3 по двойному механизму, включающему кальпаин-зависимое расщепление интегрина β3 цитоплазматического хвоста, а также TMEM16F-зависимое скремблирование самих фосфолипидов29,30. Таким образом, прокоагулянтные тромбоциты, в отличие от проагрегаторных тромбоцитов, имеют неактивный интегрин. Кроме того, воздействие ФС обеспечивает поверхность для связывания факторов свертывания, облегчая сборку комплексов теназы и протромбиназы3. Таким образом, прокоагулянтные тромбоциты значительно ускоряют коагуляцию4.
Экспозиция ФС и последующая прокоагулянтная активность также могут быть индуцированы каспазозависимым расщеплением скрамблазы XKR8 в тромбоцитах, подвергающихся внутреннему апоптозу, независимо от активации25,31. Несмотря на то, что стимулированные тромбоциты демонстрируют признаки внутреннего апоптоза, включая накопление Bax/Bak21,22, вопрос о том, активирует ли это каспазы23,24 и способствует ли это воздействию PS25, остается спорным. О внешнем апоптозе TNFα или FasL в тромбоцитах не сообщалось, несмотря на присутствие большинства компонентов и некоторые доказательства активации каспазы 832. Тромбоциты при длительной стимуляции подвергаются MLKL-опосредованному некроптозу17, который, как известно, индуцирует воздействие PS независимо от CypD или каспазы33.
В этом исследовании был предложен метод детектирования прокоагулянтных тромбоцитов с использованием экспозиции PS (связывание с аннексином V), экспрессии P-селектина (CD62P) и активации интегринаα IIbβ3 (связывание PAC1) в качестве маркеров. Эти маркеры могут помочь эффективно отличить прокоагулянтные тромбоциты от апоптотических и проагрегаторных тромбоцитов15. Однако связывание аннексина V требует наличия высокого уровня кальция в среде. Следовательно, гепарин или другие ингибиторы тромбина должны использоваться при использовании обогащенной тромбоцитами плазмы или образцов цельной крови. Кроме того, ингибитор полимеризации фибрина GPRP используется, когда тромбин должен быть использован в качестве одного из агонистов с этими образцами34,35. Лактадерин или GSAO могут быть использованы в качестве альтернативных маркеров аннексину V, но у них есть свои ограничения. В то время как лактадерин не специфичен к PS и связывается с интегринами36,37, GSAO не является коммерчески доступным и может быть получен только в рамках исследовательского сотрудничества38.
В данной статье также представлены дополнительные методы исследования механизмов воздействия ФС, включая приток митохондриального кальция и образование переходных пор митохондриальной проницаемости (потеря потенциала митохондриальной мембраны). Здесь следует отметить, что эти методы могут быть дополнены измерениями цитозольного кальция с использованием красителей Fluo-4 и Fluo-5N. Поскольку остается неясным, способствует ли активация каспазы воздействию PS в стимулированных тромбоцитах, мы также перечисляем протоколы для анализов активации каспазы 8 и каспазы 3/7. Истинная «прокоагулянтная» природа тромбоцитов может быть подтверждена только их способностью связывать факторы свертывания крови и способствовать образованию тромбина. Таким образом, тщательное исследование тромбоцитов на предмет экспозиции PS (связывание с аннексином V), экспрессии P-селектина (CD62P) и активации интегринаIIbβ3 интегрина α (связывание PAC1), притока митохондриального кальция, потенциала митохондриальной мембраны, активности каспазы вместе со связыванием фактора свертывания крови (протромбина) и генерации/коагуляции фосфолипид-зависимого тромбина тромбоцитов, как описано в настоящей статье, было бы необходимым и достаточным для всестороннего анализа прокоагулянтных тромбоцитов.
Раскрытие информации
Авторы не имеют конкурирующих интересов для раскрытия информации.
Благодарности
Пареш. Кулкарни и Кит Р. МакКрей, соответственно, отмечают гранты стипендиатов и пилотов, финансируемые VeloSano, Фондом клиники Кливленда.
Материалы
| Name | Company | Catalog Number | Comments |
| Acid Citrate Dextrose (ACD) solution (For 1000 mL) | Tri- Sodium Citrate- 22 g Citric Acid- 8 g Dextrose- 24.5 g Water- Make up volume to 1000 mL | ||
| Alexa Fluor 488 protein labelling kit | Invitrogen | A10235 | |
| APC Mouse Anti-Human CD62P | BD Pharmingen | 550888 | |
| Bovine Prothrombin | Prolytix | BCP-1010 | |
| Buffer A (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 6.2 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution EGTA 1 mM Add 10 μL (1:100 v/v) 100 mM EGTA Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose PGE1 3 μM Add 3 μL (1:333 v/v) 1 mM PGE1 solution | ||
| Buffer B (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 7.4 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose | ||
| CaCl2 (0.5 M) (For 50ml) | Molecular weight of CaCl2.2H2O = 147.02 Dissolve 3.675 g of CaCl2.2H2O in 50 ml Milli Q water | ||
| CellEvent Caspase-3/7 Detection Reagents Green | Invitrogen | C10423 | Apoptosis detection reagent |
| Convulxin | Enzo Life Sciences | ALX-350-100 | |
| EDTA (0.5 M; pH 8) (For 100 mL) | Molecular Weight of EDTA Na2.2H2 O: 372.24g Weigh 18.612 g and suspend in 50 ml Milli Q water and check the pH (pH~4) Slowly add 10N NaOH with stirring and monitor the pH. EDTA starts solubilizing at around pH 7 and is completely soluble at pH 8. Make up the volume to 100 ml with Milli Q water. | ||
| EGTA (100 mM; pH 7.4) (For 100 mL) | Molecular Weight: 380.4 Add 3.804 g EGTA in 50 ml Milli Q water and check the pH (pH~3) Add 10 N NaOH dropwise while stirring and monitor the pH EGTA becomes soluble at pH 7.0 (approx) Adjust pH to 7.4 Make up the volume to 100 ml with Milli Q water | ||
| FITC Mouse Anti-Human PAC-1 | BD | 340507 | |
| FITC-IETD-FMK Caspase 8 (active) staining kit | Abcam | ab65614 | |
| Mitotracker Red CMXRos (mitochindria labeling dye) | Invitrogen | M7512 | Stock= 1 mM (50 µg dissolved in 90 µl DMSO) Sub-stock= 100 µM (10 µl Stock + 90 µl DMSO) Working concentration= 500nM (0.5 µl in 100 µl) |
| PE Annexin V | BD Pharmingen | 560930 | |
| Prostaglandin E1 | Sigma | P5515 | Stock= 20 mM (1 mg dissolved in 141 µL DMSO) Sub-stock= 1 mM (10 µl Stock + 190 µL DMSO) Working concentration= 3 µM (3 µL in 1 mL) |
| Rhod-2 AM | Invitrogen | R1244 | Stock= 5 mM (1 mg dissolved in 178 µL DMSO) Sub-stock= 100 µM (10 µL Stock + 90 µL DMSO) Working concentration= 500 nM (0.5 µL in 100 µL) |
| Thrombin from human plasma | Sigma | T7572 |
Ссылки
- Munnix, I., Cosemans, J., Auger, J., Heemskerk, J. Platelet response heterogeneity in thrombus formation. Thromb Haemost. 102 (12), 1149-1156 (2009).
- Heemskerk, J. W. M., Mattheij, N. J. A., Cosemans, J. M. E. M. Platelet-based coagulation: Different populations, different functions. J Thromb Haemost. 11 (1), 2-16 (2013).
- Podoplelova, N. A., et al. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood. 128 (13), 1745-1755 (2016).
- Mann, K. G., Butenas, S., Brummel, K. The dynamics of thrombin formation. Arterioscler Thromb Vasc Biol. 23 (1), 17-25 (2003).
- Jackson, S. P., Schoenwaelder, S. M. Procoagulant platelets: Are they necrotic. Blood. 116 (12), 2011-2018 (2010).
- Hua Vivien Mun Yee, V. M. C. Procoagulant platelets and the pathways leading to cell death. Semin Thromb Hemost. 41 (04), 405-412 (2015).
- Dale, G. L. Coated-platelets: An emerging component of the procoagulant response. J Thromb Haemost. 3 (10), 2185-2192 (2005).
- Vulliamy, P., Armstrong, P. C. Platelets in hemostasis, thrombosis, and inflammation after major trauma. Arterioscler Thromb Vasc Biol. 44 (3), 545-557 (2024).
- Vulliamy, P., et al. Histone H4 induces platelet ballooning and microparticle release during trauma hemorrhage. Proc Natl Acad Sci U S A. 116 (35), 17444-17449 (2019).
- Aliotta, A., Bertaggia Calderara, D., Zermatten, M. G., Marchetti, M., Alberio, L. Thrombocytopathies: Not just aggregation defects-the clinical relevance of procoagulant platelets. J Clin Med. 10 (5), 894(2021).
- Kirkpatrick, A. C., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets predict stroke at 30 days following TIA. Neurology. 89 (2), 125-128 (2017).
- Kirkpatrick, A. C., Tafur, A. J., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets improve prediction of stroke and transient ischemic attack in asymptomatic internal carotid artery stenosis. Stroke. 45 (10), 2995-3001 (2014).
- Suzuki, J., Umeda, M., Sims, P. J., Nagata, S. Calcium-dependent phospholipid scrambling by TMEM16F. Nature. 468 (7325), 834-838 (2010).
- Prodan, C. I., Vincent, A. S., Dale, G. L. Coated platelet levels correlate with bleed volume in patients with spontaneous intracerebral hemorrhage. Stroke. 41 (6), 1301-1303 (2010).
- Josefsson, E. C., et al. Consensus report on markers to distinguish procoagulant platelets from apoptotic platelets: Communication from the Scientific and Standardization Committee of the ISTH. J Thromb Haemost. 21 (8), 2291-2299 (2023).
- Kulkarni, P. P., Sonkar, V. K., Gautam, D., Dash, D. AMPK inhibition protects against arterial thrombosis while sparing hemostasis through differential modulation of platelet responses. Thromb Res. 196, 175-185 (2020).
- Ekhlak, M., et al. Necroptosis executioner MLKL plays pivotal roles in agonist-induced platelet prothrombotic responses and lytic cell death in a temporal order. Cell Death Differ. 30 (8), 1886-1899 (2023).
- Kholmukhamedov, A., Janecke, R., Choo, H. -J., Jobe, S. M. The mitochondrial calcium uniporter regulates procoagulant platelet formation. J Thromb Haemost. 16 (11), 2315-2321 (2018).
- Choo, H. -J., Saafir, T. B., Mkumba, L., Wagner, M. B., Jobe, S. M. Mitochondrial calcium and reactive oxygen species regulate agonist-initiated platelet phosphatidylserine exposure. Arterioscler Thromb Vasc Biol. 32 (12), 2946-2955 (2012).
- Jobe, S. M., et al. Critical role for the mitochondrial permeability transition pore and cyclophilin D in platelet activation and thrombosis. Blood. 111 (3), 1257-1265 (2008).
- Leytin, V., Allen, D. J., Mykhaylov, S., Lyubimov, E., Freedman, J. Thrombin-triggered platelet apoptosis. J Thromb Haemost. 4 (12), 2656-2663 (2006).
- Lopez, J. J., Salido, G. M., Pariente, J. A., Rosado, J. A. Thrombin induces activation and translocation of Bid, Bax and Bak to the mitochondria in human platelets. J Thromb Haemost. 6 (10), 1780-1788 (2008).
- Wolf, B. B., et al. Calpain functions in a caspase-independent manner to promote apoptosis-like events during platelet activation. Blood. 94 (5), 1683-1692 (1999).
- Kim, O. V., et al. Fatal dysfunction and disintegration of thrombin-stimulated platelets. Haematologica. 104 (9), 1866-1878 (2019).
- Schoenwaelder, S. M., et al. Two distinct pathways regulate platelet phosphatidylserine exposure and procoagulant function. Blood. 114 (3), 663-666 (2009).
- Abbasian, N., Millington-Burgess, S. L., Chabra, S., Malcor, J. -D., Harper, M. T. Supramaximal calcium signaling triggers procoagulant platelet formation. Blood Adv. 4 (1), 154-164 (2020).
- Le, T., et al. An inner activation gate controls TMEM16F phospholipid scrambling. Nat Commun. 10 (1), 1846(2019).
- Yang, H., et al. TMEM16F forms a Ca2+-activated cation channel required for lipid scrambling in platelets during blood coagulation. Cell. 151 (1), 111-122 (2012).
- Mattheij, N. J. A., et al. Dual mechanism of integrin closure in procoagulant platelets. J Biol Chem. 288 (19), 13325-13336 (2013).
- Liu, F., et al. Mitochondrially mediated integrin αiIbβ3 protein inactivation limits thrombus growth. J Biol Chem. 288 (42), 30672-30681 (2013).
- van Kruchten, R., et al. Both TMEM16F-dependent and TMEM16F-independent pathways contribute to phosphatidylserine exposure in platelet apoptosis and platelet activation. Blood. 121 (10), 1850-1857 (2013).
- Goelz, N., et al. Platelets express adaptor proteins of the extrinsic apoptosis pathway and can activate caspase-8. PLOS ONE. 16 (1), e0244848(2021).
- Shlomovitz, I., Speir, M., Gerlic, M. Flipping the dogma - phosphatidylserine in non-apoptotic cell death. Cell Commun Signal. 17 (1), 139(2019).
- Nadine, J. A. M., et al. Coated platelets function in platelet-dependent fibrin formation via integrin αIIbβ3 and transglutaminase factor XIII. Haematologica. 101 (4), 427-436 (2016).
- Michelson, A. D. Platelet activation by thrombin can be directly measured in whole blood through the use of the peptide GPRP and flow cytometry: Methods and clinical applications. Blood Coagul Fibrinolysis. 5 (1), 121-131 (1994).
- Taylor, M. R., Couto, J. R., Scallan, C. D., Ceriani, R. L., Peterson, J. A. Lactadherin (formerly BA46), a membrane-associated glycoprotein expressed in human milk and breast carcinomas, promotes Arg-Gly-Asp (RGD)-dependent cell adhesion. DNA Cell Biol. 16 (7), 861-869 (1997).
- Andersen, M. H., Graversen, H., Fedosov, S. N., Petersen, T. E., Rasmussen, J. T. Functional analyses of two cellular binding domains of bovine lactadherin. Biochemistry. 39 (20), 6200-6206 (2000).
- Tan, C. W., Bourcy, M., Pasalic, L., Chen, V. M. Flow cytometry assessment of procoagulant platelets using a dithiol-reactive probe functional disulfide bonds: Methods and protocols. Methods Mol Biol. 1967, 305-321 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены