Method Article
壊死、アポトーシス、血小板活性化の特徴を示す凝固促進血小板の包括的解析
要約
本プロトコルは、壊死、アポトーシス、および血小板活性化の重複する特徴を示す凝固促進血小板を分析するために必要な包括的な一連の手順を提供します。
要約
血流中を循環する血小板は比較的静止していますが、血管損傷部位で覚醒剤または「アゴニスト」に遭遇すると「活性化」します。凝集促進血小板と凝固促進血小板は、活性化血小板の2つの異なる集団を表します。凝集促進性血小板は、フィブリノーゲン架橋を介して凝集した血小板の栓を形成することにより、出血の停止、または「止血」を促進しますが、凝固促進血小板は凝固カスケードを劇的に加速し、フィブリン血栓形成で最高潮に達します。凝固促進剤血小板の興味深い側面は、その形態が「壊死」と「アポトーシス」の特定の特徴を示すことです。したがって、それらは血小板の細胞死の一形態を表している可能性がありますが、血栓症と止血に重要な役割を果たしています。この記事では、凝固促進剤血小板の概念、健康や疾患との関連性、およびそれらの分析のための既存の方法の比較を紹介します。次に、凝固促進剤血小板を分析し、その形成メカニズムを調査し、凝固を促進する血栓形成の役割を評価するための包括的なプロトコルを提供します。この記事の最後に、説明されている方法の主要な手順、制限事項、およびトラブルシューティングの原則について説明します。
概要
活性化血小板1,2には、少なくとも2つの異なる集団があります。凝集促進性血小板は、インテグリンの活性化が高く、PS曝露があるとしても低いという特徴があります。一方、凝固促進剤の血小板は、インテグリン活性が低く、PS曝露が高い1,2を特徴とし、テナーゼおよびプロトロンビナーゼ複合体3の集合のための表面を提供し、これはそれぞれ個々の可溶性相因子IXaおよびXaよりも105-10 6倍および300000倍活性です4.したがって、凝固促進剤の血小板は凝固を劇的に加速します。凝固促進剤血小板の興味深い側面は、その形態が、微小胞形成、細胞骨格破壊による細胞のバルーニング、膜完全性の喪失などの「壊死」の特定の特徴に似ていること、および外尖のホスファチジルセリンの曝露による膜リン脂質の非対称性の喪失などの「アポトーシス」の特徴に似ていることです5,6.言い換えれば、凝固促進剤の血小板形成は、止血における重要な生理学的機能を有するにもかかわらず、血小板における細胞死の一形態を表している可能性があります。
凝固促進血小板は血栓性疾患と有意に関連しています。ほとんどの健康な人は循環凝固促進血小板を持っていませんが、正常なドナー血小板の~30%は、トロンビンやコラーゲン7などの強力なアゴニストへの曝露後にex vivoで凝固促進剤の表現型を採用します。循環凝固促進剤の血小板は外傷で報告されており、その形成はヒストンH4 8,9による活性化を反映している可能性があります。しかし、ほとんどの血栓性障害では、凝固促進血小板のレベルの増加は、ex vivo刺激10の後にのみ検出されます。例えば、急性脳卒中の患者で、血小板の>51.1%がコラーゲンとトロンビンによって凝固促進血小板(COAT血小板とも呼ばれる)に変換された場合、30日以内に脳卒中が再発するハザード比は10.72であったのに対し、凝固促進血小板形成が少なかった患者11。同様の結果は、一過性脳虚血発作および頸動脈アテローム性動脈硬化症の患者でも報告されています12。対照的に、出血性疾患スコット症候群は、リン脂質スクランブラーゼTMEM-16FをコードするANO6の突然変異に起因し、血小板PS曝露の欠損につながる13。特発性出血性疾患および頭蓋内出血は、凝固促進血小板を生成する能力の低下と関連している可能性がある14。
したがって、凝固促進剤の血小板の評価は、血小板の活性化とそれに伴う血栓症および止血のメカニズムに関する基本的な調査中だけでなく、さまざまな病理学的状態における患者の血栓症または出血のリスクに関する臨床分析中にも、血小板機能の解析の一部です。International Society on Thrombosis and Haemostasis(ISTH)のパネルは、凝固促進剤を他の血小板亜集団と区別するために、フローサイトメトリーによるアネキシンV結合とP-セレクチン発現の使用を推奨しました15。この記事では、凝固促進剤とアポトーシス血小板の分析に使用できるさまざまな方法についても説明していますが、プロセスを詳細に説明するには不十分です。これらの方法には、(1)PAC1 / JonAまたはフィブリノーゲン結合(フローサイトメトリー)による血小板活性化の検出が含まれます。(2)P-セレクチン発現によるα-顆粒分泌(フローサイトメトリー);(3)アネキシンV/ラクタドヘリン結合によるPS曝露(フローサイトメトリー);(4)GSAO標識(フローサイトメトリー)による膜の完全性の喪失。(5)バルーニングのような形態学的変化(顕微鏡検査)。(6)カスパーゼアッセイ(イムノブロッティング/ルミノメトリー/フローサイトメトリー)によるカスパーゼ活性化の検出、または細胞骨格基質ゲルソリンの分解(イムノブロッティング);(7)JC-1/Mitotracker(フローサイトメトリー)などのミトコンドリア電位感受性色素によるミトコンドリア膜電位の喪失。(8)ミトコンドリア内因性アポトーシスマーカーBax、Bakおよびシトクロムc放出(イムノブロッティング);(9)トロンビン生成アッセイと凝固因子Xa / Va結合による凝固促進機能(フローサイトメトリー、顕微鏡検査)。(10)蛍光カルシウム感受性色素による細胞質およびミトコンドリアカルシウムの上昇(フローサイトメトリー、蛍光測定、顕微鏡)。
本研究では、凝固促進血小板の分析のための包括的なプロトコルを掘り下げるとともに、それらを凝集促進血小板およびアポトーシス血小板と区別します。記載されているほとんどの手順は、(1)容易に入手でき、使いやすい、(2)サンプル量が少なくて済む、(3)血小板の複数の亜集団(凝集促進、凝固促進、およびアポトーシス)の同時検出が可能という利点を持つフローサイトメトリーに依存しています15。これらのフローサイトメトリーベースのプロトコルは、凝固因子結合に基づく凝固促進活性の機能アッセイおよび血栓ベースのトロンビン生成アッセイによって補完されます。
プロトコル
人間の参加者は、書面によるインフォームドコンセントを得た後、末梢静脈血サンプリングの研究に募集されました。クリーブランドクリニックラーナー研究所の施設内審査委員会の推奨事項と承認に厳密に従い、すべての研究方法論はヘルシンキ宣言によって設定された基準に準拠しています。18歳以上の健康な成人参加者が含まれ、18歳未満の人、過去6か月間に血栓性イベントの最近の病歴がある人、アルコール依存症または薬物乱用の病歴がある人、および過去4週間に抗血小板薬または抗凝固薬を使用した参加者は除外されました。プロトコールで使用される材料および試薬の詳細な説明は、 材料の表に記載されています。
1. 血小板の調製
- 書面によるインフォームドコンセントを得た後、末梢静脈血サンプルをACD抗凝固剤(1:9 v / v)に採取します 治験審査委員会によって承認された推奨事項に厳密に従って、人間の参加者から。
- ACDに採取した血液を100 x g で20分間、22°Cで遠心分離し、上清として多血小板血漿(PRP)を得ます。
- 3 μM の PGE1 と 2 mM の EDTA を添加した後、PRP を 800 x g で 22 °C で 7 分間遠心分離します。
- 上清を捨て、穏やかなピペッティングにより、血小板ペレットを緩衝液A( 材料の表を参照)に再懸濁します。.
- 血小板をバッファーAに再懸濁し、800 x g で22°C、7分間遠心分離します。
- 穏やかなピペッティングにより、血小板ペレットを緩衝液B( 材料の表を参照)に再懸濁します。
- 自動セルカウンターを使用して、最終的な血小板数を 1 × 107/mL に調整します。
注:滅菌条件下ですべての手順を実行し、ピペッティング中に過度のせん断にさらされないようにして、血小板を休止状態に維持するための予防措置を講じてください。
2. フローサイトメトリーによる凝固促進血小板の解析
- 洗浄したヒト血小板に 2.5 mM カルシウム (血小板懸濁液 100 μL に 0.5 μL のストック CaCl2 0.5 M 溶液) を添加します。
- 血小板の1つの画分を刺激しないようにし、トロンビン(0.1 U / mL、0.25 U / mL、0.5 U / mL)、コンブルキシン(20 ng / mL、50 ng / mL、100 ng / mL)、またはそれらの組み合わせで室温で15分間刺激します。.
- 刺激後、刺激した血小板懸濁液100 μLに、PE-アネキシンV抗体、FITC-PAC1抗体、およびAPC-抗ヒトCD62P抗体をそれぞれ1 μL加えます。
- 血小板を暗所で室温で30分間インキュベートします。
- 等量(1:1)の2%ホルマリンを添加して血小板を固定します。
- フローサイトメトリーでサンプルを分析し、凝固促進剤の血小板を定量します15,16。
- 血小板を取り囲むアモルファスゲートを描き、血小板をノイズや多血小板粒子から分離します。
- 各サンプルの血小板ゲート内の 10,000 イベントについて、4 象限対数増幅を使用してすべての蛍光データを収集します。
- ホスファチジルセリン(PS)曝露(アネキシンV結合)、P-セレクチン(CD62P)発現、およびインテグリンαIIbβ3活性化(PAC1結合)の蛍光陽性または陰性に基づいて血小板の領域を定義します。
- 血小板は、PS曝露(アネキシンV結合)とP-セレクチン(CD62P)の発現の両方で陽性であるが、インテグリンαIIbβ3活性化(PAC1結合)は陰性であると考えてください(図1)(表1)。
- 同様に、インテグリンαIIbβ3活性化(PAC1結合)とP-セレクチン(CD62P)の両方の発現に陽性であるが、PS曝露(アネキシンV結合)に陰性の血小板を凝集促進血小板と考えてください。
注:インテグリンαIIbβ3活性化(PAC1結合)とP-セレクチン(CD62P)発現の両方に対して陰性であるが、PS曝露(アネキシンV結合)に対して陽性である血小板は、アポトーシス血小板である可能性が高い15,16。
3. フローサイトメトリーによるミトコンドリアカルシウムの解析
- 洗浄したヒト血小板を1 × 106/mLに希釈し、2.5 mMカルシウム(100 μL血小板懸濁液中の0.5 μLストックCaCl2 0.5 M溶液)を添加します。
- 血小板を5 μM Rhod-2 AM(ミトコンドリアカルシウム用)で暗所で30分間標識します。
- ステップ2で説明したように、ゲート血小板を適切に。
- PE蛍光(Rhod-2 AMの場合)と時間の密度散布図を使用して、5分間にわたる取得イベントの平均蛍光の時間依存的な変化について、血小板ゲート内のイベントを解析します。
- 最初の 1 分間のベースライン カルシウム レベルを記録します。
- トロンビン(0.1 U/mL、0.25 U/mL、または0.5 U/mL)、コンブルキシン(20 ng/mL、50 ng/mL、または100 ng/mL)、またはそれらの組み合わせを添加し、さらに4分間データを取得し続けます17。
4. フローサイトメトリーによるミトコンドリア膜電位の解析
- 洗浄したヒト血小板に 2.5 mM カルシウム (血小板懸濁液 100 μL に 0.5 μL のストック CaCl2 0.5 M 溶液) を添加します。
- 血小板の1つの画分を刺激しないようにし、トロンビン(0.1 U / mL、0.25 U / mL、または0.5 U / mL)、コンブルキシン(20 ng / mL、50 ng / mL、または100 ng / mL)、またはそれらの組み合わせで室温で15分間刺激します。.
- 刺激後、刺激した血小板懸濁液に最終濃度500 nMのミトコンドリア標識色素( 材料の表を参照)を添加します。
- 血小板を暗闇で30分間インキュベートします。
- 等量の2%ホルマリンを添加して血小板を固定します。
- フローサイトメトリーによるサンプルの分析17.
- ゲート血小板は、ステップ2で説明したように適切に。
- フローサイトメーターのPEチャネル(ミトコンドリア標識色素用)の蛍光の低下について、血小板ゲートのイベントを解析します。
5. フローサイトメトリーによるカスパーゼ3およびカスパーゼ8活性の解析
- 洗浄したヒト血小板に 2.5 mM カルシウム (血小板懸濁液 100 μL に 0.5 μL のストック CaCl2 0.5 M 溶液) を添加します。
- 血小板の1つの画分を刺激しないようにし、トロンビン(0.1 U / mL、0.25 U / mL、または0.5 U / mL)、コンブルキシン(20 ng / mL、50 ng / mL、または100 ng / mL)、またはそれらの組み合わせで室温で15分間刺激します。.
- 刺激後、1:1000(v/v)アポトーシス検出試薬( 材料表を参照)(内因性および外因性アポトーシス経路の両方について)または1:300(v/v)FITC-IETD-FNK(外部アポトーシス経路のカスパーゼ8について)を刺激された血小板懸濁液に加えます。
- 血小板を暗闇で30分間インキュベートします。
- 等量の2%ホルマリンを添加して血小板を固定します。
- フローサイトメトリーによるサンプルの分析17.
- ステップ2で説明したように、ゲート血小板を適切に。
- フローサイトメーターのFITCチャネル(カスパーゼ3/7またはカスパーゼ8)の蛍光について、血小板ゲートのイベントを解析します。
6. フローサイトメトリーによるプロトロンビン結合の解析
- 製造元の指示に従って、タンパク質標識キット( 材料表を参照)を使用して、ウシプロトロンビンとAlexa Fluor 488色素を結合します。
- 洗浄したヒト血小板に2.5 mMカルシウム(100 μL血小板懸濁液中の0.5 μLストックCaCl2 0.5 M溶液)を添加します。
- 血小板の1つの画分を刺激しないようにし、トロンビン(0.1 U / mL、0.25 U / mL、または0.5 U / mL)、コンブルキシン(20 ng / mL、50 ng / mL、または100 ng / mL)、またはそれらの組み合わせで室温で15分間刺激します。.
- 刺激後、AF488標識ウシプロトロンビン(100 μg/mL)とPE-アネキシンVおよびAPC抗ヒトCD62P抗体をそれぞれ1 μLずつ刺激した血小板懸濁液100 μLに加えます。
- 等量の2%ホルマリンを添加して血小板を固定します。
- フローサイトメトリー17 によりサンプルを解析し、血小板へのプロトロンビン結合の定量化を行います。
- ノイズや多血小板粒子から分離した血小板を包み込むアモルファスゲートを描きます。
- 各サンプルの血小板ゲート内の 10,000 イベントについて、4 象限対数増幅を使用してすべての蛍光データを収集します。
- PS曝露(アネキシンV結合)、P-セレクチン(CD62P)発現、およびAF488-プロトロンビン(プロトロンビン結合)に対して蛍光陽性または陰性の血小板の領域を描画します。
- すべての血小板イベントの割合と、PS 曝露 (アネキシン V 結合) と P セレクチン (CD62P) 発現 (凝固促進血小板) の両方で陽性で、プロトロンビン結合が陽性の血小板の割合を決定します。
7. 共焦点顕微鏡によるプロトロンビン結合の解析
- 製造元の指示に従って、タンパク質標識キット( 材料表を参照)を使用して、ウシプロトロンビンとAlexa Fluor 488色素を結合します。
- 洗浄したヒト血小板に2.5 mMカルシウム(100 μL血小板懸濁液中の0.5 μLストックCaCl2 0.5 M溶液)を添加します。
- 血小板の1つの画分を刺激しないようにし、トロンビン(0.1 U / mL、0.25 U / mL、または0.5 U / mL)、コンブルキシン(20 ng / mL、50 ng / mL、または100 ng / mL)、またはそれらの組み合わせで室温で15分間刺激します。.
- 刺激後、AF488標識ウシプロトロンビン(100 μg/mL)とPE-アネキシンVおよびAPC抗ヒトCD62P抗体をそれぞれ1 μLずつ刺激した血小板懸濁液100 μLに加えます。
- 等量の2%ホルマリンを添加して血小板を固定します。
- 固定された血小板をポリD-リジンコーティングされたカバースリップにペレット化します。
- カバースリップを顕微鏡スライドに取り付け、退色防止ソリューションを使用します。
- あるいは、湿ったチャンバーで1時間、カバースリップをコラーゲン(100 μg/mL)でコーティングします。
- コーティングされたカバーガラスをPBS中の0.5%BSAで1時間ブロックします。
- AF488標識ウシプロトロンビン(100 μg/mL)とPE-アネキシンV抗体とAPC抗ヒトCD62P抗体をそれぞれ1 μLずつで標識します。
- ラベル付けされた血小板をコラーゲンコーティングされたカバースリップに20分間接着させます。.
- 付着性血小板でカバースリップをPBSで3回洗浄します。
- カバーガラスを2%パラホルムアルデヒドで1時間固定します。
- カバースリップを顕微鏡スライドに取り付け、退色防止ソリューションを使用します。
- 共焦点顕微鏡でスライドを63×の対物レンズ倍率で観察します。
- フィジーのソフトウェアを使用して画像を解析し、蛍光定量化を行います。
8. 血餅を用いた血小板リン脂質依存性トロンビン生成アッセイ
- 洗浄したヒト血小板に 2.5 mM カルシウム (血小板懸濁液 100 μL に 0.5 μL のストック CaCl2 0.5 M 溶液) を添加します。
- 血小板の1つの画分を刺激しないようにし、トロンビン(0.1 U / mL、0.25 U / mL、または0.5 U / mL)、コンブルキシン(20 ng / mL、50 ng / mL、または100 ng / mL)、またはそれらの組み合わせで室温で15分間刺激します。.
- 50 μLのプールされた正常血漿と50 μLの低濁度カオリン溶液(20 mg/mL)の混合物に、処理した血小板100 μLを加え、37 °Cで5分間プレインキュベートします。
- 5 mMのCaCl2 を混合物に加えます。
- マイクロプレートリーダー上のタービジメトリーにより血栓形成をモニターし、60秒ごとに660nmの吸光度を1時間測定します。
結果
活性化血小板の割合は、ホスファチジルセリン(PS)とP-セレクチンの両方の表面発現の特徴的な増加とともに「凝固促進剤」に変わり、PS曝露のみ陽性の「アポトーシス」血小板やP-セレクチン発現陽性の「凝集促進性」血小板と区別されます。その結果、トロンビンは、FITC-抗CD62P抗体とPE-アネキシンVの結合により、P-セレクチンとPSの発現が陽性の凝固促進剤血小板の割合を用量依存的に増加させることが分かりました(図2)。凝固促進性血小板の生成は、アゴニストによって誘発される細胞質カルシウムの上昇と、その結果として生じるシクロフィリンD(CypD)依存性ミトコンドリア透過性遷移細孔(mPTP)形成20に対する、ミトコンドリア内膜を横切る電気化学的勾配に沿ったミトコンドリアカルシウム流入18,19に依存する。一貫して、トロンビン誘発性凝固活性の増加は、Rhod-2およびMitotracker Red色素を使用して測定したミトコンドリアカルシウムの増加(図3)およびミトコンドリア膜電位の低下(図4)と関連していました。刺激された血小板は、Bax/Bak蓄積21,22を含むアポトーシスの特徴を示します。これがカスパーゼ23,24を活性化し、PS曝露25に寄与するかどうかは、依然として議論の余地がある。血小板のトロンビン刺激は、カスパーゼ8の活性化と関連していましたが、末端のカスパーゼ3および7(図5)は関連していませんでした(図5)これは、それぞれFITC-IETD-FMKおよびアポトーシス検出試薬によって分析されました。

図1:凝固促進剤血小板の分析。 FITC-PAC1、APC-抗CD62P抗体、PE-Annexin Vを蛍光プローブとして、インテグリン活性化、P-セレクチン発現、PS曝露をそれぞれ検出するためのフローサイトメトリーによる凝固促進血小板の解析を示す模式図。 この図の拡大版を表示するには、ここをクリックしてください。
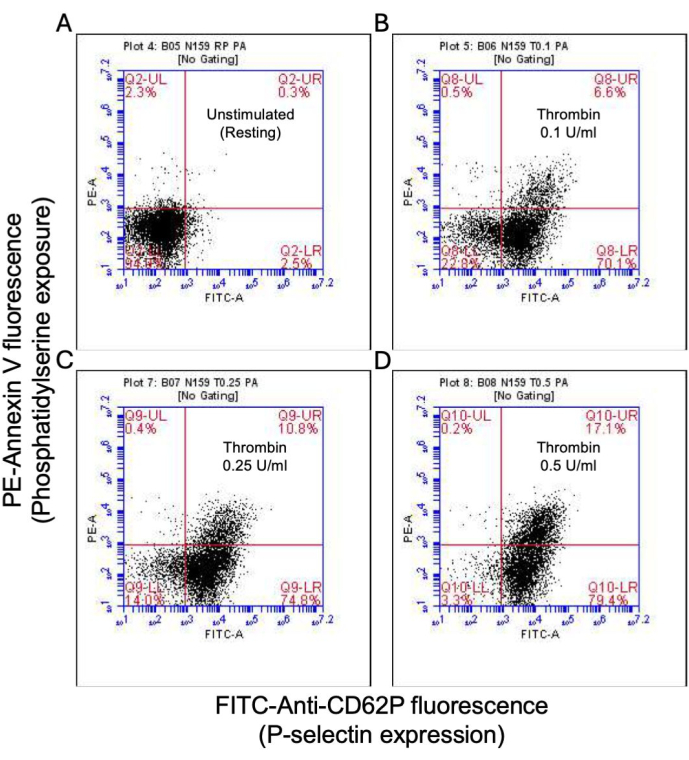
図2:トロンビン刺激時の血小板におけるP-セレクチン発現とホスファチジルセリン曝露。 代表的なドットプロットは、(A)刺激されていない血小板、および(B)0.1 U/mL、(C)0.25 U/mL、および(D)0.5 U/mLの用量でトロンビンに曝露されたときに、フローサイトメトリーを使用したFITC抗CD62PおよびPE-アネキシンV蛍光によって検出された、P-セレクチン発現および/またはPS曝露に対して陽性の血小板を示すドットプロット。括弧内の数値は、プロットの各象限における総血小板の割合を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
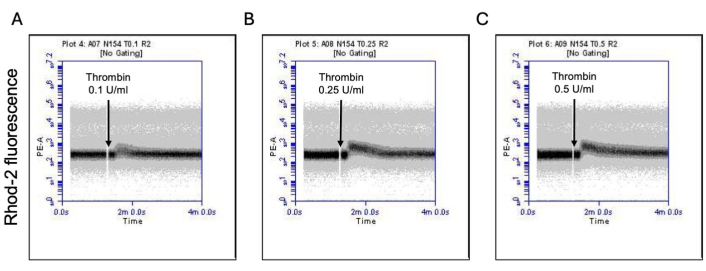
図3:トロンビン曝露による血小板中のミトコンドリアカルシウムレベルの時間依存的な変化。 Rhod-2色素による蛍光の時間依存的な変化を示す代表的な密度プロットは、(A)0.1 U/mL、(B)0.25 U/mL、および(C)0.5 U/mLの用量でトロンビンに曝露した場合の血小板中のミトコンドリアカルシウムレベルをフローサイトメトリーで検出します。 この図の拡大版を表示するには、ここをクリックしてください。
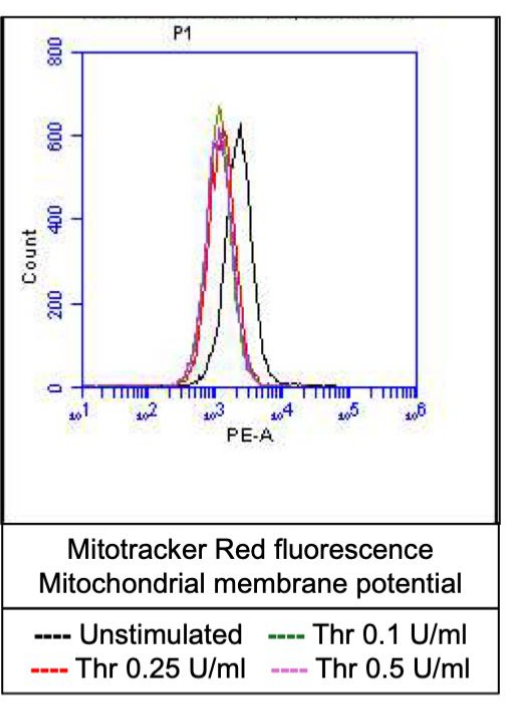
図4:トロンビン刺激による血小板のミトコンドリア膜電位。 この図は、ミトコンドリア標識色素による蛍光を示す代表的なヒストグラムオーバーレイを示しており、フローサイトメトリーによって検出される、異なる用量のトロンビンへの曝露による血小板のミトコンドリア膜電位を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
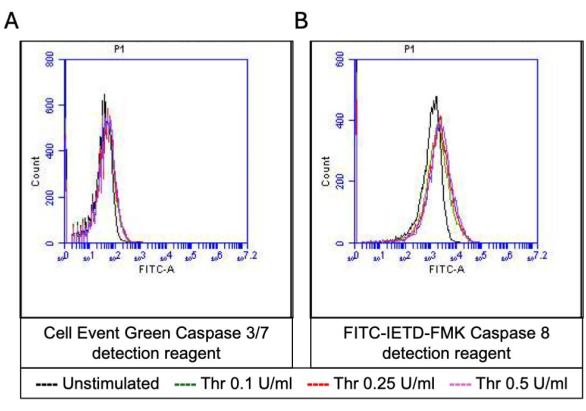
図5:トロンビン刺激による血小板中のカスパーゼ3/7およびカスパーゼ8の活性。 (A)アポトーシス検出試薬および(B)FITC-IETD-FMKによる蛍光を示す代表的なヒストグラムの重ね合わせは、フローサイトメトリーによって検出されるトロンビンの異なる用量への曝露による血小板中のカスパーゼ3/7およびカスパーゼ8活性を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
| マーカー | 凝固促進剤血小板 | 凝集性血小板 | アポトーシス血小板 |
| インテグリン活性化(PAC1結合) | いいえ | はい | いいえ |
| 顆粒分泌 | はい | はい | いいえ |
| (P-selectin 式) | |||
| PS露出 | はい | いいえ | はい |
| (アネキシンV結合) |
表1:刺激後の血小板集団を同定するためのフローサイトメトリーマーカー。 この表は、トロンビンやコンブルキシンなどの強力なアゴニストによる血小板の刺激後に出現する血小板の異なる集団を検出するために使用されるフローサイトメトリーマーカーを示しています。
ディスカッション
凝固促進血小板は、刺激時に細胞内カルシウムの顕著かつ持続的な増加を示す26が、異なるメカニズムを通じて誘導され得る。これらは、アゴニストによって誘発される細胞質カルシウムの上昇時に、ミトコンドリア内膜を横切る電気化学的勾配に沿ったミトコンドリアカルシウム流入18,19を含む、異なるメディエーターを介してコラーゲンとトロンビンによる強力なアゴニスト刺激によって生成されます。ミトコンドリアカルシウムが一定の閾値に達すると、ミトコンドリア透過性遷移細孔(mPTP)形成をシクロフィリンD(CypD)依存的に活性化する20。ミトコンドリアがカルシウムに透過処理され、細胞質カルシウムの吸収源として機能しなくなると、mPTP形成後に最大限にカルシウムシグナル伝達が観察されます26。高レベルの細胞質カルシウムが持続すると、カルシウム依存性リン脂質スクランブラーゼTMEM16F活性化が活性化され、PS曝露につながります27,28。PS曝露は、インテグリンαIIbβ3の不活性化を伴い、インテグリンβ3細胞質尾部のカルパイン依存性切断とTMEM16F依存性リン脂質スクランブル自体を含む二重のメカニズムによって行われます29,30。したがって、凝固促進血小板は、凝集促進血小板とは異なり、不活性インテグリンを有する。さらに、PS曝露は凝固因子の結合のための表面を提供し、テナーゼおよびプロトロンビナーゼ複合体の集合を促進する3。したがって、凝固促進血小板は凝固を劇的に加速します4。
PS曝露とその結果としての凝固促進活性は、活性化とは無関係に、内因性アポトーシスを受けている血小板におけるスクランブラーゼXKR8のカスパーゼ依存性切断によっても誘発され得る25,31。刺激された血小板は、Bax/Bak蓄積21,22を含む内因性アポトーシスの特徴を示すが、これがカスパーゼ23,24を活性化し、PS曝露に寄与するかどうかは議論の余地がある。TNFαまたはFasLによる外因性アポトーシスは、ほとんどの成分が存在し、カスパーゼ8活性化のいくつかの証拠があるにもかかわらず、血小板では報告されていません32。血小板は、長時間の刺激を受けると、MLKL媒介性ネクロプトーシス17を受け、CypDまたはカスパーゼ33とは無関係にPS曝露を誘導することが知られている。
本研究は、PS曝露(アネキシンV結合)、P-セレクチン(CD62P)発現、インテグリンαIIbβ3活性化(PAC1結合)をマーカーとして、凝固促進血小板を検出する方法を提供しました。これらのマーカーは、凝固促進血小板をアポトーシス血小板および凝集促進血小板から効果的に区別するのに役立つ15。しかし、アネキシンVの結合には、培地中に高カルシウムレベルが存在する必要があります。したがって、多血小板血漿または全血サンプルを使用する場合は、ヘパリンまたは他のトロンビン阻害剤を使用する必要があります。さらに、フィブリン重合阻害剤GPRPは、トロンビンがこれらのサンプル34,35と共にアゴニストの1つとして使用されなければならない場合に使用される。ラクタデリンまたはGSAOは、アネキシンVの代替マーカーとして使用できますが、それぞれに制限があります。ラクタデリンはPSに特異的ではなく、インテグリンに結合する36,37が、GSAOは市販されておらず、研究協力を通じてのみ入手できる38。
この記事では、ミトコンドリアカルシウム流入やミトコンドリア透過性遷移細孔形成(ミトコンドリア膜電位の喪失)など、PS曝露のメカニズムを調査するための補足的な方法も提供しました。ここで注意すべきは、これらの方法は、Fluo-4およびFluo-5N色素を用いた細胞質カルシウム測定によって補完できることである。カスパーゼの活性化が刺激された血小板のPS曝露に寄与するかどうかは不明のままであるため、カスパーゼ8およびカスパーゼ3/7活性化アッセイのプロトコルも列挙します。血小板の真の「凝固促進剤」の性質は、凝固因子を結合し、トロンビン生成を促進する能力によってのみ確認することができます。したがって、PS曝露(アネキシンV結合)、P-セレクチン(CD62P)発現およびインテグリンαIIbβ3 活性化(PAC1結合)、ミトコンドリアカルシウム流入、ミトコンドリア膜電位、カスパーゼ活性、凝固因子(プロトロンビン)結合、および本論文で説明されている血小板リン脂質依存性トロンビン生成/凝固のための血小板の徹底的な研究は、凝固促進血小板の包括的な分析に必要かつ十分です。
開示事項
著者には、開示すべき競合する利益はありません。
謝辞
Paresh P. KulkarniとKeith R. McCraeは、それぞれ、VeloSano、Cleveland Clinic Foundationが資金提供するフェローとパイロットの助成金を表彰しています。
資料
| Name | Company | Catalog Number | Comments |
| Acid Citrate Dextrose (ACD) solution (For 1000 mL) | Tri- Sodium Citrate- 22 g Citric Acid- 8 g Dextrose- 24.5 g Water- Make up volume to 1000 mL | ||
| Alexa Fluor 488 protein labelling kit | Invitrogen | A10235 | |
| APC Mouse Anti-Human CD62P | BD Pharmingen | 550888 | |
| Bovine Prothrombin | Prolytix | BCP-1010 | |
| Buffer A (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 6.2 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution EGTA 1 mM Add 10 μL (1:100 v/v) 100 mM EGTA Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose PGE1 3 μM Add 3 μL (1:333 v/v) 1 mM PGE1 solution | ||
| Buffer B (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 7.4 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose | ||
| CaCl2 (0.5 M) (For 50ml) | Molecular weight of CaCl2.2H2O = 147.02 Dissolve 3.675 g of CaCl2.2H2O in 50 ml Milli Q water | ||
| CellEvent Caspase-3/7 Detection Reagents Green | Invitrogen | C10423 | Apoptosis detection reagent |
| Convulxin | Enzo Life Sciences | ALX-350-100 | |
| EDTA (0.5 M; pH 8) (For 100 mL) | Molecular Weight of EDTA Na2.2H2 O: 372.24g Weigh 18.612 g and suspend in 50 ml Milli Q water and check the pH (pH~4) Slowly add 10N NaOH with stirring and monitor the pH. EDTA starts solubilizing at around pH 7 and is completely soluble at pH 8. Make up the volume to 100 ml with Milli Q water. | ||
| EGTA (100 mM; pH 7.4) (For 100 mL) | Molecular Weight: 380.4 Add 3.804 g EGTA in 50 ml Milli Q water and check the pH (pH~3) Add 10 N NaOH dropwise while stirring and monitor the pH EGTA becomes soluble at pH 7.0 (approx) Adjust pH to 7.4 Make up the volume to 100 ml with Milli Q water | ||
| FITC Mouse Anti-Human PAC-1 | BD | 340507 | |
| FITC-IETD-FMK Caspase 8 (active) staining kit | Abcam | ab65614 | |
| Mitotracker Red CMXRos (mitochindria labeling dye) | Invitrogen | M7512 | Stock= 1 mM (50 µg dissolved in 90 µl DMSO) Sub-stock= 100 µM (10 µl Stock + 90 µl DMSO) Working concentration= 500nM (0.5 µl in 100 µl) |
| PE Annexin V | BD Pharmingen | 560930 | |
| Prostaglandin E1 | Sigma | P5515 | Stock= 20 mM (1 mg dissolved in 141 µL DMSO) Sub-stock= 1 mM (10 µl Stock + 190 µL DMSO) Working concentration= 3 µM (3 µL in 1 mL) |
| Rhod-2 AM | Invitrogen | R1244 | Stock= 5 mM (1 mg dissolved in 178 µL DMSO) Sub-stock= 100 µM (10 µL Stock + 90 µL DMSO) Working concentration= 500 nM (0.5 µL in 100 µL) |
| Thrombin from human plasma | Sigma | T7572 |
参考文献
- Munnix, I., Cosemans, J., Auger, J., Heemskerk, J. Platelet response heterogeneity in thrombus formation. Thromb Haemost. 102 (12), 1149-1156 (2009).
- Heemskerk, J. W. M., Mattheij, N. J. A., Cosemans, J. M. E. M. Platelet-based coagulation: Different populations, different functions. J Thromb Haemost. 11 (1), 2-16 (2013).
- Podoplelova, N. A., et al. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood. 128 (13), 1745-1755 (2016).
- Mann, K. G., Butenas, S., Brummel, K. The dynamics of thrombin formation. Arterioscler Thromb Vasc Biol. 23 (1), 17-25 (2003).
- Jackson, S. P., Schoenwaelder, S. M. Procoagulant platelets: Are they necrotic. Blood. 116 (12), 2011-2018 (2010).
- Hua Vivien Mun Yee, V. M. C. Procoagulant platelets and the pathways leading to cell death. Semin Thromb Hemost. 41 (04), 405-412 (2015).
- Dale, G. L. Coated-platelets: An emerging component of the procoagulant response. J Thromb Haemost. 3 (10), 2185-2192 (2005).
- Vulliamy, P., Armstrong, P. C. Platelets in hemostasis, thrombosis, and inflammation after major trauma. Arterioscler Thromb Vasc Biol. 44 (3), 545-557 (2024).
- Vulliamy, P., et al. Histone H4 induces platelet ballooning and microparticle release during trauma hemorrhage. Proc Natl Acad Sci U S A. 116 (35), 17444-17449 (2019).
- Aliotta, A., Bertaggia Calderara, D., Zermatten, M. G., Marchetti, M., Alberio, L. Thrombocytopathies: Not just aggregation defects-the clinical relevance of procoagulant platelets. J Clin Med. 10 (5), 894(2021).
- Kirkpatrick, A. C., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets predict stroke at 30 days following TIA. Neurology. 89 (2), 125-128 (2017).
- Kirkpatrick, A. C., Tafur, A. J., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets improve prediction of stroke and transient ischemic attack in asymptomatic internal carotid artery stenosis. Stroke. 45 (10), 2995-3001 (2014).
- Suzuki, J., Umeda, M., Sims, P. J., Nagata, S. Calcium-dependent phospholipid scrambling by TMEM16F. Nature. 468 (7325), 834-838 (2010).
- Prodan, C. I., Vincent, A. S., Dale, G. L. Coated platelet levels correlate with bleed volume in patients with spontaneous intracerebral hemorrhage. Stroke. 41 (6), 1301-1303 (2010).
- Josefsson, E. C., et al. Consensus report on markers to distinguish procoagulant platelets from apoptotic platelets: Communication from the Scientific and Standardization Committee of the ISTH. J Thromb Haemost. 21 (8), 2291-2299 (2023).
- Kulkarni, P. P., Sonkar, V. K., Gautam, D., Dash, D. AMPK inhibition protects against arterial thrombosis while sparing hemostasis through differential modulation of platelet responses. Thromb Res. 196, 175-185 (2020).
- Ekhlak, M., et al. Necroptosis executioner MLKL plays pivotal roles in agonist-induced platelet prothrombotic responses and lytic cell death in a temporal order. Cell Death Differ. 30 (8), 1886-1899 (2023).
- Kholmukhamedov, A., Janecke, R., Choo, H. -J., Jobe, S. M. The mitochondrial calcium uniporter regulates procoagulant platelet formation. J Thromb Haemost. 16 (11), 2315-2321 (2018).
- Choo, H. -J., Saafir, T. B., Mkumba, L., Wagner, M. B., Jobe, S. M. Mitochondrial calcium and reactive oxygen species regulate agonist-initiated platelet phosphatidylserine exposure. Arterioscler Thromb Vasc Biol. 32 (12), 2946-2955 (2012).
- Jobe, S. M., et al. Critical role for the mitochondrial permeability transition pore and cyclophilin D in platelet activation and thrombosis. Blood. 111 (3), 1257-1265 (2008).
- Leytin, V., Allen, D. J., Mykhaylov, S., Lyubimov, E., Freedman, J. Thrombin-triggered platelet apoptosis. J Thromb Haemost. 4 (12), 2656-2663 (2006).
- Lopez, J. J., Salido, G. M., Pariente, J. A., Rosado, J. A. Thrombin induces activation and translocation of Bid, Bax and Bak to the mitochondria in human platelets. J Thromb Haemost. 6 (10), 1780-1788 (2008).
- Wolf, B. B., et al. Calpain functions in a caspase-independent manner to promote apoptosis-like events during platelet activation. Blood. 94 (5), 1683-1692 (1999).
- Kim, O. V., et al. Fatal dysfunction and disintegration of thrombin-stimulated platelets. Haematologica. 104 (9), 1866-1878 (2019).
- Schoenwaelder, S. M., et al. Two distinct pathways regulate platelet phosphatidylserine exposure and procoagulant function. Blood. 114 (3), 663-666 (2009).
- Abbasian, N., Millington-Burgess, S. L., Chabra, S., Malcor, J. -D., Harper, M. T. Supramaximal calcium signaling triggers procoagulant platelet formation. Blood Adv. 4 (1), 154-164 (2020).
- Le, T., et al. An inner activation gate controls TMEM16F phospholipid scrambling. Nat Commun. 10 (1), 1846(2019).
- Yang, H., et al. TMEM16F forms a Ca2+-activated cation channel required for lipid scrambling in platelets during blood coagulation. Cell. 151 (1), 111-122 (2012).
- Mattheij, N. J. A., et al. Dual mechanism of integrin closure in procoagulant platelets. J Biol Chem. 288 (19), 13325-13336 (2013).
- Liu, F., et al. Mitochondrially mediated integrin αiIbβ3 protein inactivation limits thrombus growth. J Biol Chem. 288 (42), 30672-30681 (2013).
- van Kruchten, R., et al. Both TMEM16F-dependent and TMEM16F-independent pathways contribute to phosphatidylserine exposure in platelet apoptosis and platelet activation. Blood. 121 (10), 1850-1857 (2013).
- Goelz, N., et al. Platelets express adaptor proteins of the extrinsic apoptosis pathway and can activate caspase-8. PLOS ONE. 16 (1), e0244848(2021).
- Shlomovitz, I., Speir, M., Gerlic, M. Flipping the dogma - phosphatidylserine in non-apoptotic cell death. Cell Commun Signal. 17 (1), 139(2019).
- Nadine, J. A. M., et al. Coated platelets function in platelet-dependent fibrin formation via integrin αIIbβ3 and transglutaminase factor XIII. Haematologica. 101 (4), 427-436 (2016).
- Michelson, A. D. Platelet activation by thrombin can be directly measured in whole blood through the use of the peptide GPRP and flow cytometry: Methods and clinical applications. Blood Coagul Fibrinolysis. 5 (1), 121-131 (1994).
- Taylor, M. R., Couto, J. R., Scallan, C. D., Ceriani, R. L., Peterson, J. A. Lactadherin (formerly BA46), a membrane-associated glycoprotein expressed in human milk and breast carcinomas, promotes Arg-Gly-Asp (RGD)-dependent cell adhesion. DNA Cell Biol. 16 (7), 861-869 (1997).
- Andersen, M. H., Graversen, H., Fedosov, S. N., Petersen, T. E., Rasmussen, J. T. Functional analyses of two cellular binding domains of bovine lactadherin. Biochemistry. 39 (20), 6200-6206 (2000).
- Tan, C. W., Bourcy, M., Pasalic, L., Chen, V. M. Flow cytometry assessment of procoagulant platelets using a dithiol-reactive probe functional disulfide bonds: Methods and protocols. Methods Mol Biol. 1967, 305-321 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved