Method Article
ניתוח מקיף של טסיות דם מקרישות המציגות מאפיינים של נמק, אפופטוזיס והפעלת טסיות דם
In This Article
Summary
הפרוטוקול הנוכחי מספק מערך מקיף של נהלים הדרושים לניתוח טסיות דם פרו-קרישיות, המציגות תכונות חופפות של נמק, אפופטוזיס והפעלת טסיות דם.
Abstract
טסיות הדם המסתובבות בזרם הדם שקטות יחסית אך "מופעלות" כאשר נתקלות בממריצים או "אגוניסטים" במקום הפגיעה בכלי הדם. טסיות פרו-אגרגטוריות ופרו-קרישיות מייצגות שתי אוכלוסיות נפרדות של טסיות מופעלות. בעוד שטסיות פרו-אגרגטוריות מקלות על הפסקת הדימום, או "המוסטזיס", על ידי יצירת פקק של טסיות דם המקובצות יחד דרך גשרי פיברינוגן, טסיות פרו-קרישה מאיצות באופן דרמטי את מפל הקרישה, ומגיעה לשיאה בהיווצרות קרישי פיברין. היבט מעניין של טסיות דם מקרישות הוא שהמורפולוגיה שלהן מציגה מאפיינים מסוימים של "נמק" ו"אפופטוזיס". לפיכך הם עשויים לייצג צורה של מוות תאי בטסיות דם, אם כי יש להם תפקיד חשוב בפקקת והמוסטזיס. מאמר זה מציג את הרעיון של טסיות דם פרו-קרישה, הרלוונטיות שלהן לבריאות ולמחלות, והשוואה בין השיטות הקיימות לניתוחן. לאחר מכן הוא מספק פרוטוקולים מקיפים לניתוח טסיות דם פרו-קרישה, חקירת מנגנוני היווצרותם והערכת תפקידם הפרוטרומבוטי בהקלת הקרישה. המאמר מסתיים בדיון בשלבים מרכזיים, מגבלות ועקרונות פתרון בעיות עבור השיטות המתוארות.
Introduction
ישנן לפחות שתי אוכלוסיות נפרדות של טסיות פעילות 1,2. טסיות פרו-אגרגטוריות מאופיינות בהפעלה גבוהה של אינטגרין וחשיפה נמוכה, אם בכלל, ל-PS. מצד שני, טסיות דם מקרישות מאופיינות בפעילות אינטגרין נמוכה וחשיפה גבוהה ל-PS 1,2, ומספקות משטח להרכבה של קומפלקסים טנאז ופרותרומבינאז3, שהוא פעיל פי 105-10 פי6 ופי 300000 מגורם פאזה מסיס בודד IXa ו-Xa, בהתאמה4. טסיות דם מעודדות קרישה מאיצות באופן דרמטי את הקרישה. היבט מעניין של טסיות דם פרו-קרישה הוא שהמורפולוגיה שלהן דומה למאפיינים מסוימים של "נמק" כגון מיקרו-שלפוחית, בלון של התא עם הפרעה בשלד הציטו ואובדן שלמות הממברנה, כמו גם אלה של "אפופטוזיס" כגון אובדן אסימטריה של פוספוליפידים בממברנה עם חשיפה של פוספטידילסרין בעלון החיצוני 5,6. במילים אחרות, היווצרות טסיות דם פרו-קרישה עשויה לייצג צורה של מוות תאים בטסיות דם, אם כי עם פונקציה פיזיולוגית חשובה בהמוסטזיס.
טסיות דם מקרישות קשורות באופן משמעותי להפרעות פקקתיות. בעוד שלרוב האנשים הבריאים אין טסיות דם מעודדות קרישה במחזור הדם, ~30% מהטסיות הרגילות מאמצות פנוטיפ פרוקו-קרישה ex vivo לאחר חשיפה לאגוניסטים חזקים כמו טרומבין וקולגן7. טסיות דם פרו-קרישה במחזור דווחו בטראומה, כאשר היווצרותן עשויה לשקף הפעלה על ידי היסטון H4 8,9. עם זאת, ברוב ההפרעות הפרוטרומבוטיות, רמות מוגברות של טסיות דם מקרישות מתגלות רק לאחר גירוי ex vivo 10. לדוגמה, לחולים עם שבץ מוחי חריף שאצלם >51.1% מהטסיות שלהם הומרו לטסיות דם מעודדות קרישה (הידועות גם בשם טסיות COATed) על ידי קולגן ותרומבין היה יחס סיכון של 10.72 לשבץ חוזר תוך 30 יום בהשוואה לחולים עםהיווצרות טסיות דם פרו-קרישה פחותה. תוצאות דומות דווחו בחולים עם התקפים איסכמיים חולפים וטרשת עורקים קרוטידית12. לעומת זאת, הפרעת הדימום תסמונת סקוט נובעת ממוטציה של ANO6, המקודדת את הסקרמבלאז הפוספוליפיד TMEM-16F, מה שמוביל לחשיפה חסרה של טסיות דםPS 13. הפרעות דימום אידיופטיות ודימום תוך גולגולתי עשויות להיות קשורות לירידה ביכולת לייצר טסיות דם פרו-קרישיות14.
לפיכך, הערכת טסיות דם מקרישות היא חלק מכל ניתוח של תפקוד טסיות הדם לא רק במהלך חקירות בסיסיות של מנגנוני הפעלת טסיות דם וכתוצאה מכך פקקת והמוסטזיס, אלא גם במהלך ניתוח קליני לסיכון לפקקת או דימום בחולים במצבים פתולוגיים שונים. פאנל של האגודה הבינלאומית לפקקת והמוסטזיס (ISTH) המליץ על שימוש בקשירת Annexin V וביטוי P-selectin על ידי זרימה ציטומטרית להבחנה בין פרוקו-קרישה מתת-אוכלוסיות טסיות אחרות15. המאמר דן גם בשיטות השונות שניתן להשתמש בהן כדי לנתח טסיות דם פרו-קרישה ואפופטוטיות, אך אינו מתאר את התהליכים בפירוט. שיטות אלה כוללות זיהוי של (1) הפעלת טסיות דם על ידי PAC1/JonA או קשירת פיברינוגן (ציטומטריית זרימה); (2) הפרשת גרגירי אלפא על ידי ביטוי P-selectin (ציטומטריית זרימה); (3) חשיפה ל-PS על ידי קשירת Annexin V/lactadherin (ציטומטריית זרימה); (4) אובדן שלמות הממברנה על ידי תיוג GSAO (ציטומטריית זרימה); (5) שינויים מורפולוגיים כמו בלון (מיקרוסקופיה); (6) זיהוי הפעלת קספאאז על ידי בדיקת קספאזה (אימונובלוטינג/לינומטריה/ציטומטריית זרימה) או פירוק של גלסולין מצע שלד ציטו (אימונובלוטינג); (7) אובדן פוטנציאל הממברנה המיטוכונדריאלית על ידי צבעים רגישים לפוטנציאל מיטוכונדריאלי כגון JC-1/Mitotracker (ציטומטריית זרימה); (8) סמנים אפופטוטיים פנימיים מיטוכונדריאלים שחרור Bax, Bak וציטוכרום c (אימונובלטינג); (9) תפקוד פרוקו-קרישה על ידי בדיקת יצירת תרומבין וקשירת גורם קרישה Xa/Va (ציטומטריית זרימה, מיקרוסקופיה); (10) עליית סידן ציטוזולית ומיטוכונדריאלית על ידי צבעים רגישים לסידן פלואורסצנטיים (ציטומטריית זרימה, פלואורומטריה, מיקרוסקופיה).
המחקר הנוכחי מתעמק בפרוטוקולים מקיפים לניתוח טסיות דם פרו-קרישיות וכן מבדיל אותן מטסיות פרואגרגטוריות ואפופטוטיות. רוב ההליכים המתוארים מסתמכים על זרימה ציטומטרית שיש לה את היתרונות של (1) היותה זמינה וקלה לשימוש, (2) דורשת נפח דגימה נמוך, ו-(3) מאפשרת זיהוי בו זמנית של תת-אוכלוסיות מרובות של טסיות דם (פרואגרגטורי, פרוקו-קרישה ואפופטוטית)15. פרוטוקולים אלה המבוססים על ציטומטריית זרימה מתווספים למבחנים פונקציונליים של פעילות פרוקו-קרישה המבוססים על קשירת גורמי קרישה ומבחני יצירת תרומבין מבוססי קריש.
Protocol
משתתפים אנושיים גויסו למחקר לדגימת דם ורידית היקפית לאחר קבלת הסכמה מדעת בכתב, תוך הקפדה על ההמלצות והאישור של ועדת הביקורת המוסדית של מכון המחקר לרנר קליבלנד קליניק, כאשר כל מתודולוגיות המחקר תואמות את הסטנדרטים שנקבעו בהצהרת הלסינקי. משתתפים בוגרים בריאים מעל גיל 18 נכללו, בעוד שמשתתפים מתחת לגיל 18, אנשים עם היסטוריה עדכנית של אירועים טרומבוטיים בששת החודשים האחרונים, אלה עם היסטוריה של אלכוהוליזם או שימוש בסמים, ומשתתפים שהשתמשו בתרופות נוגדות טסיות או נוגדות קרישה בארבעת השבועות האחרונים לא נכללו. תיאור מפורט של חומרים וריאגנטים המשמשים בפרוטוקולים ניתן למצוא בטבלת החומרים.
1. הכנת טסיות דם
- לשאוב דגימות דם ורידיות היקפיות לנוגדי קרישה ACD (1:9 v/v) ממשתתפים אנושיים לאחר קבלת הסכמה מדעת בכתב, תוך הקפדה על ההמלצות שאושרו על ידי ועדת הביקורת המוסדית.
- צנטריפוגה הדם שנאסף ב-ACD ב-100 x גרם למשך 20 דקות ב-22 מעלות צלזיוס כדי לקבל פלזמה עשירה בטסיות דם (PRP) כסופרנטנט.
- צנטריפוגה את ה-PRP ב-800 x g למשך 7 דקות ב-22 מעלות צלזיוס לאחר הוספת 3 מיקרומטר של PGE1 ו-2 מ"מ של EDTA.
- השליכו את הסופרנטנט והשעו מחדש את כדור הטסיות במאגר A (ראה טבלת חומרים) על ידי פיפטינג עדין.
- צנטריפוגה: טסיות הדם תלויות במאגר A ב-800 x גרם למשך 7 דקות ב-22 מעלות צלזיוס.
- השעו מחדש את כדור הטסיות במאגר B (ראה טבלת חומרים) על ידי פיפטינג עדין.
- התאם את ספירת הטסיות הסופית ל-1 ×10 7/מ"ל באמצעות מונה תאים אוטומטי.
הערה: בצע את כל השלבים בתנאים סטריליים ונקוט באמצעי זהירות כדי לשמור על טסיות הדם במצב מנוחה על ידי הימנעות מחשיפה לגזירה מוגזמת במהלך הפיפטינג.
2. אנליזה של טסיות דם פרו-קרישה על ידי זרימה ציטומטרית
- תוסף טסיות דם אנושיות שטופות עם 2.5 מ"מ סידן (0.5 מיקרוליטר של תמיסת CaCl2 0.5 M במלאי ב-100 מיקרוליטר של תרחיף טסיות דם).
- שמרו על חלק אחד של טסיות דם ללא גירוי ועוררו את השברים הנותרים עם טרומבין (0.1 U/mL, 0.25 U/mL, 0.5 U/mL), קונוולקסין (20 ננוגרם/מ"ל, 50 ננוגרם/מ"ל, 100 ננוגרם/מ"ל), או השילוב שלהם למשך 15 דקות בטמפרטורת החדר.
- לאחר הגירוי, הוסף 1 מיקרוליטר כל אחד של PE-Annexin V, FITC-PAC1 ונוגדני CD62P אנטי-אנושיים APC ל-100 מיקרוליטר של תרחיפי טסיות מגורים.
- דגרו את הטסיות בחושך בטמפרטורת החדר למשך 30 דקות.
- תקן את הטסיות על ידי הוספת נפח שווה (1:1) של 2% פורמלין.
- נתח את הדגימות על ידי זרימה ציטומטרית כדי לכמת טסיות דם פרו-קרישה15,16.
- צייר שער אמורפי כדי להקיף טסיות דם, להפריד אותן מרעש וחלקיקים מרובי טסיות.
- אסוף את כל נתוני הקרינה באמצעות הגברה לוגריתמית של ארבעה רבעים עבור 10,000 אירועים בשער הטסיות מכל דגימה.
- הגדר אזורים לטסיות דם על סמך חיוביות פלואורסצנטית או שליליות לחשיפה לפוספטידילסרין (PS) (כריכת Annexin V), ביטוי P-selectin (CD62P) והפעלת אינטגרין αIIbβ3 (קשירת PAC1).
- קחו בחשבון טסיות חיוביות הן עבור חשיפה ל-PS (קשירת Annexin V) והן עבור ביטוי P-selectin (CD62P) אך שליליות עבור הפעלת אינטגרין αIIbβ3 (קשירת PAC1) כטסיות פרו-קרישה (איור 1) (טבלה 1).
- באופן דומה, קחו בחשבון טסיות חיוביות הן להפעלת אינטגרין αIIbβ3 (קשירת PAC1) והן לביטוי P-selectin (CD62P) אך שליליות לחשיפה ל-PS (קשירת Annexin V) כטסיות דם מצטברות.
הערה: טסיות שליליות הן להפעלת אינטגרין αIIbβ3 (קשירת PAC1) והן לביטוי P-selectin (CD62P) אך חיוביות לחשיפה ל-PS (קשירת Annexin V) הן ככל הנראה טסיות אפופטוטיות15,16.
3. אנליזה של סידן מיטוכונדריאלי על ידי זרימה ציטומטרית
- יש לדלל טסיות דם אנושיות שטופות ל-1 ×10 6/מ"ל ולהשלים עם 2.5 מ"מ סידן (0.5 מיקרוליטר של תמיסת CaCl2 0.5 M במלאי בתרחיף טסיות של 100 מיקרוליטר).
- סמן את הטסיות עם 5 מיקרומטר רוד-2 AM (לסידן מיטוכונדריאלי) למשך 30 דקות בחושך.
- טסיות שער כראוי, כמתואר בשלב 2.
- נתח אירועים בשער הטסיות עבור שינויים תלויי זמן בקרינה הממוצעת של אירועים נרכשים במשך 5 דקות באמצעות תרשים פיזור צפיפות של פלואורסצנציה PE (עבור Rhod-2 AM) לעומת זמן.
- רשום את רמות הסידן הבסיסיות במשך הדקה הראשונה.
- הוסיפו תרומבין (0.1 ננוגרם/מ"ל, 0.25 ננוגרם/מ"ל, או 0.5 ננוגרם/מ"ל), קונוולקסין (20 ננוגרם/מ"ל, 50 ננוגרם/מ"ל או 100 ננוגרם/מ"ל), או השילוב שלהם, והמשיכו לאסוף נתונים עוד 4 דקות17.
4. ניתוח פוטנציאל הממברנה המיטוכונדריאלית על ידי ציטומטריית זרימה
- תוסף טסיות דם אנושיות שטופות עם 2.5 מ"מ סידן (0.5 מיקרוליטר של תמיסת CaCl2 0.5 M במלאי ב-100 מיקרוליטר של תרחיף טסיות דם).
- שמרו על חלק אחד של טסיות דם ללא גירוי ועוררו את השברים הנותרים עם טרומבין (0.1 U/mL, 0.25 U/mL, או 0.5 U/mL), קונוולקסין (20 ננוגרם/מ"ל, 50 ננוגרם/מ"ל או 100 ננוגרם/מ"ל), או השילוב שלהם למשך 15 דקות בטמפרטורת החדר.
- לאחר הגירוי, הוסף צבע תיוג מיטוכונדריה (ראה טבלת חומרים) בריכוז סופי של 500 ננומטר לתרחיפים המגורים של טסיות הדם.
- דגרו על הטסיות למשך 30 דקות בחושך.
- תקן את הטסיות על ידי הוספת נפח שווה של 2% פורמלין.
- לנתח דגימות לפי זרימה ציטומטרית17.
- טסיות שער כמתואר בשלב 2.
- נתח אירועים בשער הטסיות לאיתור ירידה בקרינה בתעלת PE (עבור צבע תיוג המיטוכונדריה) של ציטומטר הזרימה.
5. ניתוח פעילות קספאז 3 וקספאז 8 על ידי זרימה ציטומטרית
- תוסף טסיות דם אנושיות שטופות עם 2.5 מ"מ סידן (0.5 מיקרוליטר של תמיסת CaCl2 0.5 M במלאי ב-100 מיקרוליטר של תרחיף טסיות דם).
- שמרו על חלק אחד של טסיות דם ללא גירוי ועוררו את השברים הנותרים עם טרומבין (0.1 U/mL, 0.25 U/mL, או 0.5 U/mL), קונוולקסין (20 ננוגרם/מ"ל, 50 ננוגרם/מ"ל או 100 ננוגרם/מ"ל), או השילוב שלהם למשך 15 דקות בטמפרטורת החדר.
- לאחר הגירוי, הוסף מגיב לזיהוי אפופטוזיס 1:1000 (v/v) (ראה טבלת חומרים) (עבור מסלולי אפופטוזיס פנימיים וחיצוניים כאחד) או 1:300 (v/v) FITC-IETD-FMK (עבור קספאז 8 של מסלול האפופטוזיס החיצוני) לתרחיפי הטסיות המגורים.
- דגרו על הטסיות למשך 30 דקות בחושך.
- תקן את הטסיות על ידי הוספת נפח שווה של 2% פורמלין.
- לנתח דגימות לפי זרימה ציטומטרית17.
- טסיות שער כראוי, כמתואר בשלב 2.
- נתח אירועים בשער הטסיות לפלואורסצנטיות בתעלת FITC (עבור קספאז 3/7 או קספאז 8) של ציטומטר הזרימה.
6. אנליזה של קשירת פרותרומבין על ידי זרימה ציטומטרית
- צימוד פרותרומבין בקר עם צבע Alexa Fluor 488 באמצעות ערכת תיוג חלבון (ראה טבלת חומרים), בהתאם להוראות היצרן.
- תוסף טסיות דם אנושיות שטופות עם 2.5 מ"מ סידן (0.5 מיקרוליטר של תמיסת CaCl2 0.5 M במלאי בתרחיף טסיות של 100 מיקרוליטר).
- שמרו על חלק אחד של טסיות דם ללא גירוי ועוררו את השברים הנותרים עם טרומבין (0.1 U/mL, 0.25 U/mL, או 0.5 U/mL), קונוולקסין (20 ננוגרם/מ"ל, 50 ננוגרם/מ"ל או 100 ננוגרם/מ"ל), או השילוב שלהם למשך 15 דקות בטמפרטורת החדר.
- לאחר הגירוי, הוסף פרותרומבין בקר מצומד AF488 (100 מיקרוגרם/מ"ל) ו-1 מיקרוליטר כל אחד של נוגדן CD62P אנטי-אנושי PE-Annexin V ו-APC ל-100 מיקרוליטר של תרחיפי טסיות מגורים.
- תקן את הטסיות על ידי הוספת נפח שווה של 2% פורמלין.
- לנתח דגימות על ידי זרימה ציטומטרית17 לכימות קשירת פרותרומבין לטסיות דם.
- צייר שער אמורפי כדי להקיף טסיות נפרדות מרעש וחלקיקים מרובי טסיות.
- אסוף את כל נתוני הקרינה באמצעות הגברה לוגריתמית של ארבעה רבעים עבור 10,000 אירועים בשער הטסיות מכל דגימה.
- צייר אזורים עבור טסיות דם עם פלואורסצנטיות חיוביות או שליליות לחשיפה ל-PS (כריכת Annexin V), ביטוי P-selectin (CD62P) ו-AF488-prothrombin (קשירת פרותרומבין).
- קבע את החלק היחסי של כל אירועי טסיות הדם, כמו גם את שיעור הטסיות החיוביות הן לחשיפה ל-PS (כריכת Annexin V) והן לביטוי P-selectin (CD62P) (טסיות דם פרוקו-קרישה), החיוביות לקשירת פרותרומבין.
7. ניתוח קשירת פרותרומבין במיקרוסקופיה קונפוקלית
- צימוד פרותרומבין בקר עם צבע Alexa Fluor 488 באמצעות ערכת תיוג חלבון (ראה טבלת חומרים), בהתאם להוראות היצרן.
- תוסף טסיות דם אנושיות שטופות עם 2.5 מ"מ סידן (0.5 מיקרוליטר של תמיסת CaCl2 0.5 M במלאי בתרחיף טסיות של 100 מיקרוליטר).
- שמרו על חלק אחד של טסיות דם ללא גירוי ועוררו את השברים הנותרים עם טרומבין (0.1 U/mL, 0.25 U/mL, או 0.5 U/mL), קונוולקסין (20 ננוגרם/מ"ל, 50 ננוגרם/מ"ל או 100 ננוגרם/מ"ל), או השילוב שלהם למשך 15 דקות בטמפרטורת החדר.
- לאחר הגירוי, הוסף פרותרומבין בקר מצומד AF488 (100 מיקרוגרם/מ"ל) ו-1 מיקרוליטר כל אחד של נוגדן CD62P אנטי-אנושי PE-Annexin V ו-APC ל-100 מיקרוליטר של תרחיפי טסיות מגורים.
- תקן את הטסיות על ידי הוספת נפח שווה של 2% פורמלין.
- גלולה את הטסיות הקבועות על כיסויים מצופים פולי-D-ליזין.
- הרכיבו כיסויים על שקופיות מיקרוסקופיה באמצעות תמיסה נגד דהייה.
- לחלופין, כיסויי מעיל עם קולגן (100 מיקרוגרם/מ"ל) למשך שעה אחת בתא לח.
- חסום את הכיסויים המצופים עם 0.5% BSA ב-PBS למשך שעה.
- סמן את הטסיות עם פרותרומבין בקר מצומד AF488 (100 מיקרוגרם/מ"ל) ו-1 מיקרוליטר כל אחד של נוגדן CD62P אנטי-אנושי PE-Annexin V ו-APC.
- אפשר לטסיות המסומנות להיצמד למשך 20 דקות על כיסויים מצופים קולגן.
- שטפו את הכיסויים עם טסיות דביקות שלוש פעמים עם PBS.
- תקן כיסויים עם 2% פרפורמלדהיד למשך שעה.
- הרכיבו כיסויים על שקופיות מיקרוסקופיה באמצעות תמיסה נגד דהייה.
- התבונן בשקופיות תחת מיקרוסקופ קונפוקלי בהגדלה אובייקטיבית של 63×.
- לנתח את התמונות באמצעות תוכנת פיג'י לכימות פלואורסצנטי.
8. בדיקת יצירת תרומבין תלויה בפוספוליפידים על בסיס טסיות דם
- תוסף טסיות דם אנושיות שטופות עם 2.5 מ"מ סידן (0.5 מיקרוליטר של תמיסת CaCl2 0.5 M במלאי ב-100 מיקרוליטר של תרחיף טסיות דם).
- שמרו על חלק אחד של טסיות דם ללא גירוי ועוררו את השברים הנותרים עם טרומבין (0.1 U/mL, 0.25 U/mL, או 0.5 U/mL), קונוולקסין (20 ננוגרם/מ"ל, 50 ננוגרם/מ"ל או 100 ננוגרם/מ"ל), או השילוב שלהם למשך 15 דקות בטמפרטורת החדר.
- הוסף 100 מיקרוליטר של טסיות דם מטופלות לתערובת של 50 מיקרוליטר של פלזמה רגילה מאוגדת ו-50 מיקרוליטר של תמיסת קאולין בעלת עכירות נמוכה (20 מ"ג/מ"ל), שהודגרה מראש ב-37 מעלות צלזיוס למשך 5 דקות.
- מוסיפים לתערובת 5 מ"מ של CaCl2 .
- עקוב אחר היווצרות הקריש על ידי עכירות בקורא מיקרו-פלטות, ומדוד ספיגה ב-660 ננומטר כל 60 שניות למשך שעה.
תוצאות
חלק מהטסיות המופעלות הופכות ל"פרו-קרישות" עם עלייה אופיינית בביטוי פני השטח של פוספטידילסרין (PS) ו-P-סלקטין, מה שמבדיל אותן מטסיות "אפופטוטיות" שהן חיוביות רק לחשיפה ל-PS כמו גם טסיות "פרו-אגרגטוריות" שהן חיוביות לביטוי P-selectin. מצאנו כי תרומבין גורם לעלייה תלוית מינון בשיעור טסיות הדם החיוביות הן לביטוי P-selectin והן לביטוי PS כפי שזוהה על ידי קשירה של נוגדן FITC-anti-CD62P ו-PE-Annexin V, בהתאמה (איור 2). יצירת טסיות דם פרו-קרישה תלויה בזרם הסידן המיטוכונדריאלי18,19 לאורך השיפוע האלקטרוכימי על פני הממברנה המיטוכונדריאלית הפנימית עם עליות סידן ציטוזוליות הנגרמות על ידי אגוניסטים, כמו גם היווצרות נקבוביות מעבר חדירות מיטוכונדריאלית (mPTP) התלויה בציקלופילין D (CypD)כתוצאה מכך 20. באופן עקבי, עלייה בפעילות פרו-קרישה הנגרמת על ידי תרומבין הייתה קשורה לעלייה בסידן המיטוכונדריאלי (איור 3) ולירידה בפוטנציאל הממברנה המיטוכונדריאלית (איור 4) כפי שנמדד באמצעות צבעי Rhod-2 ו-Mitotracker Red, בהתאמה. טסיות מגורות מציגות מאפיינים של אפופטוזיס, כולל הצטברות Bax/Bak21,22; האם זה מפעיל את קספאז23,24 ותורם לחשיפה ל-PS25 נותרה שנויה במחלוקת. גירוי תרומבין של טסיות הדם היה קשור להפעלה של קספאז 8, אך לא לקספזות סופניות 3 ו-7 (איור 5), כפי שנותחו על ידי FITC-IETD-FMK ומגיב לזיהוי אפופטוזיס, בהתאמה.

איור 1: ניתוח טסיות דם פרו-קרישה. תרשים סכמטי המתאר ניתוח של טסיות דם פרו-קרישה על ידי זרימה ציטומטרית באמצעות נוגדנים FITC-PAC1, APC-anti-CD62P ו-PE-Annexin V כבדיקות פלואורסצנטיות לזיהוי הפעלת אינטגרין, ביטוי P-selectin וחשיפה ל-PS, בהתאמה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
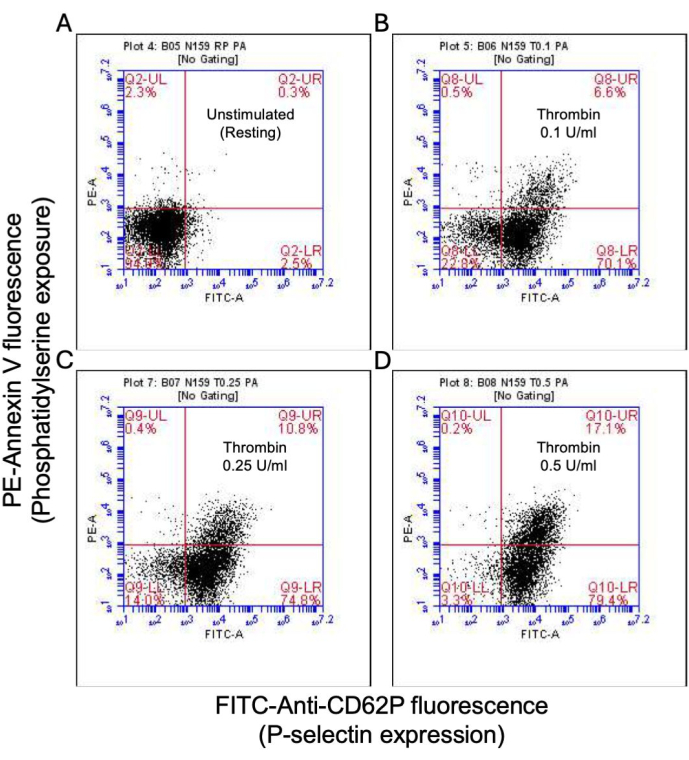
איור 2: ביטוי P-סלקטין וחשיפה לפוספטידילסרין בטסיות בעת גירוי תרומבין. תרשימי נקודות מייצגים המראים טסיות חיוביות לביטוי P-selectin ו/או חשיפה ל-PS ב-(A) טסיות לא מגורה ובחשיפה לפטרומבין במינונים של (B) 0.1 U/mL, (C) 0.25 U/mL ו-(D) 0.5 U/mL כפי שזוהה על ידי FITC-anti-CD62P ו-PE-Annexin V פלואורסצנטי באמצעות ציטומטריית זרימה. האיורים בסוגריים מציינים את שיעור הטסיות הכולל בכל רבעון של החלקה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
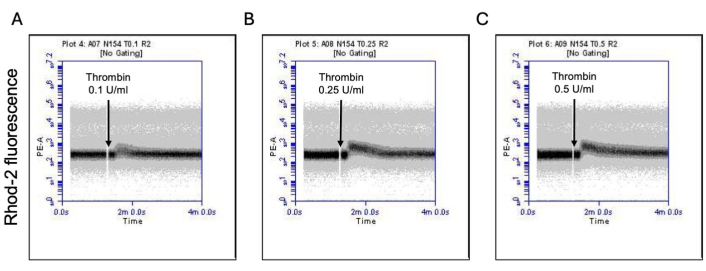
איור 3: שינויים תלויי זמן ברמות הסידן המיטוכונדריאלי בטסיות הדם בעת חשיפה לתרומבין. תרשימי צפיפות מייצגים המראים שינויים תלויי זמן בקרינה עקב צבע Rhod-2 המצביע על רמות סידן מיטוכונדריאלי בטסיות הדם בעת חשיפה לפטרומבין במינונים של (A) 0.1 U/mL, (B) 0.25 U/mL ו-(C) 0.5 U/mL כפי שזוהה על ידי ציטומטריית זרימה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
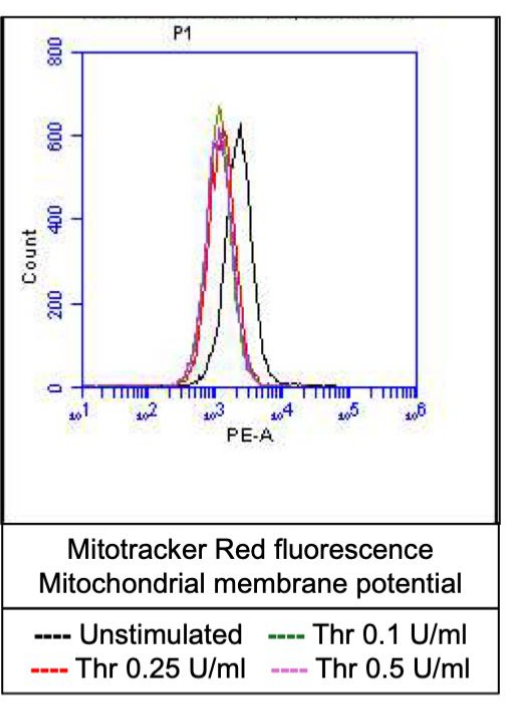
איור 4: פוטנציאל הממברנה המיטוכונדריאלית בטסיות הדם בעת גירוי תרומבין. איור זה מציג שכבות היסטוגרמה מייצגות המתארות פלואורסצנטיות עקב צבע תיוג מיטוכונדריה, המצביע על פוטנציאל הממברנה המיטוכונדריאלית בטסיות הדם בעת חשיפה למינונים שונים של תרומבין, כפי שזוהה על ידי ציטומטריית זרימה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
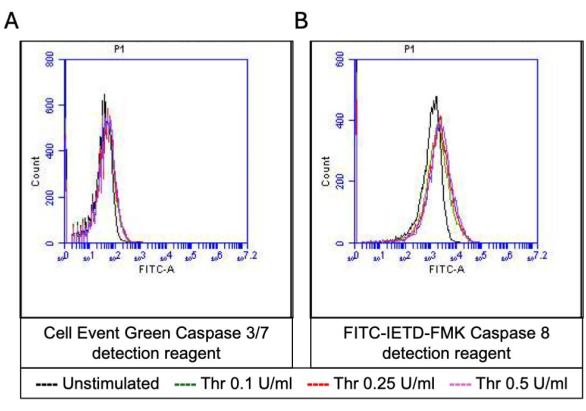
איור 5: פעילויות Caspase 3/7 ו-Caspase 8 בטסיות עם גירוי טרומבין. שכבות היסטוגרמה מייצגות המציגות פלואורסצנטיות עקב (A) מגיב לזיהוי אפופטוזיס ו-(B) FITC-IETD-FMK, בהתאמה, המצביעות על פעילויות Caspase 3/7 ו-caspase 8 בטסיות הדם בעת חשיפה למינונים שונים של טרומבין כפי שזוהו על ידי ציטומטריית זרימה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| סמן | טסיות דם מעודדות קרישה | טסיות דם מצטברות | טסיות אפופטוטיות |
| הפעלת אינטגרין (קשירת PAC1) | לא | כן | לא |
| הפרשת גרגירים | כן | כן | לא |
| (ביטוי P-selectin) | |||
| חשיפת PS | כן | לא | כן |
| (כריכת נספח 5) |
טבלה 1: סמני זרימה ציטומטרית לזיהוי אוכלוסיות טסיות לאחר גירוי. טבלה זו מציגה סמני זרימה ציטומטריים המשמשים לאיתור אוכלוסיות מובחנות של טסיות דם המופיעות לאחר גירוי טסיות עם אגוניסטים חזקים כגון טרומבין וקונבולקסין.
Discussion
טסיות דם מעודדות קרישה מדגימות עלייה ניכרת ומתמשכת בסידן התוך תאי עם גירוי26, אך ניתן להפיק אותן באמצעות מנגנונים שונים. הם נוצרים על ידי גירוי אגוניסטי חזק עם קולגן ותרומבין באמצעות מתווכים נפרדים, כולל זרם הסידן המיטוכונדריאליהבולט ביותר 18,19 לאורך השיפוע האלקטרוכימי על פני הממברנה המיטוכונדריאלית הפנימית עם עליות סידן ציטוזוליות הנגרמות על ידי אגוניסטים. ברגע שהסידן המיטוכונדריאלי מגיע לסף מסוים, הוא מפעיל היווצרות נקבוביות מעבר חדירות מיטוכונדריאלית (mPTP) באופן תלוי ציקלופילין D (CypD)20. כאשר המיטוכונדריה מחלחלים לסידן ואינם יכולים עוד לשמש כיורים לסידן הציטוזולי, איתות סידן על-מקסימלי נצפה לאחר היווצרות mPTP26. הרמות הגבוהות המתמשכות של סידן ציטוזולי, בתורן, מפעילות את הסקרמבלאז הפוספוליפיד התלוי בסידן, TMEM16F הפעלה, מה שמוביל לחשיפה ל-PS27,28. חשיפה ל-PS מלווה בהשבתה של אינטגריןα IIbβ3 על ידי מנגנון כפול הכולל מחשוף תלוי קלפין של הזנב הציטופלזמי של אינטגרין β3 וכן ערבול פוספוליפידים תלוי TMEM16Fעצמו 29,30. לפיכך, לטסיות פרו-קרישה, בניגוד לטסיות פרו-אגרגטוריות, יש אינטגרין לא פעיל. בנוסף, חשיפה ל-PS מספקת משטח לקשירת גורמי קרישה, מה שמקל על הרכבה של קומפלקסים טנאז ופרותרומבינאז3. טסיות דם מעודדות קרישה מאיצות באופן דרמטי את הקרישה4.
חשיפה ל-PS וכתוצאה מכך פעילות פרוקו-קרישה יכולה להיגרם גם על ידי מחשוף תלוי קספאז של סקרמבלאז XKR8 בטסיות הדם העוברות אפופטוזיס פנימי, ללא תלות בהפעלה25,31. למרות שטסיות דם מגרות מציגות מאפיינים של אפופטוזיס פנימי, כולל הצטברות Bax/Bak21,22, האם זה מפעיל קספאז23,24 ותורם לחשיפה ל-PS25 נותר שנוי במחלוקת. אפופטוזיס חיצוני על ידי TNFα או FasL לא דווח בטסיות למרות נוכחותם של רוב הרכיבים ועדויות מסוימות להפעלת קספאז 832. טסיות דם לאחר גירוי ממושך עוברות נקרופטוזיס17 בתיווך MLKL, הידוע כגורם לחשיפה ל-PS ללא תלות ב-CypD או ב-caspase33.
מחקר זה סיפק שיטה לאיתור טסיות דם מעודדות קרישה באמצעות חשיפה ל-PS (קשירת Annexin V), ביטוי P-selectin (CD62P) והפעלת אינטגריןα-IIbβ-3 (קשירת PAC1) כסמנים. סמנים אלה יכולים לעזור להבחין ביעילות בין טסיות דם פרו-קרישה לבין טסיות אפופטוטיות ופרו-אגרגטוריות15. עם זאת, קשירת נספח V דורשת נוכחות של רמות סידן גבוהות במדיום. לפיכך, יש להשתמש בהפרין או במעכבי טרומבין אחרים בעת שימוש בפלזמה עשירה בטסיות דם או בדגימות דם מלא. יתר על כן, מעכב פילמור פיברין GPRP משמש כאשר יש להשתמש בתרומבין כאחד האגוניסטים עם דגימות אלה34,35. Lactadherin או GSAO יכולים לשמש כסמנים חלופיים לנספח V, אך יש להם מגבלות משלהם. בעוד שלקטדרין אינו ספציפי ל-PS וקושר אינטגרינים36,37, GSAO אינו זמין מסחרית וניתן להשיג אותו רק באמצעות שיתוף פעולה מחקרי38.
מאמר זה סיפק גם שיטות משלימות לחקירת מנגנוני החשיפה ל-PS, כולל זרם סידן מיטוכונדריאלי והיווצרות נקבוביות מעבר חדירות מיטוכונדריאלית (אובדן פוטנציאל הממברנה המיטוכונדריאלית). יש לציין כאן כי ניתן להשלים שיטות אלו על ידי מדידות סידן ציטוזוליות באמצעות צבעי Fluo-4 ו-Fluo-5N. מכיוון שעדיין לא ברור אם הפעלת קספאז תורמת לחשיפה ל-PS בטסיות מגורות, אנו מונים גם פרוטוקולים עבור מבחני הפעלה של קספאז 8 וקספאז 3/7. ניתן לאשש את האופי האמיתי של טסיות הדם רק על ידי יכולתן לקשור גורמי קרישה ולקדם יצירת תרומבין. לפיכך, מחקר מעמיק של טסיות דם לחשיפה ל-PS (קשירת Annexin V), ביטוי P-selectin (CD62P) והפעלת אינטגריןα IIbβ3 (קשירת PAC1), זרם סידן מיטוכונדריאלי, פוטנציאל ממברנה מיטוכונדריאלית, פעילות קספאז יחד עם קשירת גורם קרישה (פרותרומבין) ויצירת / קרישה תלויה בפוספוליפידים של טסיות דם כמתואר במאמר הנוכחי יהיה הכרחי ומספיק לניתוח מקיף של טסיות דם פרו-קרישה.
Disclosures
לסופרים אין אינטרסים מתחרים לחשוף.
Acknowledgements
פארש פ. קולקרני וקית' ר. מקריי, בהתאמה, מכירים בפרסי מענק עמית ופיילוט הממומנים על ידי VeloSano, קרן קליבלנד קליניק.
Materials
| Name | Company | Catalog Number | Comments |
| Acid Citrate Dextrose (ACD) solution (For 1000 mL) | Tri- Sodium Citrate- 22 g Citric Acid- 8 g Dextrose- 24.5 g Water- Make up volume to 1000 mL | ||
| Alexa Fluor 488 protein labelling kit | Invitrogen | A10235 | |
| APC Mouse Anti-Human CD62P | BD Pharmingen | 550888 | |
| Bovine Prothrombin | Prolytix | BCP-1010 | |
| Buffer A (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 6.2 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution EGTA 1 mM Add 10 μL (1:100 v/v) 100 mM EGTA Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose PGE1 3 μM Add 3 μL (1:333 v/v) 1 mM PGE1 solution | ||
| Buffer B (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 7.4 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose | ||
| CaCl2 (0.5 M) (For 50ml) | Molecular weight of CaCl2.2H2O = 147.02 Dissolve 3.675 g of CaCl2.2H2O in 50 ml Milli Q water | ||
| CellEvent Caspase-3/7 Detection Reagents Green | Invitrogen | C10423 | Apoptosis detection reagent |
| Convulxin | Enzo Life Sciences | ALX-350-100 | |
| EDTA (0.5 M; pH 8) (For 100 mL) | Molecular Weight of EDTA Na2.2H2 O: 372.24g Weigh 18.612 g and suspend in 50 ml Milli Q water and check the pH (pH~4) Slowly add 10N NaOH with stirring and monitor the pH. EDTA starts solubilizing at around pH 7 and is completely soluble at pH 8. Make up the volume to 100 ml with Milli Q water. | ||
| EGTA (100 mM; pH 7.4) (For 100 mL) | Molecular Weight: 380.4 Add 3.804 g EGTA in 50 ml Milli Q water and check the pH (pH~3) Add 10 N NaOH dropwise while stirring and monitor the pH EGTA becomes soluble at pH 7.0 (approx) Adjust pH to 7.4 Make up the volume to 100 ml with Milli Q water | ||
| FITC Mouse Anti-Human PAC-1 | BD | 340507 | |
| FITC-IETD-FMK Caspase 8 (active) staining kit | Abcam | ab65614 | |
| Mitotracker Red CMXRos (mitochindria labeling dye) | Invitrogen | M7512 | Stock= 1 mM (50 µg dissolved in 90 µl DMSO) Sub-stock= 100 µM (10 µl Stock + 90 µl DMSO) Working concentration= 500nM (0.5 µl in 100 µl) |
| PE Annexin V | BD Pharmingen | 560930 | |
| Prostaglandin E1 | Sigma | P5515 | Stock= 20 mM (1 mg dissolved in 141 µL DMSO) Sub-stock= 1 mM (10 µl Stock + 190 µL DMSO) Working concentration= 3 µM (3 µL in 1 mL) |
| Rhod-2 AM | Invitrogen | R1244 | Stock= 5 mM (1 mg dissolved in 178 µL DMSO) Sub-stock= 100 µM (10 µL Stock + 90 µL DMSO) Working concentration= 500 nM (0.5 µL in 100 µL) |
| Thrombin from human plasma | Sigma | T7572 |
References
- Munnix, I., Cosemans, J., Auger, J., Heemskerk, J. Platelet response heterogeneity in thrombus formation. Thromb Haemost. 102 (12), 1149-1156 (2009).
- Heemskerk, J. W. M., Mattheij, N. J. A., Cosemans, J. M. E. M. Platelet-based coagulation: Different populations, different functions. J Thromb Haemost. 11 (1), 2-16 (2013).
- Podoplelova, N. A., et al. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood. 128 (13), 1745-1755 (2016).
- Mann, K. G., Butenas, S., Brummel, K. The dynamics of thrombin formation. Arterioscler Thromb Vasc Biol. 23 (1), 17-25 (2003).
- Jackson, S. P., Schoenwaelder, S. M. Procoagulant platelets: Are they necrotic. Blood. 116 (12), 2011-2018 (2010).
- Hua Vivien Mun Yee, V. M. C. Procoagulant platelets and the pathways leading to cell death. Semin Thromb Hemost. 41 (04), 405-412 (2015).
- Dale, G. L. Coated-platelets: An emerging component of the procoagulant response. J Thromb Haemost. 3 (10), 2185-2192 (2005).
- Vulliamy, P., Armstrong, P. C. Platelets in hemostasis, thrombosis, and inflammation after major trauma. Arterioscler Thromb Vasc Biol. 44 (3), 545-557 (2024).
- Vulliamy, P., et al. Histone H4 induces platelet ballooning and microparticle release during trauma hemorrhage. Proc Natl Acad Sci U S A. 116 (35), 17444-17449 (2019).
- Aliotta, A., Bertaggia Calderara, D., Zermatten, M. G., Marchetti, M., Alberio, L. Thrombocytopathies: Not just aggregation defects-the clinical relevance of procoagulant platelets. J Clin Med. 10 (5), 894(2021).
- Kirkpatrick, A. C., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets predict stroke at 30 days following TIA. Neurology. 89 (2), 125-128 (2017).
- Kirkpatrick, A. C., Tafur, A. J., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets improve prediction of stroke and transient ischemic attack in asymptomatic internal carotid artery stenosis. Stroke. 45 (10), 2995-3001 (2014).
- Suzuki, J., Umeda, M., Sims, P. J., Nagata, S. Calcium-dependent phospholipid scrambling by TMEM16F. Nature. 468 (7325), 834-838 (2010).
- Prodan, C. I., Vincent, A. S., Dale, G. L. Coated platelet levels correlate with bleed volume in patients with spontaneous intracerebral hemorrhage. Stroke. 41 (6), 1301-1303 (2010).
- Josefsson, E. C., et al. Consensus report on markers to distinguish procoagulant platelets from apoptotic platelets: Communication from the Scientific and Standardization Committee of the ISTH. J Thromb Haemost. 21 (8), 2291-2299 (2023).
- Kulkarni, P. P., Sonkar, V. K., Gautam, D., Dash, D. AMPK inhibition protects against arterial thrombosis while sparing hemostasis through differential modulation of platelet responses. Thromb Res. 196, 175-185 (2020).
- Ekhlak, M., et al. Necroptosis executioner MLKL plays pivotal roles in agonist-induced platelet prothrombotic responses and lytic cell death in a temporal order. Cell Death Differ. 30 (8), 1886-1899 (2023).
- Kholmukhamedov, A., Janecke, R., Choo, H. -J., Jobe, S. M. The mitochondrial calcium uniporter regulates procoagulant platelet formation. J Thromb Haemost. 16 (11), 2315-2321 (2018).
- Choo, H. -J., Saafir, T. B., Mkumba, L., Wagner, M. B., Jobe, S. M. Mitochondrial calcium and reactive oxygen species regulate agonist-initiated platelet phosphatidylserine exposure. Arterioscler Thromb Vasc Biol. 32 (12), 2946-2955 (2012).
- Jobe, S. M., et al. Critical role for the mitochondrial permeability transition pore and cyclophilin D in platelet activation and thrombosis. Blood. 111 (3), 1257-1265 (2008).
- Leytin, V., Allen, D. J., Mykhaylov, S., Lyubimov, E., Freedman, J. Thrombin-triggered platelet apoptosis. J Thromb Haemost. 4 (12), 2656-2663 (2006).
- Lopez, J. J., Salido, G. M., Pariente, J. A., Rosado, J. A. Thrombin induces activation and translocation of Bid, Bax and Bak to the mitochondria in human platelets. J Thromb Haemost. 6 (10), 1780-1788 (2008).
- Wolf, B. B., et al. Calpain functions in a caspase-independent manner to promote apoptosis-like events during platelet activation. Blood. 94 (5), 1683-1692 (1999).
- Kim, O. V., et al. Fatal dysfunction and disintegration of thrombin-stimulated platelets. Haematologica. 104 (9), 1866-1878 (2019).
- Schoenwaelder, S. M., et al. Two distinct pathways regulate platelet phosphatidylserine exposure and procoagulant function. Blood. 114 (3), 663-666 (2009).
- Abbasian, N., Millington-Burgess, S. L., Chabra, S., Malcor, J. -D., Harper, M. T. Supramaximal calcium signaling triggers procoagulant platelet formation. Blood Adv. 4 (1), 154-164 (2020).
- Le, T., et al. An inner activation gate controls TMEM16F phospholipid scrambling. Nat Commun. 10 (1), 1846(2019).
- Yang, H., et al. TMEM16F forms a Ca2+-activated cation channel required for lipid scrambling in platelets during blood coagulation. Cell. 151 (1), 111-122 (2012).
- Mattheij, N. J. A., et al. Dual mechanism of integrin closure in procoagulant platelets. J Biol Chem. 288 (19), 13325-13336 (2013).
- Liu, F., et al. Mitochondrially mediated integrin αiIbβ3 protein inactivation limits thrombus growth. J Biol Chem. 288 (42), 30672-30681 (2013).
- van Kruchten, R., et al. Both TMEM16F-dependent and TMEM16F-independent pathways contribute to phosphatidylserine exposure in platelet apoptosis and platelet activation. Blood. 121 (10), 1850-1857 (2013).
- Goelz, N., et al. Platelets express adaptor proteins of the extrinsic apoptosis pathway and can activate caspase-8. PLOS ONE. 16 (1), e0244848(2021).
- Shlomovitz, I., Speir, M., Gerlic, M. Flipping the dogma - phosphatidylserine in non-apoptotic cell death. Cell Commun Signal. 17 (1), 139(2019).
- Nadine, J. A. M., et al. Coated platelets function in platelet-dependent fibrin formation via integrin αIIbβ3 and transglutaminase factor XIII. Haematologica. 101 (4), 427-436 (2016).
- Michelson, A. D. Platelet activation by thrombin can be directly measured in whole blood through the use of the peptide GPRP and flow cytometry: Methods and clinical applications. Blood Coagul Fibrinolysis. 5 (1), 121-131 (1994).
- Taylor, M. R., Couto, J. R., Scallan, C. D., Ceriani, R. L., Peterson, J. A. Lactadherin (formerly BA46), a membrane-associated glycoprotein expressed in human milk and breast carcinomas, promotes Arg-Gly-Asp (RGD)-dependent cell adhesion. DNA Cell Biol. 16 (7), 861-869 (1997).
- Andersen, M. H., Graversen, H., Fedosov, S. N., Petersen, T. E., Rasmussen, J. T. Functional analyses of two cellular binding domains of bovine lactadherin. Biochemistry. 39 (20), 6200-6206 (2000).
- Tan, C. W., Bourcy, M., Pasalic, L., Chen, V. M. Flow cytometry assessment of procoagulant platelets using a dithiol-reactive probe functional disulfide bonds: Methods and protocols. Methods Mol Biol. 1967, 305-321 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved