Method Article
Umfassende Analyse von prokoagulanzien Thrombozyten, die Merkmale von Nekrose, Apoptose und Thrombozytenaktivierung aufweisen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll bietet eine umfassende Reihe von Verfahren, die zur Analyse von gerinnungsfördernden Thrombozyten erforderlich sind, die überlappende Merkmale von Nekrose, Apoptose und Thrombozytenaktivierung aufweisen.
Zusammenfassung
Blutplättchen, die im Blutkreislauf zirkulieren, sind relativ ruhig, werden aber "aktiviert", wenn sie an der Stelle der Blutgefäßverletzung auf Stimulanzien oder "Agonisten" treffen. Proaggregatorische und prokoagulante Blutplättchen repräsentieren zwei unterschiedliche Populationen aktivierter Blutplättchen. Während proaggregierte Blutplättchen die Beendigung der Blutung oder "Hämostase" erleichtern, indem sie einen Pfropfen aus Blutplättchen bilden, die durch Fibrinogenbrücken miteinander verklumpt sind, beschleunigen prokoagulanziöse Blutplättchen die Gerinnungskaskade dramatisch und gipfeln in der Bildung von Fibringerinnseln. Ein interessanter Aspekt der gerinnungsfördernden Blutplättchen ist, dass ihre Morphologie bestimmte Merkmale von "Nekrose" und "Apoptose" aufweist. Sie könnten daher eine Form des Zelltods bei Blutplättchen darstellen, wenn auch mit einer wichtigen Rolle bei Thrombose und Blutstillung. In diesem Artikel werden das Konzept der gerinnungsfördernden Blutplättchen, ihre Bedeutung für Gesundheit und Krankheit und ein Vergleich bestehender Methoden zu ihrer Analyse vorgestellt. Es bietet dann umfassende Protokolle für die Analyse von prokoagulanzien Blutplättchen, die Untersuchung der Mechanismen ihrer Bildung und die Bewertung ihrer prothrombotischen Rolle bei der Erleichterung der Gerinnung. Der Artikel schließt mit einer Erläuterung der wichtigsten Schritte, Einschränkungen und Problembehandlungsprinzipien für die beschriebenen Methoden.
Einleitung
Es gibt mindestens zwei unterschiedliche Populationen aktivierter Blutplättchen 1,2. Pro-aggregatorische Thrombozyten zeichnen sich durch eine hohe Integrinaktivierung und eine geringe PS-Exposition aus, wenn überhaupt. Auf der anderen Seite zeichnen sich Prokoagulanzienplättchen durch eine geringe Integrinaktivität und eine hohe PS-Exposition 1,2 aus, die eine Oberfläche für die Assemblierung der Tenase- und Prothrombinase-Komplexe3 bieten, die 10,5-10,6-fach und 300000-fach aktiver ist als die einzelnen löslichen Phasenfaktoren IXa bzw.Xa 4. Prokoagulanzien Blutplättchen beschleunigen so die Gerinnung dramatisch. Ein interessanter Aspekt der gerinnungsfördernden Blutplättchen ist, dass ihre Morphologie bestimmten Merkmalen der "Nekrose" wie Mikrovesikulation, Ballonbildung der Zelle mit Störung des Zytoskeletts und Verlust der Membranintegrität ähnelt, sowie denen der "Apoptose" wie dem Verlust der Membranphospholipid-Asymmetrie mit Exposition von Phosphatidylserin in der äußeren Packungsbeilage 5,6. Mit anderen Worten, die Bildung von prokoagulanzien Blutplättchen kann eine Form des Zelltods bei Blutplättchen darstellen, wenn auch mit einer wichtigen physiologischen Funktion bei der Blutstillung.
Prokoagulanzien-Blutplättchen sind signifikant mit thrombotischen Erkrankungen verbunden. Während die meisten gesunden Menschen keine zirkulierenden Prokoagulanzien-Blutplättchen haben, nehmen ~30% der normalen Spenderplättchen ex vivo einen prokoagulanziellen Phänotyp an, nachdem sie starken Agonisten wie Thrombin und Kollagen ausgesetzt waren7. Zirkulierende prokoagulierende Blutplättchen wurden bei Traumata berichtet, bei denen ihre Bildung eine Aktivierung durch Histon H4widerspiegeln kann 8,9. Bei den meisten prothrombotischen Erkrankungen werden erhöhte Spiegel an gerinnungsfördernden Blutplättchen jedoch erst nach ex vivo-Stimulation nachgewiesen10. Zum Beispiel hatten Patienten mit akutem Schlaganfall, bei denen >51,1 % ihrer Blutplättchen durch Kollagen und Thrombin in prokoagulanziöse Blutplättchen (auch bekannt als COATed-Thrombozyten) umgewandelt wurden, eine Hazard Ratio von 10,72 für einen rezidivierenden Schlaganfall innerhalb von 30 Tagen im Vergleich zu Patienten mit geringerer prokoagulanzienartiger Thrombozytenbildung11. Ähnliche Ergebnisse wurden bei Patienten mit transitorischen ischämischen Attacken und Karotis-Atherosklerose berichtet12. Im Gegensatz dazu resultiert die Blutgerinnungsstörung Scott-Syndrom aus einer Mutation von ANO6, die für das Phospholipid-Scramblase TMEM-16F kodiert, was zu einer mangelhaften PS-Exposition der Blutplättchenführt 13. Idiopathische Blutungsstörungen und intrakranielle Blutungen können mit einer verminderten Fähigkeit zur Bildung von prokoagulanzien Blutplättchen verbunden sein14.
Daher ist die Beurteilung der gerinnungsfördernden Blutplättchen Teil jeder Analyse der Thrombozytenfunktion, nicht nur bei grundlegenden Untersuchungen der Mechanismen der Thrombozytenaktivierung und der daraus resultierenden Thrombose und Blutstillung, sondern auch bei der klinischen Analyse des Thrombose- oder Blutungsrisikos bei Patienten während verschiedener pathologischer Zustände. Ein Gremium der International Society on Thrombosis and Haemostasis (ISTH) empfahl die Verwendung der Annexin-V-Bindung und der P-Selektin-Expression durch Durchflusszytometrie zur Unterscheidung von Prokoagulanzien von anderen Thrombozyten-Subpopulationen15. Der Artikel diskutiert auch die verschiedenen Methoden, mit denen prokoagulante und apoptotische Blutplättchen analysiert werden können, beschreibt aber die Prozesse nicht im Detail. Zu diesen Methoden gehören der Nachweis von (1) der Thrombozytenaktivierung durch PAC1/JonA oder der Fibrinogenbindung (Durchflusszytometrie); (2) Alpha-Granula-Sekretion durch P-Selektin-Expression (Durchflusszytometrie); (3) PS-Exposition durch Annexin V/Lactadherin-Bindung (Durchflusszytometrie); (4) Verlust der Membranintegrität durch GSAO-Markierung (Durchflusszytometrie); (5) morphologische Veränderungen wie Ballonbildung (Mikroskopie); (6) Nachweis der Caspase-Aktivierung durch Caspase-Assay (Immunblotting/Luminometrie/Durchflusszytometrie) oder Abbau des Zytoskelettsubstrats Gelsolin (Immunblotting); (7) Verlust des mitochondrialen Membranpotentialpotentials durch mitochondriale potentialempfindliche Farbstoffe wie JC-1/Mitotracker (Durchflusszytometrie); (8) mitochondriale intrinsische apoptotische Marker Bax, Bak und Cytochrom c-Freisetzung (Immunblotting); (9) Prokoagulanzienfunktion durch Thrombingenerationsassay und Gerinnungsfaktor-Xa/Va-Bindung (Durchflusszytometrie, Mikroskopie); (10) Zytosolischer und mitochondrialer Calciumanstieg durch fluoreszierende Calcium-empfindliche Farbstoffe (Durchflusszytometrie, Fluorometrie, Mikroskopie).
Die vorliegende Studie befasst sich mit umfassenden Protokollen für die Analyse von prokoagulanzien Thrombozyten sowie deren Unterscheidung von proaggregatorischen und apoptotischen Thrombozyten. Die meisten beschriebenen Verfahren beruhen auf einer Durchflusszytometrie, die die Vorteile hat, dass sie (1) leicht verfügbar und einfach anzuwenden ist, (2) ein geringes Probenvolumen erfordert und (3) den gleichzeitigen Nachweis mehrerer Subpopulationen von Blutplättchen (proaggregatorisch, prokoagulant und apoptotisch) ermöglicht)15. Diese auf Durchflusszytometrie basierenden Protokolle werden durch funktionelle Assays der Prokoagulanzienaktivität auf der Grundlage der Gerinnungsfaktorbindung und gerinnselbasierter Thrombingenerierungsassays ergänzt.
Protokoll
Menschliche Teilnehmer wurden für die Studie für die Entnahme von peripherem venösem Blut rekrutiert, nachdem sie eine schriftliche Einverständniserklärung erhalten hatten, die streng den Empfehlungen und der Genehmigung des Institutional Review Board des Cleveland Clinic Lerner Research Institute folgte, wobei alle Studienmethoden den in der Deklaration von Helsinki festgelegten Standards entsprachen. Gesunde erwachsene Teilnehmer über 18 Jahre wurden eingeschlossen, während Personen unter 18 Jahren, Personen mit einer kürzlichen Vorgeschichte von thrombotischen Ereignissen in den letzten sechs Monaten, Personen mit einer Vorgeschichte von Alkoholismus oder Drogenmissbrauch und Teilnehmer, die in den letzten vier Wochen Thrombozytenaggregationshemmer oder Antikoagulanzien eingenommen hatten, ausgeschlossen wurden. Eine detaillierte Beschreibung der in den Protokollen verwendeten Materialien und Reagenzien finden Sie in der Materialtabelle.
1. Vorbereitung der Blutplättchen
- Entnahme von peripheren venösen Blutproben in ACD-Antikoagulans (1:9 v/v) von menschlichen Teilnehmern nach Einholung einer schriftlichen Einverständniserklärung unter strikter Befolgung der vom Institutional Review Board genehmigten Empfehlungen.
- Das in ACD gesammelte Blut wird bei 100 x g für 20 min bei 22 °C zentrifugiert, um plättchenreiches Plasma (PRP) als Überstand zu erhalten.
- Das PRP wird bei 800 x g für 7 min bei 22 °C zentrifugiert, nachdem 3 μM PGE1 und 2 mM EDTA hinzugefügt wurden.
- Der Überstand wird verworfen und das Thrombozytenpellet in Puffer A (siehe Materialtabelle) durch vorsichtiges Pipettieren wieder suspendiert.
- Die in Puffer A resuspendierten Blutplättchen werden 7 min lang bei 22 °C bei 800 x g zentrifugiert.
- Resuspendieren Sie das Plättchenpellet in Puffer B (siehe Materialtabelle) durch vorsichtiges Pipettieren.
- Passen Sie die endgültige Thrombozytenzahl mit einem automatisierten Zellzähler auf 1 × 107/ml an.
HINWEIS: Führen Sie alle Schritte unter sterilen Bedingungen durch und treffen Sie Vorsichtsmaßnahmen, um die Blutplättchen in einem Ruhezustand zu halten, indem Sie während des Pipettierens keine übermäßige Scherung aussetzen.
2. Analyse von gerinnungsfördernden Blutplättchen mittels Durchflusszytometrie
- Ergänzen Sie gewaschene menschliche Blutplättchen mit 2,5 mM Calcium (0,5 μl Stamm CaCl2 0,5 M Lösung in 100 μl Thrombozytensuspension).
- Halten Sie eine Fraktion der Blutplättchen unstimuliert und stimulieren Sie die restlichen Fraktionen mit Thrombin (0,1 U/ml, 0,25 U/ml, 0,5 U/ml), Convulxin (20 ng/ml, 50 ng/ml, 100 ng/ml) oder einer Kombination davon für 15 Minuten bei Raumtemperatur.
- Nach der Stimulation fügen Sie je 1 μl PE-Annexin V, FITC-PAC1 und APC-Anti-human-CD62P-Antikörper zu 100 μl stimulierten Thrombozytensuspensionen hinzu.
- Inkubieren Sie die Blutplättchen im Dunkeln bei Raumtemperatur für 30 min.
- Fixieren Sie die Blutplättchen, indem Sie ein gleiches Volumen (1:1) von 2% Formalin hinzufügen.
- Analyse der Proben mittels Durchflusszytometrie zur Quantifizierung der gerinnungsfördernden Blutplättchen15,16.
- Zeichnen Sie ein amorphes Gate, um die Blutplättchen zu umfassen und sie von Rauschen und Multiplättchenpartikeln zu trennen.
- Erfassen Sie alle Fluoreszenzdaten mittels logarithmischer Vier-Quadranten-Amplifikation für 10.000 Ereignisse im Thrombozyten-Gate aus jeder Probe.
- Definieren Sie Regionen für Blutplättchen basierend auf der Fluoreszenzpositivität oder -negativität für die Exposition gegenüber Phosphatidylserin (PS) (Annexin V-Bindung), die Expression von P-Selektin (CD62P) und die Aktivierung von Integrin αIIbβ3 (PAC1-Bindung).
- Thrombozyten sind sowohl für die PS-Exposition (Annexin-V-Bindung) als auch für die P-Selektin-Expression (CD62P) positiv, aber negativ für die Aktivierung von Integrin αIIbβ3 (PAC1-Bindung) als prokoagulansierende Blutplättchen zu betrachten (Abbildung 1) (Tabelle 1).
- In ähnlicher Weise sollten Thrombozyten sowohl für die Aktivierung von Integrin αIIbβ3 (PAC1-Bindung) als auch für die Expression von P-Selektin (CD62P) positiv betrachtet werden, aber negativ für die PS-Exposition (Annexin V-Bindung) als proaggregierte Thrombozyten.
HINWEIS: Thrombozyten, die sowohl für die Aktivierung des Integrins αIIbβ3 (PAC1-Bindung) als auch für die P-Selektin-Expression (CD62P) negativ sind, aber positiv für die PS-Exposition (Annexin-V-Bindung), sind wahrscheinlich apoptotische Thrombozyten15,16.
3. Analyse des mitochondrialen Calciums mittels Durchflusszytometrie
- Verdünnen Sie die gewaschenen humanen Blutplättchen auf 1 × 106/ml und ergänzen Sie sie mit 2,5 mM Calcium (0,5 μl CaCl2 0,5 M Stammlösung in 100 μl Thrombozytensuspension).
- Markieren Sie die Blutplättchen mit 5 μM Rhod-2 AM (für mitochondriales Calcium) für 30 min im Dunkeln.
- Die Blutplättchen entsprechend ansetzen, wie in Schritt 2 beschrieben.
- Analysieren Sie Ereignisse im Thrombozytengatter auf zeitabhängige Änderungen der mittleren Fluoreszenz erfasster Ereignisse über 5 Minuten unter Verwendung eines Dichtestreudiagramms der PE-Fluoreszenz (für Rhod-2 AM) über die Zeit.
- Notieren Sie den Kalziumspiegel zu Studienbeginn für die ersten 1 Minuten.
- Fügen Sie Thrombin (0,1 U/ml, 0,25 U/ml oder 0,5 U/ml), Convulxin (20 ng/ml, 50 ng/ml oder 100 ng/ml) oder eine Kombination davon hinzu und setzen Sie die Datenerfassung für weitere 4 Minuten fort17.
4. Analyse des mitochondrialen Membranpotentials mittels Durchflusszytometrie
- Ergänzen Sie gewaschene menschliche Blutplättchen mit 2,5 mM Calcium (0,5 μl Stamm CaCl2 0,5 M Lösung in 100 μl Thrombozytensuspension).
- Halten Sie eine Fraktion der Blutplättchen unstimuliert und stimulieren Sie die restlichen Fraktionen mit Thrombin (0,1 U/ml, 0,25 U/ml oder 0,5 U/ml), Convulxin (20 ng/ml, 50 ng/ml oder 100 ng/ml) oder einer Kombination davon für 15 Minuten bei Raumtemperatur.
- Nach der Stimulation ist der Mitochondrienmarkierungsfarbstoff (siehe Materialtabelle) in einer Endkonzentration von 500 nM zu den stimulierten Thrombozytensuspensionen hinzuzufügen.
- Inkubieren Sie die Blutplättchen 30 Minuten lang im Dunkeln.
- Fixieren Sie die Blutplättchen, indem Sie ein gleiches Volumen von 2 % Formalin hinzufügen.
- Analyse von Proben mittels Durchflusszytometrie17.
- Die Blutplättchen wie in Schritt 2 beschrieben ansetzen.
- Analysieren Sie Ereignisse im Thrombozyten-Gate auf einen Abfall der Fluoreszenz im PE-Kanal (für den Mitochondrien-Markierungsfarbstoff) des Durchflusszytometers.
5. Analyse der Caspase 3- und Caspase 8-Aktivität mittels Durchflusszytometrie
- Ergänzen Sie gewaschene menschliche Blutplättchen mit 2,5 mM Calcium (0,5 μl Stamm CaCl2 0,5 M Lösung in 100 μl Thrombozytensuspension).
- Halten Sie eine Fraktion der Blutplättchen unstimuliert und stimulieren Sie die restlichen Fraktionen mit Thrombin (0,1 U/ml, 0,25 U/ml oder 0,5 U/ml), Convulxin (20 ng/ml, 50 ng/ml oder 100 ng/ml) oder einer Kombination davon für 15 Minuten bei Raumtemperatur.
- Nach der Stimulation fügen Sie entweder 1:1000 (v/v) Apoptose-Detektionsreagenz (siehe Materialtabelle) (sowohl für intrinsische als auch extrinsische Apoptosewege) oder 1:300 (v/v) FITC-IETD-FMK (für Caspase 8 des extrinsischen Apoptosewegs) zu den stimulierten Thrombozytensuspensionen hinzu.
- Inkubieren Sie die Blutplättchen 30 Minuten lang im Dunkeln.
- Fixieren Sie die Blutplättchen, indem Sie ein gleiches Volumen von 2 % Formalin hinzufügen.
- Analyse von Proben mittels Durchflusszytometrie17.
- Die Blutplättchen entsprechend ansetzen, wie in Schritt 2 beschrieben.
- Analysieren Sie Ereignisse im Thrombozyten-Gate auf Fluoreszenz im FITC-Kanal (entweder für Caspase 3/7 oder Caspase 8) des Durchflusszytometers.
6. Analyse der Prothrombinbindung mittels Durchflusszytometrie
- Konjugieren Sie Rinderprothrombin mit dem Farbstoff Alexa Fluor 488 unter Verwendung eines Proteinmarkierungskits (siehe Materialtabelle) gemäß den Anweisungen des Herstellers.
- Ergänzen Sie gewaschene menschliche Blutplättchen mit 2,5 mM Calcium (0,5 μl Stammlösung CaCl2 0,5 M in 100 μl Thrombozytensuspension).
- Halten Sie eine Fraktion der Blutplättchen unstimuliert und stimulieren Sie die restlichen Fraktionen mit Thrombin (0,1 U/ml, 0,25 U/ml oder 0,5 U/ml), Convulxin (20 ng/ml, 50 ng/ml oder 100 ng/ml) oder einer Kombination davon für 15 Minuten bei Raumtemperatur.
- Nach der Stimulation werden AF488-konjugiertes Rinderprothrombin (100 μg/ml) und je 1 μl PE-Annexin V und APC Anti-Human-CD62P-Antikörper zu 100 μl stimulierten Thrombozytensuspensionen hinzugefügt.
- Fixieren Sie die Blutplättchen, indem Sie ein gleiches Volumen von 2 % Formalin hinzufügen.
- Analyse von Proben mittels Durchflusszytometrie17 zur Quantifizierung der Prothrombinbindung an Blutplättchen.
- Zeichnen Sie ein amorphes Gate, um Thrombozyten zu umfassen, die von Rauschen und Multiplättchenpartikeln getrennt sind.
- Erfassen Sie alle Fluoreszenzdaten mittels logarithmischer Vier-Quadranten-Amplifikation für 10.000 Ereignisse im Thrombozyten-Gate aus jeder Probe.
- Zeichnen Sie Regionen für Thrombozyten mit positiver oder negativer Fluoreszenz für PS-Exposition (Annexin V-Bindung), P-Selektin-Expression (CD62P) und AF488-Prothrombin (Prothrombinbindung).
- Bestimmen Sie den Anteil aller Thrombozytenereignisse sowie den Anteil der Thrombozyten, die sowohl für die PS-Exposition (Annexin-V-Bindung) als auch für die P-Selektin-Expression (CD62P) (Prokoagulanzienthrombozyten) positiv sind und für die Prothrombinbindung positiv sind.
7. Analyse der Prothrombinbindung mittels konfokaler Mikroskopie
- Konjugieren Sie Rinderprothrombin mit dem Farbstoff Alexa Fluor 488 unter Verwendung eines Proteinmarkierungskits (siehe Materialtabelle) gemäß den Anweisungen des Herstellers.
- Ergänzen Sie gewaschene menschliche Blutplättchen mit 2,5 mM Calcium (0,5 μl Stammlösung CaCl2 0,5 M in 100 μl Thrombozytensuspension).
- Halten Sie eine Fraktion der Blutplättchen unstimuliert und stimulieren Sie die restlichen Fraktionen mit Thrombin (0,1 U/ml, 0,25 U/ml oder 0,5 U/ml), Convulxin (20 ng/ml, 50 ng/ml oder 100 ng/ml) oder einer Kombination davon für 15 Minuten bei Raumtemperatur.
- Nach der Stimulation werden AF488-konjugiertes Rinderprothrombin (100 μg/ml) und je 1 μl PE-Annexin V und APC Anti-Human-CD62P-Antikörper zu 100 μl stimulierten Thrombozytensuspensionen hinzugefügt.
- Fixieren Sie die Blutplättchen, indem Sie ein gleiches Volumen von 2 % Formalin hinzufügen.
- Pelletieren Sie die fixierten Plättchen auf Poly-D-Lysin-beschichtete Deckgläser.
- Montieren Sie Deckgläser mit einer Anti-Fade-Lösung auf Objektträger.
- Alternativ Deckgläser 1 h lang in einer Feuchtkammer mit Kollagen (100 μg/ml) beschichten.
- Blockieren Sie die gestrichenen Deckgläser mit 0,5 % BSA in PBS für 1 h.
- Markieren Sie die Blutplättchen mit AF488-konjugiertem Rinderprothrombin (100 μg/ml) und je 1 μl PE-Annexin V und APC Anti-Human-CD62P-Antikörper.
- Lassen Sie die markierten Blutplättchen 20 Minuten lang auf kollagenbeschichteten Deckgläsern haften.
- Waschen Sie Deckgläser mit anhaftenden Blutplättchen dreimal mit PBS.
- Deckgläser mit 2 % Paraformaldehyd für 1 h fixieren.
- Montieren Sie Deckgläser mit einer Anti-Fade-Lösung auf Objektträger.
- Betrachten Sie die Objektträger unter einem konfokalen Mikroskop bei 63× Objektivvergrößerung.
- Analysieren Sie die Bilder mit der Fidschi-Software zur Fluoreszenzquantifizierung.
8. Gerinnselbasierter Thrombozytenphospholipid-abhängiger Assay zur Thrombinerzeugung
- Ergänzen Sie gewaschene menschliche Blutplättchen mit 2,5 mM Calcium (0,5 μl Stamm CaCl2 0,5 M Lösung in 100 μl Thrombozytensuspension).
- Halten Sie eine Fraktion der Blutplättchen unstimuliert und stimulieren Sie die restlichen Fraktionen mit Thrombin (0,1 U/ml, 0,25 U/ml oder 0,5 U/ml), Convulxin (20 ng/ml, 50 ng/ml oder 100 ng/ml) oder einer Kombination davon für 15 Minuten bei Raumtemperatur.
- 100 μl behandelte Blutplättchen werden zu einer Mischung aus 50 μl gepooltem normalem Plasma und 50 μl Kaolinlösung mit geringer Trübung (20 mg/ml) gegeben, die 5 Minuten lang bei 37 °C vorinkubiert wurde.
- 5 mM CaCl2 zu der Mischung geben.
- Überwachen Sie die Gerinnselbildung durch Trübung auf einem Mikroplatten-Reader und messen Sie die Absorption bei 660 nm alle 60 s für 1 h.
Ergebnisse
Ein Teil der aktivierten Blutplättchen wird zu einem "Prokoagulationsmittel" mit einer charakteristischen Erhöhung der Oberflächenexpression von Phosphatidylserin (PS) und P-Selektin, was sie von "apoptotischen" Blutplättchen unterscheidet, die nur für die PS-Exposition positiv sind, sowie von "proaggregatorischen" Blutplättchen, die positiv für die P-Selektin-Expression sind. Wir fanden heraus, dass Thrombin einen dosisabhängigen Anstieg des Anteils der Prokoagulanzienthrombozyten induziert, die sowohl für die P-Selektin- als auch für die PS-Expression positiv sind, was durch Bindung von FITC-anti-CD62P-Antikörpern bzw. PE-Annexin V nachgewiesen wird (Abbildung 2). Die Bildung von prokoagulanziösen Blutplättchen ist abhängig vom mitochondrialen Calciumeinstrom18,19 entlang des elektrochemischen Gradienten durch die innere Mitochondrienmembran bei Agonisten-induzierten zytosolischen Calciumerhöhungen sowie der daraus resultierenden Bildung einer Cyclophilin D (CypD)-abhängigen mitochondrialen Permeabilitätsübergangspore (mPTP)20. In der Konsistenz war eine Thrombin-induzierte Erhöhung der Prokoagulanzienaktivität mit einem Anstieg des mitochondrialen Kalziums (Abbildung 3) und einem Abfall des mitochondrialen Membranpotentials (Abbildung 4) verbunden, gemessen mit Rhod-2- bzw. Mitotracker Red-Farbstoffen. Stimulierte Blutplättchen weisen Merkmale der Apoptose auf, einschließlich der Bax/Bak-Akkumulation21,22; Ob dies Caspase23,24 aktiviert und zur PS-Exposition25 beiträgt, bleibt umstritten. Die Thrombinstimulation von Blutplättchen war mit der Aktivierung von Caspase 8 assoziiert, nicht jedoch mit den terminalen Caspasen 3 und 7 (Abbildung 5), wie mit dem FITC-IETD-FMK bzw. dem Apoptose-Detektionsreagenz analysiert.

Abbildung 1: Analyse von gerinnungsfördernden Blutplättchen. Schematische Darstellung der Analyse von Blutplättchen des Gerinnungsmittels mittels Durchflusszytometrie unter Verwendung von FITC-PAC1, APC-Anti-CD62P-Antikörpern und PE-Annexin V als Fluoreszenzsonden zum Nachweis der Integrinaktivierung, der P-Selektin-Expression bzw. der PS-Exposition. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
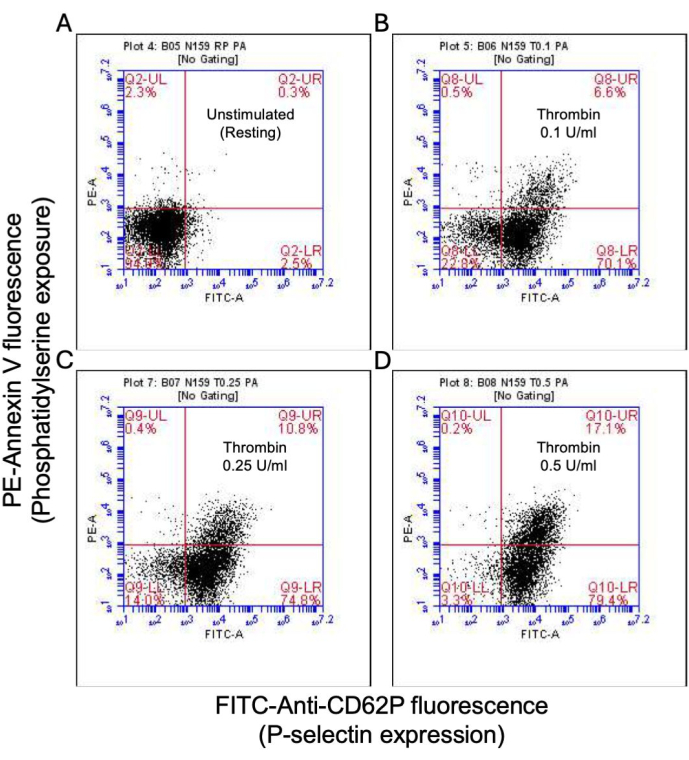
Abbildung 2: P-Selektin-Expression und Phosphatidylserin-Exposition in Blutplättchen nach Thrombinstimulation. Repräsentative Punktdiagramme, die Thrombozyten zeigen, die positiv auf die P-Selektin-Expression und/oder PS-Exposition in (A) nicht stimulierten Thrombozyten und nach Exposition gegenüber Thrombin in Dosen von (B) 0,1 U/ml, (C) 0,25 U/ml und (D) 0,5 U/ml sind, nachgewiesen durch FITC-anti-CD62P und PE-Annexin V-Fluoreszenz mittels Durchflusszytometrie. Die Abbildungen in Klammern geben den Anteil der Gesamtplättchen in jedem Quadranten des Diagramms an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
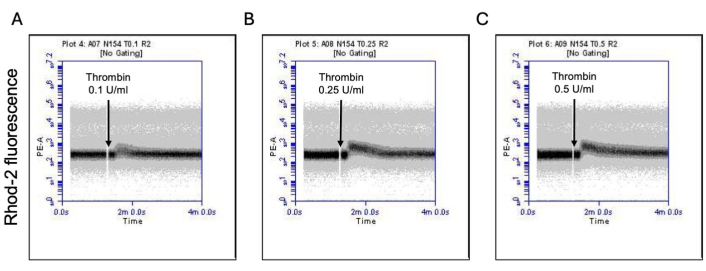
Abbildung 3: Zeitabhängige Veränderungen des mitochondrialen Kalziumspiegels in Blutplättchen nach Thrombinexposition. Repräsentative Dichtediagramme, die zeitabhängige Änderungen der Fluoreszenz aufgrund des Rhod-2-Farbstoffs zeigen, die die mitochondrialen Kalziumspiegel in Blutplättchen bei Exposition gegenüber Thrombin bei Dosen von (A) 0,1 U/ml, (B) 0,25 U/ml und (C) 0,5 U/ml, wie durch Durchflusszytometrie nachgewiesen, anzeigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
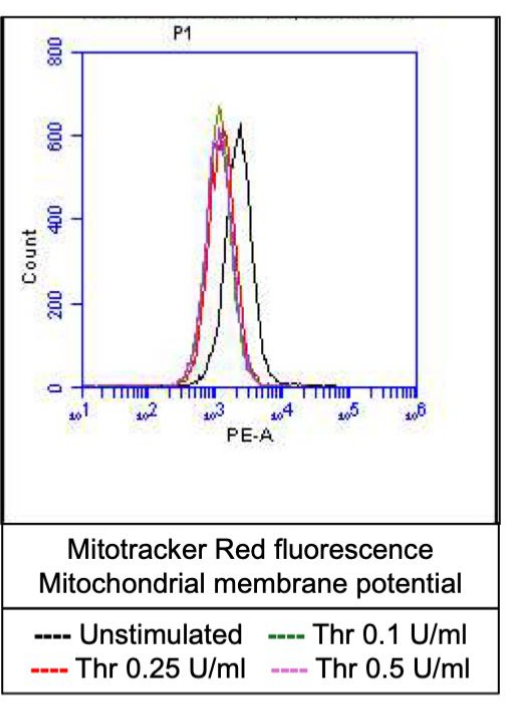
Abbildung 4: Mitochondriales Membranpotential in Blutplättchen nach Thrombinstimulation. Diese Abbildung zeigt repräsentative Histogramm-Overlays, die die Fluoreszenz aufgrund des Mitochondrienmarkierungsfarbstoffs darstellen und das mitochondriale Membranpotenzial in Blutplättchen bei Exposition gegenüber verschiedenen Dosen von Thrombin anzeigen, wie es durch Durchflusszytometrie nachgewiesen wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
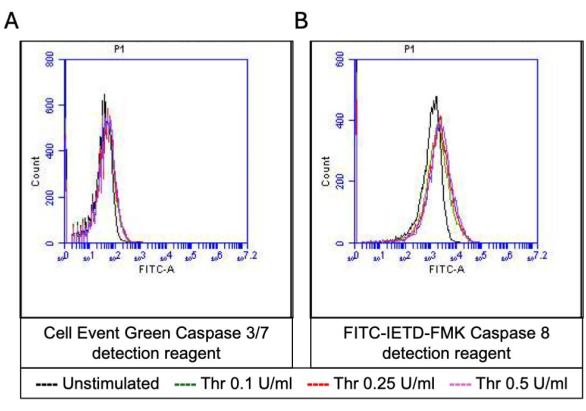
Abbildung 5: Caspase 3/7 und Caspase 8 Aktivitäten in Blutplättchen nach Thrombinstimulation. Repräsentative Histogramm-Overlays, die die Fluoreszenz aufgrund des (A) Apoptose-Detektionsreagenzes bzw. (B) FITC-IETD-FMK zeigen und die Caspase 3/7- und Caspase 8-Aktivitäten in Blutplättchen bei Exposition gegenüber unterschiedlichen Dosen von Thrombin anzeigen, wie durch Durchflusszytometrie nachgewiesen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Markierung | Prokoagulanzien Blutplättchen | Proaggregatorische Blutplättchen | Apoptotische Blutplättchen |
| Integrin-Aktivierung (PAC1-Bindung) | Nein | Ja | Nein |
| Sekretion von Granulat | Ja | Ja | Nein |
| (P-Selektion-Ausdruck) | |||
| PS-Belichtung | Ja | Nein | Ja |
| (Bindung an Anhang V) |
Tabelle 1: Durchflusszytometrische Marker zur Identifizierung von Thrombozytenpopulationen nach Stimulation. Diese Tabelle zeigt durchflusszytometrische Marker, die zum Nachweis unterschiedlicher Thrombozytenpopulationen verwendet werden, die nach Stimulation von Blutplättchen mit starken Agonisten wie Thrombin und Convulxin entstehen.
Diskussion
Prokoagulanzienthrombozyten zeigen nach Stimulation einen deutlichen und anhaltenden Anstieg des intrazellulären Kalziums26, können aber durch unterschiedliche Mechanismen abgeleitet werden. Sie werden nach starker agonistischer Stimulation mit Kollagen und Thrombin durch unterschiedliche Mediatoren erzeugt, einschließlich des mitochondrialen Calciumeinstroms18,19 entlang des elektrochemischen Gradienten über die innere mitochondriale Membran bei agonisteninduzierten zytosolischen Calciumerhöhungen. Sobald das mitochondriale Calcium einen bestimmten Schwellenwert erreicht, aktiviert es die Bildung von mitochondrialen Permeabilitätsübergangsporen (mPTP) in einer Cyclophilin D (CypD)-abhängigen Weise20. Wenn Mitochondrien zu Calcium permeabilisiert werden und nicht mehr als Senken für das zytosolische Calcium dienen können, wird nach mPTP-Bildung eine supramaximale Calcium-Signalgebung beobachtet26. Die anhaltend hohen Spiegel an zytosolischem Calcium aktivieren wiederum die Calcium-abhängige Phospholipid-Scramblase TMEM16F Aktivierung, was zu einer PS-Exposition führt27,28. Die PS-Exposition geht einher mit der Inaktivierung von Integrin αIIbβ3 durch einen dualen Mechanismus, der eine Calpain-abhängige Spaltung des Integrin-β 3-Zytoplasma-Schwanzes sowie das TMEM16F-abhängige Phospholipid-Scrambling selbst umfasst 29,30. Somit haben prokoagulansierende Blutplättchen im Gegensatz zu proaggregatorischen Blutplättchen ein inaktives Integrin. Darüber hinaus bietet die PS-Exposition eine Oberfläche für die Bindung von Gerinnungsfaktoren, die den Aufbau von Tenase- und Prothrombinase-Komplexen erleichtert3. Prokoagulanzien Blutplättchen beschleunigen somit die Gerinnung dramatisch4.
Die PS-Exposition und die daraus resultierende prokoagulanziöse Aktivität können auch durch Caspase-abhängige Spaltung von Scramblase XKR8 in Thrombozyten induziert werden, die sich einer intrinsischen Apoptose unterziehen, unabhängig von der Aktivierung25,31. Obwohl stimulierte Blutplättchen Merkmale der intrinsischen Apoptose aufweisen, einschließlich der Bax/Bak-Akkumulation21,22, bleibt umstritten, ob dies die Caspase23,24 aktiviert und zur PS-Expositionbeiträgt 25. Eine extrinsische Apoptose durch TNFα oder FasL wurde bei Thrombozyten nicht berichtet, obwohl die meisten Komponenten vorhanden waren und einige Hinweise auf eine Caspase-8-Aktivierung vorhanden waren32. Blutplättchen durchlaufen nach längerer Stimulation eine MLKL-vermittelte Nekroptose17, von der bekannt ist, dass sie unabhängig von CypD oder Caspase33 eine PS-Exposition induziert.
Diese Studie lieferte eine Methode zum Nachweis von gerinnungsfördernden Blutplättchen unter Verwendung der PS-Exposition (Annexin-V-Bindung), der P-Selektin-Expression (CD62P) und der Aktivierung von Integrin αIIbβ3 (PAC1-Bindung) als Marker. Diese Marker können helfen, prokoagulanziöse Thrombozyten effektiv von apoptotischen und proaggregatorischen Thrombozytenzu unterscheiden 15. Die Bindung von Annexin V erfordert jedoch das Vorhandensein eines hohen Kalziumgehalts im Medium. Daher müssen Heparin oder andere Thrombinhemmer verwendet werden, wenn plättchenreiche Plasma- oder Vollblutproben verwendet werden. Ferner wird der Fibrinpolymerisationshemmer GPRP eingesetzt, wenn Thrombin als einer der Agonisten mit diesen Proben verwendet werdenmuss 34,35. Lactadherin oder GSAO können als alternative Marker zu Annexin V verwendet werden, aber sie haben ihre eigenen Einschränkungen. Während Lactadherin nicht spezifisch für PS ist und Integrine bindet 36,37, ist GSAO nicht kommerziell erhältlich und kann nur durch Forschungskooperation bezogen werden38.
In diesem Artikel wurden auch ergänzende Methoden zur Untersuchung der Mechanismen der PS-Exposition vorgestellt, einschließlich des mitochondrialen Kalziumeinstroms und der mitochondrialen Permeabilitätsübergangsporenbildung (Verlust des mitochondrialen Membranpotentials). Hierbei ist zu beachten, dass diese Methoden durch zytosolische Calciummessungen mit Fluo-4- und Fluo-5N-Farbstoffen ergänzt werden können. Da unklar bleibt, ob die Caspase-Aktivierung zur PS-Exposition in stimulierten Thrombozyten beiträgt, zählen wir auch Protokolle für Caspase 8- und Caspase 3/7-Aktivierungsassays auf. Die wahre "gerinnungsfördernde" Natur von Blutplättchen kann nur durch ihre Fähigkeit bestätigt werden, Gerinnungsfaktoren zu binden und die Thrombinbildung zu fördern. Daher wäre eine gründliche Untersuchung der Blutplättchen auf die PS-Exposition (Annexin-V-Bindung), die P-Selektin-Expression (CD62P) und die Aktivierung von Integrin αIIbβ3 (PAC1-Bindung), den mitochondrialen Kalziumeinstrom, das mitochondriale Membranpotential, die Caspase-Aktivität zusammen mit der Bindung des Gerinnungsfaktors (Prothrombin) und die Thrombozytenphospholipid-abhängige Thrombinerzeugung/-gerinnung, wie im vorliegenden Artikel beschrieben, notwendig und ausreichend für eine umfassende Analyse der Prokoagulanzienthrombozyten.
Offenlegungen
Die Autoren haben keine konkurrierenden Interessen offenzulegen.
Danksagungen
Paresh P. Kulkarni und Keith R. McCrae würdigen die von VeloSano, Cleveland Clinic Foundation, gestifteten Fellow- und Pilotenstipendien.
Materialien
| Name | Company | Catalog Number | Comments |
| Acid Citrate Dextrose (ACD) solution (For 1000 mL) | Tri- Sodium Citrate- 22 g Citric Acid- 8 g Dextrose- 24.5 g Water- Make up volume to 1000 mL | ||
| Alexa Fluor 488 protein labelling kit | Invitrogen | A10235 | |
| APC Mouse Anti-Human CD62P | BD Pharmingen | 550888 | |
| Bovine Prothrombin | Prolytix | BCP-1010 | |
| Buffer A (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 6.2 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution EGTA 1 mM Add 10 μL (1:100 v/v) 100 mM EGTA Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose PGE1 3 μM Add 3 μL (1:333 v/v) 1 mM PGE1 solution | ||
| Buffer B (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 7.4 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose | ||
| CaCl2 (0.5 M) (For 50ml) | Molecular weight of CaCl2.2H2O = 147.02 Dissolve 3.675 g of CaCl2.2H2O in 50 ml Milli Q water | ||
| CellEvent Caspase-3/7 Detection Reagents Green | Invitrogen | C10423 | Apoptosis detection reagent |
| Convulxin | Enzo Life Sciences | ALX-350-100 | |
| EDTA (0.5 M; pH 8) (For 100 mL) | Molecular Weight of EDTA Na2.2H2 O: 372.24g Weigh 18.612 g and suspend in 50 ml Milli Q water and check the pH (pH~4) Slowly add 10N NaOH with stirring and monitor the pH. EDTA starts solubilizing at around pH 7 and is completely soluble at pH 8. Make up the volume to 100 ml with Milli Q water. | ||
| EGTA (100 mM; pH 7.4) (For 100 mL) | Molecular Weight: 380.4 Add 3.804 g EGTA in 50 ml Milli Q water and check the pH (pH~3) Add 10 N NaOH dropwise while stirring and monitor the pH EGTA becomes soluble at pH 7.0 (approx) Adjust pH to 7.4 Make up the volume to 100 ml with Milli Q water | ||
| FITC Mouse Anti-Human PAC-1 | BD | 340507 | |
| FITC-IETD-FMK Caspase 8 (active) staining kit | Abcam | ab65614 | |
| Mitotracker Red CMXRos (mitochindria labeling dye) | Invitrogen | M7512 | Stock= 1 mM (50 µg dissolved in 90 µl DMSO) Sub-stock= 100 µM (10 µl Stock + 90 µl DMSO) Working concentration= 500nM (0.5 µl in 100 µl) |
| PE Annexin V | BD Pharmingen | 560930 | |
| Prostaglandin E1 | Sigma | P5515 | Stock= 20 mM (1 mg dissolved in 141 µL DMSO) Sub-stock= 1 mM (10 µl Stock + 190 µL DMSO) Working concentration= 3 µM (3 µL in 1 mL) |
| Rhod-2 AM | Invitrogen | R1244 | Stock= 5 mM (1 mg dissolved in 178 µL DMSO) Sub-stock= 100 µM (10 µL Stock + 90 µL DMSO) Working concentration= 500 nM (0.5 µL in 100 µL) |
| Thrombin from human plasma | Sigma | T7572 |
Referenzen
- Munnix, I., Cosemans, J., Auger, J., Heemskerk, J. Platelet response heterogeneity in thrombus formation. Thromb Haemost. 102 (12), 1149-1156 (2009).
- Heemskerk, J. W. M., Mattheij, N. J. A., Cosemans, J. M. E. M. Platelet-based coagulation: Different populations, different functions. J Thromb Haemost. 11 (1), 2-16 (2013).
- Podoplelova, N. A., et al. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood. 128 (13), 1745-1755 (2016).
- Mann, K. G., Butenas, S., Brummel, K. The dynamics of thrombin formation. Arterioscler Thromb Vasc Biol. 23 (1), 17-25 (2003).
- Jackson, S. P., Schoenwaelder, S. M. Procoagulant platelets: Are they necrotic. Blood. 116 (12), 2011-2018 (2010).
- Hua Vivien Mun Yee, V. M. C. Procoagulant platelets and the pathways leading to cell death. Semin Thromb Hemost. 41 (04), 405-412 (2015).
- Dale, G. L. Coated-platelets: An emerging component of the procoagulant response. J Thromb Haemost. 3 (10), 2185-2192 (2005).
- Vulliamy, P., Armstrong, P. C. Platelets in hemostasis, thrombosis, and inflammation after major trauma. Arterioscler Thromb Vasc Biol. 44 (3), 545-557 (2024).
- Vulliamy, P., et al. Histone H4 induces platelet ballooning and microparticle release during trauma hemorrhage. Proc Natl Acad Sci U S A. 116 (35), 17444-17449 (2019).
- Aliotta, A., Bertaggia Calderara, D., Zermatten, M. G., Marchetti, M., Alberio, L. Thrombocytopathies: Not just aggregation defects-the clinical relevance of procoagulant platelets. J Clin Med. 10 (5), 894(2021).
- Kirkpatrick, A. C., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets predict stroke at 30 days following TIA. Neurology. 89 (2), 125-128 (2017).
- Kirkpatrick, A. C., Tafur, A. J., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets improve prediction of stroke and transient ischemic attack in asymptomatic internal carotid artery stenosis. Stroke. 45 (10), 2995-3001 (2014).
- Suzuki, J., Umeda, M., Sims, P. J., Nagata, S. Calcium-dependent phospholipid scrambling by TMEM16F. Nature. 468 (7325), 834-838 (2010).
- Prodan, C. I., Vincent, A. S., Dale, G. L. Coated platelet levels correlate with bleed volume in patients with spontaneous intracerebral hemorrhage. Stroke. 41 (6), 1301-1303 (2010).
- Josefsson, E. C., et al. Consensus report on markers to distinguish procoagulant platelets from apoptotic platelets: Communication from the Scientific and Standardization Committee of the ISTH. J Thromb Haemost. 21 (8), 2291-2299 (2023).
- Kulkarni, P. P., Sonkar, V. K., Gautam, D., Dash, D. AMPK inhibition protects against arterial thrombosis while sparing hemostasis through differential modulation of platelet responses. Thromb Res. 196, 175-185 (2020).
- Ekhlak, M., et al. Necroptosis executioner MLKL plays pivotal roles in agonist-induced platelet prothrombotic responses and lytic cell death in a temporal order. Cell Death Differ. 30 (8), 1886-1899 (2023).
- Kholmukhamedov, A., Janecke, R., Choo, H. -J., Jobe, S. M. The mitochondrial calcium uniporter regulates procoagulant platelet formation. J Thromb Haemost. 16 (11), 2315-2321 (2018).
- Choo, H. -J., Saafir, T. B., Mkumba, L., Wagner, M. B., Jobe, S. M. Mitochondrial calcium and reactive oxygen species regulate agonist-initiated platelet phosphatidylserine exposure. Arterioscler Thromb Vasc Biol. 32 (12), 2946-2955 (2012).
- Jobe, S. M., et al. Critical role for the mitochondrial permeability transition pore and cyclophilin D in platelet activation and thrombosis. Blood. 111 (3), 1257-1265 (2008).
- Leytin, V., Allen, D. J., Mykhaylov, S., Lyubimov, E., Freedman, J. Thrombin-triggered platelet apoptosis. J Thromb Haemost. 4 (12), 2656-2663 (2006).
- Lopez, J. J., Salido, G. M., Pariente, J. A., Rosado, J. A. Thrombin induces activation and translocation of Bid, Bax and Bak to the mitochondria in human platelets. J Thromb Haemost. 6 (10), 1780-1788 (2008).
- Wolf, B. B., et al. Calpain functions in a caspase-independent manner to promote apoptosis-like events during platelet activation. Blood. 94 (5), 1683-1692 (1999).
- Kim, O. V., et al. Fatal dysfunction and disintegration of thrombin-stimulated platelets. Haematologica. 104 (9), 1866-1878 (2019).
- Schoenwaelder, S. M., et al. Two distinct pathways regulate platelet phosphatidylserine exposure and procoagulant function. Blood. 114 (3), 663-666 (2009).
- Abbasian, N., Millington-Burgess, S. L., Chabra, S., Malcor, J. -D., Harper, M. T. Supramaximal calcium signaling triggers procoagulant platelet formation. Blood Adv. 4 (1), 154-164 (2020).
- Le, T., et al. An inner activation gate controls TMEM16F phospholipid scrambling. Nat Commun. 10 (1), 1846(2019).
- Yang, H., et al. TMEM16F forms a Ca2+-activated cation channel required for lipid scrambling in platelets during blood coagulation. Cell. 151 (1), 111-122 (2012).
- Mattheij, N. J. A., et al. Dual mechanism of integrin closure in procoagulant platelets. J Biol Chem. 288 (19), 13325-13336 (2013).
- Liu, F., et al. Mitochondrially mediated integrin αiIbβ3 protein inactivation limits thrombus growth. J Biol Chem. 288 (42), 30672-30681 (2013).
- van Kruchten, R., et al. Both TMEM16F-dependent and TMEM16F-independent pathways contribute to phosphatidylserine exposure in platelet apoptosis and platelet activation. Blood. 121 (10), 1850-1857 (2013).
- Goelz, N., et al. Platelets express adaptor proteins of the extrinsic apoptosis pathway and can activate caspase-8. PLOS ONE. 16 (1), e0244848(2021).
- Shlomovitz, I., Speir, M., Gerlic, M. Flipping the dogma - phosphatidylserine in non-apoptotic cell death. Cell Commun Signal. 17 (1), 139(2019).
- Nadine, J. A. M., et al. Coated platelets function in platelet-dependent fibrin formation via integrin αIIbβ3 and transglutaminase factor XIII. Haematologica. 101 (4), 427-436 (2016).
- Michelson, A. D. Platelet activation by thrombin can be directly measured in whole blood through the use of the peptide GPRP and flow cytometry: Methods and clinical applications. Blood Coagul Fibrinolysis. 5 (1), 121-131 (1994).
- Taylor, M. R., Couto, J. R., Scallan, C. D., Ceriani, R. L., Peterson, J. A. Lactadherin (formerly BA46), a membrane-associated glycoprotein expressed in human milk and breast carcinomas, promotes Arg-Gly-Asp (RGD)-dependent cell adhesion. DNA Cell Biol. 16 (7), 861-869 (1997).
- Andersen, M. H., Graversen, H., Fedosov, S. N., Petersen, T. E., Rasmussen, J. T. Functional analyses of two cellular binding domains of bovine lactadherin. Biochemistry. 39 (20), 6200-6206 (2000).
- Tan, C. W., Bourcy, M., Pasalic, L., Chen, V. M. Flow cytometry assessment of procoagulant platelets using a dithiol-reactive probe functional disulfide bonds: Methods and protocols. Methods Mol Biol. 1967, 305-321 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten