Method Article
Dolaşım Ölümü Sonrası Bağışı Takiben Ortotopik Kalp Naklinin Yüksek Sadakatli Domuz Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Buradaki protokol, allogreftin ex vivo perfüzyonu kullanılarak dolaşım ölümünden sonra bağışı takiben yüksek kaliteli bir domuz nakli modelini açıklamaktadır.
Özet
Kalp nakli yapılabilecek ileri kalp yetmezliği hastalarının sayısı, uygun organ bağışçısı eksikliği nedeniyle sınırlıdır. Donör havuzunu genişletme çabalarında, dolaşım ölümü sonrası bağış sonrası kalp nakli (DCD HT) dahil olmak üzere alternatif bağış ve tedarik yöntemleri geliştirilmiştir. DCD HT'yi takiben kısa süreli sağkalım, beyin ölümü gerçekleşen donörlerle kalp naklinden daha düşük olmasa da, DCD HT allogreftleri ile ilişkili primer greft disfonksiyonu (PGD) oranı artabilir. PGT'nin altta yatan etiyolojisi multifaktöriyel ve tam olarak anlaşılamamıştır. DCD HT allogreftleri için, DCD alımı sırasında sıcak iskemik yaralanma dönemi, beyin ölümü allogreftlerinin maruz kalmadığı PGD için potansiyel bir risk faktörüdür. Bu nedenle fonksiyonel sıcak iskemik zaman, DCD HT'de PGD'nin önemli bir itici gücü olabilir. Bununla birlikte, bu klinik senaryoda PGT'nin altında yatan mekanizmalar moleküler düzeyde tam olarak anlaşılamamıştır. Burada sunulan çalışma, DCD ortotopik kalp transplantasyonunun yüksek sadakatli, hayatta kalmayan bir domuz modelinin geliştirilmesini ve doğrulanmasını tanımlamayı amaçlamaktadır. Bu translasyonel büyük hayvan modelinin kullanımının, PGD'ye katkıda bulunan moleküler mekanizmaları aydınlatmanın yanı sıra allogreft korumasını ve erken performansı optimize etmek için tasarlanmış müdahaleleri araştırmak için kritik olduğunu varsayıyoruz. Bu model, domuz anatomisi ve fizyolojisini hesaba katmak için modifikasyonlarla DCD HT'de kullanılan perioperatif ve cerrahi yaklaşımı klinik olarak tekrarlar. Bu büyük hayvan cerrahi modelinin geliştirilmesi, yalnızca PGD'nin gelişimine ilişkin mekanik bilgiler sağlamakla kalmayacak, aynı zamanda DCD HT'yi takiben organ iyileşmesini iyileştirmeyi amaçlayan translasyonel araştırma çabalarını geliştirmek için de değiştirilebilir.
Giriş
Tıbbi tedaviye dirençli son dönem kalp yetmezliği olan hastalar için kalp nakli, en iyi uzun süreli sağkalım ve yaşam kalitesi ile ilişkili tedavi olmaya devam etmektedir. Tarihsel olarak, kalp nakli, beyin ölümü gerçekleşmiş bir donörden (DBD HT) temin edilen ve hipotermik statik depolama ile korunurken taşınan bir kalp allogreftinin kullanılmasını gerektiriyordu. Bununla birlikte, kalp nakli gerektiren hasta sayısı mevcut donör sayısını aşıyor. Dünya genelinde yılda 5.000'den fazla kalp nakli yapılırken, 50.000 adayın kalp nakli beklediği tahmin edilmektedir1. Ek olarak, belirlenen donörlerden alınan organların kullanımı %30 gibi düşük bir oranda kalmaktadır2. Donör organ kullanımını iyileştirmek için son yıllarda, dolaşım ölümü sonrası bağış sonrası kalp nakli (DCD HT) dahil olmak üzere alternatif bağış ve tedarik yöntemleri geliştirilmiştir3,4,5,6.
DCD HT donörleri resmi beyin ölümü kriterlerini karşılamamaktadır, ancak devam eden tıbbi bakımın boşuna olduğu düşünülen iyileşemeyen bir nörolojik yaralanmaya sahiptir. Bir DCD HT alımı sırasında, yaşamı sürdüren önlemler geri çekilir ve hasta apneye ilerleme ve dolaşım durması açısından izlenir. Bu durumlarda ölüm, nakil veya organ temin sürecine katılmayan bir hekim tarafından ilan edilir. Ölüm ilan edildikten sonra, potansiyel donörün herhangi bir iyileşme veya yaşam belirtisi olmadığından emin olmak için gözlemlendiği ek bir bekleme süresi (genellikle 5 dakika) vardır ve ardından organ alımına devam etmeden önce ölüm beyanı yeniden teyit edilir 7,8. Bu nedenle DCD allogreftleri, DBD donör allogreftlerinin maruz kalmadığı değişken bir sıcak iskemi periyoduna (en az 10 dakika) maruz bırakılır. Bu sıcak iskemi dönemi daha önce DCD donörleri ile kalp nakli kullanımını caydırıyordu. Bununla birlikte, son beş yıl içinde, DCD ile ilişkili sıcak iskemik zamanı takiben allogreft geri kazanımı için iki tedarik reperfüzyon yöntemi geliştirilmiştir. İlk olarak, doğrudan tedarik ve perfüzyon (DPP), dolaşım ölümünün doğrulanması üzerine donör kardiyomektomiyi, ardından allogreft resüsitasyonunu ve ex vivo perfüzyon ile korumayı içerir. Alternatif olarak, normotermik bölgesel perfüzyon (NRP), kardiyoloji 9,10,11,12'den önce donör kalbi yerinde reperfüze etmek ve yeniden canlandırmak için serebral dolaşımın dışlanmasıyla ekstrakorporeal dolaşımı kullanır.
Şimdiye kadar, DCD HT ile ilişkili kısa süreli sağkalım, DBD HT ile gözlenene benzer olmuştur. Bununla birlikte, erken çalışmalar, DBD HT3'e kıyasla DCD HT ile ciddi primer greft disfonksiyonu (PGD) riskinin daha yüksek olduğunu da göstermektedir. PGT, kalp transplantasyonunu takiben erken allogreft fonksiyonunun alıcının dolaşım ihtiyaçlarını karşılamak için yetersiz kaldığı klinik durumu tanımlamak için kullanılan bir terimdir. Uluslararası Kalp ve Akciğer Nakli Derneği tarafından PGD'nin şiddetini derecelendirmek için bir sistem tanımlanmıştır. Şiddetli PGD'de, nakil sonrası dönemde yeterli dolaşımı desteklemek için mekanik dolaşım desteği gereklidir13. Bu durum, kalp nakli sonrası erken postoperatif mortalitenin ana itici gücüdür. Hem DBD HT hem de DCD HT için PGT'nin etiyolojisi tam olarak anlaşılamamıştır, ancak donör, koruma ve alıcı değişkenlerinin tümünün katkıda bulunduğu çok faktörlüdür. DCD allogreftleri için, DCD alımı sırasındaki sıcak iskemik yaralanmanın yanı sıra hemodinamik instabilite, metabolik bozukluklar ve katekolaminler, sitokinler, laktat ve potasyumdaki dalgalanmalar dahil olmak üzere zararlı donöre özgü yanıtlar, DBD allogreftlerine kıyasla PGD riskinin artmasına katkıda bulunabilecek önerilen faktörlerdir. 14,15,16. Bununla birlikte, bu klinik senaryoda PGT'nin altında yatan mekanizmalar moleküler düzeyde tam olarak anlaşılamamıştır. Ek olarak, belki de bu endişeler nedeniyle, DCD kalplerinin DBD organlarından 3.37 kat daha fazla azalma olasılığı vardır17. Sonuç olarak, organ koruma sürecini optimize ederek organ kullanımını artırmak ve nakil sonuçlarını iyileştirmek için hala karşılanmamış bir ihtiyaç vardır.
Bu çalışmada, mevcut klinik DPP DCD HT'yi yüksek doğrulukla yansıtan DPP kullanan bir domuz DCD HT'yi tanımladık. Bu model, DCD nakil süreci boyunca unsurları içerir: 1) DCD tedariki, 2) bir Organ Bakım Sistemi (OCS) ile ex vivo perfüzyon koruması ve 3) alıcı implantasyonu. Bu kapsamlı model, DCD HT'de PGD'nin altında yatan mekanizmaları daha iyi karakterize etmek için bir fırsat sağlar. Bu daha sonra allogreft korumasını ve performansını iyileştirmeyi amaçlayan hedefli ve rasyonel terapötik stratejilerin geliştirilmesine izin verir. Ayrıca, bu model, kalp nakli alanını güvenli ve hızlı bir şekilde ilerletmeye yardımcı olmak için önemli olacak bu tür yeni terapötiklerin klinik öncesi değerlendirmesi için bir platform sağlar.
Protokol
Tüm yetiştirme ve prosedürler, Duke Üniversitesi Tıp Merkezi'nin Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından yönetmeliklerine ve yönergelerine uygun olarak onaylanmıştır.
1. Ameliyat öncesi donör hazırlığı
- 70-80 kg ağırlığında iki kan grubu uyumlu Yorkshire domuzu seçin (kan gruplaması Granite Falls, NC, ABD'deki Looper Farms tarafından gerçekleştirilir). Ameliyattan önce her iki domuzu da en az 6-8 saat oruç tutun.
- Kalp perfüzyon modülünü üreticinin yönergelerine ve gerekli bakım noktası testlerine (Malzeme Tablosu) göre hazırlayın.
- Kalp perfüzyon modülü için bakım solüsyonunu hazırlayın. Bu çözelti, hedef kan basıncının korunmasına yardımcı olmak için metabolik olarak aktif kalp için besinlerin yanı sıra adenosin içerir.
- Aşağıdakileri ekleyin: 500 mL berrak hazırlama çözeltisi, 100 mL% 25 albümin, 100 mg siprofloksasin (200 mg / 100 mL), iki adet 5 mL flakon multivitamin enjeksiyonu, 20mEq sodyum bikarbonat, 1 g sefazolin sodyum ve 250 mg metilprednizolon. Hazırlama solüsyonunu dökün ve içeriği kalp perfüzyon modülüne ekleyin.
- Hazırlandıktan sonra, torbaya 50 IU insan rekombinant insülini enjekte edin.
- Su içinde 500 mL'lik bir %5 dekstroz torbasına 0.25 mg epinefrin ve 30 IU insan rekombinant insülini enjekte ederek bir epinefrin çözeltisi hazırlayın. Bu çözelti, inotropik bir etkiye sahip olmaktan ziyade katekolaminlerin yerini almak içindir. Çözeltiyi 10 mL / s'de demleyin.
- T4 çözeltisini, 100 mL% 0.9 normal tuzlu su torbasına 200 μg sulandırılmış levotiroksin enjekte ederek hazırlayın. 3 mL / s hızında demleyin.
- Kalp perfüzyon modülü için bakım solüsyonunu hazırlayın. Bu çözelti, hedef kan basıncının korunmasına yardımcı olmak için metabolik olarak aktif kalp için besinlerin yanı sıra adenosin içerir.
- Belirlenen donör domuzu 4.4 mg / kg telazol ve 1.0 mg / kg propofol ile sakinleştirin, ardından yüz maskesi ile verilen% 2 -% 5 inhale izofluran izleyin.
- Domuz sırtüstü pozisyondayken, ameliyat sırasında hava yolunun korunması için 8-10 mm'lik bir endotrakeal tüp ile entübe edin. Endotrakeal tüpü burnuna yerine sabitleyin. Ameliyat sırasında oküler kayganlığı korumak için gözlere veteriner merhemi sürün.
- IV sıvıları uygulamak için kulak damarına intravenöz (IV) bir kateter yerleştirin (bakım sıvıları: Emzirilmiş Ringer çözeltisi 10 mL / kg / saat).
- Analjezi (25-100 μg / s) için sürekli fentanil infüzyonuna başlayın ve felci sürdürmek için 0.2 mg / kg vekuronyum uygulayın.
- Elektriksel aktivitenin ve oksijenasyonun sürekli izlenmesi için elektrokardiyogram uçlarını ve nabız oksimetresini yerleştirin.
- 10 mL / kg / dk tidal hacimde, dakikada 10-15 nefes hızında ve prosedürün geri kalanında izofluran (% 1 -% 5) ile mekanik ventilasyona başlayın. Anestezikleri ve vazoaktif ilaçları, refleksler olmayacak, kalp atış hızı 61-99 bpm ve sistolik kan basıncı 90-130 mmHg kalacak şekilde titre edin.
- Domu, üst ekstremiteler sefalad olarak konumlandırılmış ve ameliyat alanının dışında sabitlenmiş olarak ameliyat masasına yerleştirin. Alt ekstremiteleri ameliyat alanının dışında sabitleyin.
- Ameliyat alanına dahil edilecek alanı gıdı üstünde, ön aksiller çizgi iki taraflı olarak ve kifoid sürecin iki parmak genişliği altında daha aşağıda tanımlayın. Standart uygulamaları izleyerek cerrahi bölgeyi aseptik olarak hazırlayın ve örtün.
- Sağ taraflı bir karotis kesimi yapın.
- # 10 bıçak kullanarak, sternokleidomastoid kasın medial sınırı boyunca, trakeanın yanalında iki parmak genişliğinde eğik bir sağ lateral boyun insizyonu yapın.
- Bu kesiyi elektrokoter ile platizmadan aşağı doğru taşıyın ve hemostaz sağlayın. Platizmadan geçtikten sonra, maruz kalmaya yardımcı olması için kendi kendini tutan bir ekartör kullanın.
- Karotis arteri ve iç juguler veni dikkatlice inceleyin ve izole edin; Her teknenin etrafına bir gemi halkası yerleştirin.
- Damarları yıkamak için topikal olarak 10 mL% 2 lidokain uygulayın.
NOT: Lidokain, damar genişletici etkileri için kullanılır, çünkü domuz damarları manipülasyonla kolayca spazm yapar ve kanüllenmesi zor hale gelebilir. - Seldinger tekniğini kullanarak, karotis arteri 5 Fr'lik bir mikropunktur ile doğrudan kanüle edin, ardından 6 Fr'lik bir introdüser kılıfı uygulayın.
- İşlem sırasında sistemik arter basıncının sürekli izlenmesi için giriş kılıfını bir arteriyel hatta ve dönüştürücüye bağlayın.
- Preoperatif laboratuvar kan çalışması için karotis arter arteriyel hattından kan alın (tam kan sayımı, kapsamlı metabolik panel, troponin, laktat ve periferik kan mononükleer hücre izolasyonu için tam kan).
- 1.11.5'teki ile aynı tekniği kullanarak iç juguler veni kanül edin. 6 Fr kılıfı yerinde bırakın, çünkü bu, aşağı akış fonksiyonel değerlendirmeleri için bir basınç-hacim döngü kateteri eklemek için kullanılacaktır.
2. Dolaşım ölümü ve donör kardiyoloji sonrası bağış
- Sternotomi yapın.
- # 10 bıçak kullanarak, sternal çentikten ksifoid sürecine kadar uzunlamasına bir kesi yapın. Elektrokoter kullanarak, diseksiyonu deri altı dokusu ve pektoralis kas fasyasından aşağı doğru taşıyın.
- Sternumun orta hattını elektrokoter ile puanlayın. Manubriumdaki ve ksifoid sürecin etrafındaki ligamentöz ekleri inceleyin.
- Sternumun ön tablasını orta hat boyunca dikkatlice bölmek için salınımlı bir sternal testere kullanın. Sternumun arka masasını manubrium seviyesinde tamamen bölmek için salınımlı testereyi kullanın. Bu adımda innominate venin yaralanmasını önlemeye dikkat edin. Bir çift ağır makas kullanarak manubriumun altındaki arka masanın sternal bölümünü tamamlayın.
NOT: Sternumun alt tarafı ile perikard arasındaki düzlemin manuel olarak künt diseksiyonu, bu adım sırasında kalbin yaralanmasını önlemeye yardımcı olabilir. - Sternal kenarların hemostazı elde etmek için elektrokoter kullanın. Bir sternal ekartör yerleştirin.
- Perikardın maruz kalmasını optimize etmek için timik ve perikardiyal yağ yastıkçığı dokusunu elektrokoter ile çıkarın.
- Perikard'ı elektrokoter ile dikkatlice açın. Kesiyonu kalbin tepesinden aort seviyesine kadar uzunlamasına taşıyın.
- 2-0 ipek kalın dikişlerle perikardiyal bir kuyu oluşturun.
- Başlangıç donör allogreft analizlerini gerçekleştirin.
- Donör kalbi açıkta iken ve herhangi bir doğrudan kardiyak manipülasyondan önce, temel analizler yapın. Bunlar arasında direkt epikardiyal ekokardiyografi, basınç-hacim döngü değerlendirmesi ve miyokardiyal çekirdek iğne biyopsileri yer alır.
- Doğrudan epikardiyal yüzeyden standart uzun ve kısa eksenli görünümler elde etmek için steril bir şekilde ekokardiyografi yapın.
- Basınç-hacim döngü kayıtlarını yapmak için, sırasıyla sol ve sağ ventriküllere karotis artere ve internal juguler ven'e sırayla katı hal basınç-hacim kateteri (5Fr, 122 cm) sokun.
- Kılıfa yerleştirilmeden önce dışarıdan (kanülasyon bölgesinden kalbin tepesine kadar) sokulacak kateterin uzunluğunu ölçün.
- Kateteri arteriyel kılıfın içine yerleştirin ve epikardiyal ultrason kullanarak sol ventriküle yönlendirin. Kateterin doğrudan bir ventriküler duvara temas etmediğinden emin olun, çünkü bu ölçüm doğruluğunu etkileyebilir.
- Daha sonra, kateteri venöz kılıfın içine sokun, doğrudan palpasyon veya epikardiyal ultrason rehberliği kullanarak sağ ventriküle yönlendirin.
- Daha sonraki analizler için doku toplamak için çekirdek iğne miyokard biyopsileri yapın. Bunu sol ventrikülün tepesinde gerçekleştirin. Biyopsi bölgesinden önemli bir kanama varsa, bir onarım dikişi yerleştirin.
- Donör kalbini hazırlayın.
- Çapraz kelepçe yerleşimi için yer açmak üzere aortopulmonary pencereyi inceleyin.
- Elektrokoter ile superior vena kava (SVC) ve inferior vena kava'yı (IVC) çevresel olarak diseke edin.
- Antikoagüle etmek için, aort kanülasyonundan önce intravenöz (IV) 300 ünite / kg heparin uygulayın.
- Aort kanülasyonu için aort köküne bir aort çanta ipi yerleştirmek için çift kollu 4-0 polipropilen sütür kullanın. 7 Fr (14G) aort kökü havalandırma kanülü ile kanül.
- Rumel turnike ile havayı boşaltın ve yerinde sabitleyin. Kardiyopleji tüpünü havasını almak için yıkayın ve hattı aort kökü kanülüne sabitleyin.
- Daha sonra, gelecekteki venöz kanülasyona hazırlanmak için, sağ atriyal apendikste bir çanta dikişi yerleştirin ve bir Rumel turnike ile sabitleyin.
- Kontrollü dolaşım ölümü gerçekleştirin.
- Analjezi için 250 μg fentanil IV bolus ve ardından 100 μg / s'de sürekli hız infüzyonu (CRI) sağlayın. Felç etmek için intravenöz olarak 0.2 mg / kg vekuronyum uygulayın.
- Kontrollü dolaşım ölüm sürecini başlatmak için mekanik ventilasyonu durdurun.
- Sistolik ve ortalama arteriyel kan basıncını, arteriyel hat pulsatilitesini, elektriksel kardiyak aktiviteyi ve oksijenasyon durumunu sürekli olarak izleyin.
NOT: Sistolik kan basıncı 50 mmHg'nin altına düştüğünde agonal faz başlar. Bu noktada, kalp şişebilir. Ölüm, mekanik asistol (nabızsız elektriksel aktivite) ile tanımlanır ve yaşam belirtisi yoktur. Bu çalışma, bu modelde elektriksel asistol ile ölümü tanımlamamaktadır, çünkü yavaş nabızsız elektriksel aktivite, insanlarda gözlemlenenden daha uzun bir süre boyunca domuzlarda devam eder ve bu da model için amaçlanandan daha fazla allogreft iskemik hakaret ile sonuçlanabilir. - Protokolün aşağıdaki adımlarına devam etmeden önce ölüm / asistol zamanından sonra 10 dakika bekleyin. Bu aralık, standoff periyodunu ve klinik DCD HT'de mediastinal giriş ve hazırlık için gereken süreyi simüle eder.
- Ex vivo perfüzyon cihazı astarlaması gerçekleştirin.
- # 11 bıçakla, sağ atriyal apendikste bir bıçak kesisi yapın ve üretici tarafından sağlanan 34Fr venöz kanül ile kanül yapın. Kanülü bir Rumel turnike ile sabitleyin ve kanülü ex vivo perfüzyon cihazının toplama torbasına bağlayın.
- Yaklaşık 1200-1500 mL donör kanını üretici tarafından sağlanan toplama torbasına toplayın. Kan kaybından önce, toplama torbasına 30.000 U heparin ve 2 mg tirofiban HCl eklenmiş olacaktır.
- Donör kanını filtreleyin ve kalp perfüzyon modülüne verin.
- Donör kardiyektomi yapın.
- Donör kanının alınmasını takiben aort çapraz klempini uygulayın.
- Domuz aort kökü ve çıkan aortun insanlardan çok daha kısa olduğunu unutmayın. Arkın klemplenmesini veya aortun eksik tıkanmasını önlemek için çapraz klempi mümkün olduğunca proksimal olarak uygulamaya özen gösterin.
- 60-100 mmHg'lik bir kök basıncını hedefleyerek aort köküne 1 L Del Nido kardiyopleji uygulayın.
- Kardiyopleji doğumu sırasında sağ ve sol ventrikülleri havalandırmak için perikardiyal yansımada inferior vena kava'yı ve sol atriyal apendiksüyü transekte edin.
- Donör kalbinin üzerine soğuk steril rüşvet yerleştirin.
- IVC, SVC, innominat arterin hemen distalindeki aortu ve bifurkasyonda pulmoner arteri (PA) bölün. Donör sol atriyumu (LA) kesin ve allogreft üzerinde yeterli bir doku manşeti bırakın.
- Kalbi tarladan çıkarın ve arka masa hazırlığı için steril, soğuk rüşvetle dolu bir leğene koyun.
- Aortun distal ucuna eşit uzaklıkta dört adet yatay yatak ipliği (4-0 polipropilen) yerleştirin.
- Donör kanının alınmasını takiben aort çapraz klempini uygulayın.
- Ex vivo perfüzyon
- Ex vivo perfüzyon aort adaptörünü distal aort içine yerleştirin ve taahhüt edilen dikişlerin hemen altına yerleştirilen 0-0 ipek sütür veya göbek bandı ile sıkıca sabitleyin.
- Ex vivo perfüzyon cihazındayken PA, SVC, IVC ve sol atriyumu açık bırakın.
NOT: Bu konfigürasyon ile sol ventrikül distansiyonu ile karşılaşılmadı. - Allogrefti ex vivo perfüzyon cihazına taşıyın ve aort adaptörünü bağlayın. Kalbin arka yüzeyinin öne baktığından emin olun. Kalbin ön yüzeyinin cihaz ve iki defibrilasyon pedi ile temas halinde olduğundan emin olun. Allogrefti 34 °C'de tutun. Herhangi bir ventriküler aritmiyi organize bir ritme geri döndürmek için gerektiği gibi defibrilasyon yapın.
- Bu noktada, kardiyopleji portu yoluyla ex-vivo perfüzyon devresine bir terapötik sokulabilir. Alternatif olarak, perfüzat veya fiziksel devre, bir DCD HT allogreftinin geri kazanımını arttırmayı amaçlayan deneysel koşulları değerlendirmek için değiştirilebilir. Örneğin, daha önce perfaşın, viral vektörler18,19,20 ile transdüksiyonu arttırmak için bir hücre koruyucu aracılığıyla önceden oluşturulmuş nötralize edici antikorlardan yıkanması gerektiğini göstermiştik.
- Gerektiğinde sodyum bikarbonat, kalsiyum glukonat ve dekstroz uygulamasına rehberlik etmek için bakım noktası laboratuvarlarını kullanın.
- Bu ex vivo perfüzyon aşamasında perfüzat örnekleri, kan tahlili ve çekirdek iğne biyopsisi örnekleri alın.
NOT: Bu modelde, allogreft, alıcıya implantasyondan yaklaşık 2-3 saat önce ex vivo perfüzyon cihazında kalır (Tablo 1). Allogreftin ex vivo perfüze edilme süresi, alıcı hayvanı implantasyona hazırlamak için geçen sürenin uzunluğuna göre belirlendi. Bununla birlikte, ex vivo perfüzyon süresi, çalışma hedeflerine göre ayarlanabilen bir değişkendir.
3. Alıcı kardiyoloji, implantasyon ve reperfüzyon
- Alıcı domuzu adım 1.3-1.11.8'de açıklandığı gibi hazırlayın.
- Ek olarak, ultrason rehberliğinde ve Seldinger tekniği kullanılarak sol dış veya iç juguler ven içine 7 Fr 20 cm üç lümenli merkezi hat kateteri yerleştirin. Ultrason rehberliğinde 5 Fr femoral arteriyel çizgi yerleştirin.
- Steril alanı örttükten sonra kardiyopulmoner baypas (CPB) devresini hazırlayın ve hatları sahaya getirin.
- Havayı boşaltmak için CPB arteriyel ve venöz hatları boyunca yeniden dolaşın. Çizgileri sıkıştırın ve bölün. Venöz hattı bicaval kanülasyon için hazırlayın.
- Bu çalışmanın yapıldığı kurumda klinik kalp naklinde olduğu gibi, rejeksiyon veya iskemiye bağlı herhangi bir enflamatuar yanıtı ele almak için preoperatif 1 g metilprednizolon dozu uygulayın.
- Daha önce adım 1.11 ve 2.1'de açıklandığı gibi sağ karotis kesimi ve orta hat sternotomisi gerçekleştirin.
- Alıcı kardiyektomi yapın.
- Aortopulmonary pencereyi daha önce olduğu gibi inceleyin. SVC ve IVC'yi inceleyin ve damarların etrafına çevresel göbek bandı yerleştirin.
- Kanülasyondan önce 400 ünite / kg heparin uygulayın. 480 s'> aktif pıhtılaşma süresi (ACT) hedefine titre edin.
- Distal çıkan aorta standart bir aort kanülasyonu çanta ipi dikişi yerleştirin (çift kollu rehinli 2-0 kaplamalı örgülü polyester sütür kullanarak). Rumel turnike ve kanama durdurucu ile sabitleyin.
- Sistolik kan basıncının 120 mmHg'den az olduğundan emin olun. Çanta ipi içinde tam kalınlıkta bir bıçak kesisi yapmak için bir # 11 bıçak kullanın. Bu kesiden aortu 15 Fr kanül ile kanül edin. Kanülü bir Rumel turnike ile yerine sabitleyin.
- Aort kanülünü kelepçeleyin. Arteriyel baypas hattını havalandırdıktan sonra, aort kanülünü CPB devresine bağlayın. Hatta hava kabarcığı olmadığından emin olun.
- Başka bir aort çanta ipi yapın ve aort kökü havalandırma kanülünü yerleştirin.
- Hem SVC hem de IVC'de 18-20 Fr dik açılı metal uçlu kanüller ile Rummel turnike ile sabitlenmiş bir bicaval tekniği kullanarak venöz kanülasyon gerçekleştirin. Ardından, bu kanülleri CPB devresinin venöz uzvuna bağlayın.
- CPB'yi 2,4 L/dk/m2'lik bir hedef akışa başlatın ve 32 °C'ye soğutun. Ortalama arteriyel basıncı 60 mmHg> korumak için anestezik ve vazopresörleri titre edin.
NOT: Bu prosedürler, CPB çalışması boyunca hemodinamik yönetimi izleyen ve koordine eden kurul onaylı kardiyotorasik anestezistler ve sertifikalı perfüzyonistler ile gerçekleştirilir. - Aort çapraz klemp proksimalini aort kanülüne uygulayın ve alıcının doğal kalbinin bir açıklaması ile devam edin. Bi-atriyal implantasyon tekniğini kolaylaştıracak kadar büyük sağ ve sol atriyal manşetleri sağlam bırakın.
NOT: Bu modelde bi-atriyal teknik kullanılmıştır, çünkü domuz damar sistemi çok hassastır, bu da IVC ve SVC vasküler anastomozlarını bicaval teknikte teknik olarak zorlaştırır. - Maksimum damar uzunluğunu korumak için aort ve PA'yı köke mümkün olduğunca yakın kesin. Yeni ekilen kalbi, laboratuvarda taşınmak ve işlenmek üzere buz gibi soğuk fosfat tamponlu tuzlu suya (PBS) yerleştirin.
- Alıcı allogreft biatriyal implantasyonu gerçekleştirin.
- Allogrefti ex vivo perfüzyon cihazında üretici talimatlarına göre soğutun. Cihazdan çıkarmadan önce bir kez daha kardiyoplejik arrest için 1 L soğuk Del Nido kardiyopleji uygulayın.
- Aort adaptörünü ayırın ve kalbi steril, soğuk bir rüşvet leğende arka masaya taşıyın.
- Kalbi herhangi bir patent primum fossa ovalis (PFO) veya kasıtsız yaralanma bölgesi açısından inceleyin.
NOT: Daha da önemlisi, domuzlarda, genellikle sağ atriyuma veya IVC'ye boşalmadan önce sol atriyal sınır boyunca boşalan sistemik bir damar vardır. Bu damar tedarik sürecinde açılabilir ve implantasyona devam etmeden önce bağlandığından emin olmak için özen gösterilmelidir. - Aortu adaptör sabitleme bölgesinin altındaki sağlıklı dokuya geri kesin.
- Metzenbaum makası kullanarak, sol atriyal açıklığı alıcı LA manşetinin boyutuna uyacak şekilde kesin. Aynısını sağ atriyuma da yapın.
- Sol atriyal anastomoza çift kollu 4-0 Prolene sütür ile koşu şeklinde başlayın. Sağ PA, aort ve sağ atriyal anastomoz ile devam edin, ayrıca hepsi sürekli 4-0 prolen sütür ile tamamlandı.
- Aort çapraz klempinin çıkarılmasından önce normotermiye (37 ° C) yeniden ısıtmaya başlayın.
- Allogreft reperfüzyonu yapın ve CPB'den ayırın.
- Tüm anastomozları tamamladıktan sonra, allogrefti yeniden perfüze etmek için aort çapraz klempini serbest bırakın.
- Tüm anastomozların hemostazını sağlayın.
- Doğal ritim ve kasılmanın geri dönüşünü bekleyin. Epikardiyal pacing tellerini yerleştirin ve allogreft kalp atış hızı 100 bpm ise 100 bpm'de < hızında.
- 60 dakikalık reperfüzyondan sonra, CPB'den ayırmaya çalışın. Alıcılar, ortalama arteriyel basıncı (MAP) >65 mmHg'yi korumak için gerektiğinde 0.05 μg / kg / dak epinefrin ve vazopresör infüzyonları ile desteklenir.
- Hem erken hem de geç reperfüzyon zaman noktalarında ekokardiyografi, kan tahlili, miyokard biyopsileri ve basınç-hacim döngüsü değerlendirmesi gibi analizler yapın.
4. Deneyin sona ermesi ve ötenazi
NOT: Bu çalışmada, nakil alıcısı hayvan, CPB'den ayrıldıktan sonra 1 saat boyunca desteklenmiştir.
- Deneyin tamamlanmasının ardından anestezi altında kan kaybı yoluyla ötenazi yapılır.
- Nakledilen allogrefti, tüm anastomozlar boyunca sütür hatlarını keserek çıkarın. Allogreft örneğine herhangi bir doğal alıcı doku dahil etmemeye dikkat edin.
- Allogrefti hemen buz gibi soğuk PBS'ye yerleştirin ve işlenmek ve saklanmak üzere laboratuvara taşıyın.
Sonuçlar
Burada açıklanan protokol kullanılarak bir pilot analiz için toplam 6 domuz DCD nakli gerçekleştirildi. Bu altı pilot deney boyunca, protokolün bileşenleri, modelin ihtiyaçlarına daha iyi uymak, tekrarlanabilirliği artırmak ve lojistik kısıtlamaları hesaba katmak için rafine edildi. Sonuçta ortaya çıkan protokol, burada yazıldığı gibi, Şekil 1'de özetlenmiştir.
İnsan kontrollü dolaşım ölüm sürecinden farklı olarak, iskemiye maruz kalan domuz kalpleri, kasılma durduktan sonra bile beklenenden çok daha uzun süre elektriksel aktiviteyi sürdürdü. İlk deneyde bu farkın tanınması üzerine, elektriksel asistolün ölüm ilanı için bir ölçü olarak güvenilmez olduğu kabul edildi. Allogreftte klinik bağlamda görülenle orantısız olarak sıcak-iskemik hasarı önlemek için, kalan nakil prosedürleri için ölüm zamanını belirlemek için mekanik asistol (darbesiz elektriksel aktivite) kullanıldı.
Ek olarak, donör kardiyektomiye devam etmeden önce bekleme süresi başlangıçta 15 dakika idi. Bu, pilot setin ilk üç deneyi için kullanıldı. Bu 15 dakikalık ılık iskemi döneminin mantığının bir kısmı, çalışma için uygun olacak bir dereceye kadar nakil sonrası greft disfonksiyonuna sahip olmak için yeterince ciddi yaralanmaya sahip olmayı hedeflememizdi. Bu erken deneylerde greft disfonksiyonunun o kadar şiddetli olduğunu bulduk ki, CPB'den ayrıldıktan sonra alıcı hayvanı bir saat boyunca sürdürmekte zorluk çektik, öyle ki alıcı hayvanın 1 saatlik zaman noktasını karşılamak için yüksek dozlarda inotropik ve baskıcı desteğine ihtiyacı vardı. Bu zorluklar göz önüne alındığında, sıcak iskemik hasar süresini 10 dakikaya indirdik, bu da ex vivo perfüzyon ile klinik DCD HT'ye daha yakındır. Şekil 2 , bu aşamada ve ayrıca ex vivo perfüzyon sırasında ve implantasyondan sonra allogreftin temsili görüntülerini göstermektedir. Son olarak, yeni nakledilen kalbi desteklemek için CPB sonrası sütten kesme fazında vazopresör ve inotrop infüzyonlarının titrasyonunda ayarlamalar yapıldı. KPB sonrası bu aşamada başarıyı artırmak için kardiyovasküler anesteziyoloji konusunda özel uzmanlığa sahip deneyimli bir ekibe duyulan ihtiyaç ne kadar vurgulansa azdır.
Ameliyat süreleri 6 deneyin 4'ünde izlendi ve Tablo 1'de özetlendi. Protokolün DCD tedarik aşamasında, donör domuzda yaşamı sürdüren önlemlerin kesilmesinden ölüm beyanına kadar geçen süre 14.25 (+/- 2.6) dk idi. Operatif kardiyopulmoner baypas süresi ve çapraz klemp süresi, pilot deneyler boyunca sırasıyla yaklaşık 3 saat ve 1.5 saat boyunca tutarlı kalmıştır. Deneyler, CPB'den ayrıldıktan yaklaşık 1 saat sonra ötenazi ile sonlandırıldı. Ötenazi sırasında hayvanların stabilite derecesinde değişkenlik vardı. Bazı hayvanlar nispeten iyi stabilite ve sadece hafif greft disfonksiyonu gösterirken, diğerleri önemli hemodinamik instabilite ve ciddi greft disfonksiyonu gösterdi. Temsili hala ekokardiyografi ekranları Şekil 3'te gösterilmiştir. Bu ve PV döngüleri gibi diğer fonksiyonel değerlendirmeler, allogreft fonksiyonundaki farklılıkları taban çizgisinden ve ayrıca terapötik müdahalelerin başlatılmasından önce ve sonra belirlemek için kullanılabilir.
Deney yoluyla toplanan, işlenen ve saklanan örneklerin bir özeti Şekil 4'te gösterilmektedir. Ekilen kalpler hemen buz gibi soğuk PBS'ye yerleştirildi ve doku ve moleküler analiz için laboratuvarda saklandı. Alıcının doğal kalbi kontrol olarak kullanılırken, nakledilen allogreft deney dokusu olarak saklandı. Kalpler tepeden tabana kadar 4 kesite ayrıldı. Bunların her birinden, her bir odanın (sol ventrikül, sağ ventrikül, septum ve her iki kulakçık) temsili doku örnekleri sıvı nitrojen içinde hızlı donduruldu ve gelecekteki analizler için -80 ° C'de saklandı. Benzer şekilde, bu seviyelerin ve odaların her birinden temsili doku örnekleri, RNAlater'da inkübe edildi ve flaş donduruldu. Kalan doku örneği histopatolojik analiz için formalin içinde korundu. Herhangi bir zaman noktasından alınan kan örnekleri iki kopya halinde elde edildi ve EDTA veya CPT tüplerinde saklandı. EDTA tüplerinde depolanan kan, plazmayı izole etmek için döndürüldü ve bu da flaşla donduruldu. CPT tüplerindeki kan, CPT tüpü satıcısı tarafından sağlanan değiştirilmiş bir protokol kullanılarak PBMC'ler için işlendi.
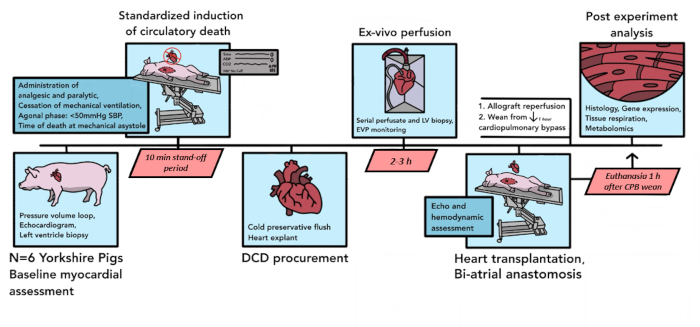
Şekil 1: Porcine DCD HT protokol şeması. Domuz DCD HT prosedüründe meydana gelen olayların zaman çizelgesi burada gösterilmektedir. Bu pilot çalışmada 6 adet DCD HT gerçekleştirilmiştir. Donör domuz kalbi allogrefti üzerinde temel miyokardiyal değerlendirmeler yapılır ve ardından kontrollü dolaşım ölümü başlar. Ölüm ilanından sonra 10 dakikalık bir soğukluk süresi vardır. Allogreft daha sonra ekilir ve ex vivo perfüzyon cihazına taşınır ve burada 2-3 saat boyunca yeniden perfüze edilir. Alıcı hayvanın hazırlanmasından sonra, donör allogreft biatriyal bir teknikle implante edilir. CPB'de 1 saatlik reperfüzyonun ardından, alıcı baypas desteğinden kesilir. Ötenazi, CPB'den ayrıldıktan 1 saat sonra gerçekleşir. İmplante edilen allogreft daha sonra doku analizi için işlenir. DCD HT = dolaşım ölümünden sonra bağışı takiben kalp nakli; CPB = kardiyopulmoner baypas. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
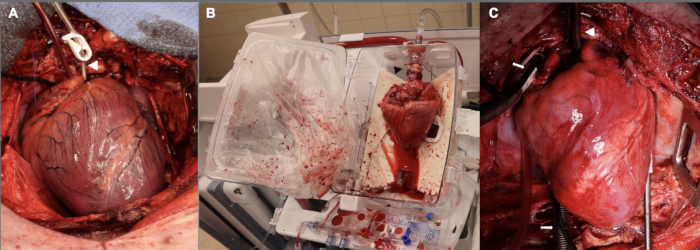
Şekil 2: DCD OHT süreci boyunca farklı aşamalarda domuz kardiyak allogrefti. (A) Kontrollü dolaşım ölümünü takiben, donör allogrefti şişkin, iskemik ve ödemlidir. Beyaz ok ucu aort kökü kanülünü gösterir. (B) Allogreft donörden çıkarıldıktan sonra, ex vivo perfüzyon için EVP cihazına yerleştirilir. Arka yönü dışa bakacak şekilde kalbin yönüne dikkat edin. Siyah ok ucu, allogrefti cihaza bağlamak için kullanılan aort adaptörüne işaret eder. (C) Alıcıya implantasyondan sonra, allogreft, CPB'den ayrılmadan bir saat önce kardiyopulmoner baypas üzerinde yeniden perfüze edilir. Beyaz ok ucu aort kanülünü gösterir; Beyaz oklar bikaval venöz kanülleri gösterir. EVP = ex vivo perfüzyon; CPB = kardiyopulmoner baypas. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
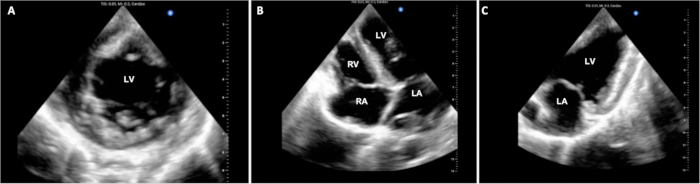
Şekil 3: Kardiyak epikardiyal ekokardiyografi. DCD OHT prosedürü boyunca, ventriküler fonksiyonu değerlendirmek için çoklu epikardiyal ekokardiyografik görüntüler elde edildi. (A) Standart kısa eksen, (B) 4 odacıklı ve (C) 2 odacıklı görünümler burada gösterilmektedir. LV = sol ventrikül; LA = sol atriyum; RV = sağ ventrikül; RA = sağ atriyum. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
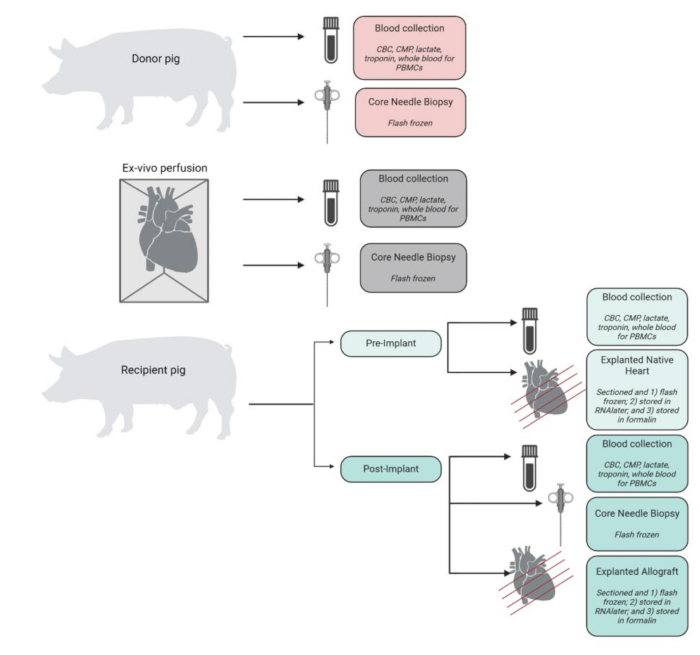
Şekil 4: Numune toplama ve işleme iş akışı. Prosedürün her adımında numune toplama ve işleme şeması. CBC = tam kan sayımı; CMP = kapsamlı metabolik panel; PBMC'ler = periferik kan mononükleer hücreleri. BioRender'da oluşturulan şekil. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Süre Uzunluğu (dk) | |
| (ortalama ± SD; n = 4) | |
| Havalandırmanın kesilmesinden ölüm beyanına kadar geçen süre | 14.25 (2.6) |
| Ex vivo perfüzyon süresi | 147 (18) |
| CPB süresi | 174 (4) |
| Çapraz kelepçe süresi | 90 (12.5) |
| CPB sütten kesilmesinden ölüme kadar geçen süre | 50 (37) |
Tablo 1. Prosedür bilgileri. DCD HT prosedüründeki her kritik adımın ortalama süresi. CPB = kardiyopulmoner baypas.
Tartışmalar
Son dönem kalp yetmezliğinin tedavisinde kalp naklinin etkinliğine rağmen, bu alanda önemli zorluklar devam etmektedir. Donör organların sınırlı mevcudiyeti ile mücadele etmek için, kalp allogreft koruma yöntemlerindeki gelişmeler (örneğin, normotermik makine perfüzyonu) son yıllarda ön plana çıkmıştır. Bu gelişmeler, dolaşım ölümü sonrası bağışı takiben kardiyak allogreft transplantasyonunun (DCD HT) benimsenmesine yol açmıştır. DCD HT allogreftlerinin kullanımı donör havuzunu genişletmiş ve DBD HT allogreftlerinden daha düşük olmayan kısa vadeli sonuçlara sahip olsa da, her iki donör tipi3 ile ilişkili erken peri-transplant mortalite riski yaklaşık %5'tir. Kalp naklinde erken mortalite riski ağırlıklı olarak PGT'den kaynaklanmaktadır. PGT, etiyolojide tanımlanmış donör, alıcı ve koruma değişkenlerinin bir miktar katkısıyla multifaktöriyel olmasına rağmen, PGD'nin altında yatan moleküler mekanizmalar genellikle tam olarak anlaşılamamıştır. Ayrıca, DCD HT prosesinin neden olduğu ilave sıcak iskemik hasar göz önüne alındığında, bu kalplerin DBD allogreftlerine kıyasla daha yüksek PGD riski altında olması şaşırtıcı değildir. Bu nedenle, ortotopik kalp nakli sonrası kısa süreli mortalite riskini azaltmaya yardımcı olmak için PGT'nin daha iyi anlaşılması önemlidir ve bu özellikle DCD HT için geçerli olabilir.
Burada, DCD HT'nin yüksek kaliteli bir domuz cerrahisi modelini açıklıyoruz. DCD HT'nin büyük bir hayvan modelinde in vivo olarak modellenmesinin faydaları, yalnızca DCD HT sırasında elde edilen bir allogreftte meydana gelen patofizyolojik değişiklikleri daha iyi anlama yeteneğini değil, aynı zamanda optimal allogreft kalitesini sağlamayı amaçlayan hedefli müdahaleleri test etme yeteneğini de içerir. İmplantasyon sonrası sol ventrikül fonksiyonunun değerlendirilmesi ve basınç-hacim döngü analizi, bu domuz cerrahi modelinin DCD HT'yi takiben erken kardiyak allogreft disfonksiyonunu özetleyebildiğini göstermektedir. Bu nedenle, burada detaylandırılan teknik, DCD HT'yi takiben tekrarlanabilir büyük bir PGD hayvan modeli oluşturur ve DCD HT süreci boyunca birçok noktada terapötik stratejileri değerlendirmeye uygundur. Aslında, viral vektör aracılı gen terapisi gibi yeni terapötiklerin sunulması için bir araç olarak ex vivo perfüzyonun kullanılması, laboratuvarımızda ve diğerlerinde aktif bir odak alanıdır 18,19,20. Daha önce, DCD olmayan bir HT modeli kullanarak bir kardiyak allogrefte bir transgeni sağlam ve homojen bir şekilde iletme yeteneğini göstermiştik; aynı teknikler bir DCD HT modeli 19,20'ye de uygulanabilir. Diğer potansiyel terapötik stratejiler arasında perfüzatın kimyasal modifikasyonu, oksidatif stresi azaltmayı amaçlayan küçük molekül dağıtımı, iskemik dönem boyunca metabolizmayı desteklemek için metabolik substratların sağlanması vb. 16,21,22 yer alır. Ayrıca, burada sunulan model, klinik olarak kullanılan farklı tedarik teknikleri de dahil olmak üzere DCD HT ile ilişkili farklı değişkenleri değerlendirmek için kolayca uyarlanabilir. Örneğin, doğrudan tedarik ve ex vivo perfüzyon stratejisini tanımlıyoruz; Bununla birlikte, model, normotermik bölgesel perfüzyon dahil olmak üzere alternatif tedarik perfüzyon yöntemlerini içerecek şekilde kolayca uyarlanabilir.
Bu modelde kullanılan cerrahi teknik, klinik ortamda kullanılanları yakından yansıtır; Ancak, bazı önemli farklılıklar vardır. İlk olarak, sternotomi ve kardiyak maruziyet, kardiyopulmoner desteğin kesilmesi, agonal faz, ölümün belirlenmesi ve etik olarak zorunlu bekleme süresinden (açık göğüs modeli) önce gerçekleşir23. Sternotomi bu sırayla yapılır, böylece miyokard biyopsileri de dahil olmak üzere temel donör kalp değerlendirmesi yapılabilir. Bir DCD HT domuz modelinde sternotomi zamanlamasının önceden değerlendirilmesi, yaşamı sürdüren önlemlerin geri çekilmesinden ölüme (sıcak iskemik zaman) ilerlemenin, açık göğüs modelinde daha az belirgin hemodinamik değişikliklere eşlik ederek daha hızlı olduğunu göstermiştir; Bu allogreftler, tedarik sırasında daha az zarar verici koşullarla karşılaşabilir. Bununla birlikte, kapalı ve açık göğüs grupları arasında biyokimyasal (laktat, glukoz, katekolamin vb.) laboratuvar değerleri veya hücre ölümü belirteçleri açısından anlamlı bir fark yoktu24. Ayrıca, modele 10 dakikalık soğukluk süresinin dahil edilmesi nedeniyle, bu modelde ventilasyonun geri çekilmesinden fonksiyonel sıcak iskemiye kadar geçen süre, belirtilen çalışmanın kapalı göğüs grubunun zamanlamasına daha çok benzemektedir. Ek olarak, bu model içinde, fonksiyonel sıcak iskemi zamanı, belirli bir çalışma için deneysel hedeflere uyacak şekilde değiştirilebilen bir değişkendir. Burada rapor edilen model ile klinik ortam arasındaki bir diğer potansiyel fark, bu modelde ölümü tanımlamak için nabızsız elektriksel aktivitenin (PEA; mekanik asistol) kullanılmasıdır. Klinik bağlamda, nakil sürecine dahil olmayan bir hekim tarafından ölüm beyanı yapılır; ya PEA, diğer yaşam belirtilerinin veya elektriksel asistolün yokluğu ile birlikte, ölüm beyanı kriterlerini karşılamak için kabul edilebilir olacaktır. Domuz kalpleri, kasılmanın kesilmesini takiben uzun bir süre elektriksel aktiviteyi sürdürdü. Klinik bağlamda görülenle orantısız sıcak iskemik hasarı önlemek için, ölümü tanımlamak için mekanik asistol (PEA) kullanıldı. Kapalı göğüs DCD modelini kullanan araştırmacılar için, nabızsız elektriksel aktivite (arteriyel hatta pulsatilite eksikliği) ölüm tanımlayıcı kriter olarak hala kullanılabilir. Periferik oksijen satürasyonunun agonal dönemin başlangıcını tanımlamak veya ölümü tanımlamak için ilgili bir belirteç olduğunu bulamadık.
Son olarak, burada anlattığımız şey, zaman ve kaynak yoğun bir modeldir. Donör domuzun hazırlanmasından alıcı hayvanın ölümüne kadar yaklaşık 10 saat sürer ve büyük bir işbirliği çabası gerektirir. Prosedür ekibi, numune toplama ve işlemeye yardımcı olan deneyimli kalp cerrahları, kardiyak anestezistler, perfüzyonistler ve veterinerlik ve laboratuvar personelini içerir. Bunun gibi büyük bir ekip, DCD HT'nin karmaşık prosedürü sırasında ayrılmaz bir parçadır. Bununla birlikte, deneyimli bir ekiple, bu yazıda açıklandığı gibi, DCD HT'nin yüksek kaliteli bir domuz modelinin oluşturulması mümkündür.
Açıklamalar
CAM, TransMedics Inc. için danışman olarak hizmet verdiği için hisse senedi tazminatı aldı.
Teşekkürler
Duke Laboratuvar Hayvanları Kaynakları'nın veterinerlik teknik desteğine, Santrifüj Çözeltileri'nin perfüzyon desteğine ve Duke kardiyovasküler anestezi ekiplerine bu cerrahi deneylere verdikleri paha biçilmez destek için teşekkür ederiz. Ayrıca Paul Lezberg ve TransMedics, Inc.'e destekleri için içtenlikle teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
Referanslar
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır