Method Article
Un modelo porcino de alta fidelidad de trasplante ortotópico de corazón después de la donación después de la muerte circulatoria
* Estos autores han contribuido por igual
En este artículo
Resumen
El protocolo describe un modelo porcino de alta fidelidad de trasplante cardíaco después de la donación después de la muerte circulatoria utilizando la perfusión ex vivo del aloinjerto.
Resumen
El número de pacientes con insuficiencia cardíaca avanzada que pueden recibir un trasplante de corazón está limitado por la escasez de donantes de órganos adecuados. En un esfuerzo por ampliar el grupo de donantes, se han desarrollado métodos alternativos de donación y obtención, incluido el trasplante de corazón después de la donación después de la muerte circulatoria (DCD HT). Si bien la supervivencia a corto plazo después de la TH con DCD no es inferior a la del trasplante de corazón con donantes con muerte cerebral, puede haber un aumento en la tasa de disfunción primaria del injerto (DGP) asociada con los aloinjertos de TH con DCD. La etiología subyacente del DGP es multifactorial y no se comprende completamente. En el caso de los aloinjertos de DCD HT, el período de lesión isquémica caliente durante la obtención de DCD es un factor de riesgo potencial para el DGP al que no están expuestos los aloinjertos de muerte encefálica. Por lo tanto, el tiempo isquémico cálido funcional puede ser un factor importante del DGP en la DTC HT. Sin embargo, los mecanismos que subyacen al DGP en este escenario clínico son poco conocidos a nivel molecular. El trabajo que se presenta tiene como objetivo describir el desarrollo y la validación de un modelo porcino de alta fidelidad y no supervivencia de trasplante cardíaco ortotópico con DCD. Nuestra hipótesis es que el uso de este modelo traslacional de animales grandes es fundamental para dilucidar los mecanismos moleculares que contribuyen al DGP, así como para investigar intervenciones diseñadas para optimizar la preservación del aloinjerto y el rendimiento temprano. Este modelo replica clínicamente el abordaje perioperatorio y quirúrgico utilizado en la TH con DCD, con modificaciones para tener en cuenta la anatomía y fisiología porcina. El desarrollo de este modelo quirúrgico de animales grandes no solo proporcionará información mecanicista sobre el desarrollo del DGP, sino que también puede modificarse para mejorar los esfuerzos de investigación traslacional destinados a mejorar la recuperación de órganos después de la HTA con DCD.
Introducción
Para los pacientes con insuficiencia cardíaca terminal refractaria al tratamiento médico, el trasplante de corazón sigue siendo la terapia asociada con la mejor supervivencia y calidad de vida a largo plazo. Históricamente, el trasplante de corazón requería el uso de un aloinjerto cardíaco obtenido de un donante con muerte cerebral (DBD HT) y transportado mientras se conservaba con almacenamiento estático hipotérmico. Sin embargo, el número de pacientes que requieren un trasplante de corazón supera el número de donantes disponibles. Si bien cada año se realizan más de 5.000 trasplantes de corazón en todo el mundo, se estima que 50.000 candidatos esperan un trasplante decorazón. Además, la utilización de órganos de donantes identificados sigue siendo tan baja como el 30%2. Con el fin de mejorar la utilización de los órganos del donante, en los últimos años se han desarrollado métodos alternativos de donación y obtención, entre ellos el trasplante de corazón después de la donación después de la muerte circulatoria (TDC)3,4,5,6.
Los donantes de DCD HT no cumplen con los criterios formales de muerte encefálica, pero tienen una lesión neurológica no recuperable para la cual la atención médica continua se considera inútil. Durante la obtención de una THD con DCD, se retiran las medidas de soporte vital y se monitoriza al paciente para determinar su progresión a apnea y paro circulatorio. La muerte en estas situaciones es declarada por un médico que no participa en el proceso de trasplante o obtención de órganos. Una vez que se ha declarado la muerte, hay un período de espera adicional (generalmente 5 minutos) en el que se observa al posible donante para asegurarse de que no haya recuperación o signos de vida, después de lo cual se vuelve a confirmar la declaración de muerte antes de proceder con la obtención de órganos 7,8. Por lo tanto, los aloinjertos de DCD están expuestos a un período variable de isquemia cálida (al menos 10 min) al que no están expuestos los aloinjertos de donantes de DBD. Este período de isquemia caliente había disuadido previamente el uso del trasplante de corazón con donantes de DCD. Sin embargo, en los últimos cinco años, se desarrollaron dos métodos de reperfusión para la recuperación del aloinjerto después del tiempo isquémico cálido asociado con DCD. En primer lugar, la obtención y perfusión directa (DPP) implica la cardiectomía del donante tras la confirmación de la muerte circulatoria, seguida de la reanimación con aloinjerto y la preservación por perfusión ex vivo. Alternativamente, la perfusión regional normotérmica (NRP) utiliza la circulación extracorpórea con exclusión de la circulación cerebral para reperfundir y reanimar el corazón del donante in situ antes de la cardiectomía 9,10,11,12.
Hasta ahora, la supervivencia a corto plazo asociada con la TH con DCD ha sido similar a la observada con la HTA DBD. Sin embargo, los estudios preliminares también sugieren que existe un mayor riesgo de disfunción primaria del injerto (DGP) grave con DCD HT en comparación con DBD HT3. El DGP es un término utilizado para describir la circunstancia clínica en la que, tras un trasplante de corazón, la función precoz del aloinjerto es insuficiente para satisfacer las necesidades circulatorias del receptor. La Sociedad Internacional de Trasplantes de Corazón y Pulmón describió un sistema para clasificar la gravedad del DGP. En el DGP severo, se requiere soporte circulatorio mecánico para mantener una circulación adecuada en el período post-trasplante13. Esta afección es el principal impulsor de la mortalidad postoperatoria precoz después del trasplante cardíaco. La etiología del DGP tanto para la TDC HTA como para la DTC HTA es poco conocida, pero es probable que sea multifactorial, con la contribución de las variables donante, preservación y receptor. En el caso de los aloinjertos de DCD, la lesión isquémica caliente durante la obtención de DCD, así como las respuestas deletéreas específicas del donante, incluida la inestabilidad hemodinámica, los trastornos metabólicos y los aumentos repentinos de catecolaminas, citocinas, lactato y potasio, son factores propuestos que pueden contribuir a un mayor riesgo de DGP en comparación con los aloinjertos de DBD. 14,15,16. Sin embargo, los mecanismos que subyacen al DGP en este escenario clínico son poco conocidos a nivel molecular. Además, tal vez debido a estas preocupaciones, los corazones con DCD tienen 3,37 veces más probabilidades de ser rechazados que los órganos con DBD17. Como resultado, todavía existe una necesidad insatisfecha de mejorar la utilización de los órganos y mejorar los resultados de los trasplantes mediante la optimización del proceso de preservación de órganos.
En este estudio, describimos un DCD HT porcino que utiliza DPP que refleja el DPP DCD HT clínico actual con alta fidelidad. Este modelo incluye elementos a lo largo del proceso de trasplante de DCD: 1) obtención de DCD, 2) preservación de la perfusión ex vivo con un Sistema de Cuidado de Órganos (OCS) y 3) implantación del receptor. Este modelo integral brinda la oportunidad de caracterizar mejor los mecanismos subyacentes al DGP en la HTA de DCD. Esto permite el desarrollo de estrategias terapéuticas específicas y racionales destinadas a mejorar la conservación y el rendimiento del aloinjerto. Además, este modelo proporciona una plataforma para la evaluación preclínica de estas nuevas terapias, que serán importantes para ayudar a avanzar en el campo del trasplante cardíaco de manera segura y rápida.
Protocolo
Toda la cría y los procedimientos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales del Centro Médico de la Universidad de Duke de acuerdo con sus regulaciones y pautas.
1. Preparación preoperatoria del donante
- Seleccione dos cerdos Yorkshire con el mismo tipo de sangre que pesen entre 70 y 80 kg (tipificación sanguínea realizada por Looper Farms en Granite Falls, Carolina del Norte, EE. UU.). Ayuna a ambos cerdos durante un mínimo de 6-8 h antes de la cirugía.
- Prepare el módulo de perfusión cardíaca de acuerdo con las pautas del fabricante y las pruebas necesarias en el punto de atención (Tabla de materiales).
- Prepare la solución de mantenimiento para el módulo de perfusión cardíaca. Esta solución contiene nutrientes para el corazón metabólicamente activo, así como adenosina, para ayudar a mantener la presión arterial objetivo.
- Agregue lo siguiente: 500 mL de solución de cebado transparente, 100 mL de albúmina al 25%, 100 mg de ciprofloxacina (200 mg/100 mL), dos viales de 5 mL de inyección multivitamínica, bicarbonato de sodio 20mEq, 1 g de cefazolina sódica y 250 mg de metilprednisolona. Agregue la solución de cebado y agregue el contenido al módulo de perfusión cardíaca.
- Una vez preparado, inyecte 50 UI de insulina recombinante humana en la bolsa.
- Prepare una solución de epinefrina inyectando 0,25 mg de epinefrina y 30 UI de insulina recombinante humana en una bolsa de 500 ml de dextrosa al 5% en agua. Esta solución está destinada a reemplazar las catecolaminas en lugar de tener un efecto inotrópico. Infundir la solución a 10 mL/h.
- Prepare la solución T4 inyectando 200 μg de levotiroxina reconstituida en una bolsa de solución salina normal al 0,9% de 100 mL. Infundir a una velocidad de 3 mL/h.
- Prepare la solución de mantenimiento para el módulo de perfusión cardíaca. Esta solución contiene nutrientes para el corazón metabólicamente activo, así como adenosina, para ayudar a mantener la presión arterial objetivo.
- Sedar al cerdo donante designado con 4,4 mg/kg de telazol y 1,0 mg/kg de propofol seguidos de isoflurano inhalado al 2%-5% administrado por mascarilla.
- Mientras el cerdo está en decúbito supino, intuble con un tubo endotraqueal de 8-10 mm para el mantenimiento de la vía aérea durante la cirugía. Asegure el tubo endotraqueal en su lugar al hocico. Aplique ungüento veterinario en los ojos para mantener la lubricación ocular durante la cirugía.
- Insertar un catéter intravenoso (IV) en una vena del oído para administrar líquidos IV (líquidos de mantenimiento: solución de Ringer lactato 10 mL/kg/h).
- Iniciar la infusión continua de fentanilo para la analgesia (25-100 μg/h) y administrar 0,2 mg/kg de vecuronio para mantener la parálisis.
- Coloque los cables del electrocardiograma y el oxímetro de pulso para el monitoreo continuo de la actividad eléctrica y la oxigenación.
- Iniciar la ventilación mecánica a un volumen corriente de 10 mL/kg/min, a una velocidad de 10-15 respiraciones por minuto, y con mantenimiento de isoflurano (1%-5%) durante el resto del procedimiento. Titule los anestésicos y los medicamentos vasoactivos de manera que los reflejos estén ausentes, la frecuencia cardíaca permanezca entre 61 y 99 lpm y la presión arterial sistólica entre 90 y 130 mmHg.
- Coloque el cerdo en la mesa de operaciones con las extremidades superiores colocadas cefálicas y aseguradas fuera del campo operatorio. Asegure las extremidades inferiores fuera del campo operatorio.
- Defina el área a incluir en el campo operatorio por la papada en la parte superior, la línea axilar anterior en el plano bilateral y dos dedos por debajo de la apófisis xifoides en la parte inferior. Prepare y cubra el sitio quirúrgico de manera aséptica, siguiendo las prácticas estándar.
- Realice un corte de la carótida del lado derecho.
- Con una cuchilla # 10, haga una incisión oblicua en el cuello lateral derecho, de dos dedos de ancho lateral a la tráquea, a lo largo del borde medial del músculo esternocleidomastoideo.
- Llevar esta incisión hacia abajo a través del platisma con electrocauterización, asegurando la hemostasia. Una vez atravesado el platisma, use un retractor de retención automática para ayudar a la exposición.
- Diseccionar y aislar cuidadosamente la arteria carótida y la vena yugular interna; Coloque un lazo alrededor de cada recipiente.
- Aplicar 10 mL de lidocaína al 2% por vía tópica para bañar los vasos.
NOTA: La lidocaína se utiliza por sus efectos vasodilatadores, ya que los vasos porcinos sufren fácilmente espasmos con la manipulación y pueden resultar difíciles de canular. - Mediante la técnica de Seldinger, se canuló directamente la arteria carótida con una micropunción de 5 Fr, seguida de una vaina introductora de 6 Fr.
- Conecte la vaina introductora a una vía arterial y un transductor para la monitorización continua de la presión arterial sistémica durante el procedimiento.
- Extraiga sangre de la línea arterial de la arteria carótida para análisis de sangre de laboratorio preoperatorios (hemograma completo, panel metabólico completo, troponina, lactato y sangre total para el aislamiento de células mononucleares de sangre periférica).
- Cánula de la vena yugular interna utilizando la misma técnica que en 1.11.5. Deje la funda de 6 Fr en su lugar, ya que se utilizará para introducir un catéter de bucle de presión-volumen para evaluaciones funcionales posteriores.
2. Donación tras muerte circulatoria y cardiectomía del donante
- Realizar una esternotomía.
- Con una cuchilla # 10, haga una incisión longitudinal desde la muesca esternal hasta la apófisis xifoides. Con electrocauterización, lleve la disección hacia abajo a través del tejido subcutáneo y la fascia del músculo pectoral.
- Marque la línea media del esternón con electrocauterización. Diseccionar las inserciones ligamentosas en el manubrio y alrededor de la apófisis xifoides.
- Use una sierra esternal oscilante para dividir cuidadosamente la mesa anterior del esternón a lo largo de la línea media. Utilice la sierra oscilante para dividir completamente la mesa posterior del esternón a nivel del manubrio. Tenga cuidado de evitar lesiones en la vena innominada en este paso. Complete la división esteral de la mesa posterior debajo del manubrio con un par de tijeras gruesas.
NOTA: La disección manual roma del plano entre la parte inferior del esternón y el pericardio puede ayudar a evitar lesiones al corazón durante este paso. - Utilizar la electrocauterización para obtener la hemostasia de los bordes esternales. Coloque un retractor esternal.
- Eliminar el tejido de la almohadilla de grasa tímica y pericárdica con electrocauterio para optimizar la exposición del pericardio.
- Abra cuidadosamente el pericardio con electrocauterización. Lleve la incisión longitudinalmente desde el vértice del corazón hasta el nivel de la aorta.
- Crea un hueco pericárdico con puntos de tirantes de seda 2-0.
- Realizar análisis de aloinjertos de donantes de referencia.
- Mientras el corazón del donante está expuesto y antes de cualquier manipulación cardíaca directa, realice análisis basales. Estos incluyen ecocardiografía epicárdica directa, evaluación del asa presión-volumen y biopsias miocárdicas con aguja gruesa.
- Realice la ecocardiografía de forma estéril para obtener vistas estándar de eje largo y corto directamente desde la superficie epicárdica.
- Para realizar registros del bucle presión-volumen, se introduce un catéter de presión-volumen de estado sólido (5Fr, 122 cm) secuencialmente en la arteria carótida y en la vena yugular interna en los ventrículos izquierdo y derecho, respectivamente.
- Medir la longitud del catéter que se introducirá externamente (desde el sitio de la canulación hasta el ápice del corazón) antes de la inserción en la vaina.
- Introducir el catéter en la vaina arterial, guiándolo hasta el ventrículo izquierdo mediante ecografía epicárdica. Asegúrese de que el catéter no toque directamente la pared ventricular, ya que esto puede interferir con la precisión de la medición.
- A continuación, introduzca el catéter en la vaina venosa, guiándolo hasta el ventrículo derecho, mediante palpación directa o guía ecográfica epicárdica.
- Realizar biopsias miocárdicas con aguja gruesa para recolectar tejido para análisis posteriores. Realice esto en el vértice del ventrículo izquierdo. Si hay sangrado significativo en el sitio de la biopsia, coloque una sutura de reparación.
- Prepara el corazón del donante.
- Diseccione la ventana aortopulmonar para dejar espacio para la colocación de pinzas cruzadas.
- Diseccionar circunferencialmente la vena cava superior (VCS) y la vena cava inferior (VCI) con electrocauterización.
- Para anticoagular, administrar 300 unidades/kg de heparina por vía intravenosa (IV) antes de la canulación aórtica.
- Use una sutura de polipropileno 4-0 de doble brazo para colocar un collar aórtico en la raíz aórtica para la canulación aórtica. Cánula con cánula de ventilación de la raíz aórtica de 7 Fr (14 G).
- Desairee y asegúrelo en su lugar con un torniquete Rumel. Enjuague el tubo de cardioplejia para desairear y asegure la vía a la cánula de la raíz aórtica.
- A continuación, para prepararse para una futura canulación venosa, coloque una sutura en el apéndice auricular derecho y asegúrelo con un torniquete de Rumel.
- Realizar la muerte circulatoria controlada.
- Proporcionar un bolo de 250 μg de fentanilo IV seguido de una infusión de velocidad continua (CRI) a 100 μg/h para la analgesia. Para paralizar, administrar 0,2 mg/kg de vecuronio por vía intravenosa.
- Cesar la ventilación mecánica para iniciar el proceso de muerte circulatoria controlada.
- Monitoree continuamente la presión arterial sistólica y media, la pulsatilidad de la línea arterial, la actividad cardíaca eléctrica y el estado de oxigenación.
NOTA: La fase agónica comienza cuando la presión arterial sistólica cae por debajo de 50 mmHg. En este punto, el corazón puede distenderse. La muerte se define por asistolia mecánica (actividad eléctrica sin pulso) y sin signos de vida. Este estudio no define la muerte por asistolia eléctrica en este modelo, ya que la actividad eléctrica lenta sin pulso persiste en los cerdos durante un período de tiempo más largo que el observado en los humanos, lo que puede resultar en un aumento de la agresión isquémica del aloinjerto de lo previsto para el modelo. - Espere 10 minutos después de la hora de la muerte/asistolia antes de continuar con los siguientes pasos del protocolo. Este intervalo simula el período de separación más el tiempo necesario para la entrada mediastínica y la preparación en la TH clínica con DCD.
- Realizar el cebado ex vivo del dispositivo de perfusión.
- Con una cuchilla #11, haga una incisión punzante en el apéndice auricular derecho y cánula con la cánula venosa de 34Fr proporcionada por el fabricante. Asegure la cánula con un torniquete Rumel y conecte la cánula a la bolsa de recolección del dispositivo de perfusión ex vivo .
- Recoja aproximadamente 1200-1500 ml de sangre del donante en la bolsa de recolección proporcionada por el fabricante. Antes de la exanguinación, se habrán añadido 30.000 U de heparina y 2 mg de tirofiban HCl a la bolsa de recogida.
- Filtre la sangre del donante y entréguela en el módulo de perfusión cardíaca.
- Realizar una cardiectomía del donante.
- Después de la recolección de la sangre del donante, aplique la pinza cruzada aórtica.
- Tenga en cuenta que la raíz aórtica porcina y la aorta ascendente son considerablemente más cortas que en los humanos. Tenga cuidado de aplicar la pinza cruzada lo más proximalmente posible para evitar pinzar el arco u ocluir incompletamente la aorta.
- Administrar 1 L de cardioplejia Del Nido en la raíz aórtica, apuntando a una presión radicular de 60-100 mmHg.
- Seccionar la vena cava inferior en el reflejo pericárdico y la orejuela auricular izquierda para ventilar los ventrículos derecho e izquierdo durante el parto de la cardioplejia.
- Coloque aguanieve fría y estéril en el corazón del donante.
- Divida la VCI, la VCS, la aorta justo distal a la arteria innominada y la arteria pulmonar (AP) en la bifurcación. Transecto de la aurícula izquierda (LA) del donante, dejando un manguito suficiente de tejido en el aloinjerto.
- Retire el corazón del campo y colóquelo en un recipiente lleno de granizado estéril y frío para prepararlo en la mesa trasera.
- Coloque cuatro suturas de colchón horizontales equidistantes (polipropileno 4-0) dentro del extremo distal de la aorta.
- Después de la recolección de la sangre del donante, aplique la pinza cruzada aórtica.
- Perfusión ex vivo
- Coloque el adaptador aórtico de perfusión ex vivo en la aorta distal y asegúrelo firmemente con una sutura de seda 0-0 o cinta umbilical colocada justo debajo de las suturas comprometidas.
- Deje abiertos el PA, SVC, IVC y la aurícula izquierda mientras esté en el dispositivo de perfusión ex vivo .
NOTA: Con esta configuración, no se encontró distensión ventricular izquierda. - Transporte el aloinjerto al dispositivo de perfusión ex vivo y conecte el adaptador aórtico. Asegúrese de que la superficie posterior del corazón esté orientada hacia atrás. Asegúrese de que la superficie anterior del corazón esté en contacto con el dispositivo y con las dos almohadillas de desfibrilación. Mantener el aloinjerto a 34 °C. Desfibrilar según sea necesario para restaurar cualquier arritmia ventricular a un ritmo organizado.
- En este punto, se podría introducir una terapéutica en el circuito de perfusión ex-vivo a través del puerto de cardioplejia. Alternativamente, el perfusado o el circuito físico pueden modificarse para evaluar las condiciones experimentales destinadas a mejorar la recuperación de un aloinjerto DCD HT. Por ejemplo, hemos demostrado previamente que la perfusión necesita ser lavada de anticuerpos neutralizantes preformados a través de un protector de células para mejorar la transducción con vectores virales 18,19,20.
- Utilice los laboratorios en el punto de atención para guiar la administración de bicarbonato de sodio, gluconato de calcio y dextrosa, según sea necesario.
- Obtener muestras de perfusión, análisis de sangre y muestras de biopsia con aguja gruesa durante esta etapa de perfusión ex vivo .
NOTA: En este modelo, el aloinjerto permanece en el dispositivo de perfusión ex vivo durante aproximadamente 2-3 h antes de la implantación en el receptor (Tabla 1). El tiempo de perfusión ex vivo del aloinjerto estuvo determinado por el tiempo que se tardó en preparar al animal receptor para la implantación. Sin embargo, el tiempo de perfusión ex vivo es una variable que se puede ajustar en función de los objetivos del estudio.
3. Cardiectomía, implantación y reperfusión del receptor
- Prepare el cerdo receptor como se describe en los pasos 1.3 a 1.11.8.
- Además, coloque un catéter de vía central de triple lumen de 7 Fr 20 cm en la vena yugular externa o interna izquierda utilizando la guía ecográfica y la técnica de Seldinger. Colocar una vía arterial femoral de 5 Fr con guía ecográfica.
- Después de cubrir el campo estéril, prepare el circuito de derivación cardiopulmonar (CPB) y coloque las vías en el campo.
- Recirculen a través de las vías arteriales y venosas del CPB para desairear. Sujeta y divide las líneas. Preparar la vía venosa para la canulación bicaval.
- Administrar una dosis preoperatoria de 1 g de metilprednisolona para abordar las respuestas inflamatorias debidas al rechazo o a la isquemia, tal y como se hace en el trasplante cardíaco clínico de la institución donde se realiza este estudio.
- Realice un corte de la carótida derecha y una esternotomía de la línea media como se describió anteriormente en los pasos 1.11 y 2.1.
- Realizar la cardiectomía del receptor.
- Diseccionar la ventana aortopulmonar como antes. Diseccionar la VCS y la VCI y colocar cinta umbilical circunferencial alrededor de los vasos.
- Antes de la canulación, administrar 400 unidades/kg de heparina. Valoración a un objetivo de tiempo de coagulación activado (ACT) > 480 s.
- Coloque una sutura de canulación aórtica estándar en la aorta ascendente distal (usando sutura de poliéster trenzado recubierta 2-0 de doble brazo). Asegúrelo con un torniquete Rumel y hemostático.
- Asegúrese de que la presión arterial sistólica sea inferior a 120 mmHg. Use una cuchilla # 11 para hacer una incisión de puñalada de espesor completo dentro de la cuerda de la bolsa. Cánula de la aorta con una cánula de 15 Fr a través de esta incisión. Asegure la cánula en su lugar con un torniquete Rumel.
- Pinza la cánula aórtica. Después de desairear la vía de derivación arterial, conecte la cánula aórtica al circuito CPB. Asegúrese de que no haya burbujas de aire en la línea.
- Haga otra bolsa aórtica e inserte la cánula de ventilación de la raíz aórtica.
- Realizar la canulación venosa mediante una técnica bicaval con cánulas de punta metálica en ángulo recto de 18-20 Fr tanto en la VCS como en la VCI, aseguradas con torniquetes Rummel. Luego, conecte estas cánulas a la extremidad venosa del circuito CPB.
- Inicie el CPB a un caudal objetivo de 2,4 L/min/m2 y enfríe a 32 °C. Titule el anestésico y los vasopresores para mantener una presión arterial media > 60 mmHg.
NOTA: Estos procedimientos se realizan con anestesiólogos cardiotorácicos certificados por la junta y perfusionistas certificados que monitorean y coordinan el manejo hemodinámico durante todo el curso de la ejecución de CPB. - Aplique la pinza cruzada aórtica proximal a la cánula aórtica y proceda con una explicación del corazón nativo del receptor. Dejar intactos los manguitos auriculares derecho e izquierdo lo suficientemente grandes como para facilitar una técnica de implante biauricular.
NOTA: En este modelo se utiliza la técnica biauricular ya que la vasculatura porcina es muy delicada, lo que hace que las anastomosis vasculares de la VCI y la VCS sean técnicamente difíciles en una técnica bicaval. - Transijar la aorta y la PA lo más cerca posible de la raíz para mantener la longitud máxima de los vasos. Coloque el corazón recién explantado en solución salina tamponada con fosfato (PBS) helada para transportarlo y procesarlo en el laboratorio.
- Realizar la implantación biauricular del aloinjerto del receptor.
- Enfríe el aloinjerto en el dispositivo de perfusión ex vivo según las instrucciones del fabricante. Administre 1 L de cardioplejia fría Del Nido para el paro cardiopléjico una vez más antes de retirar el dispositivo.
- Desconecte el adaptador aórtico y transporte el corazón en un recipiente con aguanieve estéril y fría a la mesa trasera.
- Inspeccione el corazón en busca de penetraciones primarias ovales (FOP) o sitios de lesiones inadvertidas.
NOTA: Es importante destacar que, en los cerdos, generalmente hay una vena sistémica que drena a lo largo del borde auricular izquierdo antes de drenar hacia la aurícula derecha o IVC. Esta vena puede abrirse en el proceso de obtención, y se debe tener cuidado para asegurarse de que esté ligada antes de proceder con la implantación. - Recorte la aorta hasta el tejido sano por debajo del sitio de fijación del adaptador.
- Con unas tijeras Metzenbaum, recorte la abertura auricular izquierda para que coincida con el tamaño del manguito LA del receptor. Haz lo mismo con la aurícula derecha.
- Comience la anastomosis de la aurícula izquierda de forma continua con sutura Prolene 4-0 de doble brazo. Continuar con las anastomosis PA, aórtica y auricular derechas, todas también completadas con sutura continua de prolene 4-0.
- Comience a recalentar hasta la normotermia (37 °C) antes de retirar la pinza cruzada aórtica.
- Realizar la reperfusión del aloinjerto y el destete de la CPB.
- Después de completar todas las anastomosis, suelte la pinza cruzada aórtica para reperfundir el aloinjerto.
- Asegurar la hemostasia de todas las anastomosis.
- Esperar el regreso del ritmo autóctono y la contractilidad. Coloque alambres de estimulación epicárdica y marque el ritmo a 100 lpm si la frecuencia cardíaca del aloinjerto es de <100 lpm.
- Después de 60 min de reperfusión, intente destetar la CEC. Los receptores reciben 0,05 μg/kg/min de epinefrina, así como infusiones de vasopresores, según sea necesario para mantener una presión arterial media (PAM) >65 mmHg.
- Realizar análisis como ecocardiografía, análisis de sangre, biopsias miocárdicas y evaluación del bucle presión-volumen en puntos temporales de reperfusión temprana y tardía.
4. Terminación del experimento y eutanasia
NOTA: En este estudio, el animal receptor del trasplante fue apoyado durante 1 h después de la separación de la CEC.
- Una vez finalizado el experimento, la eutanasia se realiza mediante exanguinación bajo anestesia.
- Explante el aloinjerto trasplantado seccionando las líneas de sutura a lo largo de todas las anastomosis. Tenga cuidado de no incluir ningún tejido receptor nativo con la muestra de aloinjerto.
- Coloque el aloinjerto inmediatamente en PBS helado y transpórtelo al laboratorio para su procesamiento y almacenamiento.
Resultados
Se realizaron un total de 6 trasplantes de DCD porcino para un análisis piloto utilizando el protocolo aquí descrito. En el transcurso de estos seis experimentos piloto, los componentes del protocolo se refinaron para adaptarse mejor a las necesidades del modelo, mejorar la reproducibilidad y tener en cuenta las limitaciones logísticas. El protocolo final resultante, tal como está escrito aquí, se resume en la Figura 1.
A diferencia del proceso de muerte circulatoria controlado por el ser humano, los corazones porcinos sometidos a isquemia mantuvieron la actividad eléctrica durante mucho más tiempo de lo esperado, incluso después de que cesó la contractilidad. Tras el reconocimiento de esta diferencia en el primer experimento, se consideró que la asistolia eléctrica no era fiable como medida para la declaración de muerte. Con el fin de evitar un daño isquémico caliente en el aloinjerto desproporcionado con el observado en el contexto clínico, se utilizó asistolia mecánica (actividad eléctrica sin pulso) para determinar el momento de la muerte para el resto de los procedimientos de trasplante.
Además, el período de espera fue inicialmente de 15 minutos antes de proceder con la cardiectomía del donante. Esto se utilizó para los tres primeros experimentos del conjunto piloto. Parte de la justificación de este período de isquemia tibia de 15 minutos fue que nuestro objetivo era tener una lesión lo suficientemente grave como para tener un grado de disfunción del injerto posterior al trasplante que fuera adecuado para el estudio. Descubrimos que la disfunción del injerto en estos primeros experimentos era tan grave que tuvimos dificultades para sostener al animal receptor durante una hora después de la separación de la CEC, de modo que el animal receptor requirió altas dosis de apoyo inotrópico y presor para cumplir con el punto de tiempo de 1 hora. Dadas estas dificultades, redujimos el período de lesión isquémico-caliente a 10 min, lo que se aproxima más a la TH clínica de DCD con perfusión ex vivo . La Figura 2 muestra imágenes representativas del aloinjerto en esta etapa, así como durante la perfusión ex vivo y después de la implantación. Por último, se realizaron ajustes en la titulación de las infusiones de vasopresores e inotrópicos en la fase posterior al destete de la CEC para apoyar al corazón recién trasplantado. No se puede enfatizar lo suficiente la necesidad de un equipo experimentado con conocimientos específicos en anestesiología cardiovascular para mejorar el éxito en esta fase posterior a la CEC.
Se realizó un seguimiento de los tiempos operativos en 4 de los 6 experimentos y se resumen en la Tabla 1. En la fase de obtención de DCD del protocolo, el tiempo transcurrido desde el cese de las medidas de soporte vital en el cerdo donante hasta la declaración de muerte fue de 14,25 (+/- 2,6) min. El tiempo de circulación cardiopulmonar operatoria y el tiempo de pinzamiento cruzado se mantuvieron constantes a lo largo de los experimentos piloto a las 3 h y 1,5 h, respectivamente. Los experimentos se terminaron con eutanasia aproximadamente 1 h después de la separación de la CEC. Hubo variabilidad en el grado de estabilidad de los animales en el momento de la eutanasia. Algunos animales demostraron una estabilidad relativamente buena y solo una disfunción leve del injerto, mientras que otros mostraron una inestabilidad hemodinámica significativa y una disfunción grave del injerto. En la Figura 3 se muestran las representaciones representativas de la ecocardiografía. Esta y otras evaluaciones funcionales, como los bucles PV, se pueden utilizar para determinar las diferencias en la función del aloinjerto desde el inicio, así como antes y después de la introducción de intervenciones terapéuticas.
En la Figura 4 se muestra un resumen de las muestras recolectadas, procesadas y almacenadas durante el experimento. Los corazones explantados se colocaron inmediatamente en PBS helados y se almacenaron en el laboratorio para su análisis molecular y de tejidos. El corazón nativo del receptor se utilizó como control, mientras que el aloinjerto trasplantado se almacenó como tejido experimental. Los corazones se cortaron en 4 secciones transversales desde el ápice hasta la base. De cada una de ellas, se congelaron rápidamente muestras de tejido representativas de cada cámara (ventrículo izquierdo, ventrículo derecho, tabique y ambas aurículas) en nitrógeno líquido y se almacenaron a -80 °C para su posterior análisis. Del mismo modo, las muestras de tejido representativas de cada uno de estos niveles y cámaras se incubaron en RNAlater y se congelaron rápidamente. El resto de la muestra de tejido se conservó en formol para su análisis histopatológico. Las muestras de sangre de cualquier punto del tiempo se obtuvieron por duplicado y se almacenaron en tubos de EDTA o CPT. La sangre almacenada en tubos de EDTA se centrifugaba para aislar el plasma, que se congelaba rápidamente. La sangre en los tubos CPT se procesó para PBMC utilizando un protocolo modificado proporcionado por el proveedor del tubo CPT.
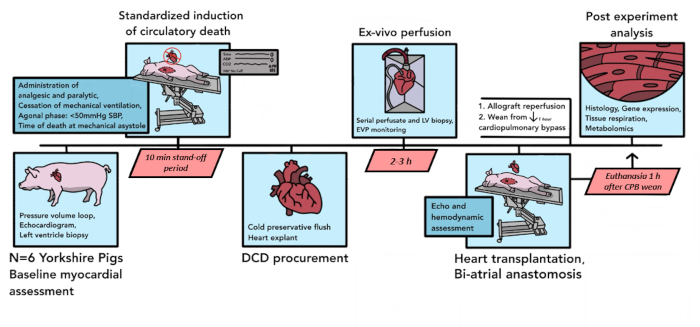
Figura 1: Esquema del protocolo DCD HT porcino. Aquí se muestra la línea de tiempo de los eventos que ocurren en el procedimiento de TR de DCD porcino. En este estudio piloto se realizaron 6 TDC HT. Se realizan evaluaciones miocárdicas basales en el aloinjerto cardíaco del cerdo donante, después de lo cual comienza la muerte circulatoria controlada. Después de la declaración de muerte, hay un período de enfrentamiento de 10 minutos. A continuación, el aloinjerto se explanta y se transporta al dispositivo de perfusión ex vivo , donde se reperfunde durante 2-3 h. Tras la preparación del animal receptor, se implanta el aloinjerto donante con una técnica biauricular. Después de 1 h de reperfusión en CPB, el receptor es destetado del soporte de bypass. La eutanasia ocurre 1 h después de la separación de la CEC. A continuación, el aloinjerto implantado se procesa para el análisis de tejidos. DCD HT = trasplante de corazón después de la donación después de la muerte circulatoria; CPB = bypass cardiopulmonar. Haga clic aquí para ver una versión más grande de esta figura.
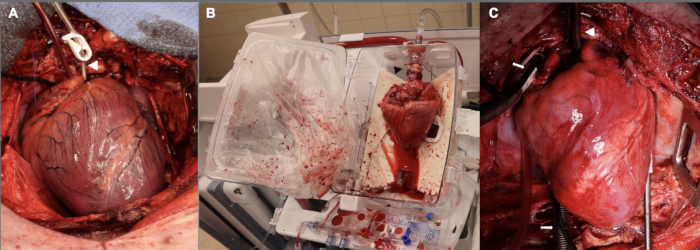
Figura 2: Aloinjerto cardíaco porcino en diferentes etapas a lo largo del proceso de DCD OHT. (A) Después de la muerte circulatoria controlada, el aloinjerto del donante está distendido, isquémico y edematoso. La punta de flecha blanca muestra la cánula de la raíz aórtica. (B) Una vez que el aloinjerto se explanta del donante, se coloca en el dispositivo EVP para su perfusión ex vivo . Nótese la orientación del corazón, con la cara posterior hacia fuera. La punta de flecha negra apunta al adaptador aórtico utilizado para conectar el aloinjerto al dispositivo. (C) Después de la implantación en el receptor, el aloinjerto se reperfunde en un bypass cardiopulmonar durante una hora antes del destete de la CEC. La punta de flecha blanca muestra la cánula aórtica; Las flechas blancas señalan las cánulas venosas bicavas. EVP = perfusión ex vivo ; CPB = bypass cardiopulmonar. Haga clic aquí para ver una versión más grande de esta figura.
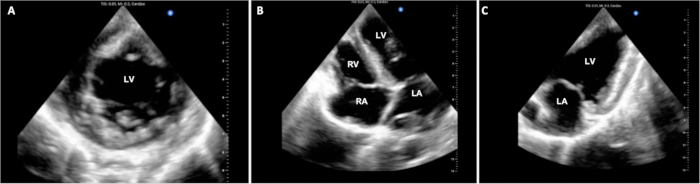
Figura 3: Ecocardiografía epicárdica cardíaca. A lo largo del procedimiento de DCD OHT, se adquirieron múltiples imágenes ecocardiográficas epicárdicas para evaluar la función ventricular. Aquí se muestran las vistas estándar de eje corto, (B) de 4 cámaras y (C) de 2 cámaras. VI = ventrículo izquierdo; LA = aurícula izquierda; VD = ventrículo derecho; RA = aurícula derecha. Haga clic aquí para ver una versión más grande de esta figura.
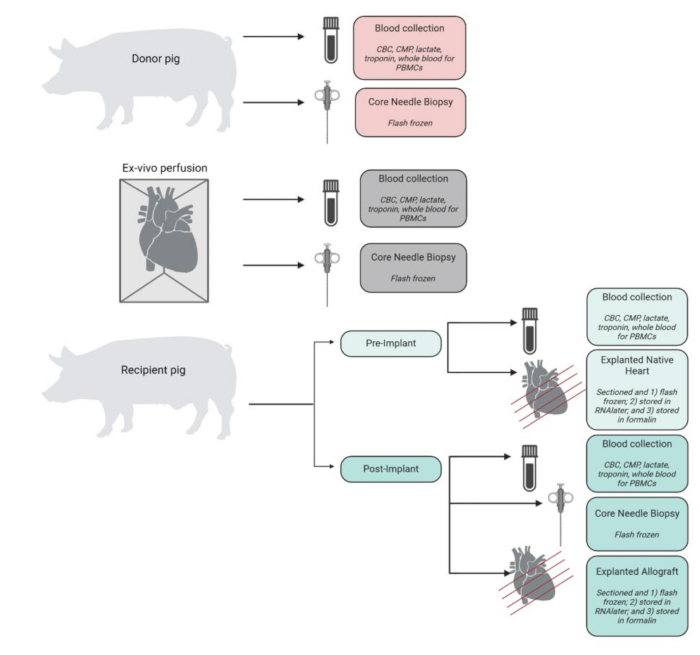
Figura 4: Flujo de trabajo de recolección y procesamiento de muestras. Esquema de la recolección y procesamiento de muestras en cada paso del procedimiento. Hemograma completo = hemograma completo; CMP = panel metabólico completo; PBMC = células mononucleares de sangre periférica. Figura creada en BioRender. Haga clic aquí para ver una versión más grande de esta figura.
| Duración del tiempo (min) | |
| (media ± DE; n = 4) | |
| Tiempo transcurrido desde el cese de la ventilación hasta la declaración de fallecimiento | 14.25 (2.6) |
| Duración de la perfusión ex vivo | 147 (18) |
| Duración del CPB | 174 (4) |
| Tiempo de sujeción cruzada | 90 (12.5) |
| Tiempo desde el destete hasta la muerte por CPB | 50 (37) |
Tabla 1. Información procedimental. La duración promedio de cada paso crítico en el procedimiento DCD HT. CPB = bypass cardiopulmonar.
Discusión
A pesar de la eficacia del trasplante cardíaco para el tratamiento de la insuficiencia cardíaca terminal, persisten desafíos significativos en este campo. Para combatir la disponibilidad limitada de órganos de donantes, los avances en los métodos de preservación de aloinjertos cardíacos (por ejemplo, la perfusión con máquina normotérmica) han pasado a primer plano en los últimos años. Estos avances condujeron a la adopción del trasplante de aloinjertos cardíacos después de la donación después de la muerte circulatoria (TDC). Si bien la utilización de aloinjertos de DCD HT amplió el grupo de donantes y tiene resultados a corto plazo que no son inferiores a los aloinjertos de DBD HT, sigue habiendo un riesgo de aproximadamente 5% de mortalidad peritrasplante temprana asociada con ambos tipos de donantes3. El riesgo de mortalidad precoz en el trasplante de corazón está impulsado principalmente por el DGP. Si bien el DGP es multifactorial en su etiología, con alguna contribución de variables definidas del donante, el receptor y la preservación, los mecanismos moleculares que subyacen al DGP siguen siendo generalmente poco conocidos. Además, dada la lesión isquémica caliente añadida provocada por el proceso de DCD HT, no es sorprendente que estos corazones, en comparación con los aloinjertos de DBD, puedan tener un mayor riesgo de DGP. Por lo tanto, una mejor comprensión del DGP es importante para ayudar a reducir el riesgo de mortalidad a corto plazo después del trasplante de corazón ortotópico, y esto puede ser particularmente cierto para la DTC HT.
En este trabajo describimos un modelo quirúrgico porcino de alta fidelidad de DCD HT. Los beneficios de modelar DCD HT in vivo en un modelo animal grande incluyen no solo la capacidad de comprender mejor los cambios fisiopatológicos que ocurren en un aloinjerto obtenido durante DCD HT, sino también la capacidad de probar intervenciones específicas destinadas a garantizar una calidad óptima del aloinjerto. La evaluación de la función ventricular izquierda post-implantación y el análisis del bucle presión-volumen sugieren que este modelo quirúrgico porcino es capaz de recapitular la disfunción temprana del aloinjerto cardíaco después de la TH con DCD. Por lo tanto, la técnica detallada aquí crea un modelo animal grande reproducible de DGP después de la TH con DCD y es susceptible de evaluar estrategias terapéuticas en muchos puntos a lo largo del proceso de la HTA con DCD. De hecho, el uso de la perfusión ex vivo como medio para administrar terapias novedosas, como la terapia génica mediada por vectores virales, es un área activa de enfoque en nuestro laboratorio y en otros 18,19,20. Anteriormente demostramos la capacidad de administrar de manera robusta y homogénea un transgén a un aloinjerto cardíaco utilizando un modelo de HT porcino no DCD; las mismas técnicas se pueden aplicar a un modelo DCD HT19,20. Otras posibles estrategias terapéuticas incluyen la modificación química del perfuso, la administración de moléculas pequeñas dirigidas a disminuir el estrés oxidativo, el suministro de sustratos metabólicos para apoyar el metabolismo durante el período isquémico, etc. 16,21,22. Además, el modelo que se presenta en este trabajo puede adaptarse fácilmente para evaluar diferentes variables asociadas a la TH con DCD, incluyendo las diferentes técnicas de obtención utilizadas clínicamente. Por ejemplo, describimos una estrategia de adquisición directa y perfusión ex vivo; Sin embargo, el modelo puede adaptarse fácilmente para incorporar métodos alternativos de perfusión por procuración, incluida la perfusión regional normotérmica.
La técnica quirúrgica empleada en este modelo se asemeja mucho a la utilizada en el ámbito clínico; Sin embargo, hay algunas diferencias clave. En primer lugar, la esternotomía y la exposición cardíaca ocurren antes del cese del soporte cardiopulmonar, la fase agónica, la determinación de la muerte y el período de espera éticamente exigido (modelo de tórax abierto)23. La esternotomía se realiza en este orden para que se pueda realizar una evaluación inicial del corazón del donante, incluidas las biopsias miocárdicas. La evaluación previa del momento de la esternotomía en un modelo porcino con TH con DCD demostró que la progresión desde la retirada de las medidas de soporte vital hasta la muerte (tiempo isquémico cálido) es más rápida y acompaña a cambios hemodinámicos menos pronunciados en el modelo de tórax abierto; Estos aloinjertos pueden experimentar condiciones menos dañinas durante la adquisición. Sin embargo, no hubo diferencias significativas en los valores de laboratorio bioquímicos (lactato, glucosa, catecolaminas, etc.) ni en los marcadores de muerte celular entre los grupos de tórax cerrado y abierto24. Además, debido a la inclusión del período de separación de 10 minutos en el modelo, el tiempo desde la retirada de la ventilación hasta la isquemia caliente funcional en este modelo se asemeja más al tiempo del grupo de tórax cerrado del estudio citado. Además, dentro de este modelo, el tiempo de isquemia caliente funcional es una variable que puede modificarse para adaptarse a los objetivos experimentales de un estudio en particular. Otra diferencia potencial entre el modelo reportado aquí y el entorno clínico es que la actividad eléctrica sin pulso (PEA; asistolia mecánica) se utiliza para definir la muerte en este modelo. En el contexto clínico, la declaración de muerte la realiza un médico que no participa en el proceso de trasplante; la PEA, junto con la ausencia de otros signos de vida o asistolia eléctrica, sería aceptable para cumplir con los criterios para la declaración de defunción. Los corazones porcinos mantuvieron la actividad eléctrica durante un período prolongado después del cese de la contractilidad. Con el fin de evitar el daño isquémico caliente que no es proporcional al observado en el contexto clínico, se utilizó la asistolia mecánica (PEA) para definir la muerte. Para los investigadores que utilizan un modelo de tórax cerrado de DCD, la actividad eléctrica sin pulso (falta de pulsatilidad en la línea arterial) aún se puede usar como criterio definitorio de la muerte. No encontramos que la saturación periférica de oxígeno fuera un marcador relevante para definir el inicio del período agónico o para definir la muerte.
Por último, lo que hemos descrito aquí es un modelo que requiere mucho tiempo y recursos. Desde la preparación del cerdo donante hasta la muerte del animal receptor transcurren aproximadamente 10 h y requieren un gran esfuerzo colaborativo. El equipo de procedimientos incluye cirujanos cardíacos experimentados, anestesiólogos cardíacos, perfusionistas y personal veterinario y de laboratorio que ayudan con la recolección y el procesamiento de muestras. Un equipo grande como este es integral durante el complejo procedimiento de DCD HT. Sin embargo, con un equipo experimentado, es posible la creación de un modelo porcino de alta fidelidad de DCD HT, como se describe en este manuscrito.
Divulgaciones
CAM ha recibido una compensación en acciones por servir como consultor para TransMedics Inc.
Agradecimientos
Agradecemos el apoyo técnico veterinario de Duke Laboratory Animal Resources, el apoyo de perfusión de Centrifugal Solutions y los equipos de anestesia cardiovascular de Duke por su invaluable apoyo en estos experimentos quirúrgicos. También agradecemos sinceramente a Paul Lezberg y TransMedics, Inc. por su apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
Referencias
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados