Method Article
Un modello suino ad alta fedeltà di trapianto di cuore ortotopico dopo donazione dopo morte circolatoria
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il protocollo qui descrive un modello suino ad alta fedeltà di trapianto di cuore dopo la donazione dopo la morte circolatoria utilizzando la perfusione ex vivo dell'allotrapianto.
Abstract
Il numero di pazienti con insufficienza cardiaca avanzata che possono ricevere un trapianto di cuore è limitato dalla carenza di donatori di organi idonei. Nel tentativo di espandere il pool di donatori, sono stati sviluppati metodi alternativi di donazione e approvvigionamento, tra cui il trapianto di cuore dopo la donazione dopo la morte circolatoria (DCD HT). Sebbene la sopravvivenza a breve termine dopo DCD HT non sia inferiore al trapianto di cuore con donatori cerebralmente morti, potrebbe esserci un aumento del tasso di disfunzione primaria del trapianto (PGD) associata agli allotrapianti di DCD HT. L'eziologia alla base della PGD è multifattoriale e non è completamente compresa. Per gli allotrapianti di DCD HT, il periodo di danno ischemico caldo durante l'approvvigionamento di DCD è un potenziale fattore di rischio per la PGD a cui gli allotrapianti di morte cerebrale non sono esposti. Il tempo ischemico caldo funzionale può quindi essere un fattore importante della PGD nella DCD HT. Tuttavia, i meccanismi alla base della PGD in questo scenario clinico sono scarsamente compresi a livello molecolare. Il lavoro qui presentato mira a descrivere lo sviluppo e la validazione di un modello suino ad alta fedeltà non sopravvivenza di trapianto di cuore ortotopico DCD. Ipotizziamo che l'uso di questo modello traslazionale di grandi dimensioni animali sia fondamentale per chiarire i meccanismi molecolari che contribuiscono alla PGD, nonché per studiare interventi progettati per ottimizzare la conservazione dell'allotrapianto e le prestazioni precoci. Questo modello replica clinicamente l'approccio perioperatorio e chirurgico utilizzato nella DCD HT, con modifiche per tenere conto dell'anatomia e della fisiologia dei suini. Lo sviluppo di questo modello chirurgico animale di grandi dimensioni non solo fornirà informazioni meccanicistiche sullo sviluppo della PGD, ma può anche essere modificato per migliorare gli sforzi di ricerca traslazionale volti a migliorare il recupero degli organi dopo la DCD HT.
Introduzione
Per i pazienti con insufficienza cardiaca terminale refrattaria alla gestione medica, il trapianto di cuore rimane la terapia associata alla migliore sopravvivenza a lungo termine e alla migliore qualità della vita. Storicamente, il trapianto di cuore richiedeva l'uso di un allotrapianto di cuore prelevato da un donatore cerebralmente morto (DBD HT) e trasportato mentre era conservato con conservazione statica ipotermica. Tuttavia, il numero di pazienti che richiedono un trapianto di cuore supera il numero di donatori disponibili. Sebbene ogni anno vengano eseguiti più di 5.000 trapianti di cuore in tutto il mondo, si stima che 50.000 candidati siano in attesa di un trapianto dicuore1. Inoltre, l'utilizzo di organi da donatori identificati rimane al di sotto del 30%2. Al fine di migliorare l'utilizzo degli organi da parte dei donatori, negli ultimi anni sono stati sviluppati metodi alternativi di donazione e approvvigionamento, tra cui il trapianto di cuore a seguito di donazione dopo morte circolatoria (DCD HT)3,4,5,6.
I donatori di DCD HT non soddisfano i criteri formali di morte cerebrale, ma hanno una lesione neurologica non recuperabile per la quale le cure mediche in corso sono ritenute inutili. Durante l'approvvigionamento di DCD HT, le misure di sostegno vitale vengono sospese e il paziente viene monitorato per la progressione verso l'apnea e l'arresto circolatorio. La morte in queste situazioni è dichiarata da un medico che non partecipa al processo di trapianto o di prelievo degli organi. Una volta che il decesso è stato dichiarato, c'è un ulteriore periodo di stallo (di solito 5 minuti) in cui il potenziale donatore viene osservato per assicurarsi che non vi siano recuperi o segni di vita, dopodiché la dichiarazione di morte viene riconfermata prima di procedere con il prelievo di organi 7,8. Gli allotrapianti di DCD sono, quindi, esposti a un periodo variabile di ischemia calda (almeno 10 minuti) a cui gli allotrapianti di donatori DBD non sono esposti. Questo periodo di ischemia calda ha precedentemente scoraggiato l'uso del trapianto di cuore con donatori di DCD. Tuttavia, negli ultimi cinque anni, sono stati sviluppati due metodi di riperfusione per il recupero dell'allotrapianto dopo il tempo ischemico caldo associato alla DCD. In primo luogo, l'approvvigionamento diretto e la perfusione (DPP) comportano la cardiectomia del donatore dopo la conferma della morte circolatoria, seguita dalla rianimazione con allotrapianto e dalla conservazione mediante perfusione ex vivo. In alternativa, la perfusione regionale normotermica (NRP) utilizza la circolazione extracorporea con l'esclusione della circolazione cerebrale per riperfondere e rianimare il cuore del donatore in situ prima della cardiectomia 9,10,11,12.
Finora, la sopravvivenza a breve termine associata alla DCD HT è stata simile a quella osservata con la DBD HT. Tuttavia, i primi studi suggeriscono anche che esiste un rischio maggiore di grave disfunzione primaria del trapianto (PGD) con DCD HT rispetto a DBD HT3. La PGD è un termine usato per descrivere la circostanza clinica in cui, dopo il trapianto di cuore, la funzione precoce dell'allotrapianto è insufficiente a soddisfare le esigenze circolatorie del ricevente. Un sistema per classificare la gravità della PGD è stato descritto dalla Società Internazionale di Trapianto di Cuore e Polmone. Nella PGD grave, è necessario un supporto circolatorio meccanico per supportare un'adeguata circolazione nel periodo post-trapianto13. Questa condizione è il principale fattore di mortalità postoperatoria precoce dopo il trapianto di cuore. L'eziologia della PGD sia per la DBD HT che per la DCD HT è poco conosciuta, ma è probabilmente multifattoriale, con le variabili del donatore, della conservazione e del ricevente che contribuiscono. Per gli allotrapianti di DCD, il danno ischemico caldo durante l'approvvigionamento di DCD, così come le risposte deleterie specifiche del donatore, tra cui instabilità emodinamica, squilibri metabolici e picchi di catecolamine, citochine, lattato e potassio, sono fattori proposti che possono contribuire ad un aumento del rischio di PGD rispetto agli allotrapianti DBD. 14,15,16. Tuttavia, i meccanismi alla base della PGD in questo scenario clinico sono scarsamente compresi a livello molecolare. Inoltre, forse a causa di queste preoccupazioni, i cuori DCD hanno 3,37 volte più probabilità di essere declinati rispetto agli organi DBD17. Di conseguenza, c'è ancora un'esigenza insoddisfatta di migliorare l'utilizzo degli organi e migliorare i risultati dei trapianti ottimizzando il processo di conservazione degli organi.
In questo studio, descriviamo un DCD HT suino utilizzando DPP che rispecchia l'attuale DPP DCD HT clinico con alta fedeltà. Questo modello include elementi durante tutto il processo di trapianto di DCD: 1) approvvigionamento di DCD, 2) conservazione della perfusione ex vivo con un sistema di cura degli organi (OCS) e 3) impianto del ricevente. Questo modello completo offre l'opportunità di caratterizzare meglio i meccanismi alla base della PGD nella DCD HT. Ciò consente quindi lo sviluppo di strategie terapeutiche mirate e razionali volte a migliorare la conservazione e le prestazioni dell'allotrapianto. Inoltre, questo modello fornisce una piattaforma per la valutazione preclinica di tali nuove terapie, che saranno importanti per aiutare a far progredire il campo del trapianto di cuore in modo sicuro e rapido.
Protocollo
Tutti gli allevamenti e le procedure sono stati approvati dal Comitato istituzionale per la cura e l'uso degli animali del Duke University Medical Center, in linea con i loro regolamenti e linee guida.
1. Preparazione preoperatoria del donatore
- Selezionare due suini Yorkshire con gruppo sanguigno corrispondente del peso di 70-80 kg (gruppo sanguigno eseguito da Looper Farms a Granite Falls, NC, USA). Digiunare entrambi i suini per un minimo di 6-8 ore prima dell'intervento.
- Preparare il modulo di perfusione cardiaca secondo le linee guida del produttore e i necessari test point-of-care (Tabella dei materiali).
- Preparare la soluzione di manutenzione per il modulo di perfusione cardiaca. Questa soluzione contiene sostanze nutritive per il cuore metabolicamente attivo, oltre all'adenosina, per aiutare a mantenere la pressione sanguigna target.
- Aggiungere quanto segue: 500 mL di soluzione di priming trasparente, 100 mL di albumina al 25%, 100 mg di ciprofloxacina (200 mg/100 mL), due fiale da 5 mL di iniezione multivitaminica, 20 mEq di bicarbonato di sodio, 1 g di cefazolina sodica e 250 mg di metilprednisolone. Addizionare la soluzione di adescamento e aggiungere il contenuto al modulo di perfusione cardiaca.
- Una volta preparata, iniettare 50 UI di insulina umana ricombinante nella sacca.
- Preparare una soluzione di epinefrina iniettando 0,25 mg di epinefrina e 30 UI di insulina umana ricombinante in una sacca da 500 ml di destrosio al 5% in acqua. Questa soluzione ha lo scopo di sostituire le catecolamine piuttosto che avere un effetto inotropo. Infondere la soluzione a 10 mL/h.
- Preparare la soluzione T4 iniettando 200 μg di levotiroxina ricostituita in una sacca da 100 mL di soluzione fisiologica normale allo 0,9%. Infondere a una velocità di 3 mL/h.
- Preparare la soluzione di manutenzione per il modulo di perfusione cardiaca. Questa soluzione contiene sostanze nutritive per il cuore metabolicamente attivo, oltre all'adenosina, per aiutare a mantenere la pressione sanguigna target.
- Sedare il suino donatore designato con 4,4 mg/kg di telazol e 1,0 mg/kg di propofol seguiti da isoflurano inalato al 2%-5% somministrato tramite maschera facciale.
- Mentre il maiale è in posizione supina, intubare con un tubo endotracheale da 8-10 mm per il mantenimento delle vie aeree durante l'intervento chirurgico. Fissare il tubo endotracheale in posizione al muso. Applicare un unguento veterinario sugli occhi per mantenere la lubrificazione oculare durante l'intervento chirurgico.
- Inserire un catetere endovenoso (IV) in una vena dell'orecchio per somministrare fluidi EV (fluidi di mantenimento: soluzione di Ringer lattato 10 ml/kg/h).
- Iniziare l'infusione continua di fentanil per analgesia (25-100 μg/h) e somministrare 0,2 mg/kg di vecuronio per mantenere la paralisi.
- Posizionare elettrocardiogramma e pulsossimetro per il monitoraggio continuo dell'attività elettrica e dell'ossigenazione.
- Iniziare la ventilazione meccanica a un volume corrente di 10 ml/kg/min, una velocità di 10-15 respiri al minuto e con il mantenimento di isoflurano (1%-5%) per il resto della procedura. Titola gli anestetici e i farmaci vasoattivi in modo tale che i riflessi siano assenti, la frequenza cardiaca rimanga di 61-99 bpm e la pressione arteriosa sistolica rimanga di 90-130 mmHg.
- Posizionare il maiale sul tavolo operatorio con gli arti superiori posizionati cefalicamente e fissati al di fuori del campo operatorio. Fissare gli arti inferiori al di fuori del campo operatorio.
- Definire l'area da includere nel campo operatorio con la guancia superiormente, la linea ascellare anteriore bilateralmente e due dita sotto il processo xifoideo inferiormente. Preparare e drappeggiare il sito chirurgico in modo asettico, seguendo le pratiche standard.
- Eseguire un taglio carotideo destro.
- Usando una lama #10, praticare un'incisione obliqua del collo laterale destro, due dita di larghezza laterale alla trachea, lungo il bordo mediale del muscolo sternocleidomastoideo.
- Eseguire questa incisione attraverso il platisma con l'elettrocauterizzazione, garantendo l'emostasi. Una volta attraversato il platisma, utilizzare un divaricatore autobloccante per facilitare l'esposizione.
- Sezionare e isolare con cura l'arteria carotide e la vena giugulare interna; Posiziona un anello attorno a ciascun recipiente.
- Applicare 10 ml di lidocaina al 2% per via topica per bagnare i vasi.
NOTA: La lidocaina viene utilizzata per i suoi effetti vasodilatatori, poiché i vasi suini si spasimano facilmente con la manipolazione e possono diventare difficili da incannulare. - Utilizzando la tecnica di Seldinger, incannulare direttamente l'arteria carotide con una micropuntura da 5 Fr, seguita da una guaina introduttrice da 6 Fr.
- Collegare la guaina dell'introduttore a una linea arteriosa e a un trasduttore per il monitoraggio continuo della pressione arteriosa sistemica durante la procedura.
- Prelevare il sangue dalla linea arteriosa dell'arteria carotide per le analisi di laboratorio preoperatorie (emocromo completo, pannello metabolico completo, troponina, lattato e sangue intero per l'isolamento delle cellule mononucleate del sangue periferico).
- Incannulare la vena giugulare interna utilizzando la stessa tecnica di 1.11.5. Lasciare la guaina da 6 Fr in posizione, poiché verrà utilizzata per introdurre un catetere ad ansa pressione-volume per le valutazioni funzionali a valle.
2. Donazione dopo morte circolatoria e cardiectomia da donatore
- Eseguire una sternotomia.
- Utilizzando una lama #10, praticare un'incisione longitudinale dalla tacca sternale al processo xifoideo. Utilizzando l'elettrocauterizzazione, portare la dissezione verso il basso attraverso il tessuto sottocutaneo e la fascia del muscolo pettorale.
- Incidere la linea mediana dello sterno con l'elettrocauterizzazione. Sezionare gli attacchi legamentosi al manubrio e intorno al processo xifoideo.
- Utilizzare una sega sternale oscillante per dividere accuratamente la tavola anteriore dello sterno lungo la linea mediana. Utilizzare la sega oscillante per dividere completamente la tavola posteriore dello sterno a livello del manubrio. Fare attenzione a evitare lesioni alla vena anonima in questa fase. Completa la divisione sternale della tavola posteriore sotto il manubrio usando un paio di forbici pesanti.
NOTA: La dissezione manuale del piano tra la parte inferiore dello sterno e il pericardio può aiutare a evitare lesioni al cuore durante questa fase. - Utilizzare l'elettrocauterizzazione per ottenere l'emostasi dei bordi sternali. Posizionare un divaricatore sternale.
- Rimuovere il tessuto adiposo timico e pericardico con l'elettrocauterizzazione per ottimizzare l'esposizione del pericardio.
- Aprire con cautela il pericardio con l'elettrocauterizzazione. Portare l'incisione longitudinalmente dall'apice del cuore al livello dell'aorta.
- Creare un pozzetto pericardico con 2-0 punti di stecca in seta.
- Eseguire analisi di base dell'allotrapianto del donatore.
- Mentre il cuore del donatore è esposto e prima di qualsiasi manipolazione cardiaca diretta, eseguire analisi di base. Questi includono l'ecocardiografia epicardica diretta, la valutazione dell'ansa pressione-volume e le biopsie con ago del nucleo miocardico.
- Eseguire l'ecocardiografia in modo sterile per ottenere viste standard dell'asse lungo e corto direttamente dalla superficie epicardica.
- Per condurre registrazioni del loop pressione-volume, introdurre un catetere pressione-volume a stato solido (5Fr, 122 cm) in sequenza nell'arteria carotide e nella vena giugulare interna rispettivamente nei ventricoli sinistro e destro.
- Misurare la lunghezza del catetere da introdurre esternamente (dal sito di incannulamento all'apice del cuore) prima dell'inserimento nella guaina.
- Introdurre il catetere nella guaina arteriosa, guidandolo nel ventricolo sinistro mediante ecografia epicardica. Assicurarsi che il catetere non tocchi direttamente una parete ventricolare, poiché ciò potrebbe interferire con l'accuratezza della misurazione.
- Successivamente, introdurre il catetere nella guaina venosa, guidandolo nel ventricolo destro, utilizzando la palpazione diretta o la guida ecografica epicardica.
- Eseguire biopsie miocardiche con ago centrale per raccogliere il tessuto per analisi successive. Esegui questa operazione all'apice del ventricolo sinistro. Se c'è un sanguinamento significativo dal sito della biopsia, posizionare un punto di riparazione.
- Prepara il cuore del donatore.
- Sezionare la finestra aortopolmonare per lasciare spazio per il posizionamento del morsetto a croce.
- Sezionare circonferenzialmente la vena cava superiore (SVC) e la vena cava inferiore (IVC) con elettrocauterizzazione.
- Per l'anticoagulazione, somministrare 300 unità/kg di eparina per via endovenosa (IV) prima dell'incannulamento aortico.
- Utilizzare una sutura in polipropilene 4-0 a doppio braccio per posizionare un cordino della borsa aortica nella radice aortica per l'incannulamento aortico. Cannulare con cannula di sfiato della radice aortica da 7 Fr (14G).
- Sganciare l'aria e fissarlo in posizione con un laccio emostatico Rumel. Sciacquare il tubo della cardioplegia per disarieggiare e fissare la linea alla cannula della radice aortica.
- Successivamente, per prepararsi alla futura incannulamento venoso, posizionare un punto di sutura del cordino della borsa nell'appendice atriale destra e fissarlo con un laccio emostatico Rumel.
- Eseguire la morte circolatoria controllata.
- Fornire 250 μg di fentanil in bolo EV seguito da infusione a velocità continua (CRI) a 100 μg/h per l'analgesia. Per paralizzare, somministrare 0,2 mg/kg di vecuronio per via endovenosa.
- Interrompere la ventilazione meccanica per iniziare il processo di morte circolatoria controllata.
- Monitorare continuamente la pressione arteriosa sistolica e media, la pulsatilità della linea arteriosa, l'attività cardiaca elettrica e lo stato di ossigenazione.
NOTA: La fase agonale inizia quando la pressione arteriosa sistolica scende al di sotto di 50 mmHg. A questo punto, il cuore può dilatarsi. La morte è definita dall'asistolia meccanica (attività elettrica senza polso) e dall'assenza di segni di vita. Questo studio non definisce la morte per asistolia elettrica in questo modello, poiché l'attività elettrica lenta senza polso persiste nei suini per un periodo di tempo più lungo di quello osservato nell'uomo, il che può comportare un aumento dell'insulto ischemico dell'allotrapianto rispetto a quanto previsto per il modello. - Attendere 10 minuti dopo l'ora della morte/asistolia prima di procedere con i passaggi successivi del protocollo. Questo intervallo simula il periodo di standoff più il tempo necessario per l'ingresso e la preparazione del mediastino nella DCD HT clinica.
- Eseguire l'adescamento del dispositivo di perfusione ex vivo .
- Con una lama #11, praticare un'incisione con pugnalata nell'appendice atriale destra e incannulare con la cannula venosa da 34Fr fornita dal produttore. Fissare la cannula con un laccio emostatico Rumel e collegare la cannula alla sacca di raccolta del dispositivo di perfusione ex vivo .
- Raccogliere circa 1200-1500 ml di sangue di donatore nella sacca di raccolta fornita dal produttore. Prima del dissanguamento, 30.000 U di eparina e 2 mg di tirofiban HCl saranno stati aggiunti alla sacca di raccolta.
- Filtrare il sangue del donatore e consegnarlo al modulo di perfusione cardiaca.
- Eseguire la cardiectomia del donatore.
- Dopo il prelievo del sangue del donatore, applicare la pinza a croce aortica.
- Si noti che la radice aortica suina e l'aorta ascendente sono considerevolmente più corte rispetto all'uomo. Fare attenzione ad applicare il morsetto a croce il più prossimalmente possibile per evitare di bloccare l'arco o di occludere in modo incompleto l'aorta.
- Somministrare 1 L di cardioplegia di Del Nido nella radice aortica, mirando a una pressione radicolare di 60-100 mmHg.
- Sezionare la vena cava inferiore in corrispondenza della riflessione pericardica e l'appendice atriale sinistra per sfiatare i ventricoli destro e sinistro durante il parto della cardioplegia.
- Posizionare una graniglia sterile fredda sul cuore del donatore.
- Dividi l'IVC, la SVC, l'aorta appena distalmente all'arteria anonima e l'arteria polmonare (PA) alla biforcazione. Sezionare l'atrio sinistro del donatore (LA), lasciando una cuffia di tessuto sufficiente sull'allotrapianto.
- Togliete il cuore dal campo e mettetelo in una bacinella piena di granita sterile e fredda per la preparazione del sottotavola.
- Posizionare quattro suture orizzontali equidistanti (polipropilene 4-0) all'interno dell'estremità distale dell'aorta.
- Dopo il prelievo del sangue del donatore, applicare la pinza a croce aortica.
- Perfusione ex vivo
- Posizionare l'adattatore aortico di perfusione ex vivo nell'aorta distale e fissarlo saldamente con una sutura di seta 0-0 o un nastro ombelicale posizionato appena sotto le suture impegnate.
- Lasciare il PA, l'SVC, l'IVC e l'atrio sinistro aperti mentre si è sul dispositivo di perfusione ex vivo .
NOTA: Con questa configurazione, non è stata riscontrata alcuna distensione ventricolare sinistra. - Trasportare l'allotrapianto al dispositivo di perfusione ex vivo e collegare l'adattatore aortico. Assicurarsi che la superficie posteriore del cuore sia rivolta anteriormente. Assicurarsi che la superficie anteriore del cuore sia a contatto con il dispositivo e due elettrodi di defibrillazione. Mantenere l'allotrapianto a 34 °C. Defibrillare secondo necessità per ripristinare l'eventuale aritmia ventricolare a un ritmo organizzato.
- A questo punto, una terapia potrebbe essere introdotta nel circuito di perfusione ex-vivo attraverso la porta della cardioplegia. In alternativa, il perfusato o il circuito fisico possono essere modificati per valutare le condizioni sperimentali volte a migliorare il recupero di un allotrapianto di DCD HT. Ad esempio, abbiamo precedentemente dimostrato che il perfusato deve essere lavato con anticorpi neutralizzanti preformati tramite un salvatore di cellule per migliorare la trasduzione con vettori virali 18,19,20.
- Utilizzare i laboratori point-of-care per guidare la somministrazione di bicarbonato di sodio, gluconato di calcio e destrosio, se necessario.
- Ottenere campioni di perfusato, analisi del sangue e campioni di biopsia con ago centrale durante questa fase di perfusione ex vivo .
NOTA: In questo modello, l'allotrapianto rimane sul dispositivo di perfusione ex vivo per circa 2-3 ore prima dell'impianto nel ricevente (Tabella 1). Il periodo di tempo in cui l'allotrapianto è stato perfuso ex vivo è stato determinato dal tempo necessario per preparare l'animale ricevente per l'impianto. Tuttavia, il tempo di perfusione ex vivo è una variabile che può essere regolata in base agli obiettivi dello studio.
3. Cardioctomia, impianto e riperfusione del ricevente
- Preparare il maiale ricevente come descritto nei passaggi 1.3-1.11.8.
- Inoltre, posizionare un catetere della linea centrale a triplo lume da 7 Fr 20 cm nella vena giugulare esterna o interna sinistra utilizzando la guida ecografica e la tecnica di Seldinger. Posizionare una linea arteriosa femorale di 5 Fr utilizzando la guida ecografica.
- Dopo aver drappeggiato il campo sterile, preparare il circuito di bypass cardiopolmonare (CPB) e portare le linee sul campo.
- Ricircolare attraverso le linee arteriose e venose del CPB per disaerare. Blocca e dividi le linee. Preparare la linea venosa per l'incannulamento bicavale.
- Somministrare una dose preoperatoria di 1 g di metilprednisolone per affrontare eventuali risposte infiammatorie dovute a rigetto o ischemia, come viene fatto nel trapianto clinico di cuore presso l'istituto in cui viene eseguito questo studio.
- Eseguire un taglio della carotide destra e una sternotomia della linea mediana come descritto in precedenza nei passaggi 1.11 e 2.1.
- Eseguire la cardiectomia del ricevente.
- Sezionare la finestra aortopolmonare come prima. Sezionare la SVC e l'IVC e posizionare il nastro ombelicale circonferenziale attorno ai vasi.
- Prima dell'incannulamento, somministrare 400 unità/kg di eparina. Titolare fino a un obiettivo di tempo di coagulazione attivato (ACT) > 480 s.
- Posizionare un punto standard per il cordino della borsa per incannulamento aortico nell'aorta ascendente distale (utilizzando una sutura in poliestere intrecciata rivestita 2-0 a doppio braccio). Fissare con un laccio emostatico Rumel e un emostato.
- Assicurarsi che la pressione arteriosa sistolica sia inferiore a 120 mmHg. Usa una lama #11 per praticare un'incisione a tutto spessore all'interno del cordone della borsa. Cannulare l'aorta con una cannula da 15 Fr attraverso questa incisione. Fissare la cannula in posizione con un laccio emostatico Rumel.
- Bloccare la cannula aortica. Dopo aver sganciato la linea di bypass arterioso, collegare la cannula aortica al circuito CPB. Assicurarsi che non siano presenti bolle d'aria nella linea.
- Realizzare un altro cordino aortico e inserire la cannula di sfiato della radice aortica.
- Eseguire l'incannulamento venoso utilizzando una tecnica bicaval con cannule metalliche a punta retta ad angolo retto da 18-20 Fr sia nella SVC che nell'IVC, fissate con lacci emostatici Rummel. Quindi, collegare queste cannule all'arto venoso del circuito CPB.
- Avviare il CPB a un flusso target di 2,4 L/min/m2 e raffreddare a 32 °C. Titolare l'anestetico e i vasopressori per mantenere una pressione arteriosa media > 60 mmHg.
NOTA: Queste procedure vengono eseguite con anestesisti cardiotoracici certificati e perfusionisti certificati che monitorano e coordinano la gestione emodinamica durante il corso dell'esecuzione CPB. - Applicare il morsetto a croce aortica prossimale alla cannula aortica e procedere con una spiegazione del cuore nativo del ricevente. Lasciare intatte le cuffie atriali destra e sinistra sufficientemente grandi da facilitare una tecnica di impianto bi-atriale.
NOTA: In questo modello viene utilizzata la tecnica bi-atriale poiché la vascolarizzazione suina è molto delicata, il che rende le anastomosi vascolari IVC e SVC tecnicamente impegnative in una tecnica bicavale. - Sezionare l'aorta e l'AP il più vicino possibile alla radice per mantenere la massima lunghezza del vaso. Posizionare il cuore appena espiantato in soluzione salina tamponata con fosfato ghiacciato (PBS) per essere trasportato e processato in laboratorio.
- Eseguire l'impianto bi-atriale dell'allotrapianto ricevente.
- Raffreddare l'allotrapianto sul dispositivo di perfusione ex vivo secondo le istruzioni del produttore. Somministrare nuovamente 1 L di cardioplegia fredda Del Nido per l'arresto cardioplegico prima di rimuoverlo dal dispositivo.
- Scollegare l'adattatore aortico e trasportare il cuore in una bacinella di fanghiglia fredda e sterile sul tavolo posteriore.
- Ispezionare il cuore per verificare la presenza di eventuali corpi di fabbrica ovali (PFO) o siti di lesioni involontarie.
NOTA: È importante sottolineare che, nei suini, di solito c'è una vena sistemica che drena lungo il bordo atriale sinistro prima di drenare nell'atrio destro o nell'IVC. Questa vena può essere aperta nel processo di approvvigionamento e si deve prestare attenzione per assicurarsi che sia legata prima di procedere con l'impianto. - Taglia l'aorta fino al tessuto sano sotto il sito di fissaggio dell'adattatore.
- Usando le forbici Metzenbaum, tagliare l'apertura atriale sinistra in modo che corrisponda alle dimensioni del bracciale LA ricevente. Fai lo stesso con l'atrio destro.
- Iniziare l'anastomosi atriale sinistra in modo di corsa con la sutura Prolene 4-0 a doppio braccio. Continuare con le anastomosi PA destra, aortica e atriale destra, tutte completate con sutura continua 4-0 in prolene.
- Iniziare il riscaldamento alla normotermia (37 °C) prima di rimuovere la pinza aortica.
- Eseguire la riperfusione dell'allotrapianto e lo svezzamento dal CPB.
- Dopo aver completato tutte le anastomosi, rilasciare la pinza a croce aortica per riperfondere l'allotrapianto.
- Garantire l'emostasi di tutte le anastomosi.
- Attendere il ritorno del ritmo e della contrattilità nativi. Posizionare i fili di stimolazione epicardica e il ritmo a 100 bpm se la frequenza cardiaca dell'allotrapianto è <100 bpm.
- Dopo 60 minuti di riperfusione, tentare di svezzamento dal CPB. I riceventi sono supportati con 0,05 μg/kg/min di adrenalina e infusioni di vasopressore, se necessario, per mantenere una pressione arteriosa media (MAP) >65 mmHg.
- Esegui analisi come ecocardiografia, analisi del sangue, biopsie miocardiche e valutazione dell'ansa pressione-volume sia nei momenti di riperfusione precoce che tardiva.
4. Conclusione dell'esperimento ed eutanasia
NOTA: In questo studio, l'animale ricevente il trapianto è stato supportato per 1 ora dopo la separazione dal CPB.
- Al termine dell'esperimento, l'eutanasia viene eseguita tramite dissanguamento in anestesia.
- Espiantare l'allotrapianto trapiantato sezionando le linee di sutura lungo tutte le anastomosi. Fare attenzione a non includere alcun tessuto ricevente nativo con il campione di allotrapianto.
- Posizionare immediatamente l'allotrapianto in PBS ghiacciato e trasportarlo in laboratorio per la lavorazione e la conservazione.
Risultati
Un totale di 6 trapianti di DCD suina sono stati eseguiti per un'analisi pilota utilizzando il protocollo qui descritto. Nel corso di questi sei esperimenti pilota, i componenti del protocollo sono stati perfezionati per soddisfare meglio le esigenze del modello, migliorare la riproducibilità e tenere conto dei vincoli logistici. Il protocollo finale risultante, come scritto qui, è riassunto nella Figura 1.
A differenza del processo di morte circolatoria controllato dall'uomo, i cuori suini sottoposti a ischemia hanno sostenuto l'attività elettrica molto più a lungo del previsto, anche dopo la cessazione della contrattilità. Dopo il riconoscimento di questa differenza nel primo esperimento, l'asistolia elettrica è stata ritenuta inaffidabile come misura per la dichiarazione di morte. Al fine di evitare un danno caldo-ischemico all'allotrapianto sproporzionato rispetto a quello osservato nel contesto clinico, è stata utilizzata l'asistolia meccanica (attività elettrica senza polso) per determinare il momento della morte per le restanti procedure di trapianto.
Inoltre, il periodo di stallo era inizialmente di 15 minuti prima di procedere con la cardiectomia da donatore. Questo è stato utilizzato per i primi tre esperimenti del set pilota. Parte del razionale di questo periodo di ischemia calda di 15 minuti era che miravamo ad avere una lesione abbastanza grave da avere un grado di disfunzione del trapianto post-trapianto che sarebbe stato adatto per lo studio. Abbiamo scoperto che la disfunzione del trapianto in questi primi esperimenti era così grave che abbiamo avuto difficoltà a sostenere l'animale ricevente per un'ora dopo la separazione dal CPB, in modo tale che l'animale ricevente richiedeva alte dosi di supporto inotropo e pressore per soddisfare il punto temporale di 1 ora. Date queste difficoltà, abbiamo ridotto il periodo di danno caldo-ischemico a 10 minuti, che si avvicina più da vicino alla DCD HT clinica con perfusione ex vivo . La Figura 2 mostra immagini rappresentative dell'allotrapianto in questa fase, così come durante la perfusione ex vivo e dopo l'impianto. Infine, sono stati apportati aggiustamenti alla titolazione delle infusioni di vasopressori e inotropi nella fase post-svezzamento CPB per supportare il cuore appena trapiantato. La necessità di un team esperto con competenze specifiche in anestesiologia cardiovascolare per migliorare il successo in questa fase post-CPB non può essere sottolineata abbastanza.
I tempi operativi sono stati monitorati in 4 dei 6 esperimenti e sono riassunti nella Tabella 1. Nella fase di approvvigionamento DCD del protocollo, il tempo trascorso dalla cessazione delle misure di sostegno vitale nel suino donatore alla dichiarazione di morte è stato di 14,25 (+/- 2,6) min. Il tempo di bypass cardiopolmonare operativo e il tempo di cross-clamp sono rimasti costanti durante gli esperimenti pilota, rispettivamente a circa 3 ore e 1,5 ore. Gli esperimenti sono stati conclusi con l'eutanasia circa 1 ora dopo la separazione dal CPB. C'era variabilità nel grado di stabilità degli animali al momento dell'eutanasia. Alcuni animali hanno dimostrato una stabilità relativamente buona e solo una lieve disfunzione del trapianto, mentre altri hanno dimostrato una significativa instabilità emodinamica e una grave disfunzione del trapianto. I display rappresentativi dell'ecocardiografia sono mostrati nella Figura 3. Questa e altre valutazioni funzionali, come i loop PV, possono essere utilizzate per determinare le differenze nella funzione dell'allotrapianto rispetto al basale e prima e dopo l'introduzione di interventi terapeutici.
Nella Figura 4 viene visualizzato un riepilogo dei campioni raccolti, elaborati e conservati durante l'esperimento. I cuori espiantati sono stati immediatamente posti in PBS ghiacciato e conservati in laboratorio per analisi tissutali e molecolari. Il cuore nativo del ricevente è stato utilizzato come controllo, mentre l'allotrapianto trapiantato è stato conservato come tessuto sperimentale. I cuori sono stati tagliati in 4 sezioni trasversali dall'apice alla base. Da ciascuno di questi, campioni di tessuto rappresentativi di ciascuna camera (ventricolo sinistro, ventricolo destro, setto ed entrambi gli atri) sono stati congelati in azoto liquido e conservati a -80 °C per analisi future. Allo stesso modo, campioni di tessuto rappresentativi di ciascuno di questi livelli e camere sono stati incubati in RNAlater e congelati istantaneamente. Il campione di tessuto rimanente è stato conservato in formalina per l'analisi istopatologica. I campioni di sangue provenienti da qualsiasi momento sono stati ottenuti in duplicato e conservati in provette EDTA o CPT. Il sangue conservato nelle provette EDTA è stato centrifugato per isolare il plasma, che è stato congelato all'istante. Il sangue nelle provette CPT è stato processato per le PBMC utilizzando un protocollo modificato fornito dal fornitore delle provette CPT.
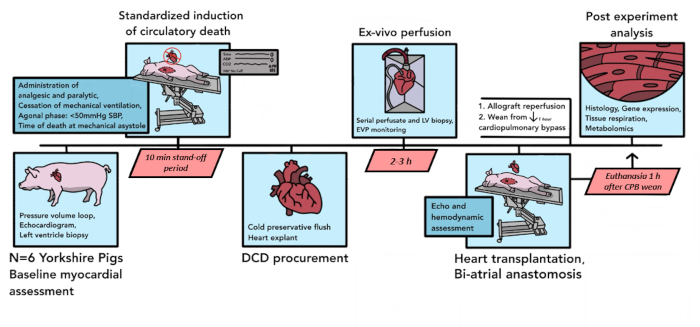
Figura 1: Schema del protocollo DCD HT suino. La cronologia degli eventi che si verificano nella procedura di DCD HT suina è illustrata qui. In questo studio pilota sono stati condotti 6 DCD HT. Le valutazioni miocardiche al basale vengono eseguite sull'allotrapianto di cuore di suino donatore, dopodiché inizia la morte circolatoria controllata. Dopo la dichiarazione di morte, c'è un periodo di stallo di 10 minuti. L'allotrapianto viene quindi espiantato e trasportato al dispositivo di perfusione ex vivo , dove viene riperfuso per 2-3 ore. Dopo la preparazione dell'animale ricevente, l'allotrapianto donatore viene impiantato con una tecnica biatriale. Dopo 1 ora di riperfusione su CPB, il ricevente viene svezzato dal supporto di bypass. L'eutanasia avviene 1 ora dopo la separazione dal CPB. L'allotrapianto impiantato viene quindi processato per l'analisi dei tessuti. DCD HT = trapianto di cuore a seguito di donazione dopo morte circolatoria; CPB = bypass cardiopolmonare. Clicca qui per visualizzare una versione più grande di questa figura.
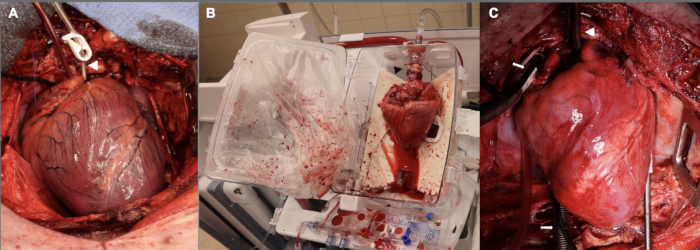
Figura 2: Allotrapianto cardiaco suino in diversi stadi lungo il processo DCD OHT. (A) Dopo la morte circolatoria controllata, l'allotrapianto del donatore è disteso, ischemico ed edematoso. La punta della freccia bianca mostra la cannula della radice aortica. (B) Una volta espiantato l'allotrapianto dal donatore, viene posizionato sul dispositivo EVP per la perfusione ex vivo . Notare l'orientamento del cuore, con l'aspetto posteriore rivolto verso l'esterno. La punta della freccia nera punta verso l'adattatore aortico utilizzato per collegare l'allotrapianto al dispositivo. (C) Dopo l'impianto nel ricevente, l'allotrapianto viene riperfuso con bypass cardiopolmonare per un'ora prima dello svezzamento dal CPB. La punta di freccia bianca mostra la cannula aortica; Le frecce bianche puntano verso le cannule venose bicavali. EVP = perfusione ex vivo ; CPB = bypass cardiopolmonare. Clicca qui per visualizzare una versione più grande di questa figura.
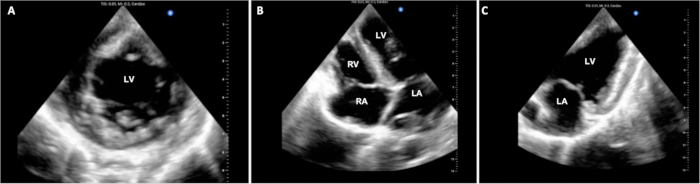
Figura 3: Ecocardiografia epicardica cardiaca. Durante la procedura DCD OHT, sono state acquisite più immagini ecocardiografiche epicardiche per valutare la funzione ventricolare. (A) Qui sono mostrate le viste standard ad asse corto, (B) a 4 camere e (C) a 2 camere. LV = ventricolo sinistro; LA = atrio sinistro; RV = ventricolo destro; RA = atrio destro. Clicca qui per visualizzare una versione più grande di questa figura.
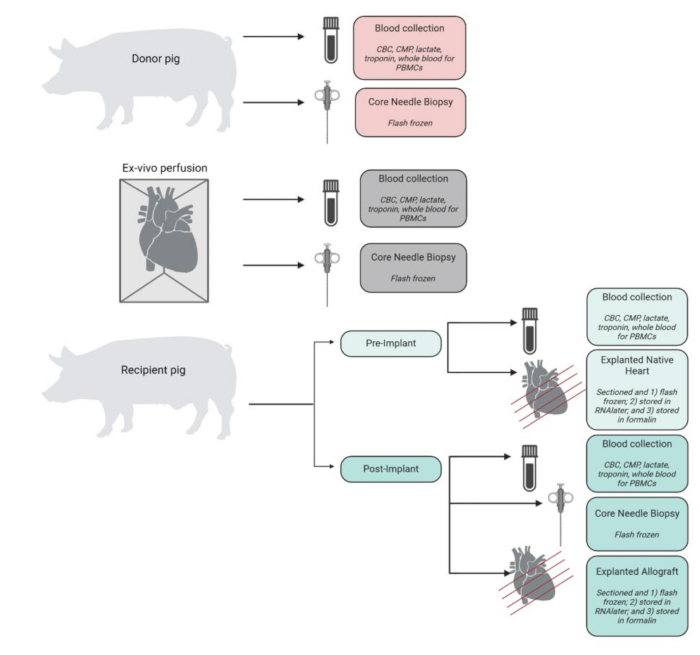
Figura 4: Flusso di lavoro per la raccolta e l'elaborazione dei campioni. Schema della raccolta e dell'elaborazione del campione in ogni fase della procedura. CBC = emocromo completo; CMP = pannello metabolico completo; PBMCs = cellule mononucleate del sangue periferico. Figura creata in BioRender. Clicca qui per visualizzare una versione più grande di questa figura.
| Durata (min) | |
| (media ± DS; n = 4) | |
| Tempo dall'interruzione della ventilazione alla dichiarazione di morte | 14.25 (2.6) |
| Durata della perfusione ex vivo | 147 (18) |
| Durata CPB | 174 (4) |
| Tempo di bloccaggio incrociato | 90 (12.5) |
| Tempo dallo svezzamento del CPB alla morte | 50 (37) |
Tabella 1. Informazioni procedurali. La durata media di ogni passaggio critico nella procedura DCD HT. CPB = bypass cardiopolmonare.
Discussione
Nonostante l'efficacia del trapianto di cuore per il trattamento dell'insufficienza cardiaca allo stadio terminale, persistono sfide significative in questo campo. Per combattere la limitata disponibilità di organi da donatore, negli ultimi anni sono saliti alla ribalta i progressi nei metodi di conservazione dell'allotrapianto cardiaco (ad esempio, la perfusione meccanica normotermica). Questi progressi hanno portato all'adozione del trapianto di allotrapianti cardiaci dopo la donazione dopo morte circolatoria (DCD HT). Sebbene l'utilizzo di allotrapianti DCD HT abbia ampliato il pool di donatori e abbia esiti a breve termine non inferiori agli allotrapianti DBD HT, rimane un rischio di circa il 5% di mortalità precoce per peri-trapianto associato a entrambi i tipi di donatori3. Il rischio di mortalità precoce nel trapianto di cuore è guidato prevalentemente dalla PGD. Sebbene la PGD sia multifattoriale in eziologia con un certo contributo di variabili definite da donatore, ricevente e conservazione, i meccanismi molecolari alla base della PGD rimangono generalmente poco compresi. Inoltre, data l'aggiunta del danno ischemico caldo causato dal processo HT DCD, non sorprende che questi cuori, rispetto agli allotrapianti DBD, possano essere a più alto rischio di PGD. Pertanto, una migliore comprensione della PGD è importante per aiutare a ridurre il rischio di mortalità a breve termine dopo il trapianto di cuore ortotopico, e questo può essere particolarmente vero per la DCD HT.
Qui, descriviamo un modello chirurgico suino ad alta fedeltà di DCD HT. I vantaggi della modellazione della DCD HT in vivo in un modello animale di grandi dimensioni includono non solo la capacità di comprendere ulteriormente i cambiamenti fisiopatologici che si verificano in un allotrapianto prelevato durante la DCD HT, ma anche la capacità di testare interventi mirati volti a garantire una qualità ottimale dell'allotrapianto. La valutazione della funzione ventricolare sinistra post-impianto e l'analisi del loop pressione-volume suggeriscono che questo modello chirurgico suino è in grado di ricapitolare la disfunzione cardiaca precoce dell'allotrapianto dopo DCD HT. Pertanto, la tecnica qui descritta crea un modello animale riproducibile di PGD su larga scala dopo DCD HT ed è suscettibile di valutare strategie terapeutiche in molti punti lungo il processo DCD HT. Infatti, l'uso della perfusione ex vivo come mezzo per fornire nuove terapie, come la terapia genica mediata da vettori virali, è un'area di interesse attiva nel nostro laboratorio e in altri 18,19,20. In precedenza abbiamo dimostrato la capacità di somministrare in modo robusto e omogeneo un transgene a un allotrapianto cardiaco utilizzando un modello HT suino non-DCD; le stesse tecniche possono essere applicate ad un DCD HT modello19,20. Altre potenziali strategie terapeutiche includono la modifica chimica del perfusato, la somministrazione di piccole molecole volte a ridurre lo stress ossidativo, la fornitura di substrati metabolici per supportare il metabolismo durante il periodo ischemico, ecc. 16,21,22. Inoltre, il modello qui presentato può essere facilmente adattato per valutare diverse variabili associate alla DCD HT, comprese le diverse tecniche di approvvigionamento utilizzate clinicamente. Ad esempio, descriviamo una strategia di approvvigionamento diretto e di perfusione ex vivo; Tuttavia, il modello può essere facilmente adattato per incorporare metodi di perfusione di approvvigionamento alternativi, inclusa la perfusione regionale normotermica.
La tecnica chirurgica impiegata in questo modello rispecchia da vicino quella utilizzata in ambito clinico; Tuttavia, ci sono alcune differenze fondamentali. In primo luogo, la sternotomia e l'esposizione cardiaca si verificano prima della cessazione del supporto cardiopolmonare, della fase agonale, della determinazione della morte e del periodo di stallo eticamente obbligatorio (modello a torace aperto)23. La sternotomia viene eseguita in questo ordine in modo che possa avvenire la valutazione del cuore del donatore al basale, comprese le biopsie miocardiche. Una valutazione preliminare della tempistica della sternotomia in un modello suino DCD HT ha dimostrato che la progressione dalla sospensione delle misure di sostegno vitale alla morte (tempo ischemico caldo) è più rapida con cambiamenti emodinamici meno pronunciati nel modello a torace aperto; Questi allotrapianti possono sperimentare condizioni meno dannose durante l'approvvigionamento. Tuttavia, non ci sono state differenze significative nei valori di laboratorio biochimici (lattato, glucosio, catecolamine, ecc.) o nei marcatori di morte cellulare tra i gruppi a torace chiuso e aperto24. Inoltre, a causa dell'inclusione del periodo di stallo di 10 minuti nel modello, il tempo dalla sospensione della ventilazione all'ischemia calda funzionale in questo modello assomiglia più da vicino alla tempistica del gruppo a torace chiuso dello studio citato. Inoltre, all'interno di questo modello, il tempo di ischemia calda funzionale è una variabile che può essere modificata per adattarsi agli obiettivi sperimentali di un particolare studio. Un'altra potenziale differenza tra il modello riportato qui e l'impostazione clinica è che l'attività elettrica senza polso (PEA; asistolia meccanica) viene utilizzata per definire la morte in questo modello. Nel contesto clinico, la dichiarazione di morte viene fatta da un medico che non è coinvolto nel processo di trapianto; La PEA, insieme all'assenza di altri segni di vita o asistolia elettrica, sarebbe accettabile per soddisfare i criteri per la dichiarazione di morte. I cuori suini hanno sostenuto l'attività elettrica per un periodo prolungato dopo la cessazione della contrattilità. Al fine di evitare un danno ischemico caldo sproporzionato rispetto a quello osservato nel contesto clinico, l'asistolia meccanica (PEA) è stata utilizzata per definire la morte. Per gli investigatori che utilizzano un modello a torace chiuso di DCD, l'attività elettrica senza polso (mancanza di pulsatilità sulla linea arteriosa) può ancora essere utilizzata come criterio di definizione della morte. Non abbiamo trovato che la saturazione periferica di ossigeno fosse un marcatore rilevante per definire l'inizio del periodo agonale o per definire la morte.
Infine, quello che abbiamo descritto qui è un modello che richiede molto tempo e risorse. Dalla preparazione del suino donatore alla morte dell'animale ricevente ci vogliono circa 10 ore e richiede un grande sforzo collaborativo. Il team procedurale comprende cardiochirurghi esperti, cardioanestesisti, perfusionisti e personale veterinario e di laboratorio che aiuta con la raccolta e l'elaborazione dei campioni. Un team di grandi dimensioni come questo è parte integrante della complessa procedura di DCD HT. Tuttavia, con un team esperto, è possibile la creazione di un modello suino ad alta fedeltà di DCD HT, come descritto in questo manoscritto.
Divulgazioni
CAM ha ricevuto un compenso azionario per aver prestato servizio come consulente per TransMedics Inc.
Riconoscimenti
Ringraziamo il supporto tecnico veterinario della Duke Laboratory Animal Resources, il supporto alla perfusione di Centrifugal Solutions e i team di anestesia cardiovascolare della Duke per il loro inestimabile supporto a questi esperimenti chirurgici. Ringraziamo sinceramente Paul Lezberg e TransMedics, Inc. per il loro supporto.
Materiali
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
Riferimenti
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon