Method Article
Высокоточная свиная модель ортотопической трансплантации сердца после донорства после смерти от кровообращения
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данном протоколе описывается высокоточная модель трансплантации сердца свиньи после донорства после смерти от кровообращения с использованием перфузии аллотрансплантата ex vivo .
Аннотация
Количество пациентов с сердечной недостаточностью на поздних стадиях, которые могут получить пересадку сердца, ограничено нехваткой подходящих доноров органов. В целях расширения пула доноров были разработаны альтернативные методы донорства и закупок, включая трансплантацию сердца после донорства после смерти от кровообращения (DCD HT). В то время как краткосрочная выживаемость после DCD HT не уступает трансплантации сердца от доноров с мертвым мозгом, может наблюдаться повышенная частота первичной дисфункции трансплантата (ПГД), связанная с аллотрансплантатами DCD HT. Основная этиология ПГД является многофакторной и не до конца изучена. Для аллотрансплантатов DCD HT период теплового ишемического повреждения во время приобретения DCD является потенциальным фактором риска развития ПГД, которым аллотрансплантаты смерти мозга не подвергаются. Таким образом, функциональное теплое время ишемии может быть важным фактором ПГД при ДКБ ГТ. Однако механизмы, лежащие в основе ПГД в этом клиническом сценарии, плохо изучены на молекулярном уровне. Представленная здесь работа направлена на описание разработки и валидации высокоточной модели ортотопической трансплантации сердца DCD у свиней. Мы предполагаем, что использование этой трансляционной модели крупного животного имеет решающее значение для выяснения молекулярных механизмов, способствующих ПГД, а также для исследования вмешательств, направленных на оптимизацию сохранения аллотрансплантата и ранней производительности. Эта модель повторяет периоперационный и хирургический подход, используемый при ДКД ГТ в клинической практике, с изменениями с учетом анатомии и физиологии свиней. Разработка этой большой хирургической модели на животных не только обеспечит механистическое понимание развития ПГД, но также может быть модифицирована для расширения трансляционных исследований, направленных на улучшение восстановления органов после ДКД ГТ.
Введение
Для пациентов с терминальной стадией сердечной недостаточности, не поддающейся медикаментозному лечению, трансплантация сердца остается терапией, связанной с наилучшей долгосрочной выживаемостью и качеством жизни. Исторически сложилось так, что трансплантация сердца требовала использования сердечного аллотрансплантата, полученного от донора с мертвым мозгом (DBD HT) и транспортированного в сохранном состоянии с гипотермическим статическим хранением. Однако количество пациентов, которым требуется пересадка сердца, превышает количество доступных доноров. В то время как ежегодно во всем мире проводится более 5 000 трансплантаций сердца, по оценкам, 50 000 кандидатов ожидают пересадкисердца. Кроме того, использование органов от идентифицированных доноров остается на уровне 30%2. В последние годы для улучшения использования донорских органов были разработаны альтернативные методы донорства и закупки, включая трансплантацию сердца после донорства после смерти от кровообращения (DCD HT)3,4,5,6.
Доноры ГТ DCD не соответствуют формальным критериям смерти мозга, но имеют неизлечимую неврологическую травму, из-за которой постоянное медицинское лечение считается бесполезным. Во время закупки DCD HT меры по поддержанию жизни отменяются, и пациент контролируется на предмет прогрессирования апноэ и остановки кровообращения. Смерть в этих ситуациях констатируется врачом, не участвующим в процессе трансплантации или забора органов. После того, как смерть была констатирована, существует дополнительный период ожидания (обычно 5 минут), в течение которого за потенциальным донором наблюдают, чтобы убедиться в отсутствии выздоровления или признаков жизни, после чего заявление о смерти подтверждается повторно, прежде чем приступить к забору органов 7,8. Таким образом, аллотрансплантаты DCD подвергаются воздействию переменного периода теплой ишемии (не менее 10 минут), которому донорские аллотрансплантаты DBD не подвергаются. Этот период теплой ишемии ранее сдерживал использование трансплантации сердца у доноров DCD. Тем не менее, в течение последних пяти лет были разработаны два метода реперфузии для восстановления аллотрансплантата после теплого ишемического времени, связанного с DCD. Во-первых, прямая закупка и перфузия (ДПП) включает в себя донорскую кардиэктомию после подтверждения смерти кровообращения, за которой следует реанимация аллотрансплантата и сохранение с помощью перфузии ex vivo. В качестве альтернативы при нормотермической регионарной перфузии (НРП) используется экстракорпоральное кровообращение, за исключением мозгового кровообращения, для реперфузии и реанимации донорского сердца in situ перед кардиэктомией 9,10,11,12.
До сих пор краткосрочная выживаемость, связанная с ДКБ ГТ, была аналогична той, которая наблюдалась при ДБД ГТ. Тем не менее, ранние исследования также свидетельствуют о более высоком риске тяжелой первичной дисфункции трансплантата (ПГД) при DCD HT по сравнению с DBD HT3. ПГД — это термин, используемый для описания клинических обстоятельств, когда после трансплантации сердца функция раннего аллотрансплантата недостаточна для удовлетворения потребностей реципиента в кровообращении. Система оценки тяжести ПГД была описана Международным обществом трансплантации сердца и легких. При тяжелой ПГД требуется механическая поддержка кровообращения для поддержания адекватного кровообращения в посттрансплантационном периоде13. Это состояние является основным фактором ранней послеоперационной смертности после трансплантации сердца. Этиология ПГД как для DBD HT, так и для DCD HT плохо изучена, но, вероятно, является многофакторной, при этом свой вклад вносят переменные донора, сохранения и реципиента. Для аллотрансплантатов DCD предполагается, что теплое ишемическое повреждение во время приобретения DCD, а также вредные донор-специфические реакции, включая гемодинамическую нестабильность, метаболические нарушения и всплески катехоламинов, цитокинов, лактата и калия, являются факторами, которые могут способствовать повышенному риску ПГД по сравнению с аллотрансплантатами DBD. 14,15,16. Однако механизмы, лежащие в основе ПГД в этом клиническом сценарии, плохо изучены на молекулярном уровне. Кроме того, возможно, из-за этих опасений, вероятность отказа сердца с ДКБ в 3,37 раза выше, чем у органов ДКБ17. В результате, все еще существует неудовлетворенная потребность в повышении эффективности использования органов и улучшении результатов трансплантации за счет оптимизации процесса сохранения органов.
В этом исследовании мы описываем свиную ДКД ГТ с использованием ДПП, которая с высокой точностью отражает текущую клиническую ДХД ДХД у свиней. Эта модель включает в себя элементы на протяжении всего процесса трансплантации DCD: 1) закупка DCD, 2) сохранение перфузии ex vivo с помощью системы ухода за органами (OCS) и 3) имплантация реципиента. Эта комплексная модель дает возможность лучше охарактеризовать механизмы, лежащие в основе ПГД при ДКД ГТ. Это позволяет разработать целенаправленные и рациональные терапевтические стратегии, направленные на улучшение сохранности и эффективности аллотрансплантата. Кроме того, эта модель обеспечивает платформу для доклинической оценки таких новых методов лечения, которые будут иметь важное значение для содействия безопасному и быстрому продвижению в области трансплантации сердца.
протокол
Все условия содержания и процедуры были одобрены Комитетом по уходу за животными и их использованию Медицинского центра Университета Дьюка в соответствии с их правилами и рекомендациями.
1. Предоперационная подготовка донора
- Выберите двух подходящих по группе крови йоркширских свиней весом 70-80 кг (определение группы крови выполнено компанией Looper Farms в Гранит-Фолс, Северная Каролина, США). Голодайте на обеих свиньях в течение как минимум 6-8 часов до операции.
- Подготовьте модуль перфузии сердца в соответствии с рекомендациями производителя и необходимыми испытаниями в месте оказания медицинской помощи (Таблица материалов).
- Подготовьте раствор для технического обслуживания модуля перфузии сердца. Этот раствор содержит питательные вещества для метаболически активного сердца, а также аденозин, помогающий поддерживать целевое кровяное давление.
- Добавьте следующее: 500 мл прозрачного раствора прайминга, 100 мл 25% альбумина, 100 мг ципрофлоксацина (200 мг/100 мл), два флакона по 5 мл мультивитаминов для инъекций, 20mEq бикарбоната натрия, 1 г цефазолина натрия и 250 мг метилпреднизолона. Добавьте раствор для прайминга и добавьте содержимое в модуль перфузии сердца.
- После приготовления введите в мешок 50 МЕ человеческого рекомбинантного инсулина.
- Приготовьте раствор адреналина, введя 0,25 мг адреналина и 30 МЕ человеческого рекомбинантного инсулина в 500 мл пакета с 5% декстрозой в воде. Этот раствор предназначен для замены катехоламинов, а не обладает инотропным эффектом. Настаивайте раствор со скоростью 10 мл/ч.
- Приготовьте раствор Т4 путем введения 200 мкг восстановленного левотироксина в мешок объемом 100 мл 0,9% нормального физиологического раствора. Настаивать со скоростью 3 мл/ч.
- Подготовьте раствор для технического обслуживания модуля перфузии сердца. Этот раствор содержит питательные вещества для метаболически активного сердца, а также аденозин, помогающий поддерживать целевое кровяное давление.
- Успокойте назначенную донорскую свинью 4,4 мг/кг телазола и 1,0 мг/кг пропофола с последующим введением 2%-5% ингаляционного изофлурана в виде маски для лица.
- Пока свинья находится в положении лежа на спине, интубируйте с помощью эндотрахеальной трубки диаметром 8-10 мм для поддержания дыхательных путей во время операции. Закрепите эндотрахеальную трубку на месте рыла. Нанесите ветеринарную мазь на глаза для поддержания смазки глаз во время операции.
- Введите внутривенный (IV) катетер в ушную вену для внутривенного введения жидкостей (поддерживающие жидкости: раствор Lactated Ringer 10 мл/кг/ч).
- Начните непрерывную инфузию фентанила для обезболивания (25-100 мкг/ч) и вводите 0,2 мг/кг векурония для поддержания паралича.
- Установите отведения электрокардиограммы и пульсоксиметр для непрерывного контроля электрической активности и оксигенации.
- Начинают искусственную вентиляцию легких с дыхательным объемом 10 мл/кг/мин, со скоростью 10-15 вдохов в минуту и с поддержанием изофлурана (1%-5%) в течение оставшейся части процедуры. Титруйте анестетики и вазоактивные препараты так, чтобы рефлексы отсутствовали, частота сердечных сокращений оставалась 61-99 уд/мин, а систолическое артериальное давление оставалось 90-130 мм рт.ст.
- Расположите свинью на операционном столе так, чтобы верхние конечности располагались головным путем и обездвиживались за пределами операционного поля. Закрепите нижние конечности за пределами операционного поля.
- Определите область, которая должна быть включена в операционное поле, челюстью вверху, передней подмышечной линией с обеих сторон и на два пальца ниже мечевидного отростка снизу. Подготовьте и накидывайте операционное место асептически в соответствии со стандартными методами.
- Выполните правосторонний срез сонной артерии.
- С помощью лезвия #10 сделайте косой правый боковой разрез шейки на два пальца латеральнее трахеи, вдоль медиальной границы грудино-ключично-сосцевидной мышцы.
- Проведите этот разрез вниз через платизму с помощью электрокаутеризации, обеспечивая гемостаз. Пройдя через платизму, используйте самоудерживающийся ретрактор для облегчения воздействия.
- Тщательно рассеките и изолируйте сонную артерию и внутреннюю яремную вену; Вокруг каждого сосуда обернитесь петлей для сосудов.
- Нанесите 10 мл 2% лидокаина местно для промывания сосудов.
ПРИМЕЧАНИЕ: Лидокаин используется из-за его сосудорасширяющего эффекта, так как сосуды свиньи легко спазмируются при манипуляциях и могут стать трудными для канюлию. - Используя технику Сельдингера, непосредственно канюлировать сонную артерию с помощью микропунктуры 5 Fr с последующей интродуксерной оболочкой 6 Fr.
- Подсоедините интродьюсерный тубус к артериальной магистрали и датчику для непрерывного мониторинга системного артериального давления во время процедуры.
- Забор крови из артериальной магистрали сонной артерии для предоперационного лабораторного анализа крови (общий анализ крови, комплексная метаболическая панель, тропонин, лактат и цельная кровь для выделения мононуклеарных клеток периферической крови).
- Канюляция внутренней яремной вены осуществляется по той же методике, что и в 1.11.5. Оставьте тубус 6 Fr на месте, так как он будет использоваться для введения петлевого катетера давления-объема для последующей функциональной оценки.
2. Донорство после смерти кровообращения и донорской кардиэктомии
- Провести стернотомию.
- С помощью лезвия #10 сделайте продольный разрез от грудинной выемки до мечевидного отростка. С помощью электрокаутеризации проводите рассечение вниз через подкожную клетчатку и фасцию грудной мышцы.
- Надрежьте среднюю линию грудины с помощью электрокоагуляции. Рассеките связочные прикрепления в области кисти и вокруг мечевидного отростка.
- С помощью качающейся грудинной пилы аккуратно разделите передний стол грудины по средней линии. С помощью качающейся пилы полностью разделите задний стол грудины на уровне манубриума. Следите за тем, чтобы не травмировать обезличенную вену на этом этапе. Завершите грудное деление заднего стола ниже манубриума с помощью тяжелых ножниц.
ПРИМЕЧАНИЕ: Ручное тупое рассечение плоскости между нижней стороной грудины и перикардом может помочь избежать травмирования сердца на этом этапе. - Используют электрокоагуляцию для получения гемостаза грудных краев. Установите стернальный ретрактор.
- Удалите ткань жировой подушки тимуса и перикарда с помощью электрокаутеризации, чтобы оптимизировать воздействие на перикард.
- Осторожно вскройте перикард с помощью электрокаутеризации. Разрез проводят продольно от верхушки сердца до уровня аорты.
- Создайте перикардиальную лунку с помощью шелковых стежков 2-0.
- Выполнение исходного анализа донорских аллотрансплантатов.
- Во время обнажения донорского сердца и перед любыми прямыми сердечными манипуляциями проведите исходный анализ. К ним относятся прямая эпикардиальная эхокардиография, оценка объемной петли давления и пункционная биопсия миокарда.
- Выполняйте эхокардиографию стерильным способом, чтобы получить стандартные изображения по длинной и короткой осям непосредственно с поверхности эпикарда.
- Чтобы провести запись петли давления-объема, введите твердотельный катетер давления-объема (5Fr, 122 см) последовательно в сонную артерию и внутреннюю яремную вену в левый и правый желудочки соответственно.
- Измерьте длину катетера, который должен быть введен извне (от места канюляции до верхушки сердца) перед введением в оболочку.
- Введите катетер в артериальную оболочку, направив его в левый желудочек с помощью эпикардиального ультразвука. Убедитесь, что катетер не соприкасается непосредственно со стенкой желудочка, так как это может повлиять на точность измерения.
- Далее ввести катетер в венозную оболочку, направив его в правый желудочек, с помощью прямой пальпации или эпикардиального ультразвукового контроля.
- Выполните пункционную биопсию миокарда для сбора ткани для последующих анализов. Выполняют это в верхушке левого желудочка. Если имеется значительное кровотечение из места биопсии, наложите восстановительный шов.
- Подготовьте донорское сердце.
- Рассеките аорто-легочное окно, чтобы освободить место для установки поперечного зажима.
- По окружности рассекайте верхнюю полую вену (ВПВ) и нижнюю полую вену (НПВ) с помощью электрокаутеризации.
- Для антикоагуляции введите 300 ЕД/кг гепарина внутривенно (в/в) перед канюляцией аорты.
- Используйте двусторонний полипропиленовый шов 4-0, чтобы поместить кошельковый шнур аорты в корень аорты для канюляции аорты. Канюля с канюлей для отверстия корня аорты 7 Fr (14G).
- Снимите воздух и закрепите на месте с помощью жгута Rumel. Промойте трубку кардиоплегии, чтобы удалить воздух и закрепить катетер к канюле корня аорты.
- Далее, чтобы подготовиться к будущей венозной канюляции, наложите кисетной шов в правый придаток предсердия и закрепите его жгутом Румель.
- Проводят контролируемую гибель кровообращения.
- Введите 250 мкг фентанила в/в бокс с последующей непрерывной инфузией (CRI) со скоростью 100 мкг/ч для обезболивания. Для паралича следует ввести внутривенно 0,2 мг/кг векурония.
- Прекратить искусственную вентиляцию легких, чтобы начать контролируемый процесс кровообращения.
- Постоянно контролируйте систолическое и среднее артериальное давление, пульсацию артериальной линии, электрическую сердечную деятельность и состояние оксигенации.
ПРИМЕЧАНИЕ: Агональная фаза начинается, когда систолическое артериальное давление падает ниже 50 мм рт.ст. В этот момент сердце может растягиваться. Смерть определяется механической асистолией (безпульсовой электрической активностью) и отсутствием признаков жизни. Данное исследование не определяет смерть от электрической асистолии в данной модели, так как медленная безпульсовая электрическая активность сохраняется у свиней в течение более длительного периода времени, чем наблюдается у людей, что может привести к увеличению ишемического повреждения аллотрансплантата, чем предполагалось в модели. - Подождите 10 минут после момента смерти/асистолии, прежде чем приступать к следующим этапам протокола. Этот интервал моделирует период противостояния плюс время, необходимое для проникновения в медиастинальное пространство и подготовки к клинической ДКД ГТ.
- Выполните грунтовку перфузионного устройства ex vivo .
- С помощью лезвия #11 сделайте колющий разрез в правом придатке предсердия и канюляция с помощью венозной канюли 34Fr, предоставленной производителем. Закрепите канюлю жгутом Rumel и подсоедините канюлю к мешку для сбора перфузионного устройства ex vivo .
- Соберите примерно 1200-1500 мл донорской крови в мешок для сбора, предоставленный производителем. Перед обескровливанием в мешок для сбора добавляется 30 000 ЕД гепарина и 2 мг тирофибана гидрохлорида.
- Отфильтровать донорскую кровь и доставить ее в модуль перфузии сердца.
- Провести донорскую кардиэктомию.
- После забора донорской крови наложите поперечный зажим для аорты.
- Обратите внимание, что корень аорты свиньи и восходящая аорта значительно короче, чем у человека. Позаботьтесь о том, чтобы наложить поперечный зажим как можно проксимальнее, чтобы избежать зажатия дуги или неполной окклюзии аорты.
- Введите 1 л кардиоплегии Дель Нидо в корень аорты, ориентируясь на давление корня 60-100 мм рт.ст.
- Пересеките нижнюю полую вену в области перикардиального отражения и придаток левого предсердия для вентиляции правого и левого желудочков во время кардиоплегии.
- Поместите холодную стерильную жижу на донорское сердце.
- Разделите IVC, SVC, аорту дистальнее безымянной артерии и легочную артерию (PA) в месте бифуркации. Пересекают донорское левое предсердие (ЛП), оставляя достаточную манжету ткани на аллотрансплантате.
- Уберите сердце с поля и поместите его в таз, наполненный стерильной, холодной слякотью для подготовки к столу.
- Поместите четыре равноудаленных горизонтальных матрасных шва (полипропилен 4-0) внутрь дистального конца аорты.
- После забора донорской крови наложите поперечный зажим для аорты.
- Перфузия ex vivo
- Поместите перфузионный аортальный адаптер ex vivo в дистальный отдел аорты и плотно закрепите шелковым швом 0-0 или пупочной лентой, расположенной чуть ниже наложенных швов.
- Оставьте ПА, СВЦ, НПВ и левое предсердие открытыми, находясь на перфузионном аппарате ex vivo .
ПРИМЕЧАНИЕ: При такой конфигурации не наблюдалось растяжения левого желудочка. - Транспортируйте аллотрансплантат к перфузионному аппарату ex vivo и подсоедините аортальный адаптер. Убедитесь, что задняя поверхность сердца обращена кпереди. Убедитесь, что передняя поверхность сердца находится в контакте с устройством и двумя дефибрилляционными прокладками. Поддерживайте аллотрансплантат при температуре 34 °C. Дефибрилляцию проводят по мере необходимости, чтобы восстановить любой желудочковый ритм до организованного ритма.
- На этом этапе терапевтический препарат может быть введен в контур перфузии ex-vivo через порт кардиоплегии. В качестве альтернативы, перфузат или физическая схема могут быть модифицированы для оценки экспериментальных условий, направленных на улучшение восстановления аллотрансплантата DCD HT. Например, ранее мы показали, что перфузат необходимо промывать от предварительно сформированных нейтрализующих антител с помощью клеточного сейвера для усиления трансдукции вирусными векторами 18,19,20.
- Используйте лаборатории на месте оказания медицинской помощи для руководства по введению бикарбоната натрия, глюконата кальция и декстрозы по мере необходимости.
- Получите образцы перфузата, анализ крови и образцы пункционной биопсии во время этой стадии перфузии ex vivo .
ПРИМЕЧАНИЕ: В этой модели аллотрансплантат остается на перфузионном устройстве ex vivo в течение примерно 2-3 часов перед имплантацией реципиенту (Таблица 1). Продолжительность перфузии аллотрансплантата ex vivo определялась продолжительностью времени, которое потребовалось для подготовки животного-реципиента к имплантации. Тем не менее, время перфузии ex vivo является переменной, которая может быть скорректирована в зависимости от целей исследования.
3. Реципиентная кардиэктомия, имплантация и реперфузия
- Подготовьте свинью-реципиента так, как описано в пунктах 1.3-1.11.8.
- Кроме того, установите трехпросветный центральный катетер 7 Fr 20 см в левую наружную или внутреннюю яремную вену под ультразвуковым контролем и по методике Сельдингера. Установите артериальный катетерий 5 Fr бедренной кости под ультразвуковым контролем.
- После драпировки стерильного поля подготовьте схему искусственного кровообращения (ЧЛБ) и выведите линии на поле.
- Рециркулируют через артериальные и венозные катетеры ХЛБ для удаления воздуха. Зажимаем и разделяем линии. Подготовьте венозную капельницу для бикавальной канюляции.
- Введите предоперационную дозу 1 г метилпреднизолона для устранения любых воспалительных реакций, вызванных отторжением или ишемией, как это делается при клинической трансплантации сердца в учреждении, где проводится данное исследование.
- Выполните разрезание правой сонной артерии и стернотомию по средней линии, как описано ранее в шагах 1.11 и 2.1.
- Выполните реципиентную кардиэктомию.
- Рассекайте аорто-легочное окно, как и раньше. Рассеките СВК и НПВ и наложите круговую пуповинную ленту вокруг сосудов.
- Перед канюляцией введите 400 ЕД/кг гепарина. Титруйте до целевого значения активированного времени свертывания крови (ACT) > 480 с.
- Наложите стандартный кошельковый шов канюляции аорты в дистальный отдел восходящей аорты (с помощью двустороннего плетеного полиэфирного шовного материала с покрытием 2-0). Закрепить жгутом Румель и гемостатом.
- Следите за тем, чтобы систолическое артериальное давление не превышало 120 мм рт.ст. Используйте лезвие #11, чтобы сделать разрез на всю толщину в кошельке. Канюля аорты с помощью канюли 15 Fr через этот разрез. Закрепите канюлю на месте жгутом Rumel.
- Зажмите канюлю аорты. После деаэрации артериального шунта подключите аортальную канюлю к цепи ХЛБ. Убедитесь, что в трубопроводе нет пузырьков воздуха.
- Сделайте еще один аортальный кошелек и вставьте канюлю для отверстия корня аорты.
- Выполните канюляцию вен по бикавальному методу с помощью канюль с металлическим наконечником под прямым углом 18-20 Fr как в SVC, так и в IVC, закрепленных жгутами Rummel. Затем соедините эти канюли с венозной конечностью контура искусственного кровообращения.
- Инициируйте CPB до целевого расхода 2,4 л/мин/м2 и охладите до 32 °C. Титруйте анестетики и вазопрессоры для поддержания среднего артериального давления > 60 мм рт.ст.
ПРИМЕЧАНИЕ: Эти процедуры выполняются сертифицированными кардиоторакальными анестезиологами и сертифицированными перфузиологами, которые контролируют и координируют управление гемодинамикой на протяжении всего периода КПБ. - Приложите поперечный зажим аорты проксимальнее к канюле аорты и продолжите объяснение родного сердца реципиента. Оставьте неповрежденными манжеты правого и левого предсердий, достаточно большие, чтобы облегчить технику бипредсердной имплантации.
ПРИМЕЧАНИЕ: В этой модели используется бипредсердная техника, так как сосудистая сеть свиньи очень нежная, что делает сосудистые анастомозы IVC и SVC технически сложными при бикавальной технике. - Пересеките аорту и ПА как можно ближе к корню, чтобы сохранить максимальную длину сосуда. Поместите только что эксплантированное сердце в ледяной фосфатно-солевой буфер (PBS) для транспортировки и обработки в лаборатории.
- Провести имплантацию реципиентного аллотрансплантата в бипредсердное состояние.
- Охладите аллотрансплантат на перфузионном устройстве ex vivo в соответствии с инструкциями производителя. Введите 1 л холодной кардиоплегии Дель Нидо для остановки сердца еще раз перед извлечением из устройства.
- Отсоедините адаптер аорты и перевезите сердце в тазу со стерильной холодной слякотью на задний стол.
- Осмотрите сердце на наличие явных первичных ямок овальной ямки (PFO) или мест непреднамеренных травм.
ПРИМЕЧАНИЕ: Важно отметить, что у свиней обычно имеется системная вена, которая дренируется вдоль левой границы предсердия перед впадением в правое предсердие или НПВ. Эта вена может быть открыта в процессе забора, и следует позаботиться о том, чтобы убедиться, что она перевязана до начала имплантации. - Обрежьте аорту до здоровой ткани ниже места фиксации адаптера.
- С помощью ножниц Метценбаума обрежьте левое предсердное отверстие в соответствии с размером манжеты реципиента LA. То же самое проделайте с правым предсердием.
- Начните оперативный анастомоз левого предсердия с помощью двустороннего шва Prolene 4-0. Продолжайте с анастомозов правого ПА, аорты и правого предсердия, также все это завершено непрерывным швом пролена 4-0.
- Начните согревание до нормотермии (37 °C) до удаления поперечного зажима аорты.
- Проведите реперфузию аллотрансплантата и отлучите от искусственного кровообращения.
- После завершения всех анастомозов освободите поперечный зажим аорты для реперфузии аллотрансплантата.
- Обеспечить гемостаз всех анастомозов.
- Ждите возвращения родного ритма и сократительной способности. Установите эпикардиальные провода для стимуляции и установите темп 100 уд/мин, если частота сердечных сокращений аллотрансплантата составляет <100 уд/мин.
- После 60 минут реперфузии попытайтесь отучить от искусственного кровообращения. Реципиентам оказывают поддержку в дозе 0,05 мкг/кг/мин адреналина, а также при необходимости проводят вазопрессорные инфузии для поддержания среднего артериального давления (MAP) >65 мм рт.ст.
- Выполняйте такие анализы, как эхокардиография, анализ крови, биопсия миокарда и оценка объемной петли давления как в ранние, так и в поздние моменты реперфузии.
4. Прекращение эксперимента и эвтаназия
Примечание: В данном исследовании животное-реципиент трансплантата получало поддержку в течение 1 ч после отделения от ИКЛ.
- По завершению эксперимента проводится эвтаназия путем обескровливания под наркозом.
- Эксплантируйте пересаженный аллотрансплантат, пересектив линии швов по всем анастомозам. Будьте осторожны, чтобы не включить в образец аллотрансплантата нативную ткань реципиента.
- Немедленно поместите аллотрансплантат в ледяную PBS и транспортируйте его в лабораторию для обработки и хранения.
Результаты
В общей сложности было проведено 6 трансплантаций DCD свиньям для пилотного анализа с использованием описанного здесь протокола. В ходе этих шести пилотных экспериментов компоненты протокола были усовершенствованы, чтобы лучше соответствовать потребностям модели, повысить воспроизводимость и учесть логистические ограничения. Окончательный итоговый протокол, как описано здесь, обобщен на рисунке 1.
В отличие от контролируемого человеком процесса смерти через кровообращение, сердца свиней, подвергшиеся ишемии, сохраняли электрическую активность гораздо дольше, чем ожидалось, даже после того, как сократительная способность прекращалась. После обнаружения этой разницы в первом эксперименте электрическая асистолия была признана ненадежной в качестве меры для объявления смерти. Чтобы избежать теплово-ишемического повреждения аллотрансплантата, непропорционального тому, которое наблюдается в клиническом контексте, для определения времени смерти для остальных процедур трансплантации использовали механическую асистолию (безпульсовую электрическую активность).
Кроме того, период противостояния первоначально составлял 15 минут до начала донорской кардиэктомии. Это было использовано для первых трех экспериментов опытной установки. Одним из обоснований этого 15-минутного периода теплой ишемии было то, что мы стремились получить достаточно серьезную травму, чтобы иметь степень дисфункции трансплантата после трансплантации, которая была бы пригодна для изучения. Мы обнаружили, что дисфункция трансплантата в этих ранних экспериментах была настолько серьезной, что мы испытывали трудности с поддержанием животного-реципиента в течение часа после отделения от искусственного кровообращения, так что животному-реципиенту требовались высокие дозы инотропной и прессорной поддержки для соблюдения временного интервала в 1 час. Учитывая эти трудности, мы сократили период теплоишемического повреждения до 10 мин, что более близко приближается к клиническому ДКД ГТ при перфузии ex vivo . На рисунке 2 представлены репрезентативные изображения аллотрансплантата на этой стадии, а также во время перфузии ex vivo и после имплантации. Наконец, были внесены коррективы в титрование вазопрессорных и инотропных инфузий в фазе после отлучения от ИКЛ для поддержки вновь пересаженного сердца. Невозможно переоценить потребность в опытной команде специалистов со специальными знаниями в области сердечно-сосудистой анестезиологии для повышения успеха в этой фазе после ИКЛ.
Время работы отслеживалось в 4 из 6 экспериментов и обобщено в таблице 1. На этапе закупки DCD в соответствии с протоколом время, прошедшее с момента прекращения жизнеподдерживающих мероприятий у донорской свиньи до объявления смерти, составило 14,25 (+/- 2,6) минут. Время оперативного искусственного кровообращения и время перекрестного зажима оставались неизменными на протяжении всех пилотных экспериментов и составляли около 3 ч и 1,5 ч соответственно. Эксперименты заканчивались эвтаназией примерно через 1 ч после отделения от КПБ. Наблюдалась вариабельность степени устойчивости животных во время эвтаназии. Некоторые животные продемонстрировали относительно хорошую стабильность и только легкую дисфункцию трансплантата, в то время как другие продемонстрировали значительную гемодинамическую нестабильность и тяжелую дисфункцию трансплантата. Репрезентативные дисплеи стоп-эхокардиографии показаны на рисунке 3. Эта и другие функциональные оценки, такие как петли ВП, могут быть использованы для определения различий в функции аллотрансплантата от исходного уровня, а также до и после введения терапевтических вмешательств.
Сводка по образцам, собранным, обработанным и сохраненным в ходе эксперимента, показана на рисунке 4. Эксплантированные сердца были немедленно помещены в ледяную PBS и сохранены в лаборатории для тканевого и молекулярного анализа. Нативное сердце реципиента использовалось в качестве контрольной, в то время как трансплантированный аллотрансплантат хранился в качестве экспериментальной ткани. Сердца были разрезаны на 4 поперечных сечения от вершины до основания. Из каждого из них репрезентативные образцы тканей каждой камеры (левого желудочка, правого желудочка, перегородки и обоих предсердий) были мгновенно заморожены в жидком азоте и сохранены при температуре -80 °C для будущего анализа. Аналогичным образом, репрезентативные образцы тканей с каждого из этих уровней и камер инкубировали в РНК-позже и мгновенно замораживали. Оставшийся образец ткани был законсервирован в формалине для проведения гистопатологического анализа. Образцы крови из любого момента времени были получены в двух экземплярах и хранились либо в пробирках EDTA, либо в пробирках CPT. Кровь, хранящаяся в пробирках ЭДТА, была раскручена для выделения плазмы, которая была мгновенно заморожена. Кровь в пробирках CPT обрабатывалась для PBMC с использованием модифицированного протокола, предоставленного поставщиком пробирок CPT.
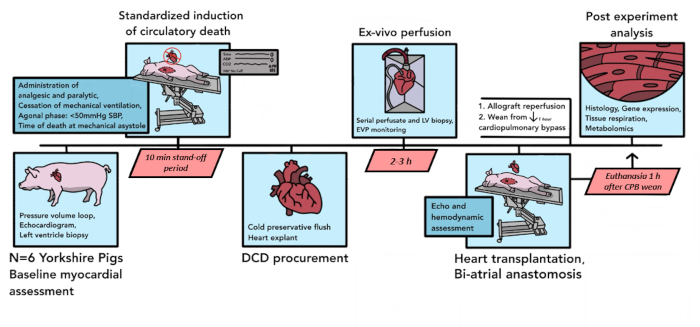
Рисунок 1: Схема протокола Porcine DCD HT. Здесь изображена временная шкала событий, происходящих в процедуре DCD HT у свиней. В данном пилотном исследовании было проведено 6 ДКД ГТ. Исходная оценка миокарда проводится на аллотрансплантате сердца донорской свиньи, после чего начинается контролируемая гибель кровообращения. После объявления смерти наступает 10-минутный период ожидания. Затем аллотрансплантат эксплантируется и транспортируется в перфузионное устройство ex vivo , где он реперфузируется в течение 2-3 часов. После подготовки животного-реципиента донорский аллотрансплантат имплантируется по биатриальной методике. После 1 ч реперфузии на ИКЛ реципиент отлучается от поддержки шунтирования. Эвтаназия происходит через 1 ч после отделения от ХЛБ. Затем имплантированный аллотрансплантат обрабатывается для анализа тканей. DCD HT = трансплантация сердца после донорства после смерти от кровообращения; ИКЛ = сердечно-легочное шунтирование. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
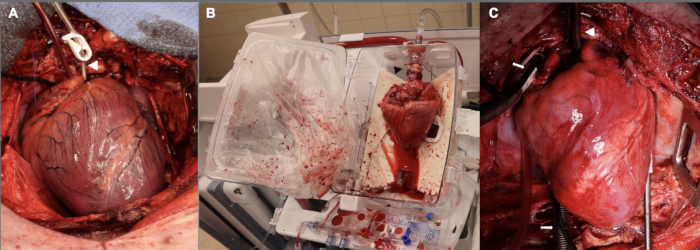
Рисунок 2: Сердечный аллотрансплантат свиньи на разных стадиях процесса DCD OHT. (A) После контролируемой циркуляционной смерти донорский аллотрансплантат растягивается, ишемизируется и отечный. Белой стрелкой обозначена канюля корня аорты. (В) После того, как аллотрансплантат эксплантируется у донора, его помещают на устройство EVP для перфузии ex vivo . Обратите внимание на ориентацию сердца, при этом задняя сторона обращена наружу. Черная стрелка указывает на аортальный адаптер, используемый для подключения аллотрансплантата к устройству. (C) После имплантации реципиенту аллотрансплантат реперфузируется на искусственном кровопролитном устройстве в течение одного часа до отлучения от искусственного кровообращения. Белой стрелкой обозначена канюля аорты; Белые стрелки указывают на двучелюстные венозные канюли. EVP = перфузия ex vivo ; ИКЛ = сердечно-легочное шунтирование. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
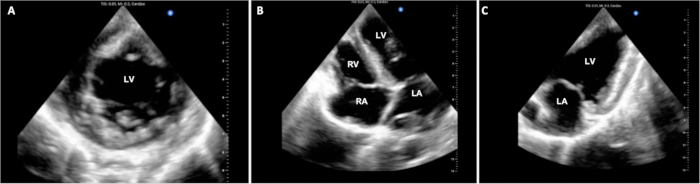
Рисунок 3: Эпикардиальная эхокардиография сердца. На протяжении всей процедуры DCD OHT были получены множественные эпикардиальные эхокардиографические изображения для оценки функции желудочков. (A) Стандартный вид с короткой осью, (B) 4-камерный и (C) 2-камерный вид. ЛЖ = левый желудочек; LA = левое предсердие; RV = правый желудочек; RA = правое предсердие. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
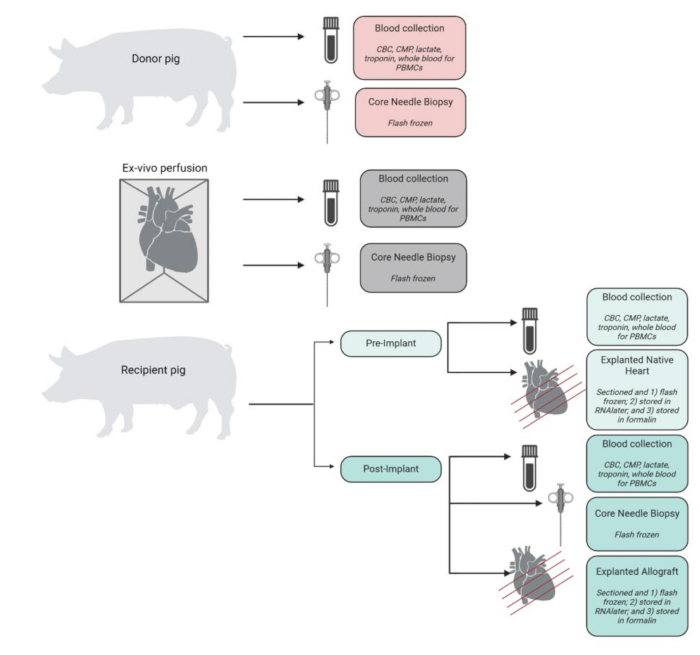
Рисунок 4: Рабочий процесс сбора и обработки образцов. Схема сбора и обработки образцов на каждом этапе процедуры. ОАК = общий анализ крови; CMP = комплексная метаболическая панель; PBMCs = мононуклеарные клетки периферической крови. Фигура создана в BioRender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Продолжительность времени (мин) | |
| (среднее значение ± SD; n = 4) | |
| Время от прекращения вентиляции легких до объявления смерти | 14.25 (2.6) |
| Продолжительность перфузии ex vivo | 147 (18) |
| Продолжительность CPB | 174 (4) |
| Время поперечного зажима | 90 (12.5) |
| Время от отлучения от КПБ до смерти | 50 (37) |
Таблица 1. Процедурная информация. Средняя продолжительность каждого критического шага в процедуре DCD HT. ИКЛ = сердечно-легочное шунтирование.
Обсуждение
Несмотря на эффективность трансплантации сердца для лечения терминальной стадии сердечной недостаточности, в этой области сохраняются значительные проблемы. Для борьбы с ограниченной доступностью донорских органов в последние годы на первый план вышли достижения в области методов сохранения сердечных аллотрансплантатов (например, нормотермическая перфузия с помощью аппарата). Эти достижения привели к принятию трансплантации сердечных аллотрансплантатов после донорства после смерти кровообращения (DCD HT). Несмотря на то, что использование аллотрансплантатов DCD HT расширило пул доноров и имеет краткосрочные результаты, которые не уступают аллотрансплантатам DBD HT, сохраняется примерно 5% риск ранней перитрансплантационной смертности, связанный собоими типами доноров. Риск ранней смертности при трансплантации сердца обусловлен преимущественно ПГД. В то время как ПГД является многофакторной по этиологии с некоторым вкладом определенных переменных донора, реципиента и сохранения, молекулярные механизмы, лежащие в основе ПГД, остаются в целом плохо изученными. Кроме того, учитывая дополнительное тепловое ишемическое повреждение, вызванное процессом DCD HT, неудивительно, что эти сердца, по сравнению с аллотрансплантатами DBD, могут подвергаться более высокому риску ПГД. Таким образом, лучшее понимание ПГД важно для снижения риска краткосрочной смертности после ортотопической трансплантации сердца, и это может быть особенно верно для ДКД ГТ.
В этой статье мы опишем высокоточную хирургическую модель DCD HT на свиньях. Преимущества моделирования DCD HT in vivo на крупной животной модели включают не только возможность более глубокого понимания патофизиологических изменений, происходящих в аллотрансплантате, полученном во время DCD HT, но и возможность тестирования целевых вмешательств, направленных на обеспечение оптимального качества аллотрансплантата. Оценка постимплантационной функции левого желудочка и анализ петли давления и объема позволяют предположить, что эта хирургическая модель свиньи способна восполнить раннюю дисфункцию сердечного аллотрансплантата после DCD HT. Таким образом, описанная здесь методика создает воспроизводимую модель ПГД на крупных животных после ДКД ГТ и поддается оценке терапевтических стратегий на многих этапах процесса ДКД ГТ. На самом деле, использование перфузии ex vivo в качестве средства для доставки новых методов лечения, таких как вирусно-вектор-опосредованная генная терапия, является активной областью внимания в нашей лаборатории и других лабораториях. Ранее мы продемонстрировали способность надежно и однородно доставлять трансген к сердечному аллотрансплантату с использованием модели HT свиньи без DCD; те же методы могут быть применены к модели DCD HT 19,20. Другие потенциальные терапевтические стратегии включают химическую модификацию перфузата, доставку малых молекул с целью снижения окислительного стресса, обеспечение метаболическими субстратами для поддержки метаболизма в период ишемии и т.д. 16,21,22. Кроме того, представленная здесь модель может быть легко адаптирована для оценки различных переменных, связанных с DCD HT, включая различные методы закупок, используемые в клинической практике. Например, мы описываем стратегию прямых закупок и перфузии ex vivo; Тем не менее, модель может быть легко адаптирована для включения альтернативных методов перфузии закупок, включая нормотермическую регионарную перфузию.
Хирургическая техника, используемая в этой модели, очень похожа на технику, используемую в клинических условиях; Тем не менее, есть некоторые ключевые различия. Во-первых, стернотомия и сердечная экспозиция происходят до прекращения сердечно-легочной поддержки, агональной фазы, определения смерти и этически предписанного периода противостояния (модель открытой грудной клетки)23. Стернотомия проводится в таком порядке, чтобы можно было провести исходную оценку донорского сердца, включая биопсию миокарда. Предыдущая оценка сроков стернотомии в модели свиней с DCD HT показала, что прогрессирование от отмены мер поддержания жизни до смерти (теплое время ишемии) происходит более быстрыми темпами с сопутствующими менее выраженными гемодинамическими изменениями в модели открытой грудной клетки; Эти аллотрансплантаты могут испытывать менее разрушительные условия во время заготовки. Тем не менее, не было существенных различий в биохимических (лактат, глюкоза, катехоламин и др.) лабораторных показателях или маркерах гибели клеток между закрытой и открытой группами грудной клетки24. Кроме того, в связи с включением в модель 10-минутного периода ожидания, время от отмены вентиляции до функциональной теплой ишемии в этой модели больше напоминает время в группе закрытой грудной клетки в цитируемом исследовании. Кроме того, в рамках этой модели время функциональной теплой ишемии является переменной, которая может быть изменена в соответствии с экспериментальными целями конкретного исследования. Еще одно потенциальное различие между представленной моделью и клиническими условиями заключается в том, что для определения смерти в этой модели используется безпульсовая электрическая активность (ПЭА; механическая асистолия). В клиническом контексте заявление о смерти делается врачом, который не участвует в процессе трансплантации; либо ПЭА, наряду с отсутствием других признаков жизни или электрической асистолии, будет приемлемым для соответствия критериям для констатации смерти. Сердца свиней сохраняли электрическую активность в течение длительного периода времени после прекращения сократительной способности. Чтобы избежать теплового ишемического повреждения, которое непропорционально наблюдаемому в клиническом контексте, для определения смерти использовалась механическая асистолия (ПЭА). Для исследователей, использующих закрытую модель ДКД, безпульсовая электрическая активность (отсутствие пульсации на артериальной линии) все еще может быть использована в качестве критерия, определяющего смерть. Мы не обнаружили, что периферическое насыщение кислородом является релевантным маркером для определения начала агонального периода или определения смерти.
Наконец, то, что мы описали здесь, является моделью, требующей много времени и ресурсов. От подготовки свиньи-донора до смерти животного-реципиента проходит около 10 часов и требует больших совместных усилий. В состав процедурной команды входят опытные кардиохирурги, кардиоанестезиологи, перфузиологи, ветеринарные и лабораторные работники, которые помогают со сбором и обработкой образцов. Такая большая команда, как эта, является неотъемлемой частью сложной процедуры DCD HT. Тем не менее, с опытной командой возможно создание высокоточной модели DCD HT для свиней, как описано в этой рукописи.
Раскрытие информации
CAM получила компенсацию за работу в качестве консультанта TransMedics Inc.
Благодарности
Мы благодарим ветеринарную техническую поддержку от Duke Laboratory Animal Resources, перфузионную поддержку от Centrifugal Solutions и команды сердечно-сосудистой анестезии Duke за их неоценимую поддержку этих хирургических экспериментов. Мы также искренне благодарны Полу Лезбергу и TransMedics, Inc. за их поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
Ссылки
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены