Method Article
Ein High-Fidelity-Schweinemodell der orthotopen Herztransplantation nach Spende nach Kreislauftod
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt hier ein High-Fidelity-Schweinemodell der Herztransplantation nach Spende nach Kreislauftod unter Verwendung einer ex vivo-Perfusion des Allotransplantats.
Zusammenfassung
Die Zahl der Patienten mit fortgeschrittener Herzinsuffizienz, die eine Herztransplantation erhalten können, ist durch einen Mangel an geeigneten Organspendern begrenzt. Um den Spenderpool zu erweitern, wurden alternative Spenden- und Beschaffungsmethoden entwickelt, darunter auch die Herztransplantation nach Spende nach Kreislauftod (DCD HT). Während das kurzfristige Überleben nach DCD HT nicht schlechter ist als bei einer Herztransplantation mit hirntoten Spendern, kann es zu einer erhöhten Rate an primärer Transplantatdysfunktion (PID) im Zusammenhang mit DCD HT-Allotransplantaten kommen. Die zugrundeliegende Ätiologie der PID ist multifaktoriell und unvollständig verstanden. Bei DCD-HT-Allotransplantaten ist die Periode warmer ischämischer Verletzungen während der DCD-Entnahme ein potenzieller Risikofaktor für die PID, bei der Hirntod-Allotransplantate nicht exponiert sind. Die funktionelle warme ischämische Zeit könnte daher ein wichtiger Treiber der PID bei DCD HT sein. Die Mechanismen, die der PID in diesem klinischen Szenario zugrunde liegen, sind jedoch auf molekularer Ebene nur unzureichend verstanden. Die hier vorgestellte Arbeit zielt darauf ab, die Entwicklung und Validierung eines High-Fidelity-Non-Survival-Schweinemodells der orthotopen DCD-Herztransplantation zu beschreiben. Wir stellen die Hypothese auf, dass die Verwendung dieses translationalen Großtiermodells entscheidend ist, um molekulare Mechanismen aufzuklären, die zur PID beitragen, sowie um Interventionen zur Optimierung der Allotransplantatkonservierung und der frühen Leistung zu untersuchen. Dieses Modell repliziert den perioperativen und chirurgischen Ansatz, der bei DCD HT klinisch verwendet wird, mit Modifikationen, um die Anatomie und Physiologie des Schweins zu berücksichtigen. Die Entwicklung dieses chirurgischen Modells für Großtiere wird nicht nur mechanistische Einblicke in die Entwicklung der PID liefern, sondern kann auch modifiziert werden, um die translationale Forschung zur Verbesserung der Organwiederherstellung nach DCD HT zu verbessern.
Einleitung
Für Patienten mit Herzinsuffizienz im Endstadium, die nicht medizinisch behandelt werden können, bleibt die Herztransplantation die Therapie, die mit dem besten Langzeitüberleben und der besten Lebensqualität verbunden ist. In der Vergangenheit erforderte die Herztransplantation die Verwendung eines Herzallotransplantats, das von einem hirntoten Spender (DBD HT) beschafft und unter Lagerung mit hypothermischer statischer Lagerung transportiert wurde. Die Zahl der Patienten, die eine Herztransplantation benötigen, übersteigt jedoch die Zahl der verfügbaren Spender. Während weltweit jährlich mehr als 5.000 Herztransplantationen durchgeführt werden, warten schätzungsweise 50.000 Kandidaten auf eine Herztransplantation1. Darüber hinaus liegt die Verwendung von Organen von identifizierten Spendern nach wie vor bei nur 30 %2. Um die Verwertung von Spenderorganen zu verbessern, wurden in den letzten Jahren alternative Spende- und Beschaffungsmethoden entwickelt, darunter die Herztransplantation nach Spende nach Kreislauftod (DCD HT)3,4,5,6.
DCD HT-Spender erfüllen die formalen Hirntodkriterien nicht, haben aber eine nicht heilbare neurologische Verletzung, für die eine laufende medizinische Versorgung als sinnlos erachtet wird. Bei einer DCD HT-Beschaffung werden lebenserhaltende Maßnahmen abgesetzt und der Patient auf das Fortschreiten zu Apnoe und Kreislaufstillstand überwacht. Der Tod wird in diesen Situationen von einem Arzt erklärt, der nicht an der Transplantation oder Organbeschaffung beteiligt ist. Sobald der Tod erklärt wurde, gibt es eine zusätzliche Distanzierungsphase (in der Regel 5 Minuten), in der der potenzielle Spender beobachtet wird, um sicherzustellen, dass es keine Genesung oder Lebenszeichen gibt, wonach die Todeserklärung erneut bestätigt wird, bevor mit der Organentnahme fortgefahren wird 7,8. DCD-Allotransplantate werden daher einer variablen Periode warmer Ischämie (mindestens 10 min) ausgesetzt, der DBD-Spender-Allotransplantate nicht ausgesetzt sind. Diese Periode der warmen Ischämie hat zuvor von der Herztransplantation mit DCD-Spendern abgehalten. In den letzten fünf Jahren wurden jedoch zwei Beschaffungsreperfusionsmethoden für die Allotransplantatwiederherstellung nach der warmen ischämischen Zeit im Zusammenhang mit DCD entwickelt. Zunächst umfasst die direkte Entnahme und Perfusion (DPP) eine Spenderkardiektomie nach Bestätigung des Kreislauftods, gefolgt von der Wiederbelebung des Allotransplantats und der Konservierung durch ex vivo-Perfusion. Alternativ nutzt die normotherme regionale Perfusion (NRP) die extrakorporale Zirkulation unter Ausschluss der Hirnzirkulation, um das Spenderherz in situ vor der Kardiektomie zu reperfundieren und zu reanimieren 9,10,11,12.
Bisher war das Kurzzeitüberleben im Zusammenhang mit DCD HT ähnlich wie bei DBD HT. Erste Studien deuten jedoch auch darauf hin, dass bei DCD HT im Vergleich zu DBD HT ein höheres Risiko für eine schwere primäre Transplantatdysfunktion (PID)besteht. PID ist ein Begriff, der verwendet wird, um den klinischen Umstand zu beschreiben, unter dem nach einer Herztransplantation die frühe Funktion des Allotransplantats nicht ausreicht, um den Kreislaufbedarf des Empfängers zu decken. Ein System zur Einstufung des Schweregrads der PID wurde von der International Society of Heart and Lung Transplantation beschrieben. Bei schwerer PID ist eine mechanische Durchblutungsunterstützung erforderlich, um eine ausreichende Durchblutung in der Zeit nach der Transplantation zu gewährleisten13. Diese Erkrankung ist die Hauptursache für die frühe postoperative Mortalität nach einer Herztransplantation. Die Ätiologie der PID sowohl für DBD HT als auch für DCD HT ist wenig verstanden, aber wahrscheinlich multifaktoriell, wobei Spender-, Konservierungs- und Empfängervariablen alle dazu beitragen. Bei DCD-Allotransplantaten werden die warme ischämische Schädigung während der DCD-Entnahme sowie schädliche spenderspezifische Reaktionen, einschließlich hämodynamischer Instabilität, metabolischer Störungen und Anstiege von Katecholaminen, Zytokinen, Laktat und Kalium, als Faktoren vorgeschlagen, die zu einem erhöhten Risiko für PID im Vergleich zu DBD-Allotransplantaten beitragen können. 14,15,16. Die Mechanismen, die der PID in diesem klinischen Szenario zugrunde liegen, sind jedoch auf molekularer Ebene nur unzureichend verstanden. Darüber hinaus, vielleicht aufgrund dieser Bedenken, ist die Wahrscheinlichkeit, dass DCD-Herzen abgenommen werden, 3,37-mal höher als bei DBD-Organen17. Infolgedessen besteht nach wie vor ein ungedeckter Bedarf, die Organnutzung zu verbessern und die Transplantationsergebnisse durch die Optimierung des Organkonservierungsprozesses zu verbessern.
In dieser Studie beschreiben wir eine schweinische DCD HT unter Verwendung von DPP, die die aktuelle klinische DPP DCD HT mit hoher Genauigkeit widerspiegelt. Dieses Modell umfasst Elemente während des gesamten DCD-Transplantationsprozesses: 1) DCD-Beschaffung, 2) Ex-vivo-Perfusionserhaltung mit einem Organpflegesystem (OCS) und 3) Empfängerimplantation. Dieses umfassende Modell bietet die Möglichkeit, die Mechanismen, die der PID bei DCD HT zugrunde liegen, besser zu charakterisieren. Dies ermöglicht dann die Entwicklung gezielter und rationaler therapeutischer Strategien, die darauf abzielen, den Erhalt und die Leistung von Allotransplantaten zu verbessern. Darüber hinaus bietet dieses Modell eine Plattform für die präklinische Bewertung solcher neuartigen Therapeutika, die wichtig sein werden, um das Gebiet der Herztransplantation auf sichere und schnelle Weise voranzutreiben.
Protokoll
Alle Haltungen und Verfahren wurden vom Institutional Animal Care and Use Committee des Duke University Medical Center in Übereinstimmung mit ihren Vorschriften und Richtlinien genehmigt.
1. Präoperative Vorbereitung des Spenders
- Wählen Sie zwei Yorkshire-Schweine mit einem Gewicht von 70-80 kg aus, die der Blutgruppe entsprechen (Blutgruppenbestimmung durchgeführt von Looper Farms in Granite Falls, NC, USA). Fasten Sie beide Schweine mindestens 6-8 Stunden vor der Operation.
- Bereiten Sie das Herzperfusionsmodul gemäß den Richtlinien des Herstellers und den notwendigen Point-of-Care-Tests vor (Materialtabelle).
- Bereiten Sie die Wartungslösung für das Herzperfusionsmodul vor. Diese Lösung enthält Nährstoffe für das stoffwechselaktive Herz sowie Adenosin, um den Zielblutdruck aufrechtzuerhalten.
- Fügen Sie Folgendes hinzu: 500 ml klare Priming-Lösung, 100 ml 25% Albumin, 100 mg Ciprofloxacin (200 mg/100 ml), zwei 5-ml-Durchstechflaschen mit Multivitamin-Injektion, 20 mEq Natriumbicarbonat, 1 g Cefazolin-Natrium und 250 mg Methylprednisolon. Gib die Priming-Lösung auf und gib den Inhalt in das Herzperfusionsmodul.
- Nach der Zubereitung injizieren Sie 50 I.E. humanes rekombinantes Insulin in den Beutel.
- Bereiten Sie eine Adrenalinlösung vor, indem Sie 0,25 mg Adrenalin und 30 I.E. humanes rekombinantes Insulin in einen 500-ml-Beutel mit 5% Dextrose in Wasser injizieren. Diese Lösung soll die Katecholamine ersetzen, anstatt eine inotrope Wirkung zu haben. Die Lösung mit 10 mL/h infundieren.
- Bereiten Sie die T4-Lösung vor, indem Sie 200 μg rekonstituiertes Levothyroxin in einen 100 ml 0,9%igen Beutel mit normaler Kochsalzlösung injizieren. Mit einer Geschwindigkeit von 3 ml/h infundieren.
- Bereiten Sie die Wartungslösung für das Herzperfusionsmodul vor. Diese Lösung enthält Nährstoffe für das stoffwechselaktive Herz sowie Adenosin, um den Zielblutdruck aufrechtzuerhalten.
- Betäuben Sie das vorgesehene Spenderschwein mit 4,4 mg/kg Telazol und 1,0 mg/kg Propofol, gefolgt von 2 % bis 5 % inhalativem Isofluran, das als Gesichtsmaske verabreicht wird.
- Während sich das Schwein in Rückenlage befindet, intubieren Sie mit einem 8-10 mm Endotrachealtubus, um die Atemwege während der Operation zu erhalten. Befestigen Sie den Endotrachealtubus an der Schnauze. Tragen Sie tierärztliche Salbe auf die Augen auf, um die Augenfeuchtigkeit während der Operation aufrechtzuerhalten.
- Führen Sie einen intravenösen (IV) Katheter in eine Ohrvene ein, um IV-Flüssigkeiten zu verabreichen (Erhaltungsflüssigkeiten: Laktat-Ringer-Lösung 10 ml/kg/h).
- Beginnen Sie mit einer kontinuierlichen Fentanyl-Infusion zur Analgesie (25-100 μg/h) und verabreichen Sie 0,2 mg/kg Vecuronium, um die Lähmung aufrechtzuerhalten.
- Platzieren Sie Elektrokardiogramm-Elektroden und Pulsoximeter zur kontinuierlichen Überwachung der elektrischen Aktivität und der Sauerstoffversorgung.
- Beginnen Sie die mechanische Beatmung bei einem Atemzugvolumen von 10 ml/kg/min, einer Frequenz von 10-15 Atemzügen pro Minute und unter Beibehaltung von Isofluran (1%-5%) für den Rest des Eingriffs. Titrieren Sie Anästhetika und vasoaktive Medikamente, so dass Reflexe fehlen, die Herzfrequenz bei 61-99 Schlägen pro Minute bleibt und der systolische Blutdruck bei 90-130 mmHg bleibt.
- Positionieren Sie den Molch auf dem Operationstisch, wobei die oberen Extremitäten cephalad positioniert und außerhalb des Operationsfeldes gesichert sind. Sichern Sie die unteren Extremitäten außerhalb des Operationsfeldes.
- Definieren Sie den Bereich, der in das Operationsfeld aufgenommen werden soll, durch die obere Backe, die vordere Achsellinie bilateral und zwei Fingerbreit unterhalb des Processus xiphoideus im unteren Bereich. Bereiten Sie die Operationsstelle aseptisch vor und bedecken Sie sie gemäß den üblichen Praktiken.
- Führen Sie einen rechtsseitigen Karotisschnitt durch.
- Machen Sie mit einer Klinge #10 einen schrägen Schnitt am rechten seitlichen Hals, zwei Fingerbreit lateral der Luftröhre, entlang des medialen Randes des Musculus sternocleidomastoideus.
- Führen Sie diesen Schnitt mit Elektrokauter durch das Platysma und stellen Sie die Blutstillung sicher. Sobald Sie das Platysma durchdrungen haben, verwenden Sie einen selbsthaltenden Retraktor, um die Exposition zu erleichtern.
- Präparieren und isolieren Sie vorsichtig die Halsschlagader und die Vena jugularis interna; Legen Sie eine Gefäßschlaufe um jedes Gefäß.
- Tragen Sie 10 ml 2% Lidocain topisch auf, um die Gefäße zu baden.
HINWEIS: Lidocain wird wegen seiner gefäßerweiternden Wirkung verwendet, da sich die Schweinegefäße bei Manipulation leicht verkrampfen und schwer zu kanülieren sein können. - Bei der Seldinger-Technik wird die Halsschlagader mit einer 5 Fr Mikropunktion direkt kanüliert, gefolgt von einer 6 Fr Einführschleuse.
- Verbinden Sie die Einführschleuse mit einer arteriellen Leitung und einem Schallkopf zur kontinuierlichen Überwachung des systemischen arteriellen Drucks während des Eingriffs.
- Entnahme von Blut aus der arteriellen Leitung der Halsschlagader für präoperative Laboruntersuchungen (vollständiges Blutbild, umfassendes Stoffwechselpanel, Troponin, Laktat und Vollblut für die Isolierung mononukleärer Zellen des peripheren Blutes).
- Kanülieren Sie die Vena jugularis interna mit der gleichen Technik wie in 1.11.5. Lassen Sie die 6-Fr-Schleuse an Ort und Stelle, da diese zur Einführung eines Druck-Volumen-Schlingenkatheters für nachgeschaltete Funktionsbeurteilungen verwendet wird.
2. Spende nach Kreislauftod und Spenderkardiektomie
- Führen Sie eine Sternotomie durch.
- Machen Sie mit einer Klinge #10 einen Längsschnitt von der sternalen Kerbe bis zum Xiphoid-Prozess. Führen Sie die Dissektion mit Elektrokauter durch das Unterhautgewebe und die Faszien des Brustmuskels nach unten.
- Ritzen Sie die Mittellinie des Brustbeins mit Elektrokauter ein. Präpariere die Bänderansätze am Manubrium und um den Xiphoidfortsatz herum.
- Verwenden Sie eine oszillierende Sternumsäge, um den vorderen Tisch des Brustbeins vorsichtig entlang der Mittellinie zu teilen. Mit der oszillierenden Säge den hinteren Tisch des Brustbeins auf Höhe des Handtuchs vollständig teilen. Achten Sie darauf, dass die Vene innominatus bei diesem Schritt nicht verletzt wird. Vervollständigen Sie die sternale Teilung des hinteren Tisches unterhalb des Manubriums mit einer schweren Schere.
HINWEIS: Eine manuelle stumpfe Dissektion der Ebene zwischen der Unterseite des Brustbeins und dem Perikard kann dazu beitragen, Verletzungen des Herzens während dieses Schritts zu vermeiden. - Verwenden Sie Elektrokauter, um die Blutstillung der Brustbeinränder zu erhalten. Platzieren Sie einen Brustbein-Retraktor.
- Entfernen Sie das Thymus- und Perikardfettpolstergewebe mit Elektrokauter, um die Freilegung des Perikards zu optimieren.
- Öffnen Sie das Perikard vorsichtig mit einem Elektrokauter. Führen Sie den Schnitt in Längsrichtung von der Spitze des Herzens bis zur Höhe der Aorta.
- Eine Perikardmulde mit 2-0 Seidenstichen erstellen.
- Durchführung von Allotransplantatanalysen von Spendern zu Studienbeginn.
- Während das Spenderherz freigelegt wird und vor jeder direkten Herzmanipulation, sollten Sie Basisanalysen durchführen. Dazu gehören die direkte epikardiale Echokardiographie, die Beurteilung der Druck-Volumen-Schleife und Biopsien von Myokardkernnadeln.
- Führen Sie die Echokardiographie auf sterile Weise durch, um standardmäßige Lang- und Kurzachsenansichten direkt von der Epikardoberfläche zu erhalten.
- Um Druck-Volumen-Loop-Aufzeichnungen durchzuführen, führen Sie einen Festkörper-Druck-Volumen-Katheter (5Fr, 122 cm) nacheinander in die Halsschlagader und die Vena jugularis interna in den linken bzw. rechten Ventrikel ein.
- Messen Sie die Länge des Katheters, der von außen eingeführt werden soll (von der Kanülenstelle bis zur Herzspitze), bevor er in die Scheide eingeführt wird.
- Führen Sie den Katheter in die Arterienscheide ein und führen Sie ihn mit epikardialem Ultraschall in den linken Ventrikel. Stellen Sie sicher, dass der Katheter eine Ventrikelwand nicht direkt berührt, da dies die Messgenauigkeit beeinträchtigen kann.
- Führen Sie anschließend den Katheter in die Venenscheide ein und führen Sie ihn in den rechten Ventrikel, indem Sie ihn direkt abtasten oder mit epikardialem Ultraschall führen.
- Führen Sie Myokardbiopsien an der Kernnadel durch, um Gewebe für spätere Analysen zu sammeln. Führen Sie dies in der Spitze des linken Ventrikels durch. Wenn es starke Blutungen an der Biopsiestelle gibt, legen Sie einen Reparaturstich an.
- Bereiten Sie das Spenderherz vor.
- Präparieren Sie das aortopulmonale Fenster, um Platz für die Platzierung der Kreuzklemme zu schaffen.
- Präparieren Sie die obere Hohlvene (SVC) und die untere Hohlvene (IVC) mit Elektrokauter.
- Um zu antikoagulieren, verabreichen Sie 300 Einheiten/kg Heparin intravenös (IV) vor der Aortenkanüle.
- Verwenden Sie eine doppelarmige Naht aus 4-0 Polypropylen, um eine Aortentasche in die Aortenwurzel für die Aortenkanülierung zu platzieren. Kanülierung mit 7 Fr (14G) Aortenwurzelvent-Kanüle.
- Entlüften Sie die Luft und sichern Sie sie mit einem Rumel-Tourniquet. Spülen Sie den Kardioplegieschlauch, um die Luft zu entlüften und die Leitung an der Aortenwurzelkanüle zu befestigen.
- Um sich auf eine zukünftige Venenkanüle vorzubereiten, platzieren Sie anschließend einen Stich in das rechte Vorhofohr und sichern Sie ihn mit einem Rumel-Tourniquet.
- Führen Sie einen kontrollierten Kreislauftod durch.
- Geben Sie einen I.v. Bolus von 250 μg Fentanyl, gefolgt von einer kontinuierlichen Infusion (CRI) mit 100 μg/h zur Analgesie. Zur Lähmung 0,2 mg/kg Vecuronium intravenös verabreichen.
- Beenden Sie die mechanische Beatmung, um den kontrollierten Kreislauftodprozess zu starten.
- Kontinuierliche Überwachung des systolischen und mittleren arteriellen Blutdrucks, der Pulsatilität der arteriellen Leitung, der elektrischen Herzaktivität und des Sauerstoffversorgungsstatus.
HINWEIS: Die agonale Phase beginnt, wenn der systolische Blutdruck unter 50 mmHg fällt. An diesem Punkt kann sich das Herz ausdehnen. Der Tod wird durch mechanische Asystolie (pulslose elektrische Aktivität) und kein Lebenszeichen definiert. Diese Studie definiert den Tod durch elektrische Asystolie in diesem Modell nicht, da die langsame pulslose elektrische Aktivität bei Schweinen über einen längeren Zeitraum anhält als beim Menschen, was zu einer erhöhten ischämischen Insultation des Allotransplantats führen kann, als für das Modell vorgesehen. - Warten Sie 10 Minuten nach dem Zeitpunkt des Todes/der Asystolie, bevor Sie mit den folgenden Schritten des Protokolls fortfahren. Dieses Intervall simuliert die Standoff-Periode plus die Zeit, die für den mediastinalen Eintritt und die Vorbereitung im klinischen DCD HT benötigt wird.
- Führen Sie ein Ex-vivo-Priming des Perfusionsgeräts durch.
- Machen Sie mit einer Klinge #11 einen Stichschnitt in das rechte Vorhofohr und kanülieren Sie mit der vom Hersteller bereitgestellten Venenkanüle 34Fr. Sichern Sie die Kanüle mit einem Rumel-Tourniquet und verbinden Sie die Kanüle mit dem Sammelbeutel des ex vivo-Perfusionsgeräts.
- Entnehmen Sie ca. 1200-1500 ml Spenderblut in den vom Hersteller bereitgestellten Entnahmebeutel. Vor der Entblutung wurden 30.000 U Heparin und 2 mg Tirofiban HCl in den Sammelbeutel gegeben.
- Filtern Sie das Spenderblut und geben Sie es in das Herzperfusionsmodul ab.
- Führen Sie eine Spenderkardiektomie durch.
- Nach der Entnahme des Spenderblutes legen Sie die Aortenkreuzklemme an.
- Es ist zu beachten, dass die Aortenwurzel und die aufsteigende Aorta des Schweins erheblich kürzer sind als beim Menschen. Achten Sie darauf, die Kreuzklemme so proximal wie möglich anzulegen, um ein Einklemmen des Fußgewölbes oder einen unvollständigen Verschluss der Aorta zu vermeiden.
- Verabreichen Sie 1 l Del Nido-Kardioplegie in die Aortenwurzel mit einem Wurzeldruck von 60-100 mmHg.
- Die untere Hohlvene an der Perikardreflexion und das linke Vorhofohr zur Entlüftung des rechten und linken Ventrikels während der Kardioplegie durchschneiden.
- Lege kalten sterilen Matsch auf das Spenderherz.
- Teilen Sie die IVC, SVC, die Aorta direkt distal der Arteria innominatis und die Lungenarterie (PA) an der Bifurkation. Durchschneiden Sie den linken Vorhof des Spenders (LA) und lassen Sie eine ausreichende Gewebemanschette auf dem Allotransplantat.
- Nehmen Sie das Herz vom Feld und legen Sie es in ein mit sterilem, kaltem Matsch gefülltes Becken für die Zubereitung auf dem hinteren Tisch.
- Platzieren Sie vier äquidistante verpfändete horizontale Matratzennähte (4-0 Polypropylen) am distalen Ende der Aorta.
- Nach der Entnahme des Spenderblutes legen Sie die Aortenkreuzklemme an.
- Ex-vivo-Perfusion
- Setzen Sie den ex vivo Perfusionsaortenadapter in die distale Aorta ein und befestigen Sie ihn fest mit einer 0-0-Seidennaht oder einem Nabelband, das direkt unter den verpfändeten Nähten platziert wird.
- Lassen Sie das PA, SVC, IVC und den linken Vorhof offen, während Sie sich auf dem Ex-vivo-Perfusionsgerät befinden.
HINWEIS: Bei dieser Konfiguration wurde keine linksventrikuläre Dehnung festgestellt. - Transportieren Sie das Allotransplantat zum ex vivo Perfusionsgerät und schließen Sie den Aortenadapter an. Stellen Sie sicher, dass die hintere Oberfläche des Herzens nach vorne zeigt. Stellen Sie sicher, dass die vordere Oberfläche des Herzens mit dem Gerät und zwei Defibrillationspads in Kontakt kommt. Halten Sie das Allotransplantat bei 34 °C. Defibrillieren Sie nach Bedarf, um ventrikuläre Arrhythmien wieder in einen organisierten Rhythmus zu bringen.
- Zu diesem Zeitpunkt könnte ein Therapeutikum über den Kardioplegie-Port in den Ex-vivo-Perfusionskreislauf eingeführt werden. Alternativ kann der Perfusat- oder physikalische Schaltkreis modifiziert werden, um experimentelle Bedingungen zu bewerten, die darauf abzielen, die Wiederfindung eines DCD-HT-Allotransplantats zu verbessern. Zum Beispiel haben wir bereits gezeigt, dass das Perfusat über einen Zellschoner von vorgeformten neutralisierenden Antikörpern gewaschen werden muss, um die Transduktion mit viralen Vektoren zu verbessern 18,19,20.
- Verwenden Sie Point-of-Care-Labore, um die Verabreichung von Natriumbicarbonat, Calciumgluconat und Dextrose nach Bedarf zu steuern.
- Entnahme von Perfusatproben, Blutuntersuchungen und Kernnadelbiopsieproben während dieser ex vivo Perfusionsphase.
HINWEIS: Bei diesem Modell verbleibt das Allotransplantat ca. 2-3 h auf dem ex vivo-Perfusionsgerät, bevor es in den Empfänger implantiert wird (Tabelle 1). Die Zeitspanne, in der das Allotransplantat ex vivo perfundiert wurde, wurde durch die Zeit bestimmt, die benötigt wurde, um das Empfängertier für die Implantation vorzubereiten. Die ex vivo Perfusionszeit ist jedoch eine Variable, die auf der Grundlage von Studienzielen angepasst werden kann.
3. Empfängerkardiektomie, Implantation und Reperfusion
- Bereiten Sie das Empfängermolch wie in den Schritten 1.3-1.11.8 beschrieben vor.
- Legen Sie zusätzlich einen 7 Fr 20 cm großen Dreilumen-Zentralkatheter unter Ultraschallkontrolle und der Seldinger-Technik in die linke Vena jugularis extern oder interna. Legen Sie einen 5 Fr Femurarterienzugang unter Ultraschallkontrolle an.
- Nachdem Sie das sterile Feld drapiert haben, bereiten Sie den kardiopulmonalen Bypass-Kreislauf (CPB) vor und bringen Sie die Leitungen auf das Feld.
- Rezirkulieren Sie durch die arteriellen und venösen CPB-Leitungen, um Luft zu entlüften. Klemmen und teilen Sie die Leinen. Bereiten Sie den Venenzugang für die bikavale Kanülierung vor.
- Verabreichen Sie eine präoperative Dosis von 1 g Methylprednisolon, um Entzündungsreaktionen aufgrund von Abstoßung oder Ischämie zu behandeln, wie dies bei der klinischen Herztransplantation in der Einrichtung erfolgt, in der diese Studie durchgeführt wird.
- Führen Sie einen Schnitt der rechten Halsschlagader und eine Mittelliniensternotomie durch, wie zuvor in den Schritten 1.11 und 2.1 beschrieben.
- Führen Sie die Empfängerkardiektomie durch.
- Präparieren Sie das aortopulmonale Fenster wie zuvor. Präparieren Sie das SVC und IVC und legen Sie ein umlaufendes Nabelband um die Gefäße.
- Vor der Kanülierung 400 Einheiten/kg Heparin verabreichen. Titrieren Sie auf ein Ziel der aktivierten Gerinnungszeit (ACT) > 480 s.
- Platzieren Sie einen Standard-Aortenkanülen-Taschenstich in der distalen aufsteigenden Aorta (mit doppelarmigem verpfändetem 2-0 beschichtetem, geflochtenem Polyesternaht). Sichern Sie es mit einem Rumel-Tourniquet und einem Bluthämostaten.
- Stellen Sie sicher, dass der systolische Blutdruck weniger als 120 mmHg beträgt. Verwende eine #11 Klinge, um einen Stichschnitt in voller Dicke in der Handtasche zu machen. Kanülieren Sie die Aorta mit einer 15 Fr Kanüle durch diesen Schnitt. Befestigen Sie die Kanüle mit einem Rumel-Tourniquet.
- Klemmen Sie die Aortenkanüle ein. Nach dem Entlüften der arteriellen Bypassleitung die Aortenkanüle an den CPB-Kreislauf anschließen. Stellen Sie sicher, dass sich keine Luftblasen in der Leitung befinden.
- Machen Sie eine weitere Aortenschnur und führen Sie die Aortenwurzelvenüle ein.
- Die Venenkanülierung in bikavaler Technik mit rechtwinkligen Kanülen mit 18-20 Fr Metallkanülen sowohl im SVC als auch im IVC durchführen, die mit Rummel-Tourniquets gesichert sind. Verbinden Sie dann diese Kanülen mit dem venösen Schenkel des CPB-Kreislaufs.
- Initiieren Sie CPB auf einen Zieldurchfluss von 2,4 l/min/m2 und kühlen Sie auf 32 °C ab. Titrieren Sie Anästhetika und Vasopressoren, um einen mittleren arteriellen Druck > 60 mmHg aufrechtzuerhalten.
HINWEIS: Diese Eingriffe werden mit staatlich geprüften Herz-Thorax-Anästhesisten und zertifizierten Perfusionisten durchgeführt, die das hämodynamische Management während des gesamten CPB-Laufs überwachen und koordinieren. - Legen Sie die Aortenkreuzklemme proximal an die Aortenkanüle an und fahren Sie mit einer Erklärung des natürlichen Herzens des Empfängers fort. Lassen Sie die rechte und linke Vorhofmanschette intakt, die groß genug ist, um eine biatriale Implantationstechnik zu ermöglichen.
HINWEIS: In diesem Modell wird die biatriale Technik verwendet, da das Gefäßsystem des Schweins sehr empfindlich ist, was die IVC- und SVC-Gefäßanastomosen in einer bicavalen Technik technisch anspruchsvoll macht. - Durchschneiden Sie die Aorta und die PA so nah wie möglich an der Wurzel, um die maximale Gefäßlänge zu erhalten. Legen Sie das frisch explantierte Herz in eiskalte, phosphatgepufferte Kochsalzlösung (PBS), um es zu transportieren und im Labor zu verarbeiten.
- Führen Sie eine biatriale Implantation des Allotransplantats des Empfängers durch.
- Kühlen Sie das Allotransplantat auf dem Ex-vivo-Perfusionsgerät gemäß den Anweisungen des Herstellers. Verabreichen Sie vor der Entnahme aus dem Gerät erneut 1 l kalte Del Nido-Kardioplegie bei Herz-Lungen-Stillstand.
- Trennen Sie den Aortenadapter und transportieren Sie das Herz in einem Becken mit sterilem, kaltem Matsch zum hinteren Tisch.
- Untersuchen Sie das Herz auf offene Primum Fossa ovalis (PFO) oder Stellen unbeabsichtigter Verletzungen.
HINWEIS: Wichtig ist, dass es bei Schweinen in der Regel eine systemische Vene gibt, die entlang der linken Vorhofgrenze abfließt, bevor sie in den rechten Vorhof oder die IVC abfließt. Diese Vene kann während des Entnahmeprozesses geöffnet werden, und es sollte darauf geachtet werden, dass sie ligiert wird, bevor mit der Implantation fortgefahren wird. - Schneiden Sie die Aorta auf gesundes Gewebe unterhalb der Adapterbefestigungsstelle zurück.
- Schneiden Sie mit einer Metzenbaum-Schere die linke Vorhoföffnung auf die Größe der LA-Manschette der Empfängerin ab. Machen Sie das Gleiche mit dem rechten Vorhof.
- Beginnen Sie die Anastomose des linken Vorhofs laufend mit einer doppelarmigen 4-0 Prolene-Naht. Fahren Sie mit der rechten PA, der Aorta und der rechten Vorhofanastomose fort, die ebenfalls alle mit einer kontinuierlichen 4-0-Prolenennaht ergänzt werden.
- Beginnen Sie mit der Wiedererwärmung auf Normothermie (37 °C), bevor Sie die Aortenkreuzklemme entfernen.
- Führen Sie eine Allotransplantat-Reperfusion durch und entwöhnen Sie sich von CPB.
- Nachdem Sie alle Anastomosen abgeschlossen haben, lösen Sie die Aortenkreuzklemme, um das Allotransplantat zu reperfundieren.
- Stellen Sie sicher, dass alle Anastomosen blutstillen.
- Warten Sie auf die Rückkehr des ursprünglichen Rhythmus und der Kontraktilität. Platzieren Sie die epikardialen Stimulationsdrähte und das Tempo bei 100 Schlägen pro Minute, wenn die Herzfrequenz des Allotransplantats <100 Schläge pro Minute beträgt.
- Versuchen Sie nach 60 Minuten Reperfusion, sich von CPB zu entwöhnen. Die Empfänger werden mit 0,05 μg/kg/min Adrenalin sowie Vasopressorinfusionen unterstützt, je nach Bedarf, um einen mittleren arteriellen Druck (MAP) >65 mmHg aufrechtzuerhalten.
- Führen Sie Analysen wie Echokardiographie, Blutuntersuchungen, Myokardbiopsien und die Beurteilung der Druck-Volumen-Schleife sowohl zu frühen als auch zu späten Reperfusionszeitpunkten durch.
4. Beendigung des Versuchs und Euthanasie
HINWEIS: In dieser Studie wurde das transplantierte Tier nach der Trennung von CPB 1 h lang unterstützt.
- Nach Abschluss des Experiments wird die Euthanasie durch Entblutung unter Narkose durchgeführt.
- Explantieren Sie das transplantierte Allotransplantat, indem Sie die Nahtlinien entlang aller Anastomosen durchschneiden. Achten Sie darauf, dass der Allotransplantatprobe kein natives Empfängergewebe beigefügt wird.
- Legen Sie das Allotransplantat sofort in eiskaltes PBS und transportieren Sie es zur Verarbeitung und Lagerung ins Labor.
Ergebnisse
Insgesamt wurden 6 DCD-Transplantationen von Schweinen für eine Pilotanalyse unter Verwendung des hier beschriebenen Protokolls durchgeführt. Im Laufe dieser sechs Pilotexperimente wurden Komponenten des Protokolls verfeinert, um den Anforderungen des Modells besser gerecht zu werden, die Reproduzierbarkeit zu verbessern und logistische Einschränkungen zu berücksichtigen. Das endgültige resultierende Protokoll, wie es hier geschrieben ist, ist in Abbildung 1 zusammengefasst.
Anders als beim vom Menschen kontrollierten zirkulatorischen Todesprozess hielten Schweineherzen, die einer Ischämie ausgesetzt waren, die elektrische Aktivität viel länger als erwartet aufrecht, selbst nachdem die Kontraktilität aufgehört hatte. Nach der Feststellung dieses Unterschieds im ersten Experiment wurde die elektrische Asystolie als Maß für die Todeserklärung als unzuverlässig erachtet. Um eine warm-ischämische Schädigung des Allotransplantats zu vermeiden, die in keinem Verhältnis zu der im klinischen Kontext beobachteten steht, wurde die mechanische Asystolie (pulslose elektrische Aktivität) verwendet, um den Todeszeitpunkt für die verbleibenden Transplantationsverfahren zu bestimmen.
Darüber hinaus betrug die Standoff-Phase zunächst 15 Minuten vor Beginn der Spenderkardiektomie. Diese wurde für die ersten drei Experimente des Pilotversuchs genutzt. Ein Teil der Begründung für diese 15-minütige warme Ischämie-Periode war, dass wir eine ausreichend schwere Verletzung anstrebten, um einen Grad an Transplantatdysfunktion nach der Transplantation zu haben, der für eine Studie geeignet wäre. Wir fanden heraus, dass die Transplantatdysfunktion in diesen frühen Experimenten so schwerwiegend war, dass wir Schwierigkeiten hatten, das Empfängertier eine Stunde lang nach der Trennung von CPB aufrecht zu erhalten, so dass das Empfängertier hohe Dosen von Inotropika und Druckunterstützung benötigte, um den 1-Stunden-Zeitpunkt einzuhalten. Angesichts dieser Schwierigkeiten reduzierten wir die Dauer der warm-ischämischen Schädigung auf 10 Minuten, was der klinischen DCD HT mit ex vivo-Perfusion näher kommt. Abbildung 2 zeigt repräsentative Bilder des Allotransplantats in diesem Stadium sowie während der ex vivo-Perfusion und nach der Implantation. Schließlich wurden Anpassungen an der Titration von Vasopressor- und Inotrop-Infusionen in der Post-CPB-Entwöhnungsphase vorgenommen, um das neu transplantierte Herz zu unterstützen. Die Notwendigkeit eines erfahrenen Teams mit spezifischer Expertise in der kardiovaskulären Anästhesiologie, um den Erfolg in dieser Post-CPB-Phase zu steigern, kann nicht genug betont werden.
Die Operationszeiten wurden in 4 der 6 Experimente erfasst und sind in Tabelle 1 zusammengefasst. In der DCD-Beschaffungsphase des Protokolls betrug die verstrichene Zeit von der Beendigung der lebenserhaltenden Maßnahmen beim Spenderschwein bis zur Todeserklärung 14,25 (+/- 2,6) min. Die operative kardiopulmonale Bypasszeit und die Cross-Clamp-Zeit blieben während der gesamten Pilotversuche mit etwa 3 h bzw. 1,5 h konstant. Die Experimente wurden etwa 1 h nach der Trennung von CPB mit Euthanasie beendet. Es gab Schwankungen im Stabilitätsgrad der Tiere zum Zeitpunkt der Euthanasie. Einige Tiere zeigten eine relativ gute Stabilität und nur eine leichte Transplantatdysfunktion, während andere eine signifikante hämodynamische Instabilität und eine schwere Transplantatdysfunktion aufwiesen. Repräsentative Echokardiographie-Displays sind in Abbildung 3 dargestellt. Diese und andere funktionelle Bewertungen, wie z. B. PV-Schleifen, können verwendet werden, um Unterschiede in der Allotransplantatfunktion gegenüber dem Ausgangswert sowie vor und nach der Einführung therapeutischer Interventionen zu bestimmen.
Eine Zusammenfassung der Proben, die im Rahmen des Experiments gesammelt, verarbeitet und gelagert wurden, ist in Abbildung 4 dargestellt. Explantierte Herzen wurden sofort in eiskaltes PBS gelegt und im Labor für die Gewebe- und Molekularanalyse gelagert. Das native Herz des Empfängers wurde als Kontrolle verwendet, während das transplantierte Allotransplantat als Versuchsgewebe gelagert wurde. Die Herzen wurden von der Spitze bis zur Basis in 4 Querschnitte geschnitten. Von jeder dieser Kammern wurden repräsentative Gewebeproben jeder Kammer (linker Ventrikel, rechter Ventrikel, Septum und beide Vorhöfe) in flüssigem Stickstoff schockgefroren und bei -80 °C für zukünftige Analysen gelagert. In ähnlicher Weise wurden repräsentative Gewebeproben aus jeder dieser Ebenen und Kammern in RNAlater inkubiert und schockgefroren. Die verbleibende Gewebeprobe wurde für die histopathologische Analyse in Formalin konserviert. Blutproben aus einem beliebigen Zeitpunkt wurden in Duplikaten entnommen und entweder in EDTA- oder CPT-Röhrchen gelagert. Das in EDTA-Röhrchen gelagerte Blut wurde nach unten geschleudert, um Plasma zu isolieren, das schockgefroren wurde. Das Blut in den CPT-Röhrchen wurde für PBMCs unter Verwendung eines modifizierten Protokolls verarbeitet, das vom CPT-Röhrchenhersteller zur Verfügung gestellt wurde.
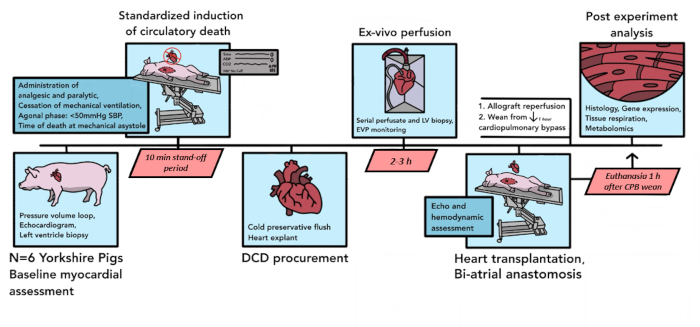
Abbildung 1: Schematische Darstellung des Porcine DCD HT-Protokolls. Die Zeitleiste der Ereignisse, die sich im Rahmen des schweinischen DCD-HT-Verfahrens ereignen, ist hier dargestellt. In dieser Pilotstudie wurden 6 DCD HTs durchgeführt. Die Myokarduntersuchung zu Studienbeginn wird an dem Spenderherz-Allotransplantat des Schweins durchgeführt, woraufhin der kontrollierte Kreislauftod einsetzt. Nach der Todeserklärung gibt es eine 10-minütige Standoff-Phase. Das Allotransplantat wird dann explantiert und zum ex vivo-Perfusionsgerät transportiert, wo es für 2-3 Stunden reperfundiert wird. Nach der Präparation des Empfängertieres wird das Spender-Allotransplantat mit einer biatrialen Technik implantiert. Nach 1 Stunde Reperfusion unter CPB wird der Empfänger von der Bypass-Unterstützung entwöhnt. Die Euthanasie erfolgt 1 h nach der Trennung von CPB. Das implantierte Allotransplantat wird dann für die Gewebeanalyse aufbereitet. DCD HT = Herztransplantation nach Spende nach Kreislauftod; CPB = kardiopulmonaler Bypass. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
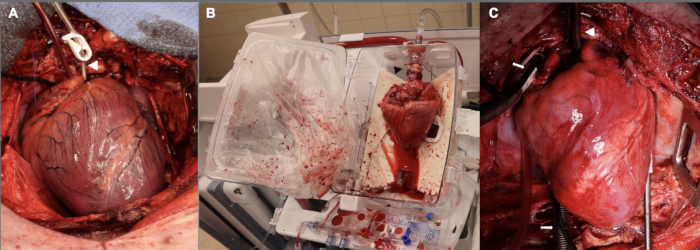
Abbildung 2: Kardiales Allotransplantat von Schweinen in verschiedenen Stadien des DCD-OHT-Prozesses. (A) Nach kontrolliertem Kreislauftod ist das Spenderallotransplantat aufgebläht, ischämisch und ödematös. Die weiße Pfeilspitze zeigt die Aortenwurzelkanüle. (B) Sobald das Allotransplantat vom Spender explantiert wurde, wird es für die Ex-vivo-Perfusion auf das EVP-Gerät gelegt. Beachten Sie die Ausrichtung des Herzens, wobei der hintere Aspekt nach außen zeigt. Die schwarze Pfeilspitze zeigt auf den Aortenadapter, mit dem das Allotransplantat mit dem Gerät verbunden ist. (C) Nach der Implantation in den Empfänger wird das Allotransplantat eine Stunde lang vor der Entwöhnung von CPB auf einem kardiopulmonalen Bypass reperfundiert. Die weiße Pfeilspitze zeigt die Aortenkanüle; Weiße Pfeile zeigen auf die bikavalen Venenkanülen. EVP = ex vivo Perfusion; CPB = kardiopulmonaler Bypass. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
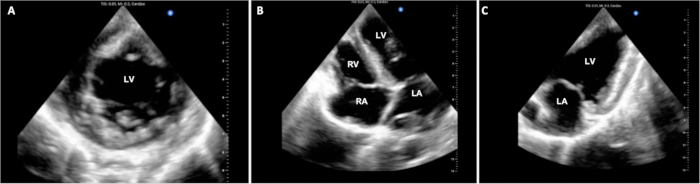
Abbildung 3: Kardiale epikardiale Echokardiographie. Während des DCD-OHT-Verfahrens wurden mehrere epikardiale echokardiographische Bilder aufgenommen, um die ventrikuläre Funktion zu beurteilen. (A) Hier sind Standardansichten mit kurzer Achse, (B) mit 4 Kammern und (C) mit 2 Kammern dargestellt. LV = linker Ventrikel; LA = linkes Atrium; RV = rechter Ventrikel; RA = rechter Vorhof. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
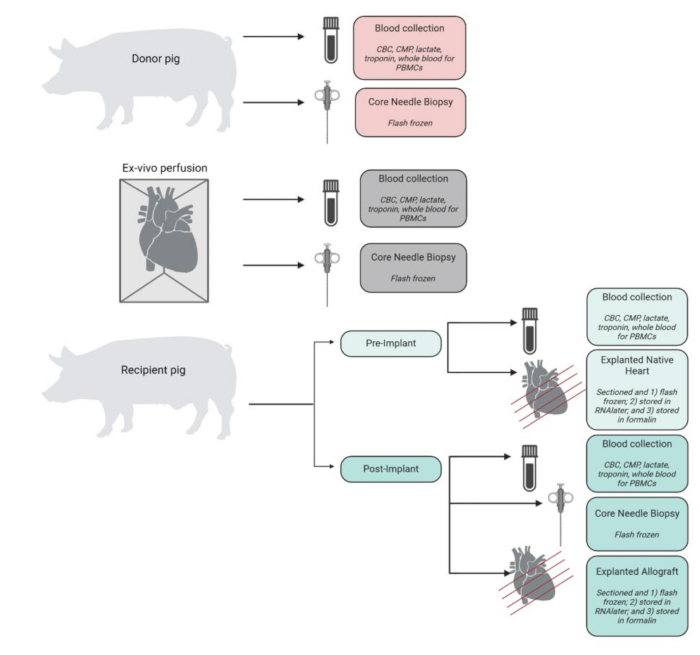
Abbildung 4: Arbeitsablauf bei der Probenentnahme und -verarbeitung. Schematische Darstellung der Probenentnahme und -verarbeitung bei jedem Schritt des Verfahrens. CBC = vollständiges Blutbild; CMP = umfassendes metabolisches Panel; PBMCs = mononukleäre Zellen des peripheren Blutes. In BioRender erstellte Figur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Dauer (min) | |
| (Mittelwert ± SD; n = 4) | |
| Zeit von der Beendigung der Beatmung bis zur Todeserklärung | 14.25 (2.6) |
| Dauer der Ex-vivo-Perfusion | 147 (18) |
| CPB-Dauer | 174 (4) |
| Kreuzspannzeit | 90 (12.5) |
| Zeit von der CPB-Entwöhnung bis zum Tod | 50 (37) |
Tabelle 1. Informationen zum Verfahren. Die durchschnittliche Dauer jedes kritischen Schritts im DCD HT-Verfahren. CPB = kardiopulmonaler Bypass.
Diskussion
Trotz der Wirksamkeit der Herztransplantation bei der Behandlung von Herzinsuffizienz im Endstadium bestehen in diesem Bereich nach wie vor erhebliche Herausforderungen. Um der begrenzten Verfügbarkeit von Spenderorganen entgegenzuwirken, sind in den letzten Jahren Fortschritte bei Methoden zur Konservierung von Herztransplantaten (z. B. normotherme maschinelle Perfusion) in den Vordergrund gerückt. Diese Fortschritte führten zur Einführung der Transplantation von kardialen Allotransplantaten nach Spende nach Kreislauftod (DCD HT). Während die Verwendung von DCD-HT-Allotransplantaten den Spenderpool erweiterte und kurzfristige Ergebnisse erzielt, die denen von DBD-HT-Allotransplantaten nicht unterlegen sind, besteht bei beiden Spendertypen ein Risiko von etwa 5 % für eine frühe Mortalität während der Transplantation3. Das frühe Mortalitätsrisiko bei Herztransplantationen wird hauptsächlich durch die PID bestimmt. Während die PID in der Ätiologie multifaktoriell ist und einen gewissen Beitrag von definierten Spender-, Empfänger- und Konservierungsvariablen leistet, sind die molekularen Mechanismen, die der PID zugrunde liegen, im Allgemeinen noch wenig verstanden. Darüber hinaus ist es angesichts der zusätzlichen warmen ischämischen Verletzung, die durch den DCD-HT-Prozess entsteht, nicht überraschend, dass diese Herzen im Vergleich zu DBD-Allotransplantaten ein höheres Risiko für PID aufweisen können. Daher ist ein besseres Verständnis der PID wichtig, um das kurzfristige Mortalitätsrisiko nach einer orthotopen Herztransplantation zu verringern, und dies könnte insbesondere für DCD HT gelten.
Hier beschreiben wir ein High-Fidelity-Operationsmodell von DCD HT am Schwein. Zu den Vorteilen der Modellierung von DCD HT in vivo in einem Großtiermodell gehören nicht nur die Möglichkeit, die pathophysiologischen Veränderungen besser zu verstehen, die in einem während der DCD HT beschafften Allotransplantat auftreten, sondern auch die Möglichkeit, gezielte Interventionen zu testen, die darauf abzielen, eine optimale Allotransplantatqualität zu gewährleisten. Die Bewertung der linksventrikulären Funktion nach der Implantation und die Analyse der Druck-Volumen-Schleife deuten darauf hin, dass dieses schweinechirurgische Modell in der Lage ist, eine frühe kardiale Allotransplantatdysfunktion nach DCD HT zu rekapitulieren. Somit schafft die hier beschriebene Technik ein reproduzierbares Großtiermodell der PID nach DCD HT und ist an vielen Stellen entlang des DCD HT-Prozesses für die Evaluierung therapeutischer Strategien geeignet. Tatsächlich ist die Verwendung von Ex-vivo-Perfusion als Mittel zur Verabreichung neuartiger Therapeutika, wie z. B. der viralen Vektor-vermittelten Gentherapie, ein aktiver Schwerpunkt in unserem Labor und anderen 18,19,20. Wir haben zuvor die Fähigkeit demonstriert, ein Transgen robust und homogen an ein kardiales Allotransplantat zu verabreichen, indem wir ein Schweine-Non-DCD-HT-Modell verwendet haben. Die gleichen Techniken können auf ein DCD HT Modell19,20 angewendet werden. Andere mögliche therapeutische Strategien umfassen die chemische Modifikation des Perfusats, die Verabreichung kleiner Moleküle zur Verringerung von oxidativem Stress, die Bereitstellung von Stoffwechselsubstraten zur Unterstützung des Stoffwechsels während der ischämischen Periode usw. 16,21,22. Darüber hinaus kann das hierin vorgestellte Modell leicht angepasst werden, um verschiedene Variablen zu bewerten, die mit DCD HT assoziiert sind, einschließlich der verschiedenen klinisch verwendeten Beschaffungstechniken. Zum Beispiel beschreiben wir eine Direktbeschaffungs- und Ex-vivo-Perfusionsstrategie; Das Modell kann jedoch leicht angepasst werden, um alternative Beschaffungsperfusionsmethoden, einschließlich der normothermen regionalen Perfusion, einzubeziehen.
Die in diesem Modell angewandte Operationstechnik ähnelt weitgehend der im klinischen Umfeld; Es gibt jedoch einige wesentliche Unterschiede. Erstens treten die Sternotomie und die kardiale Exposition vor Beendigung der kardiopulmonalen Unterstützung, der agonalen Phase, der Feststellung des Todes und der ethisch vorgeschriebenen Standoff-Periode auf (Modell des offenen Brustkorbs)23. Die Sternotomie wird in dieser Reihenfolge durchgeführt, so dass eine Ausgangsuntersuchung des Spenderherzens, einschließlich Myokardbiopsien, erfolgen kann. Eine vorherige Evaluierung des Zeitpunkts der Sternotomie in einem DCD-HT-Schweinemodell zeigte, dass das Fortschreiten vom Absetzen lebenserhaltender Maßnahmen bis zum Tod (warme ischämische Zeit) schneller ist und weniger ausgeprägte hämodynamische Veränderungen im Modell des offenen Brustkorbs begleitet werden; Diese Allotransplantate können während der Entnahme weniger schädlichen Bedingungen ausgesetzt sein. Es gab jedoch keine signifikanten Unterschiede in den biochemischen (Laktat, Glukose, Katecholamin usw.) Laborwerten oder Markern für den Zelltod zwischen der geschlossenen und der offenen Brustgruppe24. Darüber hinaus ähnelt die Zeit vom Entzug der Beatmung bis zur funktionellen warmen Ischämie in diesem Modell aufgrund der Einbeziehung der 10-minütigen Standoff-Periode in das Modell eher dem Timing der geschlossenen Brustgruppe der zitierten Studie. Darüber hinaus ist in diesem Modell die Zeit der funktionellen warmen Ischämie eine Variable, die modifiziert werden kann, um den experimentellen Zielen einer bestimmten Studie gerecht zu werden. Ein weiterer potenzieller Unterschied zwischen dem hier berichteten Modell und dem klinischen Umfeld besteht darin, dass in diesem Modell die pulslose elektrische Aktivität (PEA; mechanische Asystolie) zur Definition des Todes verwendet wird. Im klinischen Kontext wird eine Todeserklärung von einem Arzt abgegeben, der nicht an der Transplantation beteiligt ist; entweder PEA zusammen mit dem Fehlen anderer Lebenszeichen oder elektrischer Asystolie wäre akzeptabel, um die Kriterien für die Todeserklärung zu erfüllen. Die Schweineherzen hielten ihre elektrische Aktivität über einen längeren Zeitraum aufrecht, nachdem die Kontraktilität beendet war. Um warme ischämische Schäden zu vermeiden, die in keinem Verhältnis zu denen stehen, die im klinischen Kontext beobachtet werden, wurde die mechanische Asystolie (PEA) zur Definition des Todes verwendet. Für Forscher, die ein geschlossenes Thoraxmodell der DCD verwenden, kann die pulslose elektrische Aktivität (mangelnde Pulsatilität an der arteriellen Leitung) immer noch als todesbestimmendes Kriterium verwendet werden. Wir fanden nicht, dass die periphere Sauerstoffsättigung ein relevanter Marker ist, um den Beginn der agonalen Periode oder den Tod zu definieren.
Schließlich haben wir hier ein zeit- und ressourcenintensives Modell beschrieben. Von der Vorbereitung des Spenderschweins bis zum Tod des Empfängertieres dauert es ca. 10 Stunden und erfordert einen großen gemeinsamen Aufwand. Das Verfahrensteam besteht aus erfahrenen Herzchirurgen, Herzanästhesisten, Kardiotechnikern sowie Veterinär- und Labormitarbeitern, die bei der Probenentnahme und -verarbeitung helfen. Ein großes Team wie dieses ist ein integraler Bestandteil des komplexen Verfahrens von DCD HT. Mit einem erfahrenen Team ist jedoch die Erstellung eines High-Fidelity-Schweinemodells von DCD HT möglich, wie in diesem Manuskript beschrieben.
Offenlegungen
CAM hat eine Aktienvergütung für seine Tätigkeit als Berater für TransMedics Inc. erhalten.
Danksagungen
Wir danken der veterinärmedizinischen technischen Unterstützung durch die Duke Laboratory Animal Resources, der Perfusionsunterstützung durch Centrifugal Solutions und den Duke-Teams für die kardiovaskuläre Anästhesie für ihre unschätzbare Unterstützung dieser chirurgischen Experimente. Wir danken auch Paul Lezberg und TransMedics, Inc. herzlich für ihre Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
Referenzen
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten