Method Article
Un modèle porcin haute-fidélité de transplantation cardiaque orthotopique après don après mort circulatoire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le protocole décrit ici un modèle porcin haute fidélité de transplantation cardiaque après un don après mort circulatoire en utilisant la perfusion ex vivo de l’allogreffe.
Résumé
Le nombre de patients atteints d’insuffisance cardiaque avancée qui peuvent recevoir une transplantation cardiaque est limité par une pénurie de donneurs d’organes appropriés. Dans le but d’élargir le bassin de donneurs, d’autres méthodes de don et d’approvisionnement ont été mises au point, y compris la transplantation cardiaque après un don après mort circulatoire (DCD HT). Bien que la survie à court terme après une DCD HT ne soit pas inférieure à celle d’une transplantation cardiaque avec des donneurs en état de mort cérébrale, il peut y avoir un taux accru de dysfonctionnement primaire du greffon (DPI) associé aux allogreffes de DCD HT. L’étiologie sous-jacente du DPI est multifactorielle et incomplètement comprise. Pour les allogreffes DCD HT, la période de lésion ischémique chaude pendant l’obtention d’un DCD est un facteur de risque potentiel de DPI auquel les allogreffes de mort cérébrale ne sont pas exposées. Le temps ischémique chaud fonctionnel peut donc être un facteur important du DPI dans le DCD HT. Cependant, les mécanismes sous-jacents au DPI dans ce scénario clinique sont mal compris au niveau moléculaire. Les travaux présentés ici visent à décrire le développement et la validation d’un modèle porcin de non-survie de haute fidélité de transplantation cardiaque orthotopique DCD. Nous émettons l’hypothèse que l’utilisation de ce modèle translationnel de grand animal est essentielle pour élucider les mécanismes moléculaires contribuant au DPI, ainsi que pour étudier des interventions conçues pour optimiser la préservation et la performance précoce de l’allogreffe. Ce modèle reproduit cliniquement l’approche périopératoire et chirurgicale utilisée dans le DCD HT, avec des modifications pour tenir compte de l’anatomie et de la physiologie porcines. Le développement de ce modèle chirurgical chez le grand animal fournira non seulement des informations mécanistes sur le développement du DPI, mais pourra également être modifié pour améliorer les efforts de recherche translationnelle visant à améliorer la récupération des organes après un DCD HT.
Introduction
Pour les patients atteints d’insuffisance cardiaque terminale réfractaire à la prise en charge médicale, la transplantation cardiaque reste le traitement associé à la meilleure survie à long terme et à la meilleure qualité de vie. Historiquement, la transplantation cardiaque nécessitait l’utilisation d’une allogreffe cardiaque obtenue à partir d’un donneur en état de mort cérébrale (DBD HT) et transportée alors qu’elle était conservée avec un stockage statique hypothermique. Cependant, le nombre de patients nécessitant une transplantation cardiaque dépasse le nombre de donneurs disponibles. Alors que plus de 5 000 transplantations cardiaques sont effectuées chaque année dans le monde, on estime que 50 000 candidats attendent une transplantation cardiaque1. En outre, l’utilisation d’organes provenant de donneurs identifiés reste aussi faible que 30 %2. Afin d’améliorer l’utilisation des organes des donneurs, d’autres méthodes de don et d’approvisionnement ont été mises au point ces dernières années, y compris la transplantation cardiaque après un don après mort circulatoire (DCD HT)3,4,5,6.
Les donneurs de DCD HT ne répondent pas aux critères formels de mort cérébrale, mais ont une lésion neurologique non récupérable pour laquelle les soins médicaux continus sont jugés futiles. Lors d’une administration de DCD HT, les mesures de maintien de la vie sont retirées et le patient est surveillé pour détecter une progression vers l’apnée et un arrêt circulatoire. Dans ces situations, le décès est déclaré par un médecin qui ne participe pas au processus de transplantation ou de prélèvement d’organes. Une fois que le décès a été déclaré, il y a une période d’attente supplémentaire (généralement 5 min) pendant laquelle le donneur potentiel est observé pour s’assurer qu’il n’y a pas de rétablissement ou de signes de vie, après quoi la déclaration de décès est reconfirmée avant de procéder au prélèvement d’organes 7,8. Les allogreffes de DCD sont donc exposées à une période variable d’ischémie chaude (au moins 10 min) à laquelle les allogreffes de donneurs de DBD ne sont pas exposées. Cette période d’ischémie chaude avait précédemment dissuadé le recours à la transplantation cardiaque avec des donneurs de DDC. Cependant, au cours des cinq dernières années, deux méthodes de reperfusion par approvisionnement ont été mises au point pour la récupération des allogreffes après le temps ischémique chaud associé au TDC. Tout d’abord, l’approvisionnement direct et la perfusion (DPP) impliquent une cardiectomie du donneur lors de la confirmation de la mort circulatoire, suivie d’une allogreffe, d’une réanimation et d’une préservation par perfusion ex vivo. Alternativement, la perfusion régionale normothermique (PNR) utilise la circulation extracorporelle à l’exclusion de la circulation cérébrale pour reperfusionner et réanimer le cœur du donneur in situ avant la cardiectomie 9,10,11,12.
Jusqu’à présent, la survie à court terme associée au DCD HT a été similaire à celle observée avec le DBD HT. Cependant, les premières études suggèrent également qu’il existe un risque plus élevé de dysfonctionnement primaire du greffon (DPI) sévère avec le DCD HT par rapport au DBD HT3. Le DPI est un terme utilisé pour décrire la circonstance clinique où, à la suite d’une transplantation cardiaque, la fonction précoce de l’allogreffe est insuffisante pour répondre aux besoins circulatoires du receveur. Un système de classification de la gravité du DPI a été décrit par la Société internationale de transplantation cardiaque et pulmonaire. Dans le cas d’un DPI sévère, une assistance circulatoire mécanique est nécessaire pour favoriser une circulation adéquate dans la période post-greffe13. Cette condition est le principal facteur de mortalité postopératoire précoce après une transplantation cardiaque. L’étiologie du DPI pour DBD HT et DCD HT est mal comprise, mais elle est probablement multifactorielle, avec des variables du donneur, de la préservation et du receveur qui y contribuent. Pour les allogreffes de DCD, la lésion ischémique chaude lors de l’obtention de DCD, ainsi que les réponses délétères spécifiques du donneur, y compris l’instabilité hémodynamique, les troubles métaboliques et les poussées de catécholamines, de cytokines, de lactate et de potassium, sont des facteurs proposés qui peuvent contribuer à un risque accru de DPI par rapport aux allogreffes de DBD. 14, 15, 16. Cependant, les mécanismes sous-jacents au DPI dans ce scénario clinique sont mal compris au niveau moléculaire. De plus, peut-être en raison de ces préoccupations, les cœurs DCD sont 3,37 fois plus susceptibles d’être déclinés que les organes DBD17. Par conséquent, il existe encore un besoin non satisfait d’améliorer l’utilisation des organes et les résultats des greffes en optimisant le processus de préservation des organes.
Dans cette étude, nous décrivons un DCD HT porcin utilisant le DPP qui reflète le DPD clinique actuel avec une haute fidélité. Ce modèle comprend des éléments tout au long du processus de transplantation de DCD : 1) l’obtention du DCD, 2) la préservation de la perfusion ex vivo avec un système de soins d’organe (OCS) et 3) l’implantation du receveur. Ce modèle complet offre l’occasion de mieux caractériser les mécanismes sous-jacents au DPI dans le DCD HT. Cela permet ensuite de développer des stratégies thérapeutiques ciblées et rationnelles visant à améliorer la préservation et la performance de l’allogreffe. De plus, ce modèle fournit une plate-forme pour l’évaluation préclinique de ces nouvelles thérapies, ce qui sera important pour aider à faire progresser le domaine de la transplantation cardiaque de manière sûre et rapide.
Protocole
Tous les élevages et procédures ont été approuvés par le comité institutionnel de soin et d’utilisation des animaux du centre médical de l’Université Duke, conformément à leurs règlements et directives.
1. Préparation préopératoire du donneur
- Sélectionnez deux porcs Yorkshire de 70 à 80 kg de groupe sanguin (groupe sanguin effectué par Looper Farms à Granite Falls, Caroline du Nord, États-Unis). Faites jeûner les deux porcs pendant au moins 6 à 8 heures avant l’opération.
- Préparez le module de perfusion cardiaque selon les directives du fabricant et les tests nécessaires au point d’intervention (table des matériaux).
- Préparez la solution de maintenance du module de perfusion cardiaque. Cette solution contient des nutriments pour le cœur métaboliquement actif, ainsi que de l’adénosine, pour aider à maintenir la pression artérielle cible.
- Ajouter ce qui suit : 500 mL de solution d’amorçage transparente, 100 mL d’albumine à 25 %, 100 mg de ciprofloxacine (200 mg/100 mL), deux fioles de 5 mL de multivitamines injectables, 20 mEq de bicarbonate de sodium, 1 g de céfazoline sodique et 250 mg de méthylprednisolone. Augmentez la solution d’amorçage et ajoutez le contenu dans le module de perfusion cardiaque.
- Une fois préparé, injectez 50 UI d’insuline recombinante humaine dans le sac.
- Préparez une solution d’épinéphrine en injectant 0,25 mg d’épinéphrine et 30 UI d’insuline recombinante humaine dans un sac de 500 ml de dextrose à 5 % dans de l’eau. Cette solution est destinée à remplacer les catécholamines plutôt qu’à avoir un effet inotrope. Perfuser la solution à 10 mL/h.
- Préparez la solution de T4 en injectant 200 μg de lévothyroxine reconstituée dans un sac de solution saline normale à 0,9 % de 100 mL. Infuser à raison de 3 mL/h.
- Préparez la solution de maintenance du module de perfusion cardiaque. Cette solution contient des nutriments pour le cœur métaboliquement actif, ainsi que de l’adénosine, pour aider à maintenir la pression artérielle cible.
- Endormir le porc donneur désigné avec 4,4 mg/kg de télazol et 1,0 mg/kg de propofol suivis de 2 à 5 % d’isoflurane inhalé administré par masque facial.
- Pendant que le porc est en position couchée, intuber avec un tube endotrachéal de 8 à 10 mm pour le maintien des voies respiratoires pendant l’opération. Fixez la sonde endotrachéale en place sur le museau. Appliquez une pommade vétérinaire sur les yeux pour maintenir la lubrification oculaire pendant la chirurgie.
- Insérer un cathéter intraveineux (IV) dans une veine de l’oreille pour administrer des liquides IV (liquides d’entretien : solution de Ringer lactée 10 mL/kg/h).
- Commencer la perfusion continue de fentanyl pour l’analgésie (25-100 μg/h) et administrer 0,2 mg/kg de vecuronium pour maintenir la paralysie.
- Placez des cordons d’électrocardiogramme et un oxymètre de pouls pour une surveillance continue de l’activité électrique et de l’oxygénation.
- Commencer la ventilation mécanique à un volume courant de 10 mL/kg/min, à un rythme de 10 à 15 respirations par minute, et avec maintien de l’isoflurane (1 % à 5 %) pour le reste de l’intervention. Titrez les anesthésiques et les médicaments vasoactifs de manière à ce que les réflexes soient absents, que la fréquence cardiaque reste de 61 à 99 bpm et que la pression artérielle systolique reste de 90 à 130 mmHg.
- Placez le porc sur la table d’opération avec les membres supérieurs positionnés en céphalade et sécurisés à l’extérieur du champ opératoire. Sécurisez les membres inférieurs à l’extérieur du champ opératoire.
- Définissez la zone à inclure dans le champ opératoire par la bajoue en haut, la ligne axillaire antérieure bilatéralement et deux largeurs de doigt sous l’apophyse xiphoïde en bas. Préparez et drapez le site chirurgical de manière aseptique, en suivant les pratiques standard.
- Effectuez une coupe carotidienne du côté droit.
- À l’aide d’une lame #10, faites une incision oblique latérale droite du cou, de deux largeurs de doigt latérales à la trachée, le long du bord médial du muscle sternocléido-mastoïdien.
- Effectuez cette incision à travers le platysma avec l’électrocautérisation, en assurant l’hémostase. Une fois à travers le platysma, utilisez un écarteur auto-retenant pour faciliter l’exposition.
- Disséquer et isoler soigneusement l’artère carotide et la veine jugulaire interne ; Placez une boucle de récipient autour de chaque récipient.
- Appliquer localement 10 mL de lidocaïne à 2 % pour baigner les vaisseaux.
REMARQUE : La lidocaïne est utilisée pour ses effets vasodilatateurs, car les vaisseaux porcins se contractent facilement avec la manipulation et peuvent devenir difficiles à canuler. - En utilisant la technique Seldinger, canulez directement l’artère carotide avec une microponction de 5 Fr, suivie d’une gaine d’introduction de 6 Fr.
- Connectez la gaine de l’introducteur à une ligne artérielle et à un transducteur pour une surveillance continue de la pression artérielle systémique pendant la procédure.
- Prélever du sang de la ligne artérielle de l’artère carotide pour les analyses sanguines préopératoires en laboratoire (formule sanguine complète, panel métabolique complet, troponine, lactate et sang total pour l’isolement des cellules mononucléées du sang périphérique).
- Canuler la veine jugulaire interne en utilisant la même technique que celle décrite au 1.11.5. Laissez la gaine 6 Fr en place, car elle sera utilisée pour introduire un cathéter à boucle pression-volume pour les évaluations fonctionnelles en aval.
2. Don après mort circulatoire et cardiectomie du donneur
- Effectuer une sternotomie.
- À l’aide d’une lame #10, faites une incision longitudinale de l’encoche sternale à l’apophyse xiphoïde. À l’aide de l’électrocautérisation, effectuez la dissection à travers le tissu sous-cutané et le fascia du muscle pectoral.
- Marquez la ligne médiane du sternum avec l’électrocautérisation. Disséquez les attaches ligamentaires au niveau du manubrium et autour du processus xiphoïde.
- À l’aide d’une scie sternale oscillante, divisez soigneusement la table antérieure du sternum le long de la ligne médiane. Utilisez la scie oscillante pour diviser complètement la table postérieure du sternum au niveau du manubrium. Prenez soin d’éviter de blesser la veine innominée à cette étape. Complétez la division sternale de la table postérieure sous le manubrium à l’aide d’une paire de ciseaux lourds.
REMARQUE : La dissection manuelle émoussée du plan entre la face inférieure du sternum et le péricarde peut aider à éviter les blessures au cœur pendant cette étape. - Utilisez l’électrocautérisation pour obtenir l’hémostase des bords sternaux. Placez un écarteur sternal.
- Retirez le tissu adipeux thymique et péricardique par électrocautérisation pour optimiser l’exposition du péricarde.
- Ouvrez soigneusement le péricarde avec électrocautérisation. Portez l’incision longitudinalement de l’apex du cœur au niveau de l’aorte.
- Créez un puits péricardique avec des points de maintien en soie 2-0.
- Effectuer des analyses de base de l’allogreffe de donneur.
- Pendant l’exposition du cœur du donneur et avant toute manipulation cardiaque directe, effectuez des analyses de base. Il s’agit notamment de l’échocardiographie épicardique directe, de l’évaluation de l’anse pression-volume et des biopsies à l’aiguille du myocarde.
- Effectuez l’échocardiographie de manière stérile pour obtenir des vues standard à long et à court axe directement à partir de la surface épicardique.
- Afin d’effectuer des enregistrements en boucle pression-volume, introduisez séquentiellement un cathéter pression-volume à semi-conducteurs (5Fr, 122 cm) dans l’artère carotide et la veine jugulaire interne dans les ventricules gauche et droit, respectivement.
- Mesurez la longueur du cathéter à introduire à l’extérieur (du site de canulation à l’apex du cœur) avant de l’insérer dans la gaine.
- Introduisez le cathéter dans la gaine artérielle, en le guidant dans le ventricule gauche à l’aide d’une échographie épicardique. Assurez-vous que le cathéter ne touche pas directement une paroi ventriculaire, car cela pourrait interférer avec la précision de la mesure.
- Ensuite, introduisez le cathéter dans la gaine veineuse, en le guidant dans le ventricule droit, à l’aide de la palpation directe ou du guidage par échographie épicardique.
- Effectuez des biopsies myocardiques à l’aiguille pour prélever des tissus en vue d’analyses ultérieures. Effectuez cette opération dans l’apex du ventricule gauche. S’il y a un saignement important au site de la biopsie, placez un point de réparation.
- Préparez le cœur du donneur.
- Disséquez la fenêtre aortopulmonaire pour laisser de l’espace pour la mise en place de la pince croisée.
- Disséquez circonférentiellement la veine cave supérieure (SVC) et la veine cave inférieure (IVC) avec électrocautérisation.
- Pour anticoaguler, administrer 300 unités/kg d’héparine par voie intraveineuse (IV) avant la canulation aortique.
- Utilisez une suture en polypropylène 4-0 à deux bras pour placer un cordon de bourse aortique dans la racine aortique pour la canulation aortique. Canule avec canule à évent de racine aortique 7 Fr (14G).
- Désaérer et sécuriser en place avec un garrot Rumel. Rincer la tubulure de cardioplégie pour désaérer et fixer la ligne à la canule de la racine aortique.
- Ensuite, pour vous préparer à une future canulation veineuse, placez un point de cordon de bourse dans l’appendice auriculaire droit et fixez-le avec un garrot de Rumel.
- Effectuer une mort circulatoire contrôlée.
- Fournir un bolus IV de fentanyl de 250 μg suivi d’une perfusion à débit continu (IRC) à 100 μg/h pour l’analgésie. Pour paralyser, administrer 0,2 mg/kg de vecuronium par voie intraveineuse.
- Cessez la ventilation mécanique pour commencer le processus de mort circulatoire contrôlée.
- Surveillez en permanence la pression artérielle systolique et moyenne, la pulsatilité de la ligne artérielle, l’activité cardiaque électrique et l’état d’oxygénation.
REMARQUE : La phase agonale commence lorsque la pression artérielle systolique tombe en dessous de 50 mmHg. À ce stade, le cœur peut se distendre. La mort est définie par une asystole mécanique (activité électrique sans impulsion) et l’absence de signes de vie. Cette étude ne définit pas la mort par asystole électrique dans ce modèle, car l’activité électrique lente sans impulsion persiste chez les porcs pendant une période plus longue que celle observée chez les humains, ce qui peut entraîner une augmentation de l’agression ischémique de l’allogreffe par rapport à ce qui est prévu pour le modèle. - Attendez 10 minutes après l’heure du décès/de l’asystole avant de procéder aux étapes suivantes du protocole. Cet intervalle simule la période d’attente ainsi que le temps nécessaire à l’entrée médiastinale et à la préparation dans le DCD clinique HT.
- Effectuer l’amorçage du dispositif de perfusion ex vivo .
- À l’aide d’une lame #11, faites une incision dans l’appendice auriculaire droit et canulez avec la canule veineuse 34Fr fournie par le fabricant. Fixez la canule à l’aide d’un garrot de Rumel et connectez la canule au sac de prélèvement de l’appareil de perfusion ex vivo .
- Prélever environ 1200 à 1500 ml de sang de donneur dans le sac de prélèvement fourni par le fabricant. Avant l’exsanguination, 30 000 U d’héparine et 2 mg de tirofiban HCl auront été ajoutés au sac de collecte.
- Filtrez le sang du donneur et déposez-le dans le module de perfusion cardiaque.
- Effectuer une cardiectomie du donneur.
- Après le prélèvement du sang du donneur, appliquez la pince transversale aortique.
- Notez que la racine aortique et l’aorte ascendante du porc sont considérablement plus courtes que chez l’homme. Prenez soin d’appliquer la pince transversale aussi proximale que possible afin d’éviter de clamper l’arcade ou d’obstruer incomplètement l’aorte.
- Administrez 1 L de cardioplégie Del Nido dans la racine aortique, en ciblant une pression racinaire de 60 à 100 mmHg.
- Transectez la veine cave inférieure au niveau de la réflexion péricardique et de l’appendice auriculaire gauche pour ventiler les ventricules droit et gauche lors de l’accouchement de la cardioplégie.
- Placez de la neige fondue stérile froide sur le cœur du donneur.
- Divisez la VCI, la SVC, l’aorte juste distale par rapport à l’artère innominée et l’artère pulmonaire (AP) à la bifurcation. Transect de l’oreillette gauche du donneur (LA), en laissant une ampoule suffisante de tissu sur l’allogreffe.
- Retirez le cœur du champ et placez-le dans une bassine remplie de gadoue stérile et froide pour la préparation à l’arrière-table.
- Placez quatre sutures horizontales de matelas à engagement équidistant (polypropylène 4-0) à l’intérieur de l’extrémité distale de l’aorte.
- Après le prélèvement du sang du donneur, appliquez la pince transversale aortique.
- Perfusion ex vivo
- Placez l’adaptateur aortique de perfusion ex vivo dans l’aorte distale et fixez-le fermement avec une suture en soie 0-0 ou un ruban ombilical placé juste en dessous des sutures promises.
- Laissez le PA, le SVC, l’IVC et l’oreillette gauche ouverts pendant que vous utilisez le dispositif de perfusion ex vivo .
REMARQUE : Avec cette configuration, aucune distension ventriculaire gauche n’a été rencontrée. - Transportez l’allogreffe vers le dispositif de perfusion ex vivo et connectez l’adaptateur aortique. Assurez-vous que la surface postérieure du cœur est tournée vers l’avant. Assurez-vous que la surface antérieure du cœur est en contact avec l’appareil et les deux coussinets de défibrillation. Maintenez l’allogreffe à 34 °C. Défibrillez au besoin pour rétablir toute arythmie ventriculaire à un rythme organisé.
- À ce stade, un traitement pourrait être introduit dans le circuit de perfusion ex-vivo par le port de la cardioplégie. Alternativement, le perfusat ou le circuit physique peut être modifié pour évaluer les conditions expérimentales visant à améliorer la récupération d’une allogreffe DCD HT. Par exemple, nous avons précédemment montré que le perfusat doit être débarrassé des anticorps neutralisants préformés via un économiseur de cellules pour améliorer la transduction avec des vecteurs viraux 18,19,20.
- Utilisez des laboratoires au point de service pour guider l’administration de bicarbonate de sodium, de gluconate de calcium et de dextrose au besoin.
- Obtenez des échantillons de perfusat, des analyses de sang et des échantillons de biopsie à l’aiguille au cours de cette étape de perfusion ex vivo .
REMARQUE : Dans ce modèle, l’allogreffe reste sur le dispositif de perfusion ex vivo pendant environ 2 à 3 h avant de s’implanter chez le receveur (tableau 1). La durée de perfusion de l’allogreffe ex vivo a été déterminée par le temps nécessaire pour préparer l’animal receveur à l’implantation. Cependant, le temps de perfusion ex vivo est une variable qui peut être ajustée en fonction des objectifs de l’étude.
3. Cardectomie, implantation et reperfusion du receveur
- Préparez le porc receveur comme décrit aux étapes 1.3 à 1.11.8.
- De plus, placez un cathéter central à triple lumière de 7 Fr 20 cm dans la veine jugulaire externe ou interne gauche à l’aide du guidage par ultrasons et de la technique Seldinger. Placez un cathéter artériel fémoral de 5 Fr à l’aide d’un guidage par échographie.
- Après avoir drapé le champ stérile, préparez le circuit de dérivation cardiorespiratoire (CPB) et amenez les lignes sur le terrain.
- Recirculation dans les lignes artérielles et veineuses de la BPC pour désaérer. Serrez et divisez les lignes. Préparez la ligne veineuse pour la canulation bicavale.
- Administrer une dose préopératoire de 1 g de méthylprednisolone pour traiter toute réponse inflammatoire due au rejet ou à l’ischémie, comme cela se fait dans le cas d’une transplantation cardiaque clinique dans l’établissement où cette étude est réalisée.
- Effectuez une coupe de la carotide droite et une sternotomie médiane comme décrit précédemment aux étapes 1.11 et 2.1.
- Effectuer une cardiectomie chez le receveur.
- Disséquez la fenêtre aorto-pulmonaire comme précédemment. Disséquez la CVS et la VCI et placez du ruban ombilical circonférentiel autour des vaisseaux.
- Avant la canulation, administrer 400 unités/kg d’héparine. Titrer jusqu’à un objectif de temps de coagulation activée (ACT) > 480 s.
- Placez un cordon de bourse de canulation aortique standard dans l’aorte ascendante distale (à l’aide d’une suture en polyester tressé enduite 2-0 à deux bras). Sécuriser avec un garrot Rumel et un hémostat.
- Assurez-vous que la pression artérielle systolique est inférieure à 120 mmHg. Utilisez une lame #11 pour faire une incision de couteau de pleine épaisseur dans le cordon de la bourse. Canulez l’aorte avec une canule de 15 Fr à travers cette incision. Fixez la canule en place à l’aide d’un garrot de Rumel.
- Clamper la canule aortique. Après avoir désaéré la ligne de dérivation artérielle, connectez la canule aortique au circuit CPB. Assurez-vous qu’il n’y a pas de bulles d’air dans la conduite.
- Faites un autre cordon de bourse aortique et insérez la canule de l’évent de la racine aortique.
- Effectuez la canulation veineuse à l’aide d’une technique bicavale avec des canules à pointe métallique à angle droit de 18 à 20 Fr dans le SVC et l’IVC, fixées avec des garrots Rummel. Ensuite, connectez ces canules au membre veineux du circuit CPB.
- Amorcer le CPB à un débit cible de 2,4 L/min/m2 et refroidir à 32 °C. Titrer l’anesthésique et les vasopresseurs pour maintenir une pression artérielle moyenne > 60 mmHg.
REMARQUE : Ces procédures sont effectuées avec des anesthésiologistes cardiothoraciques certifiés et des perfusionnistes certifiés qui surveillent et coordonnent la gestion hémodynamique tout au long de la course CPB. - Appliquez la pince transversale aortique proximale à la canule aortique et procédez à une explication du cœur natif du receveur. Laissez intacts les brassards auriculaires droit et gauche suffisamment grands pour faciliter une technique d’implantation bi-auriculaire.
REMARQUE : La technique bi-auriculaire est utilisée dans ce modèle car le système vasculaire porcin est très délicat, ce qui rend les anastomoses vasculaires IVC et SVC techniquement difficiles dans une technique bicavale. - Transectez l’aorte et l’AP aussi près que possible de la racine pour maintenir la longueur maximale des vaisseaux. Placez le cœur nouvellement explanté dans une solution saline tamponnée au phosphate (PBS) glacée pour qu’il soit transporté et traité en laboratoire.
- Réaliser l’implantation bi-auriculaire allogreffe receveuse.
- Refroidissez l’allogreffe sur le dispositif de perfusion ex vivo selon les instructions du fabricant. Administrez à nouveau 1 L de cardioplégie Del Nido froide pour l’arrêt cardioplégique avant de le retirer de l’appareil.
- Débranchez l’adaptateur aortique et transportez le cœur dans une bassine de gadoue stérile et froide jusqu’à la table du fond.
- Inspectez le cœur à la recherche d’une persistance de la fosse ovale (FOP) ou de sites de blessure par inadvertance.
REMARQUE : Il est important de noter que chez les porcs, il y a généralement une veine systémique qui s’écoule le long du bord auriculaire gauche avant de s’écouler dans l’oreillette droite ou la VCI. Cette veine peut être ouverte dans le processus d’approvisionnement, et il faut veiller à ce qu’elle soit ligaturée avant de procéder à l’implantation. - Coupez l’aorte jusqu’aux tissus sains sous le site de fixation de l’adaptateur.
- À l’aide de ciseaux Metzenbaum, coupez l’ouverture auriculaire gauche pour qu’elle corresponde à la taille du brassard LA du destinataire. Faites de même avec l’oreillette droite.
- Commencez l’anastomose auriculaire gauche de manière courante avec une suture Prolene 4-0 à deux bras. Continuez avec l’AP droite, l’aorte et l’anastomose auriculaire droite, également toutes complétées par une suture prolène continue 4-0.
- Commencer le réchauffement jusqu’à la normothermie (37 °C) avant de retirer la pince transversale aortique.
- Effectuer une allogreffe, une reperfusion et un sevrage du CPB.
- Après avoir terminé toutes les anastomoses, relâchez la pince transversale aortique pour reperfuser l’allogreffe.
- Assurer l’hémostase de toutes les anastomoses.
- Attendez le retour du rythme natif et de la contractilité. Placez les fils de stimulation épicardique et l’allure à 100 bpm si la fréquence cardiaque de l’allogreffe est de <100 bpm.
- Après 60 min de reperfusion, essayez de vous sevrer du CPB. Les receveurs reçoivent 0,05 μg/kg/min d’épinéphrine ainsi que des perfusions de vasopresseurs au besoin pour maintenir une pression artérielle moyenne (PAM) >65 mmHg.
- Effectuez des analyses telles que l’échocardiographie, les analyses de sang, les biopsies myocardiques et l’évaluation de la boucle pression-volume à des moments de reperfusion précoce et tardive.
4. Fin de l’expérience et euthanasie
REMARQUE : Dans cette étude, l’animal receveur de la greffe a été soutenu pendant 1 heure après la séparation du doryphore.
- À la fin de l’expérience, l’euthanasie est réalisée par exsanguination sous anesthésie.
- Explantez l’allogreffe transplantée en traversant les lignes de suture le long de toutes les anastomoses. Veillez à ne pas inclure de tissu receveur natif avec l’échantillon d’allogreffe.
- Placez immédiatement l’allogreffe dans du PBS glacé et transportez-la au laboratoire pour le traitement et le stockage.
Résultats
Au total, 6 greffes de DCD porcine ont été effectuées pour une analyse pilote en utilisant le protocole décrit ici. Au cours de ces six expériences pilotes, les composants du protocole ont été affinés pour mieux répondre aux besoins du modèle, améliorer la reproductibilité et tenir compte des contraintes logistiques. Le protocole final qui en résulte, tel qu’il est écrit ici, est résumé à la figure 1.
Contrairement au processus de mort circulatoire contrôlé par l’homme, les cœurs porcins soumis à une ischémie ont maintenu une activité électrique beaucoup plus longtemps que prévu, même après la fin de la contractilité. Après avoir reconnu cette différence dans la première expérience, l’asystole électrique a été jugée non fiable comme mesure de déclaration de décès. Afin d’éviter des dommages thermiques-ischémiques à l’allogreffe disproportionnés par rapport à ceux observés dans le contexte clinique, l’asystole mécanique (activité électrique sans impulsion) a été utilisée pour déterminer le moment de la mort pour les procédures de transplantation restantes.
De plus, la période d’attente était initialement de 15 minutes avant de procéder à une cardiectomie du donneur. Il a été utilisé pour les trois premières expériences de l’ensemble pilote. Une partie de la justification de cette période d’ischémie chaude de 15 minutes était que nous visions à avoir des lésions suffisamment graves pour avoir un degré de dysfonctionnement du greffon post-transplantation qui conviendrait à l’étude. Nous avons constaté que le dysfonctionnement du greffon dans ces premières expériences était si grave que nous avions de la difficulté à maintenir l’animal receveur pendant une heure après la séparation du CPB, de sorte que l’animal receveur avait besoin de fortes doses de soutien inotrope et presseur pour respecter le délai de 1 heure. Compte tenu de ces difficultés, nous avons réduit la période de lésion ischémique chaude à 10 min, ce qui se rapproche davantage de la DCD clinique HT avec perfusion ex vivo . La figure 2 représente des images représentatives de l’allogreffe à ce stade ainsi que pendant la perfusion ex vivo et après l’implantation. Enfin, des ajustements ont été apportés au titrage des perfusions de vasopresseurs et d’inotropes dans la phase de sevrage post-CPB pour soutenir le cœur nouvellement transplanté. On ne saurait trop insister sur la nécessité d’une équipe expérimentée possédant une expertise spécifique en anesthésiologie cardiovasculaire pour améliorer le succès dans cette phase post-CPB.
Les temps opératoires ont été suivis dans 4 des 6 expériences et sont résumés dans le tableau 1. Au cours de la phase d’obtention de la DCD du protocole, le temps écoulé entre l’arrêt des mesures de maintien de la vie chez le porc donneur et la déclaration de décès était de 14,25 (+/- 2,6) min. Le temps opératoire de dérivation cardiorespiratoire et le temps de clampage croisé sont restés constants tout au long des expériences pilotes, à environ 3 h et 1,5 h, respectivement. Les expériences ont pris fin avec l’euthanasie environ 1 heure après la séparation du CPB. Le degré de stabilité des animaux variait au moment de l’euthanasie. Certains animaux ont montré une stabilité relativement bonne et seulement un léger dysfonctionnement du greffon, tandis que d’autres ont présenté une instabilité hémodynamique significative et un dysfonctionnement sévère du greffon. Des affichages représentatifs de l’échocardiographie immobile sont illustrés à la figure 3. Cette évaluation et d’autres évaluations fonctionnelles, telles que les boucles PV, peuvent être utilisées pour déterminer les différences dans la fonction de l’allogreffe par rapport à la ligne de base ainsi qu’avant et après l’introduction d’interventions thérapeutiques.
La figure 4 présente un résumé des échantillons recueillis, traités et stockés dans le cadre de l’expérience. Les cœurs explantés ont été immédiatement placés dans du PBS glacé et stockés en laboratoire pour l’analyse tissulaire et moléculaire. Le cœur natif du receveur a été utilisé comme contrôle, tandis que l’allogreffe transplantée a été stockée comme tissu expérimental. Les cœurs ont été coupés en 4 sections transversales de l’apex à la base. À partir de chacun d’entre eux, des échantillons de tissus représentatifs de chaque chambre (ventricule gauche, ventricule droit, septum et les deux oreillettes) ont été congelés dans de l’azote liquide et stockés à -80 °C pour une analyse future. De même, des échantillons de tissus représentatifs de chacun de ces niveaux et chambres ont été incubés dans de l’ARN et congelés instantanément. Le reste de l’échantillon de tissu a été conservé dans du formol pour une analyse histopathologique. Des échantillons de sang de n’importe quel point ont été obtenus en double et stockés dans des tubes EDTA ou CPT. Le sang stocké dans les tubes EDTA a été filé pour isoler le plasma, qui a été congelé instantanément. Le sang contenu dans les tubes CPT a été traité pour les PBMC à l’aide d’un protocole modifié fourni par le fournisseur des tubes CPT.
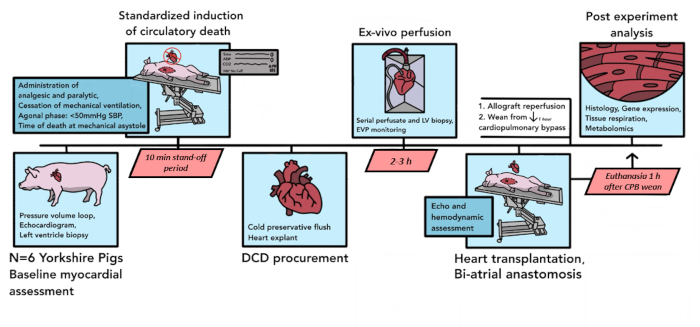
Figure 1 : Schéma du protocole DCD HT porcin. La chronologie des événements qui se produisent dans la procédure DCD HT porcine est illustrée ici. Dans cette étude pilote, 6 DCD HT ont été réalisés. Des évaluations myocardiques de base sont effectuées sur l’allogreffe de cœur de porc donneur, après quoi la mort circulatoire contrôlée commence. Après la déclaration de décès, il y a une période d’attente de 10 minutes. L’allogreffe est ensuite explantée et transportée vers le dispositif de perfusion ex vivo, où elle est reperfusée pendant 2-3 h. Après la préparation de l’animal receveur, l’allogreffe du donneur est implantée avec une technique biatriale. Après 1 h de reperfusion sous CPB, le receveur est sevré du support de pontage. L’euthanasie a lieu 1 h après la séparation de la BPC. L’allogreffe implantée est ensuite traitée pour l’analyse des tissus. DCD HT = transplantation cardiaque suite à un don après mort circulatoire ; CPB = pontage cardio-pulmonaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
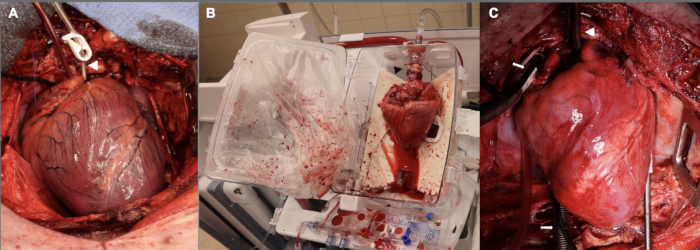
Figure 2 : Allocugreffe cardiaque porcine à différents stades du processus de TDC. (A) Après une mort circulatoire contrôlée, l’allogreffe du donneur est distendue, ischémique et œdémateuse. La pointe de flèche blanche montre la canule de la racine aortique. (B) Une fois l’allogreffe explantée du donneur, elle est placée sur le dispositif EVP pour une perfusion ex vivo. Notez l’orientation du cœur, avec la face postérieure tournée vers l’extérieur. La pointe de flèche noire pointe vers l’adaptateur aortique utilisé pour connecter l’allogreffe au dispositif. (C) Après l’implantation chez le receveur, l’allogreffe est reperfusée sur le pontage cardiorespiratoire pendant une heure avant le sevrage du CPB. La pointe de flèche blanche montre la canule aortique ; Des flèches blanches pointent vers les canules veineuses bicavales. EVP = perfusion ex vivo ; CPB = pontage cardio-pulmonaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
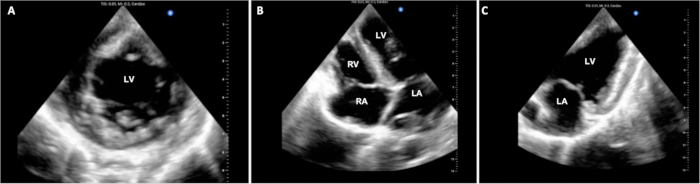
Figure 3 : Échocardiographie épicardique cardiaque. Tout au long de la procédure DCD OHT, plusieurs images échocardiographiques épicardiques ont été acquises pour évaluer la fonction ventriculaire. (A) Des vues standard à axe court, (B) à 4 chambres et (C) à 2 chambres sont présentées ici. VG = ventricule gauche ; LA = oreillette gauche ; RV = ventricule droit ; RA = oreillette droite. Veuillez cliquer ici pour voir une version agrandie de cette figure.
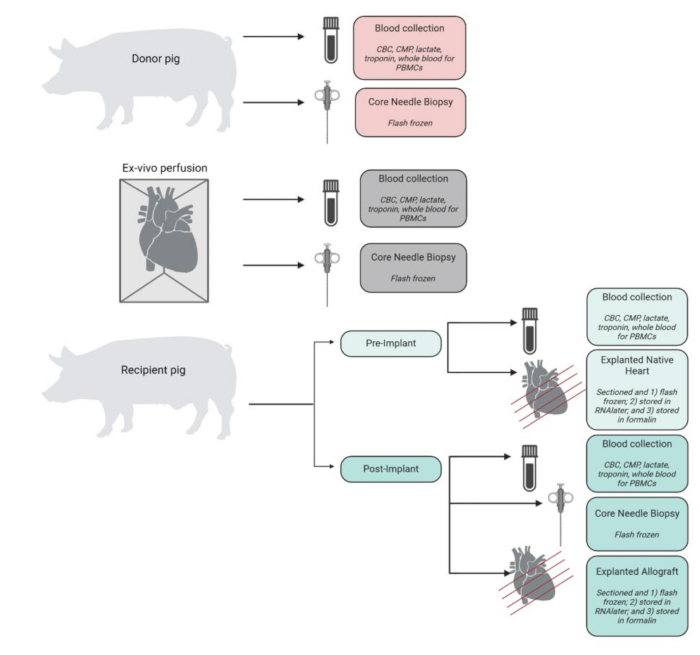
Figure 4 : Flux de travail de collecte et de traitement des échantillons. Schéma de prélèvement et de traitement des échantillons à chaque étape de la procédure. FSC = formule sanguine complète ; CMP = panel métabolique complet ; PBMC = cellules mononucléées du sang périphérique. Figurine créée dans BioRender. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Durée (min) | |
| (moyenne ± écart-type ; n = 4) | |
| Délai entre l’arrêt de la ventilation et la déclaration du décès | 14.25 (2.6) |
| Durée de la perfusion ex vivo | 147 (18) |
| Durée de la BPC | 174 (4) |
| Temps de serrage croisé | 90 (12.5) |
| Temps écoulé entre le sevrage et la mort du doryphore | 50 (37) |
Tableau 1. Informations sur la procédure. La durée moyenne de chaque étape critique de la procédure DCD HT. CPB = pontage cardio-pulmonaire.
Discussion
Malgré l’efficacité de la transplantation cardiaque pour le traitement de l’insuffisance cardiaque en phase terminale, des défis importants persistent dans ce domaine. Pour lutter contre la disponibilité limitée des organes de donneurs, les progrès des méthodes de conservation de l’allogreffe cardiaque (par exemple, la perfusion mécanique normothermique) sont apparus au premier plan ces dernières années. Ces avancées ont conduit à l’adoption de la transplantation d’allogreffes cardiaques suite à un don après mort circulatoire (DCD HT). Bien que l’utilisation des allogreffes DCD HT ait élargi le bassin de donneurs et que les résultats à court terme ne soient pas inférieurs à ceux des allogreffes DBD HT, il reste un risque d’environ 5 % de mortalité péri-transplantation précoce associé aux deux types de donneurs3. Le risque de mortalité précoce lors d’une transplantation cardiaque est principalement dû au DPI. Bien que l’étiologie du DPI soit multifactorielle avec une certaine contribution de variables définies de donneur, de receveur et de préservation, les mécanismes moléculaires sous-jacents au DPI restent généralement mal compris. De plus, compte tenu de la lésion ischémique chaude supplémentaire subie par le processus DCD HT, il n’est pas surprenant que ces cœurs, par rapport aux allogreffes DBD, puissent présenter un risque plus élevé de DPI. Par conséquent, une meilleure compréhension du DPI est importante pour aider à réduire le risque de mortalité à court terme après une transplantation cardiaque orthotopique, et cela peut être particulièrement vrai pour le DCD HT.
Ici, nous décrivons un modèle chirurgical porcin haute fidélité de DCD HT. Les avantages de la modélisation de la DCD HT in vivo dans un grand modèle animal comprennent non seulement la capacité de mieux comprendre les changements physiopathologiques qui se produisent dans une allogreffe obtenue au cours de la DCD HT, mais également la capacité de tester des interventions ciblées visant à assurer une qualité optimale de l’allogreffe. L’évaluation de la fonction ventriculaire gauche post-implantation et l’analyse de l’anse pression-volume suggèrent que ce modèle chirurgical porcin est capable de récapituler le dysfonctionnement précoce de l’allogreffe cardiaque après DCD HT. Ainsi, la technique détaillée ici crée un grand modèle animal reproductible de DPI après DCD HT et se prête à l’évaluation de stratégies thérapeutiques à de nombreux points du processus DCD HT. En fait, l’utilisation de la perfusion ex vivo comme moyen d’administrer de nouvelles thérapies, telles que la thérapie génique à médiation par vecteur viral, est un domaine d’intérêt actif dans notre laboratoire et dans d’autres 18,19,20. Nous avons précédemment démontré la capacité d’administrer de manière robuste et homogène un transgène à une allogreffe cardiaque en utilisant un modèle HT porcin non-DCD ; les mêmes techniques peuvent être appliquées à un modèle DCD HT19,20. D’autres stratégies thérapeutiques potentielles comprennent la modification chimique du perfusat, l’administration de petites molécules visant à réduire le stress oxydatif, la fourniture de substrats métaboliques pour soutenir le métabolisme pendant la période ischémique, etc. 16,21,22. De plus, le modèle présenté ici peut facilement être adapté pour évaluer différentes variables associées à la DCD HT, y compris les différentes techniques d’approvisionnement utilisées cliniquement. Par exemple, nous décrivons une stratégie d’approvisionnement direct et de perfusion ex vivo ; Cependant, le modèle peut facilement être adapté pour intégrer d’autres méthodes de perfusion d’approvisionnement, y compris la perfusion régionale normothermique.
La technique chirurgicale employée dans ce modèle reflète étroitement celle utilisée en milieu clinique ; Cependant, il existe quelques différences essentielles. Premièrement, la sternotomie et l’exposition cardiaque se produisent avant l’arrêt de l’assistance cardiorespiratoire, la phase agonale, la détermination de la mort et la période d’attente prescrite par l’éthique (modèle à poitrine ouverte)23. La sternotomie est effectuée dans cet ordre afin que l’évaluation cardiaque de base du donneur, y compris les biopsies myocardiques, puisse avoir lieu. Une évaluation antérieure du moment de la sternotomie dans un modèle porcin DCD HT a démontré que la progression entre l’abandon des mesures de maintien de la vie et la mort (temps ischémique chaud) est plus rapide, accompagnée de changements hémodynamiques moins prononcés dans le modèle à poitrine ouverte ; Ces allogreffes peuvent subir des conditions moins dommageables lors de l’obtention. Cependant, il n’y avait pas de différences significatives dans les valeurs biochimiques (lactate, glucose, catécholamine, etc.) ou les marqueurs de mort cellulaire entre les groupes à poitrine fermée et ouverte24. De plus, en raison de l’inclusion de la période d’attente de 10 minutes dans le modèle, le temps écoulé entre l’arrêt de la ventilation et l’ischémie chaude fonctionnelle dans ce modèle ressemble davantage au moment du groupe à poitrine fermée de l’étude citée. De plus, dans ce modèle, le temps de l’ischémie chaude fonctionnelle est une variable qui peut être modifiée pour s’adapter aux objectifs expérimentaux d’une étude particulière. Une autre différence potentielle entre le modèle rapporté ici et le contexte clinique est que l’activité électrique sans impulsion (PEA ; asystole mécanique) est utilisée pour définir la mort dans ce modèle. Dans le contexte clinique, une déclaration de décès est faite par un médecin qui n’est pas impliqué dans le processus de transplantation ; soit l’EEP, ainsi que l’absence d’autres signes de vie ou l’asystolie électrique, seraient acceptables pour répondre aux critères de déclaration de décès. Les cœurs porcins ont maintenu une activité électrique pendant une période prolongée après l’arrêt de la contractilité. Afin d’éviter des lésions ischémiques chaudes disproportionnées par rapport à celles observées dans le contexte clinique, l’asystole mécanique (PEA) a été utilisée pour définir la mort. Pour les chercheurs qui utilisent un modèle à poitrine fermée de DCD, l’activité électrique sans impulsion (manque de pulsatilité sur la ligne artérielle) peut toujours être utilisée comme critère de définition de la mort. Nous n’avons pas trouvé que la saturation périphérique en oxygène était un marqueur pertinent pour définir le début de la période agonale ou pour définir la mort.
Enfin, ce que nous avons décrit ici est un modèle gourmand en temps et en ressources. De la préparation du porc donneur à la mort de l’animal receveur, il faut environ 10 heures et un important effort de collaboration. L’équipe procédurale comprend des chirurgiens cardiaques, des anesthésiologistes cardiaques, des perfusionnistes et du personnel vétérinaire et de laboratoire expérimenté qui aident à la collecte et au traitement des échantillons. Une grande équipe comme celle-ci fait partie intégrante de la procédure complexe de DCD HT. Cependant, avec une équipe expérimentée, la création d’un modèle porcin haute fidélité de DCD HT est possible, comme décrit dans ce manuscrit.
Déclarations de divulgation
CAM a reçu une rémunération en actions pour avoir agi à titre de consultant pour TransMedics Inc.
Remerciements
Nous remercions le soutien technique vétérinaire des ressources animales de laboratoire de Duke, le soutien à la perfusion de Centrifugal Solutions et les équipes d’anesthésie cardiovasculaire de Duke pour leur soutien inestimable à ces expériences chirurgicales. Nous remercions également sincèrement Paul Lezberg et TransMedics, Inc. pour leur soutien.
matériels
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
Références
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon