Method Article
순환기 사망 후 기증에 따른 정형소 심장 이식의 고충실도 돼지 모델
* 이 저자들은 동등하게 기여했습니다
요약
본 프로토콜은 동종이식편의 체외 관류를 활용하여 순환기 사망 후 기증 후 심장 이식의 고충실도 돼지 모델을 설명합니다.
초록
심장 이식을 받을 수 있는 진행성 심부전 환자의 수는 적절한 장기 기증자의 부족으로 인해 제한되어 있습니다. 기증자 풀을 확대하기 위한 노력의 일환으로 순환계 사망 후 기증 후 심장 이식(DCD HT)을 포함한 대체 기증 및 조달 방법이 개발되었습니다. DCD HT 후 단기 생존율은 뇌사 기증자에 의한 심장 이식보다 열등하지 않지만, DCD HT 동종이식편과 관련된 원발성 이식 기능 장애(PGD)의 비율이 증가할 수 있습니다. PGD의 근본적인 병인은 여러 요인에 의해 이루어지며, 불완전하게 이해되고 있습니다. DCD HT 동종이식편의 경우, DCD 조달 중 온열 허혈 손상 기간은 뇌사 동종이식편이 노출되지 않는 PGD의 잠재적 위험 요소입니다. 따라서 기능적 온열 허혈 시간은 DCD HT에서 PGD의 중요한 동인이 될 수 있습니다. 그러나 이 임상 시나리오에서 PGD의 기저에 있는 메커니즘은 분자 수준에서 잘 이해되지 않았습니다. 여기에 제시된 연구는 DCD 정소성 심장 이식의 고충실도 비생존 돼지 모델의 개발 및 검증을 설명하는 것을 목표로 합니다. 우리는 이 번역 대형 동물 모델의 사용이 PGD에 기여하는 분자 메커니즘을 밝히고 동종이식 보존 및 조기 성능을 최적화하기 위해 고안된 중재를 조사하는 데 중요하다는 가설을 세웠습니다. 이 모델은 돼지의 해부학 및 생리학을 고려하여 수정하여 DCD HT에서 사용되는 수술 전후 및 수술 접근법을 임상적으로 복제합니다. 이 대형 동물 수술 모델의 개발은 PGD 발병에 대한 기계론적 통찰력을 제공할 뿐만 아니라 DCD HT 후 장기 회복을 개선하기 위한 중개 연구 노력을 강화하기 위해 수정될 수 있습니다.
서문
의학적 관리에 불응하는 말기 심부전 환자에게 심장 이식은 최상의 장기 생존 및 삶의 질과 관련된 치료법으로 남아 있습니다. 역사적으로 심장 이식은 뇌사 기증자(DBD HT)로부터 조달한 심장 동종이식편을 사용하여 저체온성 정적 저장소로 보존된 상태로 운송해야 했습니다. 그러나 심장 이식이 필요한 환자의 수가 이용 가능한 기증자의 수를 초과합니다. 전 세계적으로 매년 5,000건 이상의 심장 이식 수술이 시행되고 있으며, 50,000명의 심장 이식 환자가 심장 이식을 기다리고 있는 것으로 추정됩니다1. 또한 확인된 기증자의 장기 이용률은 30%2에 불과합니다. 최근 몇 년 동안 기증자의 장기 활용도를 높이기 위해 순환사 후 기증 후 심장 이식(DCD HT)3,4,5,6을 포함한 대체 기증 및 조달 방법이 개발되었습니다.
DCD HT 기증자는 공식적인 뇌사 기준을 충족하지 않지만 지속적인 치료가 무의미한 것으로 간주되는 회복 불가능한 신경학적 손상을 가지고 있습니다. DCD HT 조달 중에는 연명 조치가 중단되고 환자의 무호흡 및 순환 정지로의 진행을 모니터링합니다. 이러한 상황에서의 사망은 이식 또는 장기 조달 과정에 참여하지 않은 의사에 의해 선언됩니다. 사망이 선언되면 추가 대기 기간(보통 5분)이 있어 잠재적 기증자를 관찰하여 회복 또는 생명의 징후가 없는지 확인한 후 장기 조달을 진행하기 전에 사망 선언을 재확인합니다 7,8. 따라서 DCD 동종이식편은 DBD 기증자 동종이식편이 노출되지 않는 다양한 기간의 따뜻한 허혈(최소 10분)에 노출됩니다. 이 따뜻한 허혈 기간은 이전에 DCD 기증자와 함께 심장 이식을 사용하는 것을 단념했습니다. 그러나 지난 5년 동안 DCD와 관련된 따뜻한 허혈 시간 이후 동종이식 회복을 위해 두 가지 조달 재관류 방법이 개발되었습니다. 먼저, DPP(Direct Procurement and Perfusion)는 순환기 사망 확인 시 기증자의 심장 절제술을 포함하고, 그 다음에는 동종 이식 소생술 및 생체 외 관류에 의한 보존이 포함됩니다. 대안적으로, 정상온열 국소 관류(NRP)는 심장 절제술 전에 기증자의 심장을 제자리에서 재관류하고 재생시키기 위해 대뇌 순환을 제외한 체외 순환을 사용합니다 9,10,11,12.
지금까지 DCD HT와 관련된 단기 생존은 DBD HT에서 관찰된 것과 유사했습니다. 그러나 초기 연구에서는 DBD HT에 비해 DCD HT가 심각한 원발이식 기능 장애(PGD)의 위험이 더 높다고 시사한다3. PGD는 심장 이식 후 조기 동종이식 기능이 수혜자의 순환계 요구를 충족하기에 충분하지 않은 임상 상황을 설명하는 데 사용되는 용어입니다. PGD의 중증도를 등급화하는 시스템은 국제 심장 및 폐 이식 학회(International Society of Heart and Lung Transplantation)에 의해 설명되었습니다. 중증 PGD의 경우, 이식 후 기간에 적절한 혈액 순환을 지원하기 위해 기계적 순환 보조가 필요하다13. 이 질환은 심장 이식 후 조기 수술 후 사망의 주요 원인입니다. DBD HT와 DCD HT 모두에 대한 PGD의 병인은 잘 알려져 있지 않지만, 공여자, 보존 및 수혜자 변수가 모두 기여하는 다요인일 가능성이 높습니다. DCD 동종이식의 경우, DCD 조달 중 따뜻한 허혈성 손상과 혈역학적 불안정성, 대사 장애, 카테콜아민, 사이토카인, 젖산 및 칼륨의 급증을 포함한 유해한 기증자 특이적 반응은 DBD 동종이식편에 비해 PGD의 위험 증가에 기여할 수 있는 제안된 요인입니다. 14,15,16. 그러나 이 임상 시나리오에서 PGD의 기저에 있는 메커니즘은 분자 수준에서 잘 이해되지 않았습니다. 또한, 이러한 우려 때문인지 DCD 심장은 DBD 기관보다 심장 박동이 저하될 확률이 3.37배 더 높습니다17. 결과적으로, 장기 보존 과정을 최적화하여 장기 활용도를 높이고 이식 결과를 개선해야 하는 미충족 수요가 여전히 존재합니다.
이 연구에서는 현재 임상 DPP DCD HT를 높은 충실도로 미러링하는 DPP를 사용하는 돼지 DCD HT에 대해 설명합니다. 이 모델에는 DCD 이식 프로세스 전반에 걸친 요소가 포함됩니다: 1) DCD 조달, 2) 장기 관리 시스템(OCS)을 통한 체외 관류 보존, 3) 수혜자 이식. 이 포괄적인 모델은 DCD HT에서 PGD의 기저에 있는 메커니즘을 더 잘 특성화할 수 있는 기회를 제공합니다. 이를 통해 동종이식편 보존 및 성능을 개선하기 위한 표적화되고 합리적인 치료 전략을 개발할 수 있습니다. 또한, 이 모델은 이러한 새로운 치료법의 전임상 평가를 위한 플랫폼을 제공하며, 이는 심장 이식 분야를 안전하고 신속한 방식으로 발전시키는 데 도움이 되는 데 중요할 것입니다.
프로토콜
모든 사육 및 절차는 규정 및 지침에 따라 Duke University Medical Center의 기관 동물 관리 및 사용 위원회의 승인을 받았습니다.
1. 수술 전 기증자 준비
- 체중이 70-80kg인 혈액형이 일치하는 요크셔 돼지 2마리를 선택합니다(미국 노스캐롤라이나주 그래나이트 폴스에 있는 Looper Farms에서 수행한 혈액형). 수술 전에 두 돼지 모두 최소 6-8시간 동안 금식하십시오.
- 제조업체의 지침과 필요한 현장 진단 테스트(Table of Materials)에 따라 심장 관류 모듈을 준비합니다.
- 심장 관류 모듈에 대한 유지 관리 솔루션을 준비합니다. 이 용액에는 신진대사가 활발한 심장을 위한 영양소와 아데노신이 함유되어 있어 목표 혈압을 유지하는 데 도움이 됩니다.
- 투명 프라이밍 용액 500mL, 25% 알부민 100mL, 시프로플록사신 100mg(200mg/100mL), 종합비타민 주사 5mL 바이알 2개, 중탄산나트륨 20mEq, 세파졸린 나트륨 1g, 메틸프레드니솔론 250mg을 추가합니다. 프라이밍 용액을 스파이크하고 내용물을 심장 관류 모듈에 추가합니다.
- 준비가 완료되면 50IU 인간 재조합 인슐린을 백에 주입합니다.
- 5% 포도당이 든 500mL 백에 0.25mg의 에피네프린과 30IU의 인간 재조합 인슐린을 주입하여 에피네프린 용액을 준비합니다. 이 용액은 수축성 효과가 있는 것이 아니라 카테콜아민을 대체하기 위한 것입니다. 용액을 10mL/h로 주입합니다.
- 100 mL 0.9% 생리식염수 백에 200 μg의 재구성된 레보티록신을 주입하여 T4 용액을 준비합니다. 3mL/h의 속도로 주입합니다.
- 심장 관류 모듈에 대한 유지 관리 솔루션을 준비합니다. 이 용액에는 신진대사가 활발한 심장을 위한 영양소와 아데노신이 함유되어 있어 목표 혈압을 유지하는 데 도움이 됩니다.
- 지정된 기증자 돼지에 4.4mg/kg의 텔라졸과 1.0mg/kg의 프로포폴을 진정시킨 후 안면 마스크로 전달되는 2%-5% 흡입 이소플루란을 투여합니다.
- 돼지가 누운 자세에 있는 동안 수술 중 기도 유지를 위해 8-10mm 기관내관으로 삽관을 합니다. 기관내관을 주둥이에 고정합니다. 수술 중 안구 윤활을 유지하기 위해 동물용 연고를 눈에 바르십시오.
- 정맥(IV) 카테터를 귀 정맥에 삽입하여 IV 수액(유지 수액: 젖산 링거 용액 10mL/kg/h)을 투여합니다.
- 진통제(25-100μg/h)를 위해 지속적인 펜타닐 주입을 시작하고 마비를 유지하기 위해 0.2mg/kg의 베쿠로늄을 투여합니다.
- 전기 활동 및 산소 공급을 지속적으로 모니터링하기 위해 심전도 리드와 맥박 산소 농도계를 배치합니다.
- 10mL/kg/min의 일회 호흡량, 분당 10-15회의 호흡 속도, 나머지 절차 동안 이소플루란(1%-5%) 유지로 기계 환기를 시작합니다. 반사 신경이 없고 심박수가 61-99bpm, 수축기 혈압이 90-130mmHg로 유지되도록 적정 마취제 및 혈관 활성 약물을 사용합니다.
- 돼지를 수술대에 놓고 상지를 두족으로 배치하고 수술장 외부에 고정합니다. 수술 필드 밖에서 하지를 고정하십시오.
- 턱 위쪽은 턱, 앞쪽 겨드랑이 선은 양측으로, 두 손가락 너비는 xiphoid 프로세스 아래쪽으로 수술 필드에 포함될 영역을 정의합니다. 표준 관행에 따라 수술 부위를 무균으로 준비하고 드레이프합니다.
- 오른쪽 경동맥 절개를 수행합니다.
- #10 칼날을 사용하여 흉쇄유돌근의 내측 경계를 따라 기관 옆으로 두 손가락 너비의 비스듬한 오른쪽 측면 목 절개를 만듭니다.
- 이 절개 부위를 전기 소작으로 판형체를 통해 아래로 운반하여 지혈을 보장합니다. 판형체를 통과하면 자체 유지 견인기를 사용하여 노출을 돕습니다.
- 경동맥과 내부 경정맥을 조심스럽게 절개하고 분리하십시오. 각 용기 주위에 용기 루프를 놓습니다.
- 혈관을 목욕시키기 위해 2% 리도카인 10mL를 국소적으로 바르십시오.
참고: 리도카인은 혈관 확장 효과로 사용되는데, 돼지 혈관은 조작으로 쉽게 경련하고 캐뉼레이션이 어려워질 수 있기 때문입니다. - Seldinger 기술을 사용하여 5 Fr 미세 천자로 경동맥을 직접 캐뉼레이션한 다음 6 Fr 도입부 칼집을 삽입합니다.
- 주입기(introducer sheath)를 동맥관과 트랜스듀서(transducer)에 연결하여 시술 중 전신 동맥압을 지속적으로 모니터링할 수 있습니다.
- 수술 전 실험실 혈액 검사(전체 혈구 수, 종합 대사 패널, 트로포닌, 젖산 및 말초 혈액 단핵 세포 분리를 위한 전혈)를 위해 경동맥 동맥선에서 혈액을 채취합니다.
- 1.11.5와 동일한 기술을 사용하여 내부 경정맥을 캐뉼레이트합니다. 6 Fr 외피는 다운스트림 기능 평가를 위해 압력-부피 루프 카테터를 도입하는 데 사용되므로 그대로 두십시오.
2. 순환기 사망 및 기증자 심장 절제술 후 기증
- 흉골 절개술을 시행합니다.
- #10 블레이드를 사용하여 흉골 노치에서 xiphoid process까지 세로로 절개합니다. 전기 소작술을 사용하여 피하 조직과 흉근 근막을 통해 박리를 수행합니다.
- 전기 소작술로 흉골의 정중선을 긋습니다. manubrium과 xiphoid process 주변의 인대 부착물을 해부합니다.
- 진동하는 흉골 톱을 사용하여 정중선을 따라 흉골의 앞쪽 테이블을 조심스럽게 나눕니다. 진동 톱을 사용하여 흉골의 뒤쪽 테이블을 manubrium 수준에서 완전히 분할합니다. 이 단계에서 innominate 정맥이 손상되지 않도록 주의하십시오. 무거운 가위를 사용하여 마누브리움 아래 후방 테이블의 흉골 분할을 완성합니다.
참고: 흉골 아래쪽과 심낭 사이의 평면을 수동으로 둔하게 해부하면 이 단계에서 심장 부상을 방지하는 데 도움이 될 수 있습니다. - 흉골 가장자리의 지혈을 얻기 위해 전기 소작을 사용하십시오. 흉골 견인기를 놓습니다.
- 심낭의 노출을 최적화하기 위해 전기 소작기로 흉선 및 심낭 지방 패드 조직을 제거합니다.
- 전기 소작으로 심낭을 조심스럽게 엽니다. 절개 부위를 심장 정점에서 대동맥 수준까지 세로로 운반합니다.
- 2-0 실크 스테이 스티치로 심낭 우물을 만듭니다.
- 기준선 공여체 동종이식 분석을 수행합니다.
- 기증자의 심장이 노출되어 있는 동안 그리고 직접적인 심장 조작을 하기 전에 기준선 분석을 수행합니다. 여기에는 직접 심외막 심초음파, 압력-부피 루프 평가 및 심근 코어 바늘 생검이 포함됩니다.
- 무균 방식으로 심초음파를 수행하여 심외막 표면에서 직접 표준 장축 및 단축 보기를 얻습니다.
- 압력-볼륨 루프 녹음을 수행하려면 고체 상태 압력-볼륨 카테터(5Fr, 122cm)를 경동맥과 내부 경정맥에 각각 좌심실과 우심실로 순차적으로 삽입합니다.
- 칼집에 삽입하기 전에 외부(캐뉼레이션 부위에서 심장 정점까지)로 삽입할 카테터의 길이를 측정합니다.
- 카테터를 동맥초에 삽입하고 심외막 초음파를 사용하여 좌심실로 안내합니다. 카테터가 심실 벽에 직접 닿지 않도록 하면 측정 정확도에 방해가 될 수 있습니다.
- 다음으로, 카테터를 정맥초에 삽입하고 직접 촉진 또는 심외 초음파 유도를 사용하여 우심실로 안내합니다.
- 코어 니들 심근 생검을 수행하여 향후 분석을 위한 조직을 수집합니다. 좌심실의 정점에서 이것을 수행하십시오. 생검 부위에서 상당한 출혈이 있는 경우 수리 봉합을 합니다.
- 기증자의 심장을 준비합니다.
- 크로스 클램프 배치를 위한 공간을 확보하기 위해 대동맥 창을 절개합니다.
- 전기소작술로 상대정맥(SVC)과 하대정맥(IVC)을 원주방향으로 절개합니다.
- 항응고를 위해 대동맥 캐뉼레이션 전에 300단위/kg의 헤파린을 정맥 주사(IV)합니다.
- 양팔 4-0 폴리프로필렌 봉합사를 사용하여 대동맥 캐뉼레이션을 위해 대동맥 뿌리에 대동맥 지갑 끈을 놓습니다. 7 Fr(14G) 대동맥 뿌리 통풍구 캐뉼라로 캐뉼레이트.
- Rumel 지혈대로 공기를 제거하고 제자리에 고정하십시오. 심정지 튜브를 세척하여 공기를 제거하고 대동맥 뿌리 캐뉼라에 라인을 고정합니다.
- 다음으로, 향후 정맥 캐뉼레이션을 준비하기 위해 오른쪽 심방 부속기에 지갑 끈 스티치를 놓고 Rumel 지혈대로 고정합니다.
- 조절된 순환기 사멸을 수행합니다.
- 250μg의 펜타닐 IV 볼루스를 제공한 후 진통제를 위해 100μg/h로 연속 속도 주입(CRI)을 제공합니다. 마비시키려면 0.2mg/kg 베쿠로늄을 정맥 주사합니다.
- 조절된 순환기 사망 과정을 시작하기 위해 기계적 환기를 중단하십시오.
- 수축기 및 평균 동맥 혈압, 동맥관 박동, 전기 심장 활동 및 산소 공급 상태를 지속적으로 모니터링합니다.
알림: 수축기 혈압이 50mmHg 미만으로 떨어질 때 고통 단계가 시작됩니다. 이 시점에서 심장이 팽창할 수 있습니다. 죽음은 기계적 무수축(맥박이 없는 전기 활동)과 생명의 징후가 없는 것으로 정의됩니다. 이 연구는 느린 무맥동 전기 활동이 인간에서 관찰된 것보다 더 오랜 기간 동안 돼지에서 지속되어 모델에서 의도한 것보다 더 많은 동종 이식편 허혈 모욕을 초래할 수 있기 때문에 이 모델에서 전기 무수축에 의한 사망을 정의하지 않습니다. - 프로토콜의 다음 단계를 진행하기 전에 사망/무수축 시간 후 10분 동안 기다립니다. 이 간격은 스탠드오프 기간과 임상 DCD HT에서 종격동 진입 및 준비에 필요한 시간을 시뮬레이션합니다.
- 생체 외 관류 장치 프라이밍을 수행합니다.
- #11 블레이드로 오른쪽 심방 부속기를 찌르며 절개하고 제조업체에서 제공한 34Fr 정맥 캐뉼라로 캐뉼러를 삽입합니다. Rumel 지혈대로 캐뉼라를 고정하고 캐뉼라를 생체 외 관류 장치의 수집 백에 연결합니다.
- 약 1200-1500mL의 헌혈자 혈액을 제조업체에서 제공한 수집 백에 수집합니다. 출혈 전에 30,000 U의 헤파린과 2mg의 티로피반 HCl이 수집 백에 추가됩니다.
- 기증자의 혈액을 여과하여 심장 관류 모듈로 전달합니다.
- 기증자 심장 절제술을 시행합니다.
- 기증자의 혈액을 채취한 후 대동맥 교차 클램프를 적용합니다.
- 돼지 대동맥근과 상행 대동맥은 인간보다 상당히 짧습니다. 아치를 클램핑하거나 대동맥을 불완전하게 막는 것을 방지하기 위해 가능한 한 근접하게 교차 클램프를 적용하도록 주의하십시오.
- 60-100mmHg의 치근 압력을 목표로 대동맥 뿌리에 Del Nido 심정지 1L를 투여합니다.
- 심낭 반사와 좌심방 부속기에서 하대정맥을 절제하여 심정지 분만 중 우심실과 좌심실을 환기시킵니다.
- 기증자의 심장에 차갑고 멸균된 슬러시를 놓습니다.
- IVC, SVC, innominate artery의 원위부에 있는 대동맥과 분기점에서 폐동맥(PA)을 분열합니다. 기증자 좌심방(LA)을 절제하여 동종이식편에 충분한 조직 커프를 남깁니다.
- 밭에서 심장을 꺼내 백 테이블 준비를 위해 멸균되고 차가운 슬러시로 채워진 대야에 넣습니다.
- 대동맥의 원위부 끝 내부에 4개의 등거리 서약 수평 매트리스 봉합사(4-0 폴리프로필렌)를 배치합니다.
- 기증자의 혈액을 채취한 후 대동맥 교차 클램프를 적용합니다.
- 생체 외 관류
- 생체 외 관류 대동맥 어댑터를 원위 대동맥에 놓고 서약된 봉합사 바로 아래에 놓인 0-0 실크 봉합사 또는 배꼽 테이프로 단단히 고정합니다.
- 생체 외 관류 장치를 사용하는 동안 PA, SVC, IVC 및 왼쪽 아트리움을 열어 둡니다.
참고: 이 구성에서는 좌심실 팽창이 발생하지 않았습니다. - 동종이식편을 체외 관류 장치로 운반하고 대동맥 어댑터를 연결합니다. 심장의 뒤쪽 표면이 앞쪽을 향하고 있는지 확인하십시오. 심장의 앞쪽 표면이 장치 및 두 개의 제세동 패드와 접촉하고 있는지 확인하십시오. 동종이식편을 34°C로 유지하십시오. 심실 부정맥을 조직화된 리듬으로 복원하기 위해 필요에 따라 제세동합니다.
- 이 시점에서, 치료법은 심정지 포트를 통해 생체 외 관류 회로에 도입될 수 있습니다. 또는 DCD HT 동종이식의 회수를 향상시키기 위한 실험 조건을 평가하기 위해 관류액 또는 물리적 회로를 수정할 수 있습니다. 예를 들어, 우리는 이전에 바이러스 벡터 18,19,20으로 transduction을 향상시키기 위해 cell-saver를 통해 미리 형성된 중화 항체를 perfusate로 세척해야 함을 보여주었습니다.
- 현장 진료 실험실을 사용하여 필요에 따라 중탄산나트륨, 글루콘산칼슘 및 포도당을 투여할 수 있습니다.
- 이 체외 관류 단계에서 관류액 샘플, 혈액 검사 및 코어 바늘 생검 샘플을 얻습니다.
참고: 이 모델에서 동종이식편은 수혜자에게 이식하기 전에 약 2-3시간 동안 생체 외 관류 장치에 남아 있습니다(표 1). 동종이식편이 생체 외 관류된 시간은 이식 동물이 이식을 위해 준비하는 데 걸린 시간에 의해 결정되었습니다. 그러나 생체 외 관류 시간은 연구 목표에 따라 조정할 수 있는 변수입니다.
3. 수혜자 심장 절제술, 이식 및 재관류
- 1.3-1.11.8단계에 설명된 대로 수신자 돼지를 준비합니다.
- 또한 초음파 유도와 Seldinger 기술을 사용하여 7 Fr 20cm 삼중 루멘 중심선 카테터를 왼쪽 외부 또는 내부 경정맥에 배치합니다. 초음파 유도를 사용하여 5 Fr 대퇴 동맥선을 배치합니다.
- 멸균 필드를 드레이핑한 후 심폐 우회술(CPB) 회로를 준비하고 라인을 필드에 가져옵니다.
- CPB 동맥 및 정맥선을 통해 재순환하여 공기를 제거합니다. 선을 고정하고 나눕니다. 이두 캐뉼 캐뉼레이션을 위해 정맥 라인을 준비합니다.
- 이 연구가 수행되는 기관에서 임상 심장 이식에서와 같이 거부 반응 또는 허혈로 인한 염증 반응을 해결하기 위해 수술 전 메틸프레드니솔론 1g을 투여합니다.
- 앞서 1.11 및 2.1단계에서 설명한 대로 오른쪽 경동맥 절개 및 정중선 흉골 절개술을 수행합니다.
- 수혜자 심장 절제술을 시행합니다.
- 이전과 같이 대동맥폐창을 절개합니다. SVC와 IVC를 해부하고 혈관 주위에 둘레 배꼽 테이프를 붙입니다.
- 삽관하기 전에 400단위/kg의 헤파린을 투여합니다. 활성화된 응고 시간(ACT)을 480초> 목표로 적정합니다.
- 원위 상행 대동맥에 표준 대동맥 삽관 지갑 끈 스티치를 놓습니다(이중 팔 서약 2-0 코팅 꼰 폴리에스터 봉합사 사용). Rumel 지혈대와 지혈제로 고정하십시오.
- 수축기 혈압이 120mmHg 미만인지 확인하십시오. #11 칼날을 사용하여 지갑 끈 내부를 전체 두께로 찌르는 절개를 만듭니다. 이 절개를 통해 15 Fr 캐뉼라로 대동맥을 캐뉼라합니다. Rumel 지혈대로 캐뉼라를 제자리에 고정합니다.
- 대동맥 캐뉼라를 고정합니다. 동맥 우회 라인을 제거한 후 대동맥 캐뉼라를 CPB 회로에 연결합니다. 라인에 기포가 없는지 확인하십시오.
- 또 다른 대동맥 지갑 끈을 만들고 대동맥 뿌리 통풍구 캐뉼라를 삽입합니다.
- SVC와 IVC 모두에서 18-20 Fr 직각 금속 팁 캐뉼러를 사용하여 Bicaval 기술을 사용하여 정맥 캐뉼레이션을 수행하고 Rummel 지혈대로 고정합니다. 그런 다음 이 캐뉼러를 CPB 회로의 정맥 다리에 연결합니다.
- CPB를 2.4 L/min/m2 의 목표 유량으로 시작하고 32 °C로 냉각합니다. 평균 동맥압을 60mmHg> 유지하기 위해 마취제와 승압제를 적정합니다.
참고: 이러한 절차는 CPB 실행 과정 전반에 걸쳐 혈역학적 관리를 모니터링하고 조정하는 보드 인증 흉부외과 마취과 의사 및 인증된 관류사와 함께 수행됩니다. - 대동맥 캐뉼라 근위부에 대동맥 교차 클램프를 적용하고 수혜자의 원래 심장에 대한 설명을 진행합니다. 양심방 이식 기술을 용이하게 할 수 있을 만큼 충분히 큰 오른쪽 및 왼쪽 심방 커프를 그대로 두십시오.
참고: 돼지 혈관 구조가 매우 섬세하기 때문에 이 모델에서는 이심방 기법이 사용되어 IVC 및 SVC 혈관 문합이 이두 기법에서 기술적으로 까다롭습니다. - 최대 혈관 길이를 유지하기 위해 대동맥과 PA를 가능한 한 뿌리에 가깝게 절제합니다. 새로 이식한 심장을 얼음처럼 차가운 인산완충식염수(PBS)에 넣어 실험실에서 운반 및 처리합니다.
- 수혜자 동종이식 양심방 이식을 수행합니다.
- 제조업체 지침에 따라 ex vivo 관류 장치의 동종이식을 식힙니다. 장치에서 제거하기 전에 심정지 마비를 위해 다시 한 번 1L의 콜드 Del Nido 심정지를 투여합니다.
- 대동맥 어댑터를 분리하고 멸균 된 차가운 슬러시 대야에 심장을 담아 뒤쪽 테이블로 운반합니다.
- 심장에 PFO(primum fossa ovalis) 또는 부주의한 부상 부위가 있는지 검사합니다.
참고: 중요한 것은 돼지의 경우 일반적으로 우심방 또는 IVC로 배출되기 전에 왼쪽 심방 경계를 따라 배수되는 전신 정맥이 있다는 것입니다. 이 정맥은 조달 과정에서 열릴 수 있으며 이식을 진행하기 전에 결찰되었는지 확인하기 위해 주의를 기울여야 합니다. - 대동맥을 어댑터 고정 부위 아래의 건강한 조직으로 다시 잘라냅니다.
- Metzenbaum 가위를 사용하여 수신자 LA 커프의 크기에 맞게 왼쪽 심방 개구부를 자릅니다. 오른쪽 아트리움에도 동일한 작업을 수행합니다.
- 양팔 4-0 프롤렌 봉합사로 달리기 방식으로 좌심방 문합을 시작합니다. 오른쪽 PA, 대동맥 및 우심방 문합을 계속하고 모두 연속 4-0 프롤렌 봉합사로 완료합니다.
- 대동맥 교차 클램프를 제거하기 전에 정상화증(37°C)으로 재가열을 시작합니다.
- 동종이식 재관류를 수행하고 CPB에서 이탈합니다.
- 모든 문합을 완료한 후 대동맥 교차 클램프를 해제하여 동종이식편을 다시 관류합니다.
- 모든 문합이 지혈되도록 합니다.
- 본래의 리듬과 수축성이 돌아오기를 기다립니다. 심외막 페이싱 와이어를 배치하고 동종 이식 심박수가 <100bpm인 경우 100bpm으로 페이스를 조정합니다.
- 60분 동안 재관류를 한 후 CPB에서 떼어내십시오. 접종자는 0.05μg/kg/min의 에피네프린과 평균 동맥압(MAP) >65mmHg을 유지하기 위해 필요에 따라 승압제 주입으로 지원됩니다.
- 초기 및 후기 재관류 시점 모두에서 심장초음파, 혈액 검사, 심근 생검 및 압력-부피 루프 평가와 같은 분석을 수행합니다.
4. 실험의 종료와 안락사
참고: 이 연구에서 이식 수혜 동물은 CPB에서 분리된 후 1시간 동안 지지되었습니다.
- 실험이 완료되면 마취 상태에서 피출혈을 통해 안락사를 시행합니다.
- 모든 문합을 따라 봉합선을 횡단하여 이식된 동종이식을 이식합니다. 동종이식 표본에 토착 수혜자 조직을 포함하지 않도록 주의하십시오.
- 동종이식편을 즉시 얼음처럼 차가운 PBS에 넣고 가공 및 보관을 위해 실험실로 운반합니다.
결과
여기에 설명된 프로토콜을 사용하여 파일럿 분석을 위해 총 6건의 돼지 DCD 이식이 수행되었습니다. 이러한 6번의 파일럿 실험 과정에서 프로토콜의 구성 요소는 모델의 요구 사항에 더 적합하고, 재현성을 향상시키고, 물류 제약 조건을 설명하도록 개선되었습니다. 여기에 쓰여진 최종 결과 프로토콜은 그림 1에 요약되어 있습니다.
인간이 통제하는 순환계 사멸 과정과 달리, 허혈에 노출된 돼지 심장은 수축이 멈춘 후에도 예상보다 훨씬 더 오랫동안 전기 활동을 유지했습니다. 첫 번째 실험에서 이러한 차이를 인식한 후, 전기 비수축기는 사망 선언을 위한 척도로 신뢰할 수 없는 것으로 간주되었습니다. 임상적 맥락에서 나타난 것과 비례하지 않는 동종이식편에 대한 온난허혈성 손상을 피하기 위해 기계적 무수축(무맥동 전기 활성)을 사용하여 나머지 이식 절차의 사망 시간을 결정했습니다.
또한, 처음에는 기증자 심절제술을 진행하기 15분 전에 대치 상태가 되었습니다. 이것은 파일럿 세트의 처음 세 가지 실험에 활용되었습니다. 이 15분의 따뜻한 허혈 기간에 대한 근거 중 하나는 이식 후 이식 후 이식 기능 장애가 연구에 적합할 정도로 심각한 부상을 입는 것을 목표로 하고 있다는 것이었습니다. 우리는 이러한 초기 실험에서 이식편 기능 장애가 너무 심각하여 CPB에서 분리된 후 한 시간 동안 수용 동물을 유지하는 데 어려움을 겪었으며, 따라서 수용 동물이 1시간 시점을 충족하기 위해 고용량의 수축성 및 압박 보조가 필요하다는 것을 발견했습니다. 이러한 어려움을 감안하여 온허혈성 손상의 기간을 10분으로 줄였으며, 이는 체외 관류를 통한 임상 DCD HT에 더 근접합니다. 그림 2 는 이 단계와 체외 관류 중 및 이식 후에서 동종이식편의 대표적인 이미지를 보여줍니다. 마지막으로, 새로 이식된 심장을 지원하기 위해 CPB 젖을 뗀 후 단계에서 승압제 및 성분 영양 주입의 적정을 조정했습니다. CPB 이후 단계에서 성공을 거두기 위해 심혈관 마취학에 대한 특정 전문 지식을 갖춘 숙련된 팀의 필요성은 아무리 강조해도 지나치지 않습니다.
6개의 실험 중 4개에서 작동 시간을 추적했으며 표 1에 요약되어 있습니다. 프로토콜의 DCD 조달 단계에서 기증자 돼지의 연명 조치 중단부터 사망 선언까지 경과 시간은 14.25(+/- 2.6)분이었습니다. 수술 중인 심폐 우회 시간과 크로스 클램프 시간은 파일럿 실험 기간 동안 각각 약 3시간 및 1.5시간으로 일관되게 유지되었습니다. 실험은 CPB에서 분리된 후 약 1시간 후에 안락사로 종료되었습니다. 안락사 당시 동물들의 안정성의 정도에는 변동이 있었다. 일부 동물은 상대적으로 양호한 안정성과 경미한 이식 기능 장애를 보인 반면, 다른 동물은 상당한 혈역학적 불안정성과 심각한 이식 기능 장애를 보였습니다. 대표적인 스틸 심초음파(deep echocardiography) 디스플레이는 그림 3에 나와 있습니다. 이 평가와 PV 루프와 같은 기타 기능 평가는 기준선과 치료 개입 도입 전후의 동종이식 기능의 차이를 결정하는 데 사용할 수 있습니다.
실험을 통해 수집, 처리 및 저장된 샘플의 요약이 그림 4에 표시되어 있습니다. 이식된 심장은 즉시 얼음처럼 차가운 PBS에 넣고 조직 및 분자 분석을 위해 실험실에 보관했습니다. 수혜자의 원래 심장은 대조군으로 활용되었고, 이식된 동종이식편은 실험 조직으로 보관되었습니다. 심장은 정점에서 기저부까지 4개의 단면으로 절단되었습니다. 이들 각각에서 각 챔버(좌심실, 우심실, 중격 및 양쪽 심방)의 대표 조직 샘플을 액체 질소에서 급속 동결하고 향후 분석을 위해 -80°C에서 보관했습니다. 유사하게, 이러한 각 수준 및 챔버의 대표 조직 샘플을 RNAlater에서 배양하고 급속 동결했습니다. 나머지 조직 샘플은 조직병리학적 분석을 위해 포르말린에 보존되었습니다. 모든 시점의 혈액 샘플을 복제하여 EDTA 또는 CPT 튜브에 저장했습니다. EDTA 튜브에 저장된 혈액을 스핀다운하여 급속 냉동된 혈장을 분리했습니다. CPT 튜브 내의 혈액은 CPT 튜브 공급업체에서 제공한 수정된 프로토콜을 사용하여 PBMC에 대해 처리되었습니다.
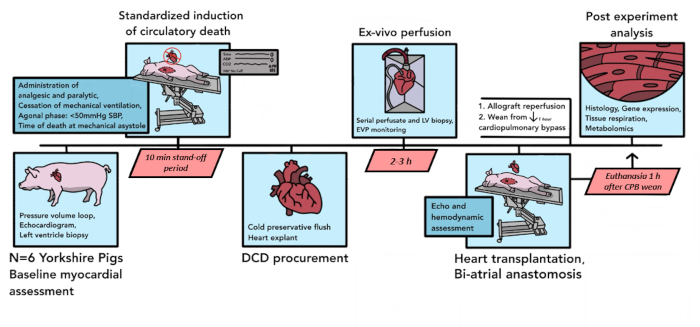
그림 1: Porcine DCD HT 프로토콜 회로도. 돼지 DCD HT 절차에서 발생하는 이벤트의 타임라인이 여기에 설명되어 있습니다. 이 파일럿 연구에서는 6개의 DCD HT가 수행되었습니다. 기증자 돼지 심장 동종이식편에 대한 기준선 심근 평가가 수행된 후 조절된 순환계 사멸이 시작됩니다. 사망 선언 후 10분간 대치 상태가 지속됩니다. 그런 다음 동종이식편을 이식하여 생체 외 관류 장치로 이송하여 2-3시간 동안 재관류합니다. 수용 동물을 준비한 후, 기증자 동종이식편에 이심방 기술을 이식합니다. CPB에서 1시간 동안 재관류를 한 후, 수혜자는 우회 지원에서 제외됩니다. 안락사는 CPB에서 분리된 후 1시간 후에 발생합니다. 이식된 동종이식편은 조직 분석을 위해 처리됩니다. DCD HT = 순환기 사망 후 기증 후 심장 이식; CPB = 심폐 우회. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
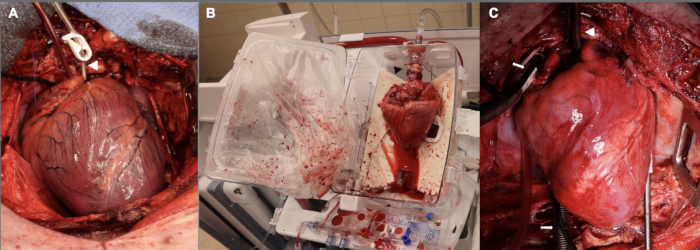
그림 2: DCD OHT 과정을 따라 여러 단계에서의 돼지 심장 동종이식편.(A) 조절된 순환계 사멸 후, 기증자 동종이식편은 팽창, 허혈성 및 부종성입니다. 흰색 화살촉은 대동맥 뿌리 캐뉼라를 보여줍니다. (나) 동종이식편이 기증자로부터 이식되면 체외 관류를 위해 EVP 장치에 배치됩니다. 심장의 방향이 뒤쪽을 향하고 뒤쪽이 바깥쪽을 향하도록 합니다. 검은색 화살표는 동종이식편을 장치에 연결하는 데 사용되는 대동맥 어댑터를 가리킵니다. (C) 수혜자에게 이식한 후, CPB에서 이탈하기 전 1시간 동안 심폐 우회로에서 동종이식편을 재관류합니다. 흰색 화살촉은 대동맥 캐뉼라를 보여줍니다. 흰색 화살표는 bicaval venous cannulas를 가리킵니다. EVP = 체외 관류; CPB = 심폐 우회. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
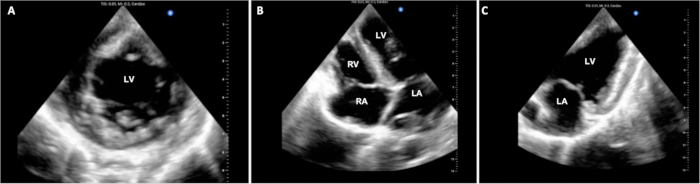
그림 3: 심장 심외막 심초음파. DCD OHT 시술 전반에 걸쳐 심실 기능을 평가하기 위해 여러 개의 심외막 심초음파 이미지를 획득했습니다. (A) 표준 단축, (B) 4챔버 및 (C) 2챔버 뷰가 여기에 표시됩니다. LV = 좌심실; LA = 좌심방; RV = 우심실; RA = 우심방. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
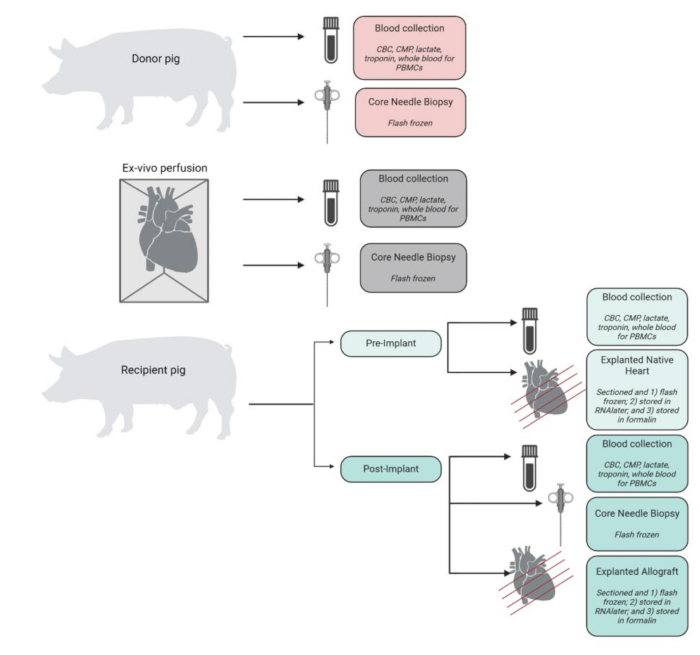
그림 4: 표본 채취 및 처리 워크플로우. 절차의 각 단계에서 샘플 수집 및 처리의 개략도. CBC = 완전 혈구 수; CMP = 종합 대사 패널; PBMC = 말초 혈액 단핵 세포. BioRender에서 만든 그림. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 시간 길이(분) | |
| (평균 ± SD; n = 4) | |
| 환기 중단부터 사망 선언까지의 시간 | 14.25 (2.6) |
| 생체 외 관류 지속 시간 | 147 (18) |
| CPB 지속 시간 | 174 (4) |
| 크로스 클램프 시간 | 90 (12.5) |
| CPB 젖을 뗀 후 사망까지의 시간 | 50 (37) |
표 1. 절차 정보. DCD HT 절차에서 각 중요 단계의 평균 기간입니다. CPB = 심폐 우회.
토론
말기 심부전 치료를 위한 심장 이식의 효능에도 불구하고 이 분야에는 상당한 과제가 남아 있습니다. 기증자 장기의 가용성이 제한되는 문제를 해결하기 위해 최근 몇 년 동안 심장 동종이식 보존 방법(예: 정상 가열 기계 관류)의 발전이 최전선에 떠올랐습니다. 이러한 발전은 순환기 사망 후 기증(DCD HT)에 따른 심장 동종이식편의 이식 채택으로 이어졌습니다. DCD HT 동종이식편을 활용하면 기증자 풀이 확장되고 DBD HT 동종이식편보다 열등하지 않은 단기적인 결과가 나왔지만, 두 기증자 유형 모두와 관련된 이식 전후 조기 사망 위험은 약 5%에 머물러 있습니다3. 심장 이식의 조기 사망 위험은 주로 PGD에 의해 주도됩니다. PGD는 정의된 기증자, 수혜자 및 보존 변수의 일부 기여와 함께 병인학에서 다인자이지만, PGD의 기저에 있는 분자 메커니즘은 일반적으로 잘 이해되지 않고 있습니다. 또한, DCD HT 과정에 의해 발생하는 추가적인 따뜻한 허혈성 손상을 감안할 때, 이러한 심장이 DBD 동종이식편에 비해 PGD의 위험이 더 높을 수 있다는 것은 놀라운 일이 아닙니다. 따라서 정소성 심장 이식 후 단기 사망 위험을 줄이기 위해서는 PGD에 대한 더 나은 이해가 중요하며, 이는 DCD HT에 특히 해당될 수 있습니다.
여기에서는 DCD HT의 고충실도 돼지 수술 모델에 대해 설명합니다. 대형 동물 모델에서 생체 내 DCD HT 모델링의 이점에는 DCD HT 동안 조달된 동종이식편에서 발생하는 병태생리학적 변화를 더 잘 이해할 수 있는 능력뿐만 아니라 최적의 동종이식술 품질을 보장하기 위한 표적 중재를 테스트할 수 있는 능력이 포함됩니다. 이식 후 좌심실 기능 평가 및 압력-부피 루프 분석은 이 돼지 수술 모델이 DCD HT 후 초기 심장 동종이식 기능 장애를 요약할 수 있음을 시사합니다. 따라서, 여기에 기술된 기술은 DCD HT 후 PGD의 재현 가능한 대형 동물 모델을 생성하고, DCD HT 프로세스의 여러 지점에서 치료 전략을 평가하는 데 적합합니다. 실제로, 바이러스 벡터 매개 유전자 치료와 같은 새로운 치료제를 전달하기 위한 수단으로 생체 외 관류를 사용하는 것은 본 연구실 및 기타 연구실에서 활발하게 초점을 맞추고 있는 분야입니다 18,19,20. 우리는 이전에 돼지 non-DCD HT 모델을 사용하여 심장 동종이식편에 이식유전자를 강력하고 균질하게 전달할 수 있는 능력을 입증했습니다. 동일한 기술을 DCD HT 모델에도 적용할 수 있습니다(19,20). 다른 잠재적인 치료 전략으로는 관류액의 화학적 변형, 산화 스트레스 감소를 목표로 하는 소분자 전달, 허혈 기간 동안 신진대사를 지원하기 위한 대사 기질 제공 등이 있습니다 16,21,22. 또한, 여기에 제시된 모델은 임상적으로 사용되는 다양한 조달 기술을 포함하여 DCD HT와 관련된 다양한 변수를 평가하기 위해 쉽게 조정할 수 있습니다. 예를 들어, 우리는 직접 조달 및 생체 외 관류 전략을 설명합니다. 그러나 이 모델은 정상온열 지역 관류를 포함한 대체 조달 관류 방법을 통합하도록 쉽게 조정할 수 있습니다.
이 모델에 사용된 수술 기법은 임상 환경에서 사용된 수술 기법과 매우 유사합니다. 그러나 몇 가지 중요한 차이점이 있습니다. 첫째, 흉골절개술과 심장 노출은 심폐 지원의 중단, 고통기, 사망 결정, 윤리적으로 명령된 교착 상태 기간(개흉 모델) 이전에 발생한다23. 흉골 절개술은 심근 생검을 포함한 기본 기증자 심장 평가가 이루어질 수 있도록 이 순서로 수행됩니다. DCD HT 돼지 모델에서 흉골 절개술 시기에 대한 이전 평가는 연명 조치의 중단에서 사망(따뜻한 허혈 시간)으로의 진행이 더 빠르며 흉부 모델에서 덜 뚜렷한 혈역학적 변화를 동반하는 것으로 나타났습니다. 이러한 동종이식편은 조달 중에 손상이 적은 조건을 경험할 수 있습니다. 그러나 폐쇄 흉부와 개방 흉부 그룹 간에 생화학적(젖산염, 포도당, 카테콜아민 등) 실험실 값이나 세포 사멸 지표에는 유의한 차이가 없었다24. 또한, 모델에 10분의 교착 상태가 포함되어 있기 때문에 이 모델에서 인공호흡 중단부터 기능적 온열 허혈까지의 시간은 인용된 연구의 폐쇄 흉부 그룹의 타이밍과 더 유사합니다. 또한 이 모델 내에서 기능적 온열 허혈 시간은 특정 연구의 실험 목표에 맞게 수정할 수 있는 변수입니다. 여기에 보고된 모델과 임상 환경 간의 또 다른 잠재적 차이는 이 모델에서 죽음을 정의하는 데 무맥동 전기 활동(PEA, 기계적 무수축)이 사용된다는 것입니다. 임상적 맥락에서 사망 선언은 이식 과정에 관여하지 않은 의사에 의해 이루어집니다. PEA는 다른 생명 징후 또는 전기 무수축의 부재와 함께 사망 선언 기준을 충족하는 데 허용될 수 있습니다. 돼지 심장은 수축이 멈춘 후 장기간 전기 활동을 유지했습니다. 임상적 맥락에서 나타난 것과 비례하지 않는 따뜻한 허혈성 손상을 피하기 위해 기계적 무수축기(PEA)를 사용하여 사망을 정의했습니다. DCD의 폐쇄흉부 모델을 사용하는 연구자의 경우, 맥박이 없는 전기 활동(동맥선의 박동 부족)이 여전히 사망을 정의하는 기준으로 사용될 수 있습니다. 말초 산소 포화도가 고통 주기의 시작을 정의하거나 죽음을 정의하는 데 적절한 지표라는 것을 발견하지 못했습니다.
마지막으로, 여기에서 설명한 것은 시간과 리소스를 많이 사용하는 모델입니다. 기증자 돼지의 준비부터 수혜 동물의 죽음까지 약 10시간이 소요되며 많은 협력 노력이 필요합니다. 시술 팀에는 경험이 풍부한 심장 외과 의사, 심장 마취과 전문의, 관류사, 검체 채취 및 처리를 돕는 수의학 및 실험실 직원이 포함됩니다. 이와 같은 대규모 팀은 DCD HT의 복잡한 절차에서 필수적입니다. 그러나 경험이 풍부한 팀과 함께 이 원고에 설명된 대로 DCD HT의 고충실도 돼지 모델을 만들 수 있습니다.
공개
CAM은 TransMedics Inc.의 컨설턴트로 활동한 것에 대해 주식 보상을 받았습니다.
감사의 말
이러한 수술 실험에 귀중한 지원을 해주신 Duke Laboratory Animal Resources의 수의학 기술 지원, Centrifugal Solutions의 관류 지원, Duke 심혈관 마취 팀에 감사드립니다. 또한 Paul Lezberg와 TransMedics, Inc.의 지원에 진심으로 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
참고문헌
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유