Method Article
循環器死後の提供後の同所性心臓移植の高忠実度ブタモデル
* これらの著者は同等に貢献しました
要約
ここでのプロトコルは、同種移植片の ex vivo 灌流を利用した循環死後の提供後の心臓移植の高忠実度ブタモデルについて説明しています。
要約
心臓移植を受けることができる進行性心不全患者の数は、適切な臓器提供者の不足によって制限されています。ドナープールを拡大するために、循環器死後の心臓移植(DCD HT)を含む代替のドナーと調達方法が開発されました。DCD HT後の短期生存率は、脳死ドナーによる心臓移植よりも劣っていませんが、DCD HT同種移植片に関連する一次移植片機能障害(PGD)の割合が増加する可能性があります。着床前診断の根底にある病因は多因子性であり、完全には理解されていません。DCD HT同種移植片の場合、DCD調達中の温性虚血性損傷の期間は、脳死同種移植片がさらされないPGDの潜在的な危険因子です。したがって、機能的な暖かい虚血時間は、DCD HTにおけるPGDの重要なドライバーである可能性があります。しかし、この臨床シナリオにおける着床前診断の根底にあるメカニズムは、分子レベルでは十分に理解されていません。ここで紹介する研究は、DCD同所性心臓移植の高忠実度非生存ブタモデルの開発と検証を説明することを目的としています。この並進大動物モデルの使用は、着床前診断に寄与する分子メカニズムを解明し、同種移植片の保存と早期のパフォーマンスを最適化するために設計された介入を調査するために重要であると仮定しています。このモデルは、DCD HTで使用される周術期および外科的アプローチを臨床的に再現し、ブタの解剖学的構造と生理学を考慮して変更を加えています。この大動物手術モデルの開発は、着床前診断の発症に関するメカニズムの洞察を提供するだけでなく、DCD HT後の臓器回復の改善を目的としたトランスレーショナルリサーチの取り組みを強化するために変更することもできます。
概要
医学的管理が困難な末期心不全の患者にとって、心臓移植は依然として最良の長期生存と生活の質に関連する治療法です。歴史的に、心臓移植には、脳死ドナー(DBD HT)から調達した心臓同種移植片を使用し、低体温静的保存で保存しながら輸送する必要がありました。しかし、心臓移植を必要とする患者の数は、利用可能なドナーの数を超えています。世界中で年間5,000件以上の心臓移植が行われていますが、50,000人の候補者が心臓移植を待っていると推定されています1。さらに、特定されたドナーからの臓器の利用率は30%と低いままです2。近年、ドナー臓器の利用を改善するために、循環器死後の臓器提供後の心臓移植(DCD HT)3,4,5,6など、代替の臓器提供や調達方法が開発されています。
DCD HTドナーは正式な脳死基準を満たしていませんが、継続的な医療が無駄と見なされる回復不能な神経学的損傷を持っています。DCD HTの調達中、延命措置は撤回され、患者は無呼吸と循環停止への進行を監視します。このような状況での死亡は、移植または臓器調達のプロセスに参加していない医師によって宣言されます。死亡が宣言されると、追加のスタンドオフ期間(通常は5分)があり、そこで潜在的なドナーが回復や生命の兆候がないことを確認するために観察され、その後、臓器調達を進める前に死亡宣言が再確認されます7,8。したがって、DCD同種移植片は、DBDドナー同種移植片がさらされない可変期間(少なくとも10分)の温虚血にさらされます。この温性虚血の期間は、以前はDCDドナーによる心臓移植の使用を思いとどまらせていました。しかし、過去 5 年以内に、DCD に関連する温かい虚血時間後の同種移植片回復のために、2 つの調達再灌流方法が開発されました。まず、直接調達および灌流 (DPP) には、循環器死の確認時にドナーの心臓切除術が含まれ、続いて同種移植片の蘇生と ex vivo 灌流による保存が行われます。あるいは、常温局所灌流 (NRP) は、脳循環を除外した体外循環を使用して、心臓摘出術 9,10,11,12 の前にドナーの心臓をその場で再灌流および蘇生します。
これまでのところ、DCD HTに関連する短期生存率は、DBD HTで観察された生存期間と同様でした。ただし、初期の研究では、DBD HT3 と比較して、DCD HT による重度の一次移植片機能障害 (PGD) のリスクが高いことも示唆されています。着床前診断とは、心臓移植後、早期の同種移植機能がレシピエントの循環器系のニーズを満たすには不十分である臨床状況を説明するために使用される用語です。着床前診断の重症度を等級付けするシステムは、国際心肺移植学会によって説明されました。重度の着床前診断では、移植後の期間に適切な循環をサポートするために、機械的な循環補助が必要です13。この状態は、心臓移植後の術後早期死亡の主な要因です。DBD HT と DCD HT の両方の PGD の病因はよく理解されていませんが、多因子性である可能性が高く、ドナー変数、保存変数、およびレシピエント変数がすべて寄与しています。DCD同種移植片の場合、DCD調達中の温性虚血性損傷、および血行動態の不安定性、代謝障害、カテコールアミン、サイトカイン、乳酸、カリウムの急増などの有害なドナー特異的反応は、DBD同種移植片と比較してPGDのリスク増加に寄与する可能性のある提案された要因です。14、15、16。しかし、この臨床シナリオにおける着床前診断の根底にあるメカニズムは、分子レベルでは十分に理解されていません。さらに、おそらくこれらの懸念のために、DCD心臓はDBD臓器17よりも3.37倍衰弱する可能性が高くなります。その結果、臓器保存プロセスを最適化することにより、臓器の利用を強化し、移植結果を改善するというアンメットニーズがまだあります。
この研究では、現在の臨床 DPP DCD HT を高い忠実度で反映する DPP を使用したブタ DCD HT について説明します。このモデルには、1)DCDの調達、2)臓器ケアシステム(OCS)による 生体外 灌流保存、3)レシピエントの移植など、DCD移植プロセス全体の要素が含まれています。この包括的なモデルは、DCD HTのPGDの根底にあるメカニズムをより適切に特徴付ける機会を提供します。これにより、同種移植片の保存と性能の向上を目的とした、標的を絞った合理的な治療戦略の開発が可能になります。さらに、このモデルは、このような新しい治療法の前臨床評価のためのプラットフォームを提供し、心臓移植の分野を安全かつ迅速に進歩させるために重要になります。
プロトコル
すべての飼育と手順は、デューク大学医療センターの施設内動物管理および使用委員会によって、その規制とガイドラインに沿って承認されました。
1. 術前ドナーの準備
- 体重 70 〜 80 kg の血液型に一致するヨークシャー豚を 2 つ選択します (血液型は、米国ノースカロライナ州グラニットフォールズの Looper Farms で実施されます)。手術前に最低6〜8時間、両方の豚を絶食します。
- メーカーのガイドラインと必要なポイントオブケアテスト(材料の表)に従って、心臓灌流モジュールを準備します。
- 心臓灌流モジュールのメンテナンスソリューションを準備します。この溶液には、代謝活性のある心臓の栄養素と、目標血圧の維持を助けるアデノシンが含まれています。
- 以下を追加します:500 mLの透明なプライミング溶液、100 mLの25%アルブミン、100 mgのシプロフロキサシン(200 mg / 100 mL)、マルチビタミン注射の2つの5 mLバイアル、20mEq重炭酸ナトリウム、1 gのセファゾリンナトリウム、および250 mgのメチルプレドニゾロン。.プライミング溶液をスパイクし、内容物を心臓灌流モジュールに加えます。
- 準備が完了したら、50 IUのヒト組換えインスリンをバッグに注入します。
- 0.25 mgのエピネフリンと30 IUのヒト組換えインスリンを500 mLのバッグに水中の500 mLのバッグに注射して、エピネフリン溶液を調製します。.この溶液は、変力効果を持つのではなく、カテコールアミンを置き換えることを目的としています。溶液を10 mL/hで注入します。
- 再構成したレボチロキシン200 μgを100 mLの0.9%生理食塩水バッグに注入して、T4溶液を調製します。3 mL/hの速度で注入します。
- 心臓灌流モジュールのメンテナンスソリューションを準備します。この溶液には、代謝活性のある心臓の栄養素と、目標血圧の維持を助けるアデノシンが含まれています。
- 指定されたドナー豚を4.4 mg / kgのテラゾールと1.0 mg / kgのプロポフォールで鎮静させ、続いてフェイスマスクで送達された2%〜5%の吸入イソフルランを投与します。
- ブタが仰臥位にある間に、手術中の気道を維持するために8〜10mmの気管内チューブで挿管します。.気管内チューブを鼻の所定の位置に固定します。手術中に眼の潤滑を維持するために、獣医用軟膏を目に塗布します。
- 耳の静脈に静脈内(IV)カテーテルを挿入し、IV液(維持液:Lactated Ringer's solution 10 mL/kg/h)を投与します。
- 鎮痛剤(25-100μg / h)のための持続フェンタニル注入を開始し、麻痺を維持するために0.2 mg / kgのベクロニウムを投与します。
- 電気的活動と酸素化を継続的に監視するために、心電図リードとパルスオキシメータを配置します。
- 10 mL / kg / minの一回換気量、毎分10〜15回の呼吸で機械的換気を開始し、残りの手順ではイソフルラン(1%〜5%)を維持します。.反射がなく、心拍数が61〜99 bpmのまま、収縮期血圧が90〜130 mmHgのままになるように、麻酔薬と血管作用薬を滴定します。
- ブタを手術台に置き、上肢を頭側に配置し、術野の外側に固定します。下肢を手術野の外側に固定します。
- 手術野に含める領域を、顎を上、前腋窩線を両側に、剣状突起の 2 本の指の幅を下にして定義します。標準的な方法に従って、手術部位を無菌的に準備し、ドレープします。
- 右側の頸動脈のカットダウンを行います。
- #10ブレードを使用して、胸鎖乳突筋の内側境界に沿って、気管の外側に2本の指の幅で、斜めの右横首切開を行います。
- この切開部を電気焼灼で板腫を通して運び、止血を確保します。platysmaを通過したら、自己保持型リトラクターを使用して曝露を助けます。
- 頸動脈と内頸静脈を慎重に解剖し、分離します。各船の周りに船のループを配置します。
- 10 mLの2%リドカインを局所的に適用して、血管を入浴させます。.
注:リドカインは、ブタの血管が操作で簡単にけいれんし、カニューレ挿入が困難になる可能性があるため、血管拡張効果に使用されます。 - セルディンガー法を使用して、5 Frのマイクロパンクチャーで頸動脈を直接カニューレし、続いて6 Frのイントロデューサーシースをカニューレで切ります。
- イントロデューサーシースを動脈ラインとトランスデューサーに接続し、処置中の全身動脈圧を連続的にモニタリングします。
- 術前の実験室での血液検査のために頸動脈動脈ラインから血液を採取します(全血球計算、包括的代謝パネル、トロポニン、乳酸、および末梢血単核細胞分離のための全血)。
- 1.11.5と同じ手法を使用して内頸静脈をカニューレ挿入します。6 Frシースは、下流の機能評価のための圧力-体積ループカテーテルを導入するために使用されるため、そのままにしておきます。
2. 循環器死およびドナー心臓摘出術後のドナー
- 胸骨切開術を行います。
- #10ブレードを使用して、胸骨のノッチから剣状突起まで縦方向に切開します。電気焼灼を使用して、解剖を皮下組織と胸筋筋膜を通して運びます。
- 電気焼灼で胸骨の正中線にスコアを付けます。手形突起の周りの靭帯付着部を解剖します。
- 振動する胸骨のこぎりを使用して、胸骨の前部テーブルを正中線に沿って慎重に分割します。振動のこぎりを使用して、胸骨の後部テーブルを手足のレベルで完全に分割します。このステップでイノミネート静脈が損傷しないように注意してください。重いハサミを使用して、手形の下の後部テーブルの胸骨分割を完了します。
注:胸骨の下側と心膜の間の平面を手動で鈍的に解剖すると、このステップ中の心臓の損傷を防ぐことができます。 - 電気焼灼を使用して、胸骨の縁の止血を取得します。胸骨リトラクターを配置します。
- 胸腺と心膜の脂肪パッド組織を電気焼灼で除去し、心膜の露出を最適化します。
- 電気焼灼で心膜を慎重に開きます。切開部を心臓の頂点から大動脈のレベルまで縦方向に運びます。
- 2-0のシルクステーステッチで心膜ウェルを作成します。
- ベースラインドナー同種移植片分析を実行します。
- ドナーの心臓が露出している間、および直接心臓操作が行われる前に、ベースライン分析を実行します。これらには、直接心外膜心エコー検査、圧力-体積ループ評価、および心筋コア針生検が含まれます。
- 無菌方式で心エコー検査を行い、心外膜表面から直接標準的な長軸および短軸の画像を取得します。
- 圧力-体積ループ記録を行うには、固体圧力-体積カテーテル(5Fr、122cm)を頸動脈に、内頸静脈を左右の心室にそれぞれ順次導入します。
- シースに挿入する前に、外部から導入するカテーテルの長さ(カニューレ挿入部位から心臓の頂点まで)を測定します。
- カテーテルを動脈シースに導入し、心外膜超音波を使用して左心室に導きます。カテーテルが心室壁に直接触れていないことを確認してください、これは測定精度を妨げる可能性があるためです。
- 次に、カテーテルを静脈鞘に導入し、直接触診または心外膜超音波ガイダンスを使用して、カテーテルを右心室に導きます。
- コア針心筋生検を実施して、後の分析のために組織を採取します。これを左心室の頂点で実行します。生検部位からの出血が著しい場合は、修復ステッチを留置します。
- ドナーの心臓を準備します。
- 大動脈肺窓を解剖して、クロスクランプ留置のためのスペースを確保します。
- 上大静脈(SVC)と下大静脈(IVC)を電気焼灼で円周方向に解剖します。
- 抗凝固薬として、大動脈カニューレ挿入の前に300ユニット/ kgのヘパリンを静脈内(IV)投与します。.
- ダブルアームの4-0ポリプロピレン縫合糸を使用して、大動脈カニューレ挿入のために大動脈巾着を大動脈基部に留置します。7 Fr(14G)大動脈根ベントカニューレでカニューレを留置します。
- 空気を抜いて、ルメル止血帯で所定の位置に固定します。心臓麻痺チューブを洗い流して空気を抜き、ラインを大動脈根カニューレに固定します。
- 次に、将来の静脈カニューレ挿入に備えるために、右心房付属器に財布紐ステッチを配置し、ルメル止血帯で固定します。
- 制御された循環器死を行います。
- 250 μg のフェンタニル IV ボーラスを投与し、続いて鎮痛のために 100 μg/h の持続速度注入 (CRI) を行います。麻痺させるには、0.2 mg / kgのベクロニウムを静脈内投与します。.
- 制御された循環死プロセスを開始するために、人工呼吸器を停止します。.
- 収縮期血圧と平均動脈血圧、動脈線の拍動性、電気的心臓活動、および酸素化状態を継続的に監視します。
注:収縮期血圧が50mmHgを下回ると、苦痛期が始まります。この時点で、心臓が膨張することがあります。死は、機械的な心不全(脈のない電気的活動)によって定義され、生命の兆候はありません。この研究では、このモデルでは電気心不全による死亡を定義していません。これは、ヒトで観察されるよりも豚では遅い脈拍のない電気的活動が持続するため、モデルで意図されたよりも同種移植片の虚血性障害が増加する可能性があるためです。 - 死亡/心不全の時刻から 10 分後、プロトコルの次の手順に進む前に待ちます。この間隔は、スタンドオフ期間に加えて、臨床 DCD HT での縦隔への侵入と準備に必要な時間をシミュレートします。
- ex vivo灌流デバイスのプライミングを行います。
- #11ブレードを使用して、右心房付属器に刺し切開を行い、メーカーが提供する34Fr静脈カニューレでカニューレを挿入します。カニューレをルメル止血帯で固定し、カニューレを ex vivo 灌流装置のコレクションバッグに接続します。
- 約1200〜1500mLのドナー血液をメーカーが提供する収集バッグに収集します。放血前に、30,000 U のヘパリンと 2 mg のチロフィバン HCl がコレクション バッグに追加されます。
- ドナーの血液をろ過し、心臓灌流モジュールに送達します。
- ドナー心臓摘出術を行います。
- ドナーの血液を採取した後、大動脈クロスクランプを適用します。
- ブタの大動脈根と上行大動脈は、人間よりもかなり短いことに注意してください。アーチをクランプしたり、大動脈を不完全に閉塞させたりしないように、クロスクランプをできるだけ近位に適用するように注意してください。
- デルニド心臓麻痺の1Lを大動脈根に投与し、根圧を60〜100mmHgとすることを目標とします。
- 心筋反射で下大静脈を横断し、左心房付属器を横断して、心臓麻痺の送達中に右心室と左心室を排出します。
- ドナーの心臓に冷たい滅菌スラッシュを置きます。
- IVC、SVC、無名動脈のすぐ遠位にある大動脈、および分岐部で肺動脈(PA)を分割します。ドナーの左心房(LA)を横断し、同種移植片に十分な組織のカフを残します。
- ハートをフィールドから取り出し、滅菌済みの冷たいスラッシュで満たされた洗面器に入れて、バックテーブルの準備をします。
- 大動脈の遠位端の内側に4つの等間隔の誓約された水平マットレス縫合糸(4-0ポリプロピレン)を置きます。
- ドナーの血液を採取した後、大動脈クロスクランプを適用します。
- Ex vivo灌流
- ex vivo 灌流大動脈アダプターを遠位大動脈に挿入し、誓約された縫合糸のすぐ下に置かれた 0-0 シルク縫合糸または臍帯テープでしっかりと固定します。
- PA、SVC、IVC、および exvivo 灌流デバイスを使用している間は、心房を開いたままにします。.
注:この構成では、左心室拡張は発生しませんでした。. - 同種移植片を ex vivo 灌流装置に輸送し、大動脈アダプターを接続します。心臓の後面が正面を向いていることを確認してください。心臓の前面がデバイスと2つの除細動パッドに接触していることを確認します。同種移植片を34°Cに維持します。 必要に応じて除細動を行い、心室性不整脈を組織化されたリズムに戻します。.
- この時点で、治療薬を心筋麻痺ポートを介してex-vivo灌流回路に導入することができます。あるいは、灌流液または物理回路を変更して、DCD HT同種移植片の回収を促進することを目的とした実験条件を評価することもできます。例えば、我々は以前に、灌流液をセルセーバーを介して予め形成された中和抗体から洗浄し、ウイルスベクター18,19,20による形質導入を増強する必要があることを示しました。
- 必要に応じて、ポイントオブケアラボを使用して、重炭酸ナトリウム、グルコン酸カルシウム、およびデキストロースの投与をガイドします。
- この ex vivo 灌流段階で、灌流液サンプル、血液検査、およびコア針生検サンプルを取得します。
注:このモデルでは、同種移植片は、レシピエントに移植する前に約2〜3時間ex vivo 灌流装置上に留まります(表1)。同種移植片が 生体外で 灌流された時間の長さは、レシピエント動物を移植する準備に要した時間の長さによって決定されました。ただし、 ex vivo 灌流時間は、研究目的に基づいて調整できる変数です。
3. レシピエントの心臓摘出術、移植術、再灌流
- 手順1.3〜1.11.8の説明に従って、レシピエントブタを準備します。
- さらに、超音波ガイドとセルディンガー法を使用して、7 Fr 20 cm トリプル ルーメン中心線カテーテルを左の外部または内部頸静脈に配置します。超音波ガイドを使用して5Frの大腿動脈ラインを配置します。
- 無菌フィールドをドレープした後、心肺バイパス(CPB)回路を準備し、ラインをフィールドに持ってきます。
- CPBの動脈と静脈のラインを再循環させて空気を抜きます。ラインをクランプして分割します。バイカバルカニューレ挿入用の静脈ラインを準備します。
- この研究が実施されている施設での臨床心臓移植で行われているように、拒絶反応または虚血による炎症反応に対処するために、術前用量 1 g のメチルプレドニゾロンを投与します。
- ステップ1.11および2.1で前述したように、右頸動脈の切り込みと胸骨正中線切開術を行います。
- レシピエント心臓切除術を行います。
- 前と同じように大動脈肺窓を解剖します。SVCとIVCを解剖し、血管の周りに円周臍テープを貼ります。
- カニューレ挿入の前に、400ユニット/ kgのヘパリンを投与します。.活性化凝固時間(ACT)の目標まで滴定>480秒。
- 標準的な大動脈カニューレ挿入財布紐ステッチを遠位上行大動脈に配置します(ダブルアームの誓約された2-0コーティングされた編組ポリエステル縫合糸を使用)。ルメル止血帯と止血剤で固定します。
- 収縮期血圧が120mmHg未満であることを確認してください。#11ブレードを使用して、巾着のひも内に全層の刺し傷を切開します。この切開を通して15 Frカニューレで大動脈をカニューレします。カニューレをRumel止血帯で所定の位置に固定します。
- 大動脈カニューレをクランプします。動脈バイパスラインの空気を抜いた後、大動脈カニューレをCPB回路に接続します。ラインに気泡が存在しないことを確認します。
- 別の大動脈巾着紐を作成し、大動脈基部ベントカニューレを挿入します。
- SVCとIVCの両方で18-20 Fr直角金属先端カニューレを使用し、ランメル止血帯で固定したバイカバル技術を使用して静脈カニューレ挿入を行います。次に、これらのカニューレをCPB回路の静脈肢に接続します。
- CPBを目標流量2.4 L / min/ m 2 まで開始し、32°Cに冷却します。 麻酔薬と昇圧剤を滴定して、平均動脈圧を60mmHg>維持します。
注:これらの手順は、CPB実行のコース全体を通じて血行動態管理を監視および調整する、委員会認定の心臓胸部麻酔科医および認定灌流医によって実行されます。 - 大動脈クロスクランプ近位を大動脈カニューレに適用し、レシピエントの本来の心臓の説明を進めます。左右の心房カフは、両心房移植技術を容易にするのに十分な大きさのままにしておきます。
注:このモデルでは、ブタの血管系が非常にデリケートであるため、バイアトリアル技術が使用されています。これにより、IVCおよびSVC血管吻合はバイカバル技術では技術的に困難になります。 - 大動脈とPAをできるだけ根元に近づけて横断し、血管の長さを最大限に維持します。新たに摘出した心臓を氷冷リン酸緩衝生理食塩水(PBS)に入れ、実験室で輸送および処理します。
- レシピエントの同種移植片両心房移植を行います。
- 製造元の指示に従って、 ex vivo 灌流装置で同種移植片を冷却します。デバイスから取り外す前に、心筋麻痺の停止のために 1 L の冷たいデルニド心臓麻痺をもう一度投与します。
- 大動脈アダプターを外し、無菌の冷たいスラッシュの洗面器で心臓をバックテーブルに運びます。
- 心臓に卵形窩窩(PFO)または不注意による損傷の部位がないか検査します。
注:重要なことに、豚では、通常、右心房またはIVCに排出される前に左心房境界に沿って排出する全身静脈があります。この静脈は調達プロセスで開く可能性があり、移植を進める前に結紮されていることを確認するように注意する必要があります。 - 大動脈をアダプター固定部位の下の健康な組織にトリミングします。
- Metzenbaumハサミを使用して、レシピエントLAカフのサイズに一致するように左心房の開口部をトリミングします。右のアトリウムにも同じことを行います。
- 左心房吻合をダブルアームの4-0 Prolene縫合糸でランニング方式で開始します。右のPA吻合、大動脈吻合、および右心房吻合を続行し、すべて連続的な4-0プロレン縫合で完了します。
- 大動脈クロスクランプを取り外す前に、常温症(37°C)への再加温を開始します。.
- 同種移植片の再灌流を行い、CPBから離脱します。
- すべての吻合が完了したら、大動脈クロスクランプを解除して同種移植片を再 ?? 血します。.
- すべての吻合部の止血を確保します。
- ネイティブのリズムと収縮性が戻ってくるのを待ちましょう。心外膜ペーシングワイヤーを配置し、同種移植片心拍数が100bpmの場合は100bpmでペースを調整します<100bpm。
- 60分の再灌流後、CPBからの離脱を試みます。.レシピエントは、0.05 μg/kg/min のエピネフリンと、平均動脈圧 (MAP) >65 mmHg を維持するために必要に応じて昇圧剤の注入でサポートされます。
- 心エコー検査、血液検査、心筋生検、圧力-体積ループ評価などの分析を、早期および後期の再灌流時点で実施します。
4. 実験の終了と安楽死
注:この研究では、移植レシピエント動物をCPBからの分離後1時間支持しました。
- 実験が完了すると、麻酔下での放血により安楽死が行われます。
- 移植された同種移植片を、すべての吻合に沿って縫合線を横断することにより、移植します。同種移植片標本に天然のレシピエント組織を含めないように注意してください。
- 同種移植片を直ちに氷冷PBSに入れ、処理と保管のために実験室に輸送します。
結果
ここに記述されているプロトコルを用いたパイロット分析のために、合計6回のブタDCD移植が行われました。これら 6 つのパイロット実験の過程で、プロトコルのコンポーネントがモデルのニーズにより適し、再現性を高め、ロジスティック上の制約を考慮するように改良されました。ここに書かれているように、最終的な結果のプロトコルを 図1にまとめます。
人間が制御する循環死過程とは異なり、虚血を受けたブタの心臓は、収縮性が停止した後でも、予想よりもはるかに長く電気的活動を維持しました。最初の実験でこの違いを認識した上で、電気心不全は死亡宣告の尺度として信頼性が低いと見なされました。臨床状況で見られるものとは不釣り合いな同種移植片への温虚血性損傷を避けるために、機械的心不全(脈のない電気的活動)を利用して、残りの移植手順の死亡時間を決定しました。
さらに、スタンドオフ期間は、ドナー心臓切除術に進む前に最初に 15 分でした。これは、パイロットセットの最初の3つの実験で利用されました。この15分間の温かい虚血期間の理論的根拠の一部は、移植後の移植片の機能障害が研究に適した程度を持つほど深刻な損傷を持つことを目指していたということでした。これらの初期の実験における移植片の機能不全は非常に深刻であり、CPBからの分離後1時間にわたってレシピエント動物を維持することが困難であり、レシピエント動物が1時間のタイムポイントを満たすために高用量の変力および昇圧サポートを必要とすることがわかりました。これらの困難を考慮して、温虚血性損傷の期間を 10 分に短縮し、 これは ex vivo 灌流による臨床 DCD HT により近似しています。 図2 は、この段階、 ex vivo 灌流中、および移植後の同種移植片の代表的な画像を示しています。最後に、新たに移植された心臓をサポートするために、CPB 離脱後の昇圧剤と強心薬注入の滴定に調整が加えられました。このCPB後のフェーズでの成功を高めるためには、心血管麻酔学の特定の専門知識を持つ経験豊富なチームの必要性は、いくら強調してもしすぎることはありません。
手術時間は、6つの実験のうち4つで追跡され、 表1にまとめられています。プロトコルのDCD調達フェーズでは、ドナーブタの生命維持措置の停止から死亡宣言までの経過時間は14.25(+/-2.6)分でした。手術中の心肺バイパス時間とクロスクランプ時間は、パイロット実験全体でそれぞれ約3時間と1.5時間で一貫していました。実験は、CPBからの分離から約1時間後に安楽死で終了しました。安楽死時の動物の安定性の程度にはばらつきがありました。一部の動物は比較的良好な安定性を示し、軽度の移植片機能障害のみを示しましたが、他の動物は重大な血行動態の不安定性と重度の移植片機能障害を示しました。.代表的な静止心エコー検査ディスプレイを 図3に示します。これとPVループなどの他の機能評価は、ベースラインからの同種移植片機能の違い、および治療的介入の導入前後の違いを判断するために利用できます。
実験を通じて収集、処理、保存されたサンプルの概要を 図4に示します。摘出された心臓は、すぐに氷冷PBSに入れられ、組織および分子分析のために実験室で保存されました。レシピエントのネイティブ心臓をコントロールとして利用し、移植した同種移植片を実験組織として保存しました。ハートは、頂点から基部まで4つの断面にカットされました。これらの各チャンバから、各チャンバー(左心室、右心室、中隔、および両心房)の代表的な組織サンプルを液体窒素で急速凍結し、将来の分析のために-80°Cで保存しました。同様に、これらの各レベルおよびチャンバーの代表的な組織サンプルをRNAlaterでインキュベートし、急速凍結しました。組織の残りのサンプルは、病理組織学的分析のためにホルマリンで保存されました。任意の時点の血液サンプルを重複して採取し、EDTAまたはCPTチューブに保存しました。EDTAチューブに保存された血液をスピンダウンして血漿を分離し、血漿を瞬間凍結しました。CPTチューブ内の血液は、CPTチューブベンダーから提供された修正プロトコルを使用してPBMC用に処理されました。
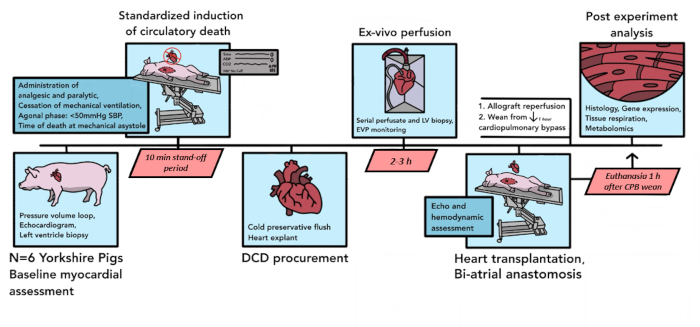
図1:ブタのDCD HTプロトコルの概略図ブタのDCD HT手順で発生するイベントのタイムラインがここに描かれています。このパイロット研究では、6 つの DCD HT が実施されました。ベースラインの心筋評価は、ドナー豚の心臓同種移植片で行われ、その後、制御された循環器死が始まります。死亡宣言後、10分間のスタンドオフ期間があります。その後、同種移植片を摘出してex vivo灌流装置に輸送し、そこで2〜3時間再灌流します。レシピエント動物の調製後、ドナー同種移植片に二心房技術を移植する。CPBでの1時間の再灌流後、レシピエントはバイパスサポートから離脱します。.安楽死は、CPBからの分離の1時間後に行われます。移植された同種移植片は、組織分析のために処理されます。DCD HT = 循環器死後の提供後の心臓移植;CPB = 心肺バイパス。この図の拡大版を表示するには、ここをクリックしてください。
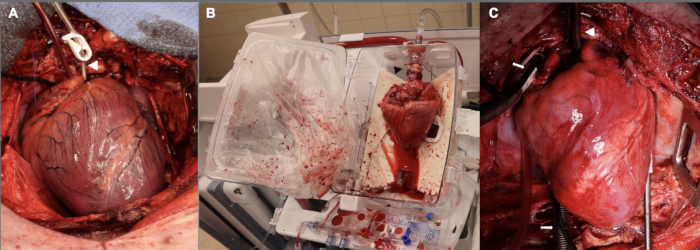
図2:DCD OHTプロセスに沿ったさまざまな段階でのブタ心臓同種移植片 (A)制御された循環死後、ドナー同種移植片は膨張し、虚血性で、浮腫性になります。白い矢印は大動脈根カニューレを示しています。(イ) 同種移植片がドナーから移植されると、ex vivo 灌流のために EVP デバイスに配置されます。心臓の向きに注目し、後面を外側に向けています。黒い矢印は、同種移植片をデバイスに接続するために使用される大動脈アダプターを指しています。(C)レシピエントに移植した後、同種移植片はCPBからの離脱前に1時間心肺バイパスで再灌流されます。白い矢印は大動脈カニューレを示しています。白い矢印は二刀骨静脈カニューレを指しています。EVP = ex vivo 灌流;CPB = 心肺バイパス。この図の拡大版を表示するには、ここをクリックしてください。
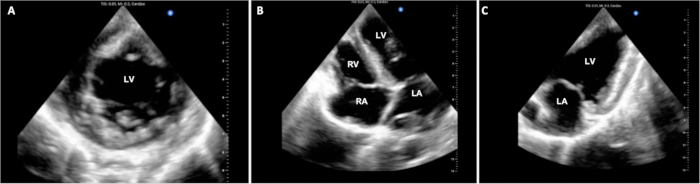
図3: 心臓心外膜心エコー検査。 DCD OHT手順全体を通じて、心室機能を評価するために複数の心外膜心エコー画像が取得されました。(A)標準短軸、(B)4チャンバー、(C)2チャンバー図を示します。LV =左心室;LA = 左心房;RV =右心室;RA =右心房。 この図の拡大版を表示するには、ここをクリックしてください。
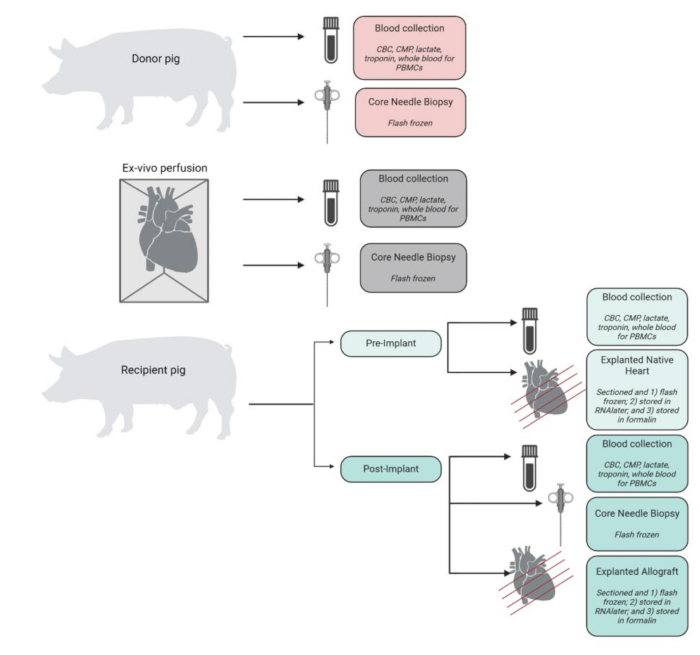
図4:検体採取と処理のワークフロー。手順の各ステップでのサンプル収集と処理の概略図。CBC = 全血球計算;CMP = 包括的な代謝パネル;PBMCs = 末梢血単核細胞。BioRenderで作成されたフィギュア。この図の拡大版を表示するには、ここをクリックしてください。
| 時間の長さ (分) | |
| (平均 ± SD; n = 4) | |
| 換気の停止から死亡宣告までの時間 | 14.25 (2.6) |
| Ex vivo 灌流期間 | 147 (18) |
| CPBデュレーション | 174 (4) |
| クロスクランプ時間 | 90 (12.5) |
| CPBの離乳から死亡までの時間 | 50 (37) |
テーブル 1. 手続き情報。 DCD HT 手順の各重要なステップの平均期間。CPB = 心肺バイパス。
ディスカッション
末期心不全の治療に対する心臓移植の有効性にもかかわらず、この分野では大きな課題が残っています。ドナー臓器の限られた利用可能性に対抗するために、近年、心臓同種移植片保存法(例えば、常温機械灌流)の進歩が最前線に浮かび上がっています。これらの進歩により、循環器死後の提供後の心臓同種移植片移植片(DCD HT)の採用につながりました。DCD HT同種移植片の利用はドナープールを拡大し、DBD HT同種移植片よりも劣らない短期的な結果をもたらしますが、両方のドナータイプに関連する移植周辺早期死亡のリスクは約5%のままです3。心臓移植における早期死亡リスクは、主に着床前診断によって引き起こされます。着床前診断は病因において多因子性であり、定義されたドナー、レシピエント、および保存変数の寄与がありますが、着床前診断の根底にある分子メカニズムは一般的によく理解されていません。さらに、DCD HTプロセスによって生じる温性虚血性損傷が加わることを考えると、これらの心臓がDBD同種移植片と比較して、着床前診断のリスクが高い可能性があることは驚くべきことではありません。したがって、同所性心臓移植後の短期的な死亡リスクを減らすためには、着床前診断をよりよく理解することが重要であり、これは特にDCD HTに当てはまる可能性があります。
ここでは、DCD HTの高忠実度ブタ手術モデルについて説明します。DCD HTをin vivoで大規模動物モデルでモデル化する利点には、DCD HT中に調達された同種移植片で発生する病態生理学的変化をさらに理解する能力だけでなく、最適な同種移植片の品質を確保することを目的とした標的を絞った介入を試験する能力も含まれます。移植後の左心室機能の評価、および圧力-体積ループ分析は、このブタ手術モデルが DCD HT 後の初期の心臓同種移植片機能障害を再現できることを示唆しています。したがって、ここで詳述する技術は、DCD HT後のPGDの再現可能な大動物モデルを作成し、DCD HTプロセスに沿った多くのポイントでの治療戦略の評価に適しています。実際、ウイルスベクター媒介遺伝子治療などの新規治療薬を送達するための手段としてex vivo灌流を使用することは、私たちの研究室や他の研究室で積極的に焦点を当てている分野です18,19,20。私たちは以前に、ブタの非DCD HTモデルを使用して、導入遺伝子を心臓同種移植片に堅牢かつ均一に送達する能力を実証しました。同じ手法をDCD HTモデル19,20に適用できます。他の潜在的な治療戦略には、灌流物の化学修飾、酸化ストレスの減少を目的とした小分子送達、虚血期の代謝をサポートする代謝基質の提供などが含まれる16,21,22。さらに、本明細書で提示するモデルは、臨床的に使用される異なる調達技術を含む、DCD HTに関連する異なる変数を評価するために容易に適合させることができる。たとえば、直接調達とex vivo灌流戦略について説明します。ただし、このモデルは、常温局所灌流を含む代替の調達灌流方法を組み込むように容易に適合させることができます。
このモデルで採用されている外科的技術は、臨床現場で使用されているものと密接に反映されています。ただし、いくつかの重要な違いがあります。第一に、胸骨切開と心臓曝露は、心肺補助の停止、苦痛期、死亡の決定、および倫理的に義務付けられたスタンドオフ期間(開胸モデル)23の前に行われます。胸骨切開術は、心筋生検を含むベースラインドナーの心臓評価が行われるように、この順序で行われます。DCD HT ブタモデルにおける胸骨切開のタイミングの事前評価では、生命維持手段の中止から死への進行 (温かい虚血時間) がより速く、開胸モデルでは血行動態の変化があまり顕著ではないことが示されました。これらの同種移植片は、調達中に損傷が少ない状態になる可能性があります。しかし、閉鎖胸部群と開放胸部群の間で、生化学的(乳酸、グルコース、カテコールアミンなど)の検査値や細胞死のマーカーに有意差はなかった24。さらに、モデルに 10 分間のスタンドオフ期間が含まれているため、このモデルでは、換気の中止から機能的温虚までの時間は、引用された研究の閉鎖胸部グループのタイミングにより近くなります。さらに、このモデル内では、機能的温性虚血の時間は、特定の研究の実験目標に合わせて変更できる変数です。ここで報告されたモデルと臨床環境との間の別の潜在的な違いは、このモデルでは死を定義するために無脈性電気活動(PEA;機械的心不全)が使用されていることです。臨床の文脈では、死亡宣告は移植プロセスに関与していない医師によって行われます。PEAは、他の生命の兆候または電気的心不全の欠如とともに、死亡宣言の基準を満たすために許容されます。ブタの心臓は、収縮性の停止後、長期間にわたって電気的活動を維持しました。臨床的文脈で見られるものとは不釣り合いな温性虚血性損傷を回避するために、機械的収縮不全(PEA)を使用して死を定義しました。DCD の閉鎖胸部モデルを使用している研究者にとって、脈拍のない電気的活動 (動脈線の拍動性の欠如) は、死を定義する基準として引き続き使用できます。末梢酸素飽和度が苦痛期の発症や死亡を定義するための適切なマーカーであることはわからなかった。
最後に、ここで説明したのは、時間とリソースを大量に消費するモデルです。ドナー豚の調製からレシピエント動物の死まで約10時間かかり、大規模な共同作業が必要です。手技チームには、経験豊富な心臓外科医、心臓麻酔科医、灌流医、サンプルの収集と処理を支援する獣医および検査スタッフが含まれます。このような大規模なチームは、DCD HTの複雑な手続きにおいて不可欠です。しかし、経験豊富なチームがあれば、この原稿で説明されているように、DCD HTの高忠実度ブタモデルの作成が可能です。
開示事項
CAMは、TransMedics Inc.のコンサルタントを務めたことで株式報酬を受け取りました。
謝辞
これらの外科的実験に対する貴重なサポートを提供してくださったDuke Laboratory Animal Resourcesの獣医学技術サポート、Centrifugal Solutionsの灌流サポート、およびDuke心血管麻酔チームに感謝します。また、Paul Lezberg氏とTransMedics, Inc.のご支援に心から感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
参考文献
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved