Method Article
Установление и гистологический анализ органоидов пищевода, моделирующих прогрессирование от нормальных к раковым тканям
* Эти авторы внесли равный вклад
В этой статье
Резюме
Настоящий протокол описывает создание и гистологический анализ моделей органоидов пищевода, которые представляют различные стадии опухолевой прогрессии. Этот метод позволяет исследователям изучать изменения в клеточной морфологии, пространственной организации и паттернах экспрессии молекулярных маркеров при переходе от нормальных тканей к раковым.
Аннотация
Органоиды стали ключевым инструментом для углубления понимания онкогенеза и терапии рака. Создавая модели органоидов человека, представляющие различные стадии опухоли, и выполняя гистологические анализы, можно получить более глубокое понимание изменений в клеточной морфологии, пространственной архитектуре и экспрессии ключевых молекулярных маркеров по мере прогрессирования опухоли. В этом исследовании представлен всеобъемлющий протокол создания и культивирования плоскоклеточных органоидов пищевода. Кроме того, в протоколе описываются методы оценки паттернов экспрессии и пространственной организации критических молекул в органоидах с использованием таких методов, как фиксация, встраивание и окрашивание. Благодаря этому протоколу были выявлены значимые изменения в пространственной структуре клеток плоского эпителия пищевода и в экспрессии различных биомаркеров опухоли в процессе онкогенеза. Протокол облегчает построение и гистологический анализ органоидов, позволяя исследователям исследовать пространственную архитектуру и молекулярные изменения эпителиальных клеток на различных стадиях онкогенеза и терапевтического вмешательства.
Введение
Онкогенез – сложный, многоступенчатый процесс, характеризующийся прогрессирующими молекулярными и морфологическими изменениями в клетках 1,2. Плоскоклеточный рак пищевода (ESCC), распространенное злокачественное новообразование с плохим прогнозом 3,4, иллюстрирует это поэтапное прогрессирование через четыре различные стадии: нормальная слизистая оболочка, интраэпителиальная неоплазия низкой степени злокачественности (LGIN), высокодифференцированная интраэпителиальная неоплазия (HGIN) и инвазивная карцинома5. На протяжении этих стадий эпителиальные клетки демонстрируют динамические изменения в паттернах молекулярной экспрессии и пространственной организации, сопровождающиеся систематическими изменениями морфологии ткани по мере ее перехода из нормального состояния в злокачественное 6,7. Несмотря на успехи в понимании патогенеза ESCC, отсутствие экспериментальных моделей, которые точно повторяют пространственные и временные аспекты эволюции опухоли, обеспечивая при этом систематический гистологические и молекулярные анализы, препятствует более глубокому механистическому пониманию прогрессирования заболевания и терапевтического развития.
В то время как 2D-иммортализированные линии раковых клеток внесли значительный вклад в понимание онкогенеза, они по своей природе ограничены в воспроизведении биологической сложности и патологических особенностей нативных опухолей8. Животные модели, хотя и предоставляют информацию в контексте in vivo, часто плохо предсказывают реакцию человека из-за видовых различий9. В противоположность этому, органоиды стали преобразующей доклинической платформой, которая добросовестно сохраняет клеточную гетерогенность, архитектуру и функциональность тканей человека 10,11,12,13. В качестве доклинических моделей органоиды лучше отражают характеристики первичных опухолей, что позволяет детально исследовать ключевые молекулярные события и клеточные изменения во времяпрогрессирования опухоли. Например, Chen et al. использовали полученные от пациента пищеводные органоиды с разных стадий ESCC для выяснения эпителиально-фибробластных взаимодействий, в конечном итоге подтвердив сигнальную ось ANXA1-FPR2 в качестве критического фактора патогенеза ESCC6. Аналогичным образом, Ko et al. использовали генетически модифицированные пищеводные органоиды для выявления ключевых генетических детерминант, вызывающих инициацию ESCC и уклонение от иммунитета, демонстрируя, как модели органоидов могут эффективно повторять особенности заболевания и выявлять новые терапевтические мишени.
Настоящая методология решает важные проблемы в моделировании рака пищевода путем создания воспроизводимого протокола для создания многоступенчатых органоидов ESCC, которые отражают гистологическую прогрессию от нормального эпителия до инвазивной карциномы. Эта система объединяет оптимизированные условия культивирования с использованием среды, кондиционированной L-WRN, для поддержания эпителиальной стволовости в сочетании со стандартизированными протоколами гистологической обработки и мультиплексного иммунофлуоресцентного анализа (mIF), обеспечивая идеальную платформу для лонгитюдного анализа пространственных и молекулярных изменений во время онкогенеза. По сравнению с альтернативными методами, такими как 2D-культуры, эта органоидная платформа уникальным образом сохраняет тканевую архитектуру, позволяя визуализировать пространственно организованные молекулярные маркеры, включая белок иммунной контрольной точки PD-L1 (CD274), который опосредует уклонение опухоли от иммунного ответа путем ингибирования Т-клеточного ответа 16,17,18, и маркер распространения Ki-67. Протокол позволяет органоидам из нормальных тканей пищевода и предраковых тканей проходить, помогая исследователям построить непрерывную модель органоида от нормальной ткани до опухоли19. Позволяя детально анализировать пространственные и молекулярные изменения во время онкогенеза, этот протокол предлагает исследователям мощный инструмент для понимания механизмов, лежащих в основе развития и прогрессирования рака, что потенциально может привести к улучшению терапевтических стратегий.
Эта методология особенно подходит для исследователей, изучающих эпителиальный канцерогенез, взаимодействие микроокружения опухоли или терапевтические реакции при ESCC и связанных с ним плоскоклеточных злокачественных новообразованиях. Его модульная конструкция позволяет адаптироваться для изучения других молекулярных маркеров или сигнальных путей при условии включения соответствующих этапов валидации. Предлагая стандартизированную, но гибкую платформу, этот протокол направлен на продвижение доклинических исследований в биологии опухолей и ускорение преобразования механистических знаний в таргетную терапию.
протокол
Это исследование было одобрено Институциональным наблюдательным советом онкологической больницы Китайской академии медицинских наук (Одобрение NoNo 20/069–2265, 22/221-3423 и 23/305-4047). Образцы тканей пищевода были получены от пациентов, перенесших хирургическое вмешательство или ранний скрининг на плоскоклеточный рак пищевода (ESCC) в Онкологической больнице Китайской академии медицинских наук в период с 2021 по 2024 год с целью создания органоидов пищевода человека. Ни один из пациентов, включенных в это исследование, не получал химиотерапию или лучевую терапию до сбора образца. Было получено информированное согласие от всех участников, а соответствующая клиническая информация была извлечена из медицинских карт. Полный перечень реагентов и оборудования, использованных в данном исследовании, приведен в Таблице материалов.
1. Получение эпителиальных органоидов пищевода
- Приготовление среды, кондиционированной L-WRN
- Получение клеточной линии L-WRN
- Разморозить клеточную линию L-WRN (хранение при -80 °С) на водяной бане при температуре 37 °С в течение 1-2 мин. Смешайте с 5 мл предварительно подогретой базальной питательной среды (DMEM с добавлением 10% FBS).
- Центрифугируйте смесь при температуре 200 x g в течение 5 минут при комнатной температуре (RT).
- Выбросьте надосадочную жидкость. Ресуспендируйте клетки 2-3 мл свежей предварительно подогретой селекционной среды (DMEM, содержащей 10% FBS, 0,5 мг/мл гигромицина B и 0,5 мг/мл G-418).
ПРИМЕЧАНИЕ: Храните среду при температуре 4 °C (максимальное хранение 1 месяц). - Перенесите клетки в 10-сантиметровую культуральную чашку, содержащую среду для отбора. Культивируйте клетки при температуре 37 °C в увлажнённом инкубаторе с 5% содержаниемCO2 .
- Прохождение клеточной линии L-WRN
- Диссоциировать конфлюентные клетки с помощью 0,025% трипсина-ЭДТА (1-2 мин при 37 °C) и разделить в соотношении 1:2.
- Сбор среды, кондиционированной L-WRN
- Замените питательную среду базальной питательной средой при 80% слиянии клеток. Перенесите надосадочную жидкость в центрифужную пробирку.
- Профильтруйте через мембрану толщиной 0,22 мкм для удаления клеточного мусора. Соберите фильтрат в виде среды, кондиционированной L-WRN.
ПРИМЕЧАНИЕ: Храните среду, кондиционированную L-WRN, при температуре 4 °C (1 неделя) или при -80 °C (6 месяцев).
- Получение клеточной линии L-WRN
- Подготовка питательной среды для органоидов пищевода человека (H-EOCM)
- Подготовка H-EOCM
- Вортексируйте L-WRN-кондиционированную среду (объем 1,5 мл) после 4 ч равновесия при 4 °C.
- Смешайте среду Advanced DMEM/F12 со следующими добавками для получения H-EOCM: 3% среды, кондиционированной L-WRN, 1× Anti-Anti, 1× L-глутамина, 1× добавки N2, 1× добавки B27, 0,15 мМ HEPES, 40 нг/мл EGF, 10 μM Y-27632 и 50 μM A83-01.
ПРИМЕЧАНИЕ: Храните H-EOCM в замороженном состоянии при температуре -20°C в течение шести месяцев.
- Подготовка H-EOCM
- Предопытная подготовка
- Разморозьте H-EOCM, поддерживая его при температуре 4 °C в течение 4 часов.
2. Создание пищеводного органоида человека
- Подготовка материалов
- Разморозьте матрицу базальной мембраны и H-EOCM при 4 °C. Простерилизуйте хирургические ножницы и пинцет для следующего эксперимента.
- Предварительно охладите наконечники пипеток до 4 °C. Предварительно прогрейте 24-луночный планшет до 37 °C.
- Обработка тканей и выделение клеток
ПРИМЕЧАНИЕ: Опухолевая ткань ESCC, диспластические поражения (≤2 см от края опухоли) и нормальная ткань пищевода (≥5 см от края опухоли) были собраны у тех же лиц с ESCC, которым была выполнена хирургическая резекция. Кроме того, многоступенчатые образцы пищевода были получены с помощью программы раннего выявления и скрининга ESCC, как описано в наших предыдущих исследованиях 6,7.- Очистите образец промывочным буфером комнатной температуры (PBS, содержащим 1×Anti-Anti и 0,15 мМ HEPES) в центрифужных пробирках объемом 5 мл три раза.
ПРИМЕЧАНИЕ: Промойте образцы более трех раз, чтобы снизить риск загрязнения. - Измельчите ткань на 1 мм3 фрагмента с помощью стерильных ножниц. Перенесите фрагменты в центрифужные пробирки объемом 1,5 мл.
- Суспензируйте образец с помощью буфера для разложения объемом 1 мл и встряхните его при температуре 37 °C, 50-100 об/мин, в течение 10-20 минут, чтобы ткань переварилась.
- Центрифугируйте смесь при 400 x g в течение 5 минут при 4 °C. Выбросьте надосадочную жидкость.
- Ресуспендируйте осадок в 500 мкл 0,025% трипсина-ЭДТА. Выдерживать при температуре 37 °C в течение 10 минут. Добавьте 1 мл DMEM с добавлением 10% FBS для остановки ферментативной активности.
- Пропустите суспензию через стерильный фильтр 70 мкм. Соберите фильтрат в центрифужную пробирку объемом 1,5 мл.
- Центрифуга фильтрует в течение 5 мин при 400 x g при 4 °C. Выбросьте надосадочную жидкость. Ресуспендируйте клетки 100 мкл H-EOCM.
- Очистите образец промывочным буфером комнатной температуры (PBS, содержащим 1×Anti-Anti и 0,15 мМ HEPES) в центрифужных пробирках объемом 5 мл три раза.
- Посев органоидов
- Определите плотность клеток, затем приготовьте свежую центрифужную пробирку объемом 1,5 мл с 5 000-15 000 клеток в суспензии.
- Центрифуга в течение 5 мин при 400 x g при 4 °C. Осторожно отсасывайте надосадочную жидкость. Мягко ресуспендируйте клетки в 50-100 мкл матрицы базальной мембраны равномерно.
ПРИМЕЧАНИЕ: Храните матрицу базальной мембраны при температуре 4 °C, чтобы избежать затвердевания. - Добавьте 50 мкл матрицы базальной мембраны со смешанными ячейками в центр каждого 24-луночного планшета. Полимеризовать матрикс базальной мембраны путем инкубации при температуре 37 °C (продолжительность 30 минут).
- Добавьте 500 мкл предварительно нагретого H-EOCM (37 °C), чтобы покрыть матрицу базальной мембраны. Культивируйте органоиды в увлажненном инкубаторе с 5% содержаниемCO2 при 37 °C.
- Замена среды
- Отсадите отработанную среду и пополните 500 мкл свежего H-EOCM (подогретого до 37 °C).
ПРИМЕЧАНИЕ: Заменяйте H-EOCM с интервалом в 3 дня.
- Отсадите отработанную среду и пополните 500 мкл свежего H-EOCM (подогретого до 37 °C).
3. Пассажирование органоидов
- Подготовка материалов
- Разморозьте матрицу базальной мембраны и H-EOCM при 4 °C. Предварительно охладите наконечники пипеток до 4 °C. Предварительно прогрейте 24-луночный планшет до 37 °C.
- Расщепление органоидов
- Аккуратно удалите среду H-EOCM. Добавьте 500 мкл предварительно охлажденного пассажного буфера (Advanced DMEM/F12, содержащий 1× Anti-Anti и 0,15 мМ HEPES, предварительно охлажденный до 4 °C) в лунку для расплавления матрицы базальной мембраны.
- Соедините матрицу базальной мембраны с буфером для прохода в центрифужной пробирке объемом 1,5 мл. Промойте лунку 500 мкл предварительно охлажденного проходного буфера и соберите буфер для извлечения оставшихся органоидов.
- Центрифугируйте буфер в течение 5 минут при 400 x g при 4 °C. Осторожно отсасывайте надосадочную жидкость. Добавьте в пробирку 500 μл рекомбинантного трипсина и инкубируйте для ферментативного пищеварения (37 °C, 15 минут). Возобновляйте работу с интервалом в 5 минут.
- Центрифугируйте переваренный образец (400 x g, 5 мин, 4 °C). Выбросьте надосадочную жидкость. Повторите шаги 3.2.6 и 3.2.7. Ресуспендируйте клетки в 100 мкл H-EOCM.
- Посев органоидов
- Для посева органоидов повторите шаг 2.3.
4. Замораживание и восстановление органоидов
- Замораживание органоидов
- Для подготовки материалов повторите шаг 2.1.
- Для усвоения органоидов повторите шаг 3.2.
- Замораживание органоидов
- Определите плотность клеток, затем приготовьте свежую центрифужную пробирку объемом 1,5 мл с 10 000 клеток в суспензии.
- Центрифугируйте образцы при давлении 400 x g в течение 5 мин при RT. Тщательно отаскайте надосадочную жидкость.
- Ресуспендируйте клетки 500-1000 μл криоконсервирующей среды. Переложите в новую криопробирку. Заморозьте криопробирку при температуре -80 °C на 24 часа. Архив в системе хранения жидкого азота для длительного хранения.
- Размораживание замерзающего органоида
- Для подготовки материалов повторите шаг 2.1.
- Размораживание замерзающего органоида
- Быстро разморозьте криопробирку на водяной бане при температуре 37 °C в течение 2-3 минут. Перенесите замороженный материал в 9 мл предварительно подогретой базальной культуры (37 °C) и равномерно суспендируйте клетки.
- Центрифугируйте клеточную суспензию в течение 5 мин при 400 x g (при RT). Осторожно отсасывайте надосадочную жидкость.
- Посев органоидов
- Для посева органоидов повторите шаг 2.3.
5. Гистологический анализ органоида
- Подготовка срезов с парафином
- Подготовка материалов
- Стерилизуйте 50 мл закладочной матрицы (водный раствор: 2% агар + 2,5% желатин) в колбе объемом 250 мл с помощью автоклава. Распределите 5 мл в центрифужные пробирки объемом 15 мл. Хранить при комнатной температуре.
- Крепление органоида
- Повторите шаги 3.2.1-3.2.2. Ресуспендируйте осадок с 1 мл пассажного буфера в свежей пробирке объемом 1,5 мл.
- Центрифуга при 400 x g при 4 °C в течение 5 мин. Удалите надосадочную жидкость. Ресуспендируйте органоиды в 500 мкл 4% параформальдегида (PFA). Инкубировать при комнатной температуре в течение 1 ч или при 4 °C в течение не менее 6 ч.
- Встраивание органоидов
- Центрифугируйте смесь (400 х г, 5 мин, RT). Удалите надосадочную жидкость. Добавьте 1 мл проходного буфера в пробирку и повторно суспендируйте осадок.
- Центрифугируйте смесь (400 х г, 5 мин, RT). Удалите надосадочную жидкость.
- Поместите одну пробирку (15 мл) со средой для наращивания (5 мл) в водяную баню (емкость 100 мл, 150 мл). Разогревайте в микроволновой печи на максимальной мощности, пока вода не закипит.
ПРИМЕЧАНИЕ: Перед подключением в микроволновой печи открутите колпачок пробирки объемом 15 мл. - Ресуспендируйте органоиды 50 мкл геля для встраивания в центрифужную пробирку объемом 1,5 мл. Охладите тюбик до 4 °C до полного затвердевания геля.
- Переведите застывший гель в 70% этанол. Хранить при температуре 4 °C.
- Подготовка парафинового блока
- Обезвоживайте гель с помощью этанола (30% → 50% → 70% → 80% → 95% → 100%), 30 мин на концентрацию.
- Поместите застывший гель в прозрачный ксилол на 30 минут. Погрузите застывший гель в парафин и заделайте его с помощью нагретой парафиновой станции.
- Нарежьте микротомом ломтики толщиной 4 мкм. Установите на предметные стекла и высушите при температуре 65 °C в течение 1 часа. Хранить в сухих условиях.
- Подготовка материалов
- Иммуногистохимическое (ИГХ) окрашивание срезов органоидов
- Депарафинизация и увлажнение
- Нагрейте ломтики в очищающем средстве при температуре 65 °C в течение 40 минут. Погрузите предметное стекло в свежее средство для очищения тканей при комнатной температуре на 20 минут.
- Проведите слайды через стеклянные лотки, содержащие этанол серии: погрузите в 100% этанол на 10 минут и повторите один раз, затем переложите на 95% этанол на 5 минут, затем на 85% этанол на 5 минут, затем на 75% этанол на 5 минут и, наконец, поместите в 4% PFA на 10 минут.
- Добавьте стерилизованную воду в термостабильную камеру и выдержите 5 минут на шейкере при 80 оборотах в минуту. Повторите этот шаг дважды.
- Забор антигена
- Добавьте раствор для извлечения антигена Tris-EDTA (pH 9,0) в термостабильную камеру для погружения предметных стекол. Разогрейте термостабильную камеру, содержащую предметные стекла, в микроволновой печи с максимальной интенсивностью (700 Вт, 3 мин) до закипания. Держите микроволновую печь на низком энергопотреблении (70 Вт, 15 минут) и охладите до комнатной температуры.
- Постирать в дистиллированной воде в течение 2 мин на шейкере при 80 оборотах в минуту. Повторите дважды. Обведите расположение органоидов гистологической ручкой.
- Блокирование пероксидазы
- Капните раствор, блокирующий пероксидазу, чтобы покрыть область образца. Выдерживать в камере влажности при комнатной температуре в течение 20 мин.
- Перенесите предметные стекла в термостабильную камеру. Стирать в PBST (PBS + 0,1% Tween 20) в течение 2 мин при 80 об/мин. Повторите дважды.
- Первичная инкубация антител
- Аккуратно сотрите лишние капли PBST на предметных стеклах.
ПРИМЕЧАНИЕ: Избегайте прикосновения к органоидам на предметных стеклах. - Капните разведенное первичное антитело, чтобы покрыть органоидную область. Выдерживать в камере с влажностью в течение 2 ч при комнатной температуре или 8-14 ч при 4 °C. Повторите этот шаг.
- Аккуратно сотрите лишние капли PBST на предметных стеклах.
- Вторичная инкубация антител
- Повторите шаг 5.2.4.1. Капните разведенное вторичное антитело HRP, чтобы покрыть органоидную область. Выдерживать в камере влажности при комнатной температуре в течение 20 мин. Повторите этот шаг.
- Окрашивание DAB (3,3'-диаминобензидин)
- Повторите шаг 5.2.4.1. Капните 1× DAB, чтобы покрыть область органоида. Выдерживайте в влажностной камере при комнатной температуре до тех пор, пока цвет не станет коричневым.
- Погрузите предметные стекла в дистиллированную воду на 5-10 секунд, чтобы прекратить изменение цвета. Повторите этот шаг.
- Окрашивание гематоксилином
- Окрашивать в гематоксилин в течение 5-8 мин. Дифференцировать в 1% кислотном спирте (1% HCl в 70% спирте) в течение 5-10 с.
- Погрузите горки в дистиллированную воду на 5-10 с. Повторите этот шаг.
- Обезвоживание
- Проведите предметные стекла через стеклянные лотки в последовательном порядке: погрузите в 75% этанол на 5 минут, переложите на 85% этанол на 5 минут, перейдите на 95% этанол на 5 минут, затем дважды погрузите в 100% этанол на 10 минут каждое, и, наконец, поместите в ксилол на два последовательных периода по 20 минут.
- Скользящее крепление
- Добавьте ксилол в нейтральную камедь до тех пор, пока она не станет прозрачной. Слегка подсушите на воздухе. Затем капните камедь с ксилолом, чтобы покрыть органоидную область.
- Наклейте защитный лист. Отсканируйте и проанализируйте предметное стекло.
- Депарафинизация и увлажнение
- Мультиплексное иммунофлюоресцентное (мИФ) окрашивание
- Для депарафинизации и увлажнения повторите шаг 5.2.1.
- Для блокирования пероксидазы повторите шаг 5.2.3.
- Для извлечения антигена повторите шаг 5.2.3.
- Блокирование сыворотки крови овец.
- Повторите шаг 5.2.4.1. Добавьте раствор, блокирующий овечью сыворотку, чтобы покрыть органоидную область. Выдерживать в камере влажности при комнатной температуре в течение 30 мин.
- Стирать в PBST в течение 2 мин. Повторить дважды.
- Для первичной инкубации антител повторите шаг 5.2.4.
- Для инкубации вторичных антител повторите шаг 5.2.4.1.
- Капните раствор специфического вторичного антитела, чтобы покрыть область органоида. Выдерживать в камере влажности при комнатной температуре в течение 20 мин. Повторите шаг 5.2.3.2.
ПРИМЕЧАНИЕ: Защищайте слайды от света с этого шага до конца эксперимента.
- Капните раствор специфического вторичного антитела, чтобы покрыть область органоида. Выдерживать в камере влажности при комнатной температуре в течение 20 мин. Повторите шаг 5.2.3.2.
- Окрашивание флуоресцентными красителями
- Повторите шаг 5.3.4.1. Капните раствор флуоресцентного красителя, чтобы покрыть область органоида.
- Выдерживать в камере влажности при комнатной температуре в течение 10-20 мин. Повторите шаг 5.2.3.2.
- Для многократного окрашивания повторите шаги 5.3.3-5.3.7.
- Окрашивание DAPI
- Повторите шаг 5.2.4.1. Капните раствор DAPI, чтобы покрыть органоидную область. Повторите шаг 5.2.3.2. Далее повторите шаг 5.3.4.2.
- Погрузите предметные стекла в стерилизованную воду на 2 минуты.
- Скользящее крепление
- Капните монтажную среду с защитой от выцветания, чтобы покрыть область органоида. Наклейте защитный лист.
- Получайте цифровые изображения с помощью сканера слайдов и анализируйте их.
Результаты
Этот протокол описывает забор органоидов и гистологический анализ на разных этапах онкогенеза ESCC (рис. 1). Путем взятия образцов нормальной слизистой оболочки пищевода, низкодифференцированной интраэпителиальной неоплазии (LGIN), высокодифференцированной интраэпителиальной неоплазии (HGIN) и опухолевых тканей у пациентов с ESCC можно сконструировать органоиды, представляющие различные стадии онкогенеза. Кроме того, проводили встраивание парафина и срезы этих органоидов с последующим иммунофлуоресцентным окрашиванием.
Для изучения экспрессии иммуносупрессивных молекул и морфологических характеристик клеточных клонов в процессе онкогенеза были собраны эпителиальные ткани пищевода с различных стадий развития опухоли и проведено иммунофлуоресцентное окрашивание. После завершения окрашивания перед сканированием слайдов были определены четыре псевдоцвета для маркеров. PD-L1, Ki-67 и KRT6A были присвоены псевдоцвета зеленого, красного и серого цветов соответственно, в то время как ядра клеток были помечены DAPI. Экспериментальные результаты показали, что морфология органоидов слизистой оболочки пищевода изменялась в процессе онкогенеза, в первую очередь становясь более дезорганизованной. Иммунофлуоресцентное окрашивание показало, что по мере прогрессирования онкогенеза пролиферация эпителиальных клеток изменялась, что сопровождалось повышенной экспрессией иммуносупрессивных молекул, таких как PD-L1 (рис. 2).
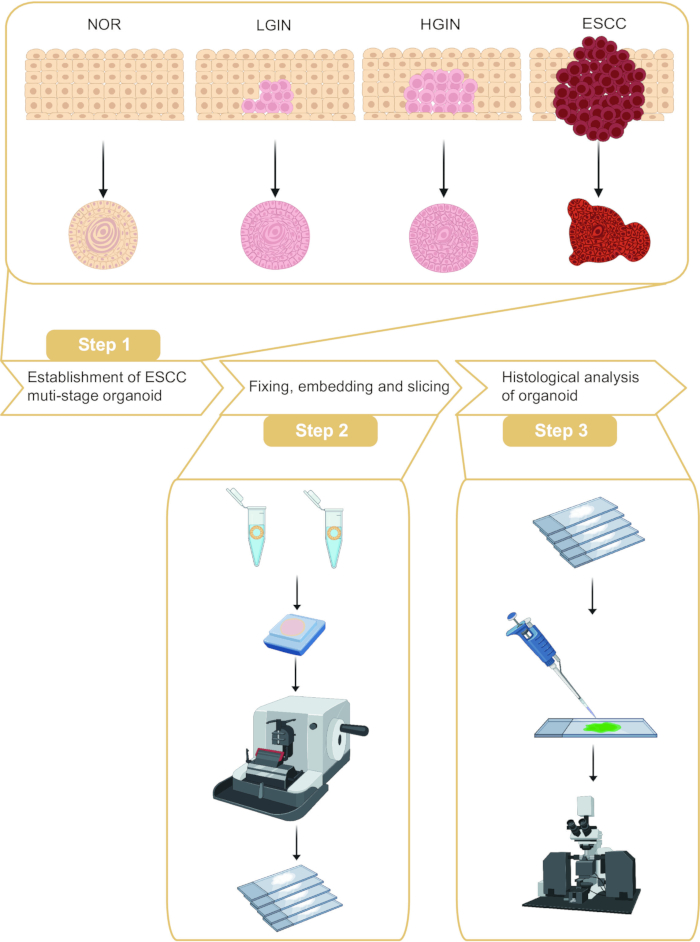
Рисунок 1: Процесс установления и гистологического анализа органоидов многоступенчатой плоскоклеточной карциномы пищевода (ESCC). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
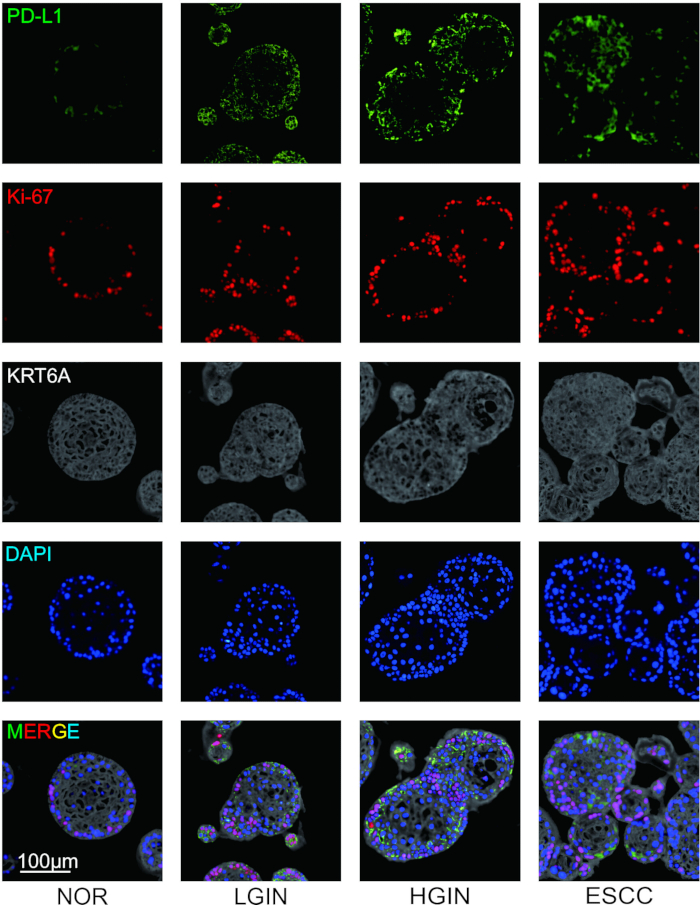
Рисунок 2: Мультиплексное иммунофлуоресцентное (мИФ) окрашивание многоступенчатого органоида ESCC. Репрезентативные изображения, показывающие экспрессию PD-L1 (зеленый), Ki-67 (красный) и KRT6A (серый). Масштабные линейки = 100 мкм. NOR, нормальная слизистая оболочка; LGIN, интраэпителиальная неоплазия низкой степени злокачественности; LGIN, интраэпителиальная неоплазия высокой степени злокачественности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Установление и гистологический анализ органоидов представляют собой значительный прогресс в моделировании прогрессирования опухоли. Протокол имеет заметные преимущества по сравнению с существующими методами изучения онкогенеза20. В отличие от традиционных систем двумерных клеточных культур, органоиды сохраняют сложную трехмерную архитектуру и клеточную гетерогенность, которые лучше отражают условия in vivo. По сравнению с животными моделями, органоиды, полученные из тканей человека, более точно отражают характеристики болезни человека 9,21,22. Включение мультиплексного иммунофлуоресцентного окрашивания позволяет одновременно визуализировать несколько маркеров, обеспечивая понимание пространственных отношений между ключевыми молекулами и архитектурой тканей во время эволюции опухоли. Используя этот передовой протокол, это исследование выявило значительные динамические изменения в плоскоклеточном раке пищевода, в частности, продемонстрировав, что уровни пролиферации опухолевых клеток прогрессивно смещались во время развития опухоли, сопровождаясь соответствующими изменениями в экспрессии иммуносупрессивной молекулы PD-L1.
Этот протокол представляет собой комплексную методологию исследования морфологических и молекулярных изменений во время онкогенеза, при этом несколько важнейших этапов требуют особого внимания. Время переваривания во время обработки тканей необходимо тщательно контролировать, так как переваривание может привести к чрезмерной гибели клеток, в то время как недостаточное переваривание приводит к плохой изоляции клеток. Кроме того, решающее значение имеет контроль температуры при работе с базальной мембраной - матрица должна поддерживаться при температуре 4 °C, чтобы предотвратить преждевременную полимеризацию и сохранить жизнеспособность клеток.
Тем не менее, следует признать некоторые ограничения метода. Отсутствие иммунных компонентов и стромальных клеток в основной системе органоидных культур может не полностью воспроизводить взаимодействия опухоли и микроокружения23,24. Это ограничение может быть частично устранено с помощью систем совместной культуры, хотя такие модификации требуют тщательной оптимизации. Наконец, размораживание органоидов также является важным вопросом. Согласно предыдущему опыту, процент успешности размораживания замороженных органоидов невысок. Поэтому пользователям рекомендуется замораживать органоиды с осторожностью.
Клинические последствия этого протокола существенны, особенно в том, что касается возможности моделирования многоступенчатого прогрессирования от NOR через LGIN и HGIN к инвазивной карциноме6. Органоиды, полученные от пациентов, полученные с использованием этой методологии, служат ценными инструментами для исследований и персонализированной медицины, позволяя идентифицировать молекулярные маркеры, связанные с прогрессированием заболевания25,26.
Этот протокол может быть адаптирован для различных применений в исследованиях рака и разработке лекарств. Методология может быть расширена для изучения других эпителиальных раковых опухолей и модифицирована для включения дополнительных методов анализа, таких как секвенирование одиночных клеток 27,28. Кроме того, будущие адаптации могут включать полученные от пациента ассоциированные с раком фибробласты и иммунные клетки для моделирования взаимодействий опухоли, стромы и иммунитета или интегрировать редактирование CRISPR для исследования генетических драйверов, расширяя его полезность в трансляционных исследованияхи прогнозировании ответа на терапию.
Этот протокол знакомит с методами конструирования и замораживания органоидов из различных стадий онкогенеза ESCC. Что еще более важно, в этой статье описаны методы встраивания, секционирования, окрашивания IHC и mIF для органоидов. Мы считаем, что эти методы встраивания, нарезки и окрашивания органоидов могут быть применены к методам окрашивания органоидами нескольких источников органов, включая пищевод. Этот подход также может помочь исследователям наблюдать за взаимосвязью между соответствующей молекулярной экспрессией и пространственной структурой.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых конфликтов или конфликтов интересов.
Благодарности
Авторы благодарят всех пациентов и врачей, участвующих в исследованиях в Онкологической больнице, Китайской академии медицинских наук (CAMS) и Пекинском объединенном медицинском колледже (PUMC). Это исследование финансируется Национальным фондом естественных наук Китая (82203156 to S.Z.), Национальной программой ключевых исследований и разработок Китая (2023YFC3503200 to S.Z.) и Инновационным фондом медицинских наук Китайской академии медицинских наук в области медицинских наук (2023-I2M-QJ-002 to S.Z.). Рисунок 1 создан с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Merck | Cat#SLGPR33RB | |
| 24-well plate | Corning | Cat#3524 | |
| 4% Paraformaldehyde | Beyotime | Cat# P0099 | |
| 70 μm sterile strainer | Falcon | Cat#352350 | |
| A83-01 | Tocris Bioscience | Cat# 2939 | |
| Advanced DMEM/F12 | Gibco | Cat# 12634028 | |
| Agar | Solarbio | Cat# A8190 | |
| Anti-Anti (Antibiotic-Antimycotic) | Gibco | Cat# 15240062 | |
| B-27 supplement | Gibco | Cat# 17504044 | |
| CO2 incubator | Thermo | Cat#371GPCN | |
| Collagenase IV | Gibco | Cat# 17104019 | |
| Cryostor | STEMCELL | Cat# 07930 | |
| DMEM | Corning | Cat# 10-013-CV | |
| EGF | Gibco | Cat# PHG0313 | |
| Fetal bovine serum | Cell Technologies | Cat# 30070 | |
| G-418 | Sigma | Cat# A1720 | |
| Gelatin | Solarbio | Cat# G8061 | |
| GlutaMAX | Gibco | Cat# 35050061 | |
| Growth factor-reduced Matrigel | Corning | Cat# 354230 | |
| HE staining kit | Beijing Yili Fine Chemicals Co., Ltd | NA | |
| HEPES | Gibco | Cat# 15630080 | |
| Histological pen | Zsbio | Cat#ZLI-9305 | |
| Hygromycin B | Sigma | Cat# 400050 | |
| Immunohistochemical staining kit | ZSGB-BIO | PV-8000 | |
| L-WRN | ATCC | CRL-3276; RRID:CVCL_DA06 | |
| N-2 supplement | Gibco | Cat# 17502048 | |
| Neutral gum | Zsbio | Cat#ZLI-9555 | |
| Opal 5-Color Manual IHC Kit | PANOVUE | Cat# 10144100100 | |
| PBS | MeilunBio | Cat#MA0015 | |
| Rabbit Monoclone anti-PD-L1 | CST | Cat# 13684; RRID:AB_2687655 | |
| Rabbit Polyclonal anti-Ki67 | Abcam | Cat# ab16667; RRID:AB_302459 | |
| Rabbit Polyclonal anti-KRT6A | Proteintech | Cat# 10590-1-AP; RRID: AB_2134306 | |
| Sheep serum | Zsbio | Cat#ZLI-9056 | |
| TrypLE Express | Gibco | Cat# 12604021 | |
| TrypLE-EDTA | Gibco | Cat#15400-054 | |
| Whole slide image scanner | Hamamatsu | Cat#C13210 | |
| Y-27632 | Selleck Chemicals | Cat# S1049 |
Ссылки
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены