Method Article
Estabelecimento e Análise Histológica de Organoides Esofágicos Modelando a Progressão de Tecidos Normais para Cancerosos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O presente protocolo descreve o estabelecimento e a análise histológica de modelos organoides esofágicos que representam diferentes estágios da progressão tumoral. Este método permite que os pesquisadores estudem mudanças na morfologia celular, organização espacial e padrões de expressão de marcadores moleculares durante a transição de tecidos normais para cancerígenos.
Resumo
Os organoides surgiram como uma ferramenta fundamental para avançar na compreensão da tumorigênese e da terapia do câncer. Ao gerar modelos organoides humanos representando diferentes estágios do tumor e realizar análises histológicas, é possível obter uma compreensão mais profunda das alterações na morfologia celular, arquitetura espacial e expressão de marcadores moleculares importantes à medida que o tumor progride. Este estudo apresenta um protocolo abrangente para o estabelecimento e cultura de organoides de células escamosas esofágicas. Além disso, o protocolo descreve métodos para avaliar os padrões de expressão e organização espacial de moléculas críticas dentro dos organoides, utilizando técnicas como fixação, incorporação e coloração. Por meio desse protocolo, foram identificadas alterações significativas na estrutura espacial das células epiteliais escamosas do esôfago e na expressão de vários biomarcadores tumorais durante a tumorigênese. O protocolo facilita a construção e análise histológica de organoides, permitindo aos pesquisadores investigar a arquitetura espacial e as alterações moleculares das células epiteliais em diferentes estágios de tumorigênese e intervenção terapêutica.
Introdução
A tumorigênese é um processo complexo, de múltiplos estágios, caracterizado por alterações moleculares e morfológicas progressivas nas células 1,2. O carcinoma espinocelular de esôfago (CEC), uma neoplasia maligna prevalente com mau prognóstico 3,4, exemplifica essa progressão gradual através de quatro estágios distintos: mucosa normal, neoplasia intraepitelial de baixo grau (LGIN), neoplasia intraepitelial de alto grau (HGIN) e carcinoma invasivo5. Ao longo desses estágios, as células epiteliais exibem mudanças dinâmicas nos padrões de expressão molecular e na organização espacial, acompanhadas por alterações sistemáticas na morfologia do tecido à medida que avança de um estado normal para um maligno 6,7. Apesar dos avanços na compreensão da patogênese do CEC, a falta de modelos experimentais que recapitulem fielmente os aspectos espaciais e temporais da evolução do tumor - ao mesmo tempo em que permitem análises histológicas e moleculares sistemáticas - tem dificultado uma compreensão mecanicista mais profunda da progressão da doença e do desenvolvimento terapêutico.
Embora as linhagens de células cancerígenas imortalizadas 2D tenham feito contribuições significativas para a compreensão da oncogênese, elas são inerentemente limitadas na replicação da complexidade biológica e das características patológicas dos tumores nativos8. Os modelos animais, embora forneçam contexto in vivo, muitas vezes preveem mal as respostas humanas devido a diferenças específicas da espécie9. Em contraste, os organoides surgiram como uma plataforma pré-clínica transformadora que preserva fielmente a heterogeneidade celular, a arquitetura e a funcionalidade dos tecidos humanos 10,11,12,13. Como modelos pré-clínicos, os organoides capturam melhor as características dos tumores primários, permitindo a investigação detalhada dos principais eventos moleculares e alterações celulares durante a progressão do tumor14. Por exemplo, Chen et al. utilizaram organoides esofágicos derivados de pacientes de diferentes estágios de ESCC para elucidar as interações epitelial-fibroblastos, validando o eixo de sinalização ANXA1-FPR2 como um fator crítico da patogênese do ESCC6. Da mesma forma, Ko et al. empregaram organoides esofágicos geneticamente modificados para identificar os principais determinantes genéticos que impulsionam a iniciação do CEC e a evasão imunológica, demonstrando como os modelos organoides podem efetivamente recapitular as características da doença e revelar novos alvos terapêuticos15.
A presente metodologia resolve questões significativas na modelagem do câncer de esôfago, estabelecendo um protocolo reprodutível para gerar organoides ESCC de múltiplos estágios que espelham a progressão histológica do epitélio normal para o carcinoma invasivo. Este sistema integra condições de cultura otimizadas usando um meio condicionado por L-WRN para manter a estaminalidade epitelial, combinado com protocolos padronizados para processamento histológico e análise de imunofluorescência multiplex (mIF), fornecendo uma plataforma ideal para analisar longitudinalmente as mudanças espaciais e moleculares durante a tumorigênese. Em comparação com técnicas alternativas, como culturas 2D, essa plataforma organoide preserva exclusivamente a arquitetura do tecido, permitindo a visualização de marcadores moleculares espacialmente organizados, incluindo a proteína de checkpoint imunológico PD-L1 (CD274), que medeia a evasão imune do tumor inibindo as respostas das células T16 , 17 , 18, e o marcador de proliferação Ki-67. O protocolo permite a passagem de organoides de tecidos esofágicos normais e pré-cancerosos, ajudando os pesquisadores a construir um modelo organoide contínuo do tecido normal para o tumor19. Ao permitir uma análise detalhada das mudanças espaciais e moleculares durante a tumorigênese, este protocolo oferece aos pesquisadores uma ferramenta poderosa para entender os mecanismos subjacentes ao desenvolvimento e progressão do câncer, potencialmente levando a melhores estratégias terapêuticas.
Essa metodologia é particularmente adequada para pesquisadores que investigam carcinogênese epitelial, interações com microambientes tumorais ou respostas terapêuticas em CEC e neoplasias escamosas relacionadas. Seu design modular permite a adaptação para estudar outros marcadores moleculares ou vias de sinalização, desde que sejam incorporadas etapas de validação apropriadas. Ao oferecer uma plataforma padronizada e flexível, este protocolo visa avançar a pesquisa pré-clínica em biologia tumoral e acelerar a tradução de insights mecanicistas em terapias direcionadas.
Protocolo
Este estudo foi aprovado pelo Conselho de Revisão Institucional do Hospital do Câncer da Academia Chinesa de Ciências Médicas (Aprovação nº 20/069–2265, 22/221-3423 e 23/305-4047). Amostras de tecido esofágico foram obtidas de pacientes submetidos a cirurgia ou triagem precoce para carcinoma de células escamosas de esôfago (ESCC) no Hospital do Câncer, Academia Chinesa de Ciências Médicas entre 2021 e 2024, com o objetivo de estabelecer organoides esofágicos humanos. Nenhum dos pacientes incluídos neste estudo havia recebido quimioterapia ou radioterapia antes da coleta da amostra. O consentimento informado foi obtido de todos os participantes e informações clínicas relevantes foram recuperadas dos prontuários médicos. Uma lista completa de reagentes e equipamentos usados neste estudo é fornecida na Tabela de Materiais.
1. Preparação de organoides epiteliais esofágicos
- Preparação de meio condicionado com L-WRN
- Preparação da linhagem celular L-WRN
- Descongelar a linhagem celular L-WRN (armazenamento a -80 °C) em banho-maria a 37 °C durante 1-2 min. Misture com 5 mL de meio de cultura basal pré-aquecido (DMEM suplementado com 10% de FBS).
- Centrifugue a mistura a 200 x g por 5 min em temperatura ambiente (RT).
- Descarte o sobrenadante. Ressuspenda as células com 2-3 mL de meio de seleção fresco pré-aquecido (DMEM contendo 10% de FBS, 0,5 mg / mL de higromicina B e 0,5 mg / mL de G-418).
NOTA: Mantenha o meio a 4 °C (armazenamento máximo de 1 mês). - Transferir as células para uma placa de cultura de 10 cm contendo o meio de selecção. Cultivar as células a 37 °C numa incubadora humidificada com 5% de CO2 .
- Passagem da linhagem celular L-WRN
- Dissocie as células confluentes usando tripsina-EDTA a 0,025% (1-2 min a 37 ° C) e divida na proporção de 1: 2.
- Coleta do meio condicionado L-WRN
- Substitua o meio de cultura por meio de cultura basal a 80% de confluência celular. Transferir o sobrenadante para um tubo de centrifugação.
- Filtre através da membrana de 0,22 μm para eliminar os detritos celulares. Colete o filtrado como um meio condicionado por L-WRN.
NOTA: Mantenha o meio condicionado com L-WRN a 4 ° C (1 semana) ou a -80 ° C (6 meses).
- Preparação da linhagem celular L-WRN
- Preparação de meio de cultura organoide esofágico humano (H-EOCM)
- Preparação do H-EOCM
- Vórtice o meio condicionado por L-WRN (volume de 1,5 mL) após 4 h de equilíbrio a 4 ° C.
- Combine o meio DMEM/F12 avançado com estes aditivos para criar H-EOCM: meio condicionado a 3% de L-WRN, 1× Anti-Anti, 1× L-glutamina, 1× suplemento de N2, 1× suplemento de B27, 0,15 mM HEPES, 40 ng/mL EGF, 10 μM Y-27632 e 50 μM A83-01.
NOTA: Mantenha o armazenamento congelado de H-EOCM a -20 ° C para preservação de seis meses.
- Preparação do H-EOCM
- Preparação pré-experimental
- Descongele o H-EOCM mantendo-o a 4 °C durante 4 h.
2. Estabelecimento do organoide esofágico humano
- Preparação de materiais
- Descongelar a matriz da membrana basal e o H-EOCM a 4 °C. Esterilize tesouras e pinças cirúrgicas para o próximo experimento.
- Pré-arrefecer as ponteiras da pipeta a 4 °C. Pré-aqueça a placa de 24 poços a 37 °C.
- Processamento de tecidos e isolamento celular
NOTA: Tecido tumoral ESCC, lesões displásicas (≤2 cm da margem do tumor) e tecido esofágico normal compatível (≥5 cm da margem do tumor) foram coletados dos mesmos indivíduos com ESC submetidos à ressecção cirúrgica. Além disso, amostras esofágicas em múltiplos estágios foram obtidas por meio de um programa de detecção precoce e triagem de ESCC, conforme descrito em nossos estudos anteriores 6,7.- Limpe a amostra com tampão de lavagem à temperatura ambiente (PBS contendo 1×Anti-Anti e HEPES 0,15 mM) em tubos de centrífuga de 5 mL três vezes.
NOTA: Lave as amostras mais de três vezes para reduzir o risco de contaminação. - Pique o tecido em fragmentos de 1 mm3 usando uma tesoura estéril. Transfira os fragmentos para tubos de centrífuga de 1,5 mL.
- Suspenda a amostra com 1 mL de tampão de digestão e agite-a a 37 °C, 50-100 rpm, por 10-20 min para digerir o tecido.
- Centrifugue a mistura a 400 x g durante 5 min a 4 °C. Descarte o sobrenadante.
- Ressuspenda o precipitado em 500 μL de tripsina-EDTA a 0,025%. Incubar a 37 °C durante 10 min. Adicione 1 mL de DMEM suplementado com 10% de FBS para interromper a atividade enzimática.
- Passe a suspensão por um filtro estéril de 70 μm. Recolha o filtrado num tubo de centrifugação de 1,5 ml.
- Centrifugar o filtrado durante 5 min a 400 x g a 4 °C. Descarte o sobrenadante. Ressuspenda as células com 100 μL de H-EOCM.
- Limpe a amostra com tampão de lavagem à temperatura ambiente (PBS contendo 1×Anti-Anti e HEPES 0,15 mM) em tubos de centrífuga de 5 mL três vezes.
- Semeadura de organoides
- Determine a densidade celular e, em seguida, prepare um novo tubo de centrífuga de 1,5 mL com 5.000-15.000 células em suspensão.
- Centrifugue por 5 min a 400 x g a 4 °C. Aspirar cuidadosamente o sobrenadante. Ressuspenda suavemente as células em 50-100 μL de matriz da membrana basal uniformemente.
NOTA: Armazene a matriz da membrana basal a 4 °C para evitar solidificação. - Adicione 50 μL de matriz de membrana basal com as células mistas ao centro de cada placa de 24 poços. Polimerizar a matriz da membrana basal através de incubação a 37 °C (duração de 30 min).
- Adicione 500 μL de H-EOCM pré-aquecido (37 °C) para cobrir a matriz da membrana basal. Cultivar os organoides em uma incubadora umidificada de CO5% 2 a 37 °C.
- Substituição de mídia
- Aspirar o meio gasto e reabastecer com 500 μl de H-EOCM fresco (aquecido a 37 °C).
NOTA: Substitua o H-EOCM em intervalos de 3 dias.
- Aspirar o meio gasto e reabastecer com 500 μl de H-EOCM fresco (aquecido a 37 °C).
3. Passagem de organoides
- Preparação de materiais
- Descongelar a matriz da membrana basal e o H-EOCM a 4 °C. Pré-arrefecer as ponteiras da pipeta a 4 °C. Pré-aqueça a placa de 24 poços a 37 °C.
- Digestão de organoides
- Remova o meio H-EOCM com cuidado. Adicione 500 μL de tampão de passagem pré-resfriado (DMEM/F12 avançado contendo 1× Anti-Anti e HEPES 0,15 mM, pré-resfriado a 4 °C) no poço para derreter a matriz da membrana basal.
- Combine a matriz da membrana basal com o tampão de passagem em um tubo de centrífuga de 1,5 mL. Lave o poço com 500 μL de tampão de passagem pré-resfriado e colete o tampão para recuperar quaisquer organoides restantes.
- Centrifugue o tampão durante 5 min a 400 x g a 4 °C. Aspirar suavemente o sobrenadante. Adicione 500 μL de tripsina recombinante no tubo e incube para digestão enzimática (37 °C, 15 min). Ressuspenda em intervalos de 5 minutos.
- Centrifugar a amostra digerida (400 x g, 5 min, 4 °C). Descarte o sobrenadante. Repita as etapas 3.2.6 e 3.2.7. Ressuspenda as células em 100 μL de H-EOCM.
- Semeadura de organoides
- Para a semeadura de organoides, repita a etapa 2.3.
4. Congelamento e recuperação de organoides
- Congelamento de organoides
- Para a preparação dos materiais, repita o passo 2.1.
- Para a digestão dos organoides, repita a etapa 3.2.
- Congelamento de organoides
- Determine a densidade celular e, em seguida, prepare um novo tubo de centrífuga de 1,5 mL com 10.000 células em suspensão.
- Centrifugar as amostras a 400 x g durante 5 min a RT. Aspirar cuidadosamente o sobrenadante.
- Ressuspenda as células com 500-1000 μL de meio de criopreservação. Transfira para um novo criotubo. Congelar o criotubo a -80 °C durante 24 h. Arquivar em um sistema de armazenamento de nitrogênio líquido para preservação prolongada.
- Descongelamento de organoide de congelamento
- Para a preparação dos materiais, repita a etapa 2.1.
- Descongelamento de organoide de congelamento
- Descongele rapidamente o criotubo em banho-maria a 37 °C por 2-3 min. Transferir o material congelado para 9 ml de cultura basal pré-aquecida (37 °C) e ressuspender as células uniformemente.
- Centrifugar a suspensão da célula durante 5 min a 400 x g (à RT). Aspirar cuidadosamente o sobrenadante.
- Semeadura de organoides
- Para semear os organoides, repita a etapa 2.3.
5. Análise histológica do organoide
- Preparação de seções embebidas em parafina
- Preparação de materiais
- Esterilizar 50 mL de matriz de inclusão (solução aquosa: ágar 2% + gelatina 2,5%) em um frasco de 250 mL via autoclave. Alíquota de 5 mL em tubos de centrífuga de 15 mL. Armazene em temperatura ambiente.
- Fixação de organoides
- Repita as etapas 3.2.1-3.2.2. Ressuspenda o precipitado com 1 mL de tampão de passagem em um novo tubo de 1,5 mL.
- Centrifugue a 400 x g a 4 °C por 5 min. Remova o sobrenadante. Ressuspenda os organoides em 500 μL de paraformaldeído a 4% (PFA). Incubar à temperatura ambiente durante 1 h ou a 4 °C durante, pelo menos, 6 h.
- Incorporação de organoides
- Centrifugue a mistura (400 x g, 5 min, RT). Remova o sobrenadante. Adicione 1 mL do tampão de passagem no tubo e ressuspenda a precipitação.
- Centrifugue a mistura (400 x g, 5 min, RT). Remova o sobrenadante.
- Coloque um tubo (15 mL) com meio de inclusão (5 mL) no banho-maria (recipiente de 100 mL, 150 mL). Microondas na potência máxima até que a água comece a ferver.
NOTA: Desaperte a tampa do tubo de 15 mL antes de colocar no micro-ondas. - Ressuspenda os organoides com 50 μL de gel de inclusão em um tubo de centrífuga de 1,5 mL. Arrefecer o tubo a 4 °C até que o gel endureça completamente.
- Transfira o gel solidificado para etanol a 70%. Conservar a 4 °C.
- Preparação de blocos de parafina
- Desidratar o gel através de séries de etanol (30% → 50% → 70% → 80% → 95% → 100%), 30 min por concentração.
- Coloque o gel solidificado em xileno transparente por 30 min. Mergulhe o gel solidificado em parafina e incorpore-o usando uma estação de parafina aquecida.
- Corte fatias de 4 μm de espessura com um micrótomo. Montar em lâminas e secar a 65 °C durante 1 h. Armazene em condições secas.
- Preparação de materiais
- Coloração imuno-histoquímica (IHQ) de fatias organoides
- Desparafinação e hidratação
- Aqueça as fatias no agente de limpeza de tecidos a 65 °C por 40 min. Mergulhe a lâmina em agente de limpeza de tecido fresco à temperatura ambiente por 20 min.
- Processe as lâminas através de bandejas de vidro contendo séries de etanol: mergulhe em etanol 100% por 10 min e repita uma vez, depois transfira para etanol 95% por 5 min, seguido de etanol 85% por 5 min, depois etanol 75% por 5 min e, finalmente, coloque em PFA 4% por 10 min.
- Adicione água esterilizada à câmara termoestável e mantenha 5 min no agitador a 80 rpm. Repita esta etapa duas vezes.
- Recuperação de antígeno
- Adicione a solução de recuperação do antígeno Tris-EDTA (pH 9,0) à câmara termoestável para imergir as lâminas. Microondas a câmara termoestável contendo as lâminas na intensidade máxima (700 W, 3 min) até ferver. Mantenha o micro-ondas em baixa potência (70 W, 15 min) e resfrie até a temperatura ambiente.
- Lave em água destilada por 2 min em uma coqueteleira a 80 rpm. Repita duas vezes. Circule a localização dos organoides com uma caneta histológica.
- Bloqueio da peroxidase
- Eliminar a solução de bloqueio da peroxidase para cobrir a área da amostra. Incubar em câmara de humidade à temperatura ambiente durante 20 min.
- Transfira as lâminas para uma câmara termoestável. Lave em PBST (PBS + 0,1% Tween 20) por 2 min a 80 rpm. Repita duas vezes.
- Incubação primária de anticorpos
- Limpe suavemente o excesso de gotículas de PBST nas lâminas.
NOTA: Evite tocar em organoides em slides. - Eliminar o anticorpo primário diluído para cobrir a área organoide. Incubar numa câmara de humidade durante 2 h à temperatura ambiente ou 8-14 h a 4 °C. Repita esta etapa.
- Limpe suavemente o excesso de gotículas de PBST nas lâminas.
- Incubação secundária de anticorpos
- Repita a etapa 5.2.4.1. Eliminar o anticorpo secundário HRP diluído para cobrir a área organoide. Incubar em câmara de humidade à temperatura ambiente durante 20 min. Repita esta etapa.
- Coloração DAB (3,3′-Diaminobenzidina)
- Repita a etapa 5.2.4.1. Solte 1× DAB para cobrir a área do organoide. Incube em uma câmara de umidade em temperatura ambiente até que a cor fique marrom.
- Mergulhe as lâminas em água destilada por 5 a 10 s para encerrar a mudança de cor. Repita a etapa.
- Coloração de hematoxilina
- Manchar em hematoxilina por 5-8 min. Diferencie em álcool ácido a 1% (HCl a 1% em álcool a 70%) por 5-10 s.
- Mergulhe as lâminas em água destilada por 5-10 s. Repita esta etapa.
- Desidratação
- Processe as lâminas através de bandejas de vidro em ordem sequencial: mergulhe em etanol a 75% por 5 min, transfira para etanol a 85% por 5 min, passe para etanol a 95% por 5 min, seguido por duas imersões separadas em etanol a 100% por 10 min cada e, finalmente, coloque em xileno por dois períodos sucessivos de 20 min.
- Montagem deslizante
- Adicione xileno à goma neutra até que fique transparente. Seque ligeiramente ao ar. Em seguida, coloque chiclete com xileno para cobrir a área organoide.
- Aplique lamínula. Digitalize e analise o slide.
- Desparafinação e hidratação
- Coloração de imunofluorescência multiplex (mIF)
- Para desparafinação e hidratação, repita a etapa 5.2.1.
- Para bloqueio da peroxidase, repita a etapa 5.2.3.
- Para a recuperação do antigénio, repetir o passo 5.2.3.
- Bloqueio do soro de ovelha.
- Repita a etapa 5.2.4.1. Adicione solução de bloqueio de soro de ovelha para cobrir a área organoide. Incubar em câmara de umidade em temperatura ambiente por 30 min.
- Lave em PBST por 2 min. Repita duas vezes.
- Para a incubação primária de anticorpos, repetir o passo 5.2.4.
- Para incubação de anticorpos secundários, repita a etapa 5.2.4.1.
- Descarte a solução de anticorpo secundário específico para cobrir a área organoide. Incubar em câmara de humidade à temperatura ambiente durante 20 min. Repita a etapa 5.2.3.2.
NOTA: Proteja as lâminas da luz desta etapa até o final do experimento.
- Descarte a solução de anticorpo secundário específico para cobrir a área organoide. Incubar em câmara de humidade à temperatura ambiente durante 20 min. Repita a etapa 5.2.3.2.
- Coloração de corante fluorescente
- Repita a etapa 5.3.4.1. Solte a solução de corante fluorescente para cobrir a área organoide.
- Incubar em uma câmara de umidade em temperatura ambiente por 10-20 min. Repita a etapa 5.2.3.2.
- Para multicoloração, repita as etapas 5.3.3-5.3.7.
- Coloração DAPI
- Repita a etapa 5.2.4.1. Solte a solução DAPI para cobrir a área organoide. Repita a etapa 5.2.3.2. Em seguida, repita a etapa 5.3.4.2.
- Mergulhe as lâminas em água esterilizada por 2 min.
- Montagem deslizante
- Remova o meio de montagem antidesbotamento para cobrir a área organoide. Aplique lamínula.
- Adquira imagens digitais usando um scanner de slides e analise-as.
Resultados
Este protocolo descreve a amostragem de organoides e a análise histológica em diferentes estágios da tumorigênese do CEC (Figura 1). Ao coletar amostras de mucosa esofágica normal, neoplasia intraepitelial de baixo grau (LGIN), neoplasia intraepitelial de alto grau (HGIN) e tecidos tumorais de pacientes com ESCC, organoides representando diferentes estágios de tumorigênese podem ser construídos. Além disso, foi realizada a inclusão e seccionamento desses organoides em parafina, seguida de coloração por imunofluorescência.
Para investigar a expressão de moléculas imunossupressoras e as características morfológicas de clones celulares durante a tumorigênese, tecidos epiteliais esofágicos foram coletados de vários estágios de desenvolvimento tumoral e realizada coloração por imunofluorescência. Após a finalização da coloração, quatro pseudo-cores foram definidas para os marcadores antes da digitalização das lâminas. PD-L1, Ki-67 e KRT6A receberam pseudo-cores de verde, vermelho e cinza, respectivamente, enquanto os núcleos das células foram marcados com DAPI. Os resultados experimentais mostraram que a morfologia organoide da mucosa esofágica mudou durante a tumorigênese, tornando-se principalmente mais desorganizada. A coloração por imunofluorescência revelou que, à medida que a tumorigênese progredia, a proliferação de células epiteliais mudava, acompanhada por expressão elevada de moléculas imunossupressoras, como PD-L1 (Figura 2).
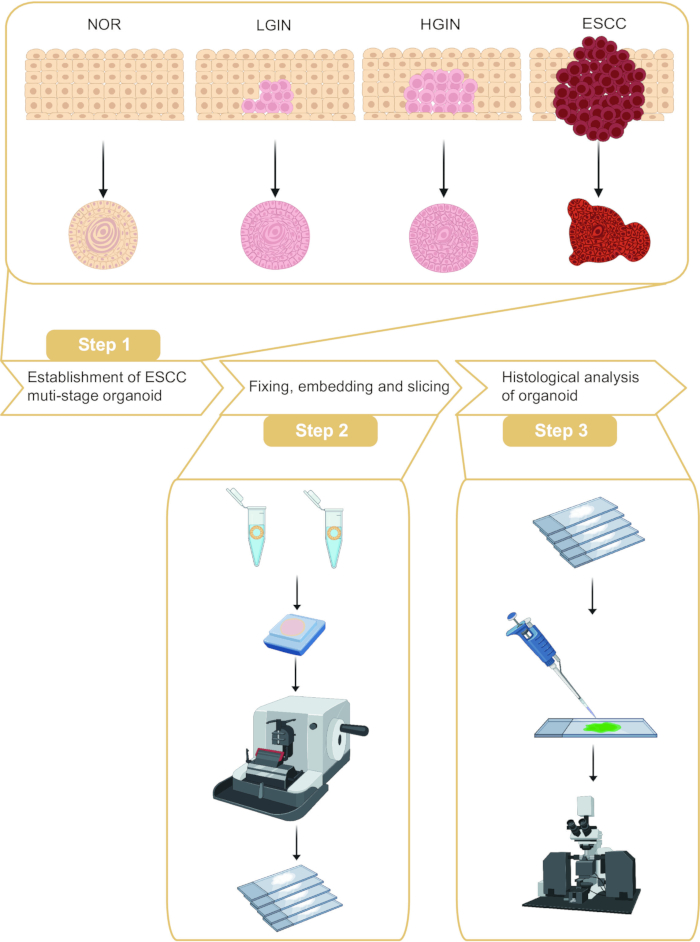
Figura 1: Fluxo de trabalho de estabelecimento e análise histológica de organoides de carcinoma de células escamosas de esôfago (ESCC) em múltiplos estágios. Clique aqui para ver uma versão maior desta figura.
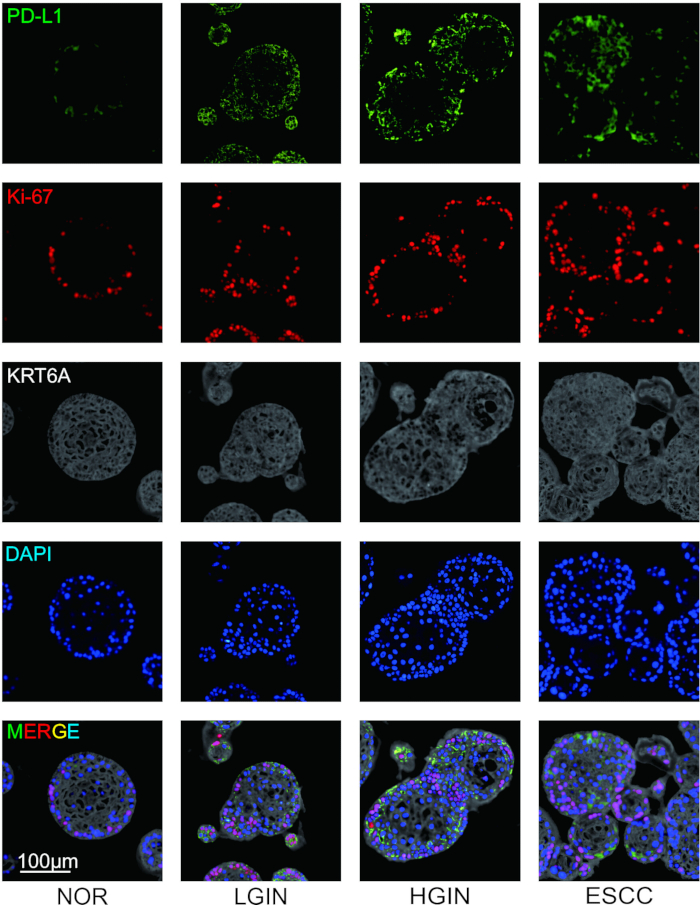
Figura 2: Coloração de imunofluorescência multiplex (mIF) do organoide ESCC de múltiplos estágios. Imagens representativas mostrando a expressão de PD-L1 (verde), Ki-67 (vermelho) e KRT6A (cinza). Barras de escala = 100 μm. NOR, mucosa normal; LGIN, neoplasia intraepitelial de baixo grau; LGIN, neoplasia intraepitelial de alto grau. Clique aqui para ver uma versão maior desta figura.
Discussão
O estabelecimento e a análise histológica dos organoides representam um avanço significativo na modelagem da progressão tumoral. O protocolo oferece vantagens notáveis sobre os métodos existentes para estudar a tumorigênese20. Ao contrário dos sistemas tradicionais de cultura de células 2D, os organoides mantêm uma arquitetura tridimensional complexa e heterogeneidade celular que refletem melhor as condições in vivo. Em comparação com os modelos animais, os organoides derivados de tecido humano representam com mais precisão as características da doença humana 9,21,22. A incorporação da coloração por imunofluorescência multiplex permite a visualização simultânea de múltiplos marcadores, fornecendo informações sobre as relações espaciais entre as principais moléculas e a arquitetura do tecido durante a evolução do tumor. Utilizando este protocolo avançado, este estudo revelou mudanças dinâmicas significativas no carcinoma de células escamosas do esôfago, demonstrando especificamente que os níveis de proliferação de células tumorais mudaram progressivamente durante o desenvolvimento do tumor, acompanhados por alterações correspondentes na expressão da molécula imunossupressora PD-L1.
Este protocolo fornece uma metodologia abrangente para investigar alterações morfológicas e moleculares durante a tumorigênese, com várias etapas críticas exigindo atenção especial. O tempo de digestão durante o processamento do tecido deve ser cuidadosamente monitorado, pois a digestão excessiva pode levar à morte celular excessiva, enquanto a digestão insuficiente resulta em mau isolamento celular. Além disso, o controle de temperatura durante o manuseio da matriz da membrana basal é crucial - a matriz deve ser mantida a 4 °C para evitar a polimerização prematura, mantendo a viabilidade celular.
No entanto, certas limitações da técnica devem ser reconhecidas. A ausência de componentes imunes e células estromais no sistema básico de cultura organoide pode não recapitular totalmente as interações tumor-microambiente23,24. Essa limitação pode ser parcialmente abordada por meio de sistemas de co-cultura, embora tais modificações exijam uma otimização cuidadosa. Finalmente, o descongelamento de organoides também é uma questão importante. De acordo com a experiência anterior, a taxa de sucesso do descongelamento de organoides congelados não é alta. Portanto, os usuários são aconselhados a congelar organoides com cautela.
As implicações clínicas deste protocolo são substanciais, particularmente ao permitir a modelagem da progressão em vários estágios de NOR através de LGIN e HGIN para carcinoma invasivo6. Os organoides derivados de pacientes gerados por essa metodologia servem como ferramentas valiosas para pesquisa e medicina personalizada, permitindo a identificação de marcadores moleculares associados à progressão da doença25,26.
Este protocolo pode ser adaptado para várias aplicações na pesquisa do câncer e no desenvolvimento de medicamentos. A metodologia pode ser estendida para estudar outros cânceres epiteliais e modificada para incorporar técnicas de análise adicionais, como sequenciamento de célula única27,28. Além disso, adaptações futuras podem incorporar fibroblastos associados ao câncer derivados de pacientes e células imunes para modelar interações tumor-estroma-imunes ou integrar a edição CRISPR para investigar fatores genéticos, expandindo sua utilidade na pesquisa translacional e na previsão da resposta terapêutica29,30.
Este protocolo apresenta os métodos de construção e congelamento de organoides de vários estágios de tumorigênese de ESCC. Mais importante, as técnicas de incorporação, seccionamento, coloração IHC e mIF para organoides são descritas neste artigo. Acreditamos que esses métodos de incorporação, fatiamento e coloração de organoides podem ser aplicados a métodos de coloração de organoides de várias fontes de órgãos, incluindo o esôfago. Essa abordagem também pode ajudar os pesquisadores a observar a relação entre a expressão molecular relevante e a estrutura espacial.
Divulgações
Os autores declaram que não têm conflitos financeiros ou de interesse concorrentes.
Agradecimentos
Os autores agradecem a todos os pacientes e médicos que participaram da pesquisa no Hospital do Câncer, na Academia Chinesa de Ciências Médicas (CAMS) e no Peking Union Medical College (PUMC). Este estudo é financiado pela Fundação Nacional de Ciências Naturais da China (82203156 a S.Z.), pelo Programa Nacional de Pesquisa e Desenvolvimento da China (2023YFC3503200 a S.Z.) e pelo Fundo de Inovação da Academia Chinesa de Ciências Médicas para Ciências Médicas (2023-I2M-QJ-002 a S.Z.). A Figura 1 é criada com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Merck | Cat#SLGPR33RB | |
| 24-well plate | Corning | Cat#3524 | |
| 4% Paraformaldehyde | Beyotime | Cat# P0099 | |
| 70 μm sterile strainer | Falcon | Cat#352350 | |
| A83-01 | Tocris Bioscience | Cat# 2939 | |
| Advanced DMEM/F12 | Gibco | Cat# 12634028 | |
| Agar | Solarbio | Cat# A8190 | |
| Anti-Anti (Antibiotic-Antimycotic) | Gibco | Cat# 15240062 | |
| B-27 supplement | Gibco | Cat# 17504044 | |
| CO2 incubator | Thermo | Cat#371GPCN | |
| Collagenase IV | Gibco | Cat# 17104019 | |
| Cryostor | STEMCELL | Cat# 07930 | |
| DMEM | Corning | Cat# 10-013-CV | |
| EGF | Gibco | Cat# PHG0313 | |
| Fetal bovine serum | Cell Technologies | Cat# 30070 | |
| G-418 | Sigma | Cat# A1720 | |
| Gelatin | Solarbio | Cat# G8061 | |
| GlutaMAX | Gibco | Cat# 35050061 | |
| Growth factor-reduced Matrigel | Corning | Cat# 354230 | |
| HE staining kit | Beijing Yili Fine Chemicals Co., Ltd | NA | |
| HEPES | Gibco | Cat# 15630080 | |
| Histological pen | Zsbio | Cat#ZLI-9305 | |
| Hygromycin B | Sigma | Cat# 400050 | |
| Immunohistochemical staining kit | ZSGB-BIO | PV-8000 | |
| L-WRN | ATCC | CRL-3276; RRID:CVCL_DA06 | |
| N-2 supplement | Gibco | Cat# 17502048 | |
| Neutral gum | Zsbio | Cat#ZLI-9555 | |
| Opal 5-Color Manual IHC Kit | PANOVUE | Cat# 10144100100 | |
| PBS | MeilunBio | Cat#MA0015 | |
| Rabbit Monoclone anti-PD-L1 | CST | Cat# 13684; RRID:AB_2687655 | |
| Rabbit Polyclonal anti-Ki67 | Abcam | Cat# ab16667; RRID:AB_302459 | |
| Rabbit Polyclonal anti-KRT6A | Proteintech | Cat# 10590-1-AP; RRID: AB_2134306 | |
| Sheep serum | Zsbio | Cat#ZLI-9056 | |
| TrypLE Express | Gibco | Cat# 12604021 | |
| TrypLE-EDTA | Gibco | Cat#15400-054 | |
| Whole slide image scanner | Hamamatsu | Cat#C13210 | |
| Y-27632 | Selleck Chemicals | Cat# S1049 |
Referências
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados