Method Article
إنشاء وتحليل نسيجي للعضيات المريئية لنمذجة التقدم من الأنسجة الطبيعية إلى الأنسجة السرطانية
* These authors contributed equally
In This Article
Summary
يصف البروتوكول الحالي الإنشاء والتحليل النسيجي للنماذج العضوية المريئية التي تمثل مراحل مختلفة من تطور الورم. تمكن هذه الطريقة الباحثين من دراسة التغيرات في التشكل الخلوي والتنظيم المكاني وأنماط التعبير عن العلامات الجزيئية أثناء الانتقال من الأنسجة الطبيعية إلى الأنسجة السرطانية.
Abstract
ظهرت العضيات كأداة محورية لتعزيز فهم تكوين الأورام وعلاج السرطان. من خلال إنشاء نماذج عضية بشرية تمثل مراحل الورم المختلفة وإجراء التحليلات النسيجية ، من الممكن الحصول على فهم أعمق للتغيرات في التشكل الخلوي ، والهندسة المكانية ، والتعبير عن العلامات الجزيئية الرئيسية مع تقدم الورم. تقدم هذه الدراسة بروتوكولا شاملا لإنشاء واستزراع عضيات الخلايا الحرشفية المريئية. بالإضافة إلى ذلك ، يحدد البروتوكول طرقا لتقييم أنماط التعبير والتنظيم المكاني للجزيئات الحرجة داخل العضيات ، باستخدام تقنيات مثل التثبيت والتضمين والتلطيخ. من خلال هذا البروتوكول ، تم تحديد تغييرات كبيرة في البنية المكانية للخلايا الظهارية الحرشفية للمريء وفي التعبير عن المؤشرات الحيوية المختلفة للورم أثناء تكوين الأورام. يسهل البروتوكول البناء والتحليل النسيجي للعضيات ، مما يمكن الباحثين من التحقيق في الهندسة المكانية والتعديلات الجزيئية للخلايا الظهارية عبر مراحل مختلفة من تكوين الأورام والتدخل العلاجي.
Introduction
تكوين الأورام هو عملية معقدة ومتعددة المراحل تتميز بالتغيرات الجزيئية والمورفولوجية التدريجية في الخلايا1،2. سرطان الخلايا الحرشفية المريئي (ESCC) ، وهو ورم خبيث منتشر مع تشخيص ضعيف3،4 ، يجسد هذا التقدم التدريجي من خلال أربع مراحل متميزة: الغشاء المخاطي الطبيعي ، والأورام داخل الظهارة منخفضة الدرجة (LGIN) ، والأورام داخل الظهارة عالية الدرجة (HGIN) ، والسرطان الغازي5. خلال هذه المراحل ، تظهر الخلايا الظهارية تغيرات ديناميكية في أنماط التعبير الجزيئي والتنظيم المكاني ، مصحوبة بتغييرات منهجية في مورفولوجيا الأنسجة أثناء تقدمها من الحالة الطبيعية إلى الحالة الخبيثة6،7. على الرغم من التقدم المحرز في فهم التسبب في المرض في ESCC ، فإن الافتقار إلى النماذج التجريبية التي تلخص بأمانة الجوانب المكانية والزمانية لتطور الورم - مع تمكين التحليلات النسيجية والجزيئية المنهجية - قد أعاق الفهم الميكانيكي الأعمق لتطور المرض والتطور العلاجي.
في حين أن خطوط الخلايا السرطانية الخالدة ثنائية الأبعاد قد قدمت مساهمات كبيرة في فهم تكوين الأورام ، إلا أنها محدودة بطبيعتها في تكرار التعقيد البيولوجي والسمات المرضية للأورامالأصلية 8. على الرغم من أن النماذج الحيوانية توفر سياقا في الجسم الحي ، إلا أنها غالبا ما تتنبأ بشكل سيئ بالاستجابات البشرية بسبب الاختلافات الخاصةبالأنواع 9. في المقابل ، ظهرت العضيات كمنصة تحويلية قبل السريرية تحافظ بأمانة على عدم التجانس الخلوي والهندسة المعمارية ووظائف الأنسجة البشرية10،11،12،13. كنماذج قبل سريرية ، تلتقط العضيات خصائص الأورام الأولية بشكل أفضل ، مما يتيح التحقيق التفصيلي للأحداث الجزيئية الرئيسية والتغيرات الخلوية أثناء تطورالورم 14. على سبيل المثال ، Chen et al. استخدم عضيات المريء المشتقة من المريض من مراحل مختلفة من ESCC لتوضيح تفاعلات الخلايا الليفية الظهارية ، مما يتحقق في النهاية من صحة محور إشارات ANXA1-FPR2 كمحرك حاسم للتسبب في ESCC6. وبالمثل ، استخدم Ko et al. عضيات المريء المعدلة وراثيا لتحديد المحددات الجينية الرئيسية التي تقود بدء ESCC والتهرب المناعي ، مما يدل على كيف يمكن للنماذج العضوية أن تلخص بشكل فعال ميزات المرض وتكشف عن أهداف علاجية جديدة15.
تحل المنهجية الحالية المشكلات المهمة في نمذجة سرطان المريء من خلال إنشاء بروتوكول قابل للتكرار لتوليد عضيات ESCC متعددة المراحل تعكس التقدم النسيجي من الظهارة الطبيعية إلى السرطان الغازي. يدمج هذا النظام ظروف الاستزراع المحسنة باستخدام وسيط مكيف L-WRN للحفاظ على جذع الظهارة ، جنبا إلى جنب مع البروتوكولات الموحدة للمعالجة النسيجية وتحليل التألق المناعي متعدد الإرسال (mIF) ، مما يوفر منصة مثالية لتحليل التغيرات المكانية والجزيئية طوليا أثناء تكوين الأورام. بالمقارنة مع التقنيات البديلة مثل الثقافات ثنائية الأبعاد ، تحافظ هذه المنصة العضوية بشكل فريد على بنية الأنسجة ، مما يتيح تصور العلامات الجزيئية المنظمة مكانيا ، بما في ذلك بروتين نقطة التفتيش المناعي PD-L1 (CD274) ، الذي يتوسط التهرب المناعي للورم عن طريق تثبيط استجابات الخلايا التائية16،17،18، وعلامة الانتشار Ki-67. يتيح البروتوكول مرور العضيات من أنسجة المريء الطبيعية وسرطانية ، مما يساعد الباحثين على بناء نموذج عضوي مستمر من الأنسجة الطبيعية إلى الورم19. من خلال تمكين التحليل التفصيلي للتغيرات المكانية والجزيئية أثناء تكوين الأورام ، يوفر هذا البروتوكول للباحثين أداة قوية لفهم الآليات الكامنة وراء تطور السرطان وتطوره ، مما قد يؤدي إلى تحسين الاستراتيجيات العلاجية.
هذه المنهجية مناسبة بشكل خاص للباحثين الذين يحققون في التسرطن الظهاري ، أو تفاعلات البيئة الدقيقة للورم ، أو الاستجابات العلاجية في ESCC والأورام الخبيثة الحرشفية ذات الصلة. يسمح تصميمه المعياري بالتكيف لدراسة العلامات الجزيئية الأخرى أو مسارات الإشارات ، بشرط دمج خطوات التحقق المناسبة. من خلال تقديم منصة موحدة ومرنة ، يهدف هذا البروتوكول إلى تطوير الأبحاث قبل السريرية في بيولوجيا الورم وتسريع ترجمة الرؤى الميكانيكية إلى علاجات مستهدفة.
Protocol
تمت الموافقة على هذه الدراسة من قبل مجلس المراجعة المؤسسية لمستشفى السرطان ، الأكاديمية الصينية للعلوم الطبية (الموافقة رقم 20/069-2265 و 22 / 221-3423 و 23 / 305-4047). تم الحصول على عينات من أنسجة المريء من المرضى الذين خضعوا لعملية جراحية أو فحص مبكر لسرطان الخلايا الحرشفية المريئي (ESCC) في مستشفى السرطان بالأكاديمية الصينية للعلوم الطبية بين عامي 2021 و 2024 ، بغرض إنشاء عضيات المريء البشرية. لم يتلق أي من المرضى المشمولين في هذه الدراسة العلاج الكيميائي أو العلاج الإشعاعي قبل جمع العينات. تم الحصول على الموافقة المستنيرة من جميع المشاركين ، وتم استرجاع المعلومات السريرية ذات الصلة من السجلات الطبية. يتم توفير قائمة كاملة بالكواشف والمعدات المستخدمة في هذه الدراسة في جدول المواد.
1. تحضير العضيات الظهارية للمريء
- تحضير وسط مكيف L-WRN
- تحضير خط خلايا L-WRN
- قم بإذابة خط خلايا L-WRN (التخزين عند -80 درجة مئوية) في حمام مائي 37 درجة مئوية لمدة 1-2 دقيقة. تخلط مع 5 مل وسط استزراع قاعدي مسخن مسبقا (DMEM مكمل بنسبة 10٪ FBS).
- الطرد المركزي الخليط على حرارة 200 × جم لمدة 5 دقائق في درجة حرارة الغرفة (RT).
- تخلص من المادة الطافية. أعد تعليق الخلايا ب 2-3 مل من وسط الانتقاء الطازج الدافئ مسبقا (DMEM يحتوي على 10٪ FBS ، و 0.5 مجم / مل hygromycin B ، و 0.5 مجم / مل G-418).
ملاحظة: احتفظ بالوسط عند 4 درجات مئوية (الحد الأقصى للتخزين 1 شهر). - انقل الخلايا إلى طبق ثقافة مقاس 10 سم يحتوي على وسط الاختيار. استزراع الخلايا عند 37 درجة مئوية في حاضنة مرطبة بنسبة 5٪ ثاني أكسيد الكربون2 .
- مرور خط خلية L-WRN
- قم بفصل الخلايا المتقاربة باستخدام 0.025٪ تربسين-EDTA (1-2 دقيقة عند 37 درجة مئوية) وانقسامها بنسبة 1: 2.
- مجموعة من الوسط المكيف L-WRN
- استبدل وسط الاستزراع بوسط الاستزراع القاعدي عند التقاء الخلايا بنسبة 80٪. انقل المادة الطافية إلى أنبوب الطرد المركزي.
- قم بالتصفية من خلال غشاء 0.22 ميكرومتر للتخلص من الحطام الخلوي. اجمع المرشح كوسيط مكيف L-WRN.
ملاحظة: احتفظ بوسط مكيف L-WRN عند 4 درجات مئوية (أسبوع واحد) أو عند -80 درجة مئوية (6 أشهر).
- تحضير خط خلايا L-WRN
- تحضير وسط زراعة العضوية في المريء البشري (H-EOCM)
- تحضير H-EOCM
- دوامة الوسط المكيف L-WRN (حجم 1.5 مل) بعد 4 ساعات من التوازن عند 4 درجات مئوية.
- اجمع بين وسط DMEM / F12 المتقدم مع هذه الإضافات لإنشاء H-EOCM: 3٪ وسط مكيف L-WRN ، 1× مضاد ، 1× L-glutamine ، 1× مكمل N2 ، 1× مكمل B27 ، 0.15 ملي هيبس ، 40 نانوغرام / مل EGF ، 10 ميكرومتر Y-27632 ، و 50 ميكرومتر A83-01.
ملاحظة: حافظ على التخزين المجمد ل H-EOCM عند -20 درجة مئوية للحفظ لمدة ستة أشهر.
- تحضير H-EOCM
- التحضير قبل التجربة
- قم بإذابة H-EOCM عن طريق الحفاظ عليه عند 4 درجات مئوية لمدة 4 ساعات.
2. إنشاء العضية المريئية البشرية
- تحضير المواد
- قم بإذابة مصفوفة الغشاء القاعدي و H-EOCM عند 4 درجات مئوية. تعقيم المقص والملاقط الجراحية للتجربة التالية.
- قم بتبريد أطراف الماصة مسبقا إلى 4 درجات مئوية. قم بتسخين الصفيحة المكونة من 24 بئرا مسبقا إلى 37 درجة مئوية.
- معالجة الأنسجة وعزل الخلايا
ملاحظة: تم جمع أنسجة ورم ESCC ، والآفات خلل التنسج (≤2 سم من هامش الورم) ، وأنسجة المريء الطبيعية المتطابقة (≥5 سم من هامش الورم) من نفس الأفراد الذين خضعوا لعملية استئصال جراحية. بالإضافة إلى ذلك ، تم الحصول على عينات المريء متعددة المراحل من خلال برنامج الكشف المبكر والفحص ESCC ، كما هو موضح في دراساتنا السابقة6،7.- نظف العينة باستخدام مخزن غسيل بدرجة حرارة الغرفة (PBS يحتوي على 1×Anti-Anti و 0.15 mM HEPES) في أنابيب الطرد المركزي سعة 5 مل ثلاث مرات.
ملاحظة: اغسل العينات أكثر من ثلاث مرات لتقليل مخاطر التلوث. - افرم الأنسجة إلى 1 مم3 شظايا باستخدام مقص معقم. نقل الشظايا إلى أنابيب طرد مركزي سعة 1.5 مل.
- قم بتعليق العينة باستخدام عازلة هضم 1 مل ورجها عند 37 درجة مئوية ، 50-100 دورة في الدقيقة ، لمدة 10-20 دقيقة لهضم الأنسجة.
- الطرد المركزي الخليط على حرارة 400 × جم لمدة 5 دقائق عند 4 درجات مئوية. تجاهل المادة الطافية.
- أعد تعليق الراسب في 500 ميكرولتر من 0.025٪ تريبسين-EDTA. احتضان عند 37 درجة مئوية لمدة 10 دقائق. أضف 1 مل من DMEM مع 10٪ FBS لإيقاف النشاط الأنزيمي.
- مرر التعليق عبر مرشح معقم 70 ميكرومتر. اجمع المرشح في أنبوب طرد مركزي سعة 1.5 مل.
- يتم ترشيح أجهزة الطرد المركزي لمدة 5 دقائق عند 400 × جم عند 4 درجات مئوية. تجاهل المادة الطافية. أعد تعليق الخلايا ب 100 ميكرولتر من H-EOCM.
- نظف العينة باستخدام مخزن غسيل بدرجة حرارة الغرفة (PBS يحتوي على 1×Anti-Anti و 0.15 mM HEPES) في أنابيب الطرد المركزي سعة 5 مل ثلاث مرات.
- البذر العضوي
- حدد كثافة الخلية ، ثم قم بإعداد أنبوب طرد مركزي جديد سعة 1.5 مل مع 5,000-15,000 خلية معلقة.
- جهاز طرد مركزي لمدة 5 دقائق عند 400 × جم عند 4 درجات مئوية. استنشق المادة الطافية بعناية. أعد تعليق الخلايا برفق في 50-100 ميكرولتر من مصفوفة الغشاء القاعدي بالتساوي.
ملاحظة: قم بتخزين مصفوفة الغشاء القاعدي عند 4 درجات مئوية لتجنب التصلب. - أضف 50 ميكرولتر من مصفوفة الغشاء القاعدي مع الخلايا المختلطة إلى وسط كل صفيحة مكونة من 24 بئرا. بلمرة مصفوفة الغشاء القاعدي من خلال حضانة 37 درجة مئوية (مدة 30 دقيقة).
- أضف 500 ميكرولتر من H-EOCM الدافئ مسبقا (37 درجة مئوية) لتغطية مصفوفة الغشاء القاعدي. استزراع العضيات في حاضنة مرطب بنسبة 5٪ ثاني أكسيد الكربون2 عند 37 درجة مئوية.
- استبدال متوسط
- استنشق الوسط المستهلك وقم بتجديده ب 500 ميكرولتر من H-EOCM الطازج (الدافئ إلى 37 درجة مئوية).
ملاحظة: استبدل H-EOCM كل 3 أيام.
- استنشق الوسط المستهلك وقم بتجديده ب 500 ميكرولتر من H-EOCM الطازج (الدافئ إلى 37 درجة مئوية).
3. مرور العضيات
- تحضير المواد
- قم بإذابة مصفوفة الغشاء القاعدي و H-EOCM عند 4 درجات مئوية. قم بتبريد أطراف الماصة مسبقا إلى 4 درجات مئوية. قم بتسخين الصفيحة المكونة من 24 بئرا مسبقا إلى 37 درجة مئوية.
- هضم العضوية
- قم بإزالة وسيط H-EOCM برفق. أضف 500 ميكرولتر من المخزن المؤقت الممر المبرد مسبقا (DMEM / F12 المتقدم الذي يحتوي على 1× مضاد مضاد و 0.15 ملي مولار HEPES ، مبرد مسبقا إلى 4 درجات مئوية) في البئر لإذابة مصفوفة الغشاء القاعدي.
- اجمع بين مصفوفة الغشاء القاعدي مع عازلة المرور في أنبوب طرد مركزي سعة 1.5 مل. اغسل البئر ب 500 ميكرولتر من المخزن المؤقت المبرد مسبقا واجمع المخزن المؤقت لاسترداد أي عضيات متبقية.
- جهاز الطرد المركزي للمخزن المؤقت لمدة 5 دقائق عند 400 × جم عند 4 درجات مئوية. استنشق المادة الطافية برفق. أضف 500 ميكرولتر من التربسين المؤتلف في الأنبوب واحتضنه للهضم الأنزيمي (37 درجة مئوية ، 15 دقيقة). قم بالتعليق على فترات 5 دقائق.
- جهاز الطرد المركزي للعينة المهضومة (400 × جم ، 5 دقائق ، 4 درجات مئوية). تخلص من المادة الطافية. كرر الخطوتين 3.2.6 و 3.2.7. أعد تعليق الخلايا في 100 ميكرولتر من H-EOCM.
- البذر العضوي
- بالنسبة للبذر العضوي ، كرر الخطوة 2.3.
4. التجميد العضوي والتعافي
- التجميد العضوي
- لتحضير المواد ، كرر الخطوة 2.1.
- لهضم العضيات ، كرر الخطوة 3.2.
- التجميد العضوي
- حدد كثافة الخلية ، ثم قم بإعداد أنبوب طرد مركزي جديد سعة 1.5 مل مع 10,000 خلية معلقة.
- الطرد المركزي للعينات عند 400 × جم لمدة 5 دقائق في RT. شفط المادة الطافية بعناية.
- أعد تعليق الخلايا ب 500-1000 ميكرولتر من وسط الحفظ بالتبريد. نقل إلى أنبوب تبريد جديد. قم بتجميد أنبوب التبريد عند -80 درجة مئوية لمدة 24 ساعة. أرشفة في نظام تخزين النيتروجين السائل للحفظ الممتد.
- ذوبان الجليد من تجميد العضوية
- لإعداد المواد ، كرر الخطوة 2.1.
- ذوبان الجليد من تجميد العضوية
- قم بإذابة أنبوب التبريد بسرعة في حمام مائي 37 درجة مئوية لمدة 2-3 دقائق. انقل المادة المجمدة إلى 9 مل من المزرعة القاعدية الدافئة مسبقا (37 درجة مئوية) وأعد تعليق الخلايا بالتساوي.
- جهاز الطرد المركزي لتعليق الخلية لمدة 5 دقائق عند 400 × جم (عند RT). استنشق المادة الطافية بعناية.
- البذر العضوي
- لبذر العضيات ، كرر الخطوة 2.3.
5. التحليل النسيجي للعضيات
- تحضير الأقسام المدمجة في البارافين
- تحضير المواد
- تعقيم 50 مل من مصفوفة التضمين (محلول مائي: 2٪ أجار + 2.5٪ جيلاتين) في قارورة 250 مل عبر الأوتوكلاف. Aliquot 5 مل في أنابيب الطرد المركزي سعة 15 مل. يحفظ في درجة حرارة الغرفة.
- التثبيت العضوي
- كرر الخطوات 3.2.1-3.2.2. أعد تعليق الراسب ب 1 مل من المخزن المؤقت للمرور في أنبوب جديد سعة 1.5 مل.
- جهاز طرد مركزي عند 400 × جم عند 4 درجات مئوية لمدة 5 دقائق. قم بإزالة المادة الطافية. أعد تعليق العضيات في 500 ميكرولتر من 4٪ بارافورمالدهايد (PFA). احتضن في درجة حرارة الغرفة لمدة ساعة واحدة أو عند 4 درجات مئوية لمدة 6 ساعات على الأقل.
- التضمين العضوي
- الطرد المركزي الخليط (400 × جم ، 5 دقائق ، RT). قم بإزالة المادة الطافية. أضف 1 مل من المخزن المؤقت للممر في الأنبوب وأعد تعليق هطول الأمطار.
- الطرد المركزي الخليط (400 × جم ، 5 دقائق ، RT). قم بإزالة المادة الطافية.
- ضع أنبوبا واحدا (15 مل) مع وسط تضمين (5 مل) في الحمام المائي (حاوية 100 مل ، 150 مل). الميكروويف بأقصى طاقة حتى يبدأ الماء في الغليان.
ملاحظة: قم بفك غطاء الأنبوب سعة 15 مل قبل الميكروويف. - أعد تعليق العضيات ب 50 ميكرولتر من هلام التضمين في أنبوب طرد مركزي سعة 1.5 مل. قم بتبريد الأنبوب إلى 4 درجات مئوية حتى يتماسك الجل تماما.
- انقل الجل المتصلب إلى 70٪ إيثانول. يحفظ في درجة حرارة 4 درجات مئوية.
- تحضير كتلة البارافين
- تجفيف الجل من خلال سلسلة الإيثانول (30٪ → 50٪ → 70٪ → 80٪ → 95٪ → 100٪) ، 30 دقيقة لكل تركيز.
- ضعي الجل المتصلب في زيلين شفاف لمدة 30 دقيقة. اغمر الجل المتصلب في البارافين وقم بتضمينه باستخدام محطة البارافين الساخنة.
- قطع شرائح بسمك 4 ميكرومتر باستخدام ميكروتوم. قم بالتركيب على الشرائح وجففها عند 65 درجة مئوية لمدة 1 ساعة. يحفظ في ظروف جافة.
- تحضير المواد
- تلطيخ الكيمياء النسيجية المناعية (IHC) للشرائح العضوية
- إزالة الشمع والترطيب
- سخني الشرائح في عامل تنظيف الأنسجة على حرارة 65 درجة مئوية لمدة 40 دقيقة. اغمر الشريحة في عامل تنظيف الأنسجة الطازجة في درجة حرارة الغرفة لمدة 20 دقيقة.
- قم بمعالجة الشرائح من خلال صواني زجاجية تحتوي على سلسلة الإيثانول: اغمر في 100٪ إيثانول لمدة 10 دقائق وكرر مرة واحدة ، ثم انقله إلى 95٪ إيثانول لمدة 5 دقائق ، متبوعا بنسبة 85٪ إيثانول لمدة 5 دقائق ، ثم 75٪ إيثانول لمدة 5 دقائق ، وأخيرا ضعه في 4٪ PFA لمدة 10 دقائق.
- أضف الماء المعقم إلى الغرفة المقاومة للحرارة واحتفظ ب 5 دقائق على الخلاط عند 80 دورة في الدقيقة. كرر هذه الخطوة مرتين.
- استرجاع المستضد
- أضف محلول استرجاع مستضد Tris-EDTA (درجة الحموضة 9.0) إلى الغرفة المقاومة للحرارة لغمر الشرائح. قم بتسخين الغرفة المقاومة للحرارة التي تحتوي على الشرائح في الميكروويف بأقصى كثافة (700 واط ، 3 دقائق) حتى الغليان. استمر في الميكروويف في إعداد منخفض الطاقة (70 واط ، 15 دقيقة) واتركه يبرد إلى درجة حرارة الغرفة.
- يغسل في الماء المقطر لمدة دقيقتين على شاكر عند 80 دورة في الدقيقة. كرر مرتين. ضع دائرة حول موقع العضيات بقلم نسيجي.
- حجب البيروكسيديز
- قم بإسقاط محلول حجب البيروكسيديز لتغطية منطقة العينة. احتضن في غرفة الرطوبة في درجة حرارة الغرفة لمدة 20 دقيقة.
- انقل الشرائح إلى غرفة قابلة للحرارة. يغسل في PBST (PBS + 0.1٪ Tween 20) لمدة دقيقتين عند 80 دورة في الدقيقة. كرر مرتين.
- حضانة الأجسام المضادة الأولية
- امسح برفق قطرات PBST الزائدة على الشرائح.
ملاحظة: تجنب لمس العضيات على الشرائح. - إسقاط الجسم المضاد الأولي المخفف لتغطية المنطقة العضوية. احتضن في غرفة الرطوبة لمدة ساعتين في درجة حرارة الغرفة ، أو 8-14 ساعة عند 4 درجات مئوية. كرر هذه الخطوة.
- امسح برفق قطرات PBST الزائدة على الشرائح.
- حضانة الأجسام المضادة الثانوية
- كرر الخطوة 5.2.4.1. إسقاط الجسم المضاد الثانوي HRP المخفف لتغطية المنطقة العضوية. احتضن في غرفة الرطوبة في درجة حرارة الغرفة لمدة 20 دقيقة. كرر هذه الخطوة.
- تلطيخ DAB (3،3 ′-ديامينوبنزيدين)
- كرر الخطوة 5.2.4.1. إسقاط 1× DAB لتغطية المنطقة العضوية. احتضن في غرفة الرطوبة في درجة حرارة الغرفة حتى يتحول اللون إلى اللون البني.
- اغمر الشرائح في الماء المقطر لمدة 5-10 ثوان لإنهاء تغيير اللون. كرر الخطوة.
- تلطيخ الهيماتوكسيلين
- وصمة عار في الهيماتوكسيلين لمدة 5-8 دقائق. تفريق في 1٪ كحول حمضي (1٪ حمض الهيدروكلوريك في 70٪ كحول) لمدة 5-10 ثوان.
- اغمر الشرائح في الماء المقطر لمدة 5-10 ثوان. كرر هذه الخطوة.
- تجفاف
- قم بمعالجة الشرائح من خلال صواني زجاجية بترتيب تسلسلي: اغمر في 75٪ من الإيثانول لمدة 5 دقائق ، ثم انقله إلى 85٪ من الإيثانول لمدة 5 دقائق ، وانتقل إلى 95٪ من الإيثانول لمدة 5 دقائق ، متبوعا بغمرين منفصلين في 100٪ من الإيثانول لمدة 10 دقائق لكل منهما ، وأخيرا ضعه في الزيلين لفترتين متتاليتين مدة كل منهما 20 دقيقة.
- تركيب الشريحة
- أضف الزيلين إلى اللثة المحايدة حتى تصبح شفافة. يجف في الهواء قليلا. ثم قم بإسقاط العلكة مع الزيلين لتغطية المنطقة العضوية.
- ضع الغطاء. مسح الشريحة وتحليلها.
- إزالة الشمع والترطيب
- تلطيخ التألق المناعي متعدد الإرسال (mIF)
- لإزالة الشمع والترطيب ، كرر الخطوة 5.2.1.
- لحجب البيروكسيديز ، كرر الخطوة 5.2.3.
- لاسترجاع المستضد، كرر الخطوة 5.2.3.
- حجب مصل الأغنام.
- كرر الخطوة 5.2.4.1. أضف محلول مانع مصل الأغنام لتغطية المنطقة العضوية. احتضن في غرفة الرطوبة في درجة حرارة الغرفة لمدة 30 دقيقة.
- يغسل في PBST لمدة 2 دقيقة.
- لحضانة الأجسام المضادة الأولية ، كرر الخطوة 5.2.4.
- بالنسبة لحضانة الأجسام المضادة الثانوية، كرر الخطوة 5.2.4.1.
- قم بإسقاط محلول الأجسام المضادة الثانوية المحددة لتغطية المنطقة العضوية. احتضن في غرفة الرطوبة في درجة حرارة الغرفة لمدة 20 دقيقة. كرر الخطوة 5.2.3.2.
ملاحظة: قم بحماية الشرائح من الضوء من هذه الخطوة حتى نهاية التجربة.
- قم بإسقاط محلول الأجسام المضادة الثانوية المحددة لتغطية المنطقة العضوية. احتضن في غرفة الرطوبة في درجة حرارة الغرفة لمدة 20 دقيقة. كرر الخطوة 5.2.3.2.
- تلطيخ صبغة الفلورسنت
- كرر الخطوة 5.3.4.1. قم بإسقاط محلول صبغة الفلورسنت لتغطية المنطقة العضوية.
- احتضن في غرفة الرطوبة في درجة حرارة الغرفة لمدة 10-20 دقيقة. كرر الخطوة 5.2.3.2.
- لتلوين متعدد البقع ، كرر الخطوات 5.3.3-5.3.7.
- تلطيخ DAPI
- كرر الخطوة 5.2.4.1. قم بإسقاط محلول DAPI لتغطية المنطقة العضوية. كرر الخطوة 5.2.3.2. بعد ذلك، كرر الخطوة 5.3.4.2.
- اغمر الشرائح في ماء معقم لمدة 2 دقيقة.
- تركيب الشريحة
- قم بإسقاط وسيط التركيب المضاد للبهتان لتغطية المنطقة العضوية. ضع الغطاء.
- احصل على صور رقمية باستخدام ماسح ضوئي للشرائح وقم بتحليلها.
النتائج
يصف هذا البروتوكول أخذ العينات العضوية والتحليل النسيجي في مراحل مختلفة من تكوين الأورام ESCC (الشكل 1). من خلال أخذ عينات من الغشاء المخاطي للمريء الطبيعي ، والأورام داخل الظهارة منخفضة الدرجة (LGIN) ، والأورام داخل الظهارة عالية الجودة (HGIN) ، والأنسجة السرطانية من مرضى ESCC ، يمكن بناء العضيات التي تمثل مراحل مختلفة من تكوين الأورام. علاوة على ذلك ، تم إجراء تضمين البارافين وتقطيع هذه العضيات ، متبوعا بتلوين التألق المناعي.
للتحقيق في التعبير عن الجزيئات المثبطة للمناعة والخصائص المورفولوجية لاستنساخ الخلايا أثناء تكوين الأورام ، تم جمع الأنسجة الظهارية للمريء من مراحل مختلفة من تطور الورم ، وإجراء تلطيخ التألق المناعي. بعد الانتهاء من التلوين ، تم تحديد أربعة ألوان زائفة للعلامات قبل مسح الشرائح. تم تعيين PD-L1 و Ki-67 و KRT6A بألوان زائفة من الأخضر والأحمر والرمادي ، على التوالي ، بينما تم تصنيف نوى الخلايا باستخدام DAPI. أظهرت النتائج التجريبية أن مورفولوجيا العضوية من الغشاء المخاطي للمريء تغيرت أثناء تكوين الأورام ، وأصبحت في المقام الأول أكثر تنظيما. كشف تلطيخ التألق المناعي أنه مع تقدم تكوين الأورام ، تغير تكاثر الخلايا الظهارية ، مصحوبا بتعبير مرتفع عن الجزيئات المثبطة للمناعة مثل PD-L1 (الشكل 2).
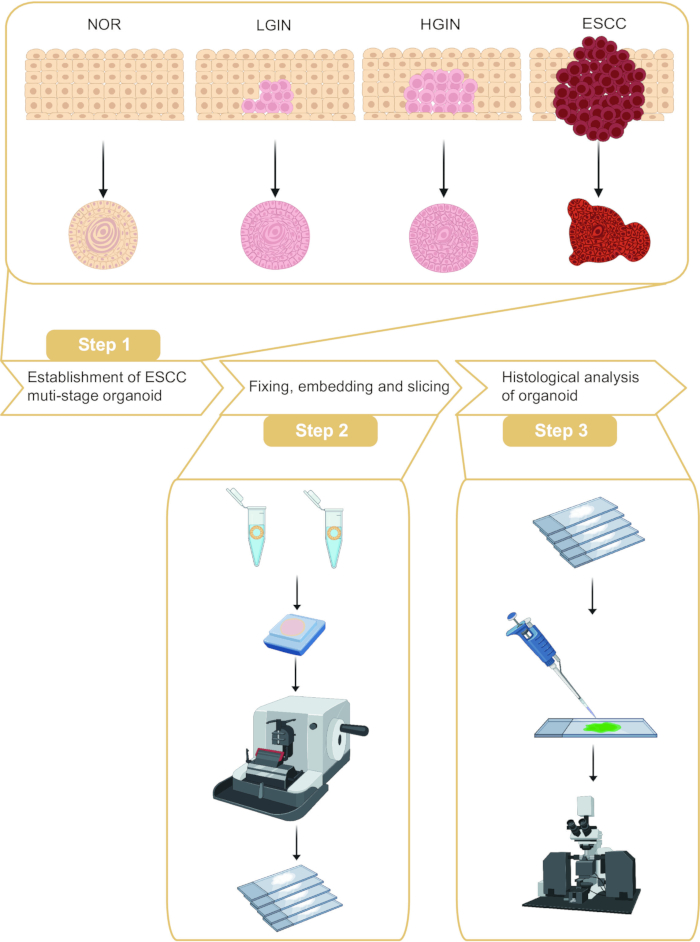
الشكل 1: سير عمل الإنشاء والتحليل النسيجي لسرطان الخلايا الحرشفية للمريء متعدد المراحل (ESCC). الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
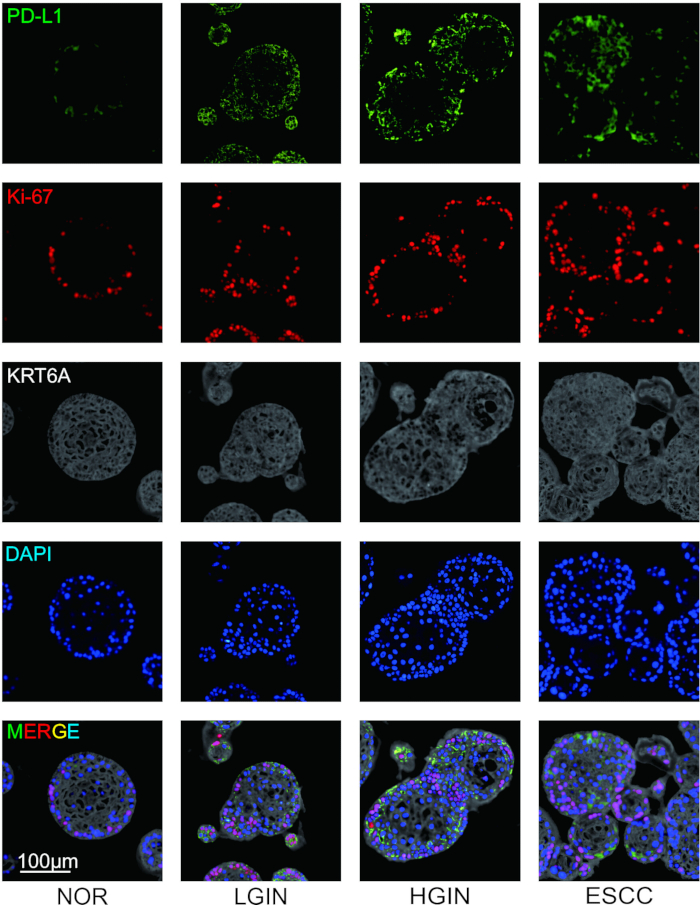
الشكل 2: تلطيخ التألق المناعي متعدد الإرسال (mIF) للعضية ESCC متعددة المراحل. صور تمثيلية تظهر تعبيرا عن PD-L1 (أخضر) و Ki-67 (أحمر) و KRT6A (رمادي). أشرطة المقياس = 100 ميكرومتر. LGIN ، الأورام داخل الظهارة منخفضة الدرجة. LGIN ، أورام داخل الظهارة عالية الجودة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يمثل إنشاء العضيات والتحليل النسيجي لها تقدما كبيرا في نمذجة تطور الورم. يوفر البروتوكول مزايا ملحوظة مقارنة بالطرق الحالية لدراسة تكوين الأورام20. على عكس أنظمة زراعة الخلايا ثنائية الأبعاد التقليدية ، تحافظ العضيات على بنية معقدة ثلاثية الأبعاد وعدم تجانس خلوي ينعكس بشكل أفضل في الظروف الحقيقية . بالمقارنة مع النماذج الحيوانية ، تمثل العضيات المشتقة من الأنسجة البشرية خصائص المرض البشريبشكل أكثر دقة 9،21،22. يسمح دمج تلطيخ التألق المناعي متعدد الإرسال بالتصور المتزامن لعلامات متعددة ، مما يوفر رؤى حول العلاقات المكانية بين الجزيئات الرئيسية وبنية الأنسجة أثناء تطور الورم. باستخدام هذا البروتوكول المتقدم ، كشفت هذه الدراسة عن تغييرات ديناميكية كبيرة في سرطان الخلايا الحرشفية للمريء ، مما يدل على وجه التحديد على أن مستويات تكاثر الخلايا السرطانية تغيرت تدريجيا أثناء تطور الورم ، مصحوبة بتغييرات مقابلة في التعبير عن الجزيء المثبط للمناعة PD-L1.
يوفر هذا البروتوكول منهجية شاملة للتحقيق في التغيرات المورفولوجية والجزيئية أثناء تكوين الأورام ، مع العديد من الخطوات الحاسمة التي تتطلب اهتماما خاصا. يجب مراقبة وقت الهضم أثناء معالجة الأنسجة بعناية ، حيث يمكن أن يؤدي الإفراط في الهضم إلى موت الخلايا بشكل مفرط ، بينما يؤدي الهضم غير الكافي إلى ضعف عزل الخلايا. بالإضافة إلى ذلك ، يعد التحكم في درجة الحرارة أثناء التعامل مع مصفوفة الغشاء القاعدي أمرا بالغ الأهمية - يجب الحفاظ على المصفوفة عند 4 درجات مئوية لمنع البلمرة المبكرة مع الحفاظ على بقاء الخلية.
ومع ذلك ، يجب الاعتراف ببعض القيود على هذه التقنية. قد لا يلخص غياب المكونات المناعية والخلايا اللحمية في نظام الثقافة العضوية الأساسي تفاعلات الورم والبيئة المكرويةبشكل كامل 23،24. ويمكن معالجة هذا القيد جزئيا من خلال أنظمة الاستزراع المشترك، على الرغم من أن هذه التعديلات تتطلب تحسينا دقيقا. أخيرا ، يعد ذوبان ذوبان العضيات أيضا قضية مهمة. وفقا للتجربة السابقة ، فإن معدل نجاح ذوبان العضيات المجمدة ليس مرتفعا. لذلك ، ينصح المستخدمون بتجميد العضيات بحذر.
الآثار السريرية لهذا البروتوكول كبيرة ، لا سيما في تمكين نمذجة التقدم متعدد المراحل من NOR عبر LGIN و HGIN إلى السرطان الغازي6. تعمل العضيات المشتقة من المريض التي تم إنشاؤها باستخدام هذه المنهجية كأدوات قيمة للبحث والطب الشخصي ، مما يسمح بتحديد العلامات الجزيئية المرتبطة بتطورالمرض 25،26.
يمكن تكييف هذا البروتوكول لتطبيقات مختلفة في أبحاث السرطان وتطوير الأدوية. يمكن توسيع المنهجية لدراسة السرطانات الظهارية الأخرى وتعديلها لدمج تقنيات تحليل إضافية مثل تسلسل الخليةالمفردة 27،28. علاوة على ذلك ، يمكن أن تتضمن التعديلات المستقبلية الخلايا الليفية المرتبطة بالسرطان المشتقة من المريض والخلايا المناعية لنمذجة التفاعلات المناعية للورم والسدى أو دمج تحرير كريسبر للتحقيق في الدوافع الجينية ، مما يوسع فائدته في البحث الانتقالي والتنبؤ باستجابة العلاج29،30.
يقدم هذا البروتوكول طرق بناء وتجميد العضيات من مراحل مختلفة من تكوين الأورام في ESCC. والأهم من ذلك ، تم وصف تقنيات التضمين والتقسيم و IHC و mIF للعضيات في هذه المقالة. نعتقد أنه يمكن تطبيق طرق تضمين وتقطيع وتلوين العضيات هذه على طرق تلوين العضوية لمصادر أعضاء متعددة ، بما في ذلك المريء. يمكن أن يساعد هذا النهج الباحثين أيضا على مراقبة العلاقة بين التعبير الجزيئي ذي الصلة والبنية المكانية.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم أي تضارب مالي أو تضارب في المصالح.
Acknowledgements
يشكر المؤلفون جميع المرضى والأطباء المشاركين في البحث في مستشفى السرطان والأكاديمية الصينية للعلوم الطبية (CAMS) وكلية الطب الاتحادية في بكين (PUMC). يتم تمويل هذه الدراسة من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (82203156 إلى SZ ) ، والبرنامج الوطني للبحث والتطوير الرئيسي في الصين (2023YFC3503200 إلى SZ) ، وصندوق الابتكار التابع للأكاديمية الصينية للعلوم الطبية للعلوم الطبية (2023-I2M-QJ-002 إلى S.Z.). تم إنشاء الشكل 1 باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Merck | Cat#SLGPR33RB | |
| 24-well plate | Corning | Cat#3524 | |
| 4% Paraformaldehyde | Beyotime | Cat# P0099 | |
| 70 μm sterile strainer | Falcon | Cat#352350 | |
| A83-01 | Tocris Bioscience | Cat# 2939 | |
| Advanced DMEM/F12 | Gibco | Cat# 12634028 | |
| Agar | Solarbio | Cat# A8190 | |
| Anti-Anti (Antibiotic-Antimycotic) | Gibco | Cat# 15240062 | |
| B-27 supplement | Gibco | Cat# 17504044 | |
| CO2 incubator | Thermo | Cat#371GPCN | |
| Collagenase IV | Gibco | Cat# 17104019 | |
| Cryostor | STEMCELL | Cat# 07930 | |
| DMEM | Corning | Cat# 10-013-CV | |
| EGF | Gibco | Cat# PHG0313 | |
| Fetal bovine serum | Cell Technologies | Cat# 30070 | |
| G-418 | Sigma | Cat# A1720 | |
| Gelatin | Solarbio | Cat# G8061 | |
| GlutaMAX | Gibco | Cat# 35050061 | |
| Growth factor-reduced Matrigel | Corning | Cat# 354230 | |
| HE staining kit | Beijing Yili Fine Chemicals Co., Ltd | NA | |
| HEPES | Gibco | Cat# 15630080 | |
| Histological pen | Zsbio | Cat#ZLI-9305 | |
| Hygromycin B | Sigma | Cat# 400050 | |
| Immunohistochemical staining kit | ZSGB-BIO | PV-8000 | |
| L-WRN | ATCC | CRL-3276; RRID:CVCL_DA06 | |
| N-2 supplement | Gibco | Cat# 17502048 | |
| Neutral gum | Zsbio | Cat#ZLI-9555 | |
| Opal 5-Color Manual IHC Kit | PANOVUE | Cat# 10144100100 | |
| PBS | MeilunBio | Cat#MA0015 | |
| Rabbit Monoclone anti-PD-L1 | CST | Cat# 13684; RRID:AB_2687655 | |
| Rabbit Polyclonal anti-Ki67 | Abcam | Cat# ab16667; RRID:AB_302459 | |
| Rabbit Polyclonal anti-KRT6A | Proteintech | Cat# 10590-1-AP; RRID: AB_2134306 | |
| Sheep serum | Zsbio | Cat#ZLI-9056 | |
| TrypLE Express | Gibco | Cat# 12604021 | |
| TrypLE-EDTA | Gibco | Cat#15400-054 | |
| Whole slide image scanner | Hamamatsu | Cat#C13210 | |
| Y-27632 | Selleck Chemicals | Cat# S1049 |
References
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved