Method Article
Definizione e analisi istologica di organoidi esofagei che modellano la progressione da tessuti normali a cancerosi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il presente protocollo descrive la costituzione e l'analisi istologica di modelli di organoidi esofagei che rappresentano diversi stadi di progressione tumorale. Questo metodo consente ai ricercatori di studiare i cambiamenti nella morfologia cellulare, nell'organizzazione spaziale e nei modelli di espressione dei marcatori molecolari durante la transizione dai tessuti normali a quelli cancerosi.
Abstract
Gli organoidi sono emersi come uno strumento fondamentale per far progredire la comprensione della tumorigenesi e della terapia del cancro. Generando modelli di organoidi umani che rappresentano diversi stadi tumorali ed eseguendo analisi istologiche, è possibile ottenere una comprensione più profonda delle alterazioni della morfologia cellulare, dell'architettura spaziale e dell'espressione di marcatori molecolari chiave durante la progressione del tumore. Questo studio presenta un protocollo completo per la creazione e la coltura di organoidi di cellule squamose esofagee. Inoltre, il protocollo delinea metodi per valutare i modelli di espressione e l'organizzazione spaziale delle molecole critiche all'interno degli organoidi, utilizzando tecniche come la fissazione, l'incorporamento e la colorazione. Attraverso questo protocollo, sono stati identificati cambiamenti significativi nella struttura spaziale delle cellule epiteliali squamose esofagee e nell'espressione di vari biomarcatori tumorali durante la tumorigenesi. Il protocollo facilita la costruzione e l'analisi istologica degli organoidi, consentendo ai ricercatori di studiare l'architettura spaziale e le alterazioni molecolari delle cellule epiteliali in diversi stadi della tumorigenesi e dell'intervento terapeutico.
Introduzione
La tumorigenesi è un processo complesso e multistadio caratterizzato da progressive modificazioni molecolari e morfologiche nelle cellule 1,2. Il carcinoma esofageo a cellule squamose (ESCC), un tumore maligno prevalente con prognosi infausta 3,4, esemplifica questa progressione graduale attraverso quattro stadi distinti: mucosa normale, neoplasia intraepiteliale di basso grado (LGIN), neoplasia intraepiteliale di alto grado (HGIN) e carcinoma invasivo5. Durante queste fasi, le cellule epiteliali mostrano cambiamenti dinamici nei modelli di espressione molecolare e nell'organizzazione spaziale, accompagnati da alterazioni sistematiche nella morfologia dei tessuti mentre avanzano da uno stato normale a uno maligno 6,7. Nonostante i progressi nella comprensione della patogenesi dell'ESCC, la mancanza di modelli sperimentali che ricapitolino fedelmente gli aspetti spaziali e temporali dell'evoluzione del tumore, consentendo al contempo analisi istologiche e molecolari sistematiche, ha ostacolato una comprensione meccanicistica più profonda della progressione della malattia e dello sviluppo terapeutico.
Sebbene le linee cellulari tumorali immortalizzate in 2D abbiano dato un contributo significativo alla comprensione dell'oncogenesi, sono intrinsecamente limitate nel replicare la complessità biologica e le caratteristiche patologiche dei tumori nativi8. I modelli animali, sebbene forniscano un contesto in vivo, spesso predicono male le risposte umane a causa delle differenze specie-specifiche9. Al contrario, gli organoidi sono emersi come una piattaforma preclinica trasformativa che preserva fedelmente l'eterogeneità cellulare, l'architettura e la funzionalità dei tessuti umani 10,11,12,13. Come modelli preclinici, gli organoidi catturano meglio le caratteristiche dei tumori primari, consentendo un'indagine dettagliata degli eventi molecolari chiave e dei cambiamenti cellulari durante la progressione del tumore14. Ad esempio, Chen et al. hanno utilizzato organoidi esofagei derivati da pazienti provenienti da diversi stadi di ESCC per chiarire le interazioni epiteliale-fibroblasto, convalidando infine l'asse di segnalazione ANXA1-FPR2 come driver critico della patogenesi 6 dell'ESCC. Allo stesso modo, Ko et al. hanno impiegato organoidi esofagei geneticamente modificati per identificare i determinanti genetici chiave che guidano l'inizio dell'ESCC e l'evasione immunitaria, dimostrando come i modelli di organoidi possano ricapitolare efficacemente le caratteristiche della malattia e rivelare nuovi bersagli terapeutici15.
La presente metodologia risolve problemi significativi nella modellazione del cancro esofageo stabilendo un protocollo riproducibile per la generazione di organoidi ESCC multistadio che rispecchiano la progressione istologica dall'epitelio normale al carcinoma invasivo. Questo sistema integra condizioni di coltura ottimizzate utilizzando un terreno condizionato con L-WRN per mantenere la staminalità epiteliale, combinato con protocolli standardizzati per l'elaborazione istologica e l'analisi di immunofluorescenza multiplex (mIF), fornendo una piattaforma ideale per analizzare longitudinalmente i cambiamenti spaziali e molecolari durante la tumorigenesi. Rispetto a tecniche alternative come le colture 2D, questa piattaforma di organoidi preserva in modo unico l'architettura dei tessuti, consentendo la visualizzazione di marcatori molecolari organizzati spazialmente, tra cui la proteina del checkpoint immunitario PD-L1 (CD274), che media l'evasione immunitaria del tumore inibendo le risposte delle cellule T 16,17,18e il marcatore di proliferazione Ki-67. Il protocollo consente il passaggio di organoidi da tessuti esofagei e precancerosi normali, aiutando i ricercatori a costruire un modello continuo di organoidi dal tessuto normale al tumore19. Consentendo un'analisi dettagliata dei cambiamenti spaziali e molecolari durante la tumorigenesi, questo protocollo offre ai ricercatori un potente strumento per comprendere i meccanismi alla base dello sviluppo e della progressione del cancro, portando potenzialmente a migliori strategie terapeutiche.
Questa metodologia è particolarmente adatta per i ricercatori che studiano la carcinogenesi epiteliale, le interazioni con il microambiente tumorale o le risposte terapeutiche nell'ESCC e nelle neoplasie squamose correlate. Il suo design modulare consente l'adattamento per studiare altri marcatori molecolari o vie di segnalazione, a condizione che siano incorporate le fasi di convalida appropriate. Offrendo una piattaforma standardizzata ma flessibile, questo protocollo mira a far progredire la ricerca preclinica nella biologia dei tumori e ad accelerare la traduzione delle intuizioni meccanicistiche in terapie mirate.
Protocollo
Questo studio è stato approvato dall'Institutional Review Board del Cancer Hospital, Chinese Academy of Medical Sciences (Approvazione n. 20/069-2265, 22/221-3423 e 23/305-4047). I campioni di tessuto esofageo sono stati ottenuti da pazienti sottoposti a intervento chirurgico o screening precoce per il carcinoma esofageo a cellule squamose (ESCC) presso il Cancer Hospital, Chinese Academy of Medical Sciences tra il 2021 e il 2024, allo scopo di stabilire organoidi esofagei umani. Nessuno dei pazienti inclusi in questo studio aveva ricevuto chemioterapia o radioterapia prima della raccolta del campione. Il consenso informato è stato ottenuto da tutti i partecipanti e le informazioni cliniche pertinenti sono state recuperate dalle cartelle cliniche. Un elenco completo dei reagenti e delle attrezzature utilizzate in questo studio è fornito nella Tabella dei materiali.
1. Preparazione di organoidi epiteliali esofagei
- Preparazione del terreno condizionato con L-WRN
- Preparazione di linee cellulari L-WRN
- Scongelare la linea cellulare L-WRN (conservazione a -80 °C) in un bagno d'acqua a 37 °C per 1-2 minuti. Miscelare con 5 mL di terreno di coltura basale preriscaldato (DMEM integrato con il 10% di FBS).
- Centrifugare la miscela a 200 x g per 5 minuti a temperatura ambiente (RT).
- Scartare il surnatante. Risospendere le cellule con 2-3 mL di terreno di selezione fresco preriscaldato (DMEM contenente il 10% di FBS, 0,5 mg/mL di igromicina B e 0,5 mg/mL di G-418).
NOTA: Mantenere il fluido a 4 °C (conservazione massima 1 mese). - Trasferire le cellule in una piastra di coltura di 10 cm contenente il terreno di selezione. Coltura delle cellule a 37 °C in un incubatore umidificato al 5% di CO2 .
- Passaggio di linee cellulari L-WRN
- Dissociare le cellule confluenti utilizzando tripsina-EDTA allo 0,025% (1-2 min a 37 °C) e dividerle in un rapporto 1:2.
- Raccolta del fluido condizionato L-WRN
- Sostituire il terreno di coltura con un terreno di coltura basale all'80% di confluenza cellulare. Trasferire il surnatante in una provetta da centrifuga.
- Filtrare attraverso una membrana da 0,22 μm per eliminare i detriti cellulari. Raccogliere il filtrato come mezzo condizionato con L-WRN.
NOTA: Mantenere il terreno condizionato con L-WRN a 4 °C (1 settimana) o a -80 °C (6 mesi).
- Preparazione di linee cellulari L-WRN
- Preparazione del terreno di coltura di organoidi esofagei umani (H-EOCM)
- Preparazione H-EOCM
- Agitare il terreno condizionato con L-WRN (volume di 1,5 mL) dopo 4 ore di equilibratura a 4 °C.
- Combina il terreno DMEM/F12 avanzato con questi additivi per creare H-EOCM: 3% di terreno condizionato con L-WRN, 1× Anti-Anti, 1× L-glutammina, 1× integratore di N2, 1× integratore di B27, 0,15 mM HEPES, 40 ng/mL EGF, 10 μM Y-27632 e 50 μM A83-01.
NOTA: Mantenere la conservazione congelata di H-EOCM a -20° C per sei mesi di conservazione.
- Preparazione H-EOCM
- Preparazione pre-sperimentale
- Scongelare l'H-EOCM mantenendolo a 4 °C per 4 ore.
2. Insediamento dell'organoide esofageo umano
- Preparazione dei materiali
- Scongelare la matrice della membrana basale e l'H-EOCM a 4 °C. Sterilizza le forbici e le pinzette chirurgiche per il prossimo esperimento.
- Pre-raffreddare i puntali delle pipette a 4 °C. Preriscaldare la piastra a 24 pozzetti a 37 °C.
- Processazione tissutale e isolamento cellulare
NOTA: Il tessuto tumorale ESCC, le lesioni displastiche (≤2 cm dal margine tumorale) e il tessuto esofageo normale abbinato (≥5 cm dal margine tumorale) sono stati raccolti dagli stessi individui con ESCC sottoposti a resezione chirurgica. Inoltre, i campioni esofagei multistadio sono stati ottenuti attraverso un programma di diagnosi precoce e screening ESCC, come descritto nei nostri studi precedenti 6,7.- Pulire il campione con un tampone di lavaggio a temperatura ambiente (PBS contenente 1×Anti-Anti e 0,15 mM HEPES) in provette da centrifuga da 5 mL tre volte.
NOTA: Lavare i campioni più di tre volte per ridurre il rischio di contaminazione. - Tritare il fazzoletto in 1 mm3 frammenti usando le forbici sterili. Trasferire i frammenti in provette da centrifuga da 1,5 mL.
- Sospendere il campione con 1 mL di tampone di digestione e agitarlo a 37 °C, 50-100 giri/min, per 10-20 minuti per digerire il tessuto.
- Centrifugare la miscela a 400 x g per 5 minuti a 4 °C. Scartare il surnatante.
- Risospendere il precipitato in 500 μL di tripsina-EDTA allo 0,025%. Incubare a 37 °C per 10 min. Aggiungere 1 mL di DMEM integrato con il 10% di FBS per fermare l'attività enzimatica.
- Far passare la sospensione attraverso un filtro sterile da 70 μm. Raccogliere il filtrato in una provetta da centrifuga da 1,5 mL.
- Centrifugare il filtrato per 5 minuti a 400 x g a 4 °C. Scartare il surnatante. Risospendere le cellule con 100 μL di H-EOCM.
- Pulire il campione con un tampone di lavaggio a temperatura ambiente (PBS contenente 1×Anti-Anti e 0,15 mM HEPES) in provette da centrifuga da 5 mL tre volte.
- Semina di organoidi
- Determinare la densità cellulare, quindi preparare una provetta da centrifuga fresca da 1,5 mL con 5.000-15.000 cellule in sospensione.
- Centrifugare per 5 minuti a 400 x g a 4 °C. Aspirare con cura il surnatante. Risospendere delicatamente le cellule in 50-100 μL di matrice della membrana basale in modo uniforme.
NOTA: Conservare la matrice della membrana basale a 4 °C per evitare la solidificazione. - Aggiungere 50 μl di matrice di membrana basale con le cellule miste al centro di ciascuna piastra a 24 pozzetti. Polimerizzare la matrice della membrana basale attraverso l'incubazione a 37 °C (durata 30 min).
- Aggiungere 500 μl di H-EOCM preriscaldato (37 °C) per coprire la matrice della membrana basale. Coltura degli organoidi in un incubatore umidificato al 5% di CO2 a 37 °C.
- Ricambio medio
- Aspirare il terreno esausto e rabboccare con 500 μl di H-EOCM fresco (riscaldato a 37 °C).
NOTA: Sostituire H-EOCM a intervalli di 3 giorni.
- Aspirare il terreno esausto e rabboccare con 500 μl di H-EOCM fresco (riscaldato a 37 °C).
3. Passaggio di organoidi
- Preparazione dei materiali
- Scongelare la matrice della membrana basale e l'H-EOCM a 4 °C. Pre-raffreddare i puntali delle pipette a 4 °C. Preriscaldare la piastra a 24 pozzetti a 37 °C.
- Digestione dell'organoide
- Rimuovere delicatamente il mezzo H-EOCM. Aggiungere 500 μl di tampone di passaggio pre-raffreddato (Advanced DMEM/F12 contenente 1× Anti-Anti e 0,15 mM HEPES, pre-raffreddato a 4 °C) nel pozzetto per fondere la matrice della membrana basale.
- Combinare la matrice della membrana basale con il tampone di passaggio in una provetta da centrifuga da 1,5 mL. Lavare il pozzetto con 500 μl di tampone di passaggio pre-raffreddato e raccogliere il tampone per recuperare eventuali organoidi rimanenti.
- Centrifugare il tampone per 5 minuti a 400 x g a 4 °C. Aspirare delicatamente il surnatante. Aggiungere 500 μL di tripsina ricombinante nella provetta e incubare per la digestione enzimatica (37 °C, 15 min). Risospendere a intervalli di 5 minuti.
- Centrifugare il campione digerito (400 x g, 5 min, 4 °C). Scartare il surnatante. Ripetere i passaggi 3.2.6 e 3.2.7. Risospendere le cellule in 100 μL di H-EOCM.
- Semina di organoidi
- Per la semina di organoidi, ripetere il passaggio 2.3.
4. Congelamento e recupero degli organoidi
- Congelamento di organoidi
- Per la preparazione dei materiali, ripetere il passaggio 2.1.
- Per la digestione degli organoidi, ripetere il passaggio 3.2.
- Congelamento di organoidi
- Determinare la densità cellulare, quindi preparare una nuova provetta da centrifuga da 1,5 mL con 10.000 cellule in sospensione.
- Centrifugare i campioni a 400 x g per 5 minuti a RT. Aspirare accuratamente il surnatante.
- Risospendere le cellule con 500-1000 μL di terreno di crioconservazione. Trasferire in un nuovo criotubo. Congelare la crioprovetta a -80 °C per 24 ore. Archiviazione in un sistema di stoccaggio di azoto liquido per una conservazione prolungata.
- Scongelamento dell'organoide di congelamento
- Per la preparazione dei materiali, ripetere il passaggio 2.1.
- Scongelamento dell'organoide di congelamento
- Scongelare rapidamente la crioprovetta in un bagno d'acqua a 37 °C per 2-3 minuti. Trasferire il materiale congelato in 9 mL di coltura basale preriscaldata (37 °C) e risospendere le cellule in modo uniforme.
- Centrifugare la sospensione cellulare per 5 minuti a 400 x g (a RT). Aspirare con cura il surnatante.
- Semina di organoidi
- Per la semina degli organoidi, ripetere il passaggio 2.3.
5. Analisi istologica di organoidi
- Preparazione di sezioni incluse in paraffina
- Preparazione dei materiali
- Sterilizzare 50 mL di matrice di inclusione (soluzione acquosa: 2% agar + 2,5% gelatina) in un pallone da 250 mL in autoclave. Aliquotare 5 mL in provette da centrifuga da 15 mL. Conservare a temperatura ambiente.
- Fissaggio di organoidi
- Ripetere i passaggi 3.2.1-3.2.2. Risospendere il precipitato con 1 mL di tampone di passaggio in una provetta fresca da 1,5 mL.
- Centrifugare a 400 x g a 4 °C per 5 min. Rimuovere il surnatante. Risospendere gli organoidi in 500 μL di paraformaldeide al 4% (PFA). Incubare a temperatura ambiente per 1 ora o a 4 °C per almeno 6 ore.
- Incorporazione di organoidi
- Centrifugare la miscela (400 x g, 5 min, RT). Rimuovere il surnatante. Aggiungere 1 mL del tampone di passaggio nella provetta e risospendere la precipitazione.
- Centrifugare la miscela (400 x g, 5 min, RT). Rimuovere il surnatante.
- Inserire una provetta (15 mL) con il terreno di inclusione (5 mL) nel bagno d'acqua (contenitore da 100 mL, 150 mL). Microonde alla massima potenza fino a quando l'acqua inizia a bollire.
NOTA: Svitare il tappo della provetta da 15 ml prima di cuocere nel microonde. - Risospendere gli organoidi con 50 μL di gel da inclusione in una provetta da centrifuga da 1,5 mL. Raffreddare il tubo a 4 °C fino a quando il gel non si indurisce completamente.
- Trasferire il gel solidificato in etanolo al 70%. Conservare a 4 °C.
- Preparazione del blocco di paraffina
- Disidratare il gel attraverso la serie di etanolo (30% → 50% → 70% → 80% → 95% → 100%), 30 minuti per concentrazione.
- Mettere il gel solidificato in xilene trasparente per 30 minuti. Immergere il gel solidificato nella paraffina e incorporarlo utilizzando una stazione di paraffina riscaldata.
- Tagliare fette spesse 4 μm con un microtomo. Montare su slitte e asciugare a 65 °C per 1 ora. Conservare in condizioni asciutte.
- Preparazione dei materiali
- Colorazione immunoistochimica (IHC) di fette di organoidi
- Deceratura e idratazione
- Scaldare le fette in agente schiarente a 65 °C per 40 min. Immergere il vetrino in un agente detergente per tessuti fresco a temperatura ambiente per 20 minuti.
- Processare i vetrini attraverso vassoi di vetro contenenti etanolo della serie: immergere in etanolo al 100% per 10 minuti e ripetere una volta, quindi trasferire a etanolo al 95% per 5 minuti, quindi a etanolo all'85% per 5 minuti, quindi a etanolo al 75% per 5 minuti e infine a immergere in PFA al 4% per 10 minuti.
- Aggiungere acqua sterilizzata nella camera termostabile e mantenere 5 minuti sullo shaker a 80 giri/min. Ripetere questo passaggio due volte.
- Recupero dell'antigene
- Aggiungere la soluzione di recupero dell'antigene Tris-EDTA (pH 9,0) alla camera termostabile per immergere i vetrini. Microonde la camera termostabile contenente i vetrini alla massima intensità (700 W, 3 min) fino all'ebollizione. Mantieni il microonde a una bassa potenza (70 W, 15 min) e raffredda a temperatura ambiente.
- Lavare in acqua distillata per 2 minuti su uno shaker a 80 giri/min. Ripeti due volte. Cerchia la posizione degli organoidi con una penna istologica.
- Blocco della perossidasi
- Versare la soluzione bloccante della perossidasi per coprire l'area del campione. Incubare in una camera di umidità a temperatura ambiente per 20 min.
- Trasferire i vetrini in una camera termostabile. Lavare in PBST (PBS + 0,1% Tween 20) per 2 min a 80 giri/min. Ripeti due volte.
- Incubazione degli anticorpi primari
- Rimuovere delicatamente le goccioline di PBST in eccesso sui vetrini.
NOTA: Evitare di toccare gli organoidi sui vetrini. - Far cadere l'anticorpo primario diluito per coprire l'area dell'organoide. Incubare in una camera di umidità per 2 ore a temperatura ambiente, o 8-14 ore a 4 °C. Ripetere questo passaggio.
- Rimuovere delicatamente le goccioline di PBST in eccesso sui vetrini.
- Incubazione secondaria degli anticorpi
- Ripetere il passaggio 5.2.4.1. Far cadere l'anticorpo secondario HRP diluito per coprire l'area dell'organoide. Incubare in una camera di umidità a temperatura ambiente per 20 min. Ripetere questo passaggio.
- Colorazione DAB (3,3′-Diaminobenzidina)
- Ripetere il passaggio 5.2.4.1. Rilasciare 1× DAB per coprire l'area dell'organoide. Incubare in una camera di umidità a temperatura ambiente fino a quando il colore diventa marrone.
- Immergere i vetrini in acqua distillata per 5-10 s per terminare il cambiamento di colore. Ripeti il passaggio.
- Colorazione con ematossilina
- Colorare in ematossilina per 5-8 min. Differenziare in alcol acido all'1% (HCl 1% in alcol al 70%) per 5-10 s.
- Immergere i vetrini in acqua distillata per 5-10 s. Ripetere questo passaggio.
- Disidratazione
- Elaborare i vetrini attraverso vassoi di vetro in ordine sequenziale: immergere in etanolo al 75% per 5 minuti, trasferire in etanolo all'85% per 5 minuti, passare a etanolo al 95% per 5 minuti, seguiti da due immersioni separate in etanolo al 100% per 10 minuti ciascuna e infine immergere in xilene per due periodi successivi di 20 minuti.
- Montaggio a slitta
- Aggiungi lo xilene alla gomma neutra finché non diventa trasparente. Asciugare leggermente all'aria. Quindi, versare la gomma con xilene per coprire l'area dell'organoide.
- Applicare il vetrino coprioggetti. Scansiona e analizza il vetrino.
- Deceratura e idratazione
- Colorazione a immunofluorescenza multiplex (mIF)
- Per la deceratura e l'idratazione, ripetere il passaggio 5.2.1.
- Per il blocco della perossidasi, ripetere il passaggio 5.2.3.
- Per il recupero dell'antigene, ripetere il passaggio 5.2.3.
- Blocco del siero di pecora.
- Ripetere il passaggio 5.2.4.1. Aggiungere la soluzione bloccante del siero di pecora per coprire l'area dell'organoide. Incubare in una camera di umidità a temperatura ambiente per 30 min.
- Lavare in PBST per 2 minuti. Ripetere due volte.
- Per l'incubazione degli anticorpi primari, ripetere il passaggio 5.2.4.
- Per l'incubazione degli anticorpi secondari, ripetere il passaggio 5.2.4.1.
- Rilasciare una soluzione di anticorpi secondari specifici per coprire l'area dell'organoide. Incubare in una camera di umidità a temperatura ambiente per 20 min. Ripetere il passaggio 5.2.3.2.
NOTA: Proteggere i vetrini dalla luce da questo passaggio fino alla fine dell'esperimento.
- Rilasciare una soluzione di anticorpi secondari specifici per coprire l'area dell'organoide. Incubare in una camera di umidità a temperatura ambiente per 20 min. Ripetere il passaggio 5.2.3.2.
- Colorazione con colorante fluorescente
- Ripetere il passaggio 5.3.4.1. Far cadere la soluzione di colorante fluorescente per coprire l'area dell'organoide.
- Incubare in una camera di umidità a temperatura ambiente per 10-20 min. Ripetere il passaggio 5.2.3.2.
- Per la colorazione multipla, ripetere i passaggi 5.3.3-5.3.7.
- Colorazione DAPI
- Ripetere il passaggio 5.2.4.1. Versare la soluzione DAPI per coprire l'area dell'organoide. Ripetere il passaggio 5.2.3.2. Quindi, ripetere il passaggio 5.3.4.2.
- Immergere i vetrini in acqua sterilizzata per 2 minuti.
- Montaggio a slitta
- Far cadere il mezzo di montaggio antisbiadimento per coprire l'area dell'organoide. Applicare il vetrino coprioggetti.
- Acquisisci immagini digitali utilizzando uno scanner per diapositive e analizzale.
Risultati
Questo protocollo descrive il campionamento degli organoidi e l'analisi istologica in diverse fasi della tumorigenesi ESCC (Figura 1). Campionando la mucosa esofagea normale, la neoplasia intraepiteliale di basso grado (LGIN), la neoplasia intraepiteliale di alto grado (HGIN) e i tessuti tumorali di pazienti con ESCC, è possibile costruire organoidi che rappresentano diversi stadi di tumorigenesi. Inoltre, sono stati eseguiti l'inclusione e il sezionamento di paraffina di questi organoidi, seguiti da colorazione in immunofluorescenza.
Per studiare l'espressione di molecole immunosoppressive e le caratteristiche morfologiche dei cloni cellulari durante la tumorigenesi, sono stati raccolti tessuti epiteliali esofagei da vari stadi di sviluppo tumorale e sono stati condotti coloraggi in immunofluorescenza. Dopo aver completato la colorazione, sono stati definiti quattro pseudo-colori per i pennarelli prima della scansione dei vetrini. A PD-L1, Ki-67 e KRT6A sono stati assegnati pseudo-colori di verde, rosso e grigio, rispettivamente, mentre i nuclei cellulari sono stati marcati con DAPI. I risultati sperimentali hanno mostrato che la morfologia degli organoidi della mucosa esofagea è cambiata durante la tumorigenesi, diventando principalmente più disorganizzata. La colorazione in immunofluorescenza ha rivelato che con il progredire della tumorigenesi, la proliferazione delle cellule epiteliali è cambiata, accompagnata da un'elevata espressione di molecole immunosoppressive come PD-L1 (Figura 2).
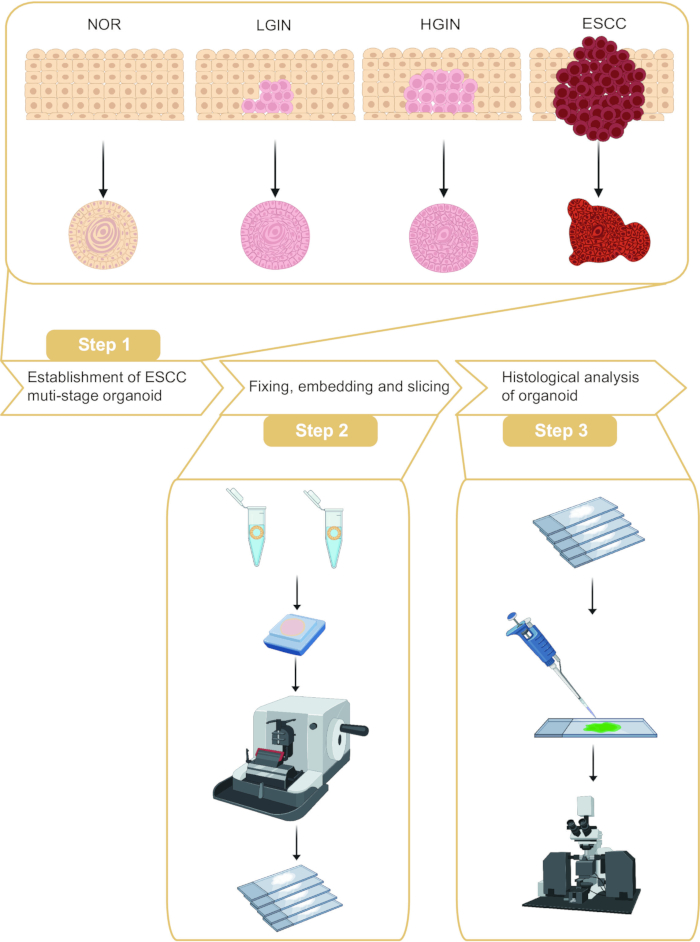
Figura 1: Flusso di lavoro dell'insediamento e dell'analisi istologica di organoidi di carcinoma esofageo a cellule squamose (ESCC) multistadio. Clicca qui per visualizzare una versione più grande di questa figura.
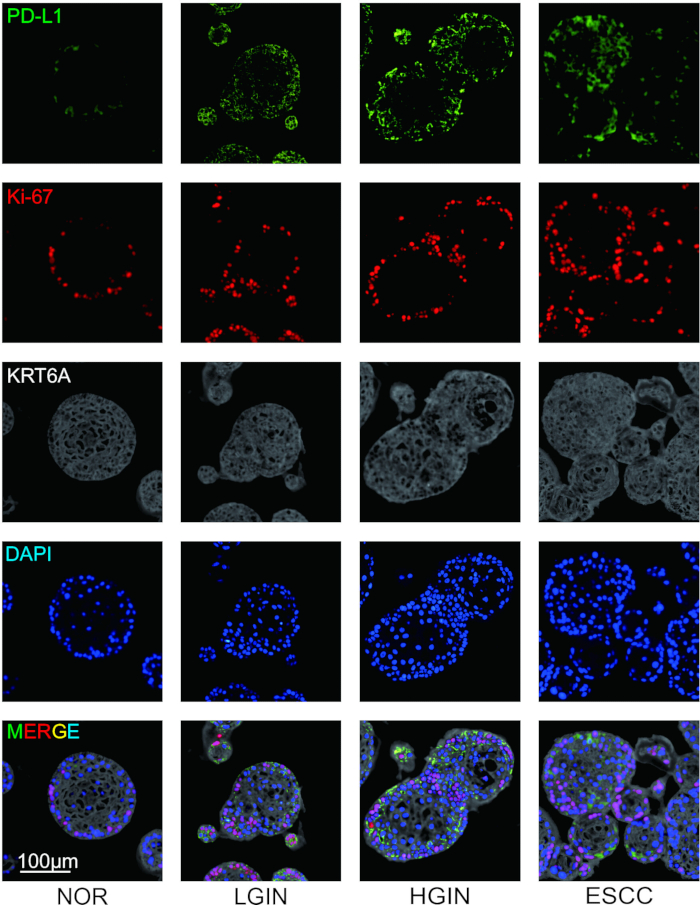
Figura 2: Colorazione in immunofluorescenza multiplex (mIF) dell'organoide ESCC multistadio. Immagini rappresentative che mostrano l'espressione di PD-L1 (verde), Ki-67 (rosso) e KRT6A (grigio). Barre graduate = 100 μm. NOR, mucosa normale; LGIN, neoplasia intraepiteliale di basso grado; LGIN, neoplasia intraepiteliale di alto grado. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La costituzione e l'analisi istologica degli organoidi rappresentano un progresso significativo nella modellazione della progressione tumorale. Il protocollo offre notevoli vantaggi rispetto ai metodi esistenti per lo studio della tumorigenesi20. A differenza dei tradizionali sistemi di coltura cellulare 2D, gli organoidi mantengono un'architettura tridimensionale complessa e un'eterogeneità cellulare che riflette meglio le condizioni in vivo. Rispetto ai modelli animali, gli organoidi derivati da tessuti umani rappresentano in modo più accurato le caratteristiche della malattia umana 9,21,22. L'incorporazione della colorazione a immunofluorescenza multiplex consente la visualizzazione simultanea di più marcatori, fornendo informazioni sulle relazioni spaziali tra le molecole chiave e l'architettura dei tessuti durante l'evoluzione del tumore. Utilizzando questo protocollo avanzato, questo studio ha rivelato cambiamenti dinamici significativi nel carcinoma esofageo a cellule squamose, dimostrando in particolare che i livelli di proliferazione delle cellule tumorali si sono spostati progressivamente durante lo sviluppo del tumore, accompagnati da corrispondenti cambiamenti nell'espressione della molecola immunosoppressiva PD-L1.
Questo protocollo fornisce una metodologia completa per studiare i cambiamenti morfologici e molecolari durante la tumorigenesi, con diverse fasi critiche che richiedono particolare attenzione. Il tempo di digestione durante l'elaborazione dei tessuti deve essere attentamente monitorato, poiché una digestione eccessiva può portare a un'eccessiva morte cellulare, mentre una digestione insufficiente provoca uno scarso isolamento cellulare. Inoltre, il controllo della temperatura durante la manipolazione della matrice della membrana basale è fondamentale: la matrice deve essere mantenuta a 4 °C per prevenire la polimerizzazione prematura mantenendo la vitalità cellulare.
Tuttavia, è necessario riconoscere alcuni limiti della tecnica. L'assenza di componenti immunitarie e cellule stromali nel sistema di coltura di base degli organoidi potrebbe non ricapitolare completamente le interazioni tumore-microambiente23,24. Questa limitazione può essere parzialmente affrontata attraverso sistemi di co-coltura, sebbene tali modifiche richiedano un'attenta ottimizzazione. Infine, anche lo scongelamento degli organoidi è una questione importante. Secondo l'esperienza precedente, il tasso di successo dello scongelamento degli organoidi congelati non è elevato. Pertanto, si consiglia agli utenti di congelare gli organoidi con cautela.
Le implicazioni cliniche di questo protocollo sono sostanziali, in particolare nel consentire la modellazione della progressione multistadio da NOR attraverso LGIN e HGIN fino al carcinoma invasivo6. Gli organoidi derivati da pazienti generati utilizzando questa metodologia fungono da strumenti preziosi per la ricerca e la medicina personalizzata, consentendo l'identificazione di marcatori molecolari associati alla progressione della malattia25,26.
Questo protocollo può essere adattato per varie applicazioni nella ricerca sul cancro e nello sviluppo di farmaci. La metodologia può essere estesa per studiare altri tumori epiteliali e modificata per incorporare ulteriori tecniche di analisi come il sequenziamento di singole cellule27,28. Inoltre, gli adattamenti futuri potrebbero incorporare fibroblasti e cellule immunitarie associati al cancro derivati da pazienti per modellare le interazioni tumore-stroma-sistema immunitario o integrare l'editing CRISPR per studiare i driver genetici, espandendo la sua utilità nella ricerca traslazionale e nella previsione della risposta alla terapia29,30.
Questo protocollo introduce i metodi di costruzione e congelamento di organoidi provenienti da vari stadi di tumorigenesi dell'ESCC. Ancora più importante, in questo articolo vengono descritte le tecniche di inclusione, sezionamento, IHC e colorazione mIF per organoidi. Riteniamo che questi metodi di inclusione, affettatura e colorazione degli organoidi possano essere applicati ai metodi di colorazione degli organoidi di più fonti di organi, incluso l'esofago. Questo approccio può anche aiutare i ricercatori a osservare la relazione tra l'espressione molecolare rilevante e la struttura spaziale.
Divulgazioni
Gli autori dichiarano di non avere conflitti finanziari o di interesse concorrenti.
Riconoscimenti
Gli autori ringraziano tutti i pazienti e i medici che partecipano alla ricerca presso il Cancer Hospital, l'Accademia cinese delle scienze mediche (CAMS) e il Peking Union Medical College (PUMC). Questo studio è finanziato dalla National Natural Science Foundation of China (da 82203156 a S.Z.), dal National Key Research and Development Program of China (2023YFC3503200 a S.Z.) e dal Fondo per l'innovazione dell'Accademia cinese delle scienze mediche per le scienze mediche (2023-I2M-QJ-002 a S.Z.). La Figura 1 viene creata con BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Merck | Cat#SLGPR33RB | |
| 24-well plate | Corning | Cat#3524 | |
| 4% Paraformaldehyde | Beyotime | Cat# P0099 | |
| 70 μm sterile strainer | Falcon | Cat#352350 | |
| A83-01 | Tocris Bioscience | Cat# 2939 | |
| Advanced DMEM/F12 | Gibco | Cat# 12634028 | |
| Agar | Solarbio | Cat# A8190 | |
| Anti-Anti (Antibiotic-Antimycotic) | Gibco | Cat# 15240062 | |
| B-27 supplement | Gibco | Cat# 17504044 | |
| CO2 incubator | Thermo | Cat#371GPCN | |
| Collagenase IV | Gibco | Cat# 17104019 | |
| Cryostor | STEMCELL | Cat# 07930 | |
| DMEM | Corning | Cat# 10-013-CV | |
| EGF | Gibco | Cat# PHG0313 | |
| Fetal bovine serum | Cell Technologies | Cat# 30070 | |
| G-418 | Sigma | Cat# A1720 | |
| Gelatin | Solarbio | Cat# G8061 | |
| GlutaMAX | Gibco | Cat# 35050061 | |
| Growth factor-reduced Matrigel | Corning | Cat# 354230 | |
| HE staining kit | Beijing Yili Fine Chemicals Co., Ltd | NA | |
| HEPES | Gibco | Cat# 15630080 | |
| Histological pen | Zsbio | Cat#ZLI-9305 | |
| Hygromycin B | Sigma | Cat# 400050 | |
| Immunohistochemical staining kit | ZSGB-BIO | PV-8000 | |
| L-WRN | ATCC | CRL-3276; RRID:CVCL_DA06 | |
| N-2 supplement | Gibco | Cat# 17502048 | |
| Neutral gum | Zsbio | Cat#ZLI-9555 | |
| Opal 5-Color Manual IHC Kit | PANOVUE | Cat# 10144100100 | |
| PBS | MeilunBio | Cat#MA0015 | |
| Rabbit Monoclone anti-PD-L1 | CST | Cat# 13684; RRID:AB_2687655 | |
| Rabbit Polyclonal anti-Ki67 | Abcam | Cat# ab16667; RRID:AB_302459 | |
| Rabbit Polyclonal anti-KRT6A | Proteintech | Cat# 10590-1-AP; RRID: AB_2134306 | |
| Sheep serum | Zsbio | Cat#ZLI-9056 | |
| TrypLE Express | Gibco | Cat# 12604021 | |
| TrypLE-EDTA | Gibco | Cat#15400-054 | |
| Whole slide image scanner | Hamamatsu | Cat#C13210 | |
| Y-27632 | Selleck Chemicals | Cat# S1049 |
Riferimenti
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon