Method Article
Establecimiento y análisis histológico de organoides esofágicos que modelan la progresión de tejidos normales a cancerosos
* Estos autores han contribuido por igual
En este artículo
Resumen
El presente protocolo describe el establecimiento y análisis histológico de modelos de organoides esofágicos que representan diferentes etapas de la progresión tumoral. Este método permite a los investigadores estudiar los cambios en la morfología celular, la organización espacial y los patrones de expresión de marcadores moleculares durante la transición de tejidos normales a cancerosos.
Resumen
Los organoides se han convertido en una herramienta fundamental para avanzar en la comprensión de la tumorigénesis y la terapia del cáncer. Mediante la generación de modelos de organoides humanos que representan diferentes estadios tumorales y la realización de análisis histológicos, es posible obtener una comprensión más profunda de las alteraciones en la morfología celular, la arquitectura espacial y la expresión de marcadores moleculares clave a medida que el tumor progresa. Este estudio presenta un protocolo completo para el establecimiento y cultivo de organoides de células escamosas esofágicas. Además, el protocolo describe métodos para evaluar los patrones de expresión y la organización espacial de las moléculas críticas dentro de los organoides, utilizando técnicas como la fijación, la inclusión y la tinción. A través de este protocolo, se identificaron cambios significativos en la estructura espacial de las células epiteliales escamosas esofágicas y en la expresión de diversos biomarcadores tumorales durante la tumorigénesis. El protocolo facilita la construcción y el análisis histológico de organoides, lo que permite a los investigadores investigar la arquitectura espacial y las alteraciones moleculares de las células epiteliales en diferentes etapas de la tumorigénesis y la intervención terapéutica.
Introducción
La tumorigénesis es un proceso complejo y polietápico caracterizado por cambios moleculares y morfológicos progresivos en las células 1,2. El carcinoma de células escamosas de esófago (ESCC), una neoplasia maligna prevalente con mal pronóstico 3,4, ejemplifica esta progresión escalonada a través de cuatro estadios distintos: mucosa normal, neoplasia intraepitelial de bajo grado (LGIN), neoplasia intraepitelial de alto grado (HGIN) y carcinoma invasivo5. A lo largo de estas etapas, las células epiteliales exhiben cambios dinámicos en los patrones de expresión molecular y organización espacial, acompañados de alteraciones sistemáticas en la morfología del tejido a medida que avanza de un estado normal a uno maligno 6,7. A pesar de los avances en la comprensión de la patogénesis de las ESCC, la falta de modelos experimentales que recapitulen fielmente los aspectos espaciales y temporales de la evolución tumoral, al tiempo que permiten análisis histológicos y moleculares sistemáticos, ha obstaculizado una comprensión mecanicista más profunda de la progresión de la enfermedad y el desarrollo terapéutico.
Si bien las líneas celulares cancerosas inmortalizadas en 2D han hecho contribuciones significativas a la comprensión de la oncogénesis, son inherentemente limitadas para replicar la complejidad biológica y las característicaspatológicas de los tumores nativos. Los modelos animales, aunque proporcionan un contexto in vivo, a menudo predicen mal las respuestas humanas debido a las diferencias específicas de cada especie9. Por el contrario, los organoides han surgido como una plataforma preclínica transformadora que preserva fielmente la heterogeneidad celular, la arquitectura y la funcionalidad de los tejidos humanos 10,11,12,13. Como modelos preclínicos, los organoides capturan mejor las características de los tumores primarios, lo que permite una investigación detallada de los eventos moleculares clave y los cambios celulares durante la progresióntumoral 14. Por ejemplo, Chen et al. utilizaron organoides esofágicos derivados de pacientes de diferentes etapas de ESCC para dilucidar las interacciones epitelial-fibroblastos, validando finalmente el eje de señalización ANXA1-FPR2 como un impulsor crítico de la patogénesis de ESCC6. De manera similar, Ko et al. emplearon organoides esofágicos modificados genéticamente para identificar los determinantes genéticos clave que impulsan el inicio de la ESCC y la evasión inmune, demostrando cómo los modelos de organoides pueden recapitular eficazmente las características de la enfermedad y revelar nuevos objetivos terapéuticos15.
La presente metodología resuelve problemas significativos en el modelado del cáncer de esófago mediante el establecimiento de un protocolo reproducible para generar organoides ESCC multietapa que reflejan la progresión histológica desde el epitelio normal hasta el carcinoma invasivo. Este sistema integra condiciones de cultivo optimizadas utilizando un medio condicionado con L-WRN para mantener la tallo epitelial, combinado con protocolos estandarizados para el procesamiento histológico y el análisis de inmunofluorescencia múltiple (mIF), proporcionando una plataforma ideal para analizar longitudinalmente los cambios espaciales y moleculares durante la tumorigénesis. En comparación con técnicas alternativas como los cultivos 2D, esta plataforma de organoides preserva de manera única la arquitectura del tejido, lo que permite la visualización de marcadores moleculares organizados espacialmente, incluida la proteína de punto de control inmunitario PD-L1 (CD274), que media la evasión inmunitaria tumoral al inhibir las respuestas de las células T 16,17,18y el marcador de proliferación Ki-67. El protocolo permite el paso de organoides de tejidos esofágicos y precancerosos normales, lo que ayuda a los investigadores a construir un modelo de organoide continuo desde el tejido normal hasta el tumor19. Al permitir un análisis detallado de los cambios espaciales y moleculares durante la tumorigénesis, este protocolo ofrece a los investigadores una poderosa herramienta para comprender los mecanismos que subyacen al desarrollo y la progresión del cáncer, lo que podría conducir a mejores estrategias terapéuticas.
Esta metodología es especialmente adecuada para los investigadores que investigan la carcinogénesis epitelial, las interacciones del microambiente tumoral o las respuestas terapéuticas en las neoplasias malignas escamosas y ESCC relacionadas. Su diseño modular permite la adaptación para estudiar otros marcadores moleculares o vías de señalización, siempre que se incorporen los pasos de validación adecuados. Al ofrecer una plataforma estandarizada pero flexible, este protocolo tiene como objetivo avanzar en la investigación preclínica en biología tumoral y acelerar la traducción de los conocimientos mecanicistas en terapias dirigidas.
Protocolo
Este estudio fue aprobado por la Junta de Revisión Institucional del Hospital del Cáncer de la Academia China de Ciencias Médicas (Aprobación Nos. 20/069-2265, 22/221-3423 y 23/305-4047). Se obtuvieron muestras de tejido esofágico de pacientes sometidos a cirugía o detección temprana de carcinoma de células escamosas de esófago (ESCC) en el Hospital del Cáncer de la Academia China de Ciencias Médicas entre 2021 y 2024, con el fin de establecer organoides esofágicos humanos. Ninguno de los pacientes incluidos en este estudio había recibido quimioterapia o radioterapia antes de la toma de muestra. Se obtuvo el consentimiento informado de todos los participantes y se obtuvo información clínica relevante de las historias clínicas. Una lista completa de los reactivos y equipos utilizados en este estudio se proporciona en la Tabla de Materiales.
1. Preparación de organoides epiteliales esofágicos
- Preparación del medio acondicionado con L-WRN
- Preparación de la línea celular L-WRN
- Descongele la línea celular L-WRN (almacenamiento a -80 °C) en un baño de agua a 37 °C durante 1-2 min. Mezclar con 5 mL de medio de cultivo basal precalentado (DMEM suplementado con 10% de FBS).
- Centrifugar la mezcla a 200 x g durante 5 min a temperatura ambiente (RT).
- Deseche el sobrenadante. Vuelva a suspender las células con 2-3 mL de medio de selección fresco precalentado (DMEM que contiene 10% de FBS, 0,5 mg/mL de higromicina B y 0,5 mg/mL de G-418).
NOTA: Mantenga el medio a 4 °C (almacenamiento máximo 1 mes). - Transfiera las células a una placa de cultivo de 10 cm que contenga el medio de selección. Cultive las células a 37 °C en una incubadora humidificada con 5% de CO2 .
- Paso de la línea celular L-WRN
- Disociar las células confluentes utilizando tripsina-EDTA al 0,025% (1-2 min a 37 °C) y dividirlas en una proporción de 1:2.
- Recogida del medio acondicionado L-WRN
- Reemplace el medio de cultivo con el medio de cultivo basal al 80% de confluencia celular. Transfiera el sobrenadante a un tubo de centrífuga.
- Filtre a través de una membrana de 0,22 μm para eliminar los desechos celulares. Recoja el filtrado como un medio acondicionado con L-WRN.
NOTA: Mantenga el medio acondicionado con L-WRN a 4 °C (1 semana) o a -80 °C (6 meses).
- Preparación de la línea celular L-WRN
- Preparación del medio de cultivo de organoides esofágicos humanos (H-EOCM)
- Preparación de H-EOCM
- Vértice el medio acondicionado con L-WRN (volumen de 1,5 mL) después de 4 h de equilibrio a 4 °C.
- Combine el medio Advanced DMEM/F12 con estos aditivos para crear H-EOCM: 3% de medio acondicionado con L-WRN, 1× Anti-Anti, 1× L-glutamina, 1× suplemento de N2, 1× suplemento de B27, 0,15 mM de HEPES, 40 ng/mL de EGF, 10 μM Y-27632 y 50 μM A83-01.
NOTA: Mantenga el almacenamiento congelado de H-EOCM a -20 ° C para su conservación durante seis meses.
- Preparación de H-EOCM
- Preparación pre-experimental
- Descongele el H-EOCM manteniéndolo a 4 °C durante 4 h.
2. Establecimiento de un organoide esofágico humano
- Preparación de materiales
- Descongelar la matriz de la membrana basal y el H-EOCM a 4 °C. Esteriliza las tijeras quirúrgicas y las pinzas para el próximo experimento.
- Enfriar previamente las puntas de pipeta a 4 °C. Precaliente la placa de 24 pocillos a 37 °C.
- Procesamiento de tejidos y aislamiento celular
NOTA: Se recolectaron tejido tumoral ESCC, lesiones displásicas (a ≤2 cm del margen tumoral) y tejido esofágico normal compatible (a ≥5 cm del margen tumoral) de los mismos individuos con ESCC que se sometieron a resección quirúrgica. Además, se obtuvieron muestras esofágicas polietápicas a través de un programa de detección precoz y cribado ESCC, tal como se describe en nuestros estudios previos 6,7.- Limpie la muestra con tampón de lavado a temperatura ambiente (PBS que contiene 1×Anti-Anti y 0,15 mM HEPES) en tubos de centrífuga de 5 mL tres veces.
NOTA: Lave las muestras más de tres veces para reducir el riesgo de contaminación. - Picar el tejido en fragmentos de 1 mm3 con unas tijeras estériles. Transfiera los fragmentos a tubos de centrífuga de 1,5 mL.
- Suspender la muestra con 1 mL de tampón de digestión y agitarla a 37 °C, 50-100 rpm, durante 10-20 min para digerir el tejido.
- Centrifugar la mezcla a 400 x g durante 5 min a 4 °C. Deseche el sobrenadante.
- Resuspender el precipitado en 500 μL de tripsina-EDTA al 0,025%. Incubar a 37 °C durante 10 min. Añadir 1 mL de DMEM suplementado con 10% de FBS para detener la actividad enzimática.
- Pase la suspensión a través de un filtro estéril de 70 μm. Recoja el filtrado en un tubo de centrífuga de 1,5 ml.
- Filtrado de centrífuga durante 5 min a 400 x g a 4 °C. Deseche el sobrenadante. Vuelva a suspender las células con 100 μL de H-EOCM.
- Limpie la muestra con tampón de lavado a temperatura ambiente (PBS que contiene 1×Anti-Anti y 0,15 mM HEPES) en tubos de centrífuga de 5 mL tres veces.
- Siembra de organoides
- Determine la densidad de celdas, luego prepare un tubo de centrífuga nuevo de 1,5 mL con 5.000-15.000 celdas en suspensión.
- Centrifugar durante 5 min a 400 x g a 4 °C. Aspire el sobrenadante con cuidado. Reimplante suavemente las células en 50-100 μL de la matriz de la membrana basal de manera uniforme.
NOTA: Almacene la matriz de la membrana basal a 4 °C para evitar la solidificación. - Agregue 50 μL de matriz de membrana basal con las células mezcladas al centro de cada placa de 24 pocillos. Polimerizar la matriz de la membrana basal a 37 °C de incubación (30 min de duración).
- Añadir 500 μL de H-EOCM precalentado (37 °C) para cubrir la matriz de la membrana basal. Cultivar los organoides en una incubadora humidificada con 5% de CO2 a 37 °C.
- Reemplazo de medio
- Aspire el medio gastado y reponga con 500 μL de H-EOCM fresco (calentado a 37 °C).
NOTA: Reemplace H-EOCM a intervalos de 3 días.
- Aspire el medio gastado y reponga con 500 μL de H-EOCM fresco (calentado a 37 °C).
3. Pasaje de organoides
- Preparación de materiales
- Descongelar la matriz de la membrana basal y el H-EOCM a 4 °C. Enfriar previamente las puntas de pipeta a 4 °C. Precaliente la placa de 24 pocillos a 37 °C.
- Digestión de organoides
- Retire el medio H-EOCM con cuidado. Añada 500 μL de tampón de paso preenfriado (Advanced DMEM/F12 que contiene 1× Anti-Anti y 0,15 mM de HEPES, preenfriado a 4 °C) en el pocillo para fundir la matriz de la membrana basal.
- Combine la matriz de la membrana basal con el tampón de paso en un tubo de centrífuga de 1,5 mL. Lave el pocillo con 500 μL de tampón de paso preenfriado y recoja el tampón para recuperar los organoides restantes.
- Centrifugar el tampón durante 5 min a 400 x g a 4 °C. Aspirar el sobrenadante suavemente. Añadir 500 μL de tripsina recombinante en el tubo e incubar para la digestión enzimática (37 °C, 15 min). Vuelva a suspender a intervalos de 5 minutos.
- Centrifugar la muestra digerida (400 x g, 5 min, 4 °C). Deseche el sobrenadante. Repita los pasos 3.2.6 y 3.2.7. Resuspender las células en 100 μL de H-EOCM.
- Siembra de organoides
- Para la siembra de organoides, repita el paso 2.3.
4. Congelación y recuperación de organoides
- Congelación de organoides
- Para la preparación de materiales, repita el paso 2.1.
- Para la digestión de los organoides, repita el paso 3.2.
- Congelación de organoides
- Determine la densidad de celdas, luego prepare un tubo de centrífuga nuevo de 1,5 mL con 10,000 celdas en suspensión.
- Centrifugar las muestras a 400 x g durante 5 min en RT. Aspirar el sobrenadante con cuidado.
- Vuelva a suspender las células con 500-1000 μL de medio de criopreservación. Transfiera a un nuevo tubo criogénico. Congele el tubo criogénico a -80 °C durante 24 h. Archivo en un sistema de almacenamiento de nitrógeno líquido para una conservación prolongada.
- Descongelación de organoides congelados
- Para la preparación de los materiales, repita el paso 2.1.
- Descongelación de organoides congelados
- Descongele rápidamente el tubo criogénico en un baño de agua a 37 °C durante 2-3 minutos. Transfiera el material congelado a 9 mL de cultivo basal precalentado (37 °C) y vuelva a suspender las células de manera uniforme.
- Centrifugar la suspensión de la célula durante 5 min a 400 x g (a RT). Aspire el sobrenadante con cuidado.
- Siembra de organoides
- Para sembrar los organoides, repita el paso 2.3.
5. Análisis histológico del organoide
- Preparación de secciones embebidas en parafina
- Preparación de materiales
- Esterilizar 50 mL de matriz de inclusión (solución acuosa: 2% de agar + 2,5% de gelatina) en un matraz de 250 mL mediante autoclave. Alícuota 5 mL en tubos de centrífuga de 15 mL. Almacene a temperatura ambiente.
- Fijación de organoides
- Repita los pasos 3.2.1-3.2.2. Vuelva a suspender el precipitado con 1 mL de tampón de paso en un tubo nuevo de 1,5 mL.
- Centrifugar a 400 x g a 4 °C durante 5 min. Retire el sobrenadante. Resuspender los organoides en 500 μL de paraformaldehído (PFA) al 4%. Incubar a temperatura ambiente durante 1 h o a 4 °C durante al menos 6 h.
- Incrustación de organoides
- Centrifugar la mezcla (400 x g, 5 min, RT). Retire el sobrenadante. Agregue 1 mL del tampón de paso en el tubo y vuelva a suspender la precipitación.
- Centrifugar la mezcla (400 x g, 5 min, RT). Retire el sobrenadante.
- Coloque un tubo (15 mL) con medio de inclusión (5 mL) en el baño de agua (recipiente de 100 mL, 150 mL). Calienta en el microondas a máxima potencia hasta que el agua empiece a hervir.
NOTA: Desenrosque la tapa del tubo de 15 ml antes de calentarlo en el microondas. - Vuelva a suspender los organoides con 50 μL de gel de inclusión en un tubo de centrífuga de 1,5 mL. Enfríe el tubo a 4 °C hasta que el gel se endurezca por completo.
- Transfiera el gel solidificado a etanol al 70%. Conservar a 4 °C.
- Preparación del bloque de parafina
- Deshidratar el gel a través de series de etanol (30% → 50% → 70% → 80% → 95% → 100%), 30 min por concentración.
- Ponga el gel solidificado en xileno transparente durante 30 min. Sumerja el gel solidificado en parafina e incorpórelo con una estación de parafina calentada.
- Cortar rodajas de 4 μm de grosor con un micrótomo. Montar en portaobjetos y secar a 65 °C durante 1 h. Almacenar en condiciones secas.
- Preparación de materiales
- Tinción inmunohistoquímica (IHQ) de cortes de organoides
- Desparafinado e hidratación
- Calentar las rodajas en un agente de limpieza de tejidos a 65 °C durante 40 min. Sumerja el portaobjetos en un agente limpiador de tejidos fresco a temperatura ambiente durante 20 minutos.
- Procese los portaobjetos a través de bandejas de vidrio que contienen series de etanol: sumérjalos en etanol al 100% durante 10 minutos y repita una vez, luego transfiéralos a etanol al 95% durante 5 minutos, seguido de etanol al 85% durante 5 minutos, luego etanol al 75% durante 5 minutos y finalmente colóquelos en PFA al 4% durante 10 minutos.
- Agregue agua esterilizada a la cámara termoestable y mantenga 5 min en el agitador a 80 rpm. Repita este paso dos veces.
- Recuperación de antígenos
- Agregue la solución de recuperación del antígeno Tris-EDTA (pH 9.0) a la cámara termoestable para sumergir los portaobjetos. Calentar en el microondas la cámara termoestable que contiene los portaobjetos a máxima intensidad (700 W, 3 min) hasta que hierva. Mantenga el microondas a una temperatura de baja potencia (70 W, 15 min) y enfríe a temperatura ambiente.
- Lavar en agua destilada durante 2 min en una coctelera a 80 rpm. Repita dos veces. Encierre en un círculo la ubicación de los organoides con un bolígrafo histológico.
- Bloqueo de la peroxidasa
- Deje caer la solución bloqueadora de peroxidasa para cubrir el área de la muestra. Incubar en una cámara de humedad a temperatura ambiente durante 20 min.
- Transfiera los portaobjetos a una cámara termoestable. Lavar en PBST (PBS + 0,1% Tween 20) durante 2 min a 80 rpm. Repita dos veces.
- Incubación primaria de anticuerpos
- Limpie suavemente el exceso de gotas de PBST en los portaobjetos.
NOTA: Evite tocar los organoides en los portaobjetos. - Deje caer el anticuerpo primario diluido para cubrir el área del organoide. Incubar en una cámara de humedad durante 2 h a temperatura ambiente, o 8-14 h a 4 °C. Repita este paso.
- Limpie suavemente el exceso de gotas de PBST en los portaobjetos.
- Incubación secundaria de anticuerpos
- Repita el paso 5.2.4.1. Deje caer el anticuerpo secundario HRP diluido para cubrir el área del organoide. Incubar en una cámara de humedad a temperatura ambiente durante 20 min. Repita este paso.
- Tinción con DAB (3,3′-diaminobenzidina)
- Repita el paso 5.2.4.1. Deje caer 1× DAB para cubrir el área del organoide. Incubar en una cámara de humedad a temperatura ambiente hasta que el color se vuelva marrón.
- Sumerja los portaobjetos en agua destilada durante 5-10 s para terminar el cambio de color. Repita el paso.
- Tinción con hematoxilina
- Teñir en hematoxilina durante 5-8 min. Diferenciar en 1% de alcohol ácido (1% de HCl en 70% de alcohol) durante 5-10 s.
- Sumerja los portaobjetos en agua destilada durante 5-10 s. Repita este paso.
- Deshidratación
- Procese los portaobjetos a través de bandejas de vidrio en orden secuencial: sumérjalos en etanol al 75% durante 5 minutos, transfiéralos a etanol al 85% durante 5 minutos, pasen a etanol al 95% durante 5 minutos, seguidos de dos inmersiones separadas en etanol al 100% durante 10 minutos cada una, y finalmente colóquelas en xileno durante dos períodos sucesivos de 20 minutos.
- Montaje de corredera
- Agregue xileno a la goma neutra hasta que se vuelva transparente. Secar ligeramente al aire. Luego, deje caer goma de mascar con xileno para cubrir el área del organoide.
- Aplique el cubreobjetos. Escanee y analice la diapositiva.
- Desparafinado e hidratación
- Tinción de inmunofluorescencia múltiple (mIF)
- Para desparafinar e hidratar, repita el paso 5.2.1.
- Para el bloqueo de la peroxidasa, repita el paso 5.2.3.
- Para la recuperación de antígenos, repita el paso 5.2.3.
- Bloqueo del suero de oveja.
- Repita el paso 5.2.4.1. Agregue una solución bloqueadora de suero de oveja para cubrir el área de los organoides. Incubar en una cámara de humedad a temperatura ambiente durante 30 min.
- Lavar en PBST durante 2 min. Repetir dos veces.
- Para la incubación primaria de anticuerpos, repita el paso 5.2.4.
- Para la incubación secundaria de anticuerpos, repita el paso 5.2.4.1.
- Deje caer una solución de anticuerpo secundario específico para cubrir el área del organoide. Incubar en una cámara de humedad a temperatura ambiente durante 20 min. Repita el paso 5.2.3.2.
NOTA: Proteja los portaobjetos de la luz desde este paso hasta el final del experimento.
- Deje caer una solución de anticuerpo secundario específico para cubrir el área del organoide. Incubar en una cámara de humedad a temperatura ambiente durante 20 min. Repita el paso 5.2.3.2.
- Tinción con colorante fluorescente
- Repita el paso 5.3.4.1. Deje caer una solución de tinte fluorescente para cubrir el área del organoide.
- Incubar en una cámara de humedad a temperatura ambiente durante 10-20 min. Repita el paso 5.2.3.2.
- Para tinciones múltiples, repita los pasos 5.3.3-5.3.7.
- Tinción de DAPI
- Repita el paso 5.2.4.1. Deje caer la solución de DAPI para cubrir el área del organoide. Repita el paso 5.2.3.2. A continuación, repita el paso 5.3.4.2.
- Sumerja los portaobjetos en agua esterilizada durante 2 min.
- Montaje de corredera
- Deje caer el medio de montaje antidecoloración para cubrir el área del organoide. Aplique el cubreobjetos.
- Adquiera imágenes digitales con un escáner de diapositivas y analícelas.
Resultados
Este protocolo describe el muestreo de organoides y el análisis histológico en diferentes estadios de la tumorigénesis ESCC (Figura 1). Mediante el muestreo de mucosa esofágica normal, neoplasia intraepitelial de bajo grado (LGIN), neoplasia intraepitelial de alto grado (HGIN) y tejidos tumorales de pacientes con ESCC, se pueden construir organoides que representan diferentes etapas de la tumorigénesis. Además, se realizó la inclusión en parafina y el corte de estos organoides, seguido de la tinción con inmunofluorescencia.
Para investigar la expresión de moléculas inmunosupresoras y las características morfológicas de los clones celulares durante la tumorigénesis, se recolectaron tejidos epiteliales esofágicos de varias etapas del desarrollo tumoral y se realizó una tinción de inmunofluorescencia. Después de completar la tinción, se definieron cuatro pseudocolores para los marcadores antes de escanear los portaobjetos. A PD-L1, Ki-67 y KRT6A se les asignaron pseudocolores de verde, rojo y gris, respectivamente, mientras que los núcleos celulares se marcaron con DAPI. Los resultados experimentales mostraron que la morfología de los organoides de la mucosa esofágica cambió durante la tumorigénesis, principalmente volviéndose más desorganizada. La tinción con inmunofluorescencia reveló que, a medida que avanzaba la tumorigénesis, la proliferación de células epiteliales cambiaba, acompañada de una expresión elevada de moléculas inmunosupresoras como PD-L1 (Figura 2).
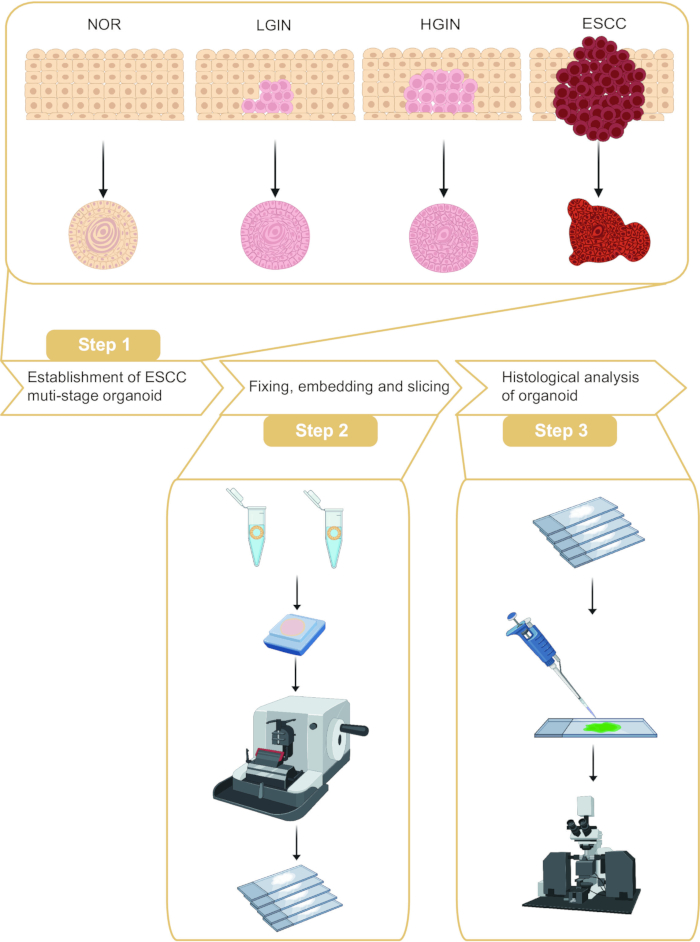
Figura 1: Flujo de trabajo de establecimiento y análisis histológico de organoides de carcinoma de células escamosas de esófago (ESCC) multietápico. Haga clic aquí para ver una versión más grande de esta figura.
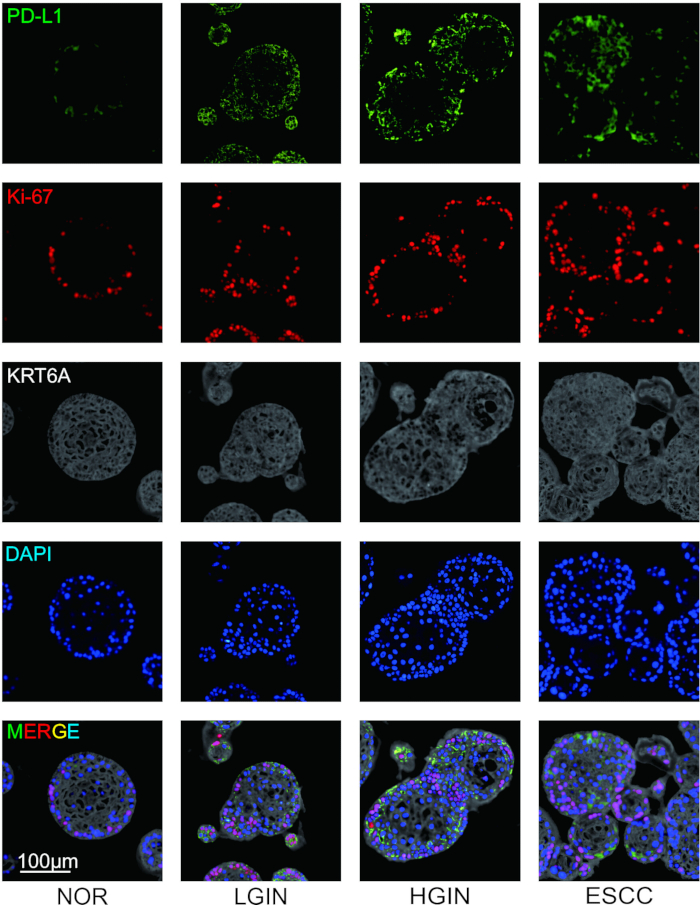
Figura 2: Tinción de inmunofluorescencia multiplex (mIF) del organoide ESCC multietápico. Imágenes representativas que muestran la expresión de PD-L1 (verde), Ki-67 (rojo) y KRT6A (gris). Barras de escala = 100 μm. NOR, mucosa normal; LGIN: neoplasia intraepitelial de bajo grado; LGIN: neoplasia intraepitelial de alto grado. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El establecimiento y el análisis histológico de los organoides representan un avance significativo en el modelado de la progresión tumoral. El protocolo ofrece notables ventajas sobre los métodos existentes para el estudio de la tumorigénesis20. A diferencia de los sistemas tradicionales de cultivo celular en 2D, los organoides mantienen una arquitectura tridimensional compleja y una heterogeneidad celular que refleja mejor las condiciones in vivo. En comparación con los modelos animales, los organoides derivados de tejido humano representan con mayor precisión las características de las enfermedades humanas 9,21,22. La incorporación de la tinción de inmunofluorescencia múltiple permite la visualización simultánea de múltiples marcadores, lo que proporciona información sobre las relaciones espaciales entre las moléculas clave y la arquitectura de los tejidos durante la evolución del tumor. Utilizando este protocolo avanzado, este estudio reveló cambios dinámicos significativos en el carcinoma de células escamosas de esófago, demostrando específicamente que los niveles de proliferación de células tumorales cambiaron progresivamente durante el desarrollo del tumor, acompañados de cambios correspondientes en la expresión de la molécula inmunosupresora PD-L1.
Este protocolo proporciona una metodología integral para investigar los cambios morfológicos y moleculares durante la tumorigénesis, con varios pasos críticos que requieren especial atención. El tiempo de digestión durante el procesamiento de tejidos debe controlarse cuidadosamente, ya que la digestión excesiva puede provocar una muerte celular excesiva, mientras que una digestión insuficiente da como resultado un aislamiento celular deficiente. Además, el control de la temperatura durante la manipulación de la matriz de la membrana basal es crucial: la matriz debe mantenerse a 4 °C para evitar la polimerización prematura y mantener la viabilidad de la célula.
Sin embargo, hay que reconocer ciertas limitaciones de la técnica. La ausencia de componentes inmunes y células estromales en el sistema básico de cultivo de organoides puede no recapitular completamente las interacciones tumor-microambiente23,24. Esta limitación puede abordarse parcialmente a través de sistemas de cocultivo, aunque tales modificaciones requieren una optimización cuidadosa. Por último, la descongelación de los organoides también es un tema importante. Según la experiencia previa, la tasa de éxito de la descongelación de organoides congelados no es alta. Por lo tanto, se recomienda a los usuarios que congelen los organoides con precaución.
Las implicaciones clínicas de este protocolo son sustanciales, particularmente al permitir el modelado de la progresión multietapa desde NOR a través de LGIN y HGIN hasta el carcinoma invasivo6. Los organoides derivados de pacientes generados mediante esta metodología sirven como herramientas valiosas para la investigación y la medicina personalizada, permitiendo la identificación de marcadores moleculares asociados a la progresión de la enfermedad25,26.
Este protocolo se puede adaptar para diversas aplicaciones en la investigación del cáncer y el desarrollo de fármacos. La metodología puede extenderse para estudiar otros cánceres epiteliales y modificarse para incorporar técnicas de análisis adicionales como la secuenciación unicelular27,28. Además, las adaptaciones futuras podrían incorporar fibroblastos asociados al cáncer y células inmunitarias derivadas del paciente para modelar las interacciones tumor-estroma-inmunidad o integrar la edición CRISPR para investigar los impulsores genéticos, ampliando su utilidad en la investigación traslacional y la predicción de la respuesta terapéutica29,30.
Este protocolo presenta los métodos de construcción y congelación de organoides de varias etapas de la tumorigénesis de ESCC. Más importante aún, en este artículo se describen las técnicas de inclusión, seccionamiento, IHQ y tinción de mIF para organoides. Creemos que estos métodos de inclusión, corte y tinción de organoides se pueden aplicar a los métodos de tinción de organoides de múltiples fuentes de órganos, incluido el esófago. Este enfoque también puede ayudar a los investigadores a observar la relación entre la expresión molecular relevante y la estructura espacial.
Divulgaciones
Los autores declaran que no tienen conflictos financieros o de intereses contrapuestos.
Agradecimientos
Los autores agradecen a todos los pacientes y médicos que participan en la investigación en el Hospital del Cáncer, la Academia China de Ciencias Médicas (CAMS) y el Colegio Médico de la Unión de Pekín (PUMC). Este estudio está financiado por la Fundación Nacional de Ciencias Naturales de China (82203156 a S.Z.), el Programa Nacional de Investigación y Desarrollo Clave de China (2023YFC3503200 a S.Z.) y el Fondo de Innovación de la Academia China de Ciencias Médicas para Ciencias Médicas (2023-I2M-QJ-002 a S.Z.). La figura 1 se crea con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Merck | Cat#SLGPR33RB | |
| 24-well plate | Corning | Cat#3524 | |
| 4% Paraformaldehyde | Beyotime | Cat# P0099 | |
| 70 μm sterile strainer | Falcon | Cat#352350 | |
| A83-01 | Tocris Bioscience | Cat# 2939 | |
| Advanced DMEM/F12 | Gibco | Cat# 12634028 | |
| Agar | Solarbio | Cat# A8190 | |
| Anti-Anti (Antibiotic-Antimycotic) | Gibco | Cat# 15240062 | |
| B-27 supplement | Gibco | Cat# 17504044 | |
| CO2 incubator | Thermo | Cat#371GPCN | |
| Collagenase IV | Gibco | Cat# 17104019 | |
| Cryostor | STEMCELL | Cat# 07930 | |
| DMEM | Corning | Cat# 10-013-CV | |
| EGF | Gibco | Cat# PHG0313 | |
| Fetal bovine serum | Cell Technologies | Cat# 30070 | |
| G-418 | Sigma | Cat# A1720 | |
| Gelatin | Solarbio | Cat# G8061 | |
| GlutaMAX | Gibco | Cat# 35050061 | |
| Growth factor-reduced Matrigel | Corning | Cat# 354230 | |
| HE staining kit | Beijing Yili Fine Chemicals Co., Ltd | NA | |
| HEPES | Gibco | Cat# 15630080 | |
| Histological pen | Zsbio | Cat#ZLI-9305 | |
| Hygromycin B | Sigma | Cat# 400050 | |
| Immunohistochemical staining kit | ZSGB-BIO | PV-8000 | |
| L-WRN | ATCC | CRL-3276; RRID:CVCL_DA06 | |
| N-2 supplement | Gibco | Cat# 17502048 | |
| Neutral gum | Zsbio | Cat#ZLI-9555 | |
| Opal 5-Color Manual IHC Kit | PANOVUE | Cat# 10144100100 | |
| PBS | MeilunBio | Cat#MA0015 | |
| Rabbit Monoclone anti-PD-L1 | CST | Cat# 13684; RRID:AB_2687655 | |
| Rabbit Polyclonal anti-Ki67 | Abcam | Cat# ab16667; RRID:AB_302459 | |
| Rabbit Polyclonal anti-KRT6A | Proteintech | Cat# 10590-1-AP; RRID: AB_2134306 | |
| Sheep serum | Zsbio | Cat#ZLI-9056 | |
| TrypLE Express | Gibco | Cat# 12604021 | |
| TrypLE-EDTA | Gibco | Cat#15400-054 | |
| Whole slide image scanner | Hamamatsu | Cat#C13210 | |
| Y-27632 | Selleck Chemicals | Cat# S1049 |
Referencias
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados