Method Article
Генерация и характеристика индуцированных плюрипотентных стволовых клеток человека астроцитов, лишенных хрупкого рибонуклеопротеина X-мессенджера
В этой статье
Резюме
В данной статье мы описываем протокол, который способствует дифференцировке индуцированных плюрипотентных стволовых клеток человека в функциональные астроциты, специфичные для переднего мозга. Это позволяет проводить исследования роли глиальных клеток в патогенезе нарушений развития нервной системы, таких как синдром ломкой X-хромосомы, и моделировать другие заболевания головного мозга.
Аннотация
Синдром ломкой Х-хромосомы (FXS), ведущая наследственная причина расстройства аутистического спектра и умственной отсталости, был широко изучен с использованием моделей грызунов. В последнее время модельные системы, полученные из стволовых клеток человека, также используются для получения механистического представления о патофизиологии FXS. Тем не менее, эти исследования были сосредоточены почти исключительно на нейронах. Кроме того, несмотря на растущее количество доказательств ключевой роли глии в функционировании нейронов в здоровье и болезнях, мало что известно о том, как FXS влияет на человеческие астроциты.
Поэтому в этом исследовании мы успешно разработали протокол, который фиксирует ключевые пространственно-временные вехи развития мозга и согласуется с процессом глиогенеза. В совокупности это дает полезную основу для изучения нарушений развития нервной системы. Во-первых, мы смоделировали индуцированные плюрипотентные стволовые клетки человека в нейроэктодермальную линию с двойным супрессором матерей против ингибирования декапентаплегии (SMAD) и малых молекул. Впоследствии мы использовали специфические факторы роста и цитокины для получения контрольных (CTRL) и полученных от пациента астроцитарных клеток-предшественников (APC) FXS. Лечение АПК цилиарным нейротрофическим фактором, дифференцирующим цитокином, регулировало и подталкивало клетки-предшественники к астроцитарному созреванию, в результате чего получались специфичные для переднего мозга глиальные фибриллярные кислые белки, экспрессирующие астроциты.
Мы обнаружили, что эти астроциты функциональны, о чем свидетельствует их кальциевая реакция на применение АТФ, и они демонстрируют нарушение гликолитического и митохондриального метаболизма при АТФ. Взятые вместе, эти результаты обеспечивают полезную экспериментальную платформу человеческого происхождения для исследования клеточно-автономных и неклеточных последствий изменений в функции астроцитов, вызванных нарушениями развития нервной системы.
Введение
Синдром ломкой Х-хромосомы (FXS), распространенная наследственная форма умственной отсталости и расстройства аутистического спектра (РАС), вызван недостатком хрупкого рибонуклеопротеина X-мессенджера (FMRP), продуцируемого геном хрупкого рибонуклеопротеина 1 (FMR1) (OMIM: #300624, https://www.omim.org/entry/300624). FMRP играет роль в регуляции трансляции мРНК, образовании и транспортировке гранул мРНК, а также в микроРНК-опосредованной регуляции экспрессии генов1. Таким образом, потеря FMRP влияет не только на развитие мозга, но и на работу мозга взрослого человека. Как уровни транскриптов мРНК FMR1, так и иммуноокрашивание для FMRP в головном мозге показали высокую экспрессию нейронов, наряду со значительной экспрессией в глиальных клетках2. Тем не менее, подавляющее большинство более ранних исследований на животных моделях FXS было сосредоточено в первую очередь на нейронах и аберрациях в их функции. Следовательно, мало что известно о роли глии в FXS3. Традиционно считающиеся клетками «пассивной поддержки»4, накапливаются доказательства того, что астроциты играют решающую роль в опосредовании широкого спектра нейронных функций 5,6, включая содействие синаптогенезу7, совершенствование развивающихсянейронных цепей 8 и рециркуляцию нейротрансмиттеров9. Параллельно с этим появляется все больше доказательств роли астроцитов в патогенезе заболевания, и многие неврологические состояния связаны с астроцитарной дисфункцией.
В то время как большая часть более ранних работ с использованием животных моделей FXS была сосредоточена на идентификации и валидации различных молекулярных мишеней в нейронах для лечения FXS, эти доклинические результаты не всегда приводили к успешным клиническим результатам. Кроме того, неудачи в недавних клинических испытаниях также подчеркивают потребность в модельных системах, основанных на человеке. Модели неврологических расстройств, основанные на клетках мозга, полученных из стволовых клеток человека, предлагают мощную стратегию для преодоления разрыва между механистическими знаниями исследований на животных и ограниченным успехом клинических результатов для пациентов. Тем не менее, лишь немногие из этих исследований были сосредоточены на астроцитах, и то в основном на астроцитах, которые были спинальными по происхождению. Это, в свою очередь, актуально в свете исследований, показывающих, что структура и функции астроцитов различаются между областями мозга11,12. Таким образом, для лучшего понимания вызванных заболеванием изменений в астроцитах человека также необходимо учитывать эти различия, специфичные для областей мозга в астроцитах. Тем не менее, модели нарушений развития нервной системы с использованием астроцитов, полученных из стволовых клеток человека, специфичных для переднего мозга, остаются сравнительномалоизученными. Таким образом, чтобы начать восполнять эти пробелы, мы описываем протоколы генерации специфичных для переднего мозга астроцитов из индуцированных плюрипотентных стволовых клеток (iPSCs), полученных от пациентов), несущих мутации FXS; Кроме того, мы показываем, что астроциты функциональны и демонстрируют измененный метаболизм.
протокол
Все эксперименты с использованием индуцированных плюрипотентных стволовых клеток человека (ИПСК) (Таблица 1) были проведены после получения соответствующих разрешений регулирующих органов. На рисунке 1А представлен полный протокол дифференцировки ИПСК к зрелым астроцитам, специфичным для переднего мозга.
1. Поддержание и расширение ИПСК
- За день до нанесения иПСК покройте 6-луночную чашку разбавленным в соотношении 1:60 Матригелем (внеклеточный матрикс [ECM]) в Advanced Dulbecco's Modified Eagle Medium/Ham's F-12 (DMEM/F12) и храните при температуре 2-8 °C.
ПРИМЕЧАНИЕ: Избегайте хранения посуды с покрытием Matrigel в течение >5 дней при температуре 2-8 °C, так как это может привести к деградации белка в ECM с течением времени. Чтобы избежать высыхания формы, нанесите не менее 1 мл разбавленного Матригеля в соотношении 1:60 на одну лунку 6-луночной чашки и равномерно распределите по чашке. При использовании в тот же день держите планшет в увлажненном инкубаторе при температуре 37 °C и 5%CO2 в течение 1 часа. - В день культивирования ИПСК удалите материал покрытия и добавьте 1 мл полной среды Essential 8 (базальная среда E8 с добавкой Essential 8) вместе с ингибитором ROCK 1x конечной концентрации и выдержите чашку в инкубаторе с температурой 37 °C и 5%CO2 перед добавлением ИПСК при температуре 37 °C и 5% CO2.
- Ресуспендируйте ИПСК в полной среде Е8 вместе с ингибитором ROCK в 1-кратной конечной концентрации для лучшей адгезии колоний.
ПРИМЕЧАНИЕ: Не готовьте большое количество питательной среды. Готовьте не более 3-4 дней и храните при температуре 2-8 °C. - На следующий день восполните полную концентрацию среды E8 без ингибитора ROCK до тех пор, пока клетки не станут слившимися на 80% (примерно 4-5 дней).
- Когда они достигнут 80% слияния, отделите колонии ферментативным путем.
- Чтобы пропустить иПСК, удалите отработанную среду из чашки и добавьте 1 мл на лунку предварительно подогретой (37 °C) смеси коллагеназы (2 мг/мл) и диспаза (1 мг/мл) в соотношении 1:1 и инкубируйте при 37 °C в течение более 20-30 минут, чтобы дать возможность колониям iPSC подняться.
ПРИМЕЧАНИЕ: Не оставляйте посуду при температуре 37 °C более чем на 20-30 минут; По истечении этого периода колонии будут распадаться, а клетки будут умирать.
- Чтобы пропустить иПСК, удалите отработанную среду из чашки и добавьте 1 мл на лунку предварительно подогретой (37 °C) смеси коллагеназы (2 мг/мл) и диспаза (1 мг/мл) в соотношении 1:1 и инкубируйте при 37 °C в течение более 20-30 минут, чтобы дать возможность колониям iPSC подняться.
- Когда колонии начнут подниматься, выньте чашки из инкубатора и нейтрализуйте активность фермента, добавив 2 мл фосфатно-солевого буфера Дульбекко (DPBS).
- Соскребите колонии с помощью DPBS и соберите суспензию в коническую пробирку объемом 15 мл с помощью широкой серологической пипетки объемом 10 мл.
- Осторожно разотрите суспензию 2-3 раза, чтобы разбить колонии с помощью серологической пипетки объемом 10 мл, и дайте колониям успокоиться.
ПРИМЕЧАНИЕ: Не превращайте колонии в одиночные клетки; Это может привести к тому, что клетки не прилипнут к чашке и вызвать дальнейшую гибель клеток. Кроме того, не оставляйте их большими колониями; В дальнейшем это приведет к более дифференцированным колониям. - Как только колонии успокоятся (примерно через 2 минуты), аспирируйте смесь ферментов DPBS, оставив в пробирке примерно 1 мл.
- Добавьте в пробирку 2 мл DPBS, перемешайте колонии постукиванием и дайте им отстояться. Повторите это 2 раза, чтобы удалить весь остаточный фермент из колоний. Удалите как можно больше надосадочной жидкости после2-й стирки, восстановите колонии в 1 мл полной среды E8 и положите в свежеприготовленную посуду, как указано в шагах 1.2-1.3.
- В качестве альтернативы можно криоконсервировать часть колоний, используя 10% диметилсульфоксид (ДМСО) в качестве криопротекторного раствора для будущего расширения и использования.
- Приготовьте свежую криоконсервирующую среду, смешав 90% готовой среды E8 и 10% ДМСО в качестве криопротекторного раствора, и поместите его при температуре 2-8 °C до использования.
- Для криоконсервации необходимо выполнить шаги 1.5-1.10.
- Во время шага 1.10, после2-го промывки, дайте колониям осесть и удалите надосадочную жидкость. В колонии добавьте 1 мл свежеприготовленной холодной криоконсервационной среды и переложите в криоприемники.
ПРИМЕЧАНИЕ: После добавления среды для криоконсервации в колонии быстро перенесите содержимое в криовиалы. Задержка может привести к снижению скорости оживления, поскольку ДМСО является криопротектором, который может повреждать клетки. - Немедленно переместите криовиалы в криобокс и храните в морозильной камере при температуре -80 °C в течение ночи.
- На следующий день переместите все криовиалы в резервуар с жидким азотом (резервуар LN2 ) для дальнейшего использования.
ПРИМЕЧАНИЕ: ИПСК следует регулярно кариотипировать с использованием G-полосы (дополнительный рисунок S1) для любых аномалий, характеризовать с помощью иммуноцитохимии для плюрипотентности (рисунок 1B) и проверять на микоплазму.- Чтобы охарактеризовать ИПСК с помощью иммуноцитохимии, нанесите на колонии 13 мм стеклянные покровные стекла толщиной 13 мм, покрытые Матригелем, в соотношении 1:60. Как только они слится на 40%, промойте клетки PBS-T (PBS-0,1% Tween 20), зафиксируйте 4% параформальдегидом в течение 10 минут, пеабилизируйте 0,3% Triton X-100 в PBS в течение 10 минут и заблокируйте 3% бычьим сывороточным альбумином (BSA) в PBS на 1 ч, чтобы предотвратить неспецифическое связывание.
- После блокирования культуры с первичными антителами инкубируют в течение 1 ч, а затем 3 раза промывают PBS-T в течение 5 мин каждая, а затем соответствующие вторичные антитела (Таблица материалов) в темноте в течение 1 ч.
- Закрепите покровные стекла на предметных стеклах с монтажным носителем и получайте изображения с помощью конфокального лазерного сканирования с длиной волны 405 нм, 488 нм, 561 нм и 633 нм. Захватывайте изображения с разрешением 512 x 512 пикселей; установите размер шага Z на 0,5 μм с 1 воздушной единицей диаметра точечного отверстия.
2. Генерация и характеристика астроцитарных клеток-предшественников (АПК)
- Ферментативно поднимают иПСК, как указано в шагах 1.5-1.10, и помещают их на неадгезивную чашку для культуры суспензии (100 мм) с химически определенной средой14, содержащей 50% модифицированной среды Дульбекко от Iscove (IMDM), 50% смеси питательных веществ F-12 от Ham's (F12), 5 мг/мл BSA, 1% химически определенного липидного концентрата (CD-липид), 450 μM монотиоглицерина, 7 μг/мл инсулина, 15 μг/мл трансферрина, 1% пенициллин-стрептомицин с добавлением митогенов N-ацетилцистеина (1 мМ), LDN 193189 (0,1 мкМ) и SB431542 (10 мкМ) в течение 7 дней.
Примечание: Низкомолекулярные ингибиторы SB431542 и LDN-193189 (LDN) являются ингибиторами костного морфогенетического белка и трансформирующих сигнальных путей фактора роста-бета.
С этого момента носитель пополнялся один раз в 2 дня или по протоколу понедельник/среда/пятница. - Поместите клеточную суспензию на орбитальный шейкер при 40 оборотах в минуту на 7 дней в нормоксических условиях, чтобы способствовать развитию кортикосфер (рис. 1A).
- На 8-й день перенесите кортикосферы в среду для пролиферации клеток, содержащую усовершенствованный DMEM/F12 с 1% антибиотиком-антимикотиком, 1% добавкой N2, 1% заменителем глютамина, 0,1% добавкой B27 и 2,5 нг/мл основного фактора роста фибробластов (bFGF) в течение 7 дней.
- Индуцируйте сферы для глиальной специфичности, подвергая их воздействию глиальной обогащающей среды, содержащей Advanced DMEM/F12 с 1% антибиотиком-антимикотиком, 1% N2, 1% заменителем глютамина, 0,1% добавкой B27, 20 нг/мл эпидермального фактора роста (EGF), bFGF-H (20 нг/мл bFGF-5 мг/мл гепарина) в течение 2 недель для получения ранних глиосфер (рис. 1A).
- Для созревания ранних глиосфер замените bFGF-H на 20 нг/мл фактора ингибирования лейкемии (LIF) и поддерживайте сферы в течение 4 недель.
- После 4 недель в среде созревания сохраняйте сферы в среде для глиального обогащения в течение длительного времени. Чтобы предотвратить агрегацию и потерю жизнеспособности, каждые 2 недели механически измельчайте глиосферы с помощью стерильного промышленного лезвия и заменяйте всю среду ДНКазой I, чтобы удалить фрагменты ДНК, образовавшиеся в результате измельчения.
- Диссоциируйте глиосферы на монослои АПК с помощью набора для диссоциации папаина и положите на обработанную клеточной культурой адгезивную чашку с разбавлением покрытия Матригель в соотношении 1:80.
- Размножайте АПК в глиальной обогащающей среде до 80% конфлюентности и ферментативно пропускайте их с помощью среды для отслоения ферментных клеток (см. Таблицу материалов).
- К прохождению:
- Извлеките отработанные среды и соберите в коническую трубку. К клеткам добавьте фермент среды для отслоения клеток и подождите 1-2 мин. Как только клетки начнут отделяться, добавьте отработанную среду, чтобы нейтрализовать активность фермента.
- Соберите клеточную суспензию и центрифугируйте при 800 x ɡ в течение 2 мин.
- Аспирируйте надосадочную жидкость, ресуспендируйте клетки в глиальную обогащающую среду и нанесите примерно 1 x 106 клеток/лунку на 6-луночную чашку с покрытием Matrigel в масштабе 1:80.
- Для криоконсервации:
- Ресуспендируйте клетки в холодной смеси, состоящей из 90% пролиферационной среды кортикосферы (без bFGF) и 10% криопротектора. Переведите ресуспензированные клетки в криовиальные.
- Немедленно переместите криоциалы в криобокс и держите в морозильной камере при температуре -80 °C в течение ночи.
- На следующий день переместите все криовиалы в резервуар с жидким азотом (резервуар LN2 ) для дальнейшего использования.
ПРИМЕЧАНИЕ: БТР крионировали с использованием 10% ДМСО до прохода No 6.
- Охарактеризовать диссоциированные АПК путем иммуноокрашивания (как указано в шагах 1.15.1-1.15.3) с помощью виментина и маркеров ядерного фактора IA (NFIA) (рис. 1C, D) (см. таблицу материалов для разведений).
- Чтобы подтвердить региональную специфичность переднего мозга АПК, полученных из hiPSC, проверьте клетки на маркер переднего мозга, такой как человеческий вилочный ящик G1 (hFOXG1) (положительный) и маркер заднего мозга, такой как человеческий гомеобокс B4 (hHOXB4) (отрицательный) с помощью количественной ПЦР в реальном времени (рис. 1E, F).
Примечание: Последовательности праймеров, использованные для этих экспериментов, перечислены в Дополнительной таблице S1.
3. Генерация и характеристика однородной популяции специфичных для переднего мозга астроцитов
- Дифференцировка астроцитов от АПК
- Используйте среду для дифференцировки астроцитов (ADM) в течение 14 дней для дифференцировки APC в астроциты. Среда для дифференцировки астроцитов содержит нейробазал, 1% антибиотик-антимикотический, 1% заменитель глютамина, 1% добавку N2, 0,2% добавку B27, 1% заменимую аминокислотную среду (NEAA) и 10 нг/мл цилиарного нейротрофического фактора (CNTF).
- Подтвердите астроцитарную идентичность с помощью иммуноокрашивания (как указано в шагах 1.15.1-1.15.3.) с глиальным фибриллярным кислым белком (GFAP) и маркерами экспрессии S100β (рис. 2A, B).
- Синтез белка de novo в АПК и астроцитах
- Поддерживайте полученные из hiPSC APC и астроциты переднего мозга на стерильных автоклавных стеклянных покровных стеклах толщиной 13 мм и окрашивайте их иммуно, как указано в шагах 1.15.1-1.15.3.
- Для синтеза белка de novo используйте метод флуоресцентного неканонического мечения аминокислот (FUNCAT), кратко описанный в шагах 3.2.3-3.2.6 (рис. 3A).
- Для устранения дефицита метионина питательную среду из культур удаляют питательную среду и заменяют ее средой, не содержащей метионина и цистеина, смешанной с 1 мМ L-азидогомоаланином (AHA) в течение 30 мин при 37 °C и 5%CO2.
- Промойте культуры PBS-T, зафиксируйте 4% параформальдегидом в течение 10 минут, пропитайте 0,3% Triton X-100 в PBS в течение 10 минут и заблокируйте 3% BSA в PBS в течение 1 часа для предотвращения неспецифического связывания.
- Инкубируют культуры в темноте в течение 1 ч при комнатной температуре с помощью химической реакционной смеси Click cell и алкина Alexa Fluor 647, а затем первичных антител в течение 1 ч и соответствующих вторичных антител (Таблица материалов) в течение 1 ч (Рисунок 3B).
- Закрепите покровные стекла на стеклянных предметных стеклах с монтажным носителем и используйте их для дальнейшего анализа изображений.
- Получение изображений с помощью конфокального лазерного сканирования с длиной волны 405 нм, 488 нм, 561 нм и 633 нм.
- Захватывайте изображения с разрешением 512 x 512 пикселей; установите размер шага Z на 0,5 μм с 1 воздушной единицей диаметра точечного отверстия.
- Поддерживайте постоянные параметры микроскопии и визуализации для всех типов клеток. Делайте снимки для каждой биологической реплики в одном сеансе.
- Выполняйте измерения интенсивности с помощью любого стандартного программного обеспечения для анализа изображений (например, на Фиджи или в Имарисе). В Imaris используйте модуль SURFACES для получения объемных измерений тел клеток, положительных на сигнал флуоресцентного неканонического мечения аминокислот (FUNCAT) с помощью Vimentin (APCs) и GFAP (астроциты), ограничивающих диапазон вокселей (250-350) для удаления мусора.
ПРИМЕЧАНИЕ: Поддерживайте параметры для всех биологических репликат для обоих типов клеток.
- Аденозин-5'-трифосфат (АТФ)-индуцированные колебательные кальциевые волны
- Наведите астроциты на стеклянную чашку с дном (35 мм) в соотношении 5 × 10 до3 клеток/чашку для измерения клеточного ответа на АТФ.
- Дайте клеткам прилипнуть к стеклянному дну в течение 24 ч, промойте их 3 раза HBSS (20 мМ HEPES, 137 мМ NaCl, 5 мМ KCl, 10 мМ Глюкоза, 1 мМ MgCl2, рН = 7,3) без кальция и инкубируйте в культуральной среде с соотношением 5 мкМ метрического красителя Фура-2АМ и 0,02% плюроника F127 в течение 1 ч при комнатной температуре.
ПРИМЕЧАНИЕ: Фура-2АМ является светочувствительным химическим веществом; хранить при температуре -20 °C. - После инкубации промойте 2 раза питательной средой и замените 2 мМ Ca2+ , содержащим HBSS, и визуализируйте клетки со скоростью 2 кадра в секунду с помощью 60-кратного масляного объектива (1,35 NA) в инвертированном микроскопе с компенсацией дрейфа фокуса.
- Запишите АТФ-индуцированные реакции кальция при применении АТФ в ванне в конечной концентрации 5 мМ через 25с (рис. 4A).
- Нарисуйте области интереса вокруг каждой ячейки с помощью Fiji/ImageJ и рассчитайте соотношение F340/F380 во всех временных точках (рис. 4B).
- Анализы клеточного метаболизма
ПРИМЕЧАНИЕ: Скорость потребления кислорода (OCR) и скорость внеклеточного закисления (ECAR) живых клеток измеряли в соответствии с протоколом производителя (см. Таблицу материалов).- За сутки до проведения анализа дайте астроцитам прилипнуть к микропланшету (1,5 × 104 плотности посева) в среде CNTF и инкубируйте при 37 °C с 5%CO2.
- Для анализа напряжения гликолиза:
- Замените среду для культивирования клеток базовой средой с добавлением 2 мМ глутамина (pH отрегулирован до 7,4) и инкубируйте в камере безCO2 при 37 °C в течение 1 ч.
ПРИМЕЧАНИЕ: pH необходимо регулировать на водяной бане при температуре 37 °C. - Вставьте пластину картриджа в прибор для калибровки датчика. После калибровки замените картриджную пластину на пластину для культивирования клеток в конечной концентрации следующих компонентов набора: 10 мМ глюкозы, 1 мкМ олигомицина и 50 мМ 2-дезоксиглюкозы (2-DG) (рис. 5A).
- В конце теста лизируют клетки и оценивают общее содержание белка.
- Замените среду для культивирования клеток базовой средой с добавлением 2 мМ глутамина (pH отрегулирован до 7,4) и инкубируйте в камере безCO2 при 37 °C в течение 1 ч.
- Для анализа митохондриального стресса:
- Замените среду CNTF базовой средой с добавлением 2 мМ глутамина, 1 мМ пирувата, 10 мМ глюкозы (pH скорректирован до 7,4) на водяной бане при 37 °C.
- Инкубируйте планшет в камере безCO2 при температуре 37 °C в течение 1 ч. Тем временем вставьте пластину картриджа в прибор для калибровки датчика.
- После калибровки замените картриджную пластину на планшет для клеточной культуры с конечной концентрацией следующих компонентов набора: 1,5 мкМ олигомицина, 1 мкМ карбонилцианида-4 (трифторметокси) фенилгидразона (FCCP) и 0,5 мкМ ротенона/антимицина А (рис. 5C).
- В конце теста лизируют клетки и оценивают общее содержание белка.
Результаты
Человеческие индуцированные колонии плюрипотентных стволовых клеток (hiPSC) поддерживали с использованием коммерчески доступной определенной среды и иммуноокрашивали на маркеры плюрипотентности, Oct4 и Nanog (рис. 1B). FXS и CTRL APC показали сопоставимые высокообогащенные доли клеток, иммуноположительных на виментин и NFIA (рис. 1C, D). Мы обнаружили, что APC, полученные из здоровых и FXS hiPSCs, показали значительную апрегуляцию FOXG1 по сравнению с HOXB4 (рисунок 1F), что согласуется с преобладающей идентичностью переднего мозга. Мы наблюдали значительное снижение количества GFAP-экспрессирующих астроцитов в группах FXS по сравнению с CTRL-астроцитами без влияния на количество S100β-экспрессирующих астроцитов (рис. 2B). Вестерн-блоттинг показал, что астроциты, полученные из обеих линий FXS, не имели экспрессии FMRP (рис. 2C, D). Количественное определение вновь синтезированных белков не выявило существенной разницы между линиями CTRL и FXS как в APC, так и в астроцитах (рис. 3C). Тем не менее, мы обнаружили, что синтез белка в APC стабильно выше, чем в соответствующих астроцитах для каждой линии (рис. 3C). Эти результаты свидетельствуют о стадийно-специфическом снижении синтеза белка de novo от APC к астроцитам как в линиях FXS, так и в линиях CTRL.
В контрольной группе, как и в астроцитах FXS, наблюдались АТФ-индуцированные кальциевые транзиенты (рис. 4А). Тем не менее, более детальный анализ выявил несколько ключевых различий между отдельными кальциевыми транзиентами, зарегистрированными из астроцитов CTRL, FXS1 и FXS2 (рис. 4B). Мы классифицировали астроциты как ответившие и не ответившие на АТФ на основании наличия или отсутствия кальциевого ответа, соответственно (рис. 4C). Число ответивших в FXS1 и FXS2 было значительно ниже, чем в CTRL. В частности, мы наблюдали значительное снижение пиковой амплитуды первого кальциевого транзиента, вызванного после применения АТФ, в обеих линиях астроцитов FXS (рис. 4D). Кроме того, общая продолжительность первого кальциевого переходного процесса была значительно короче в линиях FXS1 и FXS2, чем в CTRL (рис. 4E). Тем не менее, количество событий с кальцием (количественно определяемое как общее число событий за 250 с; Рисунок 4F), был сопоставим между линиями. В совокупности эти результаты показывают изменения в кальциевых реакциях, вызванных АТФ в астроцитах FXS, полученных из hiPSC. Результаты ECAR свидетельствуют о более высокой скорости гликолиза, гликолитической способности и гликолитического резерва в астроцитах FXS, полученных из hiPSC (рис. 5A, B). Мы не обнаружили существенной разницы в базальном дыхании в астроцитах CTRL и FXS. Продукция АТФ в клетках не показала существенной разницы между астроцитами CTRL и FXS. Стимуляция FCCP вызывала значительно более низкое максимальное дыхание в астроцитах FXS, чем в астроцитах CTRL (рис. 5C, D).
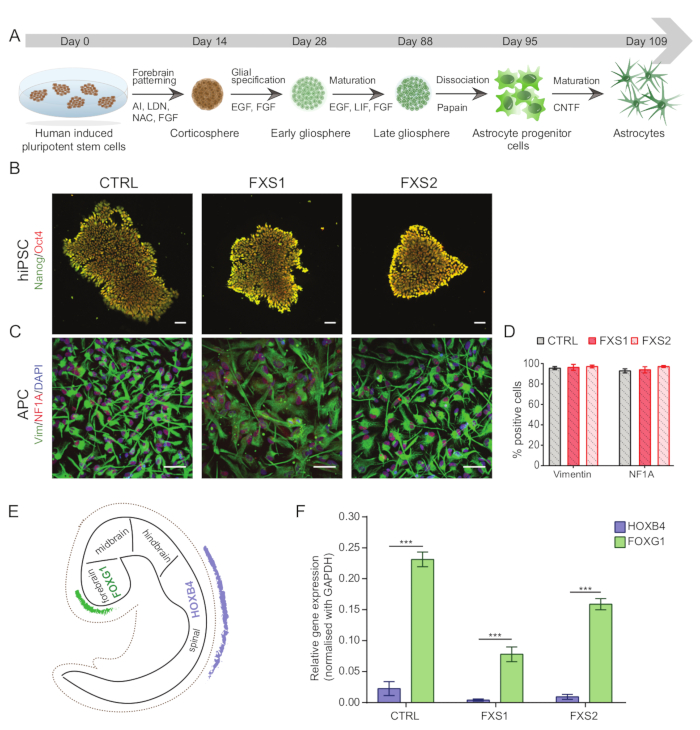
Рисунок 1: Получение специфичных для переднего мозга астроцитарных клеток-предшественников из ИПСК. (А) Иллюстративный рабочий процесс получения астроцитов из ИПСК (B) Репрезентативные изображения hiPSCs, демонстрирующие сопоставимую экспрессию Oct4/Nanog в линиях CTRL и FXS. (C) Однородная популяция АПК, полученных из hiPSC, экспрессировала аналогичное количество Vimentin- и NFIA-положительных клеток. (D) Нет существенной разницы в экспрессии Vimentin- и NFIA между CTRL и FXS APC. Статистический анализ был проведен с использованием двухфакторного ANOVA с последующим попарным сравнением Тьюки. (E) Схема, иллюстрирующая регионоспецифичную экспрессию FOXG1 и HOXB4 во время разработки in vivo. (F) Графическое представление экспрессии FOXG1 в сравнении с HOXB4 (с использованием qRT-PCR) по генотипам, предполагающее склонность к линии переднего мозга. Статистический анализ с помощью двухфакторной ANOVA с последующим тестом множественного сравнения Сидака. Для всех экспериментов N = 3 биологических репликации. p < 0,001. Масштабная линейка = 50 мкм. Полосы погрешностей представляют SEM. Сокращения: hiPSCs = индуцированные плюрипотентные стволовые клетки человека; CTRL = Управление; FXS = синдром ломкой X-хромосомы; APC = клетки-предшественники астроцитов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
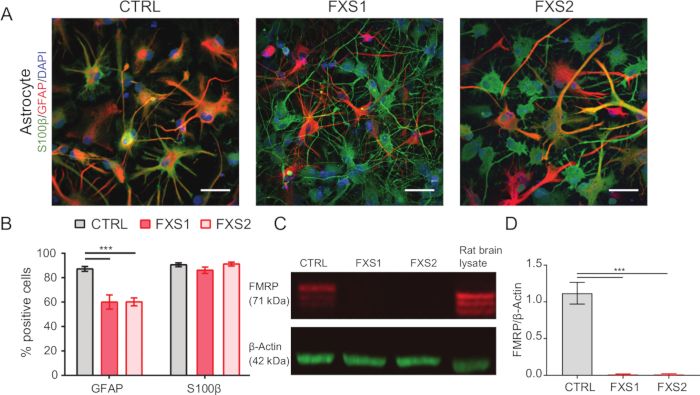
Рисунок 2: Уменьшенное количество глиальных фибриллярных кислых белков с положительным результатом hiPSC-астроцитов FXS. (A) Репрезентативные изображения астроцитов, полученных из hiPSC, демонстрирующих экспрессию S100β и GFAP. (B) Процент GFAP-положительных астроцитов был значительно ниже в астроцитах, полученных из FXS, по сравнению с CTRL, хотя оба проявляли сходную экспрессию S100β. Статистическая значимость определяется с помощью двухфакторного ANOVA с последующим попарным сравнением по Тьюки. (C) Иммуноблот, представляющий экспрессию FMRP в астроцитах из CTRL и FXS. (D) Графики, показывающие отсутствие FMRP в астроцитах FXS, полученных из hiPSC. Статистический анализ, выполненный с помощью однофакторного ANOVA с попарным сравнением Тьюки. Для всех вышеперечисленных экспериментов N = 3 биологических репликации. Масштабная линейка = 50 мкм. ***p < 0,001. Полосы погрешностей представляют SEM. Сокращения: hiPSCs = индуцированные плюрипотентные стволовые клетки человека; CTRL = Управление; FXS = синдром ломкой X-хромосомы; GFAP = глиальный фибриллярный кислый белок; FMRP = Хрупкий Х-матричный рибонуклеопротеин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
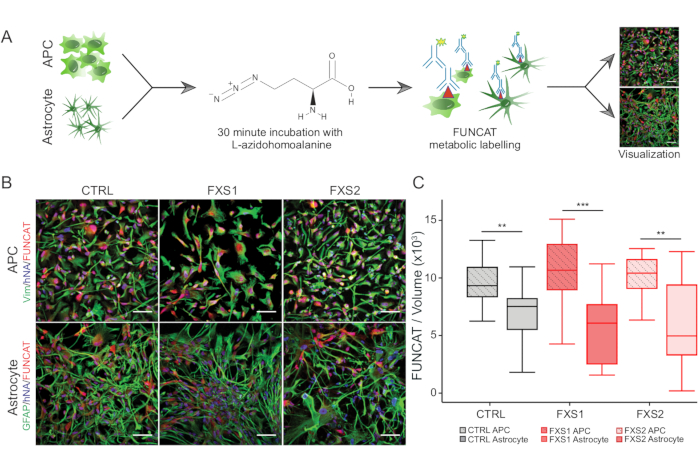
Рисунок 3: Снижение синтеза белка из-за дифференцировки от APC к астроцитам. (A) Схематический рабочий процесс, изображающий мечение и визуализацию синтеза белка в APC и астроцитах, полученных из hiPSC, с использованием метаболического мечения FUNCAT. (B) Репрезентативные изображения (вверху) виментин-положительных АПК, полученных из hiPSC, и (внизу) GFAP-положительных астроцитов с меткой FUNCAT/антител к ядрам человека (hNA) в клетках, полученных от CTRL и FXS. (C) FUNCAT/объем АПК, полученных из hiPSC, был значительно выше, чем у соответствующих производных астроцитов. Для всех экспериментов N = 3 биологических репликации. Масштабная линейка = 50 мкм. **p < 0,01, ***p < 0,001. Усы представляют 1,5 × IQR. Сокращения: hiPSCs = индуцированные плюрипотентные стволовые клетки человека; CTRL = Управление; FXS = синдром ломкой X-хромосомы; GFAP = глиальный фибриллярный кислый белок; FUNCAT = флуоресцентное мечение неканонических аминокислот. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
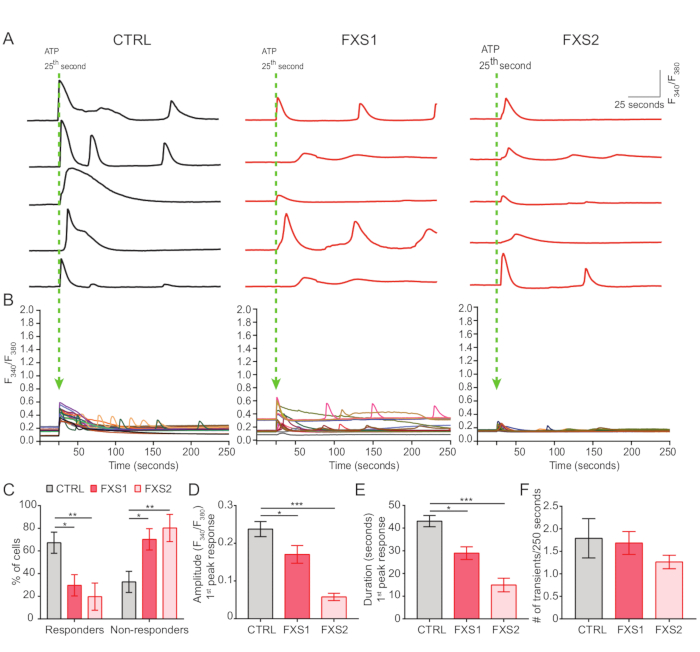
Рисунок 4: Недостаточная передача сигналов Ca2+, вызванная АТФ, в астроцитах FXS, полученных из hiPSC. (A) Репрезентативные следы транзиентов Ca2+, зарегистрированные из отдельных астроцитов при наружном применении АТФ на 25-й с. (B) Усредненные отношения F340/F380, отображающие переходные процессы Ca2+ в течение 250 с после применения АТФ. (C) Сгруппированные данные, показывающие более высокий процент неответивших на АТФ в астроцитах FXS, полученных из hiPSC. Статистическая значимость определяется двухфакторным ANOVA с помощью парного сравнения Тьюки. (Д-Ж) Количественная оценка отклика на первый пик (амплитуды и продолжительности) и частоты событий. (D) Демонстрирует значительное уменьшение амплитуды. Статистическая значимость определена с помощью однофакторного ANOVA с парным сравнением по Тьюки и (E) длительностью в астроцитах FXS, полученных из hiPSC. Статистическая значимость определена по критерию Краскела-Уоллиса с помощью теста множественного сравнения Данна; (F) Графическое представление частоты переходных процессов Ca2+ в астроцитах FXS, полученных из hiPSC. Статистический анализ с помощью однофакторного ANOVA с парным сравнением Тьюки. Для всех экспериментов N = 3 биологических репликации; n = 19 ячеек для каждой клеточной линии. *p < 0,05, **p < 0,01, ***p < 0,001. Погрешности представляют SEM. # = Число. Сокращения: hiPSCs = индуцированные плюрипотентные стволовые клетки человека; CTRL = Управление; FXS = синдром ломкой X-хромосомы; GFAP = глиальный фибриллярный кислый белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
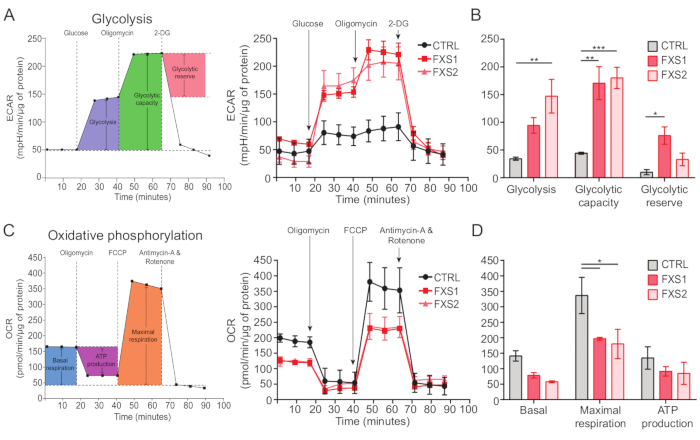
Рисунок 5: Биоэнергетический дефицит в астроцитах FXS, полученных из hiPSC. (A) Линейный график, показывающий скорость внеклеточного закисления астроцитов, полученных из hiPSC (CTRL и FXS) после добавления 10 мМ глюкозы, 1 мкМ олигомицина и 50 мМ 2-DG последовательно и нанесенный на линейный график. (B) Гликолиз, гликолитическая способность и количественное определение гликолитического резерва показали увеличение астроцитов FXS, полученных из hiPSC. Статистический анализ, выполненный с помощью двухфакторной ANOVA с попарным сравнением Тьюки. (C) Линейный график, изображающий измерение скорости потребления кислорода путем последовательного добавления 1,5 мкМ олигомицина, 1 мкМ FCCP и 0,5 мкМ антимицина А и ротенона. (D) Базальное дыхание, максимальное дыхание и продукция АТФ были количественно оценены по линейному графику, и астроциты FXS, полученные из hiPSC, показали значительное снижение максимального дыхания по сравнению с астроцитами CTRL. Статистический анализ, выполненный с помощью двухфакторной ANOVA с попарным сравнением Тьюки. Для всех экспериментов N = 2 биологических репликации. *p < 0,05, **p < 0,01, ***p < 0,001. Полосы погрешностей представляют SEM. Сокращения: hiPSCs = индуцированные плюрипотентные стволовые клетки человека; CTRL = Управление; FXS = синдром ломкой X-хромосомы; ECAR = скорость внеклеточного закисления; 2-DG = 2-дезоксиглюкоза; OCR = норма потребления кислорода; FCCP = карбонилцианид-4 (трифторметокси) фенилгидразон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| ID в рукописи | ID у источника | Возраст | Секс | Перепрограммировано имя клеточной линии | Метод перепрограммирования | Тип начальной ячейки | Кариотип G-диапазона |
| (лет) | |||||||
| CTRL | ND30625 | 76 | M | КС25iCTR-18nxx | Эписомальные векторы | Фибробласт | Нормальный |
| FXS1 | GM07072 | 22 | M | CS072iFXS-n4 | Эписомальные векторы | Фибробласт | Нормальный |
| FXS2 | GM05848 | 4 | M | КС848iFXS-n5 | Эписомальные векторы | Фибробласт | Нормальный |
Таблица 1: Клеточные линии, использованные в этом исследованиидля получения специфичных для переднего мозга астроцитов.
Дополнительный рисунок S1: Отчет о хромосомном анализе. Нормальный кариотип полос ГТГ (A) CTRL 46, XY, (B) FXS1 46, XY и (C) FXS2 46, XY. Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Дополнительная таблица S1: Праймеры, использованные в данном исследовании для характеристики клеток. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
В данной статье мы описываем метод получения астроцитов, полученных из iPSC человека, которые служат платформой для анализа характеристик функциональных изменений, вызванных FXS. Эти астроциты функционально жизнеспособны в культуре и проявляют различные свойства, о чем свидетельствует ряд измерений, проведенных в настоящем исследовании. Важнейшим этапом в этом протоколе является первоначальная конверсия иПСК в кортикосферы с использованием метода ферментативного лифтинга. На этом этапе решающее значение имеет оптимизация времени инкубации коллагеназы IV типа и диспазы. Если это не оптимизировать, это может привести к распаду ИПСК или образованию отдельных клеток, что предотвратит образование кортикосфер. Эти кортикосферы структурированы в соответствии со специфичностью переднего мозга с использованием двойного ингибирования SMAD15 и далее дифференцируются в клетки-предшественники астроцитов (APC). Для достижения высокой популяции БТР решающее значение имеет механическое рубление глиосфер. Для подтверждения специфичности переднего мозга можно использовать кПЦР в реальном времени; Мы наблюдали значительное увеличение FOXG1, маркера переднего мозга, по сравнению с HOXB4, маркером спинного мозга.
Затем APC дифференцируются в астроциты с помощью CNTF, активатора сигнального пути16 JAK-STAT. Результаты этого исследования указывают на то, что терминально дифференцированные астроциты, полученные из иПСК FXS, имеют более низкие уровни GFAP, что указывает на нарушение зрелости. Несмотря на то, что наши анализы не выявили различий в синтезе белка de novo в астроцитах и APC FXS по сравнению с контрольной группой, мы обнаружили снижение синтеза белка de novo при переходе от APC к астроцитам как в FXS, так и в контрольных линиях. Значительное снижение трансляции между APC и астроцитами согласуется с более упорядоченной и курируемой трансляцией, которая была показана для нейронов по сравнениюс нейральными клетками-предшественниками. В более ранних работах, в которых изучался аберрантный синтез белка, использовались целые ткани мозга, нейроны и фибробласты, полученные от пациента, а не астроциты илиAPCs. Единственные опубликованные данные о синтезе белка из линий, полученных от пациентов, находятся не в астроцитах, а в лимфобластоидных клетках19 и фибробластах 20,21. В свете этих различий между исследованиями, будущие исследования выиграют от использования измерений FUNCAT в астроцитах, полученных из дополнительных линий, полученных от FXS-пациента.
Мы оценивали функциональность астроцитов путем измерения внутриклеточной динамики кальция22 и биоэнергетики. Астроциты FXS показали снижение пиковой амплитуды и продолжительности АТФ-индуцированных кальциевых переходных процессов, при этом меньше клеток реагируют на АТФ по сравнению с контрольными астроцитами. В совокупности эти изменения позволяют предположить, что FXS нарушает гомеостаз кальция в астроцитах человека. Эти результаты согласуются с более ранним исследованием23,24, в котором сообщалось о нарушении активности рецепторов IP3 в фибробластах FXS. Кроме того, мы наблюдали увеличение гликолиза, гликолитической емкости и гликолитического резерва в астроцитах FXS, наряду со снижением скорости потребления кислорода митохондриями.
В настоящем исследовании описывается создание и характеристика новой модели in vitro для астроцитов FXS с использованием возможностей ИПСК пациентов. Примечательно, что только благодаря более раннему исследованию с использованием человеческих астроцитов, совместно культивируемых с человеческими нейронами, мы обнаружили критическую роль астроцитов в определении электрофизиологического фенотипа нейронов. Эти исследования, однако, были почти полностью сосредоточены на вызванных болезнью изменениях в активности нейронов, и ничего не было изучено в астроцитах. В данном случае этот протокол предлагает новую основу для смещения нашего внимания на функциональные изменения в астроцитах. Это, в свою очередь, прольет свет на ранее неизученные взаимодействия астроцитов и нейронов, такие как глутаматная передача сигналов и электрические реакции. Наши результаты на данном этапе подчеркивают необходимость приоритизации астроцитов в будущих исследованиях.
Крайне важно признать ограничения этого протокола. Во-первых, это механическое измельчение, которое также приводит к фрагментации ДНК. Это может привести к тому, что измельченные глиосферы слипнутся, что в конечном итоге приведет к гибели клеток. Во-вторых, плотность посева АПК на стадии терминальной дифференцировки в астроциты имеет важное значение для предотвращения контактно-опосредованного межклеточного ингибирования. Рекомендуется оптимизировать этот показатель по всем клеточным линиям, чтобы предотвратить отслоение от поверхности сосуда для культивирования.
Здесь наши результаты являются первым подобным анализом на астроцитах человека, поскольку все прошлые исследования были основаны на других типах клеток, таких как лимфобластоидные клеточные линии и фибробластычеловека25. Дисфункциональный энергетический метаболизм является известным игроком в этиологии расстройств аутистического спектра, о чем свидетельствуют повышенные уровни лактата плазмы крови человека, значительно более низкая скорость потребления кислорода в гранулоцитах26 и сниженная экспрессия генов окислительного фосфорилирования митохондрий в передней поясной коре, моторной коре, таламусе и мозжечке у детей с РАС27. Аналогичные изменения в энергетическом метаболизме наблюдаются при нейродегенеративных расстройствах, таких как болезнь Паркинсонаи болезнь Альцгеймера29, что позволяет предположить, что повышенный гликолиз может компенсировать снижение функциональной функции. Необходимы дальнейшие исследования, чтобы выяснить, действуют ли аналогичные механизмы в дисфункциональном энергетическом метаболизме, наблюдаемом в астроцитах, полученных от пациентов FXS.
В настоящее время создание специфичных для переднего мозга астроцитов является значительным достижением, но будущие достижения могут позволить создать региональную глию, такую как корковые/гиппокампальные астроциты. Это обеспечит более глубокое понимание различных ролей, которые эти астроциты играют в региональных функциях мозга, синаптической пластичности и нейронально-глиальных взаимодействиях. Способность генерировать такие регионоспецифичные астроциты может продвинуть модели нейроразвития и нейродегенеративных заболеваний. В конечном счете, это может привести к более точным терапевтическим стратегиям, нацеленным на дисфункцию астроцитов в определенных областях мозга.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Мы благодарим профессора Сумантру Чаттарджи за внутренние фонды. Мы благодарим профессора Гайти Хасана за доступ к установке для визуализации кальция, Центральную установку визуализации и потока Национального центра биологических наук, Падманабха Сингха и Прангья Хоту за корректуру и предложения, а также команду Labmate Asia за их помощь в проведении анализов XF Seahorse.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-Thioglycerol | Sigma-Aldrich | M6145 | |
| Accutase solution | Sigma-Aldrich | A6964 | Enzyme cell detachment medium |
| Adenosine 5′-triphosphate magnesium salt | Sigma-Aldrich | A9187 | |
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634010 | |
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240062 | |
| B-27 Supplement (50x), serum-free | ThermoFisher Scientific | 17504044 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Chemically Defined Lipid Concentrate | ThermoFisher Scientific | 11905031 | |
| Collagenase, Type IV, powder | ThermoFisher Scientific | 17104019 | |
| Deoxyribonuclease I | Worthington Biochemical Corporation | LK003170 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D2650 | |
| Dispase II, powder | ThermoFisher Scientific | 17105041 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | |
| FXS1, FXS2 | Coriell Institute of Medical Research | GM07072, GM05848 | FXS patient cells |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | glutamine substitute |
| Ham's F-12 Nutrient Mix | ThermoFisher Scientific | 11765054 | |
| Healthy control cells | Cedars-Sinai Medical Center | ND30625 | healthy control cells |
| Heparin sodium salt from porcine intestinal mucosa | Sigma-Aldrich | H3149 | |
| IMDM | ThermoFisher Scientific | 12440053 | |
| Insulin, human | Roche | 11376497001 | |
| LDN 193189 | Stratech Scientific | S2618-SEL | |
| Leukemia Inhibitory Factor human | Sigma-Aldrich | L5283 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | |
| MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | 11140050 | |
| Mouse FGF-basic (FGF-2/bFGF) Recombinant Protein | Peprotech | 450-33 | |
| Mr. Frosty freezing container | ThermoFisher Scientific | 5100-0001 | cryobox |
| N-2 Supplement (100x) | ThermoFisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Neurobasal Medium | ThermoFisher Scientific | 21103049 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | ThermoFisher Scientific | 377267 | |
| Nunc Cell-Culture Treated 6 well dish | ThermoFisher Scientific | 140675 | |
| Papain Dissociation System | Worthington Biochemical Corporation | LK003150 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Recombinant Human CNTF Protein, CF | R&D Systems | 257-NT-010 | |
| Recombinant Human EGF Protein, CF | R&D Systems | 236-EG-01M | |
| RevitaCell Supplement (100x) | ThermoFisher Scientific | A2644501 | |
| SB431542 | Tocris | 1614 | |
| Seahorse XFe24 Analyzer | Agilent Technologies | ||
| Seahorse XF Cell Mito Stress Test Kit | Agilent Technologies | 103015-100 | |
| Seahorse XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| Tissue Culture Dishes-100 cm | Biostar Lifetech | TCD000100 | |
| Transferrin | Roche | 10652202001 | |
| VWR Razor Blades | VWR International | 55411-050 | |
| Antibodies | |||
| Primary antibody | Company | Catalog number | Dilution |
| Oct4 (C-10) | Santa Cruz Biotechnology | sc-5279 | Dilution: 1:250 Secondary antibody: Goat anti-Mouse IgG, Alexa Fluor 568 |
| Nanog | R & D Systems | AF1997 | Dilution: 1:100 Secondary antibody: Donkey anti-Goat IgG, Alexa Fluor 488 |
| Vimentin | Abcam | Ab5733 | Dilution: 1:500 Secondary antibody: Goat anti-Chicken IgY, Alexa Fluor 488 |
| NFIA | Abcam | Ab41851 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| GFAP-cy3 | Sigma | C9205 | Dilution: 1:500 Secondary antibody: NA |
| GFAP | DAKO | Z0334 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| S100β | DAKO | IR504 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 488 |
| Anti-Nuclei Antibody, clone 235-1 | Merck Millipore | MAB1281 | Dilution: 1:1000 Secondary antibody: Goat anti-Mouse IgG1, Alexa Fluor 555 |
| Secondary antibodies | Dilution | ||
| Goat anti-Mouse IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11004 | 1:1000 |
| Donkey anti-Goat IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11055 | 1:1000 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A11039 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11034 | 1:1000 |
| Goat anti-Mouse IgG1, Alexa Fluor 555 | Thermo Fisher Scientific | A21127 | 1:1000 |
Ссылки
- Santoro, M. R., Bray, S. M., Warren, S. T. Molecular of fragile X syndrome: A twenty-year perspective. Annu Rev Pathol. 7, 219-245 (2012).
- Wang, H., et al. Developmentally-programmed FMRP expression in oligodendrocytes: A potential role of FMRP in regulating translation in oligodendroglia progenitors. Hum Mol Genet. 13 (1), 79-89 (2004).
- Pacey, L. K. K., Doering, L. C. Developmental expression of FMRP in the astrocyte lineage: Implications for fragile X syndrome. Glia. 55 (15), 1601-1609 (2007).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Allen, N. J., Barres, B. A. Neuroscience: Glia - more than just brain glue. Nature. 457 (7230), 675-677 (2009).
- Khakh, B. S., McCarthy, K. D. Astrocyte calcium signaling: From observations to functions and the challenges therein. Cold Spring Harb Perspect Biol. 7 (4), a020404(2015).
- Allen, N. J., et al. Astrocyte glypicans 4 and 6 promote formation of excitatory synapses via GluA1 AMPA receptors. Nature. 486 (7403), 410-414 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Rothstein, J. D., et al. Knockout of glutamate transporters reveals a major role for astroglial transport in excitotoxicity and clearance of glutamate. Neuron. 16 (3), 675-686 (1996).
- Almad, A., Maragakis, N. J. A stocked toolbox for understanding the role of astrocytes in disease. Nat Rev Neurol. 14 (6), 351-362 (2018).
- Zhang, Y., Barres, B. A. Astrocyte heterogeneity: An underappreciated topic in neurobiology. Curr Opin Neurobiol. 20 (5), 588-594 (2010).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neurosci. 14 (5), 311-321 (2013).
- Bradley, R. A., et al. Regionally specified human pluripotent stem cell-derived astrocytes exhibit different molecular signatures and functional properties. Development. 146 (13), dev170910(2019).
- Das Sharma, S., et al. Astrocytes mediate cell non-autonomous correction of aberrant firing in human FXS neurons. Cell Rep. 42 (4), 112344(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Hu, X., et al. The JAK/STAT signaling pathway: from bench to clinic. Sig Transduct Target Ther. 6, 402(2021).
- Baser, A., et al. Onset of differentiation is post-transcriptionally controlled in adult neural stem cells. Nature. 566 (7742), 100-104 (2019).
- Pal, R., Bhattacharya, A. Modelling protein synthesis as a biomarker in fragile x syndrome patient-derived cells. Brain Sci. 9 (3), 1-12 (2019).
- Gross, C., Bassell, G. J. Excess protein synthesis in FXS patient lymphoblastoid cells can be rescued with a p110β-selective inhibitor. J Mol Med. 18 (3), 336-345 (2012).
- Kumari, D., et al. Identification of fragile X syndrome specific molecular markers in human fibroblasts: A useful model to test the efficacy of therapeutic drugs. Hum Mutat. 35 (12), 1485-1494 (2014).
- Jacquemont, S., et al. Protein synthesis levels are increased in a subset of individuals with fragile X syndrome. Hum Mol Genet. 27 (12), 2039-2051 (2018).
- Bowser, D. N., Khakh, B. S. ATP excites interneurons and astrocytes to increase synaptic inhibition in neuronal networks. J Neurosci. 24 (39), 8606-8620 (2004).
- Schmunk, G., Boubion, B. J., Smith, I. F., Parker, I., Gargus, J. J. Shared functional defect in IP3R-mediated calcium signaling in diverse monogenic autism syndromes. Transl Psychiatry. 5 (9), e643-e710 (2015).
- Peteri, U. K., et al. Generation of the human pluripotent stem-cell-derived astrocyte model with forebrain identity. Brain Sci. 11 (2), 209(2021).
- Alvarez-Mora, M. I., et al. Impaired mitochondrial function and dynamics in the pathogenesis of FXTAS. Mol Neurobiol. 54 (9), 6896-6902 (2017).
- Giulivi, C., et al. Mitochondrial dysfunction in autism. JAMA. 304 (21), 2389-2396 (2010).
- Anitha, A., et al. Brain region-specific altered expression and association of mitochondria-related genes in autism. Mol Autism. 3 (1), 12(2012).
- Teves, J. M. Y., et al. Parkinson's disease skin fibroblasts display signature alterations in growth, redox homeostasis, mitochondrial function, and autophagy. Front Neurosci. 11, 737(2018).
- Yao, J., et al. Mitochondrial bioenergetic deficit precedes Alzheimer's pathology in female mouse model of Alzheimer's disease. Proc Natl Acad Sci USA. 106 (34), 14670-14675 (2009).
- Sonntag, K. C., et al. Late-onset Alzheimer's disease is associated with inherent changes in bioenergetics profiles. Sci Rep. 7 (1), 14038(2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены