Method Article
Frajil X Messenger Ribonükleoproteinden Yoksun İnsan Kaynaklı Pluripotent Kök Hücre Kaynaklı Astrositlerin Üretimi ve Karakterizasyonu
Bu Makalede
Özet
Burada, insan kaynaklı pluripotent kök hücrelerin fonksiyonel ön beyne özgü astrositlere farklılaşmasını kolaylaştıran bir protokolü açıklıyoruz. Bu, Frajil X Sendromu gibi nörogelişimsel bozuklukların patogenezinde glial hücrelerin rolünün araştırılmasını ve diğer beyin bozukluklarının modellenmesini sağlar.
Özet
Otizm spektrum bozukluğu ve zihinsel engelliliğin önde gelen kalıtsal bir nedeni olan Frajil X sendromu (FXS), kemirgen modelleri kullanılarak kapsamlı bir şekilde incelenmiştir. Daha yakın zamanlarda, insan kök hücresinden türetilmiş model sistemleri, FXS'nin patofizyolojisi hakkında mekanik içgörüler elde etmek için de kullanılmıştır. Bununla birlikte, bu çalışmalar neredeyse sadece nöronlara odaklanmıştır. Ayrıca, glia'nın sağlık ve hastalıkta nöronal fonksiyonda önemli bir rol oynadığına dair artan kanıtlara rağmen, insan astrositlerinin FXS'den nasıl etkilendiği hakkında çok az şey bilinmektedir.
Bu nedenle, bu çalışmada, beyin gelişiminin temel uzay-zamansal kilometre taşlarını yakalayan ve aynı zamanda gliogenez süreciyle de uyumlu olan bir protokolü başarıyla geliştirdik. Birlikte bu, nörogelişimsel bozuklukları incelemek için yararlı bir çerçeve sunar. İlk olarak, insan kaynaklı pluripotent kök hücreleri, Dekapentaplejik (SMAD) inhibisyona ve küçük moleküllere karşı ikili Anneler Baskılayıcı ile nöroektodermal soy içine yerleştirdik. Daha sonra, kontrol (CTRL) ve FXS hastadan türetilmiş astrositik progenitör hücreler (APC'ler) oluşturmak için spesifik büyüme faktörleri ve sitokinler kullandık. APC'lerin farklılaşan bir sitokin olan siliyer nörotrofik faktör ile tedavisi, progenitör hücreleri düzenledi ve astrositik olgunlaşmaya doğru sürükledi, ön beyne özgü glial fibriler asidik protein eksprese eden astrositler verdi.
Bu astrositlerin, ATP uygulamasına kalsiyum yanıtları ile kanıtlandığı gibi işlevsel olduklarını ve FXS'de düzensiz glikolitik ve mitokondriyal metabolizma sergilediklerini bulduk. Birlikte ele alındığında, bu bulgular, nörogelişimsel bozuklukların neden olduğu astrositik fonksiyondaki değişikliklerin hücre otonom ve hücre otonom olmayan sonuçlarının araştırılması için insan kaynaklı yararlı bir deneysel platform sağlar.
Giriş
Zihinsel engellilik ve otizm spektrum bozukluğunun (OSB) yaygın bir kalıtsal formu olan Frajil X Sendromu (FXS), frajil X haberci ribonükleoprotein 1 (FMR1) geni (OMIM: #300624, https://www.omim.org/entry/300624) tarafından üretilen frajil X haberci ribonükleoprotein (FMRP) eksikliğinden kaynaklanır. FMRP, mRNA translasyonunun düzenlenmesinde, mRNA granül oluşumu ve taşınmasında ve gen ekspresyonunun mikroRNA aracılı regülasyonundarol oynar 1. Bu nedenle, FMRP kaybı sadece beyin gelişimini değil, aynı zamanda yetişkin beyin fonksiyonlarını da etkiler. Hem FMR1'in mRNA transkript seviyeleri hem de beyindeki FMRP için immün boyama, glial hücrelerde de önemli ekspresyonun yanı sıra yüksek nöronal ekspresyon göstermiştir2. Bununla birlikte, FXS'nin hayvan modellerinde daha önce yapılan çalışmaların büyük çoğunluğu, öncelikle nöronlara ve işlevlerindeki sapmalara odaklanmıştır. Sonuç olarak, glia'nın FXS3'teki rolü hakkında çok az şey bilinmektedir. Geleneksel olarak "pasif destek" hücreleri4 olarak düşünülen astrositlerin, sinaptogenezin teşvik edilmesi7, gelişmekte olan nöral devrelerin8 iyileştirilmesi ve nörotransmitter geri dönüşümü9 dahil olmak üzere çok çeşitli nöronal işlevlere 5,6 aracılık etmede kritik olduğuna dair biriken kanıtlar vardır. Buna paralel olarak, astrositlerin hastalık patogenezindeki rolüne dair artan kanıtlar vardır ve birçok nörolojik durum astrositik disfonksiyon ile ilişkilendirilmiştir10.
FXS'nin hayvan modellerini kullanan daha önceki çalışmaların çoğu, FXS'yi tedavi etmek için nöronlardaki çeşitli moleküler hedeflerin belirlenmesine ve doğrulanmasına odaklanmış olsa da, bu klinik öncesi bulgular her zaman başarılı klinik sonuçlara yol açmamıştır. Ayrıca, son klinik çalışmalardaki aksaklıklar da insan temelli model sistemlere olan ihtiyacın altını çizmektedir. İnsan kök hücresinden türetilmiş beyin hücrelerine dayanan nörolojik bozukluk modelleri, hayvan çalışmalarından elde edilen mekanik içgörüler ile hastalar için klinik sonuçlarla sınırlı başarı arasındaki bu boşluğu kapatmak için güçlü bir strateji sunmaktadır. Bununla birlikte, bu çalışmaların sadece bir kısmı astrositlere odaklanmıştır ve bu da çoğunlukla omurga kökenli astrositlere odaklanmıştır. Bu da, astrositlerin yapısının ve işlevinin beyin bölgeleri arasında farklılık gösterdiğini gösteren çalışmaların ışığında önemlidir11,12. Bu nedenle, insan astrositlerinde hastalığa bağlı değişikliklerin daha iyi anlaşılması, astrositlerdeki bu beyin bölgesine özgü farklılıkları da hesaba katmalıdır. Bununla birlikte, ön beyne özgü insan kök hücre türevli astrositleri kullanan nörogelişimsel bozukluk modelleri nispeten az araştırılmıştır13. Bu nedenle, bu boşlukları ele almaya başlamak için, FXS mutasyonları taşıyan hastadan türetilmiş indüklenmiş pluripotent kök hücrelerden (iPSC'ler) ön beyne özgü astrositler üretmek için protokolleri açıklıyoruz; Ayrıca, astrositlerin işlevsel olduğunu ve değişmiş metabolizma gösterdiğini gösteriyoruz.
Protokol
İnsan kaynaklı pluripotent kök hücreler (hiPSC'ler) (Tablo 1) kullanılarak yapılan tüm deneyler, uygun kurumsal düzenleyici onaylar alındıktan sonra gerçekleştirilmiştir. Şekil 1A , hiPSC'lerin olgun ön beyne özgü astrositlere tam farklılaşma protokolünü temsil eder.
1. hiPSC'lerin bakımı ve genişletilmesi
- iPSC'leri kaplamadan bir gün önce, 6 oyuklu bir tabağı 1:60 seyreltilmiş Matrigel (bir Hücre Dışı Matris [ECM]) ile Advanced Dulbecco'nun Modifiye Eagle Medium/Ham'ın F-12'sinde (DMEM/F12) kaplayın ve 2-8 °C'de saklayın.
NOT: Matrigel kaplı tabakları >5 gün boyunca 2-8 °C'de saklamaktan kaçının, çünkü bu zamanla ECM'de protein bozulmasına neden olabilir. Yemeğin kurumasını önlemek için, 6 oyuklu bir tabağın bir oyuğu başına en az 1 mL 1:60 seyreltilmiş Matrigel kaplayın ve tabağa eşit şekilde yayın. Aynı gün kullanıyorsanız, plakayı 37 ° C'de ve 1 saat boyunca% 5 CO2'de nemlendirilmiş bir inkübatörde tutun. - HiPSC'lerin kültürlendiği gün, kaplama malzemesini çıkarın ve 1x nihai konsantrasyonda ROCK inhibitörü ile birlikte 1 mL tam Essential 8 besiyeri (Esansiyel 8 takviyeli E8 bazal besiyeri) ekleyin ve hiPSC'leri eklemeden önce tabağı 37 °C ve %5 CO2 inkübatörde tutun.
- Kolonilerin daha iyi yapışması için hiPSC'leri tam E8 ortamında ROCK inhibitörü ile birlikte 1x son konsantrasyonda yeniden süspanse edin.
NOT: Büyük miktarlarda kültür ortamı hazırlamayın. En fazla 3-4 gün hazırlayın ve 2-8 °C'de saklayın. - Ertesi gün, hücreler% 80 birleşene kadar (yaklaşık 4-5 gün) ROCK inhibitörü olmadan tüm E8 ortamını doldurun.
- % 80 birleşmeye ulaştıklarında, kolonileri enzimatik olarak ayırın.
- iPSC'leri geçmek için, harcanan ortamı tabaktan çıkarın ve önceden ısıtılmış (37 ° C) kollajenaz (2 mg / mL) karışımı (2 mg / mL) ve dispas (1 mg / mL) 1: 1 oranında 1 mL ekleyin ve iPSC kolonilerinin kalkmasına izin vermek için 37 ° C'de 20-30 dakikadan fazla inkübe edin.
NOT: Bulaşıkları 37 °C'de 20-30 dakikadan fazla bırakmayın; Bu sürenin ötesinde koloniler parçalanacak ve hücreler ölecektir.
- iPSC'leri geçmek için, harcanan ortamı tabaktan çıkarın ve önceden ısıtılmış (37 ° C) kollajenaz (2 mg / mL) karışımı (2 mg / mL) ve dispas (1 mg / mL) 1: 1 oranında 1 mL ekleyin ve iPSC kolonilerinin kalkmasına izin vermek için 37 ° C'de 20-30 dakikadan fazla inkübe edin.
- Koloniler kalkmaya başladığında, bulaşıkları kuluçka makinesinden çıkarın ve 2 mL Dulbecco'nun Fosfat Tamponlu Salin (DPBS) ekleyerek enzim aktivitesini nötralize edin.
- Kolonileri DPBS ile kazıyın ve süspansiyonu geniş delikli 10 mL'lik bir serolojik pipet kullanarak 15 mL'lik bir konik tüpte toplayın.
- 10 mL'lik bir serolojik pipet kullanarak kolonileri parçalamak için süspansiyonu 2-3x nazikçe ezin ve kolonilerin yerleşmesine izin verin.
NOT: Kolonileri tek hücre haline getirmeyin; Bu, hücrelerin yemeğe yapışmamasına ve daha fazla hücre ölümüne neden olabilir. Ayrıca, onları büyük koloniler olarak bırakmayın; Bu, daha sonra daha farklılaşmış kolonilere yol açacaktır. - Koloniler yerleştikten sonra (yaklaşık 2 dakika sonra), tüpte yaklaşık 1 mL bırakarak DPBS enzim karışımını aspire edin.
- Tüpe 2 mL DPBS ekleyin, kolonileri hafifçe vurarak karıştırın ve çökmelerine izin verin. Kolonilerden kalan tüm enzimi çıkarmak için bu 2 kez tekrarlayın. 2. yıkamadan sonra mümkün olduğu kadar çok süpernatanı çıkarın, kolonileri 1 mL tam E8 Ortamında yeniden süspanse edin ve 1.2-1.3 adımlarında belirtildiği gibi taze hazırlanmış bir tabakta tabağa koyun.
- Alternatif olarak, gelecekteki genişleme ve kullanım için kriyoprotektan çözeltisi olarak %10 dimetil sülfoksit (DMSO) kullanan kolonilerin bir kısmını kriyoprezervasyon yapın.
- Kriyoprotektan solüsyon olarak %90 tam E8 besiyeri ve %10 DMSO'yu karıştırarak kriyoprezervasyon ortamını taze olarak hazırlayın ve kullanana kadar 2-8 °C'ye koyun.
- Kriyoprezervasyon yapmak için 1.5-1.10 adımlarını izleyin.
- Adım 1.10 sırasında, 2. yıkamadan sonra, kolonilerin yerleşmesine ve süpernatanı çıkarmasına izin verin. Kolonilere 1 mL taze hazırlanmış soğuk kriyoprezervasyon ortamı ekleyin ve kriyoviyallere aktarın.
NOT: Kriyoprezervasyon ortamını kolonilere ekledikten sonra, içeriği hızlı bir şekilde kriyoviyallere aktarın. DMSO, hücrelere zarar verebilecek bir kriyoprotektan olduğundan, geciktirme daha düşük bir canlanma oranına neden olabilir. - Kriyovialleri hemen bir kriyo kutusuna taşıyın ve gece boyunca -80 ° C'lik bir dondurucuda saklayın.
- Ertesi gün, tüm kriyoviyalleri ileride kullanmak üzere bir Sıvı Nitrojen tankına (LN2 tankı) kaydırın.
NOT: hiPSC'ler, herhangi bir anormallik için G-bandı (Ek Şekil S1) kullanılarak rutin olarak karyotiplendirilmeli, pluripotens için immünositokimya kullanılarak karakterize edilmelidir (Şekil 1B) ve mikoplazma için test edilmelidir.- İmmünositokimya kullanarak hiPSC'leri karakterize etmek için, kolonileri 1:60 Matrigel kaplı, otoklavlanmış 13 mm cam lameller üzerine yerleştirin. % 40 birleştikten sonra, hücreleri PBS-T (PBS-0.1% Tween 20) ile yıkayın, 10 dakika boyunca% 4 paraformaldehit ile sabitleyin, 10 dakika boyunca PBS'de% 0.3 Triton X-100 ile geçirgen hale getirin ve spesifik olmayan bağlanmayı önlemek için PBS'de% 3 Sığır Serum Albümini (BSA) ile 1 saat bloke edin.
- Bloke ettikten sonra, kültürleri 1 saat boyunca birincil antikorlarla inkübe edin ve daha sonra 3x'i PBS-T ile her biri 5 dakika boyunca yıkayın, ardından karanlıkta 1 saat boyunca karşılık gelen ikincil antikorları (Malzeme Tablosu) yıkayın.
- Lamelleri montaj ortamı ile cam kızaklara monte edin ve 405 nm, 488 nm, 561 nm ve 633 nm'de konfokal lazer tarama ile görüntüler elde edin. 512 x 512 pikselde görüntü yakalayın; Z adım boyutunu 0.5 havadar iğne deliği çapı ile 1 μm'ye ayarlayın.
2. Astrositik progenitör hücrelerin (APC'ler) oluşumu ve karakterizasyonu
- HiPSC'leri adım 1.5-1.10'da belirtildiği gibi enzimatik olarak kaldırın ve bunları %50 Iscove'un Modifiye Dulbecco'nun Ortamı (IMDM), %50 Jambonun F-12 Besin Karışımı (F12), 5 mg/mL BSA, %1 Kimyasal Olarak Tanımlanmış Lipid Konsantresi (CD-Lipid), 450 μM Monotiogliserol, 7 μg/mL İnsülin, 15 μg/mL Transferrin içeren kimyasal olarak tanımlanmış ortam14 ile yapışmayan bir süspansiyon kültür kabına (100 mm) yerleştirin, 7 gün boyunca ön beyin patern mitojenleri N-asetil Sistein (1 mM), LDN 193189 (0.1 μM) ve SB431542 (10 μM) ile desteklenmiş% 1 Penisilin-Streptomisin.
NOT: Küçük molekül inhibitörleri SB431542 ve LDN-193189 (LDN), kemik morfogenetik proteininin ve transforme edici büyüme faktörü-beta sinyal yolaklarının inhibitörleridir.
Bu noktadan itibaren, ortam 2 günde bir veya Pazartesi/Çarşamba/Cuma protokolünü takiben yenilendi. - Kortikosferlerin gelişimine yardımcı olmak için hücre süspansiyonunu normoksik koşullar altında 7 gün boyunca 40 rpm'de bir orbital çalkalayıcı üzerine yerleştirin (Şekil 1A).
- 8. günde, kortikosferleri 7 gün boyunca% 1 Antibiyotik-Antimikotik,% 1 N2 takviyesi,% 1 glutamin ikamesi,% 0.1 B27 takviyesi ve% 0.1 / mL temel fibroblast büyüme faktörü (bFGF) ile Gelişmiş DMEM / F12 içeren bir hücre proliferasyon ortamına aktarın.
- Erken gliosferler elde etmek için küreleri 2 hafta boyunca %1 Antibiyotik-Antimikotik, %1 N2, %1 glutamin ikamesi, %0.1 B27 takviyesi, 20 ng/mL epidermal büyüme faktörü (EGF), bFGF-H (20 ng/mL bFGF-5 mg/mL heparin) içeren Gelişmiş DMEM/F12 içeren glial zenginleştirme ortamına tabi tutarak glial spesifikasyon için indükleyin (Şekil 1A).
- Erken gliosferlerin olgunlaşması için, bFGF-H'yi 20 ng / mL lösemi inhibitör faktörü (LIF) ile değiştirin ve küreleri 4 hafta boyunca koruyun.
- Olgunlaşma ortamında 4 hafta sonra, küreleri uzun süre glial zenginleştirme ortamında tutun. Topaklanmayı ve canlılık kaybını önlemek için, her 2 haftada bir, steril bir endüstriyel bıçak kullanarak gliosferleri mekanik olarak doğrayın ve doğramadan üretilen DNA parçalarını çıkarmak için tüm ortamı DNaz I ile değiştirin.
- Bir Papain ayrışma kiti kullanarak gliosferleri APC'lerin tek katmanlarına ayırın ve 1:80 Matrigel kaplama seyreltme ile hücre kültürü ile muamele edilmiş yapışkan bir tabak üzerine plaka koyun.
- APC'leri glial zenginleştirme ortamında %80 birleşene kadar çoğaltın ve enzim hücresi ayırma ortamını kullanarak bunları enzimatik olarak geçirin (Malzeme Tablosuna bakınız).
- Geçmek için:
- Harcanan ortamı çıkarın ve konik bir tüpte toplayın. Hücrelere enzim hücre ayrılma ortamını ekleyin ve 1-2 dakika bekleyin. Hücreler ayrılmaya başladığında, enzim aktivitesini nötralize etmek için harcanan ortamı ekleyin.
- Hücre süspansiyonunu toplayın ve 800 x ɡ'de 2 dakika santrifüjleyin.
- Süpernatanı aspire edin, hücreleri glial zenginleştirme ortamında yeniden süspanse edin ve yaklaşık 1 x 106 hücre / kuyu üzerine 1:80 Matrigel kaplı 6 oyuklu bir tabağa yerleştirin.
- Kriyoprezervasyon için:
- Hücreleri% 90 kortikosfer proliferasyon ortamı (bFGF olmadan) ve% 10 kriyoprotektan oluşan soğuk bir karışımda yeniden süspanse edin. Yeniden askıya alınan hücreleri kriyoviyallere aktarın.
- Kriyovialleri hemen bir kriyokutuya taşıyın ve gece boyunca -80 °C dondurucuda saklayın.
- Ertesi gün, tüm kriyoviyalleri ileride kullanmak üzere bir Sıvı Nitrojen tankına (LN2 tankı) kaydırın.
NOT: APC'ler, 6 numaralı geçişe kadar %10 DMSO kullanılarak dondurularak saklandı.
- Ayrışmış APC'leri vimentin ve Nükleer Faktör IA (NFIA) belirteçleri ile immün boyama (adım 1.15.1-1.15.3'te belirtildiği gibi) ile karakterize edin (Şekil 1C, D) (Seyreltmeler için Malzeme Tablosuna bakınız).
- HiPSC'den türetilmiş APC'lerin ön beyin bölgesel özgüllüğünü doğrulamak için, hücreleri gerçek zamanlı qPCR kullanarak insan çatal başlı kutu G1 (hFOXG1) (pozitif) gibi bir ön beyin işaretleyicisi ve insan Homeobox B4 (hHOXB4) (negatif) gibi bir arka beyin belirteci için test edin (Şekil 1E, F).
NOT: Bu deneyler için kullanılan primer dizileri Ek Tablo S1'de listelenmiştir.
3. Ön beyne özgü astrositlerin homojen bir popülasyonunun üretilmesi ve karakterizasyonu
- Astrositlerin APC'lerden farklılaşması
- APC'leri astrositlere ayırmak için 14 gün boyunca Astrositik farklılaşma ortamı (ADM) kullanın. Astrositik farklılaşma ortamı Nörobazal, %1 Antibiyotik-Antimikotik, %1 glutamin ikamesi, %1 N2 takviyesi, %0.2 B27 takviyesi, %1 esansiyel olmayan amino asit ortamı (NEAA) ve 10 ng/mL siliyer nörotrofik faktör (CNTF) içerir.
- Glial fibriler asidik protein (GFAP) ve S100β ekspresyon belirteçleri ile immün boyama (adım 1.15.1-1.15.3'te belirtildiği gibi) kullanarak astrositik kimliği doğrulayın (Şekil 2A, B).
- APC'lerde ve astrositlerde de novo protein sentezi
- HiPSC'den türetilmiş ön beyin APC'lerini ve astrositleri steril otoklavlanmış 13 mm cam lameller üzerinde koruyun ve bunları adım 1.15.1-1.15.3'te belirtildiği gibi immünobolayın.
- De novo protein sentezi için, adım 3.2.3-3.2.6'da kısaca açıklanan floresan kanonik olmayan amino asit etiketleme (FUNCAT) yöntemini kullanın (Şekil 3A).
- Metiyonin eksikliğini sağlamak için, büyüme ortamını kültürlerden çıkarın ve 37 ° C'de 30 dakika boyunca ve% 5 CO2 boyunca 1 mM L-azidohomoalanin (AHA) ile karıştırılmış metiyonin ve sistein içermeyen ortam ile değiştirin.
- Kültürleri PBS-T ile yıkayın, 10 dakika boyunca% 4 paraformaldehit ile sabitleyin, 10 dakika boyunca PBS'de% 0.3 Triton X-100 ile geçirgen hale getirin ve spesifik olmayan bağlanmayı önlemek için 1 saat boyunca PBS'de% 3 BSA ile bloke edin.
- Kültürleri karanlıkta oda sıcaklığında Click hücre kimyası reaksiyon karışımı ve Alkyne Alexa Fluor 647 ile 1 saat inkübe edin, ardından 1 saat boyunca birincil antikorlar ve 1 saat boyunca karşılık gelen ikincil antikorlar (Malzeme Tablosu) (Şekil 3B).
- Lamelleri montaj ortamı ile cam slaytlara monte edin ve daha fazla görüntü analizi için kullanın.
- 405 nm, 488 nm, 561 nm ve 633 nm'de konfokal lazer tarama ile görüntüler elde edin.
- 512 x 512 pikselde görüntü yakalayın; Z adım boyutunu 0.5 havadar iğne deliği çapı ile 1 μm'ye ayarlayın.
- Mikroskopi ve görüntüleme parametrelerini hücre tipleri arasında sabit bir ayarda tutun. Aynı oturumda her biyolojik kopya için görüntü yakalayın.
- Herhangi bir standart görüntü analiz yazılımı (örneğin, Fiji veya Imaris) kullanarak yoğunluk ölçümleri yapın. Imaris'te, kalıntıları gidermek için voksel aralığını (250-350) sınırlayan Vimentin (APC'ler) ve GFAP (astrositler) ile floresan kanonik olmayan amino asit etiketleme (FUNCAT) sinyali için pozitif hücre gövdelerinin hacimsel ölçümlerini elde etmek için SURFACES modülünü kullanın.
NOT: Her iki hücre tipi için tüm biyolojik replikalardaki parametreleri koruyun.
- Adenozin 5'-trifosfat (ATP) ile indüklenen salınımlı kalsiyum dalgaları
- ATP'ye hücresel yanıtı ölçmek için 5 × 103 hücre/tabakta bir cam tabanlı tabak (35 mm) üzerinde plaka astrositleri.
- Hücrelerin 24 saat boyunca cam tabana yapışmasına izin verin, 3 kez HBSS (20 mM HEPES, 137 mM NaCl, 5 mM KCl, 10 mM Glikoz, 1 mM MgCl2, pH = 7.3) ile kalsiyum olmadan yıkayın ve 5 μM oranlı metrik boya Fura-2AM ve% 0.02 Pluronics F127 ile oda sıcaklığında 1 saat inkübe edin.
NOT: Fura-2AM, ışığa ve sıcaklığa duyarlı bir kimyasaldır; -20 °C'de saklayın. - İnkübasyon sonrası, 2x'i kültür ortamı ile yıkayın ve HBSS içeren 2 mM Ca2+ ile değiştirin ve odak kaymasını dengeleyen ters çevrilmiş mikroskopta 60x yağ objektifi (1.35 NA) kullanarak hücreleri 2 FPS hızında görüntüleyin.
- ATP'nin neden olduğu kalsiyum yanıtlarını, 25inci s'de 5 mM'lik son konsantrasyonda ATP'nin banyo uygulamasıyla kaydedin (Şekil 4A).
- Fiji/ImageJ kullanarak her hücrenin etrafına ilgi alanları çizin ve tüm zaman noktalarında F340/F380 oranını hesaplayın (Şekil 4B).
- Hücre metabolik tahlilleri
NOT: Canlı hücrelerin oksijen tüketim oranı (OCR) ve hücre dışı asitleşme oranı (ECAR), üreticinin protokolüne göre ölçülmüştür (bkz. Malzeme Tablosu).- Tahlilden bir gün önce, astrositlerin CNTF ortamında mikroplakaya (1.5 × 10:4 tohumlama yoğunluğu) yapışmasına izin verin ve% 5 CO2 ile 37 ° C'de inkübe edin.
- Glikoliz stres testi için:
- Hücre kültürü ortamını 2 mM glutamin (pH 7.4'e ayarlanmış) ile takviye edilmiş baz ortamı ile değiştirin ve COolmayan bir 2 odasında 37 ° C'de 1 saat inkübe edin.
NOT: pH, 37 °C'lik bir su banyosunda ayarlanmalıdır. - Sensörü kalibre etmek için kartuş plakasını cihaza yerleştirin. Kalibrasyondan sonra, kartuş plakasını aşağıdaki kit bileşenlerinin son konsantrasyonunda hücre kültürü plakasıyla değiştirin: 10 mM glikoz, 1 μM oligomisin ve 50 mM 2-deoksi-glikoz (2-DG) (Şekil 5A).
- Testin sonunda, hücreleri parçalayın ve toplam protein içeriğini tahmin edin.
- Hücre kültürü ortamını 2 mM glutamin (pH 7.4'e ayarlanmış) ile takviye edilmiş baz ortamı ile değiştirin ve COolmayan bir 2 odasında 37 ° C'de 1 saat inkübe edin.
- Mitokondri stres testi için:
- CNTF ortamını, 37 ° C'de bir su banyosunda 2 mM glutamin, 1 mM piruvat, 10 mM glikoz (pH 7.4'e ayarlanmış) ile desteklenmiş baz ortamla değiştirin.
- Plakayı CO2 olmayan bir odada 37 ° C'de 1 saat inkübe edin. Bu arada, sensörü kalibre etmek için kartuş plakasını cihaza yerleştirin.
- Kalibrasyondan sonra, kartuş plakasını aşağıdaki kit bileşenlerinin son konsantrasyonu ile hücre kültürü plakasıyla değiştirin: 1.5 μM oligomisin, 1 μM karbonil siyanür-4 (triflorometoksi) fenilhidrazon (FCCP) ve 0.5 μM rotenon/antimisin A (Şekil 5C).
- Testin sonunda, hücreleri parçalayın ve toplam protein içeriğini tahmin edin.
Sonuçlar
İnsan kaynaklı pluripotent kök hücre (hiPSC) kolonileri, ticari olarak temin edilebilen tanımlanmış besiyeri kullanılarak korundu ve pluripotens belirteçleri, Oct4 ve Nanog için immün boyandı (Şekil 1B). FXS ve CTRL APC'ler, vimentin ve NFIA için immünopozitif hücrelerin karşılaştırılabilir yüksek oranda zenginleştirilmiş oranlarını gösterdi (Şekil 1C, D). Sağlıklı ve FXS hiPSC'lerden türetilen APC'lerin, baskın bir ön beyin kimliği ile tutarlı olarak HOXB4'e (Şekil 1F) kıyasla FOXG1'de önemli ölçüde yukarı regülasyon gösterdiğini bulduk. FXS gruplarında CTRL astrositlerine kıyasla GFAP eksprese eden astrositlerin sayısında, S100β eksprese eden astrositlerin sayısını etkilemeden önemli bir azalma gözlemledik (Şekil 2B). Western blot analizi, her iki FXS hattından üretilen astrositlerin FMRP ekspresyonundan yoksun olduğunu gösterdi (Şekil 2C,D). Yeni sentezlenen proteinlerin miktar tayini, APC'lerde veya astrositlerde CTRL ile FXS çizgileri arasında anlamlı bir fark ortaya koymadı (Şekil 3C). Bununla birlikte, APC'lerde protein sentezinin, her bir hat için ilgili astrositlerinden sürekli olarak daha yüksek olduğunu bulduk (Şekil 3C). Bu sonuçlar, hem FXS hem de CTRL hatlarında APC'lerden astrositlere de novo protein sentezinde aşamaya özgü bir azalma olduğunu göstermektedir.
Kontrol ve FXS astrositleri, ATP'nin neden olduğu kalsiyum geçişleri sergiledi (Şekil 4A). Bununla birlikte, daha ayrıntılı bir analiz, CTRL, FXS1 ve FXS2 astrositlerinden kaydedilen bireysel kalsiyum geçişleri arasında birkaç önemli fark olduğunu ortaya çıkardı (Şekil 4B). Astrositleri, sırasıyla bir kalsiyum yanıtının varlığına veya yokluğuna bağlı olarak ATP'ye yanıt verenler ve yanıt vermeyenler olarak sınıflandırdık (Şekil 4C). FXS1 ve FXS2'deki yanıtlayıcı sayısı CTRL'den önemli ölçüde düşüktü. Spesifik olarak, her iki FXS astrosit hattında ATP uygulamasından sonra uyarılan ilk kalsiyum geçişinin tepe genliğinde önemli bir azalma gözlemledik (Şekil 4D). Ayrıca, ilk kalsiyum geçişinin toplam süresi FXS1 ve FXS2 hatlarında CTRL'den önemli ölçüde daha kısaydı (Şekil 4E). Bununla birlikte, kalsiyum olaylarının sayısı (250 s başına toplam olay sayısı olarak ölçülür; Şekil 4F), çizgiler arasında karşılaştırılabilirdi. Birlikte ele alındığında, bu bulgular hiPSC'den türetilmiş FXS astrositlerinde ATP tarafından ortaya çıkan kalsiyum yanıtlarındaki değişiklikleri ortaya koymaktadır. ECAR sonuçları, hiPSC'den türetilmiş FXS astrositlerinde daha yüksek oranda glikoliz, glikolitik kapasite ve glikolitik rezerv olduğunu göstermektedir (Şekil 5A,B). CTRL ve FXS astrositlerinde bazal solunumda anlamlı bir fark bulamadık. Hücresel ATP üretimi CTRL ve FXS astrositleri arasında anlamlı bir fark göstermedi. FCCP stimülasyonu, FXS astrositlerinde CTRL astrositlerine göre önemli ölçüde daha düşük maksimal solunum ortaya çıkardı (Şekil 5C, D).
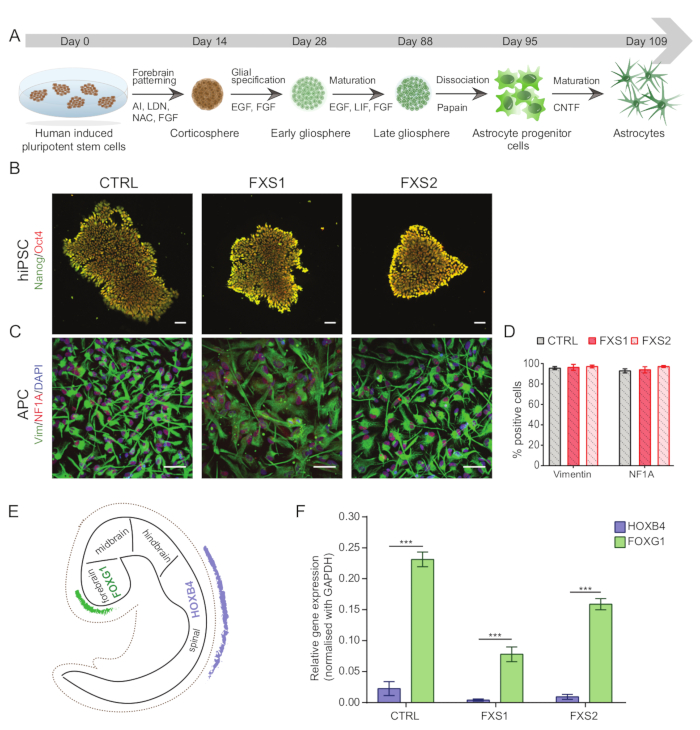
Şekil 1: hiPSC'lerden ön beyne özgü astrositik progenitör hücrelerin türetilmesi. (A) hiPSC'lerden astrosit üretimi için açıklayıcı iş akışı. (B) CTRL ve FXS satırlarında Oct4/Nanog'un karşılaştırılabilir ifadesini gösteren hiPSC'lerin temsili görüntüleri. (C) HiPSC'den türetilmiş APC'lerin homojen popülasyonu, benzer sayıda Vimentin ve NFIA pozitif hücre eksprese etti. (D) CTRL ve FXS APC'ler arasında Vimentin ve NFIA'nın ifadesinde önemli bir fark yoktur. İstatistiksel analiz iki faktörlü varyans analizi (ANOVA) kullanılarak yapıldı ve ardından Tukey'in ikili karşılaştırması yapıldı. (E) İn vivo geliştirme sırasında FOXG1 ve HOXB4'ün bölgeye özgü ifadesini gösteren şematik. (F) Ön beyin soyuna eğilimi düşündüren genotipler arasında HOXB4 (qRT-PCR kullanılarak) ile karşılaştırıldığında FOXG1 ekspresyonunun grafiksel temsili. İki faktörlü ANOVA ile istatistiksel analiz ve ardından Sidak'ın çoklu karşılaştırma testi. Tüm deneyler için N = 3 biyolojik kopya. p < 0.001. Ölçek çubuğu = 50 μm. Hata çubukları SEM'i temsil eder. Kısaltmalar: hiPSC'ler = insan kaynaklı pluripotent kök hücreler; CTRL = Kontrol; FXS = Frajil X sendromu; APC'ler = astrosit progenitör hücreleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
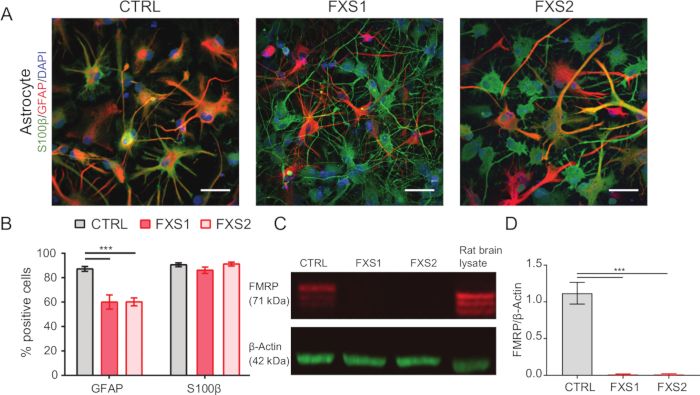
Şekil 2: Glial fibriler asidik protein pozitif hiPSC türevi FXS astrositlerinin sayısı azalmıştır. (A) S100β ve GFAP ekspresyonu sergileyen hiPSC'den türetilmiş astrositlerin temsili görüntüleri. (B) GFAP pozitif astrositlerin yüzdesi, her ikisi de benzer S100β ekspresyonu sergilemesine rağmen, FXS'den türetilmiş astrositlerde CTRL'ye kıyasla önemli ölçüde daha düşüktü. İstatistiksel anlamlılık iki faktörlü varyans analizi (ANOVA) ve ardından Tukey'in ikili karşılaştırması ile belirlendi. (C) CTRL ve FXS'den astrositlerde FMRP ekspresyonunu temsil eden immünoblot. (D) HiPSC'den türetilmiş FXS astrositlerinde FMRP olmadığını gösteren grafikler. İstatistiksel analiz tek faktörlü ANOVA ile yapıldı ve Tukey'in ikili karşılaştırması yapıldı. Yukarıdaki tüm deneyler için N = 3 biyolojik kopya. Ölçek çubuğu = 50 μm. ***p < 0.001. Hata çubukları SEM'i temsil eder. Kısaltmalar: hiPSC'ler = insan kaynaklı pluripotent kök hücreler; CTRL = Kontrol; FXS = Frajil X sendromu; GFAP = glial fibriler asidik protein; FMRP = Kırılgan X haberci ribonükleoprotein. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
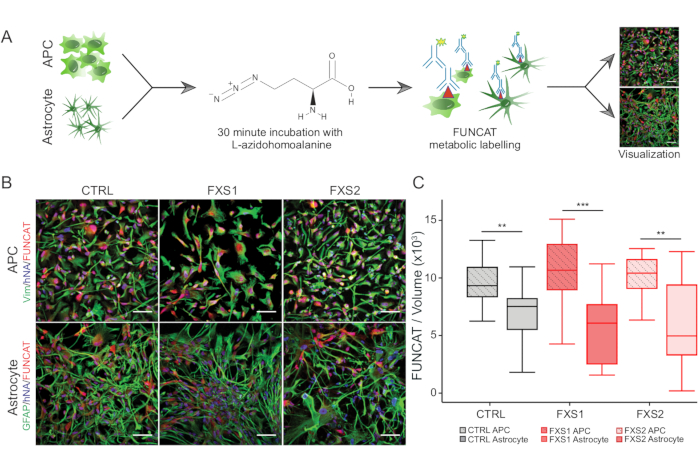
Şekil 3: APC'lerden astrositlere farklılaşma nedeniyle azalmış protein sentezi. (A) FUNCAT metabolik etiketlemesini kullanarak hiPSC'den türetilmiş APC'lerde ve astrositlerde protein sentezinin etiketlenmesini ve görselleştirilmesini gösteren şematik iş akışı. (B) CTRL ve FXS'den türetilmiş hücrelerde FUNCAT/insan Çekirdek Antikoru (hNA) etiketli (üstte) Vimentin pozitif hiPSC'den türetilmiş APC'lerin ve (altta) GFAP pozitif astrositlerin temsili görüntüleri. (C) FUNCAT/hiPSC'den türetilmiş APC'lerin hacmi, karşılık gelen türetilmiş astrositlerden önemli ölçüde daha yüksekti. Tüm deneyler için N = 3 biyolojik kopya. Ölçek çubuğu = 50 μm. **p < 0.01, ***p < 0.001. Bıyıklar 1,5 × IQR'yi temsil eder. Kısaltmalar: hiPSC'ler = insan kaynaklı pluripotent kök hücreler; CTRL = Kontrol; FXS = Frajil X sendromu; GFAP = glial fibriler asidik protein; FUNCAT = floresan kanonik olmayan amino asit etiketleme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
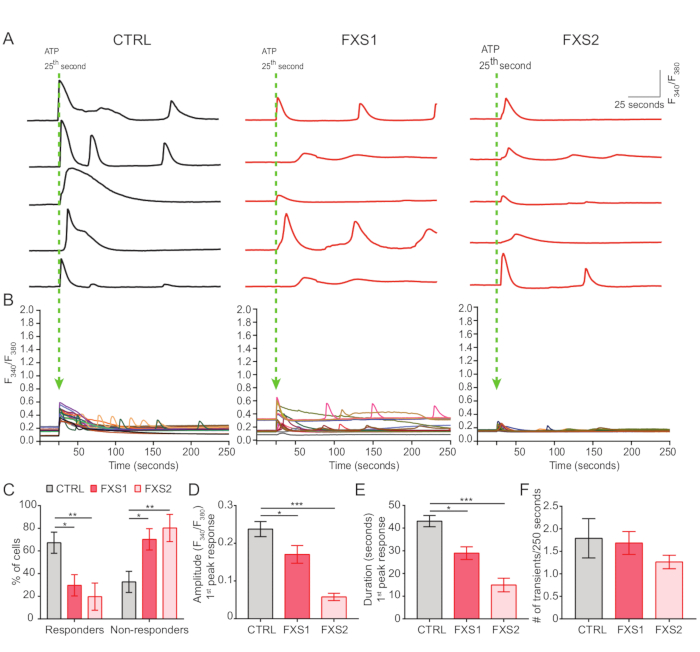
Şekil 4: hiPSC'den türetilmiş FXS astrositlerinde ATP tarafından uyarılan eksik Ca2+ sinyali.(A) ATP'nin 25inci s'de harici uygulaması üzerine bireysel astrositlerden kaydedilen Ca2+ geçici akımlarının temsili izleri. (B) ATP uygulamasından sonra 340 s'nin üzerindeki Ca 380+ geçici akımlarını gösteren ortalamaF250 / F2 oranları. (C) HiPSC'den türetilmiş FXS astrositlerinde ATP'ye yanıt vermeyenlerin daha yüksek yüzdesini gösteren gruplandırılmış veriler. İstatistiksel anlamlılık iki faktörlü ANOVA ile belirlendi ve Tukey'in ikili karşılaştırması yapıldı. (D-F) İlk tepe tepkisinin (genlik ve süre) ve olayların sıklığının ölçülmesi. (D) Genlikte önemli bir azalma gösterir. HiPSC'den türetilen FXS astrositlerinde Tukey'in ikili karşılaştırması ve (E) süresi ile tek faktörlü ANOVA ile istatistiksel anlamlılık belirlendi. Kruskal-Wallis testi ile Dunn'ın çoklu karşılaştırma testi ile belirlenen istatistiksel anlamlılık; SEM ile ortalama sıralar olarak temsil edilen veri seti. (F) HiPSC'den türetilmiş FXS astrositlerinde Ca2+ geçici frekansının grafiksel gösterimi. Tek faktörlü varyans analizi ve Tukey'in ikili karşılaştırması ile istatistiksel analiz. Tüm deneyler için N = 3 biyolojik kopya; n = her hücre satırı için 19 hücre. *p < 0.05, **p < 0.01, ***p < 0.001. Hata çubukları SEM'i temsil eder. # = Sayı. Kısaltmalar: hiPSC'ler = insan kaynaklı pluripotent kök hücreler; CTRL = Kontrol; FXS = Frajil X sendromu; GFAP = glial fibriler asidik protein. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
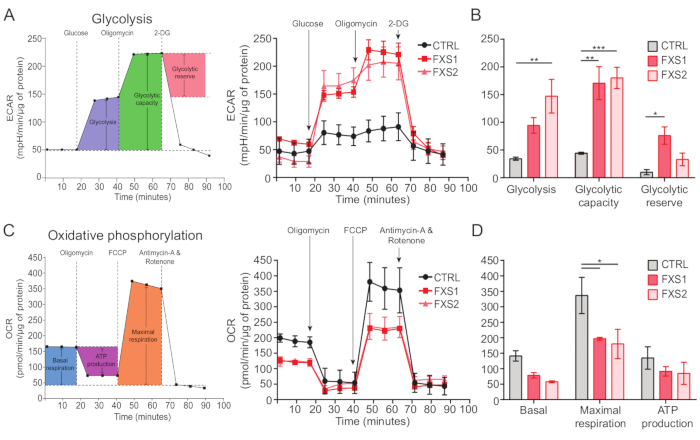
Şekil 5: hiPSC'den türetilmiş FXS astrositlerindeki biyoenerjetik eksiklikler. (A) Sırayla 10 mM Glikoz, 1 μM Oligomisin ve 50 mM 2-DG eklendikten sonra hiPSC'den türetilen astrositlerin (CTRL ve FXS) hücre dışı asitleşme oranını temsil eden ve bir çizgi grafiği üzerinde çizilen çizgi grafiği. (B) Glikoliz, glikolitik kapasite ve glikolitik rezerv miktar tayini, hiPSC'den türetilmiş FXS astrositlerinde bir artış gösterdi. İstatistiksel analiz, iki faktörlü varyans analizi (ANOVA) ile yapıldı ve Tukey'in ikili karşılaştırması yapıldı. (C) 1.5 μM Oligomisin, 1 μM FCCP ve 0.5 μM antimisin A ve Rotenonun sıralı ilavesiyle oksijen tüketim oranı ölçümünü gösteren çizgi grafik. (D) Bazal solunum, maksimal solunum ve ATP üretimi çizgi grafiğinden ölçüldü ve hiPSC'den türetilen FXS astrositleri, CTRL astrositlerine kıyasla maksimal solunumda önemli bir azalma gösterdi. İstatistiksel analiz, iki faktörlü varyans analizi (ANOVA) ile yapıldı ve Tukey'in ikili karşılaştırması yapıldı. Tüm deneyler için N = 2 biyolojik kopya. *p < 0.05, **p < 0.01, ***p < 0.001. Hata çubukları SEM'i temsil eder. Kısaltmalar: hiPSC'ler = insan kaynaklı pluripotent kök hücreler; CTRL = Kontrol; FXS = Frajil X sendromu; ECAR = hücre dışı asitlenme hızı; 2-DG = 2-deoksiglukoz; OCR = oksijen tüketim oranı; FCCP = karbonil siyanür-4 (triflorometoksi) fenilhidrazon. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| El yazmasında kimlik | Kaynakta kimlik | Yaş | Seks | Yeniden programlanmış hücre satırı adı | Yeniden programlama yöntemi | Başlangıç hücresi türü | G bandı karyotipi |
| (yıl) | |||||||
| CTRL | ND30625 | 76 | M | CS25iCTR-18nxx | Epizomal vektörler | Fibroblast | Normal |
| FXS1 Serisi | GM07072 | 22 | M | CS072iFXS-n4 | Epizomal vektörler | Fibroblast | Normal |
| FXS2 Serisi | GM05848 | 4 | M | CS848iFXS-n5 | Epizomal vektörler | Fibroblast | Normal |
Tablo 1: Bu çalışmadaön beyne özgü astrositler oluşturmak için kullanılan hücre hatları.
Ek Şekil S1: Kromozomal analiz raporu. (A) CTRL 46, XY, (B) FXS1 46, XY ve (C) FXS2 46, XY'nin normal GTG bantlama karyotipi. Bu rakamı indirmek için lütfen buraya tıklayın.
Ek Tablo S1: Bu çalışmada hücrelerin karakterizasyonu için kullanılan primerler. Bu tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada, FXS'nin neden olduğu fonksiyonel değişiklikleri karakterize etmek için bir tahlil platformu olarak hizmet eden insan iPSC'den türetilmiş astrositler üretmek için bir yöntem açıklıyoruz. Bu astrositler kültürde işlevsel olarak yaşayabilir ve bu çalışmada gerçekleştirilen bir dizi ölçümle kanıtlandığı gibi çeşitli özellikler sergiler. Bu protokoldeki kritik bir adım, enzimatik kaldırma yöntemi kullanılarak iPSC'lerin kortikosferlere ilk dönüştürülmesidir. Bu aşamada, kollajenaz tip IV ve dispas için inkübasyon süresini optimize etmek çok önemlidir. Bu optimize edilmezse, iPSC'lerin parçalanmasına veya tek hücreler oluşturmasına neden olabilir, bu da kortikosfer oluşumunu önleyecektir. Bu kortikosferler, ikili SMAD inhibisyonu15 kullanılarak ön beyin özgüllüğüne doğru modellenir ve ayrıca astrosit progenitör hücrelere (APC'ler) farklılaşır. Yüksek bir APC popülasyonu elde etmek için, gliosferlerin mekanik olarak doğranması çok önemlidir. Gerçek zamanlı qPCR, ön beyin özgüllüğünü doğrulamak için kullanılabilir; ön beyin için bir belirteç olan FOXG1'de, omurilik için bir belirteç olan HOXB4'e kıyasla önemli bir kıvrım değişikliği artışı gözlemledik.
APC'ler daha sonra JAK-STAT sinyal yolu16'nın bir aktivatörü olan CNTF kullanılarak astrositlere ayrılır. Bu çalışmadan elde edilen sonuçlar, FXS iPSC'lerden türetilen terminal olarak farklılaşmış astrositlerin daha düşük GFAP seviyelerine sahip olduğunu ve bu da olgunluğun bozulduğunu düşündürmektedir. Analizlerimiz, FXS astrositlerinde ve APC'lerde kontrollere kıyasla de novo protein sentezinde herhangi bir fark bulamamasına rağmen, hem FXS hem de kontrol hatlarında APC'lerden astrositlere geçişte de novo protein sentezinde bir azalma bulduk. APC'ler ve astrositler arasındaki translasyondaki önemli azalma, nöral öncü hücrelere karşı nöronlar için gösterilen daha aerodinamik ve küratörlü bir translasyon ile tutarlıdır17. Anormal protein sentezini inceleyen daha önceki çalışmalar, astrositleri veya APC'leri değil, tüm beyin dokularını, nöronları ve hasta kaynaklı fibroblastları kullanmıştır18. Hastadan türetilen hatlardan protein sentezi ile ilgili yayınlanmış tek rapor astrositlerde değil, lenfoblastoid hücrelerden19 ve fibroblastlardan20,21'dir. Çalışmalardaki bu farklılıklar ışığında, gelecekteki çalışmalar, ek FXS hastasından türetilen hatlardan türetilen astrositlerde FUNCAT ölçümlerinin kullanılmasından fayda sağlayacaktır.
Hücre içi kalsiyum dinamiği22 ve biyoenerjetik ölçerek astrositlerin işlevselliğini değerlendirdik. FXS astrositleri, kontrol astrositlerine kıyasla ATP'ye yanıt veren daha az hücre ile, ATP'nin neden olduğu kalsiyum geçişlerinin tepe genliğinde ve süresinde azalma gösterdi. Birlikte, bu değişiklikler FXS'nin insan astrositlerinde kalsiyum homeostazını bozduğunu göstermektedir. Bu sonuçlar, FXS fibroblastlarında bozulmuş IP3 reseptör aktivitesini bildiren daha önceki bir çalışma23,24 ile tutarlıdır. Ayrıca, FXS astrositlerinde glikoliz, glikolitik kapasite ve glikolitik rezervin arttığını ve mitokondriyal oksijen tüketim oranlarının azaldığını gözlemledik.
Bu çalışma, hastadan türetilen iPSC'lerin gücünden yararlanarak FXS astrositleri için yeni bir in vitro modelin oluşturulmasını ve karakterizasyonunu açıklamaktadır. Özellikle, sadece insan nöronlarıyla birlikte kültürlenmiş insan astrositlerini kullanan daha önceki bir çalışma sayesinde, nöronların elektrofizyolojik fenotipini belirleyen astrositlerin kritik rolünü ortaya çıkardık14. Bununla birlikte, bu çalışmalar neredeyse tamamen nöronal aktivitede hastalığa bağlı değişikliklere odaklandı ve astrositlerde hiçbir şey araştırılmadı. Burada, bu protokol, odağımızı astrositlerdeki fonksiyonel değişikliklere kaydırmak için yeni bir çerçeve sunmaktadır. Bu da, glutamat sinyalizasyonu ve elektriksel tepkiler gibi daha önce keşfedilmemiş astrosit-nöron etkileşimlerine ışık tutacaktır. Bu aşamadaki sonuçlarımız, gelecekteki araştırmalarda astrositlere öncelik verilmesi gerektiğini vurgulamaktadır.
Bu protokolün sınırlamalarını tanımak çok önemlidir. Birincisi, DNA parçalanmasına da yol açan mekanik doğramayı içerir. Bu, doğranmış gliosferlerin topaklanmasına ve sonunda hücre ölümüne yol açmasına neden olabilir. İkincisi, astrositlere terminal farklılaşma adımı sırasında APC'lerin tohumlama yoğunluğu, temas aracılı hücre-hücre inhibisyonunu önlemek için gereklidir. Kültür kabının yüzeyinden ayrılmayı önlemek için bunun hücre hatları boyunca optimize edilmesi önerilir.
Burada, bulgularımız insan astrositlerinde bu tür ilk analizdir, çünkü geçmiş tüm çalışmalar lenfoblastoid hücre dizileri ve insan fibroblastları gibi diğer hücre tiplerine dayanmaktadır25. Disfonksiyonel enerji metabolizması, insan plazma laktat seviyelerinin artması, granülositlerde26 önemli ölçüde daha düşük oksijen tüketim oranı ve ASD27'li çocukların ön singulasyon, motor korteks, talamus ve beyincikte mitokondriyal oksidatif fosforilasyon genlerinin ekspresyonunun azalması ile gösterildiği gibi otizm spektrum bozukluklarının etiyolojisinde bilinen bir oyuncudur. Enerji metabolizmasındaki benzer değişiklikler, Parkinson hastalığı28 ve Alzheimer hastalığı29 gibi nörodejeneratif bozukluklarda görülür, bu da artan glikolizin azalmış fonksiyonel fonksiyonu30 telafi edebileceğini düşündürmektedir. FXS hasta kaynaklı astrositlerde görülen işlevsiz enerji metabolizmasında benzer mekanizmaların rol oynayıp oynamadığını araştırmak için gelecekteki çalışmalara ihtiyaç vardır.
Şu anda, ön beyne özgü astrositlerin üretilmesi önemli bir başarıdır, ancak gelecekteki ilerlemeler, kortikal/hipokampal astrositler gibi bölgeye özgü gliaların oluşturulmasına izin verebilir. Bu, bu astrositlerin bölgesel beyin fonksiyonlarında, sinaptik plastisitede ve nöronal-glial etkileşimlerde oynadığı farklı roller hakkında daha derin bilgiler sağlayacaktır. Bu tür bölgeye özgü astrositler üretme yeteneği, nörogelişim ve nörodejeneratif hastalık modellerini ilerletebilir. Sonuç olarak, bu, belirli beyin bölgelerinde astrosit disfonksiyonunu hedefleyen daha kesin terapötik stratejilere yol açabilir.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Prof. Sumantra Chattarji'ye okul içi fonlar için teşekkür ederiz. Kalsiyum görüntüleme kurulumuna erişim için Prof. Gaiti Hasan'a, Merkezi Görüntüleme ve Akış Tesisi-Ulusal Biyolojik Bilimler Merkezi'ne, redaksiyon ve öneriler için Padmanabh Singh ve Prangya Hota'ya ve Seahorse XF testlerinin gerçekleştirilmesindeki yardımları için Labmate Asia ekibine teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1-Thioglycerol | Sigma-Aldrich | M6145 | |
| Accutase solution | Sigma-Aldrich | A6964 | Enzyme cell detachment medium |
| Adenosine 5′-triphosphate magnesium salt | Sigma-Aldrich | A9187 | |
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634010 | |
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240062 | |
| B-27 Supplement (50x), serum-free | ThermoFisher Scientific | 17504044 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Chemically Defined Lipid Concentrate | ThermoFisher Scientific | 11905031 | |
| Collagenase, Type IV, powder | ThermoFisher Scientific | 17104019 | |
| Deoxyribonuclease I | Worthington Biochemical Corporation | LK003170 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D2650 | |
| Dispase II, powder | ThermoFisher Scientific | 17105041 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | |
| FXS1, FXS2 | Coriell Institute of Medical Research | GM07072, GM05848 | FXS patient cells |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | glutamine substitute |
| Ham's F-12 Nutrient Mix | ThermoFisher Scientific | 11765054 | |
| Healthy control cells | Cedars-Sinai Medical Center | ND30625 | healthy control cells |
| Heparin sodium salt from porcine intestinal mucosa | Sigma-Aldrich | H3149 | |
| IMDM | ThermoFisher Scientific | 12440053 | |
| Insulin, human | Roche | 11376497001 | |
| LDN 193189 | Stratech Scientific | S2618-SEL | |
| Leukemia Inhibitory Factor human | Sigma-Aldrich | L5283 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | |
| MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | 11140050 | |
| Mouse FGF-basic (FGF-2/bFGF) Recombinant Protein | Peprotech | 450-33 | |
| Mr. Frosty freezing container | ThermoFisher Scientific | 5100-0001 | cryobox |
| N-2 Supplement (100x) | ThermoFisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Neurobasal Medium | ThermoFisher Scientific | 21103049 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | ThermoFisher Scientific | 377267 | |
| Nunc Cell-Culture Treated 6 well dish | ThermoFisher Scientific | 140675 | |
| Papain Dissociation System | Worthington Biochemical Corporation | LK003150 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Recombinant Human CNTF Protein, CF | R&D Systems | 257-NT-010 | |
| Recombinant Human EGF Protein, CF | R&D Systems | 236-EG-01M | |
| RevitaCell Supplement (100x) | ThermoFisher Scientific | A2644501 | |
| SB431542 | Tocris | 1614 | |
| Seahorse XFe24 Analyzer | Agilent Technologies | ||
| Seahorse XF Cell Mito Stress Test Kit | Agilent Technologies | 103015-100 | |
| Seahorse XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| Tissue Culture Dishes-100 cm | Biostar Lifetech | TCD000100 | |
| Transferrin | Roche | 10652202001 | |
| VWR Razor Blades | VWR International | 55411-050 | |
| Antibodies | |||
| Primary antibody | Company | Catalog number | Dilution |
| Oct4 (C-10) | Santa Cruz Biotechnology | sc-5279 | Dilution: 1:250 Secondary antibody: Goat anti-Mouse IgG, Alexa Fluor 568 |
| Nanog | R & D Systems | AF1997 | Dilution: 1:100 Secondary antibody: Donkey anti-Goat IgG, Alexa Fluor 488 |
| Vimentin | Abcam | Ab5733 | Dilution: 1:500 Secondary antibody: Goat anti-Chicken IgY, Alexa Fluor 488 |
| NFIA | Abcam | Ab41851 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| GFAP-cy3 | Sigma | C9205 | Dilution: 1:500 Secondary antibody: NA |
| GFAP | DAKO | Z0334 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| S100β | DAKO | IR504 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 488 |
| Anti-Nuclei Antibody, clone 235-1 | Merck Millipore | MAB1281 | Dilution: 1:1000 Secondary antibody: Goat anti-Mouse IgG1, Alexa Fluor 555 |
| Secondary antibodies | Dilution | ||
| Goat anti-Mouse IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11004 | 1:1000 |
| Donkey anti-Goat IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11055 | 1:1000 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A11039 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11034 | 1:1000 |
| Goat anti-Mouse IgG1, Alexa Fluor 555 | Thermo Fisher Scientific | A21127 | 1:1000 |
Referanslar
- Santoro, M. R., Bray, S. M., Warren, S. T. Molecular of fragile X syndrome: A twenty-year perspective. Annu Rev Pathol. 7, 219-245 (2012).
- Wang, H., et al. Developmentally-programmed FMRP expression in oligodendrocytes: A potential role of FMRP in regulating translation in oligodendroglia progenitors. Hum Mol Genet. 13 (1), 79-89 (2004).
- Pacey, L. K. K., Doering, L. C. Developmental expression of FMRP in the astrocyte lineage: Implications for fragile X syndrome. Glia. 55 (15), 1601-1609 (2007).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Allen, N. J., Barres, B. A. Neuroscience: Glia - more than just brain glue. Nature. 457 (7230), 675-677 (2009).
- Khakh, B. S., McCarthy, K. D. Astrocyte calcium signaling: From observations to functions and the challenges therein. Cold Spring Harb Perspect Biol. 7 (4), a020404(2015).
- Allen, N. J., et al. Astrocyte glypicans 4 and 6 promote formation of excitatory synapses via GluA1 AMPA receptors. Nature. 486 (7403), 410-414 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Rothstein, J. D., et al. Knockout of glutamate transporters reveals a major role for astroglial transport in excitotoxicity and clearance of glutamate. Neuron. 16 (3), 675-686 (1996).
- Almad, A., Maragakis, N. J. A stocked toolbox for understanding the role of astrocytes in disease. Nat Rev Neurol. 14 (6), 351-362 (2018).
- Zhang, Y., Barres, B. A. Astrocyte heterogeneity: An underappreciated topic in neurobiology. Curr Opin Neurobiol. 20 (5), 588-594 (2010).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neurosci. 14 (5), 311-321 (2013).
- Bradley, R. A., et al. Regionally specified human pluripotent stem cell-derived astrocytes exhibit different molecular signatures and functional properties. Development. 146 (13), dev170910(2019).
- Das Sharma, S., et al. Astrocytes mediate cell non-autonomous correction of aberrant firing in human FXS neurons. Cell Rep. 42 (4), 112344(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Hu, X., et al. The JAK/STAT signaling pathway: from bench to clinic. Sig Transduct Target Ther. 6, 402(2021).
- Baser, A., et al. Onset of differentiation is post-transcriptionally controlled in adult neural stem cells. Nature. 566 (7742), 100-104 (2019).
- Pal, R., Bhattacharya, A. Modelling protein synthesis as a biomarker in fragile x syndrome patient-derived cells. Brain Sci. 9 (3), 1-12 (2019).
- Gross, C., Bassell, G. J. Excess protein synthesis in FXS patient lymphoblastoid cells can be rescued with a p110β-selective inhibitor. J Mol Med. 18 (3), 336-345 (2012).
- Kumari, D., et al. Identification of fragile X syndrome specific molecular markers in human fibroblasts: A useful model to test the efficacy of therapeutic drugs. Hum Mutat. 35 (12), 1485-1494 (2014).
- Jacquemont, S., et al. Protein synthesis levels are increased in a subset of individuals with fragile X syndrome. Hum Mol Genet. 27 (12), 2039-2051 (2018).
- Bowser, D. N., Khakh, B. S. ATP excites interneurons and astrocytes to increase synaptic inhibition in neuronal networks. J Neurosci. 24 (39), 8606-8620 (2004).
- Schmunk, G., Boubion, B. J., Smith, I. F., Parker, I., Gargus, J. J. Shared functional defect in IP3R-mediated calcium signaling in diverse monogenic autism syndromes. Transl Psychiatry. 5 (9), e643-e710 (2015).
- Peteri, U. K., et al. Generation of the human pluripotent stem-cell-derived astrocyte model with forebrain identity. Brain Sci. 11 (2), 209(2021).
- Alvarez-Mora, M. I., et al. Impaired mitochondrial function and dynamics in the pathogenesis of FXTAS. Mol Neurobiol. 54 (9), 6896-6902 (2017).
- Giulivi, C., et al. Mitochondrial dysfunction in autism. JAMA. 304 (21), 2389-2396 (2010).
- Anitha, A., et al. Brain region-specific altered expression and association of mitochondria-related genes in autism. Mol Autism. 3 (1), 12(2012).
- Teves, J. M. Y., et al. Parkinson's disease skin fibroblasts display signature alterations in growth, redox homeostasis, mitochondrial function, and autophagy. Front Neurosci. 11, 737(2018).
- Yao, J., et al. Mitochondrial bioenergetic deficit precedes Alzheimer's pathology in female mouse model of Alzheimer's disease. Proc Natl Acad Sci USA. 106 (34), 14670-14675 (2009).
- Sonntag, K. C., et al. Late-onset Alzheimer's disease is associated with inherent changes in bioenergetics profiles. Sci Rep. 7 (1), 14038(2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır