Method Article
Fragile X Messenger Ribonucleoprotein이 결핍된 인간 유도 만능 줄기세포 유래 성상세포의 생성 및 특성화
요약
여기에서는 인간 유도 만능 줄기 세포를 기능적 전뇌 특이적 성상세포로 분화시키는 것을 용이하게 하는 프로토콜에 대해 설명합니다. 이를 통해 취약 X 증후군(Fragile X Syndrome)과 같은 신경 발달 장애의 발병기전에서 신경교세포의 역할에 대한 조사와 다른 뇌 질환의 모델링을 수행할 수 있습니다.
초록
자폐 스펙트럼 장애 및 지적 장애의 주요 유전 원인인 취약 X 증후군(FXS)은 설치류 모델을 사용하여 광범위하게 연구되었습니다. 보다 최근에는 인간 줄기 세포 유래 모델 시스템이 FXS의 병태 생리학에 대한 기계론적 통찰력을 얻는 데에도 사용되었습니다. 그러나 이러한 연구는 거의 전적으로 뉴런에 초점을 맞추었습니다. 또한, 건강과 질병에서 신경 세포의 기능에 있어 신경교세포의 중요한 역할에 대한 증거가 증가하고 있음에도 불구하고, 인간 성상세포가 FXS에 의해 어떻게 영향을 받는지에 대해서는 알려진 바가 거의 없습니다.
따라서 본 연구에서는 뇌 발달의 주요 시공간 이정표를 포착하고 신경교형성 과정과도 일치하는 프로토콜을 성공적으로 개발했습니다. 이것은 함께 신경 발달 장애를 연구하는 데 유용한 틀을 제공합니다. 먼저, 인간 유도 만능 줄기세포를 Decapentaplegic (SMAD) 억제에 대한 이중 산모 억제자와 소분자를 사용하여 신경외배엽 계통으로 패턴화했습니다. 그 후, 특정 성장 인자와 사이토카인을 활용하여 대조군(CTRL) 및 FXS 환자 유래 성상세포 전구 세포(APC)를 생성했습니다. 분화 사이토카인(cytokine)인 섬모 신경영양인자(ciliary neurotrophic factor)로 APC를 처리하면 전구세포가 조절되고 성상세포 성숙을 촉진하여 전뇌 특이적 신경교섬유산성 단백질 발현 성상세포를 얻을 수 있습니다.
우리는 이러한 성상세포가 ATP 적용에 대한 칼슘 반응에서 입증된 바와 같이 기능적이며, FXS에서 조절되지 않는 해당작용 및 미토콘드리아 대사를 나타낸다는 것을 발견했습니다. 종합하면, 이러한 발견은 신경 발달 장애로 인한 성상 세포 기능의 변화로 인한 세포 자율 및 비 세포 자율 결과를 조사하기 위해 인간 기원의 유용한 실험 플랫폼을 제공합니다.
서문
지적 장애 및 자폐 스펙트럼 장애(ASD)의 흔한 유전 형태인 취약 X 증후군(FXS)은 취약 X 메신저 리보핵단백질 1(FMR1) 유전자(OMIM: #300624, https://www.omim.org/entry/300624)에 의해 생성되는 취약 X 메신저 리보핵단백질(FMRP)의 부족으로 인해 발생합니다. FMRP는 mRNA 번역, mRNA 과립 형성 및 수송, microRNA 매개 유전자 발현 조절에 중요한 역할을 합니다1. 따라서 FMRP의 손실은 뇌 발달뿐만 아니라 성인의 뇌 기능에도 영향을 미칩니다. 뇌에서 FMR1과 FMRP를 위한 면역염색의 mRNA 전사체 수준은 모두 신경교세포에서도 유의미한 발현과 함께 높은 뉴런 발현을 보여주었습니다2. 그러나 FXS의 동물 모델에 대한 초기 연구의 대다수는 주로 뉴런과 그 기능의 이상에 초점을 맞췄습니다. 결과적으로 FXS3에서 신경교세포의 역할에 대해서는 알려진 바가 거의 없습니다. 전통적으로 "수동적 지원" 세포4로 여겨졌지만, 성상세포가 시냅스형성(synaptogenesis)7 촉진, 신경 회로 발달의 개선8, 신경전달물질 재활용9 등 광범위한신경 기능을 매개하는 데 중요하다는 증거가 축적되고 있습니다 5,6 . 이와 병행하여, 질병 발병기전에서 성상세포의 역할에 대한 증거가 증가하고 있으며, 많은 신경학적 질환이 성상세포 기능 장애와 관련이 있다10.
FXS의 동물 모델을 사용한 초기 연구의 대부분은 FXS 치료를 위해 뉴런의 다양한 분자 표적을 식별하고 검증하는 데 중점을 두었지만 이러한 전임상 결과가 항상 성공적인 임상 결과로 이어진 것은 아닙니다. 또한, 최근 임상시험의 차질은 인간 기반 모델 시스템의 필요성을 강조합니다. 인간 줄기세포 유래 뇌세포를 기반으로 한 신경 질환 모델은 동물 연구의 기계론적 통찰력과 환자에 대한 임상 결과의 제한된 성공 사이의 격차를 해소하는 강력한 전략을 제공합니다. 그러나 이러한 연구 중 소수만이 성상교세포에 초점을 맞추었으며 그것도 대부분 척추에서 유래한 성상교세포에 초점을 맞췄습니다. 이는 성상세포의 구조와 기능이 뇌 영역마다 다르다는 것을 보여주는 연구에 비추어 볼 때 관련이 있습니다11,12. 따라서 인간 성상세포에서 질병으로 유발된 변화에 대한 더 나은 이해는 성상세포의 이러한 뇌 영역 특이적 차이를 고려해야 합니다. 그러나 전뇌에 특이적인 인간 줄기세포 유래 성상세포를 사용하는 신경발달 장애 모델은 상대적으로 연구되지 않은 상태로 남아 있다13. 따라서 이러한 격차를 해결하기 시작하기 위해 FXS 돌연변이를 운반하는 환자 유래 유도 만능 줄기세포(iPSC)에서 전뇌 특이적 성상세포를 생성하기 위한 프로토콜을 설명합니다. 또한, 우리는 성상세포가 기능적이며 변화된 신진대사를 보인다는 것을 보여줍니다.
프로토콜
인간 유도 만능 줄기세포(hiPSC)를 사용한 모든 실험(표 1)은 적절한 기관 규제 승인을 받은 후 수행되었습니다. 그림 1A 는 전뇌 특이적 성상세포를 성숙시키기 위한 hiPSC의 완전한 분화 프로토콜을 나타냅니다.
1. hiPSC의 유지 및 확장
- iPSC를 도금하기 하루 전, Advanced Dulbecco의 Modified Eagle Medium/Ham's F-12(DMEM/F12)에서 1:60 희석된 Matrigel(ECM[Extracellular Matrix])을 6웰 접시에 코팅하고 2-8°C에서 보관합니다.
알림: Matrigel로 코팅된 접시를 2-8°C에서 >5일 동안 보관하면 시간이 지남에 따라 ECM에서 단백질 분해가 발생할 수 있으므로 보관하지 마십시오. 접시가 건조되지 않도록 1웰 접시 1웰당 최소 60:60 희석된 마트리겔을 코팅하고 접시 전체에 고르게 펴 바릅니다. 같은 날 사용하는 경우 플레이트를 37°C, 5% CO2 의 가습 인큐베이터에 1시간 동안 보관하십시오. - hiPSC를 배양하는 날, 코팅 물질을 제거하고 ROCK inhibitorat 1x 최종 농도와 함께 완전한 Essential 8 배지 1mL(Essential 8 보충제가 포함된 E8 기초 배지)를 첨가하고 hiPSC를 추가하기 전에 접시를 37°C 및 5% CO2 인큐베이터에 보관합니다.
- hiPSC를 완전한 E8 배지와 함께 ROCK 억제제와 함께 1x 최종 농도로 재현탁시켜 콜로니의 순응도를 높입니다.
참고: 많은 양의 배양 배지를 준비하지 마십시오. 최대 3-4일 동안만 준비하고 2-8 °C에서 보관하십시오. - 다음 날, 세포가 80% 융합될 때까지(약 4-5일) ROCK 억제제 없이 완전한 E8 배지를 보충합니다.
- 80% 포화도에 도달하면 효소로 군체를 분리합니다.
- iPSC를 통과시키려면 접시에서 사용한 배지를 제거하고 콜라겐분해효소(2mg/mL)와 디스파제(1mg/mL)의 예열된(37°C) 혼합물을 웰당 1mL를 1:1의 비율로 첨가하고 37°C에서 20-30분 이상 배양하여 iPSC 콜로니가 들어올릴 수 있도록 합니다.
알림: 접시를 37 ° C에서 20-30 분 이상 두지 마십시오. 이 기간이 지나면 군체가 분해되고 세포가 죽습니다.
- iPSC를 통과시키려면 접시에서 사용한 배지를 제거하고 콜라겐분해효소(2mg/mL)와 디스파제(1mg/mL)의 예열된(37°C) 혼합물을 웰당 1mL를 1:1의 비율로 첨가하고 37°C에서 20-30분 이상 배양하여 iPSC 콜로니가 들어올릴 수 있도록 합니다.
- 군집이 들어올리기 시작하면 인큐베이터에서 접시를 꺼내 Dulbecco의 DPBS(Phosphate-Buffered Saline) 2mL를 추가하여 효소 활성을 중화합니다.
- DPBS로 콜로니를 긁어내고 광경의 10mL 혈청학 피펫을 사용하여 15mL 원뿔형 튜브에 현탁액을 수집합니다.
- 10mL 혈청학적 피펫을 사용하여 현탁액을 2-3x 부드럽게 분쇄하여 집락을 분해하고 집락이 안정되도록 합니다.
참고: 군체를 단일 세포로 만들지 마십시오. 이로 인해 세포가 접시에 달라붙지 않고 더 많은 세포가 죽을 수 있습니다. 또한, 그들을 큰 식민지로 남겨두지 마십시오. 이것은 나중에 더 분화된 군체로 이어질 것입니다. - 콜로니가 안정되면(약 2분 후) 튜브에 약 1mL를 남기고 DPBS 효소 혼합물을 흡인합니다.
- 튜브에 DPBS 2mL를 추가하고 톡톡 두드려 콜로니를 혼합한 다음 가라앉히도록 합니다. 이 과정을 2회 반복하여 콜로니에서 잔류 효소를 모두 제거합니다. 2차 세척 후 가능한 한 많은 상층액을 제거하고 완전한 E8 배지 1mL에 콜로니를 재현탁하고 1.2-1.3단계에서 언급한 대로 갓 준비한 접시에 플레이트합니다.
- 또는 향후 확장 및 사용을 위한 동결 보호 용액으로 10% DMSO(dimethyl sulfoxide)를 사용하여 일부 콜로니를 동결 보존합니다.
- 동결 보호 용액으로 90% 완전 E8 배지와 10% DMSO를 혼합하여 동결 보존 배지를 신선하게 준비하고 사용할 때까지 2-8°C에 둡니다.
- 동결 보존하려면 1.5-1.10 단계를 따르십시오.
- 1.10 단계에서 2차 세척 후 집락이 가라 앉고 상층액을 제거하도록합니다. 콜로니에 갓 준비한 저온 동결 보존 배지 1mL를 추가하고 크라이오비알로 옮깁니다.
참고: 콜로니에 동결 보존 배지를 추가한 후 내용물을 냉동 용기로 빠르게 옮깁니다. DMSO는 세포를 손상시킬 수 있는 동결 보호제이므로 지연하면 재생률이 낮아질 수 있습니다. - 즉시 냉동 용기를 냉동 상자로 옮기고 -80 °C 냉동고에서 밤새 보관하십시오.
- 다음날 나중에 사용할 수 있도록 모든 극저온을 액체 질소 탱크(LN2 탱크)로 옮깁니다.
참고: hiPSC는 모든 이상에 대해 G-banding(보충 그림 S1)을 사용하여 일상적으로 핵형을 분석해야 하며, 다능성에 대한 면역세포화학(그림 1B)을 사용하여 특성화하고 마이코플라스마에 대해 검사해야 합니다.- 면역세포화학을 사용하여 hiPSC를 특성화하려면 1:60 Matrigel 코팅, 오토클레이브 13mm 유리 커버슬립에 콜로니를 플레이트합니다. 40% 농도가 되면 PBS-T(PBS-0.1% Tween 20)로 세포를 세척하고, 4% 파라포름알데히드로 10분 동안 고정하고, PBS에서 0.3% Triton X-100으로 10분 동안 투과화하고, PBS에서 3% 소 혈청 알부민(BSA)으로 1시간 동안 차단하여 비특이적 결합을 방지합니다.
- 차단 후 1차 항체로 배양액을 1시간 동안 배양한 다음 PBS-T로 각각 5분 동안 3x 세척한 다음 1시간 동안 어두운 곳에서 해당 2차 항체(Table of Materials)를 세척합니다.
- 장착 매체를 사용하여 커버 슬립을 유리 슬라이드에 장착하고 405nm, 488nm, 561nm 및 633nm에서 컨포칼 레이저 스캔으로 이미지를 획득합니다. 512 x 512 픽셀로 이미지를 캡처합니다. Z 스텝 크기를 핀홀 직경의 1 에어리 단위로 0.5μm로 설정합니다.
2. astrocytic 전구 세포(APC)의 생성 및 특성화
- 단계 1.5-1.10에서 언급한 바와 같이 hiPSC를 효소로 들어 올려 50% Iscove의 Modified Dulbecco's Medium(IMDM), 50% Ham's F-12 Nutrient Mix(F12), 5mg/mL BSA, 1% 화학적으로 정의된 지질 농축물(CD-Lipid), 450μM 모노티오글리세롤, 7μg/mL 인슐린, 15μg/mL 트랜스페린, 1% 페니실린-스트렙토마이신은 7일 동안 전뇌 패터닝 미토겐 N-아세틸 시스테인(1mM), LDN 193189(0.1μM) 및 SB431542(10μM)를 보충했습니다.
참고: 소분자 억제제 SB431542 및 LDN-193189(LDN)는 뼈 형태 유전 단백질 및 형질전환 성장 인자-베타 신호 전달 경로의 억제제입니다.
이 시점부터 배지는 2일에 한 번 또는 월요일/수요일/금요일 프로토콜에 따라 보충되었습니다. - 피질권의 발달을 돕기 위해 정상 산소 조건에서 7일 동안 40rpm의 안와 셰이커에 세포 현탁액을 놓습니다(그림 1A).
- 8일차에 7일 동안 1% 항생제-항진균제, 1% N2 보충제, 1% 글루타민 대체물, 0.1% B27 보충제 및 2.5ng/mL 염기성 섬유아세포 성장 인자(bFGF)가 포함된 Advanced DMEM/F12를 포함하는 세포 증식 배지로 피질구를 이식합니다.
- 1% 항생제-항진균제, 1% N2, 1% 글루타민 대체물, 0.1% B27 보충제, 20ng/mL 표피 성장 인자(EGF), bFGF-H(20ng/mL bFGF-5mg/mL 헤파린)가 포함된 Advanced DMEM/F12를 포함하는 신경교세포 농축 배지를 2주 동안 주입하여 신경교구 사양을 유도합니다(그림 1A).
- 초기 신경구의 성숙을 위해 bFGF-H를 20ng/mL 백혈병 억제 인자(LIF)로 대체하고 4주 동안 구를 유지합니다.
- 성숙 배지에서 4주 후, 신경교세포 농축 배지에서 구체를 장기간 유지합니다. 응집 및 생존력 상실을 방지하기 위해 2주마다 멸균 산업용 블레이드를 사용하여 신경교구를 기계적으로 절단하고 전체 배지를 DNase I로 교체하여 절단으로 인해 생성된 DNA 단편을 제거합니다.
- Papain 해리 키트를 사용하여 신경교구를 APC의 단층으로 해리하고 Matrigel 코팅을 1:80 희석한 세포 배양 처리된 접착성 접시에 플레이트합니다.
- 80%가 합류할 때까지 신경교세포 농축 배지에서 APC를 증식시키고 효소 세포 분리 배지를 사용하여 효소로 배후시킵니다( 재료 표 참조).
- 통로로:
- 사용한 매체를 제거하고 원뿔형 튜브에 모으십시오. 세포에 효소 세포 분리 배지를 추가하고 1-2분 동안 기다립니다. 세포가 분리되기 시작하면 사용한 배지를 추가하여 효소 활성을 중화합니다.
- 세포 현탁액과 원심분리기를 800 x ɡ 에서 2분 동안 수집합니다.
- 상층액을 흡인하고, 신경교세포 농축 배지에 세포를 재현탁하고, 약 1 x 106 세포/웰을 1:80 Matrigel로 코팅된 6-웰 접시에 플레이트화합니다.
- 냉동 보존의 경우:
- 90% 피질권 증식 배지(bFGF 제외)와 10% 동결 보호제의 차가운 혼합물로 세포를 재현탁합니다. 재현탁된 세포를 cryovials로 옮깁니다.
- 즉시 cryovials를 cryobox로 옮기고 -80 °C 냉동고에서 밤새 보관하십시오.
- 다음날 나중에 사용할 수 있도록 모든 극저온을 액체 질소 탱크(LN2 탱크)로 옮깁니다.
참고: APC는 통과 번호 6까지 10% DMSO를 사용하여 동결 보존되었습니다.
- 비멘틴 및 핵 인자 IA(NFIA) 마커(그림 1C,D)를 사용하여 면역염색(1.15.1-1.15.3 단계에서 언급)하여 해리된 APC를 특성화합니다(희석액은 재료 표 참조).
- hiPSC 유래 APC의 전뇌 부위 특이성을 확인하기 위해 실시간 qPCR을 사용하여 세포에서 인간 포크헤드 박스 G1(hFOXG1)(양성)과 같은 전뇌 마커와 인간 호메오박스 B4(hHOXB4)(음성)와 같은 후뇌 마커를 검사합니다(그림 1E,F).
참고: 이러한 실험에 사용된 프라이머 서열은 보충 표 S1에 나열되어 있습니다.
3. 전뇌 특이적 성상세포의 동질적인 집단의 생성 및 특성화
- APC와 성상세포의 분화
- 14일 동안 성상세포 분화 배지(ADM)를 사용하여 APC를 성상세포로 구별합니다. 성상세포 분화 배지에는 Neurobasal, 1% Antibiotic-Antimycotic, 1% glutamine substitute, 1% N2 supplement, 0.2% B27 supplement, 1% non-essential amino acid medium (NEAA) 및 10 ng/mL ciliary neurotrophic factor (CNTF)가 포함됩니다.
- 신경교섬유산단백질(GFAP) 및 S100β 발현 마커와 함께 면역염색(1.15.1-1.15.3 단계에서 언급)을 사용하여 성상세포 동일성을 확인합니다(그림 2A,B).
- APC 및 성상세포의 De novo 단백질 합성
- 멸균 오토클레이브 13mm 유리 커버슬립에서 hiPSC 유래 전뇌 APC 및 성상세포를 유지하고 1.15.1-1.15.3단계에서 언급한 대로 면역염색합니다.
- de novo 단백질 합성을 위해 3.2.3-3.2.6 단계에서 간략하게 설명한 FUNCAT(Fluorescent Non-canonical amino acid tagging) 방법을 사용합니다(그림 3A).
- 메티오닌 결핍을 보장하기 위해 배양액에서 성장 배지를 제거하고 37°C 및 5% CO2에서 30분 동안 1mM L-아지도호모알라닌(AHA)과 혼합된 메티오닌 및 시스테인이 없는 배지로 교체합니다.
- PBS-T로 배양물을 세척하고, 4% 파라포름알데히드로 10분 동안 고정하고, PBS에서 0.3% Triton X-100으로 10분 동안 투과화하고, PBS에서 3% BSA로 1시간 동안 차단하여 비특이적 결합을 방지합니다.
- Click cell chemistry 반응 혼합물 및 Alkyne Alexa Fluor 647을 사용하여 실온에서 1시간 동안 어두운 곳에서 배양물을 배양한 다음 1시간 동안 1차 항체와 1시간 동안 해당 2차 항체(Table of Materials)를 배양합니다(그림 3B).
- 장착 매체가 있는 유리 슬라이드에 커버슬립을 장착하고 추가 이미지 분석에 사용합니다.
- 405nm, 488nm, 561nm 및 633nm에서 컨포칼 레이저 스캔으로 이미지를 획득합니다.
- 512 x 512 픽셀로 이미지를 캡처합니다. Z 스텝 크기를 핀홀 직경의 1 에어리 단위로 0.5μm로 설정합니다.
- 현미경 검사 및 이미징 매개변수를 세포 유형 전반에 걸쳐 일정한 설정으로 유지합니다. 동일한 세션에서 각 생물학적 복제에 대한 이미지를 캡처합니다.
- 표준 이미지 분석 소프트웨어(예: Fiji 또는 Imaris)를 사용하여 강도 측정을 수행합니다. Imaris에서 SURFACES 모듈을 사용하여 파편을 제거하기 위해 복셀 범위(250-350)를 제한하는 Vimentin(APC) 및 GFAP(성상세포)와 함께 FUNCAT(Fluorescent Non-canonical Amino Acid Tagging) 신호에 양성인 세포체의 체적 측정을 생성합니다.
참고: 두 세포 유형 모두에 대한 모든 생물학적 복제에서 매개변수를 유지합니다.
- 아데노신 5'-트리포스페이트(ATP) 유도 진동 칼슘파
- 접시당 5 × 103 cells/dish의 유리 바닥 접시(35mm)에 성상세포를 플레이트화하여 ATP에 대한 세포 반응을 측정합니다.
- 세포를 유리 바닥에 24시간 동안 부착하고, 칼슘 없이 HBSS(20mM HEPES, 137mM NaCl, 5mM KCl, 10mM 포도당, 1mM MgCl2, pH = 7.3)로 3회 세척하고, 실온에서 1시간 동안 5μM 비율의 미터법 염료 Fura-2AM 및 0.02% Pluronics F127을 사용하여 배양 배지에서 배양합니다.
알림: Fura-2AM은 빛과 온도에 민감한 화학 물질입니다. -20 °C에서 보관하십시오. - 배양 후 배양 배지로 2x 세척하고 HBSS를 포함하는 2mM Ca2+ 로 교체하고 초점 드리프트 보상 도립 현미경에서 60x 오일 대물렌즈(1.35 NA)를 사용하여 2FPS 속도로 세포를 이미지화합니다.
- 25ths에서 5mM의 최종 농도에서 ATP의 수조 적용에 의한 ATP 유도 칼슘 반응을 기록합니다(그림 4A).
- Fiji/ImageJ를 사용하여 각 셀 주위에 관심 영역을 그리고 모든 시점에서 F340/F380 비율을 계산합니다(그림 4B).
- 세포 대사 분석
참고: 살아있는 세포의 산소 소비율(OCR) 및 세포 외 산성화율(ECAR)은 제조업체의 프로토콜에 따라 측정되었습니다( 재료 표 참조).- 분석 하루 전에 성상세포가 CNTF 배지의 마이크로플레이트(1.5 × 104 시딩 밀도)에 부착되도록 하고 5%CO2로 37°C에서 배양합니다.
- 해당과정 스트레스 분석의 경우:
- 세포 배양 배지를 2mM 글루타민(pH 7.4로 조정)이 보충된 기본 배지로 교체하고 37°C의 non-CO2 챔버에서 1시간 동안 배양합니다.
알림: pH는 37°C 수조에서 조정해야 합니다. - 카트리지 플레이트를 기기에 삽입하여 센서를 보정합니다. 보정 후 카트리지 플레이트를 10mM 포도당, 1μM 올리고마이신 및 50mM 2-데옥시글루코스(2-DG)와 같은 키트 구성 요소의 최종 농도에서 세포 배양 플레이트로 교체합니다(그림 5A).
- 테스트가 끝나면 세포를 용해하고 총 단백질 함량을 추정합니다.
- 세포 배양 배지를 2mM 글루타민(pH 7.4로 조정)이 보충된 기본 배지로 교체하고 37°C의 non-CO2 챔버에서 1시간 동안 배양합니다.
- 미토콘드리아 응력 분석의 경우:
- CNTF 배지를 37°C의 수조에서 2mM 글루타민, 1mM 피루베이트, 10mM 포도당(pH 7.4로 조정)이 보충된 기본 배지로 교체합니다.
- 37°C의 non-CO2 챔버에서 1시간 동안 플레이트를 배양합니다. 한편, 카트리지 플레이트를 기기에 삽입하여 센서를 보정합니다.
- 보정 후 카트리지 플레이트를 1.5μM 올리고마이신, 1μM 카르보닐 시안화물-4(트리플루오로메톡시) 페닐히드라존(FCCP) 및 0.5μM 로테논/항마이신 A(그림 5C)와 같은 키트 구성 요소의 최종 농도로 세포 배양 플레이트로 교체합니다.
- 테스트가 끝나면 세포를 용해하고 총 단백질 함량을 추정합니다.
결과
인간 유도 만능 줄기세포(hiPSC) 콜로니는 상업적으로 정의된 배지를 사용하여 유지하고 다능성 마커인 Oct4 및 Nanog에 대해 면역 염색했습니다(그림 1B). FXS 및 CTRL APC는 비멘틴 및 NFIA에 대해 면역 양성 세포의 유사한 고도로 농축된 비율을 보여주었습니다(그림 1C, D). 건강한 hiPSC와 FXS hiPSC에서 유래한 APC는 HOXB4(그림 1F)에 비해 FOXG1의 상당한 상향 조절을 보였으며, 이는 우세한 전뇌 정체성과 일치합니다. FXS 그룹에서 CTRL 성상세포에 비해 GFAP 발현 성상세포의 수가 크게 감소한 것을 관찰했는데, 이는 S100β 발현 성상세포의 수에 영향을 미치지 않았습니다(그림 2B). 웨스턴 블롯 분석은 두 FXS 계통에서 생성된 성상세포가 FMRP의 발현이 부족하다는 것을 보여주었습니다(그림 2C, D). 새로 합성된 단백질의 정량화에서는 APC 또는 성상세포에서 CTRL과 FXS 라인 간에 유의미한 차이가 나타나지 않았습니다(그림 3C). 그러나 단백질 합성은 각 계통에 대한 각각의 성상세포보다 APC에서 일관되게 더 높다는 것을 발견했습니다(그림 3C). 이러한 결과는 FXS 및 CTRL 라인 모두에서 APC에서 성상세포로의 de novo 단백질 합성이 단계별로 감소했음을 시사합니다.
대조군과 FXS 성상세포는 ATP에 의해 유도된 칼슘 과도 현상을 나타냈습니다(그림 4A). 그러나 보다 상세한 분석을 통해 CTRL, FXS1 및 FXS2 성상세포에서 기록된 개별 칼슘 과도 상태 간에 몇 가지 주요 차이점이 밝혀졌습니다(그림 4B). 우리는 칼슘 반응의 유무에 따라 각각 ATP에 대한 반응자와 비반응자로 성상세포를 분류했습니다(그림 4C). FXS1 및 FXS2의 반응자 수는 CTRL보다 현저히 적었습니다. 특히, 두 FXS 성상세포주에서 ATP 적용 후 유발된 첫 번째 칼슘 과도 상태의 피크 진폭이 크게 감소하는 것을 관찰했습니다(그림 4D). 또한, 첫 번째 칼슘 과도 상태의 총 지속 시간은 FXS1 및 FXS2 라인에서 CTRL보다 훨씬 짧았습니다(그림 4E). 그러나, 칼슘 사건의 수(250초당 총 사건 수로 정량화됨; 그림 4F)는 라인 간에 비슷했습니다. 종합하면, 이러한 발견은 hiPSC 유래 FXS 성상세포에서 ATP에 의해 유도된 칼슘 반응의 변화를 보여줍니다. ECAR 결과는 hiPSC 유래 FXS 성상세포에서 해당과정(glycolysis), 해당작용량(glycolytic capacity) 및 해당과정(glycolytic reserve)의 비율이 더 높다는 것을 시사합니다(그림 5A,B). CTRL과 FXS 성상세포의 기저호흡에서 유의한 차이는 발견되지 않았다. 세포 ATP 생산은 CTRL과 FXS 성상세포 간에 유의한 차이를 보이지 않았습니다. FCCP 자극은 CTRL 성상세포보다 FXS 성상세포에서 현저히 낮은 최대 호흡을 유도했습니다(그림 5C,D).
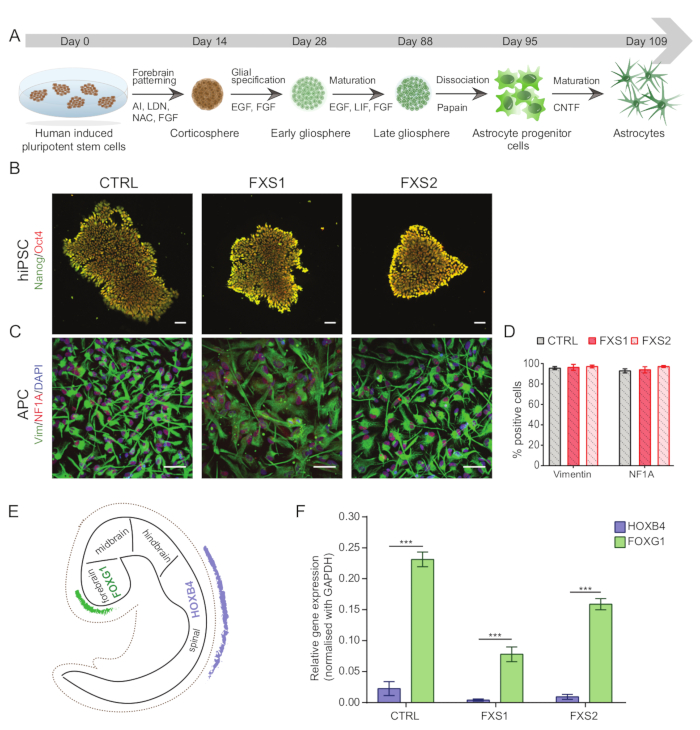
그림 1: hiPSC에서 전뇌 특이적 성상세포 전구 세포 유도.(A) hiPSC에서 성상세포 생성을 위한 예시적인 워크플로우. (B) CTRL 및 FXS 라인에서 Oct4/Nanog의 유사한 발현을 보여주는 hiPSC의 대표 이미지. (C) hiPSC 유래 APC의 동질적 집단은 유사한 수의 비멘틴 및 NFIA 양성 세포를 발현했습니다. (D) CTRL 및 FXS APC에서 Vimentin- 및 NFIA의 발현에 유의한 차이가 없습니다. 통계 분석은 2요인 ANOVA를 사용한 후 Tukey의 쌍별 비교를 사용하여 수행되었습니다. (E) in vivo 개발 중 FOXG1 및 HOXB4의 영역별 발현을 보여주는 개략도. (F) 유전자형 전반에 걸쳐 HOXB4(qRT-PCR 사용)와 비교한 FOXG1 발현의 그래픽 표현은 전뇌 혈통에 대한 경향을 시사합니다. 2-factor ANOVA에 의한 통계 분석 후 Sidak의 다중 비교 테스트. 모든 실험에서 N = 3 생물학적 복제. 피 < 0.001. 스케일 바 = 50μm. 오차 막대는 SEM을 나타냅니다. 약어: hiPSCs = human induced pluripotent stem cells; CTRL = 컨트롤; FXS = 취약 X 증후군; APCs = 성상교세포 전구세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
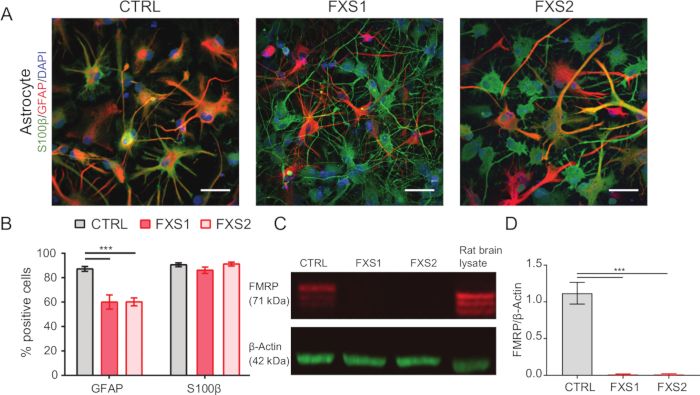
그림 2: 신경교섬유산성 단백질 양성 hiPSC 유래 FXS 성상세포의 수 감소. (A) S100β 및 GFAP 발현을 나타내는 hiPSC 유래 성상세포의 대표적인 이미지. (B) GFAP 양성 성상세포의 비율은 FXS 유래 성상세포에서 CTRL에 비해 유의하게 낮았으나, 둘 다 유사한 S100β 발현을 나타냈다. 2요인 ANOVA에 의해 결정된 통계적 유의성과 Tukey의 쌍별 비교. (C) CTRL 및 FXS의 성상세포에서 FMRP의 발현을 나타내는 면역블롯. (D) hiPSC 유래 FXS 성상세포에서 FMRP의 부재를 보여주는 그래프. Tukey의 쌍별 비교를 사용하여 단일 요인 ANOVA로 수행한 통계 분석. 위의 모든 실험에서 N = 3 개의 생물학적 복제. 스케일 바 = 50μm. ***p < 0.001. 오차 막대는 SEM을 나타냅니다. 약어: hiPSCs = human induced pluripotent stem cells; CTRL = 컨트롤; FXS = 취약 X 증후군; GFAP = 신경교섬유산성 단백질; FMRP = 취약 X 메신저 리보핵단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
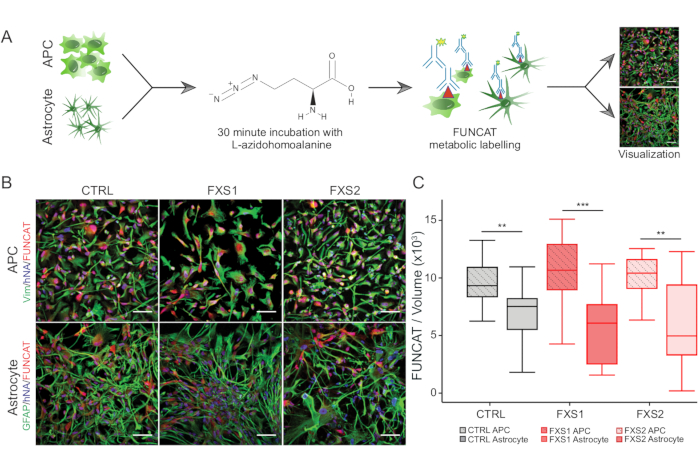
그림 3: APC에서 성상세포로의 분화로 인한 단백질 합성 감소. (A) FUNCAT 대사 라벨링을 사용하여 hiPSC 유래 APC 및 성상세포에서 단백질 합성의 라벨링 및 시각화를 보여주는 개략적인 워크플로우. (B) CTRL 및 FXS 유래 세포에서 FUNCAT/human Nuclei Antibody(hNA) 라벨이 있는 (위) Vimentin 양성 hiPSC 유래 APC 및 (아래) GFAP 양성 성상세포의 대표 이미지. (C) hiPSC 유래 APC의 FUNCAT/부피는 해당 유래 성상세포보다 유의하게 높았다. 모든 실험에서 N = 3 생물학적 복제. 눈금 막대 = 50 μm. **p < 0.01, ***p < 0.001. 수염은 1.5× IQR을 나타냅니다. 약어: hiPSCs = human induced pluripotent stem cells; CTRL = 컨트롤; FXS = 취약 X 증후군; GFAP = 신경교섬유산성 단백질; FUNCAT = 형광 비표준 아미노산 태깅. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
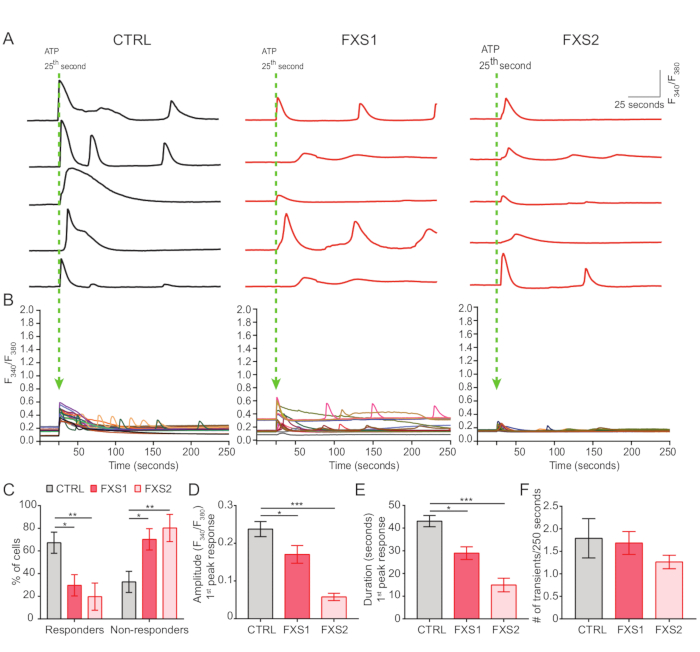
그림 4: hiPSC 유래 FXS 성상세포에서 ATP에 의해 유발되는 결핍된 Ca2+ 신호전달.(A) 25초에 ATP의 외부 적용 시 개별 성상세포에서 기록된 Ca2+ 과도 상태의 대표적인 미량.(B) ATP 적용 후 250초 이상의 Ca2+ 과도 상태를 나타내는 평균 F340/F380 비율. (C) hiPSC 유래 FXS 성상세포에서 ATP에 반응하지 않는 사람의 비율이 더 높다는 것을 보여주는 그룹화 데이터. Tukey의 쌍별 비교를 사용한 2요인 ANOVA에 의해 결정된 통계적 유의성. (D-F) 첫 번째 피크 응답(진폭 및 지속 시간)과 이벤트 빈도의 정량화. (D) 진폭의 현저한 감소를 보여줍니다. Tukey의 쌍별 비교 및 (E) hiPSC 유래 FXS 성상세포의 지속 시간을 사용한 단일 요인 ANOVA에 의해 결정된 통계적 유의성. Dunn의 다중 비교 검정을 사용한 Kruskal-Wallis 검정에 의해 결정된 통계적 유의성; SEM을 사용하여 평균 순위로 표시되는 데이터 세트. (F) hiPSC 유래 FXS 성상세포에서 Ca2+ 과도 주파수의 그래픽 표현. Tukey의 쌍별 비교를 사용한 단일 요인 ANOVA에 의한 통계 분석. 모든 실험에 대해 N = 3개의 생물학적 복제물; n = 각 세포주에 대해 19개의 셀. *p < 0.05, **p < 0.01, ***p < 0.001. 오차 막대는 SEM을 나타냅니다. # = 숫자. 약어: hiPSCs = human induced pluripotent stem cells; CTRL = 컨트롤; FXS = 취약 X 증후군; GFAP = 신경교섬유산성 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
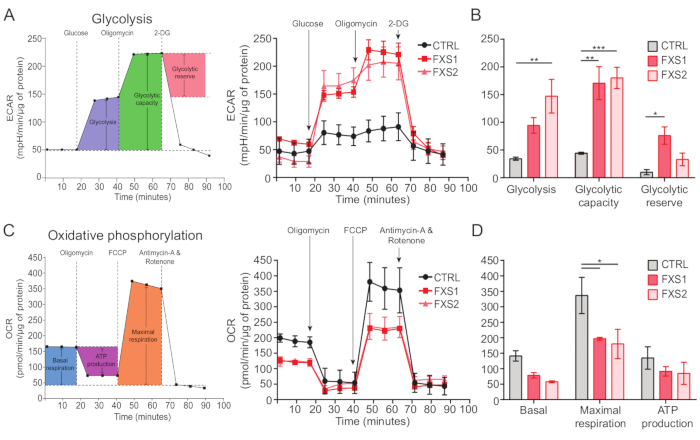
그림 5: hiPSC 유래 FXS 성상세포의 생체 에너지 결핍. (A) 10mM 포도당, 1μM 올리고마이신 및 50mM 2-DG를 순차적으로 첨가한 후 hiPSC 유래 성상세포(CTRL 및 FXS)의 세포 외 산성화 속도를 나타내는 선 그래프를 선 그래프에 표시했습니다. (B) 해당과정(glycolysis), 해당과정용량(glycolytic capacity) 및 해당과정(glycolytic reserve quantification)은 hiPSC 유래 FXS 성상세포의 증가를 보여주었습니다. Tukey의 쌍별 비교를 사용하여 2요인 ANOVA로 수행한 통계 분석. (C) 1.5μM 올리고마이신, 1μM FCCP, 0.5μM 안티마이신 A와 로테논을 순차적으로 첨가하여 산소 소비율 측정을 나타낸 선 그래프. (D) 선 그래프에서 기저 호흡, 최대 호흡 및 ATP 생산을 정량화하였으며, hiPSC 유래 FXS 성상세포는 CTRL 성상세포에 비해 최대 호흡이 유의하게 감소한 것으로 나타났다. Tukey의 쌍별 비교를 사용하여 2요인 ANOVA로 수행한 통계 분석. 모든 실험에서 N = 2개의 생물학적 복제물. *p < 0.05, **p < 0.01, ***p < 0.001. 오차 막대는 SEM을 나타냅니다. 약어: hiPSCs = human induced pluripotent stem cells; CTRL = 컨트롤; FXS = 취약 X 증후군; ECAR = 세포외 산성화 속도; 2-DG = 2-데옥시글루코스; OCR = 산소 소비율; FCCP = 카르보닐 시안화물-4(트리플루오로메톡시) 페닐히드라존. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 원고의 ID | 소스의 ID | 연령 | 성 | 재프로그래밍된 세포주 이름 | 재프로그래밍 방법 | 시작 셀 유형 | G 밴드 핵형 |
| (년) | |||||||
| Ctrl 키 | ND30625 | 76 | M | CS25iCTR-18NXX 버전 | 에피소드 벡터 | 섬유아세포 | 보통 |
| 증권 시세 표시기1 | GM07072 | 22 | M | CS072iFXS-n4 | 에피소드 벡터 | 섬유아세포 | 보통 |
| 증권 시세 표시기2 | GM05848 | 4 | M | CS848iFXS-n5 | 에피소드 벡터 | 섬유아세포 | 보통 |
표 1: 이 연구에서전뇌 특이적 성상세포를 생성하는 데 사용된 세포주.
보충 그림 S1: 염색체 분석 보고서. (A) CTRL 46, XY, (B) FXS1 46, XY 및 (C) FXS2 46, XY의 법선 GTG 밴딩 핵형. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 표 S1: 세포의 특성화를 위해 이 연구에서 사용되는 프라이머. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
여기에서는 FXS에 의해 유도된 기능적 변화를 특성화하기 위한 분석 플랫폼 역할을 하는 인간 iPSC 유래 성상세포를 생성하는 방법을 설명합니다. 이러한 성상세포는 배양에서 기능적으로 생존할 수 있으며 본 연구에서 수행된 다양한 측정에 의해 입증된 바와 같이 다양한 특성을 나타냅니다. 이 프로토콜에서 중요한 단계는 효소 리프팅 방법을 사용하여 iPSC를 피질구로 초기에 전환하는 것입니다. 이 단계에서는 콜라겐분해효소 IV형 및 디스페이아제에 대한 배양 시간을 최적화하는 것이 중요합니다. 이것이 최적화되지 않으면 iPSC가 분해되거나 단일 세포를 형성하여 피질구의 형성을 방해할 수 있습니다. 이러한 피질구는 이중 SMAD 억제15를 사용하여 전뇌 특이성을 향해 패턴화되며 성상세포 전구세포(APC)로 더욱 분화됩니다. APC의 높은 개체수를 달성하려면 신경교구를 기계적으로 절단하는 것이 중요합니다. Real-time qPCR을 사용하여 전뇌 특이성을 확인할 수 있습니다. 우리는 척수에 대한 마커인 HOXB4에 비해 전뇌의 마커인 FOXG1에서 상당한 폴드 변화 증가를 관찰했습니다.
그런 다음 APC는 JAK-STAT 신호 경로16의 활성제인 CNTF를 사용하여 성상세포로 분화됩니다. 이 연구의 결과는 FXS iPSC에서 유래한 말단에서 분화된 성상세포가 GFAP 수치가 낮다는 것을 나타내며, 이는 성숙 장애를 암시합니다. 본 연구에서는 대조군과 비교하여 FXS 성상세포 및 APC에서 de novo 단백질 합성에 어떠한 차이도 발견되지 않았지만, FXS와 대조군 모두에서 APC에서 성상세포로의 전환에서 de novo 단백질 합성이 감소하는 것을 발견했습니다. APC와 성상세포 사이의 번역이 현저히 감소하는 것은 신경 전구세포와 뉴런에 대해 나타난 보다 간소화되고 선별된 번역과 일치합니다17. 비정상적인 단백질 합성을 조사한 초기 연구에서는 성상세포나 APC가 아닌 전뇌 조직, 뉴런 및 환자 유래 섬유아세포를 활용했다18. 환자 유래 계통에서 단백질 합성에 대해 발표된 유일한 보고서는 성상세포가 아니라 림프모세포(lymphoblastoid cells)19 및 섬유아세포(fibroblasts)20,21)에서 나온 것입니다. 연구 전반에 걸친 이러한 차이에 비추어 볼 때, 향후 연구에서는 추가 FXS 환자 유래 계통에서 파생된 성상세포에서 FUNCAT 측정을 사용하는 것이 도움이 될 것입니다.
우리는 세포 내 칼슘 역학22 및 생물 에너지학을 측정하여 성상 세포의 기능을 평가했습니다. FXS 성상세포는 ATP에 의해 유도된 칼슘 과도 현상의 최대 진폭과 지속 시간이 감소했으며, 대조군 성상세포와 비교했을 때 ATP에 반응하는 세포가 더 적었습니다. 이러한 변화는 FXS가 인간 성상세포의 칼슘 항상성을 방해한다는 것을 시사합니다. 이러한 결과는 FXS 섬유아세포에서 손상된 IP3 수용체 활성을 보고한 이전 연구(23,24)와 일치합니다. 또한, FXS 성상세포에서 해당과정(glycolysis), 해당과정(glycolytic capacity) 및 해당과정(glycolytic reserve)이 증가하고, 미토콘드리아 산소 소비율이 감소하는 것을 관찰했습니다.
본 연구는 환자 유래 iPSC의 힘을 활용하여 FXS 성상세포에 대한 새로운 체외 모델의 생성 및 특성화를 설명합니다. 특히, 인간 뉴런과 공동 배양된 인간 성상세포를 사용한 초기 연구를 통해서만 뉴런의 전기생리학적 표현형을 결정하는 성상세포의 중요한 역할을 밝혀냈습니다14. 그러나 이러한 연구는 거의 전적으로 질병으로 인한 뉴런 활동의 변화에 초점을 맞췄고, 성상세포에 대해서는 아무 것도 연구되지 않았다. 여기에서 이 프로토콜은 성상세포의 기능적 변화로 초점을 전환하기 위한 새로운 프레임워크를 제공합니다. 이를 통해 글루타메이트 신호 전달 및 전기 반응과 같은 이전에 탐구되지 않은 성상세포-뉴런 상호 작용에 대한 실마리를 제공할 것입니다. 현 단계에서의 결과는 향후 연구에서 성상세포를 우선시해야 할 필요성을 강조합니다.
이 프로토콜의 한계를 인식하는 것이 중요합니다. 첫째, 그것은 DNA 단편화로 이어지는 기계적 절단과 관련이 있습니다. 이로 인해 잘게 잘린 신경교구(gliospheres)가 뭉쳐져 결국 세포가 사멸할 수 있습니다. 둘째, 성상세포에 대한 말단 분화 단계에서 APC의 파종 밀도는 접촉 매개 세포-세포 억제를 방지하는 데 필수적입니다. 배양 용기 표면에서 분리되는 것을 방지하기 위해 세포주 전반에 걸쳐 이를 최적화하는 것이 좋습니다.
여기서, 우리의 연구 결과는 과거의 모든 연구가 림프모세포 세포주 및 인간 섬유아세포와 같은 다른 세포 유형을 기반으로 했기 때문에 인간 성상세포에 대한 최초의 분석입니다25. 역기능 에너지 대사는 인간 혈장 젖산염의 수치 증가, 과립구의 산소 소비율 현저히 감소, ASD27 소아의 전대상피질, 운동피질, 시상, 소뇌에서 미토콘드리아 산화 인산화 유전자의 발현 감소에서 알 수 있듯이 자폐 스펙트럼 장애의 병인학에서 알려진 요인이다27. 파킨슨병(Parkinson's disease)28 및 알츠하이머병(Alzheimer's disease)29과 같은 신경퇴행성 질환(neurodegenerative disorders)에서도 에너지 대사의 유사한 변화가 나타나는데, 이는 해당과정(glycolysis)의 증가가 감소된 기능적 기능을 보상할 수 있음을 시사한다30. FXS 환자 유래 성상세포에서 볼 수 있는 기능 장애 에너지 대사에서 유사한 메커니즘이 작용하는지 여부를 조사하기 위한 향후 연구가 필요합니다.
현재로서는 전뇌 특이적 성상세포를 생성하는 것이 중요한 성과이지만, 미래의 발전으로 피질/해마 성상세포와 같은 지역 특이적 성상세포를 생성할 수 있을 것입니다. 이것은 지역 뇌 기능, 시냅스 가소성 및 신경교세포의 상호 작용에서 이러한 성상세포가 수행하는 뚜렷한 역할에 대한 더 깊은 통찰력을 제공할 것입니다. 이러한 지역 특이적 성상세포를 생성하는 능력은 신경 발달 및 신경 퇴행성 질환의 모델을 발전시킬 수 있습니다. 궁극적으로 이것은 특정 뇌 영역에서 성상세포 기능 장애를 표적으로 하는 보다 정확한 치료 전략으로 이어질 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
교내 기금에 대해 Sumantra Chattarji 교수에게 감사드립니다. 칼슘 이미징 설정에 접근할 수 있게 해주신 Gaiti Hasan 교수님, Central Imaging and Flow Facility-National Centre for Biological Sciences님, 교정 및 제안에 대해 말씀해 주신 Padmanabh Singh 및 Prangya Hota님, Seahorse XF 분석 수행에 도움을 주신 Labmate Asia 팀에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1-Thioglycerol | Sigma-Aldrich | M6145 | |
| Accutase solution | Sigma-Aldrich | A6964 | Enzyme cell detachment medium |
| Adenosine 5′-triphosphate magnesium salt | Sigma-Aldrich | A9187 | |
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634010 | |
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240062 | |
| B-27 Supplement (50x), serum-free | ThermoFisher Scientific | 17504044 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Chemically Defined Lipid Concentrate | ThermoFisher Scientific | 11905031 | |
| Collagenase, Type IV, powder | ThermoFisher Scientific | 17104019 | |
| Deoxyribonuclease I | Worthington Biochemical Corporation | LK003170 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D2650 | |
| Dispase II, powder | ThermoFisher Scientific | 17105041 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | |
| FXS1, FXS2 | Coriell Institute of Medical Research | GM07072, GM05848 | FXS patient cells |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | glutamine substitute |
| Ham's F-12 Nutrient Mix | ThermoFisher Scientific | 11765054 | |
| Healthy control cells | Cedars-Sinai Medical Center | ND30625 | healthy control cells |
| Heparin sodium salt from porcine intestinal mucosa | Sigma-Aldrich | H3149 | |
| IMDM | ThermoFisher Scientific | 12440053 | |
| Insulin, human | Roche | 11376497001 | |
| LDN 193189 | Stratech Scientific | S2618-SEL | |
| Leukemia Inhibitory Factor human | Sigma-Aldrich | L5283 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | |
| MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | 11140050 | |
| Mouse FGF-basic (FGF-2/bFGF) Recombinant Protein | Peprotech | 450-33 | |
| Mr. Frosty freezing container | ThermoFisher Scientific | 5100-0001 | cryobox |
| N-2 Supplement (100x) | ThermoFisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Neurobasal Medium | ThermoFisher Scientific | 21103049 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | ThermoFisher Scientific | 377267 | |
| Nunc Cell-Culture Treated 6 well dish | ThermoFisher Scientific | 140675 | |
| Papain Dissociation System | Worthington Biochemical Corporation | LK003150 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Recombinant Human CNTF Protein, CF | R&D Systems | 257-NT-010 | |
| Recombinant Human EGF Protein, CF | R&D Systems | 236-EG-01M | |
| RevitaCell Supplement (100x) | ThermoFisher Scientific | A2644501 | |
| SB431542 | Tocris | 1614 | |
| Seahorse XFe24 Analyzer | Agilent Technologies | ||
| Seahorse XF Cell Mito Stress Test Kit | Agilent Technologies | 103015-100 | |
| Seahorse XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| Tissue Culture Dishes-100 cm | Biostar Lifetech | TCD000100 | |
| Transferrin | Roche | 10652202001 | |
| VWR Razor Blades | VWR International | 55411-050 | |
| Antibodies | |||
| Primary antibody | Company | Catalog number | Dilution |
| Oct4 (C-10) | Santa Cruz Biotechnology | sc-5279 | Dilution: 1:250 Secondary antibody: Goat anti-Mouse IgG, Alexa Fluor 568 |
| Nanog | R & D Systems | AF1997 | Dilution: 1:100 Secondary antibody: Donkey anti-Goat IgG, Alexa Fluor 488 |
| Vimentin | Abcam | Ab5733 | Dilution: 1:500 Secondary antibody: Goat anti-Chicken IgY, Alexa Fluor 488 |
| NFIA | Abcam | Ab41851 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| GFAP-cy3 | Sigma | C9205 | Dilution: 1:500 Secondary antibody: NA |
| GFAP | DAKO | Z0334 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| S100β | DAKO | IR504 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 488 |
| Anti-Nuclei Antibody, clone 235-1 | Merck Millipore | MAB1281 | Dilution: 1:1000 Secondary antibody: Goat anti-Mouse IgG1, Alexa Fluor 555 |
| Secondary antibodies | Dilution | ||
| Goat anti-Mouse IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11004 | 1:1000 |
| Donkey anti-Goat IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11055 | 1:1000 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A11039 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11034 | 1:1000 |
| Goat anti-Mouse IgG1, Alexa Fluor 555 | Thermo Fisher Scientific | A21127 | 1:1000 |
참고문헌
- Santoro, M. R., Bray, S. M., Warren, S. T. Molecular of fragile X syndrome: A twenty-year perspective. Annu Rev Pathol. 7, 219-245 (2012).
- Wang, H., et al. Developmentally-programmed FMRP expression in oligodendrocytes: A potential role of FMRP in regulating translation in oligodendroglia progenitors. Hum Mol Genet. 13 (1), 79-89 (2004).
- Pacey, L. K. K., Doering, L. C. Developmental expression of FMRP in the astrocyte lineage: Implications for fragile X syndrome. Glia. 55 (15), 1601-1609 (2007).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Allen, N. J., Barres, B. A. Neuroscience: Glia - more than just brain glue. Nature. 457 (7230), 675-677 (2009).
- Khakh, B. S., McCarthy, K. D. Astrocyte calcium signaling: From observations to functions and the challenges therein. Cold Spring Harb Perspect Biol. 7 (4), a020404(2015).
- Allen, N. J., et al. Astrocyte glypicans 4 and 6 promote formation of excitatory synapses via GluA1 AMPA receptors. Nature. 486 (7403), 410-414 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Rothstein, J. D., et al. Knockout of glutamate transporters reveals a major role for astroglial transport in excitotoxicity and clearance of glutamate. Neuron. 16 (3), 675-686 (1996).
- Almad, A., Maragakis, N. J. A stocked toolbox for understanding the role of astrocytes in disease. Nat Rev Neurol. 14 (6), 351-362 (2018).
- Zhang, Y., Barres, B. A. Astrocyte heterogeneity: An underappreciated topic in neurobiology. Curr Opin Neurobiol. 20 (5), 588-594 (2010).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neurosci. 14 (5), 311-321 (2013).
- Bradley, R. A., et al. Regionally specified human pluripotent stem cell-derived astrocytes exhibit different molecular signatures and functional properties. Development. 146 (13), dev170910(2019).
- Das Sharma, S., et al. Astrocytes mediate cell non-autonomous correction of aberrant firing in human FXS neurons. Cell Rep. 42 (4), 112344(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Hu, X., et al. The JAK/STAT signaling pathway: from bench to clinic. Sig Transduct Target Ther. 6, 402(2021).
- Baser, A., et al. Onset of differentiation is post-transcriptionally controlled in adult neural stem cells. Nature. 566 (7742), 100-104 (2019).
- Pal, R., Bhattacharya, A. Modelling protein synthesis as a biomarker in fragile x syndrome patient-derived cells. Brain Sci. 9 (3), 1-12 (2019).
- Gross, C., Bassell, G. J. Excess protein synthesis in FXS patient lymphoblastoid cells can be rescued with a p110β-selective inhibitor. J Mol Med. 18 (3), 336-345 (2012).
- Kumari, D., et al. Identification of fragile X syndrome specific molecular markers in human fibroblasts: A useful model to test the efficacy of therapeutic drugs. Hum Mutat. 35 (12), 1485-1494 (2014).
- Jacquemont, S., et al. Protein synthesis levels are increased in a subset of individuals with fragile X syndrome. Hum Mol Genet. 27 (12), 2039-2051 (2018).
- Bowser, D. N., Khakh, B. S. ATP excites interneurons and astrocytes to increase synaptic inhibition in neuronal networks. J Neurosci. 24 (39), 8606-8620 (2004).
- Schmunk, G., Boubion, B. J., Smith, I. F., Parker, I., Gargus, J. J. Shared functional defect in IP3R-mediated calcium signaling in diverse monogenic autism syndromes. Transl Psychiatry. 5 (9), e643-e710 (2015).
- Peteri, U. K., et al. Generation of the human pluripotent stem-cell-derived astrocyte model with forebrain identity. Brain Sci. 11 (2), 209(2021).
- Alvarez-Mora, M. I., et al. Impaired mitochondrial function and dynamics in the pathogenesis of FXTAS. Mol Neurobiol. 54 (9), 6896-6902 (2017).
- Giulivi, C., et al. Mitochondrial dysfunction in autism. JAMA. 304 (21), 2389-2396 (2010).
- Anitha, A., et al. Brain region-specific altered expression and association of mitochondria-related genes in autism. Mol Autism. 3 (1), 12(2012).
- Teves, J. M. Y., et al. Parkinson's disease skin fibroblasts display signature alterations in growth, redox homeostasis, mitochondrial function, and autophagy. Front Neurosci. 11, 737(2018).
- Yao, J., et al. Mitochondrial bioenergetic deficit precedes Alzheimer's pathology in female mouse model of Alzheimer's disease. Proc Natl Acad Sci USA. 106 (34), 14670-14675 (2009).
- Sonntag, K. C., et al. Late-onset Alzheimer's disease is associated with inherent changes in bioenergetics profiles. Sci Rep. 7 (1), 14038(2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유