Method Article
Geração e caracterização de astrócitos derivados de células-tronco pluripotentes induzidas por humanos sem ribonucleoproteína mensageira X frágil
Neste Artigo
Resumo
Aqui descrevemos um protocolo que facilita a diferenciação de células-tronco pluripotentes induzidas por humanos em astrócitos funcionais específicos do prosencéfalo. Isso permite investigações sobre o papel das células gliais na patogênese de distúrbios do neurodesenvolvimento, como a Síndrome do X Frágil, e modelagem de outros distúrbios cerebrais.
Resumo
A síndrome do X frágil (SXF), uma das principais causas hereditárias de transtorno do espectro do autismo e deficiência intelectual, foi estudada extensivamente usando modelos de roedores. Mais recentemente, sistemas modelo derivados de células-tronco humanas também foram usados para obter insights mecanicistas sobre a fisiopatologia do FXS. No entanto, esses estudos se concentraram quase exclusivamente nos neurônios. Além disso, apesar das evidências crescentes de um papel fundamental da glia na função neuronal na saúde e na doença, pouco se sabe sobre como os astrócitos humanos são afetados pela SXF.
Portanto, neste estudo, desenvolvemos com sucesso um protocolo que captura os principais marcos espaço-temporais do desenvolvimento do cérebro e também se alinha com o processo de gliogênese. Juntos, isso oferece uma estrutura útil para estudar distúrbios do neurodesenvolvimento. Primeiro, padronizamos as células-tronco pluripotentes induzidas por humanos na linhagem neuroectodérmica com supressor duplo de mães contra a inibição decapentaplégica (SMAD) e pequenas moléculas. Posteriormente, utilizamos fatores de crescimento específicos e citocinas para gerar células progenitoras astrocíticas derivadas de pacientes (APCs) de controle (CTRL) e FXS. O tratamento de APCs com fator neurotrófico ciliar, uma citocina diferenciadora, regulou e levou as células progenitoras à maturação astrocítica, produzindo astrócitos que expressam proteínas ácidas fibrilares gliais específicas do prosencéfalo.
Descobrimos que esses astrócitos são funcionais, como evidenciado por suas respostas de cálcio à aplicação de ATP, e exibem metabolismo glicolítico e mitocondrial desregulado em FXS. Em conjunto, essas descobertas fornecem uma plataforma experimental útil de origem humana para a investigação de consequências autônomas e não autônomas de células de alterações na função astrocítica causadas por distúrbios do neurodesenvolvimento.
Introdução
A Síndrome do X Frágil (FXS), uma forma hereditária comum de deficiência intelectual e transtorno do espectro do autismo (TEA), é causada pela falta de ribonucleoproteína mensageira do X frágil (FMRP) produzida pelo gene da ribonucleoproteína 1 do mensageiro do X frágil (FMR1) (OMIM: # 300624, https://www.omim.org/entry/300624). O FMRP desempenha um papel na regulação da tradução de mRNA, formação e transporte de grânulos de mRNA e regulação mediada por microRNA da expressão gênica1. Assim, a perda de FMRP afeta não apenas o desenvolvimento do cérebro, mas também a função cerebral adulta. Tanto os níveis de transcrição de mRNA de FMR1 quanto a imunocoloração para FMRP no cérebro mostraram alta expressão neuronal, juntamente com expressão significativa também em células gliais2. No entanto, a grande maioria dos estudos anteriores em modelos animais de FXS se concentrou principalmente em neurônios e aberrações em sua função. Consequentemente, pouco se sabe sobre o papel da glia no FXS3. Tradicionalmente consideradas células de "suporte passivo"4, há evidências acumuladas de que os astrócitos são críticos na mediação de uma ampla gama de funções neuronais 5,6, incluindo a promoção da sinaptogênese7, refinamento do desenvolvimento de circuitos neurais8 e reciclagem de neurotransmissores9. Paralelamente, há evidências crescentes do papel dos astrócitos na patogênese da doença e muitas condições neurológicas têm sido associadas à disfunção astrocítica10.
Embora grande parte do trabalho anterior usando modelos animais de FXS tenha se concentrado na identificação e validação de vários alvos moleculares em neurônios para o tratamento de FXS, esses achados pré-clínicos nem sempre levaram a resultados clínicos bem-sucedidos. Além disso, contratempos em ensaios clínicos recentes também ressaltam a necessidade de sistemas de modelos baseados em humanos. Modelos de distúrbios neurológicos baseados em células-tronco cerebrais derivadas de células-tronco humanas oferecem uma estratégia poderosa para preencher essa lacuna entre insights mecanicistas de estudos com animais e sucesso limitado com resultados clínicos para os pacientes. No entanto, apenas um punhado desses estudos se concentrou em astrócitos e também principalmente em astrócitos de origem espinhal. Isso, por sua vez, é relevante à luz de estudos que mostram que a estrutura e a função dos astrócitos variam entre as regiões do cérebro11,12. Assim, uma melhor compreensão das alterações induzidas por doenças em astrócitos humanos também precisa levar em consideração essas diferenças específicas da região cerebral nos astrócitos. No entanto, modelos de distúrbios do neurodesenvolvimento usando astrócitos derivados de células-tronco humanas que são específicos para o prosencéfalo permanecem comparativamente pouco explorados13. Portanto, para começar a abordar essas lacunas, descrevemos protocolos para gerar astrócitos específicos do prosencéfalo a partir de células-tronco pluripotentes induzidas derivadas de pacientes (iPSCs) portadoras de mutações FXS; Além disso, mostramos que os astrócitos são funcionais e exibem metabolismo alterado.
Protocolo
Todos os experimentos usando células-tronco pluripotentes induzidas por humanos (hiPSCs) (Tabela 1) foram realizados após a obtenção das aprovações regulatórias institucionais apropriadas. A Figura 1A representa o protocolo completo de diferenciação de hiPSCs para astrócitos específicos do prosencéfalo maduro.
1. Manutenção e expansão de hiPSCs
- Um dia antes de plaquear os iPSCs, cubra um prato de 6 poços com Matrigel diluído 1:60 (uma matriz extracelular [ECM]) em Advanced Dulbecco's Modified Eagle Medium / Ham's F-12 (DMEM / F12) e armazene a 2-8 ° C.
NOTA: Evite armazenar pratos revestidos com Matrigel por >5 dias a 2-8 °C, pois isso pode causar degradação de proteínas na ECM ao longo do tempo. Para evitar o ressecamento do prato, cubra um mínimo de 1 mL de Matrigel diluído 1:60 por um poço de um prato de 6 poços e espalhe uniformemente pelo prato. Se utilizar no mesmo dia, mantenha a placa numa incubadora humidificada a 37 °C e 5% de CO2 durante 1 h. - No dia da cultura dos hiPSCs, remova o material de revestimento e adicione 1 mL de meio Essential 8 completo (meio basal E8 com suplemento Essential 8) junto com o inibidor de ROCK na concentração final de 1x e mantenha o prato em uma incubadora de 37 °C e 5% de CO2 antes de adicionar os hiPSCs.
- Ressuspenda os hiPSCs em meio E8 completo junto com o inibidor de ROCK na concentração final de 1x para melhor aderência das colônias.
NOTA: Não prepare grandes quantidades de meio de cultura. Preparar apenas durante 3-4 dias no máximo e conservar a 2-8 °C. - No dia seguinte, reabasteça o meio E8 completo sem o inibidor de ROCK até que as células estejam 80% confluentes (aproximadamente 4-5 dias).
- Quando atingirem 80% de confluência, destacar as colônias enzimaticamente.
- Para passar as iPSCs, remova o meio gasto do prato e adicione 1 mL por poço de mistura pré-aquecida (37 ° C) de colagenase (2 mg / mL) e dispase (1 mg / mL) em uma proporção de 1: 1 e incube a 37 ° C por mais de 20-30 min para permitir que as colônias de iPSC se levantem.
NOTA: Não deixe a loiça a 37 °C durante mais de 20-30 min; Além desse período, as colônias se desintegrarão e as células morrerão.
- Para passar as iPSCs, remova o meio gasto do prato e adicione 1 mL por poço de mistura pré-aquecida (37 ° C) de colagenase (2 mg / mL) e dispase (1 mg / mL) em uma proporção de 1: 1 e incube a 37 ° C por mais de 20-30 min para permitir que as colônias de iPSC se levantem.
- Quando as colônias começarem a se levantar, retire os pratos da incubadora e neutralize a atividade enzimática adicionando 2 mL de solução salina tamponada com fosfato (DPBS) de Dulbecco.
- Raspar as colônias com DPBS e coletar a suspensão em um tubo cônico de 15 mL usando uma pipeta sorológica de 10 mL de diâmetro largo.
- Triture suavemente a suspensão 2-3x para quebrar as colônias usando uma pipeta sorológica de 10 mL e permita que as colônias se estabeleçam.
NOTA: Não transforme as colônias em células únicas; Isso pode fazer com que as células não adiram ao prato e causar mais morte celular. Além disso, não os deixe como grandes colônias; Isso levará a colônias mais diferenciadas posteriormente. - Assim que as colônias se estabelecerem (aproximadamente após 2 min), aspire a mistura enzimática DPBS deixando aproximadamente 1 mL no tubo.
- Adicione 2 mL de DPBS ao tubo, misture as colônias batendo e deixe-as assentar. Repita isso 2x para remover toda a enzima residual das colônias. Remova o máximo de sobrenadante possível após a2ª lavagem, ressuspenda as colônias em 1 mL de meio E8 completo e coloque um prato preparado na hora, conforme mencionado nas etapas 1.2-1.3.
- Alternativamente, criopreserve uma proporção de colônias usando 10% de dimetilsulfóxido (DMSO) como solução crioprotetora para expansão e uso futuros.
- Prepare o meio de criopreservação na hora misturando 90% de meio E8 completo e 10% de DMSO como solução crioprotetora e coloque-o a 2-8 °C até o uso.
- Para crioreservar, siga as etapas 1.5-1.10.
- Durante a etapa 1.10, após a2ª lavagem, deixe as colônias assentarem e remova o sobrenadante. Às colônias, adicione 1 mL de meio de criopreservação a frio recém-preparado e transfira para criogeniais.
NOTA: Depois de adicionar o meio de criopreservação às colônias, transfira rapidamente o conteúdo para criogeniais. O atraso pode resultar em uma taxa de renascimento mais baixa, pois o DMSO é um crioprotetor que pode danificar as células. - Mova imediatamente os criotubos para uma caixa criogênica e mantenha em um freezer a -80 ° C durante a noite.
- No dia seguinte, mude todos os criogenianos para um tanque de nitrogênio líquido (tanque LN2 ) para uso futuro.
NOTA: hiPSCs devem ser rotineiramente cariotipados usando bandas G (Figura Suplementar S1) para quaisquer anormalidades, caracterizados usando imunocitoquímica para pluripotência (Figura 1B) e testados para micoplasma.- Para caracterizar hiPSCs usando imunocitoquímica, coloque as colônias em lamínulas de vidro de 13 mm revestidas com Matrigel 1:60 e autoclavadas. Quando estiverem 40% confluentes, lave as células com PBS-T (PBS-0,1% Tween 20), fixe com paraformaldeído a 4% por 10 min, permeabilize com Triton X-100 a 0,3% em PBS por 10 min e bloqueie com albumina de soro bovino (BSA) a 3% em PBS por 1 h para evitar ligação inespecífica.
- Após o bloqueio, incubar as culturas com anticorpos primários por 1 h e depois lavar 3x com PBS-T por 5 min cada, seguido de anticorpos secundários correspondentes (Tabela de Materiais) no escuro por 1 h.
- Monte as lamínulas em lâminas de vidro com meio de montagem e adquira imagens por varredura a laser confocal a 405 nm, 488 nm, 561 nm e 633 nm. Capture imagens em 512 x 512 pixels; defina o tamanho do passo Z em 0,5 μm com 1 unidade arejada de diâmetro do orifício.
2. Geração e caracterização de células progenitoras astrocíticas (APCs)
- Levante enzimaticamente os hiPSCs conforme mencionado nas etapas 1.5-1.10 e coloque-os em uma placa de cultura em suspensão não aderente (100 mm) com meio quimicamente definido14 contendo 50% de meio de Dulbecco modificado de Iscove (IMDM), 50% de mistura de nutrientes F-12 de Ham (F12), 5 mg / mL de BSA, 1% de concentrado lipídico quimicamente definido (CD-Lipid), 450 μM de monotioglicerol, 7 μg / mL de insulina, 15 μg / mL de transferrina, 1% de penicilina-estreptomicina suplementada com mitógenos de padronização do prosencéfalo N-acetilcisteína (1 mM), LDN 193189 (0,1 μM) e SB431542 (10 μM) por 7 dias.
NOTA: Os inibidores de moléculas pequenas SB431542 e LDN-193189 (LDN) são inibidores da proteína morfogenética óssea e das vias de sinalização do fator de crescimento transformador beta.
A partir deste ponto, o meio foi reabastecido uma vez a cada 2 dias ou seguindo o protocolo de segunda/quarta/sexta-feira. - Colocar a suspensão celular num agitador orbital a 40 rpm durante 7 dias em condições normóxicas para facilitar o desenvolvimento das corticosferas (figura 1A).
- No dia 8, transfira as corticosferas para um meio de proliferação celular contendo DMEM/F12 avançado com 1% de antibiótico-antimicótico, 1% de suplemento de N2, 1% de substituto de glutamina, 0,1% de suplemento de B27 e 2,5 ng/mL de fator básico de crescimento de fibroblastos (bFGF) por 7 dias.
- Induza as esferas para especificação glial, submetendo-as a meio de enriquecimento glial contendo DMEM / F12 avançado com 1% de antibiótico-antimicótico, 1% de N2, 1% de substituto de glutamina, 0,1% de suplemento de B27, 20 ng / mL de fator de crescimento epidérmico (EGF), bFGF-H (20 ng / mL de bFGF-5 mg / mL de heparina) por 2 semanas para obter gliosferas precoces ( Figura 1A ).
- Para a maturação das gliosferas iniciais, substitua o bFGF-H por 20 ng/mL de fator inibidor da leucemia (LIF) e mantenha as esferas por 4 semanas.
- Após 4 semanas no meio de maturação, manter as esferas em meio de enriquecimento glial por períodos prolongados. Para evitar agregação e perda de viabilidade, a cada 2 semanas, pique mecanicamente as gliosferas usando uma lâmina industrial estéril e substitua todo o meio por DNase I para remover fragmentos de DNA gerados pelo corte.
- Dissocie as gliosferas em monocamadas de APCs usando um kit de dissociação de papaína e coloque em uma placa aderente tratada com cultura de células com diluição de 1:80 de revestimento de Matrigel.
- Propague os APCs em meio de enriquecimento glial até 80% confluente e passe-os enzimaticamente usando o meio de descolamento de células enzimáticas (consulte a Tabela de Materiais).
- Para a passagem:
- Remova a mídia gasta e colete em um tubo cônico. Às células, adicione o meio de desprendimento de células enzimáticas e aguarde 1-2 min. Assim que as células começarem a se desprender, adicione o meio gasto para neutralizar a atividade enzimática.
- Recolher a suspensão celular e centrifugar a 800 x ɡ durante 2 min.
- Aspire o sobrenadante, ressuspenda as células em meio de enriquecimento glial e coloque aproximadamente 1 x 106 células / poço em um prato de 6 poços revestido com Matrigel 1:80.
- Para criopreservação:
- Ressuspenda as células em uma mistura fria de 90% de meio de proliferação da corticosfera (sem bFGF) e 10% de crioprotetor. Transfira as células ressuspensas para criogeniais.
- Mova imediatamente os criotubos para uma caixa criogênica e mantenha no freezer a -80 ° C durante a noite.
- No dia seguinte, mude todos os criogenianos para um tanque de nitrogênio líquido (tanque LN2 ) para uso futuro.
NOTA: Os APCs foram criopreservados com DMSO a 10% até a passagem número 6.
- Caracterize os APCs dissociados por imunocoloração (conforme mencionado nas etapas 1.15.1-1.15.3) com marcadores de vimentina e fator nuclear IA (NFIA) (Figura 1C, D) (consulte a Tabela de Materiais para diluições).
- Para confirmar a especificidade regional do prosencéfalo das APCs derivadas de hiPSC, teste as células para um marcador do prosencéfalo, como a caixa de garfo humano G1 (hFOXG1) (positivo) e o marcador do rombencéfalo, como o Homeobox B4 humano (hHOXB4) (negativo) usando qPCR em tempo real ( Figura 1E , F ).
NOTA: As sequências de primers usadas para esses experimentos foram listadas na Tabela Suplementar S1.
3. Geração e caracterização de uma população homogênea de astrócitos específicos do prosencéfalo
- Diferenciação de astrócitos de APCs
- Use o meio de diferenciação astrocítica (ADM) por 14 dias para diferenciar APCs em astrócitos. O meio de diferenciação astrocítica contém neurobasal, 1% antibiótico-antimicótico, 1% substituto da glutamina, 1% suplemento de N2, 0,2% suplemento de B27, 1% de meio de aminoácidos não essenciais (NEAA) e 10 ng/mL de fator neurotrófico ciliar (CNTF).
- Confirme a identidade astrocítica usando imunocoloração (conforme mencionado nas etapas 1.15.1-1.15.3.) com proteína ácida fibrilar glial (GFAP) e marcadores de expressão S100β (Figura 2A, B).
- Síntese proteica de novo em APCs e astrócitos
- Mantenha APCs e astrócitos do prosencéfalo derivados de hiPSC em lamínulas de vidro estéreis autoclavadas de 13 mm e imunocore-os conforme mencionado nas etapas 1.15.1-1.15.3.
- Para a síntese de proteínas de novo , use o método de marcação de aminoácidos fluorescente não canônico (FUNCAT), explicado brevemente nas etapas 3.2.3-3.2.6 (Figura 3A).
- Para garantir a deficiência de metionina, remova o meio de crescimento das culturas e substitua por meio livre de metionina e cisteína misturado com 1 mM de L-azidohomoalanina (AHA) por 30 min a 37 ° C e 5% de CO2.
- Lave as culturas com PBS-T, fixe com paraformaldeído a 4% por 10 min, permeabilize com Triton X-100 a 0,3% em PBS por 10 min e bloqueie com BSA a 3% em PBS por 1 h para evitar ligação inespecífica.
- Incube as culturas no escuro por 1 h em temperatura ambiente com a mistura de reação química de células Click e Alkyne Alexa Fluor 647, seguida por anticorpos primários por 1 h e anticorpos secundários correspondentes (Tabela de Materiais) por 1 h (Figura 3B).
- Monte as lamínulas em lâminas de vidro com meio de montagem e use-as para análise de imagem posterior.
- Adquira imagens por varredura a laser confocal em 405 nm, 488 nm, 561 nm e 633 nm.
- Capture imagens em 512 x 512 pixels; defina o tamanho do passo Z em 0,5 μm com 1 unidade arejada de diâmetro do orifício.
- Mantenha os parâmetros de microscopia e imagem em uma configuração constante em todos os tipos de células. Capture imagens para cada réplica biológica na mesma sessão.
- Realize medições de intensidade usando qualquer software de análise de imagem padrão (por exemplo, Fiji ou Imaris). Em Imaris, use o módulo SURFACES para produzir medições volumétricas de corpos celulares positivos para sinal de marcação de aminoácidos fluorescente não canônico (FUNCAT) com Vimentina (APCs) e GFAP (astrócitos) limitando a faixa de voxel (250-350) para remover detritos.
NOTA: Mantenha os parâmetros em todas as réplicas biológicas para ambos os tipos de células.
- Ondas de cálcio oscilatórias induzidas por adenosina 5′-trifosfato (ATP)
- Colocar astrócitos em uma placa com fundo de vidro (35 mm) a 5 × 103 células/placa para medir a resposta celular ao ATP.
- Deixe as células aderirem ao fundo de vidro por 24 h, lave-as 3x com HBSS (20 mM HEPES, 137 mM NaCl, 5 mM KCl, 10 mM Glucose, 1 mM MgCl2, pH = 7,3) sem cálcio e incube em meio de cultura com corante métrico de proporção 5 μM Fura-2AM e 0,02% Pluronics F127 por 1 h em temperatura ambiente.
NOTA: Fura-2AM é um produto químico sensível à luz e à temperatura; armazenar a -20 °C. - Após a incubação, lave 2x com meio de cultura e substitua por 2 mM Ca2+ contendo HBSS e obtenha imagens das células na velocidade de 2 FPS usando uma objetiva de óleo de 60x (1,35 NA) em um microscópio invertido com compensação de desvio de foco.
- Registre as respostas de cálcio induzidas por ATP pela aplicação de ATP em banho na concentração final de 5 mM aos 25anos (Figura 4A).
- Desenhe regiões de interesse ao redor de cada célula usando Fiji / ImageJ e calcule a proporção F340 / F380 em todos os pontos de tempo (Figura 4B).
- Ensaios metabólicos celulares
NOTA: A taxa de consumo de oxigênio (OCR) e a taxa de acidificação extracelular (ECAR) das células vivas foram medidas de acordo com o protocolo do fabricante (consulte a Tabela de Materiais).- Um dia antes do ensaio, permitir que os astrócitos adiram à microplaca (densidade de semeadura de 1,5 ×10 4 ) em meio CNTF e incubar a 37 °C com 5% de CO2.
- Para o ensaio de estresse de glicólise:
- Substituir o meio de cultura celular por meio de base suplementado com 2 mM de glutamina (pH ajustado para 7,4) e incubar numa câmara não-CO2 a 37 °C durante 1 h.
NOTA: O pH deve ser ajustado em banho-maria a 37 °C. - Insira a placa do cartucho no instrumento para calibrar o sensor. Após a calibração, substitua a placa do cartucho pela placa de cultura de células na concentração final dos seguintes componentes do kit: 10 mM de glicose, 1 μM de oligomicina e 50 mM de 2-desoxi-glicose (2-DG) (Figura 5A).
- No final do teste, lisar as células e estimar o teor total de proteínas.
- Substituir o meio de cultura celular por meio de base suplementado com 2 mM de glutamina (pH ajustado para 7,4) e incubar numa câmara não-CO2 a 37 °C durante 1 h.
- Para o ensaio de tensão mitocondrial:
- Substituir o meio CNTF por meio de base suplementado com 2 mM de glutamina, 1 mM de piruvato, 10 mM de glicose (pH ajustado para 7,4) em banho-maria a 37 °C.
- Incubar a placa numa câmara não-CO2 a 37 °C durante 1 h. Enquanto isso, insira a placa do cartucho no instrumento para calibrar o sensor.
- Após a calibração, substitua a placa do cartucho pela placa de cultura de células com uma concentração final dos seguintes componentes do kit: 1,5 μM de oligomicina, 1 μM de carbonilcianeto-4 (trifluorometoxi) fenilhidrazona (FCCP) e 0,5 μM de rotenona/antimicina A (Figura 5C).
- No final do teste, lisar as células e estimar o teor total de proteínas.
Resultados
As colônias de células-tronco pluripotentes induzidas por humanos (hiPSC) foram mantidas usando meio definido comercialmente disponível e imunomarcado para marcadores de pluripotência, Oct4 e Nanog (Figura 1B). FXS e CTRL APCs mostraram proporções comparáveis altamente enriquecidas de células imunopositivas para vimentina e NFIA ( Figura 1C , D ). Descobrimos que as APCs derivadas de hiPSCs saudáveis e FXS mostraram uma regulação positiva substancial de FOXG1 em comparação com HOXB4 (Figura 1F) consistente com uma identidade predominante do prosencéfalo. Observamos uma redução significativa no número de astrócitos que expressam GFAP nos grupos FXS em comparação com os astrócitos CTRL sem afetar o número de astrócitos que expressam S100β (Figura 2B). A análise de Western blot mostrou que os astrócitos gerados a partir de ambas as linhagens FXS não tinham expressão de FMRP ( Figura 2C , D ). A quantificação de proteínas recém-sintetizadas não revelou nenhuma diferença significativa entre as linhas CTRL versus FXS em APCs ou astrócitos ( Figura 3C ). No entanto, descobrimos que a síntese de proteínas é consistentemente maior nas APCs do que em seus respectivos astrócitos para cada linha ( Figura 3C ). Esses resultados sugerem uma redução específica do estágio na síntese de proteínas de novo de APCs para astrócitos nas linhagens FXS e CTRL.
O controle, assim como os astrócitos FXS, exibiram transientes de cálcio induzidos por ATP (Figura 4A). No entanto, uma análise mais detalhada revelou várias diferenças importantes entre os transientes de cálcio individuais registrados nos astrócitos CTRL, FXS1 e FXS2 (Figura 4B). Classificamos os astrócitos como respondedores e não respondedores ao ATP com base na presença ou ausência de resposta ao cálcio, respectivamente (Figura 4C). O número de respondedores em FXS1 e FXS2 foi significativamente menor do que CTRL. Especificamente, observamos uma redução significativa na amplitude de pico do primeiro transiente de cálcio evocado após a aplicação de ATP em ambas as linhas de astrócitos FXS (Figura 4D). Além disso, a duração total do primeiro transiente de cálcio foi significativamente menor nas linhas FXS1 e FXS2 do que no CTRL (Figura 4E). No entanto, o número de eventos de cálcio (quantificado como o número total de eventos por 250 s; Figura 4F), foi comparável entre as linhas. Tomados em conjunto, esses achados revelam alterações nas respostas de cálcio provocadas pelo ATP em astrócitos FXS derivados de hiPSC. Os resultados do ECAR sugerem uma taxa mais alta de glicólise, capacidade glicolítica e reserva glicolítica em astrócitos FXS derivados de hiPSC (Figura 5A, B). Não encontramos diferença significativa na respiração basal nos astrócitos CTRL e FXS. A produção de ATP celular não mostrou diferença significativa entre os astrócitos CTRL e FXS. A estimulação FCCP provocou respiração máxima significativamente menor em astrócitos FXS do que em astrócitos CTRL ( Figura 5C , D ).
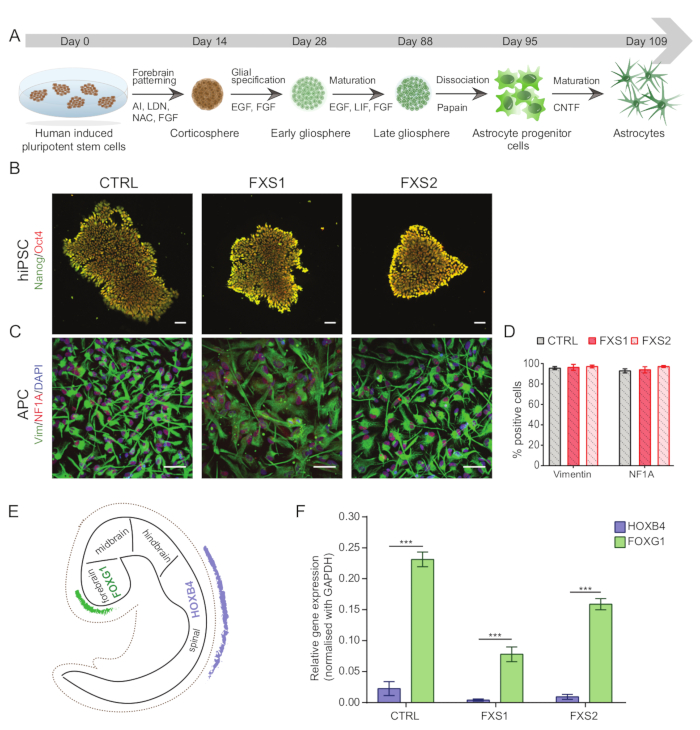
Figura 1: Derivação de células progenitoras astrocíticas específicas do prosencéfalo a partir de hiPSCs. (A) Fluxo de trabalho ilustrativo para geração de astrócitos a partir de hiPSCs. (B) Imagens representativas de hiPSCs exibindo expressão comparável de Oct4 / Nanog em linhas CTRL e FXS. (C) A população homogênea de APCs derivadas de hiPSC expressou um número semelhante de células positivas para Vimentina e NFIA. (D) Nenhuma diferença significativa na expressão de Vimentina e NFIA entre APCs CTRL e FXS. A análise estatística foi feita usando ANOVA de dois fatores seguida de comparação pareada de Tukey. (E) Esquemático ilustrando a expressão específica da região de FOXG1 e HOXB4 durante o desenvolvimento in vivo. (F) Representação gráfica da expressão de FOXG1 em comparação com HOXB4 (usando qRT-PCR) entre genótipos, sugerindo propensão para a linhagem do prosencéfalo. Análise estatística por ANOVA de dois fatores seguida do teste de comparações múltiplas de Sidak. Para todos os experimentos, N = 3 réplicas biológicas. p < 0,001. Barra de escala = 50 μm. As barras de erro representam SEM. Abreviaturas: hiPSCs = células-tronco pluripotentes induzidas por humanos; CTRL = Controle; FXS = Síndrome do X Frágil; APCs = células progenitoras de astrócitos. Clique aqui para ver uma versão maior desta figura.
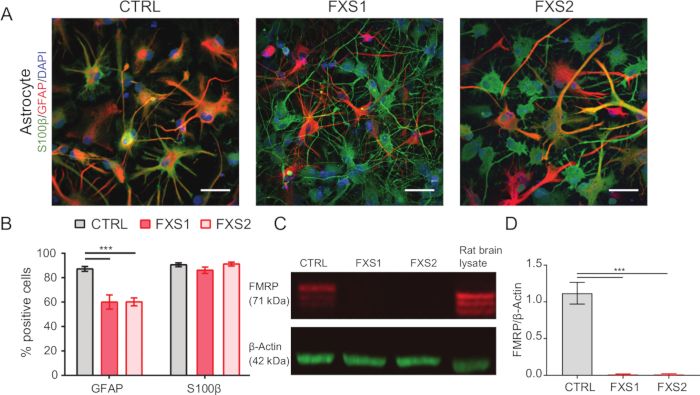
Figura 2: Número reduzido de astrócitos FXS derivados de hiPSC positivos para proteína ácida fibrilar glial. (A) Imagens representativas de astrócitos derivados de hiPSC exibindo expressão de S100β e GFAP. (B) A porcentagem de astrócitos positivos para GFAP foi significativamente menor em astrócitos derivados de FXS em comparação com CTRL, embora ambos exibissem expressão semelhante de S100β. Significância estatística determinada por ANOVA de dois fatores seguida de comparação pareada de Tukey. (C) Immunoblot representando a expressão de FMRP em astrócitos de CTRL e FXS. (D) Gráficos mostrando ausência de FMRP em astrócitos FXS derivados de hiPSC. Análise estatística feita por ANOVA de fator único com comparação pareada de Tukey. Para todos os experimentos acima, N = 3 réplicas biológicas. Barra de escala = 50 μm. ***p < 0,001. As barras de erro representam SEM. Abreviaturas: hiPSCs = células-tronco pluripotentes induzidas por humanos; CTRL = Controle; FXS = Síndrome do X Frágil; GFAP = proteína glial fibrilar ácida; FMRP = ribonucleoproteína mensageira do X frágil. Clique aqui para ver uma versão maior desta figura.
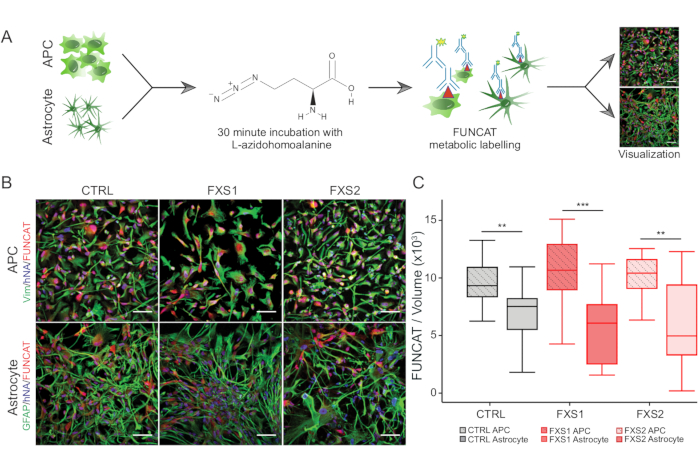
Figura 3: Síntese de proteínas reduzida devido à diferenciação de APCs para astrócitos. (A) Fluxo de trabalho esquemático que descreve a rotulagem e visualização da síntese de proteínas em APCs e astrócitos derivados de hiPSC usando a marcação metabólica FUNCAT. (B) Imagens representativas de (superior) APCs derivadas de hiPSC positivas para vimentina e (inferior) astrócitos positivos para GFAP com rótulo FUNCAT/anticorpo de núcleo humano (hNA) em células derivadas de CTRL e FXS. (C) FUNCAT/VOLUME DE APCs derivadas de hiPSC foi significativamente maior do que os astrócitos derivados correspondentes. Para todos os experimentos, N = 3 réplicas biológicas. Barra de escala = 50 μm. **p < 0,01, ***p < 0,001. Os bigodes representam 1,5 × de IQR. Abreviaturas: hiPSCs = células-tronco pluripotentes induzidas por humanos; CTRL = Controle; FXS = Síndrome do X Frágil; GFAP = proteína glial fibrilar ácida; FUNCAT = marcação fluorescente de aminoácidos não canônicos. Clique aqui para ver uma versão maior desta figura.
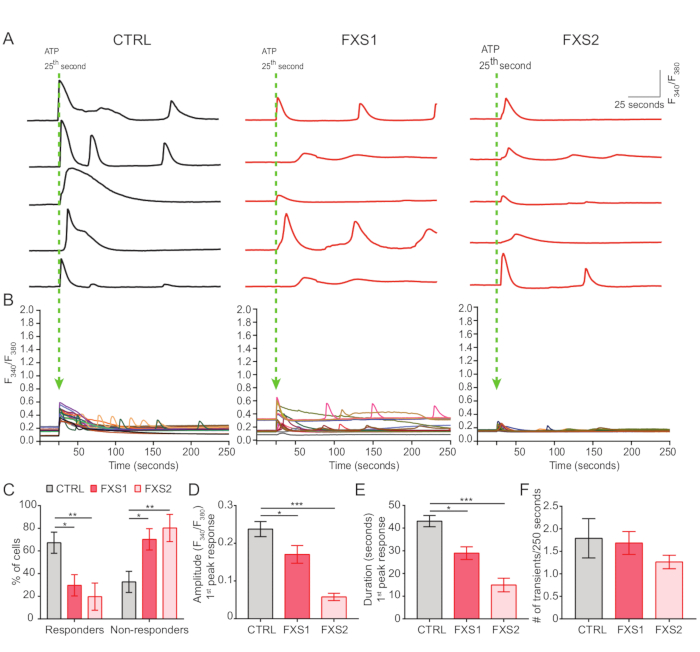
Figura 4: Sinalização deficiente de Ca2+ evocada por ATP em astrócitos FXS derivados de hiPSC. (A) Traços representativos de transientes de Ca2+ registrados de astrócitos individuais após aplicação externa de ATP a 25s . (B) Razões médias de F340 / F380 representando transientes de Ca2+ acima de 250 s após a aplicação de ATP. (C) Dados agrupados mostrando maior porcentagem de não respondedores ao ATP em astrócitos FXS derivados de hiPSC. Significância estatística determinada por ANOVA de dois fatores com comparação pareada de Tukey. (D-F) Quantificação da resposta do primeiro pico (amplitude e duração) e frequência dos eventos. (D) Mostra uma redução significativa na amplitude. Significância estatística determinada por ANOVA de fator único com comparação de pares de Tukey e duração (E) em astrócitos FXS derivados de hiPSC. Significância estatística determinada pelo teste de Kruskal-Wallis com teste de comparações múltiplas de Dunn; conjunto de dados representado como classificações médias com SEM. (F) Representação gráfica da frequência transitória de Ca2+ em astrócitos FXS derivados de hiPSC. Análise estatística por ANOVA de fator único com comparação pareada de Tukey. Para todos os experimentos, N = 3 repetições biológicas; n = 19 células para cada linhagem celular. *p < 0,05, **p < 0,01, ***p < 0,001. As barras de erro representam SEM. # = Número. Abreviaturas: hiPSCs = células-tronco pluripotentes induzidas por humanos; CTRL = Controle; FXS = Síndrome do X Frágil; GFAP = proteína glial fibrilar ácida. Clique aqui para ver uma versão maior desta figura.
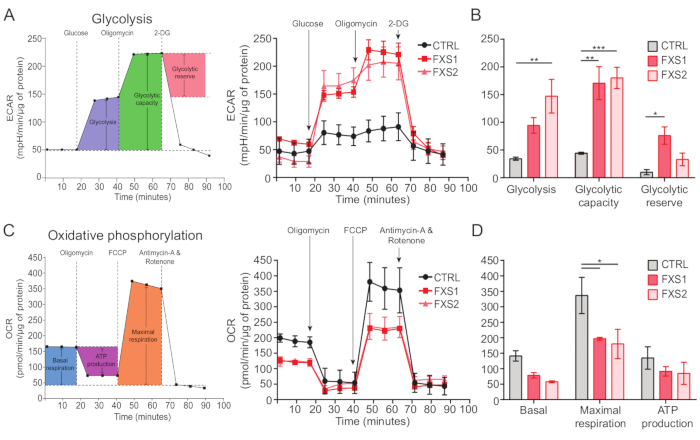
Figura 5: Déficits bioenergéticos em astrócitos FXS derivados de hiPSC. (A) Gráfico de linhas representando a taxa de acidificação extracelular de astrócitos derivados de hiPSC (CTRL e FXS) após a adição de 10 mM de glicose, 1 μM de oligomicina e 50 mM de 2-DG sequencialmente e plotado em um gráfico de linhas. (B) A glicólise, a capacidade glicolítica e a quantificação da reserva glicolítica mostraram um aumento nos astrócitos FXS derivados de hiPSC. Análise estatística feita por ANOVA de dois fatores com comparação pareada de Tukey. (C) Gráfico de linhas representando a medição da taxa de consumo de oxigênio por adição sequencial de 1,5 μM de oligomicina, 1 μM de FCCP e 0,5 μM de antimicina A e rotenona. (D) A respiração basal, a respiração máxima e a produção de ATP foram quantificadas a partir do gráfico de linhas e os astrócitos FXS derivados de hiPSC mostraram diminuição significativa na respiração máxima em comparação com os astrócitos CTRL. Análise estatística feita por ANOVA de dois fatores com comparação pareada de Tukey. Para todos os experimentos, N = 2 réplicas biológicas. *p < 0,05, **p < 0,01, ***p < 0,001. As barras de erro representam SEM. Abreviaturas: hiPSCs = células-tronco pluripotentes induzidas por humanos; CTRL = Controle; FXS = Síndrome do X Frágil; ECAR = taxa de acidificação extracelular; 2-DG = 2-desoxiglicose; OCR = taxa de consumo de oxigênio; FCCP = cianeto de carbonila-4 (trifluorometoxi) fenilhidrazona. Clique aqui para ver uma versão maior desta figura.
| ID no manuscrito | ID na origem | Idade | Sexo | Nome da linha celular reprogramada | Método de reprogramação | Tipo de célula inicial | Cariótipo de banda G |
| (anos) | |||||||
| CTRL | ND30625 | 76 | M | CS25iCTR-18nxx | Vetores epissómicos | Fibroblastos | Normal |
| FXS1 | GM07072 | 22 | M | CS072iFXS-n4 | Vetores epissómicos | Fibroblastos | Normal |
| FXS2 | GM05848 | 4 | M | CS848iFXS-n5 | Vetores epissómicos | Fibroblastos | Normal |
Tabela 1: Linhagens celulares usadas neste estudopara gerar astrócitos específicos do prosencéfalo.
Figura Suplementar S1: Relatório de análise cromossômica. Cariótipo de bandas GTG normal de (A) CTRL 46, XY, (B) FXS1 46, XY e (C) FXS2 46, XY. Clique aqui para baixar esta figura.
Tabela Suplementar S1: Primers usados neste estudo para a caracterização de células. Clique aqui para baixar esta tabela.
Discussão
Aqui, descrevemos um método para gerar astrócitos humanos derivados de iPSC que servem como uma plataforma de ensaio para caracterizar alterações funcionais induzidas por FXS. Esses astrócitos são funcionalmente viáveis em cultura e exibem várias propriedades, como evidenciado por uma série de medições realizadas no presente estudo. Uma etapa crítica neste protocolo é a conversão inicial de iPSCs em corticosferas usando o método de levantamento enzimático. Nesta fase, otimizar o tempo de incubação da colagenase tipo IV e dispase é crucial. Se isso não for otimizado, pode fazer com que as iPSCs se desintegrem ou formem células únicas, o que impedirá a formação de corticosferas. Essas corticosferas são padronizadas para a especificidade do prosencéfalo usando inibição dupla de SMAD15 e são diferenciadas em células progenitoras de astrócitos (APCs). Para alcançar uma alta população de APCs, o corte mecânico de gliosferas é crucial. A qPCR em tempo real pode ser usada para confirmar a especificidade do prosencéfalo; observamos um aumento significativo da mudança de dobra em FOXG1, um marcador para o prosencéfalo, em comparação com HOXB4, um marcador para a medula espinhal.
As APCs são então diferenciadas em astrócitos usando CNTF, um ativador da via de sinalização JAK-STAT16. Os resultados deste estudo indicam que astrócitos terminalmente diferenciados derivados de FXS iPSCs têm níveis mais baixos de GFAP, o que é sugestivo de maturidade prejudicada. Embora nossas análises não tenham encontrado nenhuma diferença na síntese proteica de novo em astrócitos FXS e APCs em comparação com controles, encontramos uma redução na síntese proteica de novo na transição de APCs para astrócitos em FXS e linhas de controle. A redução significativa na tradução entre APCs e astrócitos é consistente com uma tradução mais simplificada e curada que foi demonstrada para neurônios versus células precursoras neurais17. Trabalhos anteriores que examinaram a síntese de proteínas aberrantes utilizaram tecidos cerebrais inteiros, neurônios e fibroblastos derivados de pacientes, não astrócitos ou APCs18. Os únicos relatos publicados sobre a síntese proteica de linhagens derivadas de pacientes não são em astrócitos, mas em células linfoblastóides19 e fibroblastos 20,21. À luz dessas variações entre os estudos, estudos futuros se beneficiariam do uso de medições FUNCAT em astrócitos derivados de linhagens adicionais derivadas de pacientes com FXS.
Avaliamos a funcionalidade dos astrócitos medindo a dinâmica do cálcio intracelular22 e a bioenergética. Os astrócitos FXS mostraram amplitude de pico e duração reduzidas dos transientes de cálcio induzidos por ATP, com menos células respondendo ao ATP quando comparadas aos astrócitos de controle. Juntas, essas alterações sugerem que o FXS interrompe a homeostase do cálcio em astrócitos humanos. Esses resultados são consistentes com um estudo anterior23,24 relatando atividade prejudicada do receptor IP3 em fibroblastos FXS. Além disso, observamos aumento da glicólise, capacidade glicolítica e reserva glicolítica nos astrócitos FXS, juntamente com taxas reduzidas de consumo de oxigênio mitocondrial.
O presente estudo descreve a geração e caracterização de um novo modelo in vitro para astrócitos FXS, aproveitando o poder das iPSCs derivadas de pacientes. Notavelmente, é apenas por meio de um estudo anterior usando astrócitos humanos co-cultivados com neurônios humanos que descobrimos o papel crítico dos astrócitos na determinação do fenótipo eletrofisiológico dos neurônios14. Esses estudos, no entanto, se concentraram quase inteiramente nas mudanças induzidas pela doença na atividade neuronal, e nada foi explorado em astrócitos. Aqui, este protocolo oferece uma nova estrutura para mudar nosso foco para alterações funcionais em astrócitos. Isso, por sua vez, lançará luz sobre interações astrócitos-neurônios anteriormente inexploradas, como sinalização de glutamato e respostas elétricas. Nossos resultados nesta fase enfatizam a necessidade de priorizar os astrócitos em pesquisas futuras.
É fundamental reconhecer as limitações deste protocolo. Primeiro, envolve corte mecânico, o que também leva à fragmentação do DNA. Isso pode fazer com que as gliosferas picadas se aglomerem, levando à morte celular. Em segundo lugar, a densidade de semeadura de APCs durante a etapa de diferenciação terminal para astrócitos é essencial para evitar a inibição célula-célula mediada por contato. Recomenda-se otimizar isso em todas as linhagens celulares para evitar o descolamento da superfície do vaso de cultura.
Aqui, nossos achados são a primeira análise desse tipo em astrócitos humanos, pois todos os estudos anteriores foram baseados em outros tipos de células, como linhagens celulares linfoblastóides e fibroblastos humanos25. O metabolismo energético disfuncional é um ator conhecido na etiologia dos transtornos do espectro do autismo, conforme demonstrado pelo aumento dos níveis de lactato plasmático humano, taxa de consumo de oxigênio significativamente menor nos granulócitos26 e expressão reduzida de genes de fosforilação oxidativa mitocondrial no córtex motor, córtex motor, tálamo e cerebelo anterior de crianças com TEA27. Mudanças semelhantes no metabolismo energético são observadas em distúrbios neurodegenerativos como a doença de Parkinson28 e a doença de Alzheimer29, sugerindo que o aumento da glicólise pode compensar a redução da função funcional30. Estudos futuros são necessários para explorar se mecanismos semelhantes estão em jogo no metabolismo energético disfuncional observado em astrócitos derivados de pacientes com SXF.
Atualmente, a geração de astrócitos específicos do prosencéfalo é uma conquista significativa, mas avanços futuros podem permitir a criação de glia específica da região, como astrócitos corticais / hipocampais. Isso forneceria insights mais profundos sobre os papéis distintos desempenhados por esses astrócitos nas funções cerebrais regionais, plasticidade sináptica e interações neuronal-gliais. A capacidade de gerar esses astrócitos específicos da região pode avançar modelos de neurodesenvolvimento e doenças neurodegenerativas. Em última análise, isso pode levar a estratégias terapêuticas mais precisas direcionadas à disfunção dos astrócitos em regiões específicas do cérebro.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Agradecemos ao Prof. Sumantra Chattarji pelos fundos internos. Agradecemos ao Prof. Gaiti Hasan pelo acesso à configuração de imagem de cálcio, ao Centro Central de Imagens e Fluxo do Centro Nacional de Ciências Biológicas, a Padmanabh Singh e Prangya Hota pela revisão e sugestões, e à equipe do Labmate Asia por sua assistência na realização de ensaios Seahorse XF.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-Thioglycerol | Sigma-Aldrich | M6145 | |
| Accutase solution | Sigma-Aldrich | A6964 | Enzyme cell detachment medium |
| Adenosine 5′-triphosphate magnesium salt | Sigma-Aldrich | A9187 | |
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634010 | |
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240062 | |
| B-27 Supplement (50x), serum-free | ThermoFisher Scientific | 17504044 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Chemically Defined Lipid Concentrate | ThermoFisher Scientific | 11905031 | |
| Collagenase, Type IV, powder | ThermoFisher Scientific | 17104019 | |
| Deoxyribonuclease I | Worthington Biochemical Corporation | LK003170 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D2650 | |
| Dispase II, powder | ThermoFisher Scientific | 17105041 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | |
| FXS1, FXS2 | Coriell Institute of Medical Research | GM07072, GM05848 | FXS patient cells |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | glutamine substitute |
| Ham's F-12 Nutrient Mix | ThermoFisher Scientific | 11765054 | |
| Healthy control cells | Cedars-Sinai Medical Center | ND30625 | healthy control cells |
| Heparin sodium salt from porcine intestinal mucosa | Sigma-Aldrich | H3149 | |
| IMDM | ThermoFisher Scientific | 12440053 | |
| Insulin, human | Roche | 11376497001 | |
| LDN 193189 | Stratech Scientific | S2618-SEL | |
| Leukemia Inhibitory Factor human | Sigma-Aldrich | L5283 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | |
| MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | 11140050 | |
| Mouse FGF-basic (FGF-2/bFGF) Recombinant Protein | Peprotech | 450-33 | |
| Mr. Frosty freezing container | ThermoFisher Scientific | 5100-0001 | cryobox |
| N-2 Supplement (100x) | ThermoFisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Neurobasal Medium | ThermoFisher Scientific | 21103049 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | ThermoFisher Scientific | 377267 | |
| Nunc Cell-Culture Treated 6 well dish | ThermoFisher Scientific | 140675 | |
| Papain Dissociation System | Worthington Biochemical Corporation | LK003150 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Recombinant Human CNTF Protein, CF | R&D Systems | 257-NT-010 | |
| Recombinant Human EGF Protein, CF | R&D Systems | 236-EG-01M | |
| RevitaCell Supplement (100x) | ThermoFisher Scientific | A2644501 | |
| SB431542 | Tocris | 1614 | |
| Seahorse XFe24 Analyzer | Agilent Technologies | ||
| Seahorse XF Cell Mito Stress Test Kit | Agilent Technologies | 103015-100 | |
| Seahorse XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| Tissue Culture Dishes-100 cm | Biostar Lifetech | TCD000100 | |
| Transferrin | Roche | 10652202001 | |
| VWR Razor Blades | VWR International | 55411-050 | |
| Antibodies | |||
| Primary antibody | Company | Catalog number | Dilution |
| Oct4 (C-10) | Santa Cruz Biotechnology | sc-5279 | Dilution: 1:250 Secondary antibody: Goat anti-Mouse IgG, Alexa Fluor 568 |
| Nanog | R & D Systems | AF1997 | Dilution: 1:100 Secondary antibody: Donkey anti-Goat IgG, Alexa Fluor 488 |
| Vimentin | Abcam | Ab5733 | Dilution: 1:500 Secondary antibody: Goat anti-Chicken IgY, Alexa Fluor 488 |
| NFIA | Abcam | Ab41851 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| GFAP-cy3 | Sigma | C9205 | Dilution: 1:500 Secondary antibody: NA |
| GFAP | DAKO | Z0334 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| S100β | DAKO | IR504 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 488 |
| Anti-Nuclei Antibody, clone 235-1 | Merck Millipore | MAB1281 | Dilution: 1:1000 Secondary antibody: Goat anti-Mouse IgG1, Alexa Fluor 555 |
| Secondary antibodies | Dilution | ||
| Goat anti-Mouse IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11004 | 1:1000 |
| Donkey anti-Goat IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11055 | 1:1000 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A11039 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11034 | 1:1000 |
| Goat anti-Mouse IgG1, Alexa Fluor 555 | Thermo Fisher Scientific | A21127 | 1:1000 |
Referências
- Santoro, M. R., Bray, S. M., Warren, S. T. Molecular of fragile X syndrome: A twenty-year perspective. Annu Rev Pathol. 7, 219-245 (2012).
- Wang, H., et al. Developmentally-programmed FMRP expression in oligodendrocytes: A potential role of FMRP in regulating translation in oligodendroglia progenitors. Hum Mol Genet. 13 (1), 79-89 (2004).
- Pacey, L. K. K., Doering, L. C. Developmental expression of FMRP in the astrocyte lineage: Implications for fragile X syndrome. Glia. 55 (15), 1601-1609 (2007).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Allen, N. J., Barres, B. A. Neuroscience: Glia - more than just brain glue. Nature. 457 (7230), 675-677 (2009).
- Khakh, B. S., McCarthy, K. D. Astrocyte calcium signaling: From observations to functions and the challenges therein. Cold Spring Harb Perspect Biol. 7 (4), a020404(2015).
- Allen, N. J., et al. Astrocyte glypicans 4 and 6 promote formation of excitatory synapses via GluA1 AMPA receptors. Nature. 486 (7403), 410-414 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Rothstein, J. D., et al. Knockout of glutamate transporters reveals a major role for astroglial transport in excitotoxicity and clearance of glutamate. Neuron. 16 (3), 675-686 (1996).
- Almad, A., Maragakis, N. J. A stocked toolbox for understanding the role of astrocytes in disease. Nat Rev Neurol. 14 (6), 351-362 (2018).
- Zhang, Y., Barres, B. A. Astrocyte heterogeneity: An underappreciated topic in neurobiology. Curr Opin Neurobiol. 20 (5), 588-594 (2010).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neurosci. 14 (5), 311-321 (2013).
- Bradley, R. A., et al. Regionally specified human pluripotent stem cell-derived astrocytes exhibit different molecular signatures and functional properties. Development. 146 (13), dev170910(2019).
- Das Sharma, S., et al. Astrocytes mediate cell non-autonomous correction of aberrant firing in human FXS neurons. Cell Rep. 42 (4), 112344(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Hu, X., et al. The JAK/STAT signaling pathway: from bench to clinic. Sig Transduct Target Ther. 6, 402(2021).
- Baser, A., et al. Onset of differentiation is post-transcriptionally controlled in adult neural stem cells. Nature. 566 (7742), 100-104 (2019).
- Pal, R., Bhattacharya, A. Modelling protein synthesis as a biomarker in fragile x syndrome patient-derived cells. Brain Sci. 9 (3), 1-12 (2019).
- Gross, C., Bassell, G. J. Excess protein synthesis in FXS patient lymphoblastoid cells can be rescued with a p110β-selective inhibitor. J Mol Med. 18 (3), 336-345 (2012).
- Kumari, D., et al. Identification of fragile X syndrome specific molecular markers in human fibroblasts: A useful model to test the efficacy of therapeutic drugs. Hum Mutat. 35 (12), 1485-1494 (2014).
- Jacquemont, S., et al. Protein synthesis levels are increased in a subset of individuals with fragile X syndrome. Hum Mol Genet. 27 (12), 2039-2051 (2018).
- Bowser, D. N., Khakh, B. S. ATP excites interneurons and astrocytes to increase synaptic inhibition in neuronal networks. J Neurosci. 24 (39), 8606-8620 (2004).
- Schmunk, G., Boubion, B. J., Smith, I. F., Parker, I., Gargus, J. J. Shared functional defect in IP3R-mediated calcium signaling in diverse monogenic autism syndromes. Transl Psychiatry. 5 (9), e643-e710 (2015).
- Peteri, U. K., et al. Generation of the human pluripotent stem-cell-derived astrocyte model with forebrain identity. Brain Sci. 11 (2), 209(2021).
- Alvarez-Mora, M. I., et al. Impaired mitochondrial function and dynamics in the pathogenesis of FXTAS. Mol Neurobiol. 54 (9), 6896-6902 (2017).
- Giulivi, C., et al. Mitochondrial dysfunction in autism. JAMA. 304 (21), 2389-2396 (2010).
- Anitha, A., et al. Brain region-specific altered expression and association of mitochondria-related genes in autism. Mol Autism. 3 (1), 12(2012).
- Teves, J. M. Y., et al. Parkinson's disease skin fibroblasts display signature alterations in growth, redox homeostasis, mitochondrial function, and autophagy. Front Neurosci. 11, 737(2018).
- Yao, J., et al. Mitochondrial bioenergetic deficit precedes Alzheimer's pathology in female mouse model of Alzheimer's disease. Proc Natl Acad Sci USA. 106 (34), 14670-14675 (2009).
- Sonntag, K. C., et al. Late-onset Alzheimer's disease is associated with inherent changes in bioenergetics profiles. Sci Rep. 7 (1), 14038(2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados