Method Article
缺乏脆性 X 信使核糖核蛋白的人诱导多能干细胞来源的星形胶质细胞的产生和表征
摘要
在这里,我们描述了一种促进人诱导多能干细胞分化为功能性前脑特异性星形胶质细胞的方案。这使得研究神经胶质细胞在神经发育障碍(如脆性 X 综合征)发病机制中的作用,以及对其他脑部疾病进行建模。
摘要
脆性 X 综合征 (FXS) 是自闭症谱系障碍和智力障碍的主要遗传原因,已使用啮齿动物模型进行了广泛研究。最近,人类干细胞衍生的模型系统也被用于获得对 FXS 病理生理学的机制见解。然而,这些研究几乎完全集中在神经元上。此外,尽管越来越多的证据表明神经胶质细胞在健康和疾病的神经元功能中起关键作用,但人们对人类星形胶质细胞如何受到 FXS 的影响知之甚少。
因此,在这项研究中,我们成功开发了一种协议,该协议捕获了大脑发育的关键时空里程碑,并与胶质细胞生成过程保持一致。总之,这为研究神经发育障碍提供了一个有用的框架。首先,我们将人诱导的多能干细胞模式化为神经外胚层谱系,具有母亲双重抑制因子对抗 Decapentaplegic (SMAD) 抑制和小分子。随后,我们利用特异性生长因子和细胞因子生成对照 (CTRL) 和 FXS 患者来源的星形胶质细胞祖细胞 (APC)。用睫状神经营养因子(一种分化细胞因子)处理 APC 调节并驱动祖细胞走向星形胶质细胞成熟,产生前脑特异性胶质纤维酸性蛋白表达星形胶质细胞。
我们发现这些星形胶质细胞是功能性的,它们对 ATP 应用的钙反应证明了这一点,并且它们在 FXS 中表现出失调的糖酵解和线粒体代谢。综上所述,这些发现为研究神经发育障碍引起的星形胶质细胞功能改变的细胞自主和非细胞自主后果提供了一个有用的人类来源实验平台。
引言
脆性 X 综合征 (FXS) 是智力障碍和自闭症谱系障碍 (ASD) 的一种常见遗传形式,是由于缺乏由脆性 X 信使核糖核蛋白 1 (FMR1) 基因(OMIM:#300624,https://www.omim.org/entry/300624)产生的脆性 X 信使核糖核蛋白 (FMRP) 引起的。FMRP 在 mRNA 翻译的调节、mRNA 颗粒的形成和转运以及 microRNA 介导的基因表达调节中发挥作用1。因此,FMRP 的缺失不仅影响大脑发育,还影响成人大脑功能。大脑中 FMR1 的 mRNA 转录水平和 FMRP 的免疫染色均显示高神经元表达,同时在神经胶质细胞中也显著表达2。然而,FXS 动物模型中的绝大多数早期研究主要集中在神经元及其功能的畸变上。因此,人们对神经胶质细胞在 FXS3 中的作用知之甚少。传统上被认为是“被动支持”细胞4 ,越来越多的证据表明星形胶质细胞在介导广泛的神经元功能 5,6 中至关重要,包括促进突触发生7、发育中的神经回路的优化 8 和神经递质再循环9。同时,越来越多的证据表明星形胶质细胞在疾病发病机制中的作用,并且许多神经系统疾病与星形胶质细胞功能障碍有关10。
虽然使用 FXS 动物模型的大部分早期工作都集中在识别和验证神经元中用于治疗 FXS 的各种分子靶标,但这些临床前发现并不总是能带来成功的临床结果。此外,最近临床试验的挫折也凸显了对基于人类的模型系统的需求。基于人类干细胞来源的脑细胞的神经系统疾病模型提供了一种强大的策略,可以弥合动物研究的机制见解与患者临床结果的有限成功之间的差距。然而,这些研究中只有少数集中在星形胶质细胞上,而且大部分是起源于脊髓的星形胶质细胞。反过来,鉴于研究表明星形胶质细胞的结构和功能在大脑区域之间有所不同11,12,这与此相关。因此,更好地了解人类星形胶质细胞疾病诱导的变化还需要考虑到星形胶质细胞的这些大脑区域特异性差异。然而,使用前脑特异性的人类干细胞衍生星形胶质细胞的神经发育障碍模型仍然相对未得到充分探索13。因此,为了开始解决这些差距,我们描述了从携带 FXS 突变的患者来源的诱导多能干细胞 (iPSC) 生成前脑特异性星形胶质细胞的方案;此外,我们表明星形胶质细胞具有功能并表现出改变的新陈代谢。
研究方案
所有使用人诱导多能干细胞 (hiPSC) 的实验(表 1)均在获得适当的机构监管批准后进行。 图 1A 表示 hiPSC 到成熟前脑特异性星形胶质细胞的完全分化方案。
1. hiPSC 的维持和扩增
- 在接种 iPSC 前一天,在 Advanced Dulbecco 改良的 Eagle 培养基/Ham's F-12 (DMEM/F12) 中涂覆 1:60 稀释的基质胶(细胞外基质 [ECM])的 6 孔培养皿中,并储存在 2-8 °C。
注:避免在 2-8 °C 下存放 Matrigel 包被的培养皿 >5 天,因为这可能会导致 ECM 中的蛋白质随着时间的推移而降解。为避免培养皿干燥,请在 6 孔培养皿的每孔中涂上至少 1 mL 的 1:60 稀释的 Matrigel,并均匀地涂抹在培养皿中。如果当天使用,请将板保存在 37 °C 和 5% CO2 的加湿培养箱中 1 小时。 - 在培养 hiPSC 的当天,去除涂层材料,加入 1 mL 完全 Essential 8 培养基(含 Essential 8 补充剂的 E8 基础培养基)以及终浓度为 1x 的 ROCK 抑制剂,并将培养皿保存在 37 °C 和 5% CO2 培养箱中,然后再添加 hiPSC。
- 将 hiPSC 重悬于完全 E8 培养基中,并以 1x 终浓度的 ROCK 抑制剂重悬,以更好地粘附菌落。
注意:请勿制备大量培养基。最多准备 3-4 天,并在 2-8 °C 下储存。 - 第二天,补充不含 ROCK 抑制剂的 E8 完全培养基,直到细胞达到 80% 汇合(大约 4-5 天)。
- 当它们达到 80% 汇合时,用酶法分离菌落。
- 要传代 iPSC,请从培养皿中取出用过的培养基,并以 1:1 的比例每孔添加 1 mL 预热 (37 °C) 胶原酶 (2 mg/mL) 和分散酶 (1 mg/mL) 混合物,并在 37 °C 下孵育 20-30 分钟以上,以使 iPSC 集落提升。
注意:不要将培养皿在 37 °C 下放置超过 20-30 分钟;超过这段时间,菌落会解体,细胞会死亡。
- 要传代 iPSC,请从培养皿中取出用过的培养基,并以 1:1 的比例每孔添加 1 mL 预热 (37 °C) 胶原酶 (2 mg/mL) 和分散酶 (1 mg/mL) 混合物,并在 37 °C 下孵育 20-30 分钟以上,以使 iPSC 集落提升。
- 当菌落开始隆起时,从培养箱中取出培养皿,加入 2 mL Dulbecco 磷酸盐缓冲盐水 (DPBS) 来中和酶活性。
- 用 DPBS 刮掉菌落,并使用大口径 10 mL 血清移液管将悬浮液收集在 15 mL 锥形管中。
- 使用 10 mL 血清移液管轻轻研磨悬浮液 2-3 次以打碎菌落,并让菌落沉淀。
注意:不要将菌落制成单个细胞;这可能导致细胞不粘附在培养皿上并导致更多细胞死亡。此外,不要将它们作为大群落;这将导致以后出现更多分化的菌落。 - 一旦菌落沉淀下来(大约 2 分钟后),吸出 DPBS 酶混合物,在试管中留下大约 1 mL。
- 向试管中加入 2 mL DPBS,敲击混合菌落,并让它们沉淀。重复此作 2 次以去除菌落中的所有残留酶。第 2 次 洗涤后,尽可能多地去除上清液,将菌落重悬于 1 mL 完全 E8 培养基中,然后按照步骤 1.2-1.3 中的说明接种在新鲜制备的培养皿中。
- 或者,使用 10% 二甲基亚砜 (DMSO) 作为冷冻保护剂溶液冷冻保存一部分菌落,以备将来扩增和使用。
- 通过将 90% 完全 E8 培养基和 10% DMSO 作为冷冻保护剂溶液混合来新鲜制备冷冻保存培养基,并将其置于 2-8 °C 直至使用。
- 要冷冻保存,请按照步骤 1.5-1.10作。
- 在步骤 1.10 中,第 2 次 洗涤后,让菌落沉淀并去除上清液。向菌落中加入 1 mL 新鲜制备的冷冻存培养基,然后转移至冻存管中。
注:将冻存培养基添加到菌落中后,将内容物快速转移到冻存管中。延迟可能会导致较低的复苏率,因为 DMSO 是一种会损害细胞的冷冻保护剂。 - 立即将冻存管移至冻存盒中,并在 -80 °C 冰箱中保存过夜。
- 第二天,将所有冻存管移至液氮罐(LN2 罐)中以备将来使用。
注意:对于任何异常,应使用 G 带(补充图 S1)对 hiPSC 进行常规核型分析,使用免疫细胞化学表征多能性(图 1B),并检测支原体。- 为了使用免疫细胞化学表征 hiPSC,将菌落接种在 1:60 基质胶包被、高压灭菌的 13 mm 玻璃盖玻片上。一旦它们达到 40% 汇合,用 PBS-T(PBS-0.1% 吐温 20)洗涤细胞,用 4% 多聚甲醛固定 10 分钟,用 PBS 中的 0.3% Triton X-100 透化 10 分钟,然后用 PBS 中的 3% 牛血清白蛋白 (BSA) 封闭 1 小时以防止非特异性结合。
- 封闭后,将培养物与一抗孵育 1 小时,然后用 PBS-T 洗涤 3 次,每次 5 分钟,然后相应的二抗(材料表)在黑暗中孵育 1 小时。
- 将盖玻片安装在带有安装介质的载玻片上,并通过 405 nm、488 nm、561 nm 和 633 nm 的共聚焦激光扫描获取图像。以 512 x 512 像素拍摄图像;将 Z 步长设置为 0.5 μm,针孔直径为 1 个艾里单位。
2. 星形胶质细胞祖细胞 (APC) 的产生和表征
- 如步骤 1.5-1.10 中所述,酶促提升 hiPSC,并将它们接种到非粘附悬浮培养皿 (100 mm) 上,化学定义的培养基14 含有 50% Iscove 改良的 Dulbecco 培养基 (IMDM)、50% 火腿的 F-12 营养混合物 (F12)、5 mg/mL BSA、1% 化学定义的脂质浓缩物 (CD-Lipid)、450 μM 单硫甘油、7 μg/mL 胰岛素、15 μg/mL 转铁蛋白、 1% 青霉素-链霉素补充前脑模式有丝分裂原 N-乙酰半胱氨酸 (1 mM)、LDN 193189 (0.1 μM) 和 SB431542 (10 μM),持续 7 天。
注:小分子抑制剂 SB431542 和 LDN-193189 (LDN) 是骨形态发生蛋白和转化生长因子-β 信号通路的抑制剂。
从那时起,培养基每 2 天补充一次或按照周一/周三/周五方案进行补充。 - 在常氧条件下,将细胞悬液以 40 rpm 的转速放在轨道振荡器上 7 天,以帮助皮质球的发育(图 1A)。
- 第 8 天,将皮质球转移到含有 Advanced DMEM/F12 和 1% 抗生素-抗真菌剂、1% N2 补充剂、1% 谷氨酰胺替代品、0.1% B27 补充剂和 2.5 ng/mL 碱性成纤维细胞生长因子 (bFGF) 的细胞增殖培养基中,持续 7 天。
- 通过将它们置于含有 1% 抗生素抗真菌剂、1% N2、1% 谷氨酰胺替代品、0.1% B27 补充剂的高级 DMEM/F12 的高级 DMEM/F12 的神经胶质浓缩培养基中,诱导球体的神经胶质规格,20 ng/mL 表皮生长因子 (EGF)、bFGF-H(20 ng/mL bFGF-5 mg/mL 肝素)2 周以获得早期胶质球(图 1A)。
- 对于早期胶质球的成熟,用 20 ng/mL 白血病抑制因子 (LIF) 代替 bFGF-H,并将球体维持 4 周。
- 在成熟培养基中 4 周后,将球体长时间保持在神经胶质浓缩培养基中。为防止聚集和活力损失,每 2 周使用无菌工业刀片机械切碎胶质球,并用 DNase I 替换整个培养基,以去除切碎产生的 DNA 片段。
- 使用木瓜蛋白酶解离试剂盒将胶质球解离成单层 APC,并接种到细胞培养物处理的贴壁培养皿上,以 1:80 稀释度稀释的基质胶涂层。
- 在神经胶质细胞富集培养基中繁殖 APC,直到 80% 汇合,并使用酶细胞分离培养基进行酶促传代(参见 材料表)。
- 段落:
- 取出用过的培养基并收集在锥形管中。向细胞中加入酶细胞分离培养基并等待 1-2 分钟。一旦细胞开始分离,加入用过的培养基以中和酶活性。
- 收集细胞悬液并以 800 x ɡ 离心 2 分钟。
- 吸出上清液,将细胞重悬于神经胶质浓缩培养基中,然后将大约 1 x 106 个细胞/孔接种到 1:80 基质胶包被的 6 孔培养皿中。
- 对于冷冻保存:
- 将细胞重悬于 90% 皮质球增殖培养基(不含 bFGF)和 10% 冷冻保护剂的冷混合物中。将重悬的细胞转移到冻存管中。
- 立即将冻存管移至冻存箱中,并在 -80 °C 冰箱中保存过夜。
- 第二天,将所有冻存管移至液氮罐(LN2 罐)中以备将来使用。
注:使用 10% DMSO 冷冻保存 APC 直至第 6 次传代。
- 通过用波形蛋白和核因子 IA (NFIA) 标记物(如图 1C、D)进行免疫染色(如步骤 1.15.1-1.15.3 中所述)来表征解离的 APC(稀释度见 材料表 )。
- 为了确认 hiPSC 衍生的 APC 的前脑区域特异性,使用实时 qPCR 测试细胞的前脑标志物,例如人叉头盒 G1 (hFOXG1)(阳性)和后脑标志物,例如人同源盒 B4 (hHOXB4)(阴性)(图 1E,F)。
注:用于这些实验的引物序列已列于 补充表 S1 中。
3. 前脑特异性星形胶质细胞同质种群的产生和表征
- 星形胶质细胞与 APC 的分化
- 使用星形胶质细胞分化培养基 (ADM) 14 天,将 APC 分化为星形胶质细胞。星形胶质细胞分化培养基含有 Neurobasal、1% 抗生素-抗真菌剂、1% 谷氨酰胺替代品、1% N2 补充剂、0.2% B27 补充剂、1% 非必需氨基酸培养基 (NEAA) 和 10 ng/mL 睫状神经营养因子 (CNTF)。
- 通过使用免疫染色(如步骤 1.15.1-1.15.3 中所述)和神经胶质纤维酸性蛋白 (GFAP) 和 S100β 表达标记物(图 2A、B)来确认星形胶质细胞的身份。
- APC 和星形胶质细胞中的从头蛋白质合成
- 将 hiPSC 衍生的前脑 APC 和星形胶质细胞维持在无菌高压灭菌的 13 mm 玻璃盖玻片上,并按照步骤 1.15.1-1.15.3 中的说明对其进行免疫染色。
- 对于 从头 蛋白质合成,使用荧光非经典氨基酸标记 (FUNCAT) 方法,在步骤 3.2.3-3.2.6 中简要解释(图 3A)。
- 为确保蛋氨酸缺乏,从培养物中取出生长培养基,并更换为不含蛋氨酸和半胱氨酸的培养基,该培养基与 1 mM L-叠氮基高丙氨酸 (AHA) 混合,在 37 °C 和 5% CO2 下混合 30 分钟。
- 用 PBS-T 洗涤培养物,用 4% 多聚甲醛固定 10 分钟,用 0.3% Triton X-100 在 PBS 中透化 10 分钟,然后用 3% BSA 在 PBS 中封闭 1 小时以防止非特异性结合。
- 将培养物在室温下与 Click 细胞化学反应混合物和炔烃 Alexa Fluor 647 在黑暗中孵育 1 小时,然后用一抗孵育 1 小时,用相应的二抗(材料表)孵育 1 小时(图 3B)。
- 将盖玻片安装在带有安装介质的载玻片上,并使用它们进行进一步的图像分析。
- 通过 405 nm、488 nm、561 nm 和 633nm 的共聚焦激光扫描获取图像。
- 以 512 x 512 像素拍摄图像;将 Z 步长设置为 0.5 μm,针孔直径为 1 个艾里单位。
- 将显微镜和成像参数保持在不同细胞类型的恒定设置。在同一会话中捕获每个生物复制的图像。
- 使用任何标准图像分析软件(例如 Fiji 或 Imaris)进行强度测量。在 Imaris 中,使用 SURFACES 模块产生细胞体的体积测量,其中 Vimentin (APCs) 和 GFAP(星形胶质细胞)限制体素范围 (250-350) 以去除碎片。
注:保持两种细胞类型的所有生物学重复的参数。
- 腺苷 5′-三磷酸 (ATP) 诱导的振荡钙波
- 将星形胶质细胞以 5 × 103 个细胞 /皿的浓度接种在玻璃底培养皿 (35 mm) 上,以测量细胞对 ATP 的反应。
- 让细胞粘附在玻璃底部 24 小时,用不含钙的 HBSS(20 mM HEPES、137 mM NaCl、5 mM KCl、10 mM 葡萄糖、1 mM MgCl2,pH = 7.3)洗涤 3 次,并在培养基中与 5 μM 比率的公制染料 Fura-2AM 和 0.02% Pluronics F127 在室温下孵育 1 小时。
注:Fura-2AM 是一种对光和温度敏感的化学品;储存在 -20 °C。 - 孵育后,用培养基洗涤 2 次,并替换为含有 HBSS 的 2 mM Ca2+ ,并在焦点漂移补偿倒置显微镜中使用 60 倍油物镜 (1.35 NA) 以 2 FPS 的速度对细胞进行成像。
- 通过在第 25秒 时以 5 mM 的终浓度 ATP 浸泡来记录 ATP 诱导的钙反应(图 4A)。
- 使用 Fiji/ImageJ 在每个细胞周围绘制感兴趣的区域,并计算所有时间点的 F 340 / F380 比率(图 4B)。
- 细胞代谢检测
注意:根据制造商的方案测量活细胞的耗氧率 (OCR) 和细胞外酸化率 (ECAR)(参见 材料表)。- 测定前一天,让星形胶质细胞粘附在 CNTF 培养基中的微孔板(1.5 × 104 接种密度)上,并在 37 °C 和 5% CO2 下孵育。
- 对于糖酵解应激测定:
- 用补充有 2 mM 谷氨酰胺(pH 调节至 7.4)的基础培养基替换细胞培养基,并在 37 °C 的非 CO2 室中孵育 1 小时。
注意:必须在 37 °C 水浴中调节 pH 值。 - 将卡板插入仪器以校准传感器。校准后,用终浓度为以下试剂盒组分的细胞培养板更换卡盒板:10 mM 葡萄糖、1 μM 寡霉素和 50 mM 2-脱氧葡萄糖 (2-DG)(图 5A)。
- 在测试结束时,裂解细胞并估计总蛋白含量。
- 用补充有 2 mM 谷氨酰胺(pH 调节至 7.4)的基础培养基替换细胞培养基,并在 37 °C 的非 CO2 室中孵育 1 小时。
- 对于线粒体应激测定:
- 在 37 °C 的水浴中,用补充有 2 mM 谷氨酰胺、1 mM 丙酮酸、10 mM 葡萄糖(pH 调节至 7.4)的基础培养基替换 CNTF 培养基。
- 将板在 37 °C 的非 CO2 室中孵育 1 小时。同时,将卡板插入仪器以校准传感器。
- 校准后,用终浓度为以下试剂盒组分的细胞培养板更换卡板:1.5 μM 寡霉素、1 μM 羰基氰化物-4(三氟甲氧基)苯腙 (FCCP) 和 0.5 μM 鱼藤酮/抗霉素 A(图 5C)。
- 在测试结束时,裂解细胞并估计总蛋白含量。
结果
使用市售的成分明确的培养基维持人诱导多能干细胞 (hiPSC) 集落,并对多能性标志物 Oct4 和 Nanog 进行免疫染色(图 1B)。FXS 和 CTRL APC 显示对 vimentin 和 NFIA 免疫阳性的细胞具有相当的高度富集比例(图 1C、D)。我们发现,与 HOXB4 相比,来自健康和 FXS hiPSCs 的 APC 显示 FOXG1 的显着上调(图 1F),与主要的前脑身份一致。我们观察到与 CTRL 星形胶质细胞相比,FXS 组中表达 GFAP 的星形胶质细胞的数量显着减少,而不会影响表达 S100β 的星形胶质细胞的数量(图 2B)。Western blot 分析显示,由两个 FXS 系产生的星形胶质细胞均缺乏 FMRP 的表达(图 2C,D)。新合成蛋白质的定量未显示 APC 或星形胶质细胞中 CTRL 与 FXS 系之间有任何显着差异(图 3C)。然而,我们发现 APC 中的蛋白质合成始终高于每系各自的星形胶质细胞(图 3C)。这些结果表明,在 FXS 和 CTRL 系中,从 APC 到星形胶质细胞的从头蛋白质合成存在阶段特异性减少。
对照以及 FXS 星形胶质细胞表现出 ATP 诱导的钙瞬变(图 4A)。然而,更详细的分析揭示了 CTRL、FXS1 和 FXS2 星形胶质细胞记录的单个钙瞬变之间的几个关键差异(图 4B)。我们分别根据钙反应的存在与否将星形胶质细胞分为对 ATP 的反应者和无反应者(图 4C)。FXS1 和 FXS2 中的反应者数量显着低于 CTRL。具体来说,我们在两种 FXS 星形胶质细胞系中观察到 ATP 应用后诱发的第一次钙瞬变的峰值振幅显着降低(图 4D)。此外,FXS1 和 FXS2 线中第一次钙瞬变的总持续时间明显短于 CTRL 中(图 4E)。然而,钙事件的数量(量化为每 250 秒的事件总数;图 4F) 在不同品系之间具有可比性。综上所述,这些发现揭示了 ATP 在 hiPSC 衍生的 FXS 星形胶质细胞中引发的钙反应的改变。ECAR 结果表明,hiPSC 衍生的 FXS 星形胶质细胞具有更高的糖酵解速率、糖酵解能力和糖酵解储备(图 5A,B)。我们发现 CTRL 和 FXS 星形胶质细胞的基础呼吸没有显着差异。细胞 ATP 产生显示 CTRL 和 FXS 星形胶质细胞之间没有显着差异。FCCP 刺激在 FXS 星形胶质细胞中引起的最大呼吸作用显着低于 CTRL 星形胶质细胞(图 5C,D)。
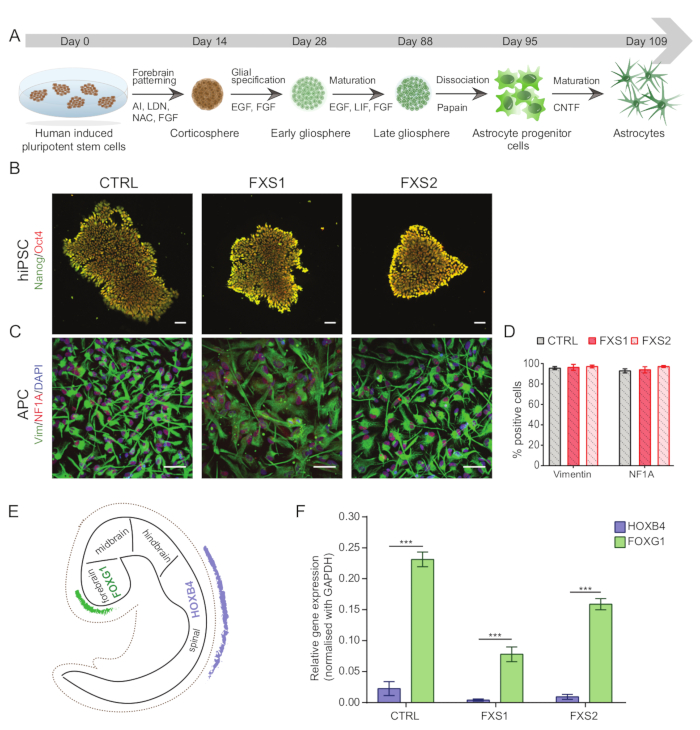
图 1:从 hiPSC 衍生前脑特异性星形胶质细胞祖细胞。(A) 从 hiPSC 生成星形胶质细胞的说明性工作流程。(B) hiPSC 的代表性图像,在 CTRL 和 FXS 系中显示 Oct4/Nanog 的可比表达。(C) hiPSC 衍生的 APC 的同质群体表达相似数量的波形蛋白和 NFIA 阳性细胞。(D) 波形蛋白和 NFIA 在 CTRL 和 FXS APC 中的表达无显著差异。使用双因素方差分析进行统计分析,然后进行 Tukey 成对比较。(E) 说明体内发育过程中 FOXG1 和 HOXB4 的区域特异性表达示意图。(F) 不同基因型的 FOXG1 表达与 HOXB4 (使用 qRT-PCR) 相比的图形表示,表明前脑谱系的倾向。通过双因素方差分析进行统计分析,然后进行 Sidak 的多重比较检验。对于所有实验,N = 3 个生物学重复。p < 0.001。比例尺 = 50 μm。误差线代表 SEM。缩写:hiPSCs = 人诱导多能干细胞;Ctrl = 控制;FXS = 脆性 X 综合征;APCs = 星形胶质细胞祖细胞。请单击此处查看此图的较大版本。
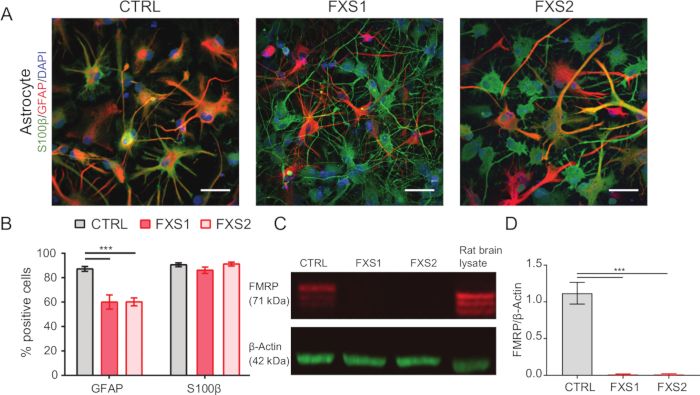
图 2:胶质纤维酸性蛋白阳性 hiPSC 衍生的 FXS 星形胶质细胞数量减少。 (A) 显示 S100β 和 GFAP 表达的 hiPSC 衍生星形胶质细胞的代表性图像。(B) 与 CTRL 相比,FXS 来源的星形胶质细胞中 GFAP 阳性星形胶质细胞的百分比显着降低,尽管两者表现出相似的 S100β 表达。由双因素方差分析确定的统计显着性,然后是 Tukey 的成对比较。(C) 代表 CTRL 和 FXS 星形胶质细胞中 FMRP 表达的免疫印迹。(D) 显示 hiPSC 衍生的 FXS 星形胶质细胞中不存在 FMRP 的图表。通过单因素方差分析和 Tukey 成对比较进行统计分析。对于上述所有实验,N = 3 个生物学重复。比例尺 = 50 μm。***p < 0.001。误差线代表 SEM。缩写:hiPSCs = 人诱导多能干细胞;Ctrl = 控制;FXS = 脆性 X 综合征;GFAP = 神经胶质纤维酸性蛋白;FMRP = 脆性 X 信使核糖核蛋白。 请单击此处查看此图的较大版本。
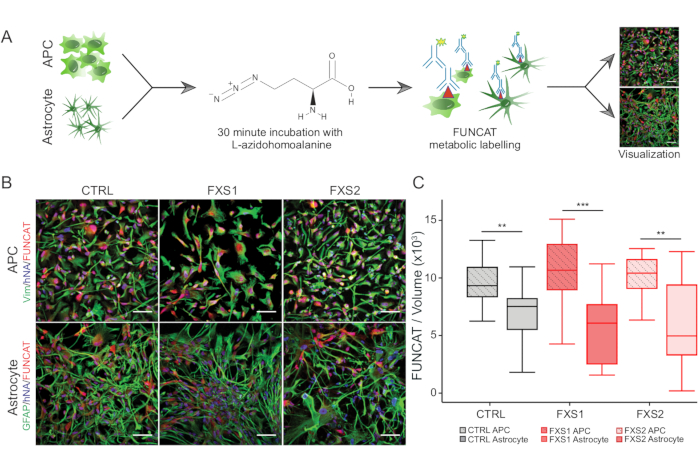
图 3:由于从 APC 分化为星形胶质细胞而导致蛋白质合成减少。 (A) 使用 FUNCAT 代谢标记描述 hiPSC 衍生的 APC 和星形胶质细胞中蛋白质合成的标记和可视化的工作流程示意图。(B) 在 CTRL 和 FXS 衍生的细胞中(上)波形蛋白阳性 hiPSC 衍生的 APC 和(下)带有 FUNCAT/人细胞核抗体 (hNA) 标记的 GFAP 阳性星形胶质细胞的代表性图像。(C) hiPSC 衍生的 APCs 的 FUNCAT/体积显著高于相应的衍生星形胶质细胞。对于所有实验,N = 3 个生物学重复。比例尺 = 50 μm。**p < 0.01,***p < 0.001。晶须代表 1.5 × IQR。缩写:hiPSCs = 人诱导多能干细胞;Ctrl = 控制;FXS = 脆性 X 综合征;GFAP = 神经胶质纤维酸性蛋白;FUNCAT = 荧光非经典氨基酸标记。 请单击此处查看此图的较大版本。
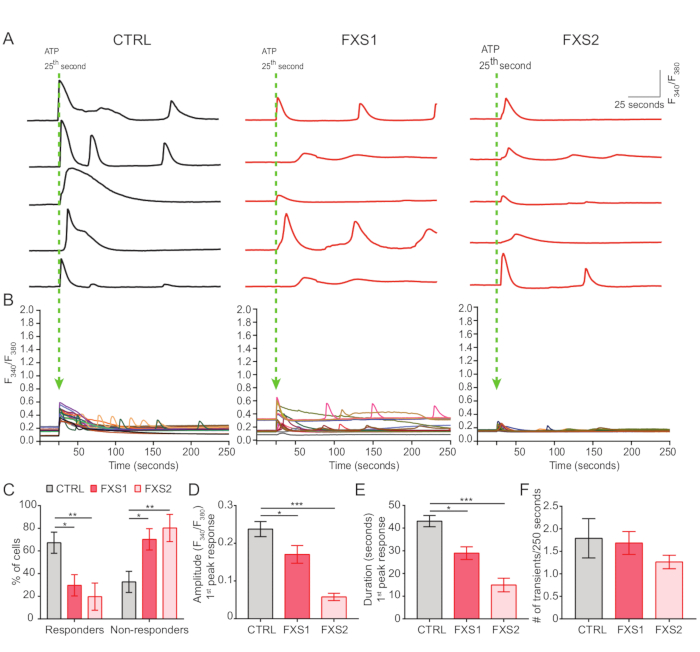
图 4:hiPSC 衍生的 FXS 星形胶质细胞中 ATP 诱发的 Ca2+ 信号传导缺陷。(A) 在 25秒外施 ATP 后从单个星形胶质细胞记录的 Ca2+ 瞬变的代表性痕迹。(B) 平均 F340/F380 比率,描绘了 ATP 应用后 250 秒内的 Ca2+ 瞬变。(C) 分组数据显示 hiPSC 衍生的 FXS 星形胶质细胞中对 ATP 无反应的比例较高。由双因素方差分析和 Tukey 成对比较确定的统计显着性。(D-F)量化第一个峰值响应(振幅和持续时间)和事件频率。(D) 显示振幅显着降低。通过单因素方差分析与 Tukey 成对比较和 (E) hiPSC 衍生的 FXS 星形胶质细胞的持续时间确定统计显着性。由 Kruskal-Wallis 检验和 Dunn 多重比较检验确定的统计显着性;数据集表示为 SEM 的平均值。(F) hiPSC 衍生的 FXS 星形胶质细胞中 Ca2+ 瞬时频率的图形表示。通过单因素方差分析和 Tukey 成对比较进行统计分析。对于所有实验 N = 3 个生物学重复;每个细胞系 n = 19 个细胞。*p < 0.05,**p < 0.01,***p < 0.001。误差线表示 SEM。# = 数字。缩写:hiPSCs = 人诱导多能干细胞;Ctrl = 控制;FXS = 脆性 X 综合征;GFAP = 神经胶质纤维酸性蛋白。请单击此处查看此图的较大版本。
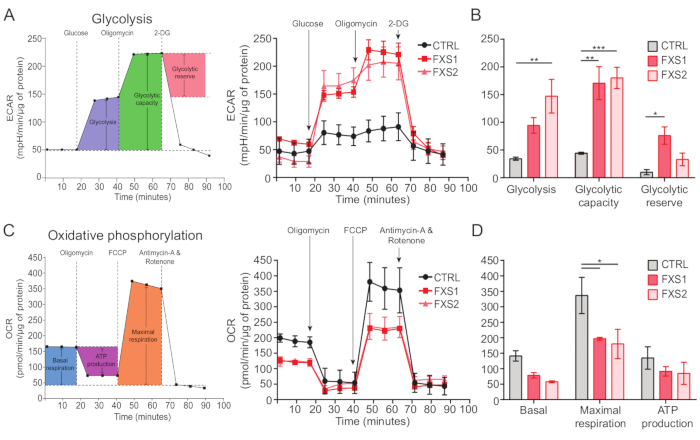
图 5:hiPSC 衍生的 FXS 星形胶质细胞中的生物能量缺陷。 (A) 依次加入 10 mM 葡萄糖、1 μM 寡霉素和 50 mM 2-DG 后 hiPSC 衍生的星形胶质细胞(CTRL 和 FXS)的细胞外酸化率的线图,并绘制在线形图上。(B) 糖酵解、糖酵解能力和糖酵解储备定量显示 hiPSC 衍生的 FXS 星形胶质细胞增加。通过双因素方差分析和 Tukey 成对比较进行统计分析。(C) 线图描述了连续添加 1.5 μM 寡霉素、1 μM FCCP 和 0.5 μM 抗霉素 A 和鱼藤酮时测得的耗氧量。(D) 从线图中量化基础呼吸、最大呼吸和 ATP 产生,与 CTRL 星形胶质细胞相比,hiPSC 衍生的 FXS 星形胶质细胞显示最大呼吸量显着降低。通过双因素方差分析和 Tukey 成对比较进行统计分析。对于所有实验,N = 2 个生物学重复。*p < 0.05,**p < 0.01,***p < 0.001。误差线代表 SEM。缩写:hiPSCs = 人诱导多能干细胞;Ctrl = 控制;FXS = 脆性 X 综合征;ECAR = 细胞外酸化率;2-DG = 2-脱氧葡萄糖;OCR = 耗氧率;FCCP = 羰基氰化物-4(三氟甲氧基)苯腙。 请单击此处查看此图的较大版本。
| 手稿中的 ID | 源的 ID | 年龄 | 性 | 重编程细胞系名称 | 重编程方法 | 起始细胞类型 | G 波段核型 |
| (年) | |||||||
| Ctrl 键 | ND30625 | 76 | M | CS25iCTR-18nxx | 游离向量 | 成纤维细胞 | 正常 |
| FXS1 系列 | GM07072 | 22 | M | CS072iFXS-n4 | 游离向量 | 成纤维细胞 | 正常 |
| FXS2 系列 | GM05848 | 4 | M | CS848iFXS-n5 | 游离向量 | 成纤维细胞 | 正常 |
表 1:本研究中用于生成前脑特异性星形胶质细胞的细胞系。
补充图 S1:染色体分析报告。(A) CTRL 46, XY, (B) FXS1 46, XY 和 (C) FXS2 46, XY 的正常 GTG 条带核型。请点击此处下载此图表。
补充表 S1:本研究中用于细胞表征的引物。 请点击此处下载此表格。
讨论
在这里,我们描述了一种生成人 iPSC 衍生的星形胶质细胞的方法,该方法用作表征 FXS 诱导的功能变化的检测平台。这些星形胶质细胞在培养中具有功能活力并表现出各种特性,本研究中进行的一系列测量证明了这一点。该方案中的一个关键步骤是使用酶促提升方法将 iPSC 初始转化为皮质球。在此阶段,优化 IV 型胶原酶和分散酶的孵育时间至关重要。如果不进行优化,可能会导致 iPSC 崩解或形成单细胞,从而阻止皮质球的形成。这些皮质球使用双重 SMAD 抑制15 向前脑特异性模式化,并进一步分化为星形胶质细胞祖细胞 (APC)。为了实现高 APC 数量,胶质球的机械切碎至关重要。实时 qPCR 可用于确认前脑特异性;我们观察到 FOXG1(前脑标志物)与脊髓标志物 HOXB4 相比,倍数变化显著增加。
然后使用 CNTF(JAK-STAT 信号通路的激活剂16)将 APC 分化为星形胶质细胞。这项研究的结果表明,源自 FXS iPSCs 的终末分化星形胶质细胞具有较低的 GFAP 水平,这表明成熟度受损。尽管我们的分析未发现与对照相比,FXS 星形胶质细胞和 APC 的从头蛋白质合成有任何差异,但我们发现在 FXS 和对照系中,从 APC 到星形胶质细胞的转变中,从头蛋白质合成减少。APC 和星形胶质细胞之间翻译的显着降低与神经元与神经前体细胞的更简化和精心策划的翻译一致17。检查异常蛋白质合成的早期工作利用了全脑组织、神经元和患者来源的成纤维细胞,而不是星形胶质细胞或 APC18。唯一已发表的关于患者来源细胞系蛋白质合成的报道不是在星形胶质细胞中,而是来自淋巴母细胞样细胞19 和成纤维细胞20,21。鉴于研究之间的这些差异,未来的研究将受益于在来自其他 FXS 患者来源系的星形胶质细胞中使用 FUNCAT 测量。
我们通过测量细胞内钙动力学22 和生物能量学来评估星形胶质细胞的功能。FXS 星形胶质细胞显示 ATP 诱导的钙瞬变的峰值振幅和持续时间降低,与对照星形胶质细胞相比,对 ATP 有反应的细胞较少。总之,这些改变表明 FXS 破坏了人类星形胶质细胞中的钙稳态。这些结果与早期研究23,24 一致,该研究报道了 FXS 成纤维细胞中 IP3 受体活性受损。此外,我们观察到 FXS 星形胶质细胞的糖酵解、糖酵解能力和糖酵解储备增加,同时线粒体耗氧率降低。
本研究描述了通过利用患者来源的 iPSC 的力量生成和表征 FXS 星形胶质细胞的新 体外 模型。值得注意的是,只有通过使用与人类神经元共培养的人类星形胶质细胞的早期研究,我们才发现了星形胶质细胞在决定神经元电生理表型方面的关键作用14。然而,这些研究几乎完全集中在疾病诱导的神经元活动变化上,没有在星形胶质细胞中进行任何探索。在这里,该协议提供了一个新的框架,将我们的注意力转移到星形胶质细胞的功能改变上。反过来,这将阐明以前未探索的星形胶质细胞-神经元相互作用,例如谷氨酸信号传导和电反应。我们在这个阶段的结果强调了在未来研究中优先考虑星形胶质细胞的必要性。
认识到此协议的局限性至关重要。首先,它涉及机械切碎,这也会导致 DNA 片段化。这会导致切碎的胶质球结块,最终导致细胞死亡。其次,在终末分化为星形胶质细胞的步骤中,APC 的接种密度对于防止接触介导的细胞间抑制至关重要。建议跨细胞系对此进行优化,以防止从培养容器表面脱落。
在这里,我们的发现是首次对人类星形胶质细胞进行此类分析,因为过去的所有研究都是基于其他细胞类型,例如淋巴母细胞样细胞系和人类成纤维细胞25。功能失调的能量代谢是自闭症谱系障碍病因学的一个已知参与者,表现为人血浆乳酸水平升高,粒细胞耗氧率显着降低26,以及线粒体氧化磷酸化基因在前扣带带回、运动皮层、丘脑和小脑中的表达降低ASD 儿童 27。在帕金森病28 和阿尔茨海默病29 等神经退行性疾病中也观察到类似的能量代谢变化,这表明糖酵解的增加可能会补偿功能下降30。需要进一步的研究来探索在 FXS 患者来源的星形胶质细胞中观察到的功能失调能量代谢中是否存在类似的机制。
目前,产生前脑特异性星形胶质细胞是一项重大成就,但未来的进步可能允许产生区域特异性胶质细胞,例如皮质/海马星形胶质细胞。这将更深入地了解这些星形胶质细胞在区域脑功能、突触可塑性和神经元-神经胶质细胞相互作用中发挥的不同作用。产生这种区域特异性星形胶质细胞的能力可以推进神经发育和神经退行性疾病的模型。最终,这可能会导致针对特定大脑区域的星形胶质细胞功能障碍的更精确的治疗策略。
披露声明
作者没有需要披露的利益冲突。
致谢
我们感谢 Sumantra Chattarji 教授的校内资金。我们感谢 Gaiti Hasan 教授使用钙成像设置,中央成像和流动设施 - 国家生物科学中心,Padmanabh Singh 和 Prangya Hota 的校对和建议,以及 Labmate 亚洲团队在执行 Seahorse XF 分析方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 1-Thioglycerol | Sigma-Aldrich | M6145 | |
| Accutase solution | Sigma-Aldrich | A6964 | Enzyme cell detachment medium |
| Adenosine 5′-triphosphate magnesium salt | Sigma-Aldrich | A9187 | |
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634010 | |
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240062 | |
| B-27 Supplement (50x), serum-free | ThermoFisher Scientific | 17504044 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Chemically Defined Lipid Concentrate | ThermoFisher Scientific | 11905031 | |
| Collagenase, Type IV, powder | ThermoFisher Scientific | 17104019 | |
| Deoxyribonuclease I | Worthington Biochemical Corporation | LK003170 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D2650 | |
| Dispase II, powder | ThermoFisher Scientific | 17105041 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | |
| FXS1, FXS2 | Coriell Institute of Medical Research | GM07072, GM05848 | FXS patient cells |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | glutamine substitute |
| Ham's F-12 Nutrient Mix | ThermoFisher Scientific | 11765054 | |
| Healthy control cells | Cedars-Sinai Medical Center | ND30625 | healthy control cells |
| Heparin sodium salt from porcine intestinal mucosa | Sigma-Aldrich | H3149 | |
| IMDM | ThermoFisher Scientific | 12440053 | |
| Insulin, human | Roche | 11376497001 | |
| LDN 193189 | Stratech Scientific | S2618-SEL | |
| Leukemia Inhibitory Factor human | Sigma-Aldrich | L5283 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | |
| MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | 11140050 | |
| Mouse FGF-basic (FGF-2/bFGF) Recombinant Protein | Peprotech | 450-33 | |
| Mr. Frosty freezing container | ThermoFisher Scientific | 5100-0001 | cryobox |
| N-2 Supplement (100x) | ThermoFisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Neurobasal Medium | ThermoFisher Scientific | 21103049 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | ThermoFisher Scientific | 377267 | |
| Nunc Cell-Culture Treated 6 well dish | ThermoFisher Scientific | 140675 | |
| Papain Dissociation System | Worthington Biochemical Corporation | LK003150 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Recombinant Human CNTF Protein, CF | R&D Systems | 257-NT-010 | |
| Recombinant Human EGF Protein, CF | R&D Systems | 236-EG-01M | |
| RevitaCell Supplement (100x) | ThermoFisher Scientific | A2644501 | |
| SB431542 | Tocris | 1614 | |
| Seahorse XFe24 Analyzer | Agilent Technologies | ||
| Seahorse XF Cell Mito Stress Test Kit | Agilent Technologies | 103015-100 | |
| Seahorse XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| Tissue Culture Dishes-100 cm | Biostar Lifetech | TCD000100 | |
| Transferrin | Roche | 10652202001 | |
| VWR Razor Blades | VWR International | 55411-050 | |
| Antibodies | |||
| Primary antibody | Company | Catalog number | Dilution |
| Oct4 (C-10) | Santa Cruz Biotechnology | sc-5279 | Dilution: 1:250 Secondary antibody: Goat anti-Mouse IgG, Alexa Fluor 568 |
| Nanog | R & D Systems | AF1997 | Dilution: 1:100 Secondary antibody: Donkey anti-Goat IgG, Alexa Fluor 488 |
| Vimentin | Abcam | Ab5733 | Dilution: 1:500 Secondary antibody: Goat anti-Chicken IgY, Alexa Fluor 488 |
| NFIA | Abcam | Ab41851 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| GFAP-cy3 | Sigma | C9205 | Dilution: 1:500 Secondary antibody: NA |
| GFAP | DAKO | Z0334 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| S100β | DAKO | IR504 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 488 |
| Anti-Nuclei Antibody, clone 235-1 | Merck Millipore | MAB1281 | Dilution: 1:1000 Secondary antibody: Goat anti-Mouse IgG1, Alexa Fluor 555 |
| Secondary antibodies | Dilution | ||
| Goat anti-Mouse IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11004 | 1:1000 |
| Donkey anti-Goat IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11055 | 1:1000 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A11039 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11034 | 1:1000 |
| Goat anti-Mouse IgG1, Alexa Fluor 555 | Thermo Fisher Scientific | A21127 | 1:1000 |
参考文献
- Santoro, M. R., Bray, S. M., Warren, S. T. Molecular of fragile X syndrome: A twenty-year perspective. Annu Rev Pathol. 7, 219-245 (2012).
- Wang, H., et al. Developmentally-programmed FMRP expression in oligodendrocytes: A potential role of FMRP in regulating translation in oligodendroglia progenitors. Hum Mol Genet. 13 (1), 79-89 (2004).
- Pacey, L. K. K., Doering, L. C. Developmental expression of FMRP in the astrocyte lineage: Implications for fragile X syndrome. Glia. 55 (15), 1601-1609 (2007).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Allen, N. J., Barres, B. A. Neuroscience: Glia - more than just brain glue. Nature. 457 (7230), 675-677 (2009).
- Khakh, B. S., McCarthy, K. D. Astrocyte calcium signaling: From observations to functions and the challenges therein. Cold Spring Harb Perspect Biol. 7 (4), a020404(2015).
- Allen, N. J., et al. Astrocyte glypicans 4 and 6 promote formation of excitatory synapses via GluA1 AMPA receptors. Nature. 486 (7403), 410-414 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Rothstein, J. D., et al. Knockout of glutamate transporters reveals a major role for astroglial transport in excitotoxicity and clearance of glutamate. Neuron. 16 (3), 675-686 (1996).
- Almad, A., Maragakis, N. J. A stocked toolbox for understanding the role of astrocytes in disease. Nat Rev Neurol. 14 (6), 351-362 (2018).
- Zhang, Y., Barres, B. A. Astrocyte heterogeneity: An underappreciated topic in neurobiology. Curr Opin Neurobiol. 20 (5), 588-594 (2010).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neurosci. 14 (5), 311-321 (2013).
- Bradley, R. A., et al. Regionally specified human pluripotent stem cell-derived astrocytes exhibit different molecular signatures and functional properties. Development. 146 (13), dev170910(2019).
- Das Sharma, S., et al. Astrocytes mediate cell non-autonomous correction of aberrant firing in human FXS neurons. Cell Rep. 42 (4), 112344(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Hu, X., et al. The JAK/STAT signaling pathway: from bench to clinic. Sig Transduct Target Ther. 6, 402(2021).
- Baser, A., et al. Onset of differentiation is post-transcriptionally controlled in adult neural stem cells. Nature. 566 (7742), 100-104 (2019).
- Pal, R., Bhattacharya, A. Modelling protein synthesis as a biomarker in fragile x syndrome patient-derived cells. Brain Sci. 9 (3), 1-12 (2019).
- Gross, C., Bassell, G. J. Excess protein synthesis in FXS patient lymphoblastoid cells can be rescued with a p110β-selective inhibitor. J Mol Med. 18 (3), 336-345 (2012).
- Kumari, D., et al. Identification of fragile X syndrome specific molecular markers in human fibroblasts: A useful model to test the efficacy of therapeutic drugs. Hum Mutat. 35 (12), 1485-1494 (2014).
- Jacquemont, S., et al. Protein synthesis levels are increased in a subset of individuals with fragile X syndrome. Hum Mol Genet. 27 (12), 2039-2051 (2018).
- Bowser, D. N., Khakh, B. S. ATP excites interneurons and astrocytes to increase synaptic inhibition in neuronal networks. J Neurosci. 24 (39), 8606-8620 (2004).
- Schmunk, G., Boubion, B. J., Smith, I. F., Parker, I., Gargus, J. J. Shared functional defect in IP3R-mediated calcium signaling in diverse monogenic autism syndromes. Transl Psychiatry. 5 (9), e643-e710 (2015).
- Peteri, U. K., et al. Generation of the human pluripotent stem-cell-derived astrocyte model with forebrain identity. Brain Sci. 11 (2), 209(2021).
- Alvarez-Mora, M. I., et al. Impaired mitochondrial function and dynamics in the pathogenesis of FXTAS. Mol Neurobiol. 54 (9), 6896-6902 (2017).
- Giulivi, C., et al. Mitochondrial dysfunction in autism. JAMA. 304 (21), 2389-2396 (2010).
- Anitha, A., et al. Brain region-specific altered expression and association of mitochondria-related genes in autism. Mol Autism. 3 (1), 12(2012).
- Teves, J. M. Y., et al. Parkinson's disease skin fibroblasts display signature alterations in growth, redox homeostasis, mitochondrial function, and autophagy. Front Neurosci. 11, 737(2018).
- Yao, J., et al. Mitochondrial bioenergetic deficit precedes Alzheimer's pathology in female mouse model of Alzheimer's disease. Proc Natl Acad Sci USA. 106 (34), 14670-14675 (2009).
- Sonntag, K. C., et al. Late-onset Alzheimer's disease is associated with inherent changes in bioenergetics profiles. Sci Rep. 7 (1), 14038(2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。