Method Article
Радиоэмболизация Y-90 и ингибитор PD-1 в качестве неоадъювантного лечения при гепатоцеллюлярной карциноме
* Эти авторы внесли равный вклад
В этой статье
Резюме
Данное исследование иллюстрирует методологический потенциал сочетания трансартериальной радиоэмболизации иттрия-90 (Y-90 TARE) с моноклональным антителом к PD-1 в качестве эффективной неоадъювантной стратегии, приводящей к гепатэктомии у пациентов с гепатоцеллюлярной карциномой (ГЦК) с высоким риском исходного рецидива. В нем подчеркивается безопасность, осуществимость и пошаговое процедурное руководство этим подходом.
Аннотация
В этом исследовании представлен комплексный протокол лечения пациентов с гепатоцеллюлярной карциномой (ГЦК) высокого риска, в котором основное внимание уделяется комбинированному использованию ингибиторов трансартериальной радиоэмболизации (TARE) Y-90 и ингибиторов программируемой клеточной смерти-1 (PD-1) в качестве неоадъювантной терапии. Выделенный в виде описания клинического случая, он предлагает пошаговый справочник по аналогичным терапевтическим вмешательствам. Проведен ретроспективный анализ пациента, перенесшего гепатэктомию после лечения Y-90 ТАРЕ и ингибиторами PD-1. Ключевые демографические и клинические данные были зарегистрированы при поступлении для выбора терапии. Пригодность и дозировка Y-90 TARE были основаны на тестах на перфузионное картирование макроагрегированного альбумина (МАА) технеция-99m (Tc-99m). Покрытие поражения микросферами Y-90 было подтверждено с помощью однофотонной эмиссионной компьютерной томографии/компьютерной томографии (ОФЭКТ/КТ), а побочные реакции и последующие исходы были тщательно задокументированы. Пациент с ГЦК 7,2 см в правой печеночной доле (T1bN0M0, BCLC A, CNLC Ib) и начальным уровнем альфа-фетопротеина (АФП) 66 840 нг/мл выбрал Y-90 TARE из-за высокого риска рецидива и первоначального отказа от операции. Параметры терапии, включая легочную шунтирующую фракцию (LSF) и неопухолевое соотношение (TNR), находились в терапевтических пределах. Всего было введено 1,36 GBq Y-90. Через 1 месяц после терапии опухоль уменьшилась до 6 см с частичным некрозом, а уровень АФП снизился до 21 155 нг/мл, оставаясь стабильным в течение 3 месяцев. Через 3 месяца лечение ингибиторами PD-1 привело к дальнейшему уменьшению опухоли до 4 см и снижению АФП до 1,84 нг/мл. Затем пациенту была проведена гепатэктомия; гистопатология подтвердила полный некроз опухоли. Через 12 месяцев после операции рецидива опухоли или метастазирования на последующих сеансах не наблюдалось. Этот протокол демонстрирует эффективную комбинацию Y-90 TARE и ингибитора PD-1 в качестве стратегии перехода к хирургическому вмешательству у пациентов с ГЦК с высоким риском рецидива, предоставляя практическое руководство по реализации этого подхода.
Введение
Гепатоцеллюлярная карцинома (ГЦК) составляет 85-90% случаев первичного рака печени во всем мире и является распространенной злокачественной опухолью пищеварительной системы1 . Проблема еще хуже в Китае, где ГЦК занимает4-е место среди наиболее распространенных злокачественных новообразований и вторую по значимости причину смертности, связанной с раком. Эта проблема усугубляется высокой частотой рецидивов после гепатэктомии, наблюдаемой у значительной подгруппы пациентов в течение 2 лет. Эти рецидивы часто развиваются в терапевтически устойчивые и агрессивно злокачественные формы, быстро приводя к летальному исходу. Следовательно, смягчение последствий рецидива после гепатэктомии имеет решающее значение для увеличения выживаемости среди пациентов с ГЦК 4,5.
Неоадъювантная терапия относится к комплексному комплексу процедур, проводимых перед операцией, направленных на увеличение скорости полного удаления опухоли (резекция R0), устранение микрометастатического заболевания, не видимого на визуализации, снижение риска послеоперационного рецидива и продление долгосрочной выживаемости пациента6. Он особенно подходит для пациентов с ГЦК с факторами высокого риска, включая неанатомическую резекцию, микроскопическую сосудистую инвазию, повышенный уровень сывороточного АФП более 32 нг/мл, размеры опухоли более 5 см, множественные опухоли и основной циррозпечени 7. Репертуар неоадъювантной терапии включает в себя различные методы, такие как транскатетерная артериальная химиоэмболизация (TACE), инфузионная химиотерапия печеночной артерии (HAIC) и селективная внутренняя лучевая терапия (SIRT). Они часто сочетаются с таргетной иммунотерапией, применяемой по отдельности или в комбинации8.
Трансартериальная радиоэмболизация иттрия-90 (Y-90 TARE), специализированная форма селективной внутренней лучевой терапии (SIRT), является важным вариантом лечения неоперабельного первичного рака печени и метастазов в печени. Известный своими исключительными показателями локального контроля, Y-90 TARE превосходно доставляет целевые высокие дозы β-излучения непосредственно к месту опухоли, в то время как его ограниченное среднее расстояние проникновения всего 2,5 мм помогает защитить соседние здоровые ткани9. Микросферная селективная внутренняя лучевая терапия иттрием-90 (90Y-SIRT) клинически используется в лечении злокачественных новообразований печени уже более 50 лет, начиная с 1970 года, а широкомасштабное клиническое применение подтверждено более двух десятилетий10. Его безопасность и эффективность были обоснованы с момента его одобрения в Европе и Соединенных Штатах в прошлом веке. Лучевая терапия иттрием-90 проводится во всем мире в течение нескольких десятилетий, что дало обильные клинические данные 11,12,13. Кроме того, иттрий-90, синтетический радиоактивный элемент, занимающий 39-е место в периодической таблице, испускает бета-лучи высокой чистоты с высокой энергией. Он имеет короткий период полувыведения (64,2 часа) и ограниченное расстояние проникновения в ткани, что исключает необходимость изоляции после операции 14,15,16. Кроме того, сосудистые технологии и продукты распада безвредны для организма человека15,17. В то же время, моноклональные антитела против PD-1 омолаживают цитотоксический потенциал иммунных клеток против раковых клеток. В связи с более устойчивыми иммунными профилями, отмеченными у пациентов с ГЦК на ранних стадиях, ингибиторы PD-1 все чаще используются в неоадъювантных условиях. Функционально эти моноклональные антитела PD-1 усиливают иммуногенную гибель клеток, вызванную Y-90 TARE, повышая способность иммунной системы распознавать и уничтожать опухолевые клетки. Механизм Y-90 TARE включает прямое уничтожение опухолевых клеток с помощью β-излучения, которое устраняет гетерогенность опухоли и уклонение от иммунитета, тем самым усиливая воздействие моноклональных антител PD-1. Тем не менее, важно отметить, что на сегодняшний день комплексные исследования по комбинированному использованию ингибиторов Y-90 ТАРЕ и PD-1 в неоадъювантной терапии относительно редки 18,19,20.
Данное тематическое исследование служит практическим руководством, демонстрирующим процесс, безопасность и потенциал Y-90 TARE в сочетании с ингибитором PD-1 в качестве неоадъювантной терапии, приводящей к гепатэктомии. Проводя ретроспективную оценку пациента с ГЦК, получавшего эту неоадъювантную терапию с последующей гепатэктомией, мы подробно описываем терапевтические шаги, управляем нежелательными явлениями и оцениваем исходы. Наши результаты направлены на то, чтобы предоставить клиницистам всестороннюю схему применения терапии ингибиторами Y-90 ТАРЕ и PD-1 при лечении пациентов с ГЦК высокого риска.
ПРЕЗЕНТАЦИЯ КЛИНИЧЕСКОГО СЛУЧАЯ:
Пациент, 49-летний мужчина, имел рост 168 см, вес 62 кг, общий объем печени (VOI) 1236 мл, объем опухоли 157 мл и объем перфузии опухоли-мишени 246 мл. Общий объем легких составил 2124 мл, при этом LSF составил 17,17%, а TNR — 8,2. У него был размер ГЦК 7,2 см в правой печеночной доле (T1bN0M0, BCLC A, CNLC Ib) и начальный уровень альфа-фетопротеина (AFP) 66 840 нг/мл. Предоперационный ECOG-PS (Eastern Cooperative Oncology Group Performance Status) пациента был оценен в 0 баллов. Он не получал никакого фармакологического лечения до того, как выбрал Y-90 TARE, который был выбран из-за высокого риска рецидива и первоначального отказа от операции.
протокол
Процедура лечения была одобрена институциональным наблюдательным советом Первой аффилированной больницы Цзинаньского университета. Информированное согласие было получено от участника, включенного в исследование.
1. Отбор пациентов для неоадъювантной терапии
- Критерии включения
- Отбираются пациенты с поражениями, поддающимися полному хирургическому удалению (резекция R0).
- У отдельных пациентов наблюдаются факторы высокого риска рецидива, включая неанатомическую резекцию, сосудистую инвазию, повышенный уровень сывороточного АФП более 32 нг/мл, размеры опухоли более 5 см, наличие множественных опухолей и основной цирроз печени.
- Критерии исключения
- Исключить пациентов с факторами рецидива высокого риска, которым требуется хирургическое лечение на момент постановки первоначального диагноза. Исключите пациентов, которые не могут позволить себе лечение Y90.
2. Показания к применению Y-90 и оценка дозы
- DSA ангиография для определения опухолевого кровоснабжения
- Попросите пациента лечь лежа на спине во время процедуры. Проведите регулярную дезинфекцию и драпировку. Нанесите 4% раствор лидокаина местно в место пункции бедренной артерии для обезболивания.
- Придерживайтесь рутинных процедур мытья рук, надевайте хирургическую одежду и надевайте стерильные перчатки.
- Введите микропунктурную иглу в правую общую бедренную артерию по методике Сельдингера. После этого следует установка оболочки, подключенной к системе промывки солевым раствором.
- После успешной пункции бедренной артерии и установки катетера (наблюдается ярко-красная артериальная кровь), продвигайте ангиографический катетер к чревному стволу. Если визуализация указывает на наличие сосудов, питающих опухоль, отличных от печеночной артерии, проведите ангиографию верхней брыжеечной артерии, инфрадиафрагмальной артерии и т. д., чтобы выявить любые сосуды, питающие опухоль.
- Проведите ангиографию в начале чревного ствола, чтобы определить, снабжается ли опухоль печени исключительно одиночной ветвью правой печеночной артерии.
- Используйте технику коаксиального микрокатетера для суперселективной катетеризации правой нижней ветви правой печеночной артерии. Проведите ангиографию для подтверждения местонахождения подающего судна.
- Технеций-99m (Tc-99m) Инжекция и визуализация МАА
- Введите 2 мКи Tc-99m MAA через микрокатетер в питающие артерии.
ПРИМЕЧАНИЕ: Эта процедура проводится в соответствии с Рекомендациями Американской ассоциации физиков в медицине по дозиметрии, визуализации и процедурам обеспечения качества для 90Y микросферной брахитерапии при лечении злокачественных новообразований печени. Рекомендуемая дозировка Tc-99m MAA установлена на уровне 2-4 мКи (74-148 МБк)16. Важно отметить, что дозировка Tc-99m MAA фиксирована и не варьируется в зависимости от веса пациента, площади поверхности тела или размера поражения. - Выполнение конусно-лучевой компьютерной томографии (КЛКТ) для определения целевой области опухоли внутрипеченочного распределения Tc-99m MAA. Вручную очертите область на сагиттальной, корональной и аксиальной проекциях во время артериальной фазы.
- Рассчитайте объем целевой области опухоли с помощью опции SEG4 Properties в КЛКТ.
- Введите 2 мКи Tc-99m MAA через микрокатетер в питающие артерии.
- Дозиметрические расчеты микросфер LSF, TNR и Y90
- Настройте параметры режимов сканирования (ОФЭКТ и КТ) на сканере и выполните визуализацию ОФЭКТ/КТ пациента в течение 1-2 часов после инфузии Tc-99m MAA. Выберите функцию Fusion для объединения изображений ОФЭКТ и КТ для определения распределения Tc-99m MAA в печени, легких и других органах.
- Рассчитайте фракцию легочного шунта (LSF) с помощью планарной визуализации.
- Вручную нарисуйте области интереса (ROI), отметив отдельные области в печени и легких, где распределение Tc-99m MAA различимо в передней и задней проекциях печени, правого и левого легких на плоских изображениях. Этот этап выполняет технолог ядерной медицины.
ПРИМЕЧАНИЕ: Фракция легочного шунта (LSF) представляет собой фракцию 99mTc-MAA, которая проходит из печени в оба легких. Используя планарную визуализацию, лаборант ядерной медицины вручную рисует ROI вокруг печени и легких (отдельно для левого и правого легкого) как в передней, так и в задней проекции. Затем с этой рабочей станции получается результат подсчета для каждой детали. - Рассчитайте значения для каждого ROI с помощью стандартной рабочей станции ядерной медицины. Используйте формулу:
Количество легких =

- Рассчитайте LSF по формуле:

- Вручную нарисуйте области интереса (ROI), отметив отдельные области в печени и легких, где распределение Tc-99m MAA различимо в передней и задней проекциях печени, правого и левого легких на плоских изображениях. Этот этап выполняет технолог ядерной медицины.
- Рассчитайте отношение опухоли к нормальной печени (TNR) с помощью трехмерной (3D) сегментации с помощью ОФЭКТ/КТ.
- Вручную нарисуйте дискретные ROI одинакового размера, чтобы охватить как опухолевые, так и нормальные участки печени на основе срезов компьютерной томографии.
- Рассчитайте среднее количество на единицу клетки опухоли над средним количеством на единицу клетки нормальной печени в каждом ROI с помощью рабочей станции.
- Рассчитайте коэффициент TNR с помощью следующей формулы:

- Используйте уравнение модели разбиения в визуализаторе дозы и активности для приложения Y-90 RE (DAVYR) на основе результатов расчетов для получения заданной активности (Gbq) и дозировки (Gy).
3. Лечение Y-90 ТАРА
- Следуйте подходу, описанному в шаге 2, а затем выполните ангиограмму непосредственно на кровоснабжающих артериях, определенных на шаге 2.1.
- Сравните текущее ангиографическое изображение с изображением, полученным на шаге 2, чтобы более точно подтвердить расположение питающих артерий.
- После суперселективной катетеризации катетер следует продвинуть к питающим артериям, а затем ввести микросферы Y90 с уже рассчитанной дозой и активностью в питающие артерии.
- Для Y-90 TARE проведите специализированную ПЭТ/КТ всего тела от грудной клетки до чуть выше таза. Выполняйте ПЭТ-КТ с использованием следующих параметров: от 80 с до 110 с, 120 кВпик, 40 мА, вращение трубки 1 с, коллимация среза 4 мм и скорость слоя 8 мм/с (т. е. шаг, 2).
- Оцените TNR на основе объемного ROI, построенного на изображениях ПЭТ/КТ, а затем сравните его с TNR, полученным на изображениях ОФЭКТ/КТ распределения Tc-99m MAA, чтобы подтвердить распределение Y-90.
- При дозировании и введении микросфер Tc-99m MAA и Y-90 следует надевать соответствующие защитные средства, такие как свинцовые фартуки, щитки для глаз и свинцовые перчатки.
- Не проводите никакого специального лечения после лечения Y-90 TARE и попросите пациентов, получивших лечение Y-90, избегать тесного контакта с другими людьми в течение 7 дней, чтобы свести к минимуму риск облучения.
4. Последовательное лечение ингибиторами PD-1 после терапии Y90
- Наблюдайте стабильность поражения в течение не менее 2 месяцев после лечения Y90. Используйте соответствующие методы визуализации для последовательного мониторинга. Повторно оцените состояние пациента для определения наличия каких-либо факторов высокого риска рецидива.
- При выявлении факторов высокого риска оцените пригодность пациента к иммунотерапии, убедившись в отсутствии противопоказаний. Выберите подходящий ингибитор PD-1, такой как ниволумаб или пембролизумаб, исходя из финансовых соображений пациента.
- Вводите выбранный ингибитор в 1-2 цикла, каждый с интервалом в 21 день. Вводите ингибитор PD-1, приготовленный из 100 мл физиологического раствора в концентрации 2 мг/мл, путем периферического внутривенного введения в течение 1 ч, тем самым завершая один цикл терапии ингибиторами PD-1.
- Оценка после лечения и последующее наблюдение
- После завершения терапии ингибиторами PD-1 были проведены последующие визуализационные исследования и исследования онкомаркеров, идентичные тем, которые использовались до лечения.
- Оцените ежемесячный ответ пациента на терапию ингибиторами PD-1 с использованием стандартных критериев оценки21.
5. Гепатэктомия после Y90 TARE и ингибитора PD-1
- Решение о гепатэктомии: Оцените место лечения с использованием тех же радиологических методов, которые ранее применялись для оценки стабильности поражения в течение как минимум 2 месяцев после терапии ингибиторами PD-1, убедившись в отсутствии факторов высокого риска рецидива.
- Предоперационная подготовка к гепатэктомии: Чтобы точно определить края резекции опухоли и проверить возможные метастатические поражения, введите пациенту зеленый индоцианин за 3 дня до операции.
- Хирургическое вмешательство
- Выполните интубацию трахеи для общего наркоза у пациента, лежачего на спине. Проводят хирургическую дезинфекцию верхней части брюшной полости, распространяясь вверх до линии сосков, ниже до лобкового симфиза и латерально до среднеподмышечной линии.
- При попадании в брюшную полость с помощью лапароскопа проводят тщательный осмотр печени и окружающих структур на предмет каких-либо отклонений или метастатических очагов.
- Поднимите нижнюю границу правой печени с помощью захватов, чтобы обнажить опухоль, расположенную в сегменте 6 (S6) печени.
- После внутривенного введения индоцианина зеленого переключитесь в режим флуоресцентной визуализации, чтобы тщательно оценить степень опухоли, гарантируя отсутствие инвазии в соседние ткани или значительных спаек.
- Рассеките соединительные ткани между нижней границей правой печени, задней брюшиной и правой почкой с помощью гармонического скальпеля. Прогрессирует верхнее рассечение правой треугольной и коронарной связок, обнажая таким образом вторые ворота печени.
- С помощью щипцов утконосы втягивают печень влево, чтобы полностью обнажить правую долю.
- Используйте режим флуоресцентной визуализации, чтобы четко очертить границу между опухолью и прилегающими здоровыми тканями.
- Отметьте направляющие линии резекции примерно в 1-2 см от края опухоли с помощью монополярного крючка для прижигания.
- Временно прервите приток сосудов из воротной вены и печеночной артерии для уменьшения интраоперационного кровотечения. Затягивайте жгуты циклами окклюзии по 15 минут с последующей реперфузией 5 минут.
- Осторожно пересеките паренхиму печени по направляющим линиям гармоническим скальпелем. Скальпелем коагулируют мелкие желчные протоки и сосуды, сначала зажимают, а затем пересекают более крупные структуры.
- После иссечения образца опухоли отправьте его на гистопатологическую оценку.
- Поверхность разреза печени промыть теплым физиологическим раствором с последующим достижением гемостаза с биполярной коагуляцией. Используйте рассасывающийся шовный материал, чтобы закрыть все разрезы. Пациент находился в больнице после операции в течение 10 дней. Для послеоперационного обезболивания введите трамадол внутримышечно.
- Последующее наблюдение после гепатэктомии
- Чтобы своевременно обнаружить любые потенциальные послеоперационные рецидивы или метастатические поражения, ежемесячно проводите контрольные обследования в течение первых 3 месяцев после операции. По истечении этого периода запланируйте осмотры каждые 3 месяца в течение следующих 2 лет, а затем каждые 6 месяцев в течение последующих 3 лет, в общей сложности до 5 лет после операции.
Результаты
В этом исследовании МРТ выявила уменьшение объема печени, волнистую поверхность печени и расширенные печеночные трещины у пациентов. Почти сферическая масса, размером примерно 7,2 см x 5,6 см x 6,6 см, была идентифицирована в правой задней доле печени. Масса демонстрировала смешанные низкие сигналы на T1-взвешенной визуализации (T1WI), смешанные высокие сигналы на T2-взвешенной визуализации (T2WI) и высокие сигналы на диффузионно-взвешенной визуализации (DWI). Он продемонстрировал четкие границы и гетерогенное усиление артериальной фазы, что указывает на возможность цирроза печени и ГЦК (рис. 1).
Во время катетерного маневрирования была проведена ангиографическая оценка для подтверждения отсутствия питающих опухоль сосудов, исходящих из брюшной аорты, диафрагмальных артерий и верхней брыжеечной артерии. На ангиографии в месте зарождения чревного ствола сегментарная ветвь правой печеночной артерии (S6 или правая нижняя ветвь) имела выраженную извитость и расширение. Это наблюдение установило, что опухоль печени получает сосудистое снабжение исключительно от этой единственной артериальной ветви (рис. 2А). Фундаментальная предварительная оценка Y-90 TARE включает в себя картирование тестов с использованием перфузии Tc-99m MAA, использующих сопоставимое распределение доз между микросферами Tc-99m MAA и Y-90. После инъекции Tc-99m МАА была оконтурена зона перфузии для Tc-99m МАА, при этом расчетный объем перфузии для опухоли-мишени составил 246,27 мл (рис. 2A). Пациенты, демонстрирующие LSF более 20%, подвергаются повышенному риску радиационно-индуцированного повреждения легких, что делает их, как правило, неподходящими кандидатами для лечения Y-9022. Повышенный TNR означает более выраженный опухолецидный эффект при соблюдении максимально допустимой дозы облучения печени. Расчетный LSF составил 17,17%, а TNR – 8,2 (рис. 2B).
Модель разделения, по сравнению с методами медицинской внутренней дозы облучения (MIRD) и площади поверхности тела (BSA), обеспечивает превосходную персонализированную оценку дозы облучения за счет учета TNR, что улучшает индивидуализированное планирование лечения. Результаты модели перегородки указывают на дозы облучения в 36,6 Гр для нормальной печени (ниже порога в 40 Гр), 17,6 Гр для легочной ткани (в пределах предела 20 Гр) и пиковую дозу в 300 Гр для опухоли, что обуславливает необходимость активности микросферы Y-90 в размере 1,36 ГБк (рис. 3A). После терапии Y-90 ТАРЕ (Рисунок 3B) была проведена ПЭТ/КТ, которая показала отсутствие отклонений от целевого распространения или расхождений в охвате (Рисунок 3C).
Через 1 месяц после лечения Y-90 ТАРЕ опухоль уменьшилась до 6 см, а уровень АФП снизился до 21 155 нг/мл. Через 3 месяца после лечения опухоль не показала существенных изменений. Учитывая стойкий высокий риск рецидива, было начато лечение ингибитором PD-1. Через 5 месяцев после терапии Y-90 ТАРЕ (через 2 месяца после начала лечения ингибиторами PD-1) поражение еще больше уменьшилось до 4 см, а уровень АФП резко снизился до 1,84 нг/мл (Рисунок 4 и Таблица 1).
Представлены изображения опухоли во время гепатэктомии как в белом свете, так и во флуоресценции (рис. 5А). Образцы опухолей, полученные в результате гепатэктомии, были преобразованы в замороженные срезы при грубой патологии. При микроскопическом исследовании они не обнаружили опухолевых клеток, отложения микросфер Y-90, значительной лимфоцитарной инфильтрации и цирротических изменений в прилегающей нормальной ткани печени23 (рис. 5B). Через 12 месяцев после операции было проведено последующее наблюдение и оценка рецидива, при этом МРТ не показала признаков рецидива или метастазирования (Рисунок 5C).
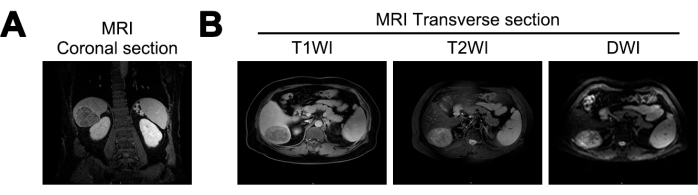
Рисунок 1: Магнитно-резонансная томография (МРТ) при первичной диагностике. (A) корональный срез сигнала МРТ T1 взвешенной визуализации (T1WI), (B) поперечные срезы сигналов МРТ T1WI, T2 взвешенной визуализации (T2WI) и диффузионно-взвешенной визуализации (DWI). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
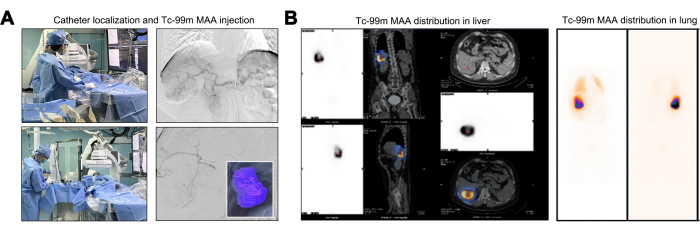
Рисунок 2: Инъекция и распределение макроагрегированного альбумина технеция-99m (Tc-99m MAA). (A) Иллюстрация процесса инжекции макроагрегированного альбумина технеция-99m (Tc-99m MAA). (B) Представление распределения дозы 99mTc MAA в печени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
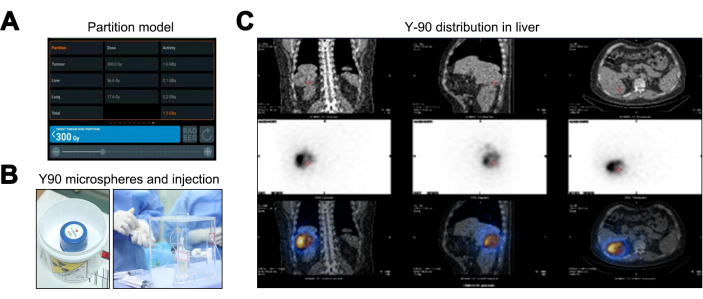
Рисунок 3: Процесс лечения трансартериальной радиоэмболизацией Иттрия-90 (Y-90 TARE). (A) Отображение данных, рассчитанных с использованием модели Partition. (B) Упаковка и инжекция микросфер Y-90. (c) Однофотонная эмиссионная компьютерная томография/компьютерная томография (ОФЭКТ/КТ) для валидации распределения доз микросфер Y-90. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
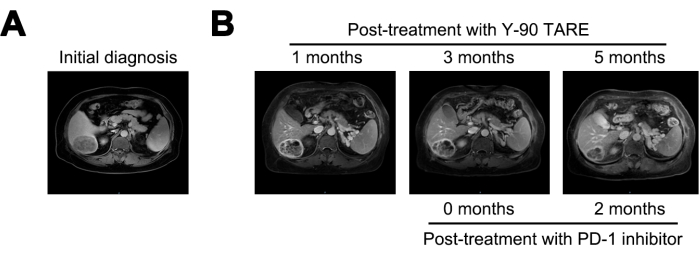
Рисунок 4: Сравнение опухолей. (A) Представление изображения МРТ при первоначальном диагнозе, в то время как (B) отображение изображений МРТ через 1, 3 и 5 месяцев после лечения Y-90 TARE. Лечение ингибиторами программируемой клеточной смерти-1 (PD-1) проводили через 3 месяца после Y-90 TARE. Пациентка проходила лечение ингибитором PD-1 через 3 месяца после процедуры Y-90 TARE. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
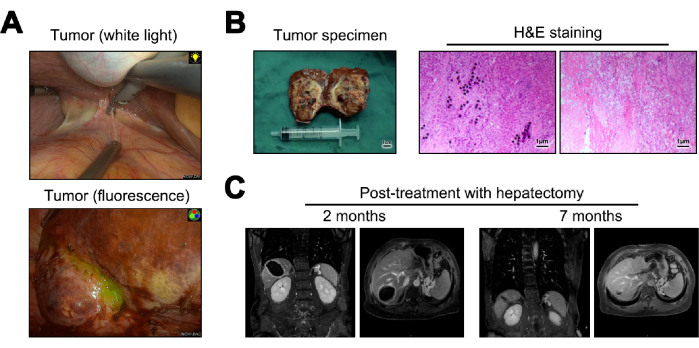
Рисунок 5: Гепатэктомия и последующее наблюдение. (А) Проявление опухоли наблюдается во время операции. (B) Иллюстрация послеоперационного образца опухоли и окрашивания гематоксилином и эозином (H&E). (C) Снимки МРТ через 2 и 12 месяцев после операции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Последующая обработка Y-90 TARE | |||||
| Первичная диагностика | 1 месяц | 3 месяца | 5 месяцев | ||
| АФП (нг/мл) | 66840 | 21155 | 19535 | 1.84 | |
Таблица 1: Измерение уровня АФП после лечения.
Обсуждение
Для пациентов с ГЦК с факторами рецидива высокого риска неблагоприятный прогноз сохраняется даже после лечебной гепатэктомии, что подчеркивает важность эффективной неоадъювантной терапии для повышения выживаемости24,25. По сравнению с интервенционными методами лечения, Y-90 ТАРЕ может похвастаться более высокой частотой местного контроля26. В то время как Y-90 ТАРЕ может активировать противоопухолевый ответ организма22, о совместном использовании Y-90 с ингибиторами PD-1 в неоадъювантной терапии рака печени пока не сообщалось. В данном исследовании ретроспективно рассматривается случай применения неоадъювантного Y-90 TARE с последующим лечением моноклональными антителами к PD-1 у пациента с ГЦК с факторами рецидива высокого риска, достигшего полной ремиссии. В нем представлен подробный протокол лечения для справки.
Несколько ключевых моментов в протоколе данного исследования заслуживают внимания. Во-первых, учитывая потенциал деградации и перераспределения MAA99, визуализацию ОФЭКТ/КТ следует проводить в течение 1-2 часов после инъекции MA99. Во-вторых, крайне важно скрупулезно рассчитывать дозу микросфер Y-90, чтобы не допустить внематочного размещения и чрезмерной дозировки, которые могут привести к поражению печени и легких. Наконец, рассматривая постнеоадъювантную операцию, неанатомическая резекция, обеспечивающая четкие края, может быть предпочтительной для сокращения продолжительности операции и минимизации иммуносупрессии, связанной с операцией.
В настоящем исследовании у пациента наблюдались симптомы нарушений сна и запоров после неоадъювантной терапии. Эти проблемы были устранены с помощью эсзопиклон для лечения расстройств сна и таблетки с кишечнорастворимой оболочкой бисакодила для лечения запоров. Это говорит о том, что побочные реакции, связанные с Y-90 TARE и ингибитором PD-1, минимальны и поддаются фармакологическому контролю. Кроме того, Y-90 TARE и ингибитор PD-1 не вызывали отека ткани печени или поражения, выраженной адгезии или повышенной хрупкости, последнее из которых могло спровоцировать значительное кровотечение или неполную резекцию при последующем хирургическом удалении. Следовательно, Y-90 TARE не мешал и не влиял на последующие хирургические процедуры.
Основываясь на уровнях АФП и изменениях в поражении, мы последовательно вводили терапию моноклональными антителами против PD-1 после Y-90 TARE. Через 5 месяцев поражение достигло патологического полного ответа (pCR), что указывает на то, что время и выбор лечения были подходящими. Корректировка стратегии лечения до наступления среднего периода ответа на Y-90 ТАРЕ может эффективно снизить риск прогрессирования заболевания27. Однако, несмотря на то, что степень разрешения поражения заметно коррелирует с выживаемостью после резекции карциномы печени28, вопрос о том, оправдано ли последующее хирургическое вмешательство в случаях pCR, индуцированных Y-90 TARE, остается предметом дальнейших исследований. Кроме того, оптимальные сроки и дозировка лечения моноклональными антителами Y-90 TARE и анти-PD-1, а также наилучшие сроки и подход к последующему хирургическому вмешательству еще предстоит подтвердить. Кроме того, высокая стоимость всего процесса лечения может ложиться значительным финансовым бременем на пациентов.
Предполагается, что возникновение пПР после лечения Y-90 ТАРЕ и ингибиторами PD-1 в нашем случае коррелирует с несколькими факторами в настоящем исследовании. Первоначально рассматривается доза внутриопухолевого облучения; Для оценки дозы лечения Y-9024 мы использовали традиционную методологию, основанную на Tc-99m MAA (модель разделения). Примечательно, что из-за высокого TNR у пациента доза облучения, проникающая в очаг поражения в данном исследовании, была повышена, при этом микросферы Y-90 полностью покрывали опухоль, тем самым достигая лечебного эффекта. Во-вторых, нельзя упускать из виду значительную инфильтрацию иммунных клеток внутри опухоли, указывающую на ключевую роль противоопухолевого иммунитета пациента в отношении pCR. Учитывая, что это был первоначальный диагноз пациента и опухоль не находилась в запущенной стадии, врожденный противоопухолевый иммунитет сохранялся. После гибели опухолевых клеток, вызванной Y-90 ТАРЕ и ингибитором PD-1, может быть спровоцирована воспалительная реакция, усиливающая воздействие опухолевого антигена, активирующая противоопухолевый иммунитет хозяина и приводящая к инфильтрации иммунных клеток и ее последующему опухолецидномудействию. Кроме того, в нашем предыдущем исследовании была выявлена корреляция между периопухолевым воспалением печени и резистентностью опухоли, что потенциально может усугубить иммунную толерантность печени30,31. Несмотря на то, что цирротические изменения печени присутствовали в периопухолевой ткани пациента в этом исследовании, существенной воспалительной реакции не наблюдалось, и все обследования, связанные с гепатитом В, были ничем не примечательными. Это говорит о том, что иммунное микроокружение печени пациента принадлежит к потенциально модифицируемой подгруппе, для которой Y-90 TARE и ингибитор PD-1 представляют собой важнейшую стратегию в усилении иммунного микроокружения печени.
Внедрение лечения Y-90 TARE требует строгих условий и совместных усилий нескольких отделений, включая ядерную медицину, интервенционную радиологию, гепатобилиарную хирургию, визуализацию и онкологию. Возможность осложнений, вызванных облучением, таких как пневмония, язва желудка и острый панкреатит, подчеркивает необходимость тщательного расчета дозы. Предоперационное моделирование и оценка дозы, проводимая отделением ядерной медицины, могут продлить цикл лечения Y90 TARE, что потенциально может привести к прогрессированию опухоли. Y90 TARE может не подходить для всех видов рака печени, особенно с множественными внутрипеченочными метастазами и диффузным раком или раком печени малого диаметра (<0,5 см), из-за проблем с дифференциацией участков опухоли от нормальной ткани печени, что может привести к неправильной оценке дозы. Сообщения о применении Y90 в сочетании с ингибиторами PD-1 для неоадъювантной терапии при гепатоцеллюлярной карциноме ограничены. По-прежнему необходимы масштабные клинические исследования для обоснования его эффективности и терапевтических деталей.
Таким образом, комбинация Y-90 ТАРЕ и ингибитора PD-1 представляет собой безопасный и эффективный подход к неоадъювантному лечению пациентов с ГЦК. Эта стратегия не только облегчает местную опухолевую нагрузку и сводит к минимуму микрометастазы в максимально возможной степени, но и делает это без увеличения риска прогрессирования заболевания. Следовательно, он обладает потенциалом для продления послеоперационного периода без рецидивов у пациентов. Мы предлагаем воспроизводимый и осуществимый протокол неоадъювантного лечения пациентов с ГЦК высокого риска.
Раскрытие информации
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Это исследование финансировалось Национальным фондом естественных наук Китая (82303287), Фондом фундаментальных и прикладных фундаментальных исследований провинции Гуандун (2021A1515110083), Научно-техническими проектами в Гуанчжоу (202201010267), Фондами фундаментальных исследований для центральных университетов (21621058).
Материалы
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
Ссылки
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены