Method Article
Radioembolização de Y-90 e Inibidor de PD-1 como Tratamento Neoadjuvante no Carcinoma Hepatocelular
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este estudo ilustra o potencial metodológico da combinação de radioembolização transarterial de ítrio-90 (Y-90 TARE) com um anticorpo monoclonal anti-PD-1 como uma estratégia neoadjuvante eficaz que leva à hepatectomia em pacientes com carcinoma hepatocelular (CHC) com alto risco inicial de recorrência. Ele enfatiza a segurança, a viabilidade e a orientação processual passo a passo dessa abordagem.
Resumo
Este estudo apresenta um protocolo de tratamento abrangente para pacientes com carcinoma hepatocelular (CHC) de alto risco, com foco no uso combinado de radioembolização transarterial Y-90 (TARE) e inibidores de Morte Celular Programada-1 (PD-1) como terapia neoadjuvante. Destacado por meio de um relato de caso, oferece uma referência passo a passo para intervenções terapêuticas semelhantes. Uma análise retrospectiva foi realizada em um paciente submetido à hepatectomia após tratamento com inibidores de Y-90 TARE e PD-1. Os principais detalhes demográficos e clínicos foram registrados na admissão para orientar a seleção da terapia. A adequação do Y-90 TARE e o cálculo da dosagem foram baseados em testes de mapeamento de perfusão de albumina macroagregada (MAA) de tecnécio-99m (Tc-99m). A cobertura da lesão por microesferas de Y-90 foi confirmada por meio de imagens de fusão de tomografia computadorizada por emissão de fóton único/tomografia computadorizada (SPECT/CT), e as reações adversas e os resultados de acompanhamento foram meticulosamente documentados. O paciente, com CHC de 7,2 cm no lobo hepático direito (T1bN0M0, BCLC A, CNLC Ib) e nível inicial de alfafetoproteína (AFP) de 66.840 ng/mL, optou pela TARA Y-90 devido ao alto risco de recidiva e recusa inicial da cirurgia. Os parâmetros da terapia, incluindo a fração de derivação pulmonar (LSF) e a razão não tumoral (TNR), estavam dentro dos limites terapêuticos. Um total de 1,36 GBq Y-90 foi administrado. Aos 1 meses após a terapia, o tumor encolheu para 6 cm com necrose parcial, e os níveis de AFP caíram para 21.155 ng/mL, permanecendo estáveis por 3 meses. Após 3 meses, o tratamento com inibidor de PD-1 levou a uma redução adicional do tumor para 4 cm e diminuição da AFP para 1,84 ng/mL. O paciente foi então submetido a hepatectomia; A histopatologia confirmou necrose tumoral completa. Aos 12 meses de pós-operatório, não foi observada recidiva tumoral ou metástase nas sessões de acompanhamento. Este protocolo demonstra a combinação eficaz de Y-90 TARE e inibidor de PD-1 como uma estratégia de ponte para a cirurgia para pacientes com CHC com alto risco de recorrência, fornecendo um guia prático para a implementação dessa abordagem.
Introdução
O carcinoma hepatocelular (CHC) é responsável por 85% a 90% dos casos de câncer primário de fígado em todo o mundo e é um tumor maligno prevalente do sistema digestivo1. O problema é ainda pior na China, onde o CHC é a4ª malignidade mais comum e a segunda principal causa de mortalidade relacionada ao câncer 2,3. Para agravar esse desafio, está a alta taxa de recorrência pós-hepatectomia, observada em um subconjunto significativo de pacientes em 2 anos. Essas recorrências geralmente evoluem para formas terapeuticamente resistentes e agressivamente malignas, levando rapidamente a resultados fatais. Consequentemente, mitigar a recorrência pós-hepatectomia é crucial para estender as taxas de sobrevida entre pacientes com CHC 4,5.
A terapia neoadjuvante refere-se a um conjunto abrangente de tratamentos realizados antes da cirurgia, com o objetivo de aumentar a taxa de remoção completa do tumor (ressecção R0), eliminar a doença micrometastática não visível nos exames de imagem, reduzir o risco de recorrência pós-operatória e prolongar a sobrevida do paciente em longo prazo6. É particularmente apropriada para pacientes com CHC que apresentam fatores de alto risco, incluindo ressecção não anatômica, invasão vascular microscópica, níveis séricos elevados de AFP superiores a 32 ng/mL, dimensões tumorais maiores que 5 cm, tumores múltiplos e cirrose subjacente7. O repertório da terapia neoadjuvante engloba várias técnicas, como quimioembolização arterial transcateter (TACE), quimioterapia de infusão arterial hepática (HAIC) e radioterapia interna seletiva (SIRT). Estes são frequentemente integrados a imunoterapias direcionadas, aplicadas isoladamente ou em combinação8.
A radioembolização transarterial de ítrio-90 (Y-90 TARE), uma forma especializada de radioterapia interna seletiva (SIRT), é uma opção de tratamento significativa para cânceres hepáticos primários inoperáveis e metástases hepáticas. Reconhecido por suas excepcionais taxas de controle local, o Y-90 TARE se destaca por fornecer alta dose direcionada de radiação β diretamente no local do tumor, enquanto sua distância média de penetração limitada de apenas 2,5 mm ajuda a proteger os tecidos saudáveis adjacentes9. A radioterapia interna seletiva de microesferas de ítrio-90 (90Y-SIRT) tem sido utilizada clinicamente no tratamento de neoplasias hepáticas há mais de 50 anos, desde 1970, com aplicação clínica em larga escala confirmada há mais de duas décadas10. Sua segurança e eficácia foram comprovadas desde sua aprovação na Europa e nos Estados Unidos no século anterior. A radioterapia com ítrio-90 é realizada internacionalmente há várias décadas, produzindo dados clínicos abundantes 11,12,13. Além disso, o ítrio-90, um elemento radioativo sintético posicionado em 39º lugar na tabela periódica, emite raios beta de alta pureza com alta energia. Tem meia-vida curta (64,2 horas) e distância de penetração tecidual limitada, eliminando a necessidade de isolamento pós-operatório 14,15,16. Além disso, a tecnologia vascular e os produtos de decomposição são inofensivos para o corpo humano15,17. Ao mesmo tempo, os anticorpos monoclonais anti-PD-1 rejuvenescem o potencial citotóxico das células imunes contra as células cancerígenas. Com perfis imunológicos mais robustos observados em pacientes com CHC em estágio inicial, os inibidores de PD-1 estão sendo cada vez mais aproveitados em ambientes neoadjuvantes. Funcionalmente, esses anticorpos monoclonais PD-1 aumentam a morte celular imunogênica induzida pelo Y-90 TARE, aumentando a capacidade do sistema imunológico de reconhecer e eliminar células tumorais. O mecanismo do Y-90 TARE envolve a destruição direta das células tumorais por meio da radiação β, que aborda a heterogeneidade do tumor e a evasão imunológica, aumentando assim o impacto dos anticorpos monoclonais PD-1. No entanto, é importante notar que, até o momento, estudos abrangentes sobre o uso combinado de inibidores de Y-90 TARE e PD-1 na terapia neoadjuvante são relativamente escassos 18,19,20.
Este estudo de caso serve como um guia prático, demonstrando o processo, a segurança e o potencial do Y-90 TARE combinado com o inibidor de PD-1 como terapia neoadjuvante que leva à hepatectomia. Ao realizar uma avaliação retrospectiva de um paciente com CHC tratado com essa terapia neoadjuvante seguida de hepatectomia, detalhamos as etapas terapêuticas, gerenciamos eventos adversos e avaliamos os resultados. Nossas descobertas visam fornecer um plano abrangente para os médicos na aplicação da terapia com inibidores de Y-90 TARE e PD-1 no tratamento de pacientes com CHC de alto risco.
APRESENTAÇÃO DO CASO:
O paciente, um homem de 49 anos, tinha 168 cm de altura, pesava 62 kg e tinha um volume hepático total (VOI) de 1236 mL, com um volume tumoral de 157 mL e um volume de perfusão tumoral alvo de 246 mL. O volume pulmonar total foi de 2124 mL, com LSF de 17,17% e TNR de 8,2. Ele tinha um CHC de 7,2 cm no lobo hepático direito (T1bN0M0, BCLC A, CNLC Ib) e um nível inicial de alfafetoproteína (AFP) de 66.840 ng/mL. O ECOG-PS (Eastern Cooperative Oncology Group Performance Status) pré-operatório do paciente foi pontuado em 0. Ele não havia recebido nenhum tratamento farmacológico antes de optar pelo Y-90 TARE, que foi escolhido devido ao alto risco de recorrência e recusa inicial da cirurgia.
Protocolo
O procedimento de tratamento foi aprovado pelo conselho de revisão institucional do Primeiro Hospital Afiliado da Universidade de Jinan. O consentimento informado foi obtido do participante incluído no estudo.
1. Seleção de pacientes para terapia neoadjuvante
- Critérios de inclusão
- Selecione pacientes com lesões passíveis de remoção cirúrgica completa (ressecção R0).
- Pacientes selecionados que apresentam fatores de alto risco para recorrência, incluindo ressecção não anatômica, invasão vascular, níveis séricos elevados de AFP superiores a 32 ng/mL, dimensões tumorais maiores que 5 cm, presença de múltiplos tumores e cirrose subjacente.
- Critérios de exclusão
- Exclua pacientes com fatores de recorrência de alto risco que requerem tratamento cirúrgico no momento do diagnóstico inicial. Exclua pacientes incapazes de pagar o tratamento Y90.
2. Indicações do Y-90 e avaliação da dose
- Angiografia DSA para determinar o suprimento sanguíneo tumoral
- Peça ao paciente que fique deitado em decúbito dorsal para o procedimento. Realize desinfecção e drapeamento de rotina. Aplique uma solução de lidocaína a 4% localmente no local da punção da artéria femoral para anestesia.
- Siga os procedimentos rotineiros de lavagem das mãos, vista trajes cirúrgicos e use luvas estéreis.
- Insira uma agulha de micropunção na artéria femoral comum direita usando a técnica de Seldinger. Em seguida, coloque uma bainha conectada a um sistema de descarga salina.
- Assim que a punção da artéria femoral e a colocação do cateter forem bem-sucedidas (sangue arterial vermelho brilhante é observado), avance o cateter angiográfico para o tronco celíaco. Se a imagem sugerir a presença de vasos supridores de tumor além da artéria hepática, realize angiografia na artéria mesentérica superior, na artéria infradiafragmática, etc., para identificar quaisquer vasos que alimentam o tumor.
- Realize angiografia na origem do tronco celíaco para determinar se o tumor hepático é suprido exclusivamente por um ramo solitário da artéria hepática direita.
- Utilize a técnica de microcateter coaxial para cateterismo super seletivo no ramo inferior direito da artéria hepática direita. Realize angiografia para confirmar a localização do vaso supridor.
- Injeção e imagem de Tecnécio-99m (Tc-99m) MAA
- Injete 2 mCi de Tc-99m MAA através do microcateter nas artérias fornecedoras.
NOTA: Este procedimento é conduzido de acordo com as Recomendações da Associação Americana de Físicos em Medicina sobre Dosimetria, Imagem e Procedimentos de Garantia de Qualidade para Braquiterapia de Microesferas 90Y no Tratamento de Malignidades Hepáticas. A dosagem recomendada de Tc-99m MAA é fixada em 2-4 mCi (74-148 MBq)16. É importante observar que a dosagem de Tc-99m MAA é fixa e não varia de acordo com o peso do paciente, a área da superfície corporal ou o tamanho da lesão. - Realize tomografia computadorizada de feixe cônico (CBCT) para delinear a região tumoral alvo da distribuição intra-hepática de Tc-99m MAA. Contorne manualmente a região nas incidências sagital, coronal e axial durante a fase arterial.
- Calcule o volume da região do tumor alvo usando a opção Propriedades SEG4 na TCFC.
- Injete 2 mCi de Tc-99m MAA através do microcateter nas artérias fornecedoras.
- Cálculos de dosimetria de microesferas LSF, TNR e Y90
- Configure os parâmetros dos modos de varredura (SPECT e TC) no scanner e execute imagens SPECT/CT no paciente dentro de 1-2 h após a infusão de Tc-99m MAA. Selecione a função Fusion para amalgamar as imagens SPECT e CT para determinar a distribuição de Tc-99m MAA no fígado, pulmão e outros órgãos.
- Calcule a fração de derivação pulmonar (LSF) usando imagens planares.
- Desenhe manualmente as regiões de interesse (ROIs), marcando as áreas distintas dentro do fígado e pulmões onde a distribuição de Tc-99m MAA é discernível nas vistas anterior e posterior do fígado, pulmão direito e pulmão esquerdo nas imagens planares. Esta etapa é realizada por um tecnólogo em medicina nuclear.
NOTA: A Fração de Shunt Pulmonar (LSF) representa a fração de 99mTc-MAA que se desvia do fígado para ambos os pulmões. Utilizando imagens planares, o tecnólogo em medicina nuclear desenha manualmente ROIs ao redor do fígado e dos pulmões (separadamente para o pulmão esquerdo e direito) nas vistas anterior e posterior. O resultado da contagem para cada peça é então obtido a partir desta estação de trabalho. - Calcule as contagens de cada ROI usando uma estação de trabalho de medicina nuclear padrão. Use a fórmula:
Contagens pulmonares =

- Calcule o LSF usando a equação:

- Desenhe manualmente as regiões de interesse (ROIs), marcando as áreas distintas dentro do fígado e pulmões onde a distribuição de Tc-99m MAA é discernível nas vistas anterior e posterior do fígado, pulmão direito e pulmão esquerdo nas imagens planares. Esta etapa é realizada por um tecnólogo em medicina nuclear.
- Calcule a relação tumor-fígado normal (TNR) usando a aplicação de segmentação tridimensional (3D) de imagens SPECT/CT.
- Desenhe manualmente ROIs discretos do mesmo tamanho para abranger áreas tumorais e hepáticas normais com base nas fatias de tomografia computadorizada.
- Calcule a contagem média por unidade de célula do tumor sobre a contagem média por unidade de célula do fígado normal em cada ROI usando uma estação de trabalho.
- Calcule o índice TNR usando a seguinte equação:

- Use a equação do modelo de partição no visualizador de dose e atividade para a aplicação Y-90 RE (DAVYR) com base nos resultados dos cálculos para obter a atividade prescrita (Gbq) e a dosagem (Gy).
3. Tratamento Y-90 TARE
- Siga a abordagem descrita na etapa 2 e, em seguida, realize uma angiografia diretamente nas artérias fornecedoras de sangue identificadas na etapa 2.1.
- Compare a imagem angiográfica atual com a do passo 2 para confirmar a localização das artérias fornecedoras com mais precisão.
- Avance o cateter para as artérias fornecedoras após o cateterismo super seletivo e, em seguida, injete as microesferas Y90, com a dose e atividade já calculadas, nas artérias fornecedoras.
- Para Y-90 TARE, obtenha exames PET/CT dedicados de corpo inteiro do tórax até logo acima da pelve. Realize o PET-CT usando os seguintes parâmetros: 80 s a 110 s, 120 kVp, 40 mA, rotação do tubo de 1 s, colimação de fatia de 4 mm e velocidade de leito de 8 mm/s (ou seja, passo, 2).
- Avalie o TNR a partir de um ROI de volume extraído nas imagens PET/CT e, em seguida, compare-o com um TNR obtido a partir das imagens SPECT/CT da distribuição Tc-99m MAA para confirmar a distribuição de Y-90.
- Ao dispensar e injetar microesferas Tc-99m MAA e Y-90, use equipamento de proteção adequado, como aventais de chumbo, protetores oculares e luvas de chumbo.
- Não realize nenhum tratamento especial após o tratamento com Y-90 TARE e peça aos pacientes que receberam tratamento com Y-90 que evitem contato próximo com outras pessoas por 7 dias para minimizar o risco de radiação.
4. Tratamento sequencial com inibidor de PD-1 após terapia com Y90
- Observe a estabilidade da lesão por pelo menos 2 meses após o tratamento com Y90. Use modalidades de imagem apropriadas para monitoramento consistente. Reavalie o paciente para determinar a presença de quaisquer fatores de alto risco para recorrência.
- Se forem identificados fatores de alto risco, avalie a adequação do paciente à imunoterapia, garantindo que não haja contraindicações. Selecione um inibidor de PD-1 apropriado, como Nivolumabe ou Pembrolizumabe, com base nas considerações financeiras do paciente.
- Administre o inibidor escolhido em 1-2 ciclos, cada um separado por 21 dias. Administre o inibidor de PD-1, preparado com 100 mL de solução salina fisiológica a 2 mg / mL, por meio de injeção intravenosa periférica ao longo de 1 h, completando assim um ciclo de terapia com inibidores de PD-1.
- Avaliação e acompanhamento pós-tratamento
- Após a conclusão da terapia com inibidores de PD-1, estudos de imagem de acompanhamento e estudos de marcadores tumorais idênticos aos usados antes do tratamento.
- Avalie a resposta mensal do paciente à terapia com inibidores de PD-1 usando critérios de avaliação padrão21.
5. Hepatectomia após Y90 TARE e inibidor de PD-1
- Decisão pela hepatectomia: Avalie o local do tratamento usando as mesmas técnicas radiológicas aplicadas anteriormente para avaliar a estabilidade da lesão por um período mínimo de 2 meses após a terapia com inibidor de PD-1, garantindo que não haja fatores de alto risco para recorrência.
- Preparações pré-operatórias para hepatectomia: Para definir com precisão as margens de ressecção do tumor e inspecionar possíveis lesões metastáticas, administre indocianina verde ao paciente 3 dias antes da cirurgia.
- Procedimento cirúrgico
- Realize a intubação traqueal para anestesia geral no paciente posicionado em decúbito dorsal. Realize a desinfecção cirúrgica da região abdominal superior estendendo-se superiormente à linha do mamilo, inferiormente à sínfise púbica e lateralmente à linha axilar média.
- Ao entrar na cavidade peritoneal, use um laparoscópio para realizar uma inspeção completa do fígado e das estruturas circundantes em busca de anormalidades ou focos metastáticos.
- Eleve a borda inferior do fígado direito com pinças para expor o tumor localizado no segmento 6 (S6) do fígado.
- Depois de injetar indocianina verde por via intravenosa, mude para o modo de imagem de fluorescência para avaliar cuidadosamente a extensão do tumor, garantindo que não haja invasão de tecidos adjacentes ou aderências significativas.
- Disseque os tecidos conjuntivos entre a borda inferior do fígado direito, o peritônio posterior e o rim direito usando um bisturi harmônico. Progresso dissecando superiormente os ligamentos triangular e coronário direitos, expondo assim a segunda porta hepática.
- Usando uma pinça bico de pato para retrair o fígado para a esquerda para expor totalmente o lobo direito.
- Empregue o modo de imagem de fluorescência para delinear claramente a margem entre o tumor e o tecido saudável adjacente.
- Marque as linhas guia de ressecção a aproximadamente 1-2 cm da margem do tumor usando um gancho de cautério monopolar.
- Interrompa temporariamente o influxo vascular da veia porta e da artéria hepática para reduzir o sangramento intraoperatório. Aperte os torniquetes em ciclos de 15 min de oclusão seguidos de 5 min de reperfusão.
- Tranque-o cuidadosamente Coagule pequenos ductos biliares e vasos com o bisturi, prenda primeiro e depois transeccione estruturas maiores.
- Após a excisão da amostra tumoral, envie-a para avaliação histopatológica.
- Enxágue a superfície de corte hepática com solução salina normal quente, seguida de hemostasia com coagulação bipolar. Use sutura absorvível para fechar todas as incisões. O paciente teve internação hospitalar pós-operatória de 10 dias. Para o controle da dor pós-cirúrgica, administre Tramadol por injeção intramuscular.
- Acompanhamento pós-hepatectomia
- Para detectar prontamente qualquer possível recorrência pós-operatória ou lesões metastáticas, realize exames de acompanhamento mensalmente durante os primeiros 3 meses após a cirurgia. Após esse período, agende exames a cada 3 meses pelos próximos 2 anos e depois a cada 6 meses pelos 3 anos subsequentes, até um total de 5 anos após a cirurgia.
Resultados
A ressonância magnética revelou uma redução no volume hepático, uma superfície ondulada do fígado e fissuras hepáticas alargadas dos pacientes neste estudo. Uma massa quase esférica, medindo aproximadamente 7,2 cm x 5,6 cm x 6,6 cm, foi identificada no lobo posterior direito do fígado. A massa exibiu sinais baixos mistos na imagem ponderada em T1 (T1WI), sinais altos mistos na imagem ponderada em T2 (T2WI) e sinais altos na imagem ponderada em difusão (DWI). Exibia limites claros e realce heterogêneo da fase arterial, sugerindo a possibilidade de cirrose hepática e CHC (Figura 1).
Durante a manobra do cateter, foi realizada avaliação angiográfica para confirmar a ausência de vasos alimentadores de tumor originados da aorta abdominal, artérias diafragmáticas e artéria mesentérica superior. Na angiografia de origem do tronco celíaco, o ramo segmentar da artéria hepática direita (S6 ou ramo inferior direito) exibia tortuosidade e dilatação acentuadas. Essa observação estabeleceu que o tumor hepático recebia suprimento vascular exclusivamente desse ramo arterial singular (Figura 2A). Uma pré-avaliação fundamental para o Y-90 TARE envolve testes de mapeamento usando perfusão de Tc-99m MAA, explorando a distribuição de dose comparável entre as microesferas de Tc-99m MAA e Y-90. Após a injeção de MAA de Tc-99m, a zona de perfusão para MAA de Tc-99m foi delineada, com o volume de perfusão calculado para o tumor alvo sendo de 246,27 mL (Figura 2A). Pacientes que demonstram um LSF maior que 20% apresentam um risco aumentado de dano pulmonar induzido por radiação, tornando-os candidatos tipicamente inadequados para o tratamento com Y-9022. Um TNR aumentado significa um efeito tumoricida mais potente enquanto adere à dose máxima permitida de radiação hepática. O LSF calculado ficou em 17,17% e o TNR foi registrado em 8,2 (Figura 2B).
O modelo de partição, em comparação com os métodos de Dose de Radiação Interna Médica (MIRD) e Área de Superfície Corporal (BSA), fornece estimativa de dose de radiação personalizada superior, levando em consideração o TNR, aprimorando o planejamento de tratamento individualizado. Os resultados do modelo de partição indicam doses de radiação de 36,6 Gy para o fígado normal (abaixo do limite de 40 Gy), 17,6 Gy para o tecido pulmonar (dentro do limite de 20 Gy) e uma dose máxima de 300 Gy para o tumor, necessitando de uma atividade da microesfera Y-90 de 1,36 GBq (Figura 3A). Após a terapia com Y-90 TARE (Figura 3B), uma PET / CT foi realizada, indicando que não havia discrepâncias de propagação ou cobertura fora do alvo (Figura 3C).
Aos 1 meses após o tratamento com Y-90 TARE, o tumor foi reduzido para 6 cm e o nível de AFP diminuiu para 21.155 ng/mL. Aos 3 meses após o tratamento, o tumor não apresentou alterações significativas. Dado o alto risco persistente de recorrência, o tratamento com um inibidor de PD-1 foi iniciado. Aos 5 meses após a terapia com Y-90 TARE (2 meses após o início do tratamento com inibidor de PD-1), a lesão reduziu ainda mais para 4 cm e o nível de AFP diminuiu drasticamente para 1,84 ng/mL (Figura 4 e Tabela 1).
Imagens do tumor durante a hepatectomia sob luz branca e fluorescência são apresentadas (Figura 5A). Os espécimes tumorais obtidos da hepatectomia foram transformados em cortes congelados para patologia macroscópica. Quando examinados microscopicamente, eles não revelaram células tumorais, deposição de microesferas de Y-90, infiltração linfocítica significativa e alterações cirróticas no tecido hepático normal adjacente23 (Figura 5B). Aos 12 meses de pós-operatório, foram realizados acompanhamento e avaliação de recidiva, com ressonância magnética indicando ausência de evidência de recidiva ou metástase (Figura 5C).
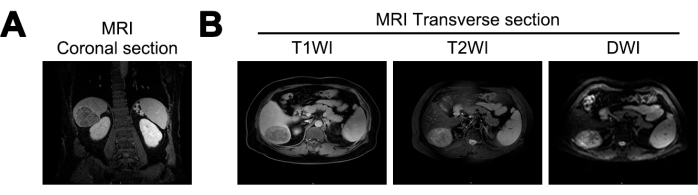
Figura 1: Imagem de ressonância magnética (MRI) no diagnóstico inicial. (A) Seção coronal do sinal de ressonância magnética T1 Weighted Imaging (T1WI), (B) seções transversais dos sinais de ressonância magnética T1WI, T2 Weighted Imaging (T2WI) e Diffusion Weighted Imaging (DWI). Clique aqui para ver uma versão maior desta figura.
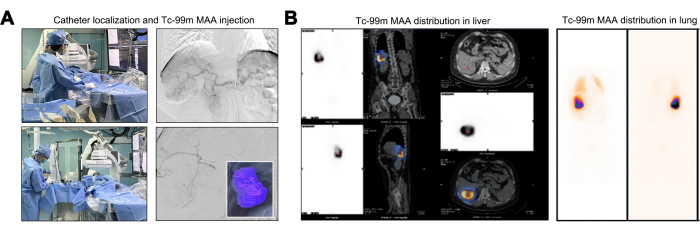
Figura 2: Injeção e distribuição de albumina macroagregada de tecnécio-99m (Tc-99m MAA). (A) Ilustração do processo de injeção de albumina macroagregada de tecnécio-99m (Tc-99m MAA). (B) Apresentação da distribuição de dose de 99mTc MAA no fígado. Clique aqui para ver uma versão maior desta figura.
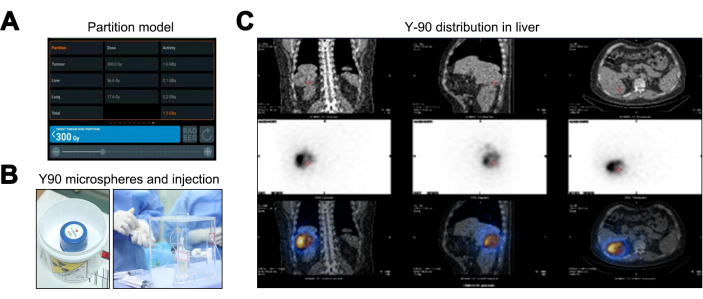
Figura 3: Processo de tratamento de radioembolização transarterial de ítrio-90 (Y-90 TARE). (A) Representação dos dados calculados usando o modelo de partição. (B) A embalagem e injeção das microesferas Y-90. (C) Tomografia Computadorizada por Emissão de Fóton Único/Tomografia Computadorizada (SPECT/CT) para validar a distribuição de dosagem das microesferas de Y-90. Clique aqui para ver uma versão maior desta figura.
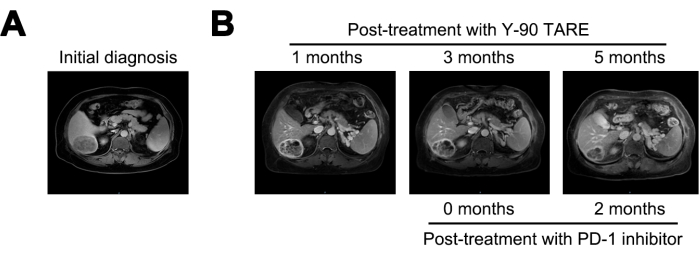
Figura 4: Comparação do tumor. (A) Apresentação da imagem de ressonância magnética no diagnóstico inicial, enquanto (B) exibe as imagens de ressonância magnética 1, 3 e 5 meses após o tratamento com Y-90 TARE. O tratamento com inibidor de Morte Celular Programada-1 (PD-1) foi realizado 3 meses após o Y-90 TARE. O paciente foi submetido a tratamento com inibidor de PD-1 3 meses após o procedimento de Y-90 TARE. Clique aqui para ver uma versão maior desta figura.
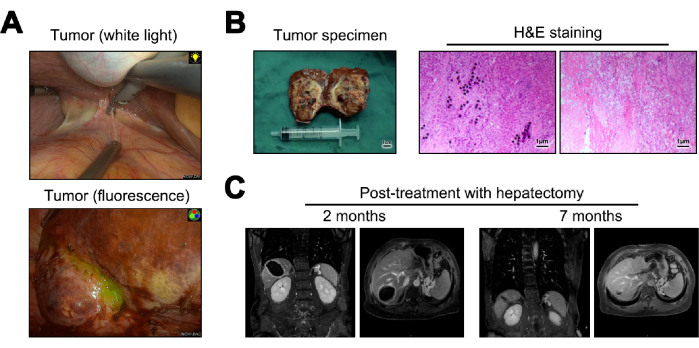
Figura 5: Hepatectomia e seguimento posterior. (A) Apresentação do tumor observado no intraoperatório. (B) Ilustração da amostra do tumor pós-operatório e coloração de hematoxilina e eosina (H&E). (C) Imagens de ressonância magnética 2 e 12 meses após a cirurgia. Clique aqui para ver uma versão maior desta figura.
| Pós-tratamento com Y-90 TARE | |||||
| Diagnóstico inicial | 1 mês | 3 meses | 5 meses | ||
| AFP (ng/mL) | 66840 | 21155 | 19535 | 1.84 | |
Tabela 1: Medição do nível de AFP pós-tratamento.
Discussão
Para pacientes com CHC que apresentam fatores de recorrência de alto risco, um prognóstico adverso persiste mesmo após a hepatectomia curativa, ressaltando a importância da terapia neoadjuvante eficaz para aumentar as taxas de sobrevida24,25. Em relação aos tratamentos intervencionistas, o Y-90 TARE possui uma taxa de controle local superior26. Embora o Y-90 TARE possa ativar a resposta antitumoral do organismo22, o uso combinado de Y-90 com inibidores de PD-1 na terapia neoadjuvante para câncer de fígado ainda não foi relatado. Este estudo revisa retrospectivamente um caso de TARE neoadjuvante Y-90 seguido de tratamento com anticorpo monoclonal anti-PD-1 em um paciente com CHC com fatores de recorrência de alto risco que alcançou remissão completa. Apresenta um protocolo de tratamento detalhado para referência.
Vários pontos-chave no protocolo deste estudo merecem atenção. Em primeiro lugar, dado o potencial de degradação e redistribuição do MAA99, a imagem SPECT / CT deve ser realizada dentro de 1-2 h após a injeção de MA99. Em segundo lugar, é imperativo calcular meticulosamente a dose das microesferas de Y-90 para evitar a colocação ectópica e a dosagem excessiva, que podem levar a danos hepáticos e pulmonares. Finalmente, considerando a cirurgia pós-neoadjuvante, uma ressecção não anatômica garantindo margens claras pode ser preferível para encurtar a duração da cirurgia e minimizar a imunossupressão relacionada à cirurgia.
No presente estudo, o paciente apresentou sintomas de distúrbios do sono e constipação após terapia neoadjuvante. Estes foram abordados usando eszopiclona para distúrbios do sono e comprimidos com revestimento entérico de bisacodil para constipação. Isso sugere que as reações adversas relacionadas ao inibidor de Y-90 TARE e PD-1 são mínimas e podem ser tratadas farmacologicamente. Além disso, o inibidor de Y-90 TARE e PD-1 não induziu edema de tecido hepático ou lesão, adesão grave ou aumento da fragilidade, o último dos quais poderia precipitar sangramento significativo ou ressecção incompleta durante a remoção cirúrgica subsequente. Consequentemente, o Y-90 TARE não interferiu ou impactou os procedimentos cirúrgicos subsequentes.
Com base nos níveis de AFP e nas alterações na lesão, administramos sequencialmente terapia com anticorpos monoclonais anti-PD-1 após o Y-90 TARE. Após 5 meses, a lesão alcançou uma resposta patológica completa (pCR), indicando que o momento e a escolha do tratamento foram adequados. Ajustar a estratégia de tratamento antes do período médio de resposta no Y-90 TARE pode efetivamente reduzir o risco de progressão da doença27. No entanto, embora o grau de resolução da lesão esteja visivelmente correlacionado com a sobrevida pós-ressecção do carcinoma hepático28, se a intervenção cirúrgica subsequente é necessária para casos de pCR induzida por Y-90 TARE permanece um assunto para investigação adicional. Além disso, o momento e a dosagem ideais do tratamento com anticorpos monoclonais Y-90 TARE e anti-PD-1, bem como o melhor momento e abordagem para a cirurgia subsequente, ainda precisam ser validados. Além disso, o alto custo de todo o processo de tratamento pode impor um ônus financeiro significativo aos pacientes.
A ocorrência de uma pCR após o tratamento com inibidores de Y-90 TARE e PD-1 em nosso caso é postulada como correlacionada com vários fatores no presente estudo. Inicialmente, considera-se a dose de radiação intratumoral; empregamos uma metodologia convencional baseada no MAA Tc-99m (modelo de partição) para avaliar a dose de tratamento com Y-9024. Notavelmente, devido ao alto TNR do paciente, a dose de radiação que permeia a lesão neste estudo foi elevada, com microesferas de Y-90 cobrindo o tumor de forma abrangente, obtendo assim um efeito curativo. Em segundo lugar, a infiltração significativa de células imunes dentro do tumor, indicando um papel fundamental da imunidade antitumoral do paciente em relação à pCR, não pode ser negligenciada. Considerando que esse era o diagnóstico inicial do paciente e o tumor não estava em estágio avançado, a imunidade antitumoral intrínseca persistiu. Após a morte das células tumorais induzida pelo inibidor de Y-90 TARE e PD-1, uma resposta inflamatória pode ser desencadeada, aumentando a exposição ao antígeno tumoral, ativando a imunidade antitumoral do hospedeiro e culminando na infiltração de células imunes e sua conseqüente ação tumoricida29. Além disso, nossa pesquisa anterior discerniu uma correlação entre inflamação hepática peritumoral e resistência tumoral, o que poderia potencialmente exacerbar a tolerância imunológica hepática30,31. Embora alterações cirróticas hepáticas estivessem presentes no tecido peritumoral do paciente deste estudo, nenhuma resposta inflamatória significativa foi observada, e todos os exames relacionados à hepatite B foram normais. Isso sugere que o microambiente imunológico hepático do paciente pertence a um subgrupo potencialmente modificável, para o qual o inibidor de Y-90 TARE e PD-1 representa uma estratégia crucial para melhorar o microambiente imunológico hepático.
A implementação do tratamento Y-90 TARE requer condições rigorosas e esforços colaborativos em vários departamentos, incluindo medicina nuclear, radiologia intervencionista, cirurgia hepatobiliar, imagem e oncologia. O potencial de complicações induzidas por radiação, como pneumonia, úlceras gástricas e pancreatite aguda, ressalta a necessidade de cálculos meticulosos de doses. Avaliações de simulação pré-operatória e estimativas de dose conduzidas pelo departamento de medicina nuclear podem estender o ciclo de tratamento Y90 TARE, potencialmente levando à progressão do tumor. O Y90 TARE pode não ser adequado para todos os cancros do fígado, particularmente aqueles com múltiplas metástases intra-hepáticas e cancros do fígado difusos ou de pequeno diâmetro (<0,5 cm), devido a desafios na diferenciação de áreas tumorais do tecido hepático normal, o que pode levar a uma estimativa incorreta da dose. Os relatos sobre o uso de Y90 em conjunto com inibidores de PD-1 para terapia neoadjuvante no carcinoma hepatocelular são limitados. Estudos clínicos em larga escala ainda são necessários para comprovar sua eficácia e detalhes terapêuticos.
Em resumo, a combinação de Y-90 TARE e um inibidor de PD-1 apresenta uma abordagem segura e eficaz para o tratamento neoadjuvante de pacientes com CHC. Essa estratégia não apenas alivia a carga tumoral local e minimiza as micrometástases na maior extensão possível, mas também o faz sem aumentar o risco de progressão da doença. Consequentemente, tem o potencial de estender o período pós-operatório livre de recidiva para os pacientes. Oferecemos um protocolo replicável e viável para o tratamento neoadjuvante de pacientes com CHC de alto risco.
Divulgações
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Este estudo foi financiado pela Fundação Nacional de Ciências Naturais da China (82303287), Fundação de Pesquisa Básica e Aplicada de Guangdong (2021A1515110083), Projetos de Ciência e Tecnologia em Guangzhou (202201010267), Fundos de Pesquisa Fundamental para as Universidades Centrais (21621058).
Materiais
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
Referências
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados