Method Article
Y-90 Radioembolisation und PD-1-Inhibitor als neoadjuvante Behandlung beim hepatozellulären Karzinom
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Studie veranschaulicht das methodische Potenzial der Kombination von Yttrium-90 Transarterieller Radioembolisation (Y-90 TARE) mit einem monoklonalen Anti-PD-1-Antikörper als wirksame neoadjuvante Strategie, die bei Patienten mit hepatozellulärem Karzinom (HCC) mit hohem initialem Rezidivrisiko zu einer Hepatektomie führt. Er betont die Sicherheit, Machbarkeit und Schritt-für-Schritt-Anleitung dieses Ansatzes.
Zusammenfassung
Diese Studie zeigt ein umfassendes Behandlungsprotokoll für Patienten mit hepatozellulärem Hochrisikokarzinom (HCC), das sich auf den kombinierten Einsatz von Y-90-Inhibitoren der transarteriellen Radioembolisation (TARE) und des programmierten Zelltods-1 (PD-1) als neoadjuvante Therapie konzentriert. Hervorgehoben durch einen Fallbericht, bietet es eine Schritt-für-Schritt-Referenz für ähnliche therapeutische Interventionen. Eine retrospektive Analyse wurde an einem Patienten durchgeführt, der sich nach einer Behandlung mit Y-90 TARE und PD-1-Inhibitoren einer Hepatektomie unterzogen hatte. Wichtige demografische und klinische Details wurden bei der Aufnahme erfasst, um die Therapieauswahl zu leiten. Die Berechnung der Tara-Eignung und der Dosierung von Y-90 basierte auf Technetium-99m (Tc-99m) makroaggregiertem Albumin (MAA) Perfusions-Mapping-Tests. Die Läsionsabdeckung durch Y-90-Mikrosphären wurde durch Einzelphotonenemissions-Computertomographie/Computertomographie (SPECT/CT) Fusionsbildgebung bestätigt, und Nebenwirkungen und Nachsorgeergebnisse wurden akribisch dokumentiert. Der Patient mit einem 7,2 cm HCC im rechten Leberlappen (T1bN0M0, BCLC A, CNLC Ib) und einem anfänglichen Alpha-Fetoprotein (AFP)-Spiegel von 66.840 ng/ml entschied sich aufgrund des hohen Rezidivrisikos und der anfänglichen Ablehnung einer Operation für Y-90 TARA. Die Parameter der Therapie, einschließlich der Lungen-Shunt-Fraktion (LSF) und des Nicht-Tumor-Verhältnisses (TNR), lagen innerhalb der therapeutischen Grenzen. Insgesamt wurden 1,36 GBq Y-90 verwaltet. 1 Monat nach der Therapie schrumpfte der Tumor auf 6 cm mit partieller Nekrose, und die AFP-Spiegel sanken auf 21.155 ng/ml, wobei er 3 Monate lang stabil blieb. Nach 3 Monaten führte die Behandlung mit PD-1-Hemmern zu einer weiteren Tumorreduktion auf 4 cm und einer AFP-Abnahme auf 1,84 ng/ml. Der Patient unterzog sich dann einer Hepatektomie; Die histopathologische Untersuchung bestätigte eine vollständige Tumornekrose. 12 Monate nach der Operation wurde in den Nachuntersuchungen kein Tumorrezidiv oder keine Metastasierung beobachtet. Dieses Protokoll zeigt die effektive Kombination von Y-90 TARE und PD-1-Inhibitor als Überbrückungsstrategie zur Operation bei HCC-Patienten mit hohem Rezidivrisiko und bietet einen praktischen Leitfaden für die Umsetzung dieses Ansatzes.
Einleitung
Das hepatozelluläre Karzinom (HCC) macht weltweit 85 % bis 90 % der primären Leberkrebsfälle aus und ist ein häufiger bösartiger Tumor des Verdauungssystems1 . Noch schlimmer ist das Problem in China, wo HCC aufPlatz 4 der häufigsten bösartigen Erkrankungen und zweithäufigste Ursache für krebsbedingte Mortalität rangiert 2,3. Erschwerend kommt hinzu, dass die hohe Rezidivrate nach der Hepatektomie bei einer signifikanten Untergruppe der Patienten innerhalb von 2 Jahren beobachtet wurde. Diese Rezidive entwickeln sich oft zu therapeutisch resistenten und aggressiv bösartigen Formen, die schnell zu tödlichen Ergebnissen führen. Folglich ist die Milderung des Rezidivs nach Hepatektomie entscheidend für die Verlängerung der Überlebensraten bei HCC-Patienten 4,5.
Die neoadjuvante Therapie bezieht sich auf eine umfassende Reihe von Behandlungen, die vor der Operation durchgeführt werden und darauf abzielen, die Rate der vollständigen Tumorentfernung (R0-Resektion) zu erhöhen, mikrometastasierende Erkrankungen zu beseitigen, die in der Bildgebung nicht sichtbar sind, das Risiko eines postoperativen Rezidivs zu verringern und das Langzeitüberleben des Patienten zu verlängern6. Es ist besonders geeignet für HCC-Patienten mit Hochrisikofaktoren, einschließlich nicht-anatomischer Resektion, mikroskopischer Gefäßinvasion, erhöhter Serum-AFP-Spiegel von mehr als 32 ng/ml, Tumorabmessungen von mehr als 5 cm, multiplen Tumoren und zugrunde liegender Zirrhose7. Das Repertoire der neoadjuvanten Therapie umfasst verschiedene Techniken wie die transkatheterarterielle Chemoembolisation (TACE), die hepatische arterielle Infusionschemotherapie (HAIC) und die selektive interne Strahlentherapie (SIRT). Diese werden oft mit gezielten Immuntherapien kombiniert, die entweder einzeln oder in Kombination angewendet werden8.
Die transarterielle Radioembolisation Yttrium-90 (Y-90 TARE), eine spezialisierte Form der selektiven internen Strahlentherapie (SIRT), stellt eine bedeutende Behandlungsoption für inoperablen primären Leberkrebs und Lebermetastasen dar. Y-90 TARE ist für seine außergewöhnlichen lokalen Kontrollraten bekannt und zeichnet sich dadurch aus, dass es gezielte hochdosierte β-Strahlung direkt an die Tumorstelle abgibt, während sein begrenzter durchschnittlicher Eindringabstand von nur 2,5 mm zum Schutz des angrenzenden gesunden Gewebes beiträgt9. Die Yttrium-90-Mikrosphären-selektive interne Strahlentherapie (90Y-SIRT) wird seit über 50 Jahren seit 1970 klinisch bei der Behandlung von Lebermalignomen eingesetzt, wobei die großflächige klinische Anwendung seit mehr als zwei Jahrzehnten bestätigtist 10. Seine Sicherheit und Wirksamkeit sind seit seiner Zulassung in Europa und den Vereinigten Staaten im vergangenen Jahrhundert nachgewiesen. Die Yttrium-90-Strahlentherapie wird seit mehreren Jahrzehnten international durchgeführt und liefert zahlreiche klinische Daten 11,12,13. Darüber hinaus emittiert Yttrium-90, ein synthetisches radioaktives Element, das im Periodensystem auf Platz 39 steht, hochreine Betastrahlen mit hoher Energie. Es hat eine kurze Halbwertszeit (64,2 Stunden) und einen begrenzten Gewebeeindringabstand, so dass eine Isolierung nach der Operation nicht erforderlich ist 14,15,16. Auch die Gefäßtechnik und die Zerfallsprodukte sind für den menschlichen Körper ungefährlich15,17. Gleichzeitig verjüngen monoklonale Anti-PD-1-Antikörper das zytotoxische Potenzial von Immunzellen gegen Krebszellen. Da bei HCC-Patienten im Frühstadium robustere Immunprofile festgestellt wurden, werden PD-1-Inhibitoren zunehmend in neoadjuvanten Umgebungen eingesetzt. Funktionell verstärken diese monoklonalen PD-1-Antikörper den durch Y-90 TARE induzierten immunogenen Zelltod und stärken die Fähigkeit des Immunsystems, Tumorzellen zu erkennen und zu eliminieren. Der Mechanismus von Y-90 TARE beinhaltet die direkte Zerstörung von Tumorzellen durch β-Bestrahlung, die die Tumorheterogenität und Immunevasion adressiert und so die Wirkung von monoklonalen PD-1-Antikörpern verstärkt. Es ist jedoch wichtig zu beachten, dass zum gegenwärtigen Zeitpunkt umfassende Studien zur kombinierten Anwendung von Y-90-Tara- und PD-1-Hemmern in der neoadjuvanten Therapie relativ selten sind 18,19,20.
Diese Fallstudie dient als praktischer Leitfaden und zeigt den Prozess, die Sicherheit und das Potenzial von Y-90 TARE in Kombination mit PD-1-Inhibitoren als neoadjuvante Therapie, die zu einer Hepatektomie führt. Durch die Durchführung einer retrospektiven Bewertung eines HCC-Patienten, der mit dieser neoadjuvanten Therapie gefolgt von einer Hepatektomie behandelt wurde, beschreiben wir die therapeutischen Schritte, behandeln unerwünschte Ereignisse und bewerten die Ergebnisse. Unsere Ergebnisse zielen darauf ab, Klinikern eine umfassende Blaupause bei der Anwendung von Y-90-Tara- und PD-1-Inhibitor-Therapien bei der Behandlung von Hochrisiko-HCC-Patienten zu liefern.
FALL-PRÄSENTATION:
Der Patient, ein 49-jähriger Mann, war 168 cm groß, 62 kg und hatte ein Gesamtlebervolumen (VOI) von 1236 ml, mit einem Tumorvolumen von 157 mL und einem Zieltumorperfusionsvolumen von 246 mL. Das Gesamtlungenvolumen betrug 2124 ml, mit einem LSF von 17,17 % und einem TNR von 8,2. Er hatte ein 7,2 cm großes HCC im rechten Leberlappen (T1bN0M0, BCLC A, CNLC Ib) und einen anfänglichen Alpha-Fetoprotein (AFP)-Spiegel von 66.840 ng/ml. Der präoperative ECOG-PS (Eastern Cooperative Oncology Group Performance Status) des Patienten wurde mit 0 bewertet. Er hatte keine pharmakologische Behandlung erhalten, bevor er sich für Y-90 TARE entschied, das aufgrund eines hohen Rezidivrisikos und einer anfänglichen Ablehnung einer Operation gewählt wurde.
Protokoll
Das Behandlungsverfahren wurde vom institutionellen Prüfungsausschuss des ersten angeschlossenen Krankenhauses der Universität Jinan genehmigt. Die Einverständniserklärung wurde von dem in die Studie eingeschlossenen Teilnehmer eingeholt.
1. Patientenauswahl für die neoadjuvante Therapie
- Einschlusskriterien
- Auswahl von Patienten mit Läsionen, die für eine vollständige chirurgische Entfernung (R0-Resektion) geeignet sind.
- Ausgewählte Patienten mit hohen Risikofaktoren für ein Rezidiv, einschließlich nicht-anatomischer Resektion, Gefäßinvasion, erhöhter Serum-AFP-Werte von mehr als 32 ng/ml, Tumorabmessungen von mehr als 5 cm, Vorhandensein mehrerer Tumoren und zugrunde liegender Zirrhose.
- Ausschlusskriterien
- Schließen Sie Patienten mit Hochrisiko-Rezidivfaktoren aus, die zum Zeitpunkt der Erstdiagnose eine chirurgische Behandlung benötigen. Patienten ausschließen, die sich eine Y90-Behandlung nicht leisten können.
2. Y-90-Indikationen und Dosisbewertung
- DSA-Angiographie zur Bestimmung der tumoralen Blutversorgung
- Bitten Sie den Patienten, sich für den Eingriff in Rückenlage zu legen. Führen Sie routinemäßige Desinfektionen und Abdeckungen durch. Tragen Sie eine 4%ige Lidocainlösung lokal an der Punktionsstelle der Oberschenkelarterie zur Anästhesie auf.
- Halten Sie sich an routinemäßige Händewaschverfahren, ziehen Sie OP-Kleidung an und tragen Sie sterile Handschuhe.
- Führen Sie eine Mikropunktionsnadel mit der Seldinger-Technik in die rechte Oberschenkelarterie ein. Anschließend wird eine Schleuse platziert, die mit einem Salzspülsystem verbunden ist.
- Sobald die Punktion der Oberschenkelarterie und die Katheterplatzierung erfolgreich sind (es wird hellrotes arterielles Blut beobachtet), wird der angiographische Katheter zum Truncus coeliacus vorgeschoben. Wenn die Bildgebung auf das Vorhandensein anderer tumorversorgender Gefäße als der Leberarterie hindeutet, ist eine Angiographie der Arteria mesenterica superior, der Arteria infradiaphragmatica usw. durchzuführen, um alle tumorversorgenden Gefäße zu identifizieren.
- Führen Sie eine Angiographie am Ursprung des Truncus coeliacus durch, um festzustellen, ob der Lebertumor ausschließlich von einem solitären Ast der rechten Leberarterie versorgt wird.
- Verwenden Sie die koaxiale Mikrokathetertechnik für die superselektive Katheterisierung am rechten unteren Ast der rechten Leberarterie. Führen Sie eine Angiographie durch, um die Position des Versorgungsgefäßes zu bestätigen.
- Technetium-99m (Tc-99m) MAA-Injektion und Bildgebung
- Injizieren Sie 2 mCi Tc-99m MAA durch den Mikrokatheter in die versorgenden Arterien.
HINWEIS: Dieses Verfahren wird in Übereinstimmung mit den Empfehlungen der American Association of Physicists in Medicine zu Dosimetrie-, Bildgebungs- und Qualitätssicherungsverfahren für die 90Y-Mikrosphären-Brachytherapie bei der Behandlung von Lebermalignomen durchgeführt. Die empfohlene Dosierung von Tc-99m MAA liegt bei 2-4 mCi (74-148 MBq)16. Es ist wichtig zu beachten, dass die Dosierung von Tc-99m MAA fest ist und nicht je nach Gewicht des Patienten, Körperoberfläche oder Größe der Läsion variiert. - Führen Sie eine Cone-Beam-Computertomographie (DVT) durch, um die Zieltumorregion der intrahepatischen Tc-99m-MAA-Verteilung abzugrenzen. Skizzieren Sie die Region während der arteriellen Phase manuell in sagittalen, koronalen und axialen Ansichten.
- Berechnen Sie das Volumen der Zieltumorregion mit der Option SEG4-Eigenschaften in der DVT.
- Injizieren Sie 2 mCi Tc-99m MAA durch den Mikrokatheter in die versorgenden Arterien.
- Berechnungen der LSF-, TNR- und Y90-Mikrosphären-Dosimetrie
- Konfigurieren Sie die Parameter der Scanmodi (SPECT und CT) am Scanner und führen Sie die SPECT/CT-Bildgebung am Patienten innerhalb von 1-2 Stunden nach der Tc-99m MAA-Infusion durch. Wählen Sie die Fusionsfunktion , um die SPECT- und CT-Bilder zusammenzuführen und die Verteilung von Tc-99m MAA in Leber, Lunge und anderen Organen zu bestimmen.
- Berechnen Sie die Lungen-Shunt-Fraktion (LSF) mit planarer Bildgebung.
- Zeichnen Sie die interessierenden Regionen (ROIs) manuell und markieren Sie die unterschiedlichen Bereiche in Leber und Lunge, in denen die Verteilung von Tc-99m MAA in den vorderen und hinteren Ansichten der Leber, der rechten Lunge und der linken Lunge auf den planaren Bildern erkennbar ist. Dieser Schritt wird von einem Nuklearmediziner durchgeführt.
HINWEIS: Die Lungen-Shunt-Fraktion (LSF) stellt die Fraktion von 99mTc-MAA dar, die von der Leber zu beiden Lungen shuntet. Mithilfe der planaren Bildgebung zeichnet der Nuklearmediziner manuell ROIs um die Leber und die Lunge (getrennt für die linke und rechte Lunge) sowohl in der vorderen als auch in der hinteren Ansicht. Von dieser Workstation wird dann das Zählergebnis für jedes Teil erhalten. - Berechnen Sie die Zählungen für jeden ROI mit einer Standard-Workstation für die Nuklearmedizin. Verwenden Sie die Formel:
Lungenzählung =

- Berechnen Sie den LSF mit der folgenden Gleichung:

- Zeichnen Sie die interessierenden Regionen (ROIs) manuell und markieren Sie die unterschiedlichen Bereiche in Leber und Lunge, in denen die Verteilung von Tc-99m MAA in den vorderen und hinteren Ansichten der Leber, der rechten Lunge und der linken Lunge auf den planaren Bildern erkennbar ist. Dieser Schritt wird von einem Nuklearmediziner durchgeführt.
- Berechnen Sie das Tumor-Normalleber-Verhältnis (TNR) mit Hilfe der dreidimensionalen (3D) Segmentierungsanwendung der SPECT/CT-Bildgebung.
- Zeichnen Sie manuell diskrete ROIs gleicher Größe, um sowohl Tumor- als auch normale Leberbereiche auf der Grundlage der Computertomographie-Schnitte zu erfassen.
- Berechnen Sie die durchschnittliche Anzahl pro Elementarzelle des Tumors über die durchschnittliche Anzahl pro Elementarzelle der normalen Leber in jedem ROI mit Hilfe einer Workstation.
- Berechnen Sie das TNR-Verhältnis mit der folgenden Gleichung:

- Verwenden Sie die Partitionsmodellgleichung in der Dosis- und Aktivitätsvisualisierung für die Anwendung Y-90 RE (DAVYR) basierend auf den Ergebnissen der Berechnungen, um die verschriebene Aktivität (Gbq) und Dosierung (Gy) zu erhalten.
3. Y-90 Tara-Behandlung
- Befolgen Sie die in Schritt 2 beschriebene Vorgehensweise und führen Sie dann ein Angiogramm direkt an den in Schritt 2.1 identifizierten blutversorgenden Arterien durch.
- Vergleichen Sie das aktuelle angiographische Bild mit dem aus Schritt 2, um die Lage der versorgenden Arterien genauer zu bestätigen.
- Schieben Sie den Katheter nach der superselektiven Katheterisierung in die versorgenden Arterien vor und injizieren Sie dann die Y90-Mikrosphären mit der bereits berechneten Dosis und Aktivität in die versorgenden Arterien.
- Für Y-90 TARE sollten Sie spezielle Ganzkörper-PET/CT-Scans von der Brust bis knapp über das Becken durchführen. Führen Sie die PET-CT mit den folgenden Parametern durch: 80 s bis 110 s, 120 kVp, 40 mA, 1 s Rohrdrehung, 4 mm Schichtkollimation und eine Bettgeschwindigkeit von 8 mm/s (d. h. Teilung, 2).
- Bewerten Sie die TNR anhand eines Volumen-ROI, der auf den PET/CT-Bildern gezeichnet wurde, und vergleichen Sie sie dann mit einer TNR, die aus den SPECT/CT-Bildern der Tc-99m-MAA-Verteilung erhalten wurde, um die Verteilung von Y-90 zu bestätigen.
- Tragen Sie beim Dispensieren und Injizieren von Tc-99m MAA- und Y-90-Mikrosphären geeignete Schutzausrüstung wie Bleischürzen, Augenschutz und Bleihandschuhe.
- Führen Sie nach der Behandlung mit Y-90 TARE keine spezielle Behandlung durch und bitten Sie Patienten, die eine Y-90-Behandlung erhalten haben, 7 Tage lang engen Kontakt mit anderen zu vermeiden, um das Strahlenrisiko zu minimieren.
4. Sequentielle Behandlung mit PD-1-Inhibitoren nach Y90-Therapie
- Beobachten Sie die Stabilität der Läsion für mindestens 2 Monate nach der Y90-Behandlung. Verwenden Sie geeignete Bildgebungsmodalitäten für eine konsistente Überwachung. Bewerten Sie den Patienten neu, um das Vorhandensein von Hochrisikofaktoren für ein Rezidiv zu bestimmen.
- Wenn Hochrisikofaktoren festgestellt werden, bewerten Sie die Eignung des Patienten für eine Immuntherapie und stellen Sie sicher, dass keine Kontraindikationen vorliegen. Wählen Sie einen geeigneten PD-1-Hemmer wie Nivolumab oder Pembrolizumab aus, basierend auf den finanziellen Erwägungen des Patienten.
- Verabreichen Sie den gewählten Inhibitor in 1-2 Zyklen im Abstand von jeweils 21 Tagen. Verabreichen Sie den PD-1-Hemmer, der mit 100 ml physiologischer Kochsalzlösung in einer Dosis von 2 mg/ml hergestellt wurde, durch periphere intravenöse Injektion über einen Zeitraum von 1 h und schließen Sie damit einen Zyklus der PD-1-Hemmertherapie ab.
- Beurteilung und Nachsorge nach der Behandlung
- Nach Abschluss der PD-1-Hemmer-Therapie werden nachfolgende bildgebende Untersuchungen und Tumormarkerstudien durchgeführt, die mit denen vor der Behandlung identisch sind.
- Beurteilen Sie das monatliche Ansprechen des Patienten auf die PD-1-Hemmer-Therapie anhand des Standardbewertungskriteriums21.
5. Hepatektomie nach Y90 TARE und PD-1 Inhibitor
- Entscheidung für eine Hepatektomie: Beurteilen Sie die Behandlungsstelle mit denselben radiologischen Techniken, die zuvor angewendet wurden, um die Stabilität der Läsion für mindestens 2 Monate nach der PD-1-Hemmer-Therapie zu beurteilen, und stellen Sie sicher, dass keine Hochrisikofaktoren für ein Rezidiv vorhanden sind.
- Präoperative Vorbereitungen für die Hepatektomie: Um die Tumorresektionsränder genau zu definieren und auf mögliche metastasierende Läsionen zu untersuchen, verabreichen Sie dem Patienten 3 Tage vor der Operation Indocyaningrün.
- Chirurgischer Eingriff
- Führen Sie eine tracheale Intubation zur Vollnarkose des Patienten in Rückenlage durch. Führen Sie eine chirurgische Desinfektion für den Oberbauchbereich durch, der sich oberhalb der Brustwarzenlinie, inferior bis zur Schambeinsymphyse und lateral bis zur Mittelachsellinie erstreckt.
- Verwenden Sie beim Eintritt in die Bauchhöhle ein Laparoskop, um die Leber und die umliegenden Strukturen gründlich auf Anomalien oder Metastasierungsherde zu untersuchen.
- Heben Sie den unteren Rand der rechten Leber mit Greifern an, um den Tumor im Segment 6 (S6) der Leber freizulegen.
- Wechseln Sie nach der intravenösen Injektion von Indocyaningrün in den Fluoreszenzbildgebungsmodus, um das Ausmaß des Tumors sorgfältig zu beurteilen und sicherzustellen, dass keine Invasion in benachbarte Gewebe oder signifikante Adhäsionen entstehen.
- Präparieren Sie das Bindegewebe zwischen dem unteren Rand der rechten Leber, dem hinteren Peritoneum und der rechten Niere mit einem harmonischen Skalpell. Kommen Sie voran und präparieren Sie die rechten dreieckigen und koronaren Bänder, wodurch die zweite Porta hepatis freigelegt wird.
- Mit einer Entenschnabelzange wird die Leber nach links zurückgezogen, um den rechten Lappen vollständig freizulegen.
- Verwenden Sie den Fluoreszenzbildgebungsmodus, um den Rand zwischen dem Tumor und dem angrenzenden gesunden Gewebe klar abzugrenzen.
- Markieren Sie die Resektionsleitlinien ca. 1-2 cm vom Tumorrand entfernt mit einem monopolaren Kauterhaken.
- Unterbrechen Sie vorübergehend den Gefäßzufluss aus der Pfortader und der Leberarterie, um intraoperative Blutungen zu reduzieren. Ziehen Sie die Tourniquets in Zyklen von 15 Minuten Okklusion fest, gefolgt von 5 Minuten Reperfusion.
- Durchschneiden Sie das Leberparenchym vorsichtig entlang der Hilfslinien mit dem harmonischen Skalpell. Kleine Gallengänge und Gefäße mit dem Skalpell koagulieren, zuerst klemmen und dann größere Strukturen durchschneiden.
- Nach der Exzidierung der Tumorprobe senden Sie sie zur histopathologischen Untersuchung.
- Spülen Sie die hepatische Schnittfläche mit warmer normaler Kochsalzlösung ab und erreichen Sie anschließend eine Blutstillung mit bipolarer Koagulation. Verwenden Sie resorbierbares Nahtmaterial, um alle Schnitte zu schließen. Der Patient hatte einen postoperativen Krankenhausaufenthalt von 10 Tagen. Zur postoperativen Schmerzbehandlung verabreichen Sie Tramadol durch intramuskuläre Injektion.
- Nachsorge nach der Hepatektomie
- Um ein mögliches postoperatives Rezidiv oder metastasierende Läsionen rechtzeitig zu erkennen, führen Sie in den ersten 3 Monaten nach der Operation monatlich Nachuntersuchungen durch. Nach diesem Zeitraum sollten die Untersuchungen in den nächsten 2 Jahren alle 3 Monate und in den folgenden 3 Jahren alle 6 Monate bis zu insgesamt 5 Jahren nach der Operation durchgeführt werden.
Ergebnisse
Die MRT zeigte bei den Patienten in dieser Studie eine Verringerung des Lebervolumens, eine gewellte Leberoberfläche und erweiterte Leberfissuren. Eine nahezu kugelförmige Masse mit den Maßen ca. 7,2 cm x 5,6 cm x 6,6 cm wurde im rechten hinteren Lappen der Leber identifiziert. Die Masse zeigte gemischte niedrige Signale in der T1-gewichteten Bildgebung (T1WI), gemischte hohe Signale in der T2-gewichteten Bildgebung (T2WI) und hohe Signale in der diffusionsgewichteten Bildgebung (DWI). Es zeigten klare Grenzen und eine heterogene arterielle Phasenverstärkung, was auf die Möglichkeit von Leberzirrhose und HCC hindeutet (Abbildung 1).
Während des Kathetermanövers wurde eine angiographische Untersuchung durchgeführt, um das Fehlen von tumorversorgenden Gefäßen zu bestätigen, die von der Bauchaorta, den Zwerchfellarterien und der Arteria mesenterica superior ausgehen. In der Angiographie am Ursprung des Truncus coeliacus zeigte der segmentale Ast der rechten Leberarterie (S6 oder rechter unterer Ast) eine ausgeprägte Tortuosität und Dilatation. Diese Beobachtung zeigte, dass der Lebertumor ausschließlich über diesen singulären arteriellen Ast vaskulär versorgt wurde (Abbildung 2A). Eine grundlegende Vorabbewertung für Y-90 TARE umfasst Mapping-Tests mit Tc-99m MAA-Perfusion, wobei die vergleichbare Dosisverteilung zwischen Tc-99m MAA- und Y-90-Mikrosphären ausgenutzt wird. Nach der Tc-99m-MAA-Injektion wurde die Perfusionszone für Tc-99m-MAA abgegrenzt, wobei das berechnete Perfusionsvolumen für den Zieltumor 246,27 mL betrug (Abbildung 2A). Patienten mit einem LSF von mehr als 20 % haben ein erhöhtes Risiko für strahleninduzierte Lungenschäden, was sie in der Regel zu ungeeigneten Kandidaten für eine Y-90-Behandlung macht22. Eine erhöhte TNR bedeutet eine stärkere tumorizide Wirkung bei Einhaltung der maximal zulässigen Leberstrahlendosis. Der berechnete LSF lag bei 17,17 % und der TNR bei 8,2 (Abbildung 2B).
Das Partitionsmodell bietet im Vergleich zu den Methoden der medizinischen internen Strahlendosis (MIRD) und der Körperoberfläche (BSA) eine überlegene personalisierte Strahlendosisabschätzung durch Berücksichtigung der TNR, wodurch die individuelle Behandlungsplanung verbessert wird. Die Ergebnisse des Partitionsmodells zeigen Strahlendosen von 36,6 Gy für die normale Leber (unterhalb der 40-Gy-Schwelle), 17,6 Gy für das Lungengewebe (innerhalb der 20-Gy-Grenze) und eine Spitzendosis von 300 Gy für den Tumor, was eine Y-90-Mikrosphärenaktivität von 1,36 GBq erfordert (Abbildung 3A). Nach der Yare-90-TARA-Therapie (Abbildung 3B) wurde ein PET/CT-Scan durchgeführt, der auf keine Off-Target-Ausbreitung oder Diskrepanzen bei der Abdeckung hinweist (Abbildung 3C).
1 Monat nach der Behandlung mit Y-90 TARE war der Tumor auf 6 cm reduziert und der AFP-Spiegel sank auf 21.155 ng/ml. 3 Monate nach der Behandlung zeigte der Tumor keine signifikanten Veränderungen. Aufgrund des anhaltend hohen Rezidivrisikos wurde die Behandlung mit einem PD-1-Hemmer eingeleitet. 5 Monate nach der Y-90-TARA-Therapie (2 Monate nach Beginn der PD-1-Hemmer-Behandlung) hatte sich die Läsion weiter auf 4 cm reduziert und der AFP-Spiegel war drastisch auf 1,84 ng/ml gesunken (Abbildung 4 und Tabelle 1).
Es werden Bilder des Tumors während der Hepatektomie sowohl unter weißem Licht als auch unter Fluoreszenz dargestellt (Abbildung 5A). Die Tumorproben, die aus der Hepatektomie gewonnen wurden, wurden in Schnellschnitte für die Grobpathologie umgewandelt. Bei der mikroskopischen Untersuchung zeigten sie keine Tumorzellen, Ablagerung von Y-90-Mikrosphären, signifikante lymphozytäre Infiltration und zirrhotische Veränderungen im angrenzenden normalen Lebergewebe23 (Abbildung 5B). 12 Monate nach der Operation wurden eine Nachsorge und eine Beurteilung auf Rezidiv durchgeführt, wobei die MRT-Bildgebung keine Hinweise auf ein Rezidiv oder eine Metastasierung zeigte (Abbildung 5C).
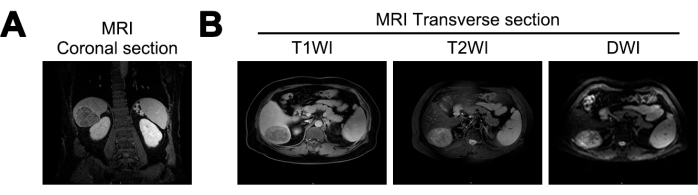
Abbildung 1: Magnetresonanztomographie (MRT) bei der Erstdiagnose. (A) Koronaler Schnitt des MRT T1 Weighted Imaging (T1WI) Signals, (B) Querschnitte von MRT T1WI, T2 Weighted Imaging (T2WI) und Diffusion Weighted Imaging (DWI) Signalen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
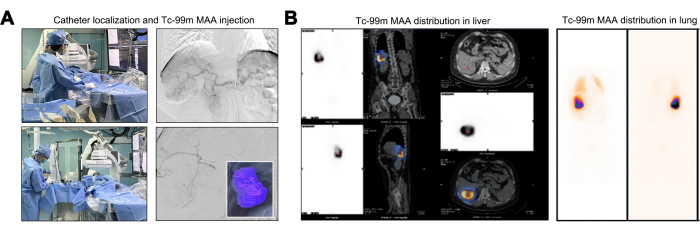
Abbildung 2: Injektion und Verteilung von makroaggregiertem Technetium-99m-Albumin (Tc-99m MAA). (A) Illustration des Injektionsprozesses von makroaggregiertem Technetium-99m-Albumin (Tc-99m MAA). (B) Darstellung der Dosisverteilung von 99mTc MAA in der Leber. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
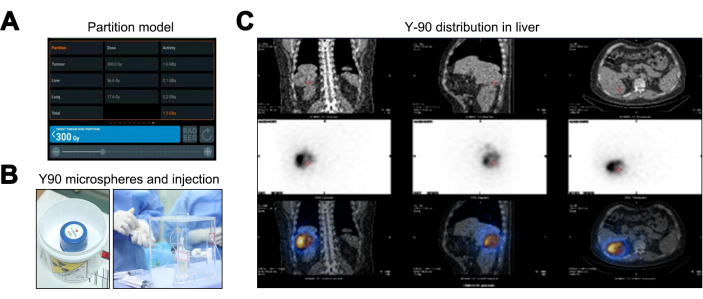
Abbildung 3: Behandlungsprozess der transarteriellen Radioembolisation von Yttrium-90 (Y-90 TARE). (A) Darstellung der Daten, die nach dem Partitionsmodell berechnet wurden. (B) Die Verpackung und Injektion der Y-90-Mikrosphären. (C) Einzelphotonen-Emissions-Computertomographie/Computertomographie (SPECT/CT) zur Validierung der Dosisverteilung der Y-90-Mikrosphären. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
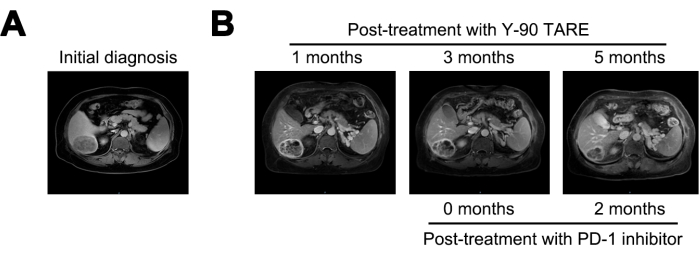
Abbildung 4: Vergleich des Tumors. (A) Präsentation des MRT-Bildes bei der Erstdiagnose, während (B) die MRT-Bilder 1-, 3- und 5 Monate nach der Behandlung mit Y-90 TARE anzeigt. Die Behandlung mit programmiertem Zelltod-1 (PD-1) -Inhibitor wurde 3 Monate nach Y-90 TARE durchgeführt. Der Patient wurde 3 Monate nach dem Y-90-TARA-Verfahren mit einem PD-1-Hemmer behandelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
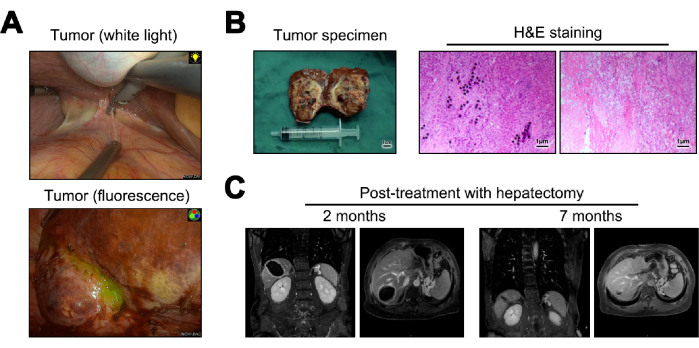
Abbildung 5: Hepatektomie und anschließende Nachsorge. (A) Präsentation des intraoperativ beobachteten Tumors. (B) Darstellung der postoperativen Tumorprobe und der Hämatoxylin- und Eosin-Färbung (H&E). (C) MRT-Bilder 2 und 12 Monate nach der Operation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Nachbehandlung mit Y-90 TARE | |||||
| Erstdiagnose | 1 Monat | 3 Monate | 5 Monate | ||
| AFP (ng/ml) | 66840 | 21155 | 19535 | 1.84 | |
Tabelle 1: Messung des AFP-Pegels nach der Behandlung.
Diskussion
Bei HCC-Patienten mit Hochrisiko-Rezidivfaktoren besteht auch nach einer kurativen Hepatektomie eine ungünstige Prognose fort, was die Bedeutung einer wirksamen neoadjuvanten Therapie zur Verbesserung der Überlebensraten unterstreicht 24,25. Im Vergleich zu interventionellen Behandlungen weist Y-90 TARE eine überlegene lokale Kontrollrateauf 26. Während Y-90 TARE die Antitumorantwort des Körpers aktivieren kann22, wurde die kombinierte Anwendung von Y-90 mit PD-1-Inhibitoren in der neoadjuvanten Therapie von Leberkrebs noch nicht berichtet. In dieser Studie wird retrospektiv ein Fall von neoadjuvanter Y-90-TARE gefolgt von einer Behandlung mit monoklonalen Anti-PD-1-Antikörpern bei einem HCC-Patienten mit Hochrisiko-Rezidivfaktoren untersucht, der eine vollständige Remission erreichte. Es wird ein detailliertes Behandlungsprotokoll als Referenz vorgestellt.
Mehrere Schlüsselpunkte im Protokoll dieser Studie verdienen Aufmerksamkeit. Erstens sollte angesichts des Potenzials für den Abbau und die Umverteilung von MAA99 eine SPECT/CT-Bildgebung innerhalb von 1-2 Stunden nach der MA99-Injektion durchgeführt werden. Zweitens ist es unerlässlich, die Dosis der Y-90-Mikrosphären sorgfältig zu berechnen, um eine ektopische Platzierung und eine übermäßige Dosierung zu verhindern, die zu Leber- und Lungenschäden führen könnte. Schließlich kann unter Berücksichtigung einer postneoadjuvanten Operation eine nicht-anatomische Resektion mit klaren Rändern vorzuziehen sein, um die Operationsdauer zu verkürzen und die operationsbedingte Immunsuppression zu minimieren.
In der vorliegenden Studie zeigte der Patient nach neoadjuvanter Therapie Symptome von Schlafstörungen und Verstopfung. Diese wurden mit Eszopiclon bei Schlafstörungen und Bisacodyl magensaftresistenten Tabletten bei Verstopfung behandelt. Dies deutet darauf hin, dass Nebenwirkungen im Zusammenhang mit Y-90 TARE und PD-1-Inhibitoren minimal sind und pharmakologisch behandelt werden können. Darüber hinaus induzierten Y-90-Tara- und PD-1-Inhibitoren kein Lebergewebe- oder Läsionsödem, keine schwere Adhäsion oder erhöhte Fragilität, was zu signifikanten Blutungen oder unvollständiger Resektion bei der anschließenden chirurgischen Entfernung führen könnte. Folglich beeinträchtigte oder beeinflusste Y-90 TARE nachfolgende chirurgische Eingriffe nicht.
Basierend auf den AFP-Werten und den Veränderungen in der Läsion verabreichten wir sequentiell eine monoklonale Anti-PD-1-Antikörpertherapie nach Y-90 TARE. Nach 5 Monaten erreichte die Läsion ein pathologisches vollständiges Ansprechen (pCR), was darauf hindeutet, dass der Zeitpunkt und die Wahl der Behandlung angemessen waren. Eine Anpassung der Behandlungsstrategie vor der medianen Ansprechzeit bei Y-90 TARE kann das Risiko eines Fortschreitens der Erkrankung wirksam verringern27. Obwohl der Grad der Läsionsauflösung auffällig mit dem Überleben nach Leberkarzinomresektionkorreliert 28, bleibt die Frage, ob ein anschließender chirurgischer Eingriff bei Fällen von pCR, die durch Y-90 TARE induziert werden, gerechtfertigt ist, Gegenstand weiterer Untersuchungen. Darüber hinaus müssen der optimale Zeitpunkt und die Dosierung der Behandlung mit Y-90 TARE und monoklonalen Anti-PD-1-Antikörpern sowie der beste Zeitpunkt und die beste Vorgehensweise für eine nachfolgende Operation weiter validiert werden. Darüber hinaus können die hohen Kosten des gesamten Behandlungsprozesses eine erhebliche finanzielle Belastung für die Patienten darstellen.
Das Auftreten einer pCR nach Behandlung mit Y-90 TARE und PD-1-Hemmern in unserem Fall wird postuliert, um mit mehreren Faktoren in der aktuellen Studie zu korrelieren. Zunächst wird die intratumorale Strahlendosis berücksichtigt; Wir verwendeten eine konventionelle Methodik, die auf Tc-99m MAA (Partitionsmodell) basiert, um die Y-90-Behandlungsdosis24 zu bewerten. Bemerkenswert ist, dass aufgrund der hohen TNR des Patienten die Strahlendosis, die die Läsion in dieser Studie durchdringt, erhöht war, wobei Y-90-Mikrosphären den Tumor umfassend bedeckten, wodurch eine heilende Wirkung erzielt wurde. Zweitens kann eine signifikante Infiltration von Immunzellen innerhalb des Tumors nicht übersehen werden, was auf eine zentrale Rolle der Anti-Tumor-Immunität des Patienten gegenüber pCR hinweist. In Anbetracht der Tatsache, dass es sich um die Erstdiagnose des Patienten handelte und sich der Tumor nicht in einem fortgeschrittenen Stadium befand, blieb die intrinsische Anti-Tumor-Immunität bestehen. Nach dem durch Y-90 TARE und PD-1-Inhibitor induzierten Tumorzelltod kann eine Entzündungsreaktion ausgelöst werden, die die Exposition des Tumorantigens erhöht, die Anti-Tumor-Immunität des Wirts aktiviert und in der Infiltration von Immunzellen und ihrer daraus resultierenden tumoriziden Wirkung gipfelt29. Darüber hinaus haben unsere früheren Forschungen einen Zusammenhang zwischen peritumoralen Leberentzündungen und Tumorresistenzen festgestellt, was die Immuntoleranz der Leber möglicherweise verschlimmern könnte30,31. Obwohl in dieser Studie Veränderungen der Leberzirrhose im peritumoralen Gewebe des Patienten vorhanden waren, wurde keine signifikante Entzündungsreaktion beobachtet, und alle Hepatitis-B-bezogenen Untersuchungen waren unauffällig. Dies deutet darauf hin, dass die hepatische Immunmikroumgebung des Patienten zu einer potenziell modifizierbaren Untergruppe gehört, für die Y-90 TARE und PD-1-Inhibitoren eine entscheidende Strategie zur Verbesserung der hepatischen Immunmikroumgebung darstellen.
Die Implementierung der Y-90-TARA-Behandlung erfordert strenge Auflagen und gemeinsame Anstrengungen zwischen mehreren Abteilungen, einschließlich Nuklearmedizin, interventioneller Radiologie, hepatobiliärer Chirurgie, Bildgebung und Onkologie. Das Potenzial für strahleninduzierte Komplikationen wie Lungenentzündung, Magengeschwüre und akute Pankreatitis unterstreicht die Notwendigkeit sorgfältiger Dosisberechnungen. Präoperative Simulationsauswertungen und Dosisabschätzungen, die von der nuklearmedizinischen Abteilung durchgeführt werden, können den Y90-TARA-Behandlungszyklus verlängern, was möglicherweise zu einer Tumorprogression führt. Y90 TARE ist möglicherweise nicht für alle Leberkrebsarten geeignet, insbesondere für solche mit multiplen intrahepatischen Metastasen und diffusen oder kleinen Leberkrebsarten (<0,5 cm), da es schwierig ist, Tumorbereiche von normalem Lebergewebe zu unterscheiden, was zu einer Fehleinschätzung der Dosis führen kann. Berichte über die Anwendung von Y90 in Verbindung mit PD-1-Inhibitoren zur neoadjuvanten Therapie des hepatozellulären Karzinoms sind begrenzt. Es sind noch groß angelegte klinische Studien erforderlich, um die Wirksamkeit und die therapeutischen Details zu untermauern.
Zusammenfassend lässt sich sagen, dass die Kombination von Y-90 TARE und einem PD-1-Inhibitor einen sicheren und effektiven Ansatz für die neoadjuvante Behandlung von HCC-Patienten darstellt. Diese Strategie verringert nicht nur die lokale Tumorlast und minimiert Mikrometastasen weitestgehend, ohne jedoch das Risiko eines Fortschreitens der Erkrankung zu erhöhen. Folglich birgt es das Potenzial, die postoperative rezidivfreie Zeit für Patienten zu verlängern. Wir bieten ein replizierbares und praktikables Protokoll für die neoadjuvante Behandlung von Patienten mit Hochrisiko-HCC an.
Offenlegungen
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Diese Studie wurde finanziert von der National Natural Science Foundation of China (82303287), der Guangdong Basic and Applied Basic Research Foundation (2021A1515110083), Science and Technology Projects in Guangzhou (202201010267), Fundamental Research Funds for the Central Universities (21621058).
Materialien
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
Referenzen
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten