Method Article
肝細胞癌におけるネオアジュバント治療としてのY-90放射線塞栓術とPD-1阻害剤
* これらの著者は同等に貢献しました
要約
この研究は、イットリウム-90 経動脈放射線塞栓術 (Y-90 TARE) と抗 PD-1 モノクローナル抗体を組み合わせる方法論的可能性を示しています 初期の再発リスクが高い肝細胞癌 (HCC) 患者の肝切除術につながる効果的なネオアジュバント戦略として。このアプローチの安全性、実現可能性、および段階的な手順ガイダンスを強調しています。
要約
この研究では、高リスク肝細胞がん (HCC) 患者に対する包括的な治療プロトコルを示しており、ネオアジュバント療法としての Y-90 経動脈放射線塞栓術 (TARE) とプログラム細胞死-1 (PD-1) 阻害剤の併用に焦点を当てています。症例報告を通じて強調され、同様の治療介入の段階的な参照を提供します。Y-90 TAREおよびPD-1阻害剤治療後に肝切除術を受けた患者に対してレトロスペクティブ解析が実施された。主要な人口統計学的および臨床的詳細は、治療選択をガイドするために入院時に記録されました。Y-90 TAREの適合性と投与量の計算は、テクネチウム-99m(Tc-99m)マクロ凝集アルブミン(MAA)灌流マッピング試験に基づいていました。Y-90マイクロスフェアによる病変の被覆率は、単一光子放出型コンピュータ断層撮影/コンピュータ断層撮影(SPECT/CT)融合イメージングによって確認され、副作用と追跡結果が細心の注意を払って文書化されました。右肝葉に 7.2 cm の HCC があり (T1bN0M0、BCLC A、CNLC Ib)、初期 α-フェトプロテイン (AFP) レベルが 66,840 ng/mL の患者は、再発リスクが高く、初期手術が拒否されたため、Y-90 TARE を選択しました。肺シャント画分(LSF)および非腫瘍比(TNR)を含む治療のパラメータは、治療限界内でした。合計1.36GBqのY-90が投与されました。治療後1カ月で腫瘍は部分壊死を伴って6cmに縮小し、AFP値は21,155 ng/mLに低下し、3カ月間安定していた。3ヵ月後、PD-1阻害剤による治療により、腫瘍はさらに4cmに縮小し、AFPは1.84ng/mLに減少しました。その後、患者は肝切除術を受けました。病理組織学では完全な腫瘍壊死が確認されました。術後12ヵ月時点で、フォローアップセッションで腫瘍の再発または転移は観察されなかった。このプロトコルは、再発リスクの高いHCC患者の手術への橋渡し戦略として、Y-90 TAREとPD-1阻害剤の効果的な組み合わせを実証し、このアプローチを実施するための実践的なガイドを提供します。
概要
肝細胞がん(HCC)は、世界中の原発性肝がん症例の85%〜90%を占め、消化器系に蔓延する悪性腫瘍です1。この問題は中国ではさらに深刻で、HCCは悪性腫瘍の第4位、がん関連死亡の第2位にランクされています2,3。この課題をさらに悪化させているのは、肝切除後の再発率が高く、2年以内にかなりの数の患者で観察されていることです。これらの再発は、しばしば治療抵抗性で攻撃的な悪性の形態に進化し、すぐに致命的な結果につながります。したがって、肝切除後の再発を軽減することは、HCC患者の生存率を延長するために重要です4,5。
術前補助療法とは、手術前に行われる包括的な治療群を指し、腫瘍の完全切除(R0切除)率の向上、画像診断では見えない微小転移性疾患の排除、術後再発リスクの低減、患者の長期生存期間の延長を目的としています6。これは、非解剖学的切除、顕微鏡的血管浸潤、32 ng/mLを超える血清AFPレベルの上昇、5 cmを超える腫瘍寸法、複数の腫瘍、および基礎となる肝硬変など、高リスク因子を呈するHCC患者に特に適しています7。ネオアジュバント療法のレパートリーには、経カテーテル的動脈化学塞栓術 (TACE)、肝動脈注入化学療法 (HAIC)、選択的内照射療法 (SIRT) など、さまざまな手法が含まれます。これらはしばしば標的免疫療法と統合され、単独または組み合わせて適用されます8。
イットリウム-90経動脈放射線塞栓術(Y-90 TARE)は、選択的内部放射線療法(SIRT)の特殊な形態であり、手術不能な原発性肝がんおよび肝転移に対する重要な治療選択肢となっています。その卓越した局所制御率で有名なY-90 TAREは、標的を絞った高線量のβ放射線を腫瘍部位に直接照射することで優れていますが、わずか2.5mmという限られた平均浸透距離は、隣接する健康な組織を保護するのに役立ちます9。イットリウム-90マイクロスフェア選択的内部放射線療法(90Y-SIRT)は、1970年以来50年以上にわたって肝臓悪性腫瘍の治療に臨床的に利用されており、大規模な臨床応用は20年以上にわたって確認されています10。その安全性と有効性は、前世紀にヨーロッパと米国で承認されて以来、実証されています。イットリウム-90放射線療法は数十年にわたって国際的に実施されており、豊富な臨床データが得られています11,12,13。また、周期表で39位に位置付けられている合成放射性元素であるイットリウム90は、高エネルギーの高純度ベータ線を放出しています。半減期が短く(64.2時間)、組織への浸透距離が限られているため、手術後の隔離が不要です14,15,16。また、血管技術、および崩壊生成物は人体に無害です15,17。同時に、抗PD-1モノクローナル抗体は、がん細胞に対する免疫細胞の細胞毒性能を若返らせます。早期のHCC患者でより強固な免疫プロファイルが認められる中、PD-1阻害剤はネオアジュバントの設定でますます活用されています。機能的には、これらのPD-1モノクローナル抗体は、Y-90 TAREによって誘発される免疫原性細胞死を増強し、免疫系が腫瘍細胞を認識して排除する能力を高めます。Y-90 TAREのメカニズムは、β放射線による直接的な腫瘍細胞破壊を含み、腫瘍の不均一性と免疫回避に対処し、PD-1モノクローナル抗体の影響を増大させます。しかし、現在のところ、ネオアジュバント療法におけるY-90 TARE阻害剤とPD-1阻害剤の併用に関する包括的な研究は比較的少ないことに注意することが重要です18,19,20。
このケーススタディは、肝切除術につながるネオアジュバント療法としてのY-90 TAREとPD-1阻害剤の併用のプロセス、安全性、および可能性を示す実践的なガイドとして機能します。このネオアジュバント療法とそれに続く肝切除術で治療されたHCC患者のレトロスペクティブ評価を実施することにより、治療ステップを詳しく説明し、有害事象を管理し、結果を評価します。私たちの調査結果は、高リスクHCC患者の管理にY-90 TAREおよびPD-1阻害剤療法を適用する臨床医に包括的な青写真を提供することを目的としています。
ケースプレゼンテーション:
患者は49歳男性で、身長168cm、体重62kg、総肝臓容積(VOI)1236mL、腫瘍容積157mL、標的腫瘍灌流量246mLでした。総肺活量は2124mLで、LSFは17.17%、TNRは8.2でした。彼は右肝葉に7.2cmサイズのHCC(T1bN0M0、BCLC A、CNLC Ib)があり、初期α-フェトプロテイン(AFP)レベルは66,840 ng / mLでした。患者の術前 ECOG-PS (Eastern Cooperative Oncology Group Performance Status) は 0 で採点されました。彼は、再発リスクが高く、初期手術が拒否されたために選択されたY-90 TAREを選択する前に、薬理学的治療を受けていませんでした。
プロトコル
治療手順は、済南大学第一附属病院の治験審査委員会によって承認されました。インフォームドコンセントは、研究に含まれる参加者から得られました。
1. ネオアジュバント療法の患者選択
- 選択基準
- 完全な外科的切除(R0切除)に適した病変を有する患者を選択します。
- 非解剖学的切除、血管浸潤、血清AFPレベルの上昇が32 ng / mLを超える、腫瘍寸法が5cmを超える、複数の腫瘍の存在、および基礎となる肝硬変など、再発のリスクが高い因子を示す患者を選択します。.
- 除外基準
- 初期診断時に外科的治療が必要な高リスク再発因子を有する患者を除外します。Y90治療を受ける余裕がない患者を除外します。
2. Y-90の適応症と用量評価
- 腫瘍の血液供給を決定するためのDSA血管造影
- 患者に手術のために仰臥位になるように頼んでください。定期的な消毒とドレープを行います。麻酔のために大腿動脈穿刺部位に 4% リドカイン溶液を局所的に塗布します。
- 定期的な手洗い手順を順守し、手術服を着用し、滅菌手袋を着用してください。
- セルディンガー法を使用して、マイクロパンク針を右総大腿動脈に挿入します。これに続いて、生理食塩水フラッシュシステムに接続されたシースを配置します。
- 大腿動脈の穿刺とカテーテルの配置が成功したら (真っ赤な動脈血が観察されます)、血管造影カテーテルを腹腔幹まで進めます。画像検査の結果、肝動脈以外の腫瘍供給血管の存在が示唆された場合は、上腸間膜動脈、横隔膜下動脈などで血管造影を行い、腫瘍供給血管を特定します。
- 腹腔幹の起点で血管造影を行い、肝腫瘍が右肝動脈の孤立した枝によってのみ供給されているかどうかを判断します。
- 同軸マイクロカテーテル技術を利用して、右肝動脈の右下枝に超選択的カテーテル法を施術します。供給容器の位置を確認するために血管造影を行います。
- テクネチウム-99m(Tc-99m)MAA注射およびイメージング
- 2 mCiのTc-99m MAAをマイクロカテーテルを介して供給動脈に注入します。
注:この手順は、肝悪性腫瘍の治療における90Yマイクロスフィア小線源治療の線量測定、イメージング、および品質保証手順に関する米国医学物理学者協会の推奨事項に従って実施されます。Tc-99m MAAの推奨投与量は、2-4 mCi(74-148 MBq)16に設定されています。Tc-99m MAAの投与量は固定されており、患者の体重、体表面積、または病変のサイズに基づいて変化しないことに注意することが重要です。 - コーンビームコンピュータ断層撮影法(CBCT)を実行して、肝内Tc-99m MAA分布の標的腫瘍領域を描写します。動脈期の矢状、冠状、軸方向のビューで領域の輪郭を手動で描きます。
- CBCTのSEG4 Propertiesオプションを使用して、標的腫瘍領域の体積を計算します。
- 2 mCiのTc-99m MAAをマイクロカテーテルを介して供給動脈に注入します。
- LSF、TNR、Y90マイクロスフェア線量計算
- スキャナーでスキャンモード(SPECTおよびCT)パラメータを設定し、Tc-99m MAA注入後1〜2時間以内に患者に対してSPECT / CTイメージングを実行します。SPECT画像とCT画像を融合して、肝臓、肺、その他の臓器におけるTc-99m MAAの分布を決定するために 、Fusion 機能を選択します。
- 平面イメージングを使用して肺シャント分率(LSF)を計算します。
- 関心領域(ROI)を手動で描画し、平面画像上の肝臓、右肺、左肺の前方および後方のビューでTc-99m MAAの分布が識別できる肝臓と肺内の明確な領域をマークします。このステップは、核医学技師によって行われます。
注:肺シャント画分(LSF)は、肝臓から両方の肺にシャントする99mTc-MAAの画分を表します。核医学技師は、平面イメージングを利用して、肝臓と肺の周り(左肺と右肺で別々に)のROIを前方図と後眼図の両方で手動で描画します。その後、各部品のカウント結果は、このワークステーションから取得されます。 - 標準的な核医学ワークステーションを使用して、各ROIのカウントを計算します。次の式を使用します。
肺数 =

- 次の式を使用して LSF を計算します。

- 関心領域(ROI)を手動で描画し、平面画像上の肝臓、右肺、左肺の前方および後方のビューでTc-99m MAAの分布が識別できる肝臓と肺内の明確な領域をマークします。このステップは、核医学技師によって行われます。
- SPECT/CTイメージングの3次元(3D)セグメンテーションアプリケーションを使用して、腫瘍と正常肝の比率(TNR)を計算します。
- コンピュータ断層撮影スライスに基づいて、腫瘍領域と正常な肝臓領域の両方を含む同じサイズの離散ROIを手動で描画します。
- ワークステーションを使用して、各ROIの正常な肝臓の単位細胞あたりの平均数に対する腫瘍の単位細胞あたりの平均数を計算します。
- 次の式を使用して TNR 比を計算します。

- Y-90 RE (DAVYR) アプリケーションの線量および活動ビジュアライザーでパーティション モデル方程式を使用し、計算の結果に基づいて、規定の活動量 (Gbq) と投与量 (Gy) を取得します。
3. Y-90風袋処理
- ステップ 2 で説明したアプローチに従い、ステップ 2.1 で特定された血液供給動脈に対して直接血管造影を実行します。
- 現在の血管造影画像とステップ2の画像を比較して、供給する動脈の位置をより正確に確認します。
- 超選択的カテーテル法の後、カテーテルを供給動脈に進め、次に、すでに計算された用量と活性でY90マイクロスフェアを供給動脈に注入します。
- Y-90 TAREの場合、胸部から骨盤のすぐ上まで専用の全身PET / CTスキャンを取得します。80 s to 110 s、120 kVp、40 mA、1 s tube rotation、4 mm slice collimation、8 mm/s (つまり、ピッチ、2) のベッド速度のパラメータを使用して PET-CT を実行します。
- PET/CT画像に描画された体積ROIからTNRを評価し、Tc-99m MAA分布のSPECT/CT画像から得られたTNRと比較することで、Y-90の分布を確認します。
- Tc-99m MAAおよびY-90マイクロスフィアを塗布および注入するときは、鉛エプロン、アイシールド、鉛手袋などの適切な保護具を着用してください。
- Y-90 TARE治療後に特別な治療を行わず、Y-90治療を受けた患者には、放射線のリスクを最小限に抑えるために、7日間は他人との密接な接触を避けるように依頼してください。
4. Y90療法後のPD-1阻害剤の逐次治療
- Y90治療後少なくとも2ヶ月間、病変の安定性を観察します。一貫したモニタリングのために、適切なイメージングモダリティを使用してください。患者を再評価して、再発のリスクが高い因子の存在を判断します。
- 高リスク因子が特定された場合は、免疫療法に対する患者の適合性を評価し、禁忌がないことを確認します。患者の経済的考慮事項に基づいて、ニボルマブやペムブロリズマブなどの適切なPD-1阻害剤を選択します。
- 選択した阻害剤を1〜2サイクルで、それぞれ21日間隔で投与します。100 mLの生理食塩水2 mg / mLを使用して調製したPD-1阻害剤を、末 ?? 静脈内注射で1時間にわたって投与し、PD-1阻害剤療法の1サイクルを完了させます。.
- 治療後の評価とフォローアップ
- PD-1阻害剤療法の完了後、フォローアップ画像検査および腫瘍マーカー検査は、治療前に使用されたものと同じです。
- 標準的な評価基準21 を使用して、PD-1 阻害剤療法に対する患者の毎月の反応を評価します。
5. Y90 TAREおよびPD-1阻害剤投与後の肝切除術
- 肝切除術の決定: 以前に適用されたのと同じ放射線技術を使用して治療部位を評価し、PD-1 阻害剤治療後少なくとも 2 か月間の病変の安定性を評価し、再発の高リスク要因が存在しないことを確認します。
- 肝切除術の術前準備: 腫瘍切除断端を正確に定義し、転移性病変の可能性を検査するために、手術の 3 日前に患者にインドシアニン グリーンを投与します。
- 手術
- 仰臥位の状態で患者に全身麻酔のための気管挿管を行います。乳頭ラインより上方、恥骨結合より下方、および中腋窩ラインまで横方向に伸びる上腹部の外科的消毒を行う。
- 腹腔に入ったら、腹腔鏡を使用して、肝臓とその周囲の構造の異常や転移性病巣がないか徹底的に検査します。
- 右肝臓の下縁を把持器で浮き上がらせ、肝臓のセグメント6(S6)に位置する腫瘍を露出させます。
- インドシアニングリーンを静脈内注射した後、蛍光イメージングモードに切り替えて腫瘍の程度を慎重に評価し、隣接する組織への浸潤や重大な癒着がないことを確認します。
- 右肝臓、後腹膜、右腎臓の下縁の間の結合組織を調和的なメスを使用して解剖します。右三角靭帯と冠状靭帯の解剖が優れており、2番目の肝門が露出しています。
- ダックビル鉗子を使用して肝臓を左に引っ込め、右葉を完全に露出させます。
- 蛍光イメージングモードを使用して、腫瘍と隣接する健康な組織との間のマージンを明確に描写します。
- 切除ガイドラインを腫瘍縁から約1〜2 cmのところに、単極性焼灼フックを使用して印を付けます。
- 門脈と肝動脈からの血管流入を一時的に中断して、術中の出血を減らします。止血帯を15分間の閉塞とそれに続く5分間の再灌流のサイクルで締めます。
- ハーモニックメスでガイドラインに沿って肝実質を慎重に横断します。メスで小さな胆管と血管を凝固させ、最初にクランプしてから、より大きな構造物を横断します。
- 腫瘍標本を切除した後、病理組織学的評価のために送ってください。
- 肝臓の切断面を温かい生理食塩水ですすぎ、続いて双極凝固で止血を達成します。吸収性縫合糸を使用して、すべての切開を閉じます。患者は術後10日間の入院期間がありました。術後の痛みの管理には、筋肉内注射でトラマドールを投与します。.
- 肝切除術後のフォローアップ
- 術後の再発や転移性病変の可能性を迅速に発見するために、手術後最初の3ヶ月間は毎月フォローアップ検査を実施してください。この期間の後、次の 2 年間は 3 か月ごとに、その後の 3 年間は 6 か月ごとに、手術後最大 5 年間、検査をスケジュールします。
結果
MRIでは、この研究では、患者の肝臓容積の減少、肝臓表面の波状化、および肝臓の裂傷の拡大が明らかになりました。肝臓の右後葉に、約7.2 cm x 5.6 cm x 6.6 cmのほぼ球状の腫瘤が同定されました。この質量は、T1 強調イメージング (T1WI) で混合低シグナル、T2 強調イメージング (T2WI) で混合高シグナル、拡散強調イメージング (DWI) で高シグナルを示しました。明確な境界と不均一な動脈相の増強を示し、肝硬変とHCCの可能性を示唆しました(図1)。
カテーテル操作中に、腹部大動脈、横隔膜動脈、および上腸間膜動脈に由来する腫瘍供給血管が存在しないことを確認するために血管造影評価が実施されました。腹腔幹の起始部における血管造影では、右肝動脈の分節枝(S6または右下枝)に顕著な曲がりくねりと拡張が認められた。この観察により、肝腫瘍はこの単一の動脈枝からのみ血管供給を受けていたことが立証されました(図2A)。Y-90 TAREの基本的な事前評価には、Tc-99m MAAとY-90マイクロスフェア間の同等の線量分布を利用した、Tc-99m MAA灌流を使用したマッピングテストが含まれます。Tc-99m MAA注射後、Tc-99m MAAの灌流ゾーンが描かれ、標的腫瘍の計算された灌流量は246.27mLでした(図2A)。LSFが20%を超える患者は、放射線誘発性肺損傷のリスクが高く、通常、Y-90治療の候補としては不適当である22。TNRの上昇は、最大許容肝臓放射線量を遵守しながら、より強力な殺腫瘍効果を意味します。計算されたLSFは17.17%で、TNRは8.2で登録されました(図2B)。
パーティションモデルは、医療内部放射線量(MIRD)および体表面積(BSA)法と比較して、TNRを考慮に入れることにより、優れた個別化された放射線量推定を提供し、個別化された治療計画を強化します。パーティションモデルの結果は、正常な肝臓で36.6Gy(40Gyの閾値未満)、肺組織で17.6Gy(20Gyの制限内)、腫瘍のピーク線量が300Gyであることを示しており、Y-90マイクロスフェアの活性は1.36GBq(図3A)である必要があります。Y-90 TARE療法(図3B)後、PET/CTスキャンが実施され、オフターゲットの広がりやカバレッジの不一致がないことが示されました(図3C)。
Y-90 TARE治療の1ヵ月後に腫瘍は6cmに縮小し、AFP値は21,155 ng/mLに低下した。治療後3ヵ月で、腫瘍には有意な変化は見られませんでした。再発リスクが持続的に高いことから、PD-1阻害剤による治療が開始されました。Y-90 TARE療法の5か月後(PD-1阻害剤治療開始の2か月後)には、病変はさらに4 cmに減少し、AFPレベルは1.84 ng / mLに劇的に減少しました(図4 および 表1)。
白色光と蛍光の両方の下での肝切除術中の腫瘍の画像が示されています(図5A)。肝切除術から得られた腫瘍標本は、肉眼的病理のために凍結切片に変換されました。顕微鏡で調べると、腫瘍細胞は見られず、Y-90マイクロスフェアの沈着、顕著なリンパ球浸潤、および隣接する正常な肝臓組織23の肝硬変が明らかになりました23 (図5B)。術後12ヵ月で、経過観察と再発の評価が実施され、MRI画像では再発または転移の証拠は示されなかった(図5C)。
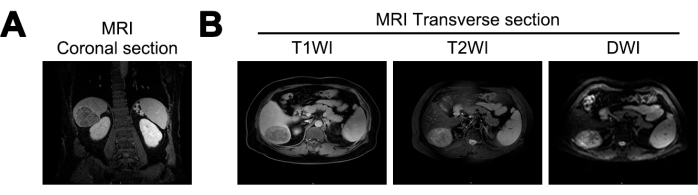
図1:初期診断時の磁気共鳴画像法(MRI)イメージング。(A) MRI T1 Weighted Imaging(T1WI)信号の冠状切片、 (B) MRI T1WI、T2 Weighted Imaging(T2WI)、およびDiffusion Weighted Imaging(DWI)信号の横断面。 この図の拡大版を表示するには、ここをクリックしてください。
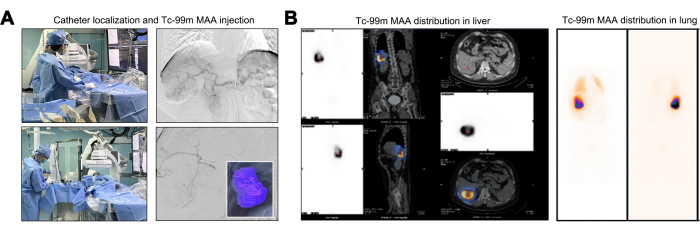
図2:テクネチウム-99mマクロ凝集アルブミン(Tc-99m MAA)の注入と分布。(A) テクネチウム-99mマクロ凝集アルブミン(Tc-99m MAA)の注入プロセスの図。 (B) 肝臓における99mTc MAAの線量分布の提示。 この図の拡大版を表示するには、ここをクリックしてください。
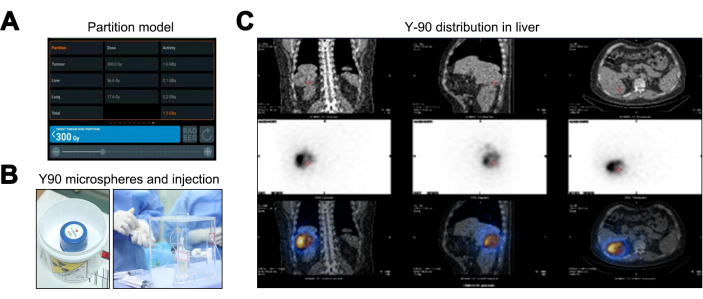
図3:Yttrium-90経動脈放射線塞栓術(Y-90 TARE)の治療プロセス。(A) パーティションモデルを使用して計算されたデータの描写。 (B) Y-90マイクロスフェアの包装と注入。 (C) Y-90マイクロスフェアの線量分布を検証するための単一光子放出コンピューター断層撮影/コンピューター断層撮影(SPECT / CT)。 この図の拡大版を表示するには、ここをクリックしてください。
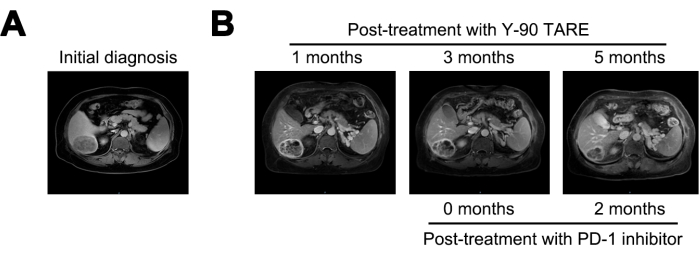
図4:腫瘍の比較。(A) 初期診断時の MRI 画像の表示、 (B) Y-90 TARE による治療後 1 か月、3 か月、および 5 か月後の MRI 画像の表示。プログラム細胞死-1(PD-1)阻害剤治療は、Y-90 TAREの3ヶ月後に実施しました。患者は、Y-90 TARE手順の3か月後にPD-1阻害剤による治療を受けました。 この図の拡大版を表示するには、ここをクリックしてください。
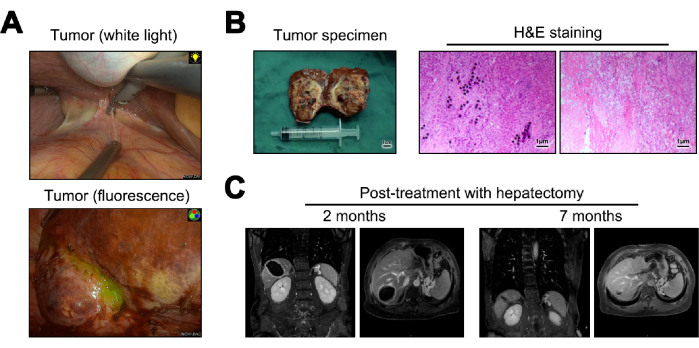
図5:肝切除術とその後のフォローアップ。(A) 術中に観察された腫瘍の提示。 (B) 術後腫瘍標本とヘマトキシリンおよびエオシン(H&E)染色のイラスト。 (C) 術後2ヶ月および12ヶ月のMRI画像。 この図の拡大版を表示するには、ここをクリックしてください。
| Y-90 TAREによる後処理 | |||||
| 初期診断 | 1ヶ月 | 3ヶ月 | 5ヶ月 | ||
| AFP(ng / mL) | 66840 | 21155 | 19535 | 1.84 | |
表1:治療後のAFPレベル測定。
ディスカッション
高リスクの再発因子を呈するHCC患者では、治癒的肝切除術後も予後不良が持続し、生存率を高めるための効果的なネオアジュバント療法の重要性が強調されている24,25。インターベンション治療と比較して、Y-90 TAREは優れた局所制御率を誇っています26。Y-90 TAREは体の抗腫瘍反応を活性化することができるが22、肝臓がんのネオアジュバント療法におけるY-90とPD-1阻害剤の併用はまだ報告されていない。この研究では、完全寛解を達成した高リスク再発因子を持つHCC患者におけるネオアジュバントY-90 TAREとそれに続く抗PD-1モノクローナル抗体治療の症例を遡及的にレビューします。参考までに詳細な治療プロトコルを提示します。
この研究のプロトコルのいくつかの重要なポイントは注目に値します。まず、MAA99の分解と再分布の可能性を考慮すると、SPECT / CTイメージングはMA99注射後1〜2時間以内に実行する必要があります。第二に、Y-90マイクロスフェアの線量を細心の注意を払って計算し、異所性の配置や過剰な投与量を防ぐことが不可欠です。これは肝臓や肺の損傷につながる可能性があります。最後に、ネオアジュバント手術後を考慮すると、手術期間を短縮し、手術関連の免疫抑制を最小限に抑えるために、明確なマージンを確保する非解剖学的切除が望ましい場合があります。
本研究では、ネオアジュバント療法後に睡眠障害と便秘の症状を示しました。これらは、睡眠障害に対するエスゾピクロンと便秘に対するビスアコジル腸溶性コーティング錠を使用して対処されました。これは、Y-90 TAREおよびPD-1阻害剤に関連する副作用が最小限であり、薬理学的に管理できることを示唆しています。.さらに、Y-90 TAREおよびPD-1阻害剤は、肝臓組織または病変の浮腫、重度の癒着、または脆弱性の増加を誘発しませんでした。後者は、その後の外科的切除中に重大な出血または不完全な切除を引き起こす可能性があります。その結果、Y-90 TAREはその後の外科的処置を妨げたり、影響を与えたりしませんでした。
AFPのレベルと病変の変化に基づいて、Y-90 TAREに続いて抗PD-1モノクローナル抗体療法を順次投与しました。5ヵ月後、病理学的完全奏効(pCR)を達成し、治療のタイミングと選択が適切であったことが示された。Y-90 TAREの奏効期間の中央値より前に治療戦略を調整することで、疾患の進行リスクを効果的に減らすことができる27。しかし、病変の解消の程度は肝癌切除後の生存率と顕著に相関していますが28、Y-90 TAREによって誘発されたpCRの症例に対してその後の外科的介入が正当化されるかどうかは、さらなる調査の対象となっています。さらに、Y-90 TAREおよび抗PD-1モノクローナル抗体治療の最適なタイミングと投与量、およびその後の手術の最適なタイミングとアプローチは、まださらに検証されていません。また、治療全体のコストが高いため、患者さんに大きな経済的負担がかかる可能性があります。
私たちの場合、Y-90 TAREおよびPD-1阻害剤治療後のpCRの発生は、現在の研究のいくつかの要因と相関していると仮定されています。最初に、腫瘍内放射線量が考慮されます。Y-90投与用量の評価には、Tc-99m MAA(分配モデル)に基づく従来の方法論を採用しました24。特に、患者のTNRが高いため、この研究では病変に浸透する放射線量が上昇し、Y-90マイクロスフェアが腫瘍を包括的に覆い、それによって治癒効果が達成されました。第二に、腫瘍内の免疫細胞の著しい浸潤は、患者の抗腫瘍免疫のpCRに対する極めて重要な役割を示していることを見逃すことはできません。これが患者の初期診断であり、腫瘍が進行した段階にないことを考慮すると、内因性抗腫瘍免疫は持続しました。Y-90 TAREおよびPD-1阻害剤によって誘発される腫瘍細胞死に続いて、炎症反応が引き起こされ、腫瘍抗原曝露が増強され、宿主の抗腫瘍免疫が活性化され、免疫細胞の浸潤とその結果としての殺腫瘍作用が最高潮に達する可能性がある29。さらに、私たちの以前の研究では、腫瘍周囲の肝炎症と腫瘍耐性との間に相関関係があり、これは肝免疫寛容を悪化させる可能性があることがわかりました30,31。この研究では、患者の腫瘍周囲組織に肝硬変性の変化が見られましたが、有意な炎症反応は観察されず、すべてのB型肝炎関連の検査は目立たなかった。このことは、患者の肝免疫微小環境が潜在的に変更可能なサブグループに属していることを示唆しており、そのためにY-90 TAREおよびPD-1阻害剤は、肝免疫微小環境を強化するための重要な戦略を表しています。
Y-90 TARE治療の実施には、核医学、インターベンショナルラジオロジー、肝胆道手術、イメージング、腫瘍学など、複数の部門にわたる厳しい条件と共同作業が必要です。肺炎、胃潰瘍、急性膵炎などの放射線誘発性合併症の可能性は、綿密な線量計算の必要性を強調しています。核医学部門が実施する術前シミュレーション評価と線量推定は、Y90 TARE治療サイクルを延長し、腫瘍の進行につながる可能性があります。Y90 TAREは、腫瘍領域を正常な肝臓組織と区別する際の課題により、用量の誤算につながる可能性があるため、すべての肝臓がん、特に多発性肝内転移およびびまん性または小径(<0.5cm)の肝臓がんに適しているとは限りません。肝細胞がんにおけるネオアジュバント療法におけるPD-1阻害剤とY90の併用に関する報告は限られています。その有効性と治療の詳細を実証するには、依然として大規模な臨床試験が必要です。
要約すると、Y-90 TAREとPD-1阻害剤の組み合わせは、HCC患者のネオアジュバント治療に安全で効果的なアプローチを提供します。この戦略は、局所的な腫瘍の負担を軽減し、微小転移を可能な限り最小限に抑えるだけでなく、疾患の進行リスクを高めることなくそれを実現します。その結果、患者さんの術後無再発期間を延長できる可能性を秘めています。私たちは、高リスクHCC患者のネオアジュバント治療のための再現可能で実行可能なプロトコルを提供します。
開示事項
著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない状態で実施されたと宣言します。
謝辞
この研究は、中国国家自然科学基金会(82303287)、広東省基礎応用基礎研究基金会(2021A1515110083)、広州の科学技術プロジェクト(202201010267)、中央大学の基礎研究基金(21621058)によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
参考文献
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved