Method Article
Radioembolización Y-90 e inhibidor de PD-1 como tratamiento neoadyuvante en el carcinoma hepatocelular
* Estos autores han contribuido por igual
En este artículo
Resumen
Este estudio ilustra el potencial metodológico de la combinación de la radioembolización transarterial con itrio-90 (Y-90 TARE) con un anticuerpo monoclonal anti-PD-1 como una estrategia neoadyuvante eficaz que conduce a la hepatectomía en pacientes con carcinoma hepatocelular (CHC) con un alto riesgo de recurrencia inicial. Hace hincapié en la seguridad, la viabilidad y la orientación procesal paso a paso de este enfoque.
Resumen
Este estudio muestra un protocolo de tratamiento integral para pacientes con carcinoma hepatocelular (CHC) de alto riesgo, centrándose en el uso combinado de radioembolización transarterial (TARE) Y-90 e inhibidores de la muerte celular programada-1 (PD-1) como terapia neoadyuvante. Destacado a través de un informe de caso, ofrece una referencia paso a paso para intervenciones terapéuticas similares. Se realizó un análisis retrospectivo de un paciente que se sometió a hepatectomía después de tratamiento con TARE Y-90 e inhibidores de PD-1. Se registraron los detalles demográficos y clínicos clave en el momento del ingreso para guiar la selección del tratamiento. La idoneidad de la tara Y-90 y el cálculo de la dosis se basaron en las pruebas de mapeo de perfusión de albúmina macroagregada (MAA) de tecnecio-99m (Tc-99m). La cobertura de la lesión por microesferas Y-90 se confirmó mediante imágenes de fusión de tomografía computarizada por emisión de fotón único/tomografía computarizada (SPECT/CT), y las reacciones adversas y los resultados del seguimiento se documentaron meticulosamente. El paciente, con un CHC de 7,2 cm en lóbulo hepático derecho (T1bN0M0, BCLC A, CNLC Ib) y un nivel inicial de alfafetoproteína (AFP) de 66.840 ng/mL, optó por la TARE Y-90 por alto riesgo de recurrencia y rechazo inicial a la cirugía. Los parámetros de la terapia, incluida la fracción de derivación pulmonar (FSL) y la relación no tumoral (TNR), estaban dentro de los límites terapéuticos. Se administró un total de 1,36 GBq Y-90. Al mes después del tratamiento, el tumor se redujo a 6 cm con necrosis parcial y los niveles de AFP descendieron a 21.155 ng/mL, permaneciendo estables durante 3 meses. Después de 3 meses, el tratamiento con inhibidores de PD-1 condujo a una mayor reducción del tumor a 4 cm y a una disminución de la AFP a 1,84 ng/ml. A continuación, el paciente se sometió a hepatectomía; El estudio histopatológico confirmó necrosis tumoral completa. A los 12 meses después de la cirugía, no se observó recidiva tumoral ni metástasis en las sesiones de seguimiento. Este protocolo demuestra la combinación efectiva de la tara Y-90 y el inhibidor de PD-1 como estrategia puente para la cirugía en pacientes con CHC con alto riesgo de recurrencia, proporcionando una guía práctica para implementar este enfoque.
Introducción
El carcinoma hepatocelular (CHC) representa el 85-90% de los casos de cáncer primario de hígado en todo el mundo y es un tumor maligno prevalente del sistema digestivo1 . El problema es aún peor en China, donde el CHC se ubica como la4ª neoplasia maligna más común y la segunda causa de mortalidad relacionada con el cáncer 2,3. Este desafío se ve agravado por la alta tasa de recurrencia después de la hepatectomía, observada en un subconjunto significativo de pacientes dentro de los 2 años. Estas recurrencias a menudo evolucionan hacia formas terapéuticamente resistentes y agresivamente malignas, lo que conduce rápidamente a resultados fatales. En consecuencia, mitigar la recurrencia post-hepatectomía es crucial para prolongar las tasas de supervivencia entre los pacientes con CHC 4,5.
La terapia neoadyuvante se refiere a un conjunto completo de tratamientos realizados antes de la cirugía, dirigidos a aumentar la tasa de extirpación completa del tumor (resección R0), eliminar la enfermedad micrometastásica no visible en las imágenes, reducir el riesgo de recurrencia postoperatoria y prolongar la supervivencia a largo plazo del paciente6. Es particularmente apropiado para pacientes con CHC que presentan factores de alto riesgo, incluyendo resección no anatómica, invasión vascular microscópica, niveles séricos elevados de AFP superiores a 32 ng/mL, dimensiones tumorales mayores de 5 cm, tumores múltiples y cirrosis subyacente7. El repertorio de terapia neoadyuvante abarca varias técnicas como la quimioembolización arterial transcatéter (TACE), la quimioterapia con infusión arterial hepática (HAIC) y la radioterapia interna selectiva (SIRT). A menudo se integran con inmunoterapias dirigidas, aplicadas individualmente o en combinación8.
La radioembolización transarterial con itrio-90 (Y-90 TARE), una forma especializada de radioterapia interna selectiva (SIRT), se presenta como una opción de tratamiento importante para los cánceres primarios de hígado inoperables y las metástasis hepáticas. Reconocido por sus excepcionales tasas de control local, Y-90 TARE sobresale por la administración de dosis altas de radiación β dirigida directamente al sitio del tumor, mientras que su distancia de penetración promedio limitada de solo 2,5 mm ayuda a proteger los tejidos sanos adyacentes9. La radioterapia interna selectiva con microesferas de itrio-90 (90Y-SIRT) se ha utilizado clínicamente en el tratamiento de neoplasias malignas hepáticas durante más de 50 años, desde 1970, con una aplicación clínica a gran escala confirmada desde hace más de dos décadas10. Su seguridad y eficacia han sido comprobadas desde su aprobación en Europa y Estados Unidos en el siglo pasado. La radioterapia con itrio-90 se ha llevado a cabo internacionalmente durante varias décadas, proporcionando abundantes datos clínicos 11,12,13. Además, el itrio-90, un elemento radiactivo sintético situado en el puesto 39 de la tabla periódica, emite rayos beta de alta pureza con alta energía. Tiene una vida media corta (64,2 horas) y una distancia de penetración tisular limitada, lo que elimina la necesidad de aislamiento postoperatorio 14,15,16. Además, la tecnología vascular y los productos de descomposición son inofensivos para el cuerpo humano 15,17. Al mismo tiempo, los anticuerpos monoclonales anti-PD-1 rejuvenecen el potencial citotóxico de las células inmunitarias contra las células cancerosas. Con perfiles inmunitarios más sólidos observados en pacientes con CHC en estadio temprano, los inhibidores de PD-1 se están aprovechando cada vez más en entornos neoadyuvantes. Funcionalmente, estos anticuerpos monoclonales PD-1 mejoran la muerte celular inmunogénica inducida por Y-90 TARE, aumentando la capacidad del sistema inmunitario para reconocer y eliminar células tumorales. El mecanismo de Y-90 TARE implica la destrucción directa de las células tumorales a través de la radiación β, que aborda la heterogeneidad tumoral y la evasión inmunitaria, aumentando así el impacto de los anticuerpos monoclonales PD-1. Sin embargo, es importante destacar que, hasta el momento, los estudios exhaustivos sobre el uso combinado de la TARE Y-90 y los inhibidores de PD-1 en la terapia neoadyuvante son relativamente escasos 18,19,20.
Este estudio de caso sirve como una guía práctica, que demuestra el proceso, la seguridad y el potencial de Y-90 TARE combinado con el inhibidor de PD-1 como terapia neoadyuvante que conduce a la hepatectomía. Al realizar una evaluación retrospectiva de un paciente con CHC tratado con esta terapia neoadyuvante seguida de hepatectomía, detallamos los pasos terapéuticos, manejamos los eventos adversos y evaluamos los resultados. Nuestros hallazgos tienen como objetivo proporcionar un plan integral para los médicos en la aplicación de la terapia con Y-90 TARE e inhibidores de PD-1 en el tratamiento de pacientes con CHC de alto riesgo.
PRESENTACIÓN DEL CASO:
El paciente, varón de 49 años, mide 168 cm, pesa 62 kg y presenta un volumen hepático total (VOI) de 1236 mL, con un volumen tumoral de 157 mL y un volumen de perfusión tumoral diana de 246 mL. El volumen pulmonar total fue de 2124 mL, con una FSM del 17,17% y una TNR de 8,2. Tenía un CHC de 7,2 cm en el lóbulo hepático derecho (T1bN0M0, BCLC A, CNLC Ib) y un nivel inicial de alfafetoproteína (AFP) de 66.840 ng/mL. El ECOG-PS (Eastern Cooperative Oncology Group Performance Status) preoperatorio del paciente se puntuó con 0. No había recibido ningún tratamiento farmacológico antes de optar por Y-90 TARE, que se eligió debido a su alto riesgo de recurrencia y rechazo inicial a la cirugía.
Protocolo
El procedimiento de tratamiento fue aprobado por la junta de revisión institucional del Primer Hospital Afiliado de la Universidad de Jinan. Se obtuvo el consentimiento informado del participante incluido en el estudio.
1. Selección de pacientes para terapia neoadyuvante
- Criterios de inclusión
- Seleccionar pacientes con lesiones susceptibles de extirpación quirúrgica completa (resección R0).
- Seleccionar pacientes que presenten factores de riesgo alto de recurrencia, como resección no anatómica, invasión vascular, niveles séricos elevados de AFP superiores a 32 ng/ml, dimensiones tumorales mayores de 5 cm, presencia de tumores múltiples y cirrosis subyacente.
- Criterios de exclusión
- Excluir a los pacientes con factores de recurrencia de alto riesgo que requieran tratamiento quirúrgico en el momento del diagnóstico inicial. Excluir a los pacientes que no pueden pagar el tratamiento Y90.
2. Indicaciones y evaluación de la dosis de Y-90
- Angiografía con DSA para determinar el suministro de sangre tumoral
- Pida al paciente que se acueste en decúbito supino durante el procedimiento. Realice la desinfección y el drapeado de rutina. Aplique una solución de lidocaína al 4% localmente en el sitio de punción de la arteria femoral para la anestesia.
- Siga los procedimientos rutinarios de lavado de manos, póngase ropa quirúrgica y use guantes estériles.
- Inserte una aguja de micropunción en la arteria femoral común derecha utilizando la técnica de Seldinger. A continuación, coloque una funda conectada a un sistema de descarga salina.
- Una vez que la punción de la arteria femoral y la colocación del catéter son exitosas (se observa sangre arterial de color rojo brillante), avance el catéter angiográfico hasta el tronco celíaco. Si las imágenes sugieren la presencia de vasos irrigadores de tumores distintos de la arteria hepática, se debe realizar una angiografía en la arteria mesentérica superior, la arteria infradiafragmática, etc., para identificar cualquier vaso que alimente el tumor.
- Realizar una angiografía en el origen del tronco celíaco para determinar si el tumor hepático es irrigado exclusivamente por una rama solitaria de la arteria hepática derecha.
- Utilizar la técnica de microcatéter coaxial para el cateterismo súper selectivo en la rama inferior derecha de la arteria hepática derecha. Realizar una angiografía para confirmar la ubicación del vaso suministrador.
- Inyección de tecnecio-99m (Tc-99m) MAA e imágenes
- Inyecte 2 mCi de Tc-99m MAA a través del microcatéter en las arterias irrigadoras.
NOTA: Este procedimiento se lleva a cabo de acuerdo con las Recomendaciones de la Asociación Americana de Físicos en Medicina sobre Dosimetría, Imágenes y Procedimientos de Aseguramiento de la Calidad para la Braquiterapia con Microesferas 90Y en el Tratamiento de Neoplasias Hepáticas Malignas. La dosis recomendada de Tc-99m MAA se establece en 2-4 mCi (74-148 MBq)16. Es importante tener en cuenta que la dosis de Tc-99m MAA es fija y no varía en función del peso del paciente, la superficie corporal o el tamaño de la lesión. - Realizar una tomografía computarizada de haz cónico (CBCT) para delinear la región tumoral objetivo de la distribución intrahepática de Tc-99m MAA. Delinee manualmente la región en las vistas sagital, coronal y axial durante la fase arterial.
- Calcule el volumen de la región tumoral objetivo utilizando la opción Propiedades de SEG4 en CBCT.
- Inyecte 2 mCi de Tc-99m MAA a través del microcatéter en las arterias irrigadoras.
- Cálculos de dosimetría de microesferas LSF, TNR e Y90
- Configure los parámetros de los modos de exploración (SPECT y CT) en el escáner y realice imágenes SPECT/CT en el paciente dentro de 1-2 h después de la infusión de Tc-99m MAA. Seleccione la función Fusión para amalgamar las imágenes de SPECT y TC para determinar la distribución de Tc-99m MAA en el hígado, el pulmón y otros órganos.
- Calcule la fracción de derivación pulmonar (LSF) mediante imágenes planas.
- Dibuje manualmente las regiones de interés (ROI), marcando las áreas distintas dentro del hígado y los pulmones donde la distribución de Tc-99m MAA es discernible en las vistas anterior y posterior del hígado, el pulmón derecho y el pulmón izquierdo en las imágenes planas. Este paso lo realiza un tecnólogo en medicina nuclear.
NOTA: La fracción de derivación pulmonar (LSF, por sus siglas en inglés) representa la fracción de 99mTc-MAA que se desvía del hígado a ambos pulmones. Mediante el uso de imágenes planas, el tecnólogo de medicina nuclear dibuja manualmente las ROI alrededor del hígado y los pulmones (por separado para el pulmón izquierdo y el derecho) tanto en la vista anterior como en la posterior. A continuación, el resultado del recuento de cada pieza se obtiene de esta estación de trabajo. - Calcule los recuentos de cada retorno de la inversión utilizando una estación de trabajo de medicina nuclear estándar. Usa la fórmula:
Recuentos pulmonares =

- Calcule el LSF usando la ecuación:

- Dibuje manualmente las regiones de interés (ROI), marcando las áreas distintas dentro del hígado y los pulmones donde la distribución de Tc-99m MAA es discernible en las vistas anterior y posterior del hígado, el pulmón derecho y el pulmón izquierdo en las imágenes planas. Este paso lo realiza un tecnólogo en medicina nuclear.
- Calcule la relación tumor-hígado normal (TNR) mediante la segmentación tridimensional (3D) de imágenes de SPECT/CT.
- Extraiga manualmente ROI discretos del mismo tamaño para abarcar tanto el tumor como las áreas hepáticas normales en función de los cortes de tomografía computarizada.
- Calcule el recuento promedio por unidad de célula del tumor sobre el recuento promedio por unidad de célula del hígado normal en cada ROI utilizando una estación de trabajo.
- Calcule la relación TNR usando la siguiente ecuación:

- Utilice la ecuación del modelo de partición en el visualizador de dosis y actividad para la aplicación Y-90 RE (DAVYR) en función de los resultados de los cálculos para obtener la actividad prescrita (Gbq) y la dosis (Gy).
3. Tratamiento de tara Y-90
- Siga el enfoque descrito en el paso 2 y luego realice una angiografía directamente en las arterias irrigadoras de sangre identificadas en el paso 2.1.
- Compare la imagen angiográfica actual con la del paso 2 para confirmar la ubicación de las arterias irrigadoras con mayor precisión.
- Avance el catéter hasta las arterias suministradoras después del cateterismo superselectivo y, a continuación, inyecte las microesferas Y90, con la dosis y la actividad ya calculadas, en las arterias suministradoras.
- En el caso de la TARE Y-90, obtenga tomografías por emisión de positrones/tomografías computarizadas de cuerpo entero desde el tórax hasta justo por encima de la pelvis. Realice la PET-CT utilizando los siguientes parámetros: 80 s a 110 s, 120 kVp, 40 mA, rotación del tubo de 1 s, colimación de corte de 4 mm y una velocidad de lecho de 8 mm/s (es decir, paso, 2).
- Evalúe el TNR a partir de un ROI de volumen dibujado en las imágenes de PET/CT y luego compárelo con un TNR obtenido de las imágenes de SPECT/CT de la distribución de Tc-99m MAA para confirmar la distribución de Y-90.
- Al dispensar e inyectar microesferas Tc-99m MAA e Y-90, use equipo de protección adecuado, como delantales de plomo, protectores oculares y guantes de plomo.
- No realice ningún tratamiento especial después del tratamiento con Y-90 TARE y pida a los pacientes que hayan recibido tratamiento con Y-90 que eviten el contacto cercano con otras personas durante 7 días para minimizar el riesgo de radiación.
4. Tratamiento secuencial con inhibidores de PD-1 después de la terapia con Y90
- Observe la estabilidad de la lesión durante al menos 2 meses después del tratamiento con Y90. Utilice las modalidades de diagnóstico por imágenes adecuadas para un control constante. Vuelva a evaluar al paciente para determinar la presencia de factores de alto riesgo de recurrencia.
- Si se identifican factores de alto riesgo, se debe evaluar la idoneidad del paciente para la inmunoterapia, asegurándose de que no haya contraindicaciones. Seleccione un inhibidor de PD-1 adecuado, como nivolumab o pembrolizumab, en función de las consideraciones financieras del paciente.
- Administrar el inhibidor elegido en 1-2 ciclos, cada uno separado por 21 días. Administrar el inhibidor de PD-1, preparado con 100 mL de solución salina fisiológica a 2 mg/mL, mediante inyección intravenosa periférica en el transcurso de 1 h, completando así un ciclo de terapia con inhibidores de PD-1.
- Evaluación y seguimiento post-tratamiento
- Después de completar la terapia con inhibidores de PD-1, se realizaron estudios de imagen de seguimiento y estudios de marcadores tumorales idénticos a los utilizados antes del tratamiento.
- Evaluar la respuesta mensual del paciente al tratamiento con inhibidores de PD-1 utilizando criterios de evaluación estándar21.
5. Hepatectomía después de la TARE Y90 y el inhibidor de PD-1
- Decisión de hepatectomía: Evaluar el sitio de tratamiento utilizando las mismas técnicas radiológicas aplicadas previamente para evaluar la estabilidad de la lesión durante un mínimo de 2 meses después de la terapia con inhibidores de PD-1, asegurándose de que no haya factores de alto riesgo de recurrencia.
- Preparativos preoperatorios para la hepatectomía: Para definir con precisión los márgenes de resección del tumor e inspeccionar posibles lesiones metastásicas, administre verde de indocianina al paciente 3 días antes de la cirugía.
- Procedimiento quirúrgico
- Realizar la intubación traqueal para anestesia general en el paciente colocado en estado supino. Realizar la desinfección quirúrgica de la región abdominal superior que se extiende superiormente hasta la línea del pezón, inferiormente a la sínfisis púbica y lateralmente a la línea axilar media.
- Al ingresar a la cavidad peritoneal, use un laparoscopio para realizar una inspección minuciosa del hígado y las estructuras circundantes en busca de anomalías o focos metastásicos.
- Elevar el borde inferior del hígado derecho con pinzas para exponer el tumor ubicado en el segmento 6 (S6) del hígado.
- Después de inyectar verde de indocianina por vía intravenosa, cambie al modo de imágenes de fluorescencia para evaluar cuidadosamente la extensión del tumor, asegurándose de que no invada los tejidos adyacentes ni haya adherencias significativas.
- Diseccionar los tejidos conectivos entre el borde inferior del hígado derecho, el peritoneo posterior y el riñón derecho con un bisturí armónico. Progresa disecando superiormente los ligamentos triangulares y coronarios derechos, exponiendo así la segunda porta hepatis.
- Usar pinzas de pico de pato para retraer el hígado hacia la izquierda para exponer completamente el lóbulo derecho.
- Emplee el modo de imágenes de fluorescencia para delinear claramente el margen entre el tumor y el tejido sano adyacente.
- Marque las líneas guía de resección aproximadamente a 1-2 cm del margen del tumor con un gancho de cauterio monopolar.
- Interrumpir temporalmente la entrada vascular de la vena porta y la arteria hepática para reducir el sangrado intraoperatorio. Apriete los torniquetes en ciclos de 15 minutos de oclusión seguidos de 5 minutos de reperfusión.
- Transegüe cuidadosamente el parénquima hepático a lo largo de las líneas guía con el bisturí armónico. Coagule los conductos y vasos biliares pequeños con el bisturí, pinza primero y luego transecte las estructuras más grandes.
- Después de extirpar el espécimen tumoral, envíelo para su evaluación histopatológica.
- Enjuagar la superficie de corte hepática con solución salina normal tibia, seguido de lograr la hemostasia con coagulación bipolar. Use una sutura absorbible para cerrar todas las incisiones. El paciente tuvo una estancia hospitalaria postoperatoria de 10 días. Para el tratamiento del dolor postquirúrgico, administrar Tramadol mediante inyección intramuscular.
- Seguimiento después de la hepatectomía
- Para detectar rápidamente cualquier posible recurrencia postoperatoria o lesiones metastásicas, realice exámenes de seguimiento mensuales durante los primeros 3 meses después de la cirugía. Después de este período, programe exámenes cada 3 meses durante los próximos 2 años y luego cada 6 meses durante los 3 años siguientes, hasta un total de 5 años después de la cirugía.
Resultados
La resonancia magnética reveló una reducción en el volumen del hígado, una superficie hepática ondulada y fisuras hepáticas ensanchadas en los pacientes de este estudio. Se identificó una masa casi esférica, de aproximadamente 7,2 cm x 5,6 cm x 6,6 cm, en el lóbulo posterior derecho del hígado. La masa mostró señales bajas mixtas en imágenes ponderadas en T1 (T1WI), señales altas mixtas en imágenes ponderadas en T2 (T2WI) y señales altas en imágenes ponderadas en difusión (DWI). Presentaba límites claros y realce heterogéneo de la fase arterial, lo que sugiere la posibilidad de cirrosis hepática y CHC (Figura 1).
Durante la maniobra del catéter, se realizó una evaluación angiográfica para confirmar la ausencia de vasos tumorales que se originan en la aorta abdominal, las arterias diafragmáticas y la arteria mesentérica superior. En la angiografía en el origen del tronco celíaco, la rama segmentaria de la arteria hepática derecha (S6 o rama inferior derecha) presentaba una tortuosidad y dilatación pronunciadas. Esta observación estableció que el tumor hepático recibía el suministro vascular exclusivamente de esta rama arterial singular (Figura 2A). Una evaluación previa fundamental para la TARE de Y-90 implica pruebas de mapeo utilizando la perfusión de Tc-99m MAA, explotando la distribución de dosis comparable entre las microesferas de Tc-99m MAA e Y-90. Después de la inyección de Tc-99m MAA, se delineó la zona de perfusión para Tc-99m MAA, con un volumen de perfusión calculado para el tumor objetivo de 246,27 mL (Figura 2A). Los pacientes que muestran una LSF superior al 20% tienen un mayor riesgo de daño pulmonar inducido por la radiación, lo que los convierte en candidatos típicamente inadecuados para el tratamiento conY-90 22. Un TNR elevado significa un efecto tumoricida más potente mientras se adhiere a la dosis máxima permisible de radiación hepática. La LSF calculada se situó en 17,17% y la TNR se registró en 8,2 (Figura 2B).
El modelo de partición, en comparación con los métodos de Dosis de Radiación Interna Médica (MIRD) y Área de Superficie Corporal (BSA), proporciona una estimación superior y personalizada de la dosis de radiación al tener en cuenta el TNR, lo que mejora la planificación individualizada del tratamiento. Los resultados del modelo de partición indican dosis de radiación de 36,6 Gy para el hígado normal (por debajo del umbral de 40 Gy), 17,6 Gy para el tejido pulmonar (dentro del límite de 20 Gy) y una dosis máxima de 300 Gy para el tumor, lo que requiere una actividad de microesferas Y-90 de 1,36 GBq (Figura 3A). Después de la terapia con TARE Y-90 (Figura 3B), se realizó una PET/TC, que no indicó diseminación fuera del objetivo ni discrepancias en la cobertura (Figura 3C).
Al cabo de 1 mes del tratamiento con Y-90 TARE, el tumor se redujo a 6 cm y el nivel de AFP disminuyó a 21.155 ng/mL. A los 3 meses después del tratamiento, el tumor no mostró cambios significativos. Dado el alto riesgo persistente de recurrencia, se inició tratamiento con un inhibidor de PD-1. A los 5 meses después del tratamiento con Y-90 TARE (2 meses después de iniciar el tratamiento con inhibidores de PD-1), la lesión se había reducido aún más a 4 cm, y el nivel de AFP había disminuido drásticamente a 1,84 ng/mL (Figura 4 y Tabla 1).
Se presentan imágenes del tumor durante la hepatectomía tanto con luz blanca como con fluorescencia (Figura 5A). Los especímenes tumorales que se obtuvieron de la hepatectomía se transformaron en secciones congeladas para la patología macroscópica. Cuando se examinaron microscópicamente, no revelaron células tumorales, depósito de microesferas Y-90, infiltración linfocítica significativa y cambios cirróticos en el tejido hepático normal adyacente23 (Figura 5B). A los 12 meses después de la operación, se realizó un seguimiento y una evaluación de la recurrencia, y las imágenes de resonancia magnética no indicaron evidencia de recurrencia o metástasis (Figura 5C).
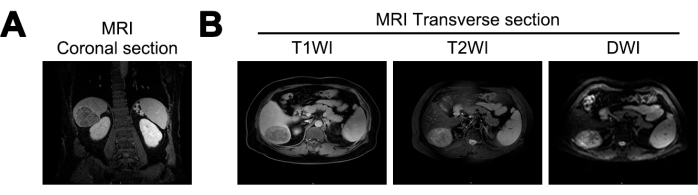
Figura 1: Imágenes por resonancia magnética (RM) en el diagnóstico inicial. (A) Sección coronal de la señal de imágenes ponderadas T1 de resonancia magnética (T1WI), (B) secciones transversales de señales de resonancia magnética T1WI, imágenes ponderadas T2 (T2WI) e imágenes ponderadas de difusión (DWI). Haga clic aquí para ver una versión más grande de esta figura.
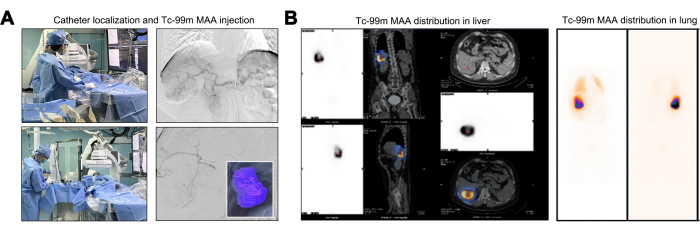
Figura 2: Inyección y distribución de albúmina macroagregada de tecnecio-99m (Tc-99m MAA). (A) Ilustración del proceso de inyección de albúmina macroagregada de tecnecio-99m (Tc-99m MAA). (B) Presentación de la distribución de la dosis de 99mTc MAA en el hígado. Haga clic aquí para ver una versión más grande de esta figura.
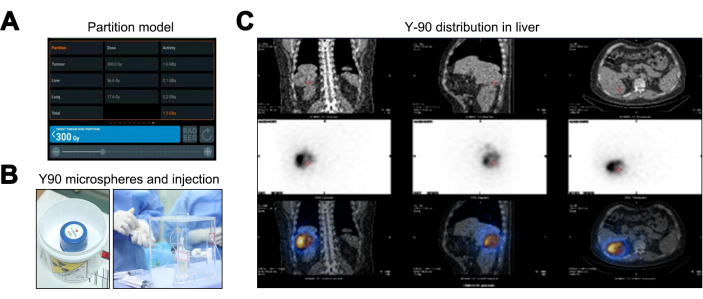
Figura 3: Proceso de tratamiento de la radioembolización transarterial con itrio-90 (Y-90 TARE). (A) Representación de los datos calculados utilizando el modelo de partición. (B) El empaquetamiento e inyección de las microesferas Y-90. (C) Tomografía computarizada por emisión de fotón único/Tomografía computarizada (SPECT/CT) para validar la distribución de la dosis de las microesferas Y-90. Haga clic aquí para ver una versión más grande de esta figura.
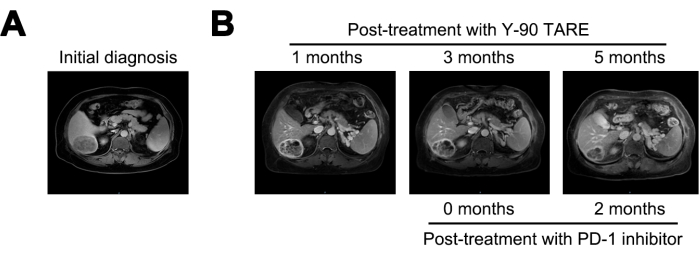
Figura 4: Comparación de tumores. (A) Presentación de la imagen de resonancia magnética en el diagnóstico inicial, mientras que (B) muestra las imágenes de resonancia magnética a 1, 3 y 5 meses después del tratamiento con Y-90 TARE. El tratamiento con inhibidores de la muerte celular programada-1 (PD-1) se realizó 3 meses después de la TARE Y-90. El paciente se sometió a tratamiento con un inhibidor de PD-1 3 meses después del procedimiento de tara Y-90. Haga clic aquí para ver una versión más grande de esta figura.
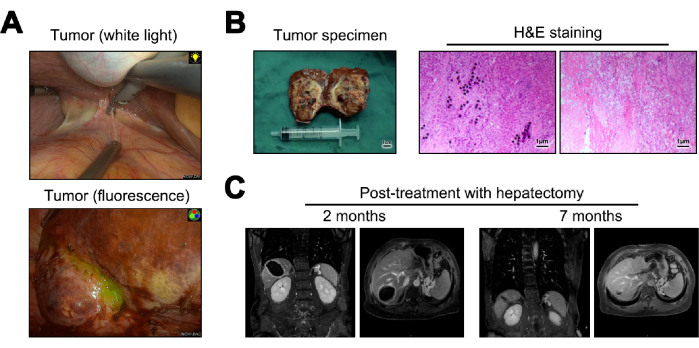
Figura 5: Hepatectomía y seguimiento posterior. (A) Presentación del tumor observada intraoperatoriamente. (B) Ilustración de la muestra tumoral postoperatoria y tinción de hematoxilina y eosina (H&E). (C) Imágenes de resonancia magnética a los 2 y 12 meses después de la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
| Post-tratamiento con Y-90 TARE | |||||
| Diagnóstico inicial | 1 meses | 3 meses | 5 meses | ||
| AFP (ng/mL) | 66840 | 21155 | 19535 | 1.84 | |
Tabla 1: Medición del nivel de AFP después del tratamiento.
Discusión
Para los pacientes con CHC que presentan factores de recurrencia de alto riesgo, el pronóstico adverso persiste incluso después de la hepatectomía curativa, lo que subraya la importancia de una terapia neoadyuvante eficaz para mejorar las tasas de supervivencia24,25. En relación con los tratamientos intervencionistas, Y-90 TARE cuenta con una tasa de control local superior26. Si bien Y-90 TARE puede activar la respuesta antitumoral del cuerpo22, aún no se ha informado sobre el uso combinado de Y-90 con inhibidores de PD-1 en la terapia neoadyuvante para el cáncer de hígado. En este estudio se revisa retrospectivamente un caso de TARE Y-90 neoadyuvante seguido de tratamiento con anticuerpos monoclonales anti-PD-1 en un paciente con CHC con factores de recidiva de alto riesgo que logró una remisión completa. Presenta un protocolo de tratamiento detallado como referencia.
Varios puntos clave en el protocolo de este estudio merecen atención. En primer lugar, dado el potencial de degradación y redistribución de MAA99, las imágenes de SPECT/CT deben realizarse dentro de 1-2 h después de la inyección de MA99. En segundo lugar, es imperativo calcular meticulosamente la dosis de microesferas Y-90 para evitar la colocación ectópica y la dosis excesiva, que podría provocar daño hepático y pulmonar. Por último, considerando la cirugía post-neoadyuvante, puede ser preferible una resección no anatómica que garantice márgenes limpios para acortar la duración quirúrgica y minimizar la inmunosupresión relacionada con la cirugía.
En el presente estudio, el paciente presentó síntomas de trastornos del sueño y estreñimiento después de la terapia neoadyuvante. Estos se abordaron con eszopiclona para los trastornos del sueño y tabletas con recubrimiento entérico de bisacodilo para el estreñimiento. Esto sugiere que las reacciones adversas relacionadas con la tara Y-90 y el inhibidor de PD-1 son mínimas y pueden tratarse farmacológicamente. Además, la TARE Y-90 y el inhibidor de PD-1 no indujeron edema de tejido hepático o lesión, adherencia severa o aumento de la fragilidad, el último de los cuales podría precipitar una hemorragia significativa o una resección incompleta durante la extirpación quirúrgica posterior. En consecuencia, Y-90 TARE no interfirió ni afectó los procedimientos quirúrgicos posteriores.
En función de los niveles de AFP y de los cambios en la lesión, se administró secuencialmente el tratamiento con anticuerpos monoclonales anti-PD-1 tras el tratamiento con Y-90 TARE. A los 5 meses, la lesión alcanzó una respuesta patológica completa (PCR), lo que indica que el momento y la elección del tratamiento fueron adecuados. El ajuste de la estrategia de tratamiento antes de la mediana del período de respuesta en la TARE Y-90 puede reducir eficazmente el riesgo de progresión de la enfermedad27. Sin embargo, aunque el grado de resolución de la lesión se correlaciona de manera evidente con la supervivencia después de la resección del carcinoma hepático28, la justificación de la intervención quirúrgica posterior para los casos de RCp inducida por la TARE Y-90 sigue siendo un tema para investigación adicional. Además, el momento y la dosis óptimos de Y-90 TARE y el tratamiento con anticuerpos monoclonales anti-PD-1, así como el mejor momento y enfoque para la cirugía posterior, aún no se han validado. Además, el alto costo de todo el proceso de tratamiento puede imponer una carga financiera significativa a los pacientes.
En nuestro caso, se postula que la aparición de una RCp tras el tratamiento con tara Y-90 e inhibidores de PD-1 se correlaciona con varios factores en el presente estudio. Inicialmente, se considera la dosis de radiación intratumoral; empleamos una metodología convencional basada en Tc-99m MAA (modelo de partición) para evaluar la dosis de tratamiento Y-9024. En particular, debido al alto TNR del paciente, la dosis de radiación que impregnó la lesión en este estudio fue elevada, con microesferas Y-90 cubriendo completamente el tumor, logrando así un efecto curativo. En segundo lugar, no se puede pasar por alto la importante infiltración de células inmunitarias dentro del tumor, lo que indica un papel fundamental de la inmunidad antitumoral del paciente frente a la pCR. Teniendo en cuenta que este era el diagnóstico inicial del paciente y que el tumor no se encontraba en un estadio avanzado, persistió la inmunidad antitumoral intrínseca. Después de la muerte de las células tumorales inducida por la TARE Y-90 y el inhibidor de PD-1, se puede desencadenar una respuesta inflamatoria que aumenta la exposición al antígeno tumoral, activa la inmunidad antitumoral del huésped y culmina en la infiltración de células inmunitarias y su consecuente acción tumoricida29. Además, nuestra investigación previa discernió una correlación entre la inflamación hepática peritumoral y la resistencia tumoral, lo que podría exacerbar la tolerancia inmune hepática30,31. A pesar de la presencia de alteraciones cirróticas hepáticas en el tejido peritumoral del paciente de este estudio, no se observó una respuesta inflamatoria significativa y todos los exámenes relacionados con la hepatitis B fueron normales. Esto sugiere que el microambiente inmune hepático del paciente pertenece a un subgrupo potencialmente modificable, para el cual la TARE Y-90 y el inhibidor de PD-1 representan una estrategia crucial en la mejora del microambiente inmune hepático.
La implementación del tratamiento con Y-90 TARE requiere condiciones estrictas y esfuerzos de colaboración entre múltiples departamentos, incluidos los de medicina nuclear, radiología intervencionista, cirugía hepatobiliar, imágenes y oncología. La posibilidad de complicaciones inducidas por la radiación, como neumonía, úlceras gástricas y pancreatitis aguda, subraya la necesidad de cálculos meticulosos de la dosis. Las evaluaciones de simulación preoperatoria y las estimaciones de dosis realizadas por el departamento de medicina nuclear pueden prolongar el ciclo de tratamiento de Y90 TARE, lo que podría conducir a la progresión del tumor. Es posible que Y90 TARE no sea adecuado para todos los cánceres de hígado, en particular aquellos con múltiples metástasis intrahepáticas y cánceres de hígado difusos o de diámetro pequeño (<0,5 cm), debido a los desafíos para diferenciar las áreas tumorales del tejido hepático normal, lo que puede llevar a una estimación incorrecta de la dosis. Los informes sobre el uso de Y90 junto con inhibidores de PD-1 para el tratamiento neoadyuvante en el carcinoma hepatocelular son limitados. Todavía se requieren estudios clínicos a gran escala para corroborar su eficacia y detalles terapéuticos.
En resumen, la combinación de Y-90 TARE y un inhibidor de PD-1 presenta un abordaje seguro y eficaz para el tratamiento neoadyuvante de los pacientes con CHC. Esta estrategia no solo alivia la carga tumoral local y minimiza las micrometástasis en la mayor medida posible, sino que también lo hace sin aumentar el riesgo de progresión de la enfermedad. En consecuencia, tiene el potencial de extender el período libre de recurrencia postoperatoria para los pacientes. Ofrecemos un protocolo replicable y factible para el tratamiento neoadyuvante de pacientes con CHC de alto riesgo.
Divulgaciones
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
Este estudio fue financiado por la Fundación Nacional de Ciencias Naturales de China (82303287), la Fundación de Investigación Básica y Básica Aplicada de Guangdong (2021A1515110083), Proyectos de Ciencia y Tecnología en Guangzhou (202201010267), Fondos de Investigación Fundamental para las Universidades Centrales (21621058).
Materiales
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
Referencias
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados