Method Article
Y-90 רדיואמבוליזציה ומעכב PD-1 כטיפול ניאו-אדג'ובנטי בקרצינומה הפטו-תאית
* These authors contributed equally
In This Article
Summary
מחקר זה ממחיש את הפוטנציאל המתודולוגי של שילוב איטריום-90 רדיו-אמבוליזציה טרנס-עורקית (Y-90 TARE) עם נוגדן חד-שבטי נגד PD-1 כאסטרטגיה ניאו-אדג'ובנטית יעילה המובילה לכריתת הכבד בחולי קרצינומה הפטו-תאית (HCC) עם סיכון הישנות ראשוני גבוה. הוא מדגיש את הבטיחות, ההיתכנות וההדרכה הפרוצדורלית שלב אחר שלב של גישה זו.
Abstract
מחקר זה מציג פרוטוקול טיפול מקיף לחולי קרצינומה הפטו-תאית (HCC) בסיכון גבוה, תוך התמקדות בשימוש משולב במעכבי רדיו טרנס-עורקי Y-90 (TARE) ומעכבי מוות תאי מתוכנת-1 (PD-1) כטיפול ניאו-אדג'ובנטי. מודגש באמצעות דוח מקרה, הוא מציע התייחסות צעד אחר צעד להתערבויות טיפוליות דומות. ניתוח רטרוספקטיבי נערך על מטופל שעבר כריתת כבד לאחר טיפול במעכבי Y-90 TARE ו-PD-1. פרטים דמוגרפיים וקליניים מרכזיים נרשמו בעת הקבלה כדי להנחות את בחירת הטיפול. התאמת Y-90 TARE וחישוב המינון התבססו על מבחני מיפוי זלוף אלבומין מקרו-מצטבר (MAA) של Technetium-99m (Tc-99m). כיסוי הנגע על ידי מיקרוספירות Y-90 אושר באמצעות הדמיית היתוך טומוגרפיה ממוחשבת/טומוגרפיה ממוחשבת של פליטת פוטון בודד (SPECT/CT), ותגובות שליליות ותוצאות מעקב תועדו בקפידה. המטופל, עם HCC של 7.2 ס"מ באונה הימנית של הכבד (T1bN0M0, BCLC A, CNLC Ib) ורמת אלפא-פטופרוטאין עוברי (AFP) ראשונית של 66,840 ננוגרם/מ"ל, בחר ב-Y-90 TARE עקב סיכון גבוה להישנות וסירוב ראשוני לניתוח. הפרמטרים של הטיפול, כולל מקטע עיתוק הריאות (LSF) והיחס שאינו גידול (TNR), היו בגבולות הטיפול. בסך הכל ניתנו 1.36 GBq Y-90. חודש לאחר הטיפול, הגידול התכווץ ל-6 ס"מ עם נמק חלקי, ורמות ה-AFP ירדו ל-21,155 ננוגרם/מ"ל, ונותרו יציבות למשך 3 חודשים. לאחר 3 חודשים, טיפול במעכב PD-1 הוביל להפחתה נוספת של הגידול ל-4 ס"מ וירידה ב-AFP ל-1.84 ננוגרם/מ"ל. לאחר מכן המטופל עבר כריתת כבד; היסטופתולוגיה אישרה נמק גידול מלא. לאחר 12 חודשים לאחר הניתוח, לא נצפתה הישנות גידול או גרורות במפגשי מעקב. פרוטוקול זה מדגים את השילוב היעיל של Y-90 TARE ומעכב PD-1 כאסטרטגיית גישור לניתוח עבור חולי HCC בסיכון גבוה להישנות, ומספק מדריך מעשי ליישום גישה זו.
Introduction
קרצינומה של הכבד (HCC) מהווה 85%-90% ממקרי סרטן הכבד הראשוניים ברחבי העולם ומהווה גידול ממאיר שכיח של מערכת העיכול1. הבעיה חמורה עוד יותר בסין, שם HCC מדורגתבמקום הרביעי בשכיחותו של הממאירות והגורם השני המוביל לתמותה הקשורה לסרטן 2,3. אתגר זה מחמיר את שיעור ההישנות הגבוה לאחר כריתת הכבד, שנצפה בתת-קבוצה משמעותית של חולים תוך שנתיים. הישנות זו מתפתחת לעתים קרובות לצורות עמידות לטיפול וממאירות אגרסיביות, מה שמוביל במהירות לתוצאות קטלניות. כתוצאה מכך, הפחתת הישנות לאחר כריתת הכבד היא חיונית להארכת שיעורי ההישרדות בקרב חולי HCC 4,5.
טיפול ניאו-אדג'ובנטי מתייחס למערך מקיף של טיפולים המתבצעים לפני הניתוח, שמטרתם להגביר את קצב ההסרה המלאה של הגידול (כריתת R0), לחסל מחלה מיקרו-גרורתית שאינה נראית בהדמיה, להפחית את הסיכון להישנות לאחר הניתוח ולהאריך את ההישרדות ארוכת הטווח של המטופל6. הוא מתאים במיוחד לחולי HCC המציגים גורמי סיכון גבוהים, כולל כריתה לא אנטומית, פלישה מיקרוסקופית לכלי הדם, רמות AFP מוגברות בסרום העולות על 32 ננוגרם/מ"ל, מידות הגידול הגדולות מ-5 ס"מ, גידולים מרובים ושחמת 7 בסיסית. הרפרטואר של טיפול ניאו-אדג'ובנטי כולל טכניקות שונות כגון כימואמבוליזציה עורקית דרך צנתר (TACE), כימותרפיה בעירוי עורקי כבד (HAIC) וטיפול בקרינה פנימית סלקטיבית (SIRT). אלה משולבים לעתים קרובות עם אימונותרפיות ממוקדות, המיושמות בנפרד או בשילוב8.
איטריום-90 רדיאמבוליזציה טרנס-עורקית (Y-90 TARE), צורה מיוחדת של טיפול בקרינה פנימית סלקטיבית (SIRT), עומדת כאופציה טיפולית משמעותית לסרטן כבד ראשוני שאינו ניתן לניתוח ולגרורות בכבד. Y-90 TARE, הידוע בשיעורי הבקרה המקומיים יוצאי הדופן שלו, מצטיין בהעברת קרינת β ממוקדת במינון גבוה ישירות לאתר הגידול, בעוד שמרחק החדירה הממוצע המוגבל שלו של 2.5 מ"מ בלבד מסייע בהגנה על רקמות בריאות סמוכות9. טיפול בקרינה פנימית סלקטיבית במיקרוספרה Yttrium-90 (90Y-SIRT) נמצא בשימוש קליני בטיפול בממאירות בכבד במשך למעלה מ-50 שנה מאז 1970, עם יישום קליני בקנה מידה גדול שאושר במשך יותר משני עשורים10. בטיחותו ויעילותו הוכחו מאז אישורו באירופה ובארצות הברית במאה הקודמת. רדיותרפיה של איטריום-90 מתבצעת ברחבי העולם מזה כמה עשורים, ומניבה שפע של נתונים קליניים 11,12,13. בנוסף, איטריום-90, יסוד רדיואקטיבי סינתטי הממוקם במקום ה-39 בטבלה המחזורית, פולט קרני בטא בטוהר גבוה עם אנרגיה גבוהה. יש לו זמן מחצית חיים קצר (64.2 שעות) ומרחק חדירת רקמות מוגבל, מה שמבטל את הצורך בבידוד לאחר הניתוח 14,15,16. כמו כן, טכנולוגיית כלי הדם ותוצרי הריקבון אינם מזיקים לגוף האדם15,17. במקביל, נוגדנים חד-שבטיים נגד PD-1 מחדשים את הפוטנציאל הציטוטוקסי של תאי החיסון כנגד תאים סרטניים. עם פרופילים חיסוניים חזקים יותר שנצפו בחולי HCC בשלב מוקדם, מעכבי PD-1 ממונפים יותר ויותר במסגרות ניאו-אדג'ובנטיות. מבחינה תפקודית, נוגדנים חד-שבטיים PD-1 אלה מגבירים את מוות התאים החיסוני הנגרם על ידי Y-90 TARE, ומגבירים את יכולתה של מערכת החיסון לזהות ולחסל תאי גידול. המנגנון של Y-90 ARE כולל הרס ישיר של תאי גידול באמצעות קרינת β, המטפלת בהטרוגניות של הגידול והתחמקות חיסונית, ובכך מגבירה את ההשפעה של נוגדנים חד-שבטיים PD-1. עם זאת, חשוב לציין כי נכון להיום, מחקרים מקיפים על השימוש המשולב במעכבי Y-90 TARE ו-PD-1 בטיפול ניאו-אדג'ובנטי הם נדירים יחסית 18,19,20.
מקרה בוחן זה משמש כמדריך מעשי, המדגים את התהליך, הבטיחות והפוטנציאל של Y-90 TARE בשילוב עם מעכב PD-1 כטיפול ניאו-אדג'ובנטי המוביל לכריתת הכבד. על ידי ביצוע הערכה רטרוספקטיבית של חולה HCC שטופל בטיפול ניאו-אדג'ובנטי זה ואחריו כריתת כבד, אנו מפרטים את השלבים הטיפוליים, מנהלים תופעות לוואי ומעריכים את התוצאות. הממצאים שלנו נועדו לספק תוכנית מקיפה לרופאים ביישום טיפול במעכבי Y-90 TARE ו-PD-1 בניהול חולי HCC בסיכון גבוה.
הצגת מקרה:
החולה, גבר בן 49, היה בגובה 168 ס"מ, שקל 62 ק"ג, ונפח הכבד הכולל (VOI) היה 1236 מ"ל, עם נפח גידול של 157 מ"ל ונפח זלוף גידול יעד של 246 מ"ל. נפח הריאות הכולל היה 2124 מ"ל, עם LSF של 17.17% ו-TNR של 8.2. היה לו HCC בגודל 7.2 ס"מ באונה הימנית של הכבד (T1bN0M0, BCLC A, CNLC Ib) ורמת אלפא-פטו-פרוטאין ראשונית (AFP) של 66,840 ננוגרם/מ"ל. ה-ECOG-PS של המטופל לפני הניתוח (סטטוס ביצועים של קבוצת אונקולוגיה שיתופית מזרחית) קיבל ציון של 0. הוא לא קיבל שום טיפול תרופתי לפני שבחר ב-Y-90 TARE, שנבחר בשל סיכון גבוה להישנות וסירוב ראשוני לניתוח.
Protocol
הליך הטיפול אושר על ידי ועדת הביקורת המוסדית של בית החולים המסונף הראשון של אוניברסיטת ג'ינאן. הסכמה מדעת התקבלה מהמשתתף שנכלל במחקר.
1. בחירת מטופלים לטיפול ניאו-אדג'ובנטי
- קריטריונים להכללה
- בחר חולים עם נגעים הניתנים להשלמת הסרה כירורגית (כריתת R0).
- בחר חולים המציגים גורמי סיכון גבוהים להישנות, כולל כריתה לא אנטומית, פלישה לכלי הדם, רמות AFP מוגברות בסרום העולות על 32 ננוגרם/מ"ל, מידות הגידול הגדולות מ-5 ס"מ, נוכחות של גידולים מרובים ושחמת בסיסית.
- קריטריונים לאי-הכללה
- לא לכלול חולים עם גורמי הישנות בסיכון גבוה הזקוקים לטיפול כירורגי בזמן האבחנה הראשונית. אל תכלול חולים שאינם יכולים להרשות לעצמם טיפול Y90.
2. אינדיקציות Y-90 והערכת מינון
- אנגיוגרפיה DSA לקביעת אספקת דם גידולית
- בקש מהמטופל לשכב על הקרקע לקראת ההליך. בצע חיטוי ועטיפה שגרתיים. יש למרוח תמיסת לידוקאין 4% באופן מקומי באתר ניקוב עורק הירך לצורך הרדמה.
- הקפידו על נהלי שטיפת ידיים שגרתיים, לבשו לבוש כירורגי ולבשו כפפות סטריליות.
- הכנס מחט מיקרו-פנצ'ר לעורק הירך המשותף הימני בטכניקת סלדינגר. עקוב אחר זה עם הנחת נדן המחובר למערכת שטיפה מלוחה.
- לאחר שניקוב עורק הירך ומיקום הצנתר מוצלחים (נצפה דם עורקי אדום בוהק), קדם את הצנתר האנגיוגרפי לתא המטען של הצליאק. אם הדמיה מצביעה על נוכחות של כלי דם המספקים גידול מלבד עורק הכבד, בצע אנגיוגרפיה על העורק המזנטרי העליון, העורק האינפרא-סרעפתי וכו', כדי לזהות כלי הזנה לגידול.
- בצע אנגיוגרפיה במקור תא המטען של הצליאק כדי לקבוע אם הגידול בכבד מסופק אך ורק על ידי ענף בודד של עורק הכבד הימני.
- השתמש בטכניקת מיקרו-צנתר קואקסיאלי לצנתור סופר סלקטיבי בענף התחתון הימני של עורק הכבד הימני. בצע אנגיוגרפיה כדי לאשר את מיקום כלי האספקה.
- טכנציום-99m (Tc-99m) הזרקה והדמיה של MAA
- הזרקת 2 mCi של Tc-99m MAA דרך המיקרו-קטטר לעורקי האספקה.
הערה: הליך זה מתבצע בהתאם להמלצות האיגוד האמריקאי לפיזיקאים ברפואה על נהלי דוזימטריה, הדמיה ואבטחת איכות עבור ברכיתרפיה מיקרוספרית 90Y בטיפול בממאירות בכבד. המינון המומלץ של Tc-99m MAA נקבע על 2-4 mCi (74-148 MBq)16. חשוב לציין כי המינון של Tc-99m MAA הוא קבוע ואינו משתנה בהתאם למשקל המטופל, שטח הגוף או גודל הנגע. - בצע טומוגרפיה ממוחשבת של קרן חרוט (CBCT) כדי לתאר את אזור הגידול הממוקד של התפלגות MAA Tc-99m תוך כבדית. מתאר ידנית את האזור בתצוגות סגיטליות, קורונליות וציריות במהלך השלב העורקי.
- חשב את נפח אזור הגידול הממוקד באמצעות אפשרות מאפייני SEG4 ב-CBCT.
- הזרקת 2 mCi של Tc-99m MAA דרך המיקרו-קטטר לעורקי האספקה.
- חישובי דוזימטריית מיקרוספרה LSF, TNR ו-Y90
- הגדר את פרמטרי מצבי הסריקה (SPECT ו-CT) בסורק ובצע הדמיית SPECT/CT על המטופל תוך 1-2 שעות לאחר עירוי Tc-99m MAA. בחר את פונקציית האיחוי כדי למזג את תמונות ה-SPECT וה-CT כדי לקבוע את התפלגות ה-Tc-99m MAA בכבד, בריאה ובאיברים אחרים.
- חשב את שבר שאנט הריאות (LSF) באמצעות הדמיה מישורית.
- צייר ידנית את אזורי העניין (ROIs), תוך סימון האזורים המובהקים בתוך הכבד והריאות שבהם ניתן להבחין בהתפלגות של Tc-99m MAA בתצוגות הקדמיות והאחוריות של הכבד, הריאה הימנית והריאה השמאלית בתמונות המישוריות. שלב זה מבוצע על ידי טכנולוג לרפואה גרעינית.
הערה: שבר שאנט הריאות (LSF) מייצג את החלק של 99mTc-MAA שעובר מהכבד לשתי הריאות. באמצעות הדמיה מישורית, טכנולוג הרפואה הגרעינית מצייר באופן ידני החזר ROI סביב הכבד והריאות (בנפרד עבור הריאה השמאלית והימנית) הן במבט הקדמי והן במבט האחורי. לאחר מכן מתקבלת תוצאת הספירה עבור כל חלק מתחנת עבודה זו. - חשב את הספירה עבור כל החזר ROI באמצעות תחנת עבודה סטנדרטית לרפואה גרעינית. השתמש בנוסחה:
ספירת ריאות =

- חשב את ה-LSF באמצעות המשוואה:

- צייר ידנית את אזורי העניין (ROIs), תוך סימון האזורים המובהקים בתוך הכבד והריאות שבהם ניתן להבחין בהתפלגות של Tc-99m MAA בתצוגות הקדמיות והאחוריות של הכבד, הריאה הימנית והריאה השמאלית בתמונות המישוריות. שלב זה מבוצע על ידי טכנולוג לרפואה גרעינית.
- חשב את יחס הגידול-כבד הנורמלי (TNR) באמצעות יישום פילוח תלת מימדי (3D) של הדמיית SPECT/CT.
- צייר ידנית החזר ROI בדיד באותו גודל כדי להקיף הן את אזורי הגידול והן את אזורי הכבד הרגילים על סמך פרוסות הטומוגרפיה הממוחשבת.
- חשב את הספירה הממוצעת ליחידת תא של הגידול על פני הספירה הממוצעת ליחידת תא של הכבד הרגיל בכל החזר ROI באמצעות תחנת עבודה.
- חשב את יחס TNR באמצעות המשוואה הבאה:

- השתמש במשוואת מודל המחיצה בוויזואליזציה של המינון והפעילות עבור יישום Y-90 RE (DAVYR) בהתבסס על תוצאות החישובים כדי להשיג את הפעילות שנקבעה (Gbq) והמינון (Gy).
3. טיפול Y-90 TARE
- עקוב אחר הגישה המתוארת בשלב 2 ולאחר מכן בצע אנגיוגרמה ישירות על העורקים המספקים דם שזוהו בשלב 2.1.
- השווה את התמונה האנגיוגרפית הנוכחית לזו משלב 2 כדי לאשר את מיקום העורקים המספקים בצורה מדויקת יותר.
- קדם את הקטטר לעורקי האספקה לאחר צנתור סופר סלקטיבי, ולאחר מכן הזריק את המיקרוספירות Y90, עם המינון והפעילות שכבר חושבו, לעורקי האספקה.
- עבור Y-90 TARE, קבל סריקות PET/CT ייעודיות לכל הגוף מהחזה ועד ממש מעל האגן. בצע PET-CT באמצעות הפרמטרים הבאים: 80 שניות עד 110 שניות, 120 kVp, 40 mA, סיבוב צינור של 1 שניות, קולימציה של פרוסה של 4 מ"מ ומהירות מיטה של 8 מ"מ לשנייה (כלומר, גובה, 2).
- הערך את ה-TNR מ-ROI נפח שצויר על תמונות PET/CT ולאחר מכן השווה אותו ל-TNR שהתקבל מתמונות SPECT/CT של התפלגות Tc-99m MAA כדי לאשר את ההתפלגות של Y-90.
- בעת חלוקה והזרקה של מיקרוספירות Tc-99m MAA ו-Y-90, יש ללבוש ציוד מגן מתאים, כגון סינרי עופרת, מגני עיניים וכפפות עופרת.
- אין לבצע טיפול מיוחד לאחר טיפול Y-90 TARE, ובקש ממטופלים שקיבלו טיפול Y-90 להימנע ממגע קרוב עם אחרים במשך 7 ימים כדי למזער את הסיכון לקרינה.
4. טיפול רציף במעכב PD-1 לאחר טיפול Y90
- יש לשים לב ליציבות הנגע במשך חודשיים לפחות לאחר הטיפול ב-Y90. השתמש בשיטות הדמיה מתאימות לניטור עקבי. הערך מחדש את המטופל כדי לקבוע את נוכחותם של גורמי סיכון גבוהים להישנות.
- אם מזוהים גורמי סיכון גבוהים, הערך את התאמת המטופל לאימונותרפיה, וודא שאין התוויות נגד. בחר מעכב PD-1 מתאים, כמו ניבולומאב או פמברוליזומאב, על סמך השיקולים הכלכליים של המטופל.
- יש לתת את המעכב הנבחר ב-1-2 מחזורים, כל אחד בהפרדה של 21 יום. מתן מעכב PD-1, המוכן באמצעות 100 מ"ל של מי מלח פיזיולוגיים במינון 2 מ"ג/מ"ל, באמצעות הזרקה תוך ורידית היקפית במשך שעה, ובכך להשלים מחזור אחד של טיפול במעכב PD-1.
- הערכה ומעקב לאחר הטיפול
- לאחר השלמת הטיפול במעכב PD-1, מחקרי הדמיה מעקב ומחקרי סמני גידול זהים לאלה ששימשו לפני הטיפול.
- להעריך את התגובה החודשית של המטופל לטיפול במעכב PD-1 באמצעות קריטריוני הערכה סטנדרטיים21.
5. כריתת הכבד בעקבות מעכב Y90 TARE ו- PD-1
- החלטה לכריתת הכבד: העריכו את אתר הטיפול באמצעות אותן טכניקות רדיולוגיות שיושמו בעבר כדי להעריך את יציבות הנגע למשך חודשיים לפחות לאחר הטיפול במעכב PD-1, תוך הקפדה על היעדר גורמי סיכון גבוהים להישנות.
- הכנות טרום ניתוחיות לכריתת כבד: כדי להגדיר במדויק את שולי כריתת הגידול ולבדוק אם יש נגעים גרורתיים אפשריים, יש לתת אינדוציאנין ירוק למטופל 3 ימים לפני הניתוח.
- הליך כירורגי
- בצע אינטובציה של קנה הנשימה להרדמה כללית על המטופל הממוקם במצב שכיבה. בצע חיטוי כירורגי לאזור הבטן העליונה המשתרע בצורה עליונה לקו הפטמה, נחות לסימפיזה של הערווה, ולרוחב לקו אמצע בית השחי.
- עם הכניסה לחלל הצפק, השתמש בלפרוסקופ כדי לבצע בדיקה יסודית של הכבד והמבנים שמסביב לאיתור חריגות או מוקדים גרורתיים.
- הרם את הגבול התחתון של הכבד הימני בעזרת אוחזים כדי לחשוף את הגידול הממוקם במקטע 6 (S6) של הכבד.
- לאחר הזרקת אינדוציאנין ירוק תוך ורידי, עבור למצב הדמיה פלואורסצנטית כדי להעריך בזהירות את היקף הגידול, ולהבטיח שלא תהיה פלישה לרקמות סמוכות או הידבקויות משמעותיות.
- נתח את רקמות החיבור בין הגבול התחתון של הכבד הימני, הצפק האחורי והכליה הימנית באמצעות אזמל הרמוני. התקדמות מנתחת בצורה מעולה את הרצועות המשולשות והכליליות הימניות, ובכך חושפת את הפורטה הפטיס השני.
- שימוש במלקחיים של ברווז כדי למשוך את הכבד שמאלה כדי לחשוף את האונה הימנית במלואה.
- השתמש במצב הדמיה פלואורסצנטי כדי לתחום בבירור את השוליים בין הגידול לרקמה הבריאה הסמוכה.
- סמן את קווי הנחיית הכריתה כ-1-2 ס"מ משולי הגידול באמצעות וו צריבה חד קוטבי.
- להפסיק באופן זמני את זרימת כלי הדם מווריד הפורטל ועורק הכבד כדי להפחית דימום תוך ניתוחי. הדק את חוסמי העורקים במחזורים של חסימה של 15 דקות ואחריו עירוי חוזר של 5 דקות.
- העבר בזהירות את פרנכימת הכבד לאורך קווי ההנחיה עם האזמל ההרמוני. לקרש צינורות מרה וכלים קטנים בעזרת האזמל, להדק תחילה ואז לחצות מבנים גדולים יותר.
- לאחר כריתת דגימת הגידול, שלח אותה להערכה היסטופתולוגית.
- שטפו את משטח החיתוך בכבד במי מלח רגילים חמים, ולאחר מכן השגת המוסטזיס עם קרישה דו קוטבית. השתמש בתפר נספג כדי לסגור את כל החתכים. המטופל שהה בבית חולים לאחר הניתוח במשך 10 ימים. לטיפול בכאב לאחר הניתוח, יש לתת טרמדול באמצעות הזרקה תוך שרירית.
- פוסט המשך כריתת הכבד
- כדי לזהות באופן מיידי כל הישנות פוטנציאלית לאחר הניתוח או נגעים גרורתיים, בצע בדיקות מעקב מדי חודש במשך 3 החודשים הראשונים לאחר הניתוח. לאחר תקופה זו, קבעו בדיקות כל 3 חודשים במשך השנתיים הבאות ולאחר מכן כל 6 חודשים במשך 3 השנים הבאות, עד לסך הכל 5 שנים לאחר הניתוח.
תוצאות
MRI חשף ירידה בנפח הכבד, משטח כבד גלי וסדקים מורחבים בכבד של חולים במחקר זה. גוש כמעט כדורי, בגודל של כ-7.2 ס"מ על 5.6 ס"מ על 6.6 ס"מ, זוהה באונה האחורית הימנית של הכבד. המסה הציגה אותות נמוכים מעורבים בהדמיה משוקללת T1 (T1WI), אותות גבוהים מעורבים בהדמיה משוקללת T2 (T2WI) ואותות גבוהים בהדמיה משוקללת דיפוזיה (DWI). הוא הציג גבולות ברורים ושיפור הטרוגני של פאזה עורקית, מה שמרמז על אפשרות של שחמת כבד ו-HCC (איור 1).
במהלך תמרון הצנתר, בוצעה הערכה אנגיוגרפית כדי לאשר את היעדרם של כלי הזנה לגידול שמקורם באבי העורקים הבטני, עורקי הסרעפת והעורק המזנטרי העליון. באנגיוגרפיה במקור גזע הצליאק, הענף הסגמנטלי של עורק הכבד הימני (S6 או הענף התחתון הימני) הראה פיתול והתרחבות בולטים. תצפית זו קבעה שהגידול בכבד קיבל אספקת כלי דם אך ורק מענף עורקי יחיד זה (איור 2A). הערכה מוקדמת בסיסית עבור Y-90 TARE כוללת בדיקות מיפוי באמצעות זלוף Tc-99m MAA, תוך ניצול התפלגות המינון המקבילה בין מיקרוספירות Tc-99m MAA ו-Y-90. לאחר הזרקת MAA של Tc-99m, אזור הזלוף עבור Tc-99m MAA תוחום, כאשר נפח הזלוף המחושב עבור גידול המטרה הוא 246.27 מ"ל (איור 2A). חולים המפגינים LSF גדול מ-20% נמצאים בסיכון מוגבר לנזק ריאתי הנגרם על ידי קרינה, מה שהופך אותם בדרך כלל למועמדים לא מתאימים לטיפול ב-Y-9022. TNR מוגבר מסמל אפקט קוטל גידול חזק יותר תוך הקפדה על מינון הקרנת הכבד המקסימלי המותר. ה-LSF המחושב עמד על 17.17%, וה-TNR נרשם על 8.2 (איור 2B).
מודל המחיצה, בהשוואה לשיטות מינון קרינה פנימית רפואית (MIRD) ושטח פנים גוף (BSA), מספק הערכת מינון קרינה מותאמת אישית מעולה על ידי שקלול ה-TNR, ומשפר את תכנון הטיפול האישי. תוצאות מודל החלוקה מצביעות על מינוני קרינה של 36.6 Gy לכבד תקין (מתחת לסף 40 Gy), 17.6 Gy לרקמת הריאה (בגבול 20 Gy) ומינון שיא של 300 Gy לגידול, מה שמחייב פעילות מיקרוספרה Y-90 של 1.36 GBq (איור 3A). לאחר טיפול TARE Y-90 (איור 3B), בוצעה סריקת PET/CT, המצביעה על כך שלא התפשטו מחוץ למטרה או פערי כיסוי (איור 3C).
חודש לאחר הטיפול ב-Y-90 TARE, הגידול הצטמצם ל-6 ס"מ, ורמת ה-AFP ירדה ל-21,155 ננוגרם/מ"ל. לאחר 3 חודשים לאחר הטיפול, הגידול לא הראה שינויים משמעותיים. בהתחשב בסיכון הגבוה המתמשך להישנות, החל טיפול במעכב PD-1. לאחר 5 חודשים לאחר הטיפול ב-Y-90 TARE (חודשיים לאחר תחילת הטיפול במעכב PD-1), הנגע ירד עוד יותר ל-4 ס"מ, ורמת ה-AFP ירדה באופן דרמטי ל-1.84 ננוגרם/מ"ל (איור 4 וטבלה 1).
מוצגות תמונות של הגידול במהלך כריתת הכבד הן באור לבן והן באור פלואורסצנטי (איור 5A). דגימות הגידול שהתקבלו מכריתת הכבד הפכו לחלקים קפואים לפתולוגיה גסה. כאשר נבדקו מיקרוסקופית, הם לא גילו תאי גידול, שקיעה של מיקרוספירות Y-90, חדירה לימפוציטית משמעותית ושינויים בשחמת ברקמת הכבד הרגילה הסמוכה23 (איור 5B). לאחר 12 חודשים לאחר הניתוח, נערך מעקב והערכה להישנות המחלה, כאשר הדמיית MRI לא הצביעה על עדות להישנות או גרורות (איור 5C).
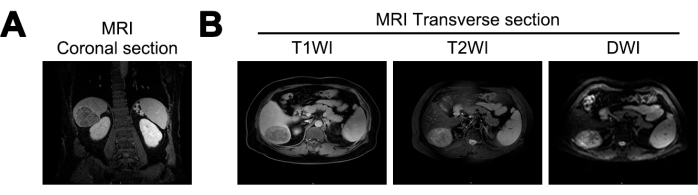
איור 1: הדמיית תהודה מגנטית (MRI) באבחון הראשוני. (A) חתך קורונלי של אות MRI T1 Weighted Imaging (T1WI), (B) מקטעים רוחביים של אותות MRI T1WI, T2 Weighted Imaging (T2WI) ו-Diffusion Weighted Imaging (DWI). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
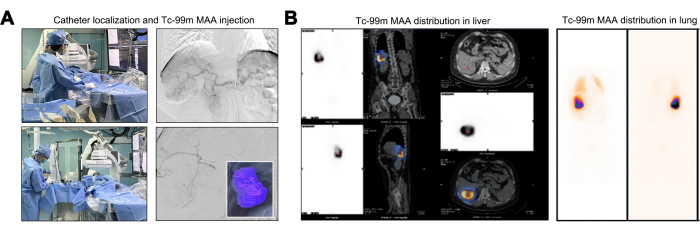
איור 2: הזרקה והפצה של אלבומין מקרו-מצטבר של טכנציום-99m (Tc-99m MAA). (A) איור של תהליך ההזרקה של אלבומין מקרו-מצטבר Technetium-99m (Tc-99m MAA). (B) הצגת התפלגות המינון של 99mTc MAA בכבד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
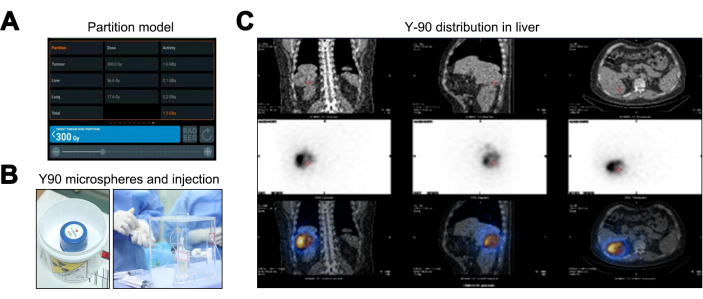
איור 3: תהליך הטיפול ב-Yttrium-90 Transarterial Radioembolization (Y-90 TARE). (א) תיאור הנתונים המחושבים באמצעות מודל המחיצה. (ב) האריזה וההזרקה של המיקרוספירות Y-90. (C) טומוגרפיה ממוחשבת/טומוגרפיה ממוחשבת של פליטת פוטון יחיד (SPECT/CT) כדי לאמת את התפלגות המינון של המיקרוספירות Y-90. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
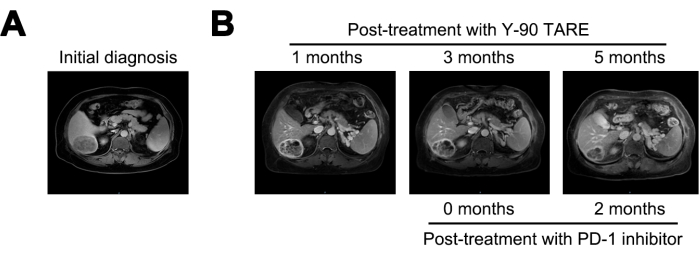
איור 4: השוואת גידולים. (A) הצגת תמונת ה-MRI באבחנה הראשונית, בעוד ש- (B) מציגה את תמונות ה-MRI לאחר 1, 3 ו-5 חודשים לאחר הטיפול ב-Y-90 TARE. טיפול במעכב מוות תאי מתוכנת-1 (PD-1) בוצע 3 חודשים לאחר Y-90 TARE. המטופל עבר טיפול במעכב PD-1 3 חודשים לאחר הליך Y-90 TARE. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
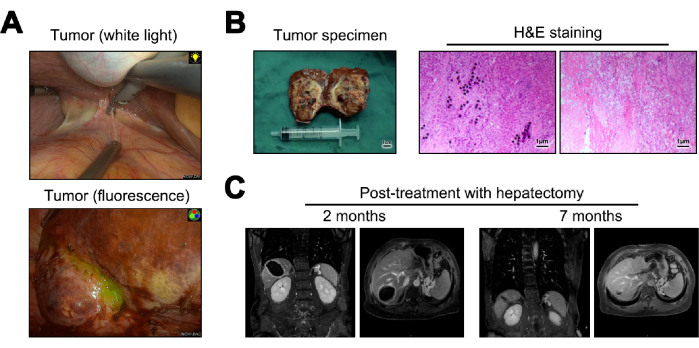
איור 5: כריתת כבד ומעקב לאחר מכן. (A) הצגת הגידול שנצפתה תוך כדי ניתוח. (B) איור של דגימת הגידול שלאחר הניתוח וצביעה של המטוקסילין ואאוזין (H&E). (C) תמונות MRI ב-2 ו-12 חודשים לאחר הניתוח. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| לאחר טיפול ב-Y-90 TARE | |||||
| אבחון ראשוני | 1 חודשים | 3 חודשים | 5 חודשים | ||
| AFP (ng/mL) | 66840 | 21155 | 19535 | 1.84 | |
טבלה 1: מדידת רמת AFP לאחר הטיפול.
Discussion
עבור חולי HCC המציגים גורמי הישנות בסיכון גבוה, פרוגנוזה שלילית נמשכת גם לאחר כריתת כבד מרפאת, מה שמדגיש את החשיבות של טיפול ניאו-אדג'ובנטי יעיל לשיפור שיעורי ההישרדות24,25. יחסית לטיפולים התערבותיים, Y-90 TARE מתהדר בשיעור שליטה מקומי מעולה26. בעוד ש-Y-90 TARE יכול להפעיל את התגובה האנטי-גידולית של הגוף22, השימוש המשולב ב-Y-90 עם מעכבי PD-1 בטיפול ניאו-אדג'ובנטי לסרטן הכבד עדיין לא דווח. מחקר זה סוקר רטרוספקטיבית מקרה של Y-90 TARE ניאו-אדג'ובנטי ואחריו טיפול בנוגדנים חד שבטיים נגד PD-1 בחולה HCC עם גורמי הישנות בסיכון גבוה שהשיג הפוגה מלאה. הוא מציג פרוטוקול טיפול מפורט לעיון.
מספר נקודות מפתח בפרוטוקול של מחקר זה ראויות לתשומת לב. ראשית, בהתחשב בפוטנציאל לפירוק והפצה מחדש של MAA99, יש לבצע הדמיית SPECT/CT תוך 1-2 שעות לאחר הזרקת MA99. שנית, חובה לחשב בקפידה את המינון של מיקרוספירות Y-90 כדי למנוע מיקום חוץ רחמי ומינון מוגזם, שעלול להוביל לנזק לכבד ולריאות. לבסוף, בהתחשב בניתוח פוסט-ניאו-אדג'ובנטי, כריתה לא אנטומית המבטיחה שוליים ברורים עשויה להיות עדיפה כדי לקצר את משך הניתוח ולמזער את הדיכוי החיסוני הקשור לניתוח.
במחקר הנוכחי, המטופל הראה תסמינים של הפרעות שינה ועצירות בעקבות טיפול ניאו-אדג'ובנטי. אלה טופלו באמצעות אסופיקלון להפרעות שינה וטבליות ביסקודיל אנטרי לעצירות. זה מצביע על כך שתגובות שליליות הקשורות ל-Y-90 TARE ומעכב PD-1 הן מינימליות וניתנות לניהול תרופתי. יתר על כן, מעכב Y-90 TARE ו-PD-1 לא גרמו לרקמת כבד או בצקת נגעים, הידבקות חמורה או שבריריות מוגברת, שהאחרונה עלולה לזרז דימום משמעותי או כריתה לא מלאה במהלך הסרה כירורגית לאחר מכן. כתוצאה מכך, Y-90 TARE לא הפריע או השפיע על הליכים כירורגיים לאחר מכן.
בהתבסס על רמות ה-AFP והשינויים בנגע, נתנו ברצף טיפול בנוגדנים חד-שבטיים נגד PD-1 לאחר Y-90 TARE. לאחר 5 חודשים, הנגע השיג תגובה פתולוגית מלאה (pCR), מה שמצביע על כך שהעיתוי ובחירת הטיפול היו מתאימים. התאמת אסטרטגיית הטיפול לפני תקופת התגובה החציונית ב-Y-90 TARE יכולה להפחית ביעילות את הסיכון להתקדמות המחלה27. עם זאת, למרות שמידת רזולוציית הנגע נמצאת בקורלציה בולטת עם הישרדות לאחר כריתת קרצינומה של הכבד28, האם יש צורך בהתערבות כירורגית לאחר מכן במקרים של pCR המושרה על ידי Y-90 TARE נותרה נושא למחקר נוסף. חוץ מזה, התזמון והמינון האופטימליים של Y-90 TARE וטיפול בנוגדנים חד שבטיים נגד PD-1, כמו גם התזמון והגישה הטובים ביותר לניתוח הבא, עדיין צריכים להיות מאומתים יותר. בנוסף, העלות הגבוהה של כל תהליך הטיפול עלולה להטיל נטל כספי משמעותי על המטופלים.
ההנחה היא שהתרחשות של pCR לאחר טיפול במעכבי Y-90 TARE ו-PD-1 במקרה שלנו כמתאמת למספר גורמים במחקר הנוכחי. בתחילה, נלקח בחשבון מינון הקרינה התוך-גידולית; השתמשנו במתודולוגיה קונבנציונלית המבוססת על Tc-99m MAA (מודל חלוקה) להערכת מינון הטיפול Y-9024. יש לציין כי בשל ה-TNR הגבוה של המטופל, מינון הקרינה שחלחל לנגע במחקר זה היה גבוה, כאשר מיקרוספירות Y-90 כיסו את הגידול באופן מקיף, ובכך השיגו אפקט מרפא. שנית, לא ניתן להתעלם מחדירת תאים חיסוניים משמעותית בתוך הגידול, המעידה על תפקיד מרכזי של החסינות האנטי-גידולית של המטופל כלפי pCR. בהתחשב בכך שזו הייתה האבחנה הראשונית של המטופל והגידול לא היה בשלב מתקדם, החסינות האנטי-גידולית הפנימית נמשכה. לאחר מוות של תאי גידול הנגרם על ידי מעכב Y-90 TARE ו-PD-1, עלולה להיווצר תגובה דלקתית, להגביר את החשיפה לאנטיגן הגידול, להפעיל חסינות נגד גידול המארח, ולהגיע לשיא בחדירת תאי חיסון וכתוצאה מכך פעולתו קוטל הגידול29. בנוסף, המחקר הקודם שלנו הבחין במתאם בין דלקת כבד פרי-גידולית ועמידות לגידול, מה שעלול להחמיר את הסבילות החיסונית של הכבד30,31. למרות ששינויים בשחמת הכבד היו נוכחים ברקמה הפריטומלית של המטופל במחקר זה, לא נצפתה תגובה דלקתית משמעותית, וכל הבדיקות הקשורות להפטיטיס B לא היו יוצאות דופן. זה מצביע על כך שהמיקרו-סביבה החיסונית של הכבד של המטופל שייכת לתת-קבוצה הניתנת לשינוי, שעבורה Y-90 TARE ומעכב PD-1 מייצגים אסטרטגיה מכרעת בשיפור המיקרו-סביבה החיסונית של הכבד.
יישום הטיפול ב-Y-90 TARE מחייב תנאים מחמירים ומאמצים משותפים במספר מחלקות, כולל רפואה גרעינית, רדיולוגיה התערבותית, ניתוחי כבד, הדמיה ואונקולוגיה. הפוטנציאל לסיבוכים הנגרמים על ידי קרינה כגון דלקת ריאות, כיבי קיבה ודלקת לבלב חריפה מדגיש את הצורך בחישובי מינון קפדניים. הערכות סימולציה לפני הניתוח והערכות מינון שנערכו על ידי המחלקה לרפואה גרעינית יכולות להאריך את מחזור הטיפול Y90 TARE, מה שעלול להוביל להתקדמות הגידול. Y90 TARE עשוי שלא להתאים לכל סוגי סרטן הכבד, במיוחד אלה עם גרורות תוך כבדיות מרובות וסרטן כבד מפושט או בקוטר קטן (<0.5 ס"מ), עקב אתגרים בהבחנה בין אזורי גידול לרקמת כבד רגילה, מה שעלול להוביל להערכת מינון שגויה. הדיווחים על השימוש ב-Y90 בשילוב עם מעכבי PD-1 לטיפול ניאו-אדג'ובנטי בקרצינומה של הכבד מוגבלים. עדיין נדרשים מחקרים קליניים בקנה מידה גדול כדי לבסס את יעילותו ואת פרטיו הטיפוליים.
לסיכום, השילוב של Y-90 TARE ומעכב PD-1 מציג גישה בטוחה ויעילה לטיפול ניאו-אדג'ובנטי בחולי HCC. אסטרטגיה זו לא רק מקלה על עומס הגידול המקומי וממזערת מיקרו-גרורות ככל האפשר, אלא גם עושה זאת מבלי להגדיל את הסיכון להתקדמות המחלה. כתוצאה מכך, הוא טומן בחובו פוטנציאל להאריך את התקופה ללא הישנות לאחר הניתוח עבור המטופלים. אנו מציעים פרוטוקול בר שכפול ואפשרי לטיפול ניאו-אדג'ובנטי בחולים עם HCC בסיכון גבוה.
Disclosures
המחברים מצהירים כי המחקר נערך בהיעדר קשרים מסחריים או פיננסיים כלשהם שיכולים להתפרש כניגוד אינטרסים פוטנציאלי.
Acknowledgements
מחקר זה מומן על ידי הקרן הלאומית למדעי הטבע של סין (82303287), קרן המחקר הבסיסי והיישומי של גואנגדונג (2021A1515110083), פרויקטים של מדע וטכנולוגיה בגואנגג'ואו (202201010267), קרנות מחקר בסיסיות לאוניברסיטאות המרכזיות (21621058).
Materials
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
References
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved