Method Article
Radioembolizzazione con ittrio-90 e inibitore di PD-1 come trattamento neoadiuvante nel carcinoma epatocellulare
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo studio illustra il potenziale metodologico della combinazione di radioembolizzazione trans-arteriosa con ittrio-90 (Y-90 TARE) con un anticorpo monoclonale anti-PD-1 come efficace strategia neoadiuvante che porta all'epatectomia nei pazienti con carcinoma epatocellulare (HCC) con un alto rischio di recidiva iniziale. Sottolinea la sicurezza, la fattibilità e la guida procedurale passo dopo passo di questo approccio.
Abstract
Questo studio presenta un protocollo di trattamento completo per i pazienti con carcinoma epatocellulare (HCC) ad alto rischio, concentrandosi sull'uso combinato della radioembolizzazione transarteriosa con ittrio-90 (TARE) e degli inibitori della morte cellulare programmata-1 (PD-1) come terapia neoadiuvante. Evidenziato attraverso un case report, offre un riferimento passo dopo passo per interventi terapeutici simili. È stata condotta un'analisi retrospettiva su un paziente sottoposto a epatectomia dopo il trattamento con Y-90 TARE e inibitore di PD-1. I principali dettagli demografici e clinici sono stati registrati al momento del ricovero per guidare la selezione della terapia. L'idoneità e il calcolo del dosaggio di Y-90 TARE si sono basati sui test di mappatura della perfusione dell'albumina macroaggregata (MAA) del tecnezio-99m (Tc-99m). La copertura della lesione da parte delle microsfere di ittrio-90 è stata confermata attraverso l'imaging a fusione con tomografia computerizzata a emissione di fotoni singoli/tomografia computerizzata (SPECT/CT) e le reazioni avverse e gli esiti del follow-up sono stati meticolosamente documentati. Il paziente, con un HCC di 7,2 cm nel lobo epatico destro (T1bN0M0, BCLC A, CNLC Ib) e un livello iniziale di alfa-fetoproteina (AFP) di 66.840 ng/mL, ha optato per l'ittrio-90 TARE a causa dell'elevato rischio di recidiva e del rifiuto iniziale dell'intervento chirurgico. I parametri della terapia, tra cui la frazione di shunt polmonare (LSF) e il rapporto non tumorale (TNR), rientravano nei limiti terapeutici. È stato somministrato un totale di 1,36 GBq di Y-90. A 1 mese dalla terapia, il tumore si è ridotto a 6 cm con necrosi parziale e i livelli di AFP sono scesi a 21.155 ng/mL, rimanendo stabili per 3 mesi. Dopo 3 mesi, il trattamento con inibitore di PD-1 ha portato a un'ulteriore riduzione del tumore a 4 cm e a una diminuzione dell'AFP a 1,84 ng/mL. Il paziente è stato quindi sottoposto a epatectomia; L'istopatologia ha confermato la necrosi completa del tumore. A 12 mesi dall'intervento chirurgico, non è stata osservata alcuna recidiva o metastasi del tumore nelle sessioni di follow-up. Questo protocollo dimostra l'efficace combinazione di Y-90 TARE e inibitore di PD-1 come strategia ponte verso la chirurgia per i pazienti con HCC ad alto rischio di recidiva, fornendo una guida pratica per l'implementazione di questo approccio.
Introduzione
Il carcinoma epatocellulare (HCC) rappresenta l'85%-90% dei casi di cancro al fegato primario in tutto il mondo ed è un tumore maligno prevalente dell'apparato digerente1 . Il problema è ancora peggiore in Cina, dove l'HCC si classifica come il 4° tumoremaligno più comune e la seconda causa di mortalità correlata al cancro 2,3. Ad aggravare questa sfida c'è l'alto tasso di recidiva post-epatectomia, osservato in un sottogruppo significativo di pazienti entro 2 anni. Queste recidive spesso evolvono in forme terapeuticamente resistenti e aggressivamente maligne, portando rapidamente a esiti fatali. Di conseguenza, mitigare la recidiva post-epatectomia è fondamentale per prolungare i tassi di sopravvivenza tra i pazienti con HCC 4,5.
La terapia neoadiuvante si riferisce a una serie completa di trattamenti condotti prima dell'intervento chirurgico, volti ad aumentare il tasso di rimozione completa del tumore (resezione R0), eliminare la malattia micrometastatica non visibile all'imaging, ridurre il rischio di recidiva postoperatoria e prolungare la sopravvivenza a lungo termine del paziente6. È particolarmente appropriato per i pazienti con HCC che presentano fattori di rischio elevati, tra cui resezione non anatomica, invasione vascolare microscopica, livelli sierici elevati di AFP superiori a 32 ng/mL, dimensioni del tumore superiori a 5 cm, tumori multipli e cirrosi sottostante7. Il repertorio della terapia neoadiuvante comprende varie tecniche come la chemioembolizzazione arteriosa transcatetere (TACE), la chemioterapia per infusione arteriosa epatica (HAIC) e la radioterapia interna selettiva (SIRT). Questi sono spesso integrati con immunoterapie mirate, applicate singolarmente o in combinazione8.
La radioembolizzazione trans-arteriosa con ittrio-90 (Y-90 TARE), una forma specializzata di radioterapia interna selettiva (SIRT), rappresenta un'opzione terapeutica significativa per i tumori epatici primari inoperabili e le metastasi epatiche. Rinomato per i suoi eccezionali tassi di controllo locale, Y-90 TARE eccelle nell'erogazione mirata di radiazioni β ad alte dosi direttamente nel sito del tumore, mentre la sua limitata distanza media di penetrazione di soli 2,5 mm aiuta a proteggere i tessuti sani adiacenti9. La radioterapia interna selettiva con microsfere di ittrio-90 (90Y-SIRT) è stata utilizzata clinicamente nel trattamento delle neoplasie epatiche per oltre 50 anni dal 1970, con applicazioni cliniche su larga scala confermate per più di due decenni10. La sua sicurezza ed efficacia sono state confermate dalla sua approvazione in Europa e negli Stati Uniti nel secolo scorso. La radioterapia con ittrio-90 è stata condotta a livello internazionale per diversi decenni, producendo abbondanti dati clinici 11,12,13. Inoltre, l'ittrio-90, un elemento radioattivo sintetico posizionato al 39° posto nella tavola periodica, emette raggi beta di elevata purezza con alta energia. Ha una breve emivita (64,2 ore) e una distanza di penetrazione tissutale limitata, eliminando la necessità di isolamento post-operatorio 14,15,16. Inoltre, la tecnologia vascolare e i prodotti di decomposizione sono innocui per il corpo umano15,17. Allo stesso tempo, gli anticorpi monoclonali anti-PD-1 ringiovaniscono il potenziale citotossico delle cellule immunitarie contro le cellule tumorali. Con profili immunitari più robusti osservati nei pazienti con HCC in stadio iniziale, gli inibitori di PD-1 vengono sempre più sfruttati in contesti neoadiuvanti. Dal punto di vista funzionale, questi anticorpi monoclonali PD-1 potenziano la morte cellulare immunogenica indotta da Y-90 TARE, aumentando la capacità del sistema immunitario di riconoscere ed eliminare le cellule tumorali. Il meccanismo di Y-90 TARE prevede la distruzione diretta delle cellule tumorali attraverso la β-radioterapia, che affronta l'eterogeneità tumorale e l'evasione immunitaria, aumentando così l'impatto degli anticorpi monoclonali PD-1. Tuttavia, è importante notare che, allo stato attuale, gli studi completi sull'uso combinato di Y-90 TARE e inibitori di PD-1 nella terapia neoadiuvante sono relativamente scarsi 18,19,20.
Questo caso di studio funge da guida pratica, dimostrando il processo, la sicurezza e il potenziale di Y-90 TARE combinato con l'inibitore di PD-1 come terapia neoadiuvante che porta all'epatectomia. Conducendo una valutazione retrospettiva di un paziente con HCC trattato con questa terapia neoadiuvante seguita da epatectomia, dettagliamo le fasi terapeutiche, gestiamo gli eventi avversi e valutiamo i risultati. I nostri risultati mirano a fornire un modello completo per i medici nell'applicazione della terapia con Y-90 TARE e inibitori di PD-1 nella gestione dei pazienti con HCC ad alto rischio.
PRESENTAZIONE DEL CASO:
Il paziente, un uomo di 49 anni, era alto 168 cm, pesava 62 kg e aveva un volume epatico totale (VOI) di 1236 ml, con un volume tumorale di 157 ml e un volume di perfusione tumorale target di 246 ml. Il volume polmonare totale era di 2124 ml, con un LSF del 17,17% e un TNR di 8,2. Aveva un HCC di 7,2 cm di dimensione nel lobo epatico destro (T1bN0M0, BCLC A, CNLC Ib) e un livello iniziale di alfa-fetoproteina (AFP) di 66.840 ng/mL. L'ECOG-PS (Eastern Cooperative Oncology Group Performance Status) preoperatorio del paziente è stato valutato a 0. Non aveva ricevuto alcun trattamento farmacologico prima di optare per l'it-90 TARE, che è stato scelto a causa di un alto rischio di recidiva e del rifiuto iniziale dell'intervento chirurgico.
Protocollo
La procedura di trattamento è stata approvata dal comitato di revisione istituzionale del primo ospedale affiliato dell'Università di Jinan. Il consenso informato è stato ottenuto dal partecipante incluso nello studio.
1. Selezione dei pazienti per la terapia neoadiuvante
- Criteri di inclusione
- Selezionare i pazienti con lesioni suscettibili di rimozione chirurgica completa (resezione R0).
- Selezionare i pazienti che presentano fattori ad alto rischio di recidiva, tra cui resezione non anatomica, invasione vascolare, livelli sierici elevati di AFP superiori a 32 ng/mL, dimensioni del tumore superiori a 5 cm, presenza di tumori multipli e cirrosi sottostante.
- Criteri di esclusione
- Escludere i pazienti con fattori di recidiva ad alto rischio che richiedono un trattamento chirurgico al momento della diagnosi iniziale. Escludere i pazienti che non possono permettersi il trattamento con Y90.
2. Indicazioni e valutazione della dose di Y-90
- Angiografia DSA per determinare l'afflusso di sangue tumorale
- Chiedi al paziente di sdraiarsi supino per la procedura. Eseguire la disinfezione e il drappeggio di routine. Applicare una soluzione di lidocaina al 4% localmente nel sito di puntura dell'arteria femorale per l'anestesia.
- Attenersi alle procedure di routine per il lavaggio delle mani, indossare indumenti chirurgici e indossare guanti sterili.
- Inserire un ago per micropuntura nell'arteria femorale comune destra utilizzando la tecnica di Seldinger. Seguire questo con il posizionamento di una guaina collegata a un sistema di lavaggio salino.
- Una volta che la puntura dell'arteria femorale e il posizionamento del catetere hanno avuto successo (si osserva sangue arterioso rosso vivo), far avanzare il catetere angiografico fino al tronco celiaco. Se l'imaging suggerisce la presenza di vasi tumorali diversi dall'arteria epatica, eseguire un'angiografia sull'arteria mesenterica superiore, sull'arteria infradiaframmatica, ecc., per identificare eventuali vasi che alimentano il tumore.
- Condurre un'angiografia all'origine del tronco celiaco per determinare se il tumore epatico è fornito esclusivamente da un ramo solitario dell'arteria epatica destra.
- Utilizzare la tecnica del microcatetere coassiale per il cateterismo super selettivo sul ramo inferiore destro dell'arteria epatica destra. Eseguire l'angiografia per confermare la posizione del recipiente di alimentazione.
- Iniezione e imaging di MAA di tecnezio-99m (Tc-99m)
- Iniettare 2 mCi di Tc-99m MAA attraverso il microcatetere nelle arterie di alimentazione.
NOTA: Questa procedura è condotta in conformità con le raccomandazioni dell'American Association of Physicists in Medicine sulle procedure di dosimetria, imaging e garanzia di qualità per la brachiterapia con microsfere 90Y nel trattamento delle neoplasie epatiche. Il dosaggio raccomandato di Tc-99m MAA è fissato a 2-4 mCi (74-148 MBq)16. È importante notare che il dosaggio di Tc-99m MAA è fisso e non varia in base al peso del paziente, alla superficie corporea o alle dimensioni della lesione. - Eseguire la tomografia computerizzata a fascio conico (CBCT) per delineare la regione tumorale mirata della distribuzione intraepatica di Tc-99m MAA. Delineare manualmente la regione su viste sagittali, coronali e assiali durante la fase arteriosa.
- Calcola il volume della regione tumorale mirata utilizzando l'opzione SEG4 Properties in CBCT.
- Iniettare 2 mCi di Tc-99m MAA attraverso il microcatetere nelle arterie di alimentazione.
- Calcoli di dosimetria di microsfere LSF, TNR e Y90
- Configurare i parametri delle modalità di scansione (SPECT e CT) sullo scanner ed eseguire l'imaging SPECT/CT sul paziente entro 1-2 ore dall'infusione di Tc-99m MAA. Selezionare la funzione Fusione per amalgamare le immagini SPECT e CT per determinare la distribuzione di Tc-99m MAA nel fegato, nei polmoni e in altri organi.
- Calcolare la frazione di shunt polmonare (LSF) utilizzando l'imaging planare.
- Disegnare manualmente le regioni di interesse (ROI), contrassegnando le aree distinte all'interno del fegato e dei polmoni in cui la distribuzione di Tc-99m MAA è distinguibile nelle viste anteriore e posteriore del fegato, del polmone destro e del polmone sinistro sulle immagini planari. Questo passaggio viene eseguito da un tecnologo di medicina nucleare.
NOTA: La frazione di shunt polmonare (LSF) rappresenta la frazione di 99mTc-MAA che devia dal fegato a entrambi i polmoni. Utilizzando l'imaging planare, il tecnologo di medicina nucleare disegna manualmente le ROI intorno al fegato e ai polmoni (separatamente per il polmone sinistro e destro) sia nella vista anteriore che in quella posteriore. Il risultato del conteggio per ogni pezzo viene quindi ottenuto da questa postazione di lavoro. - Calcola i conteggi per ogni ROI utilizzando una workstation di medicina nucleare standard. Usa la formula:
Conta polmonare =

- Calcola l'LSF usando l'equazione:

- Disegnare manualmente le regioni di interesse (ROI), contrassegnando le aree distinte all'interno del fegato e dei polmoni in cui la distribuzione di Tc-99m MAA è distinguibile nelle viste anteriore e posteriore del fegato, del polmone destro e del polmone sinistro sulle immagini planari. Questo passaggio viene eseguito da un tecnologo di medicina nucleare.
- Calcolare il rapporto tumore-fegato normale (TNR) utilizzando l'applicazione di segmentazione tridimensionale (3D) dell'imaging SPECT/CT.
- Disegna manualmente ROI discrete della stessa dimensione per comprendere sia il tumore che le aree epatiche normali in base alle sezioni di tomografia computerizzata.
- Calcolare il conteggio medio per unità di cellula del tumore rispetto al conteggio medio per unità di cellula del fegato normale in ciascuna ROI utilizzando una workstation.
- Calcola il rapporto TNR utilizzando la seguente equazione:

- Utilizzare l'equazione del modello di partizione nel visualizzatore di dose e attività per l'applicazione Y-90 RE (DAVYR) in base ai risultati dei calcoli per ottenere l'attività (Gbq) e il dosaggio (Gy) prescritti.
3. Trattamento con tara Y-90
- Seguire l'approccio descritto al punto 2 e quindi eseguire un angiogramma direttamente sulle arterie che irrorano il sangue identificate al punto 2.1.
- Confrontare l'immagine angiografica corrente con quella del passaggio 2 per confermare con maggiore precisione la posizione delle arterie di alimentazione.
- Far avanzare il catetere fino alle arterie di alimentazione dopo il cateterismo super selettivo, quindi iniettare le microsfere Y90, con la dose e l'attività già calcolate, nelle arterie di alimentazione.
- Per l'it-90 TARE, eseguire scansioni PET/TC dedicate di tutto il corpo dal torace fino a poco sopra il bacino. Eseguire la PET-CT utilizzando i seguenti parametri: da 80 s a 110 s, 120 kVp, 40 mA, rotazione del tubo di 1 s, collimazione della fetta di 4 mm e velocità del letto di 8 mm/s (cioè passo, 2).
- Valutare il TNR da un ROI del volume disegnato sulle immagini PET/CT e quindi confrontarlo con un TNR ottenuto dalle immagini SPECT/CT della distribuzione MAA Tc-99m per confermare la distribuzione di Y-90.
- Durante la dispensazione e l'iniezione di microsfere di Tc-99m MAA e Y-90, indossare dispositivi di protezione adeguati, come grembiuli di piombo, protezioni per gli occhi e guanti di piombo.
- Non eseguire alcun trattamento speciale dopo il trattamento con Y-90 TARE e chiedere ai pazienti che hanno ricevuto il trattamento con Y-90 di evitare il contatto ravvicinato con gli altri per 7 giorni per ridurre al minimo il rischio di radiazioni.
4. Trattamento sequenziale con inibitori di PD-1 dopo la terapia con Y90
- Osservare la stabilità della lesione per almeno 2 mesi dopo il trattamento con Y90. Utilizzare modalità di imaging appropriate per un monitoraggio coerente. Rivalutare il paziente per determinare la presenza di eventuali fattori ad alto rischio di recidiva.
- Se vengono identificati fattori di rischio elevati, valutare l'idoneità del paziente all'immunoterapia, assicurandosi che non siano presenti controindicazioni. Selezionare un inibitore PD-1 appropriato, come Nivolumab o Pembrolizumab, in base alle considerazioni finanziarie del paziente.
- Somministrare l'inibitore scelto in 1-2 cicli, ciascuno separato da 21 giorni. Somministrare l'inibitore PD-1, preparato utilizzando 100 mL di soluzione fisiologica a 2 mg/mL, tramite iniezione endovenosa periferica nel corso di 1 ora, completando così un ciclo di terapia con inibitore PD-1.
- Valutazione post-trattamento e follow-up
- Dopo aver completato la terapia con inibitori di PD-1, studi di imaging di follow-up e studi sui marcatori tumorali identici a quelli utilizzati prima del trattamento.
- Valutare la risposta mensile del paziente alla terapia con inibitori di PD-1 utilizzando i criteri di valutazione standard21.
5. Epatectomia dopo Y90 TARE e inibitore di PD-1
- Decisione per l'epatectomia: Valutare il sito di trattamento utilizzando le stesse tecniche radiologiche precedentemente applicate per valutare la stabilità della lesione per un minimo di 2 mesi dopo la terapia con inibitori di PD-1, assicurandosi che non siano presenti fattori ad alto rischio di recidiva.
- Preparativi preoperatori per l'epatectomia: per definire con precisione i margini di resezione del tumore e ispezionare eventuali lesioni metastatiche, somministrare il verde di indocianina al paziente 3 giorni prima dell'intervento.
- Procedura chirurgica
- Eseguire l'intubazione tracheale per anestesia generale sul paziente posizionato in stato supino. Eseguire la disinfezione chirurgica per la regione addominale superiore che si estende superiormente alla linea del capezzolo, inferiormente alla sinfisi pubica e lateralmente alla linea medio-ascellare.
- Dopo essere entrati nella cavità peritoneale, utilizzare un laparoscopio per condurre un'ispezione approfondita del fegato e delle strutture circostanti alla ricerca di eventuali anomalie o focolai metastatici.
- Elevare il bordo inferiore del fegato destro con le pinze per esporre il tumore situato nel segmento 6 (S6) del fegato.
- Dopo aver iniettato il verde indocianina per via endovenosa, passare alla modalità di imaging a fluorescenza per valutare attentamente l'estensione del tumore, assicurando l'assenza di invasione nei tessuti adiacenti o aderenze significative.
- Sezionare i tessuti connettivi tra il bordo inferiore del fegato destro, il peritoneo posteriore e il rene destro utilizzando un bisturi armonico. Progressione sezionando superiormente i legamenti triangolari e coronarici destri, esponendo così la seconda porta epatica.
- Uso del forcipe a becco d'anatra per ritrarre il fegato a sinistra per esporre completamente il lobo destro.
- Utilizzare la modalità di imaging a fluorescenza per delineare chiaramente il margine tra il tumore e il tessuto sano adiacente.
- Segnare le linee guida di resezione a circa 1-2 cm dal margine tumorale utilizzando un gancio cauterizzato monopolare.
- Interrompere temporaneamente l'afflusso vascolare dalla vena porta e dall'arteria epatica per ridurre il sanguinamento intraoperatorio. Stringere i lacci emostatici in cicli di 15 minuti di occlusione seguiti da 5 minuti di riperfusione.
- Sezionare con cura il parenchima epatico lungo le linee guida con il bisturi armonico. Coagulare piccoli dotti biliari e vasi con il bisturi, prima clampare e poi sezionare le strutture più grandi.
- Dopo aver asportato il campione tumorale, inviarlo per la valutazione istopatologica.
- Sciacquare la superficie del taglio epatico con soluzione fisiologica calda, quindi raggiungere l'emostasi con coagulazione bipolare. Utilizzare una sutura riassorbibile per chiudere tutte le incisioni. Il paziente ha avuto una degenza ospedaliera post-operatoria di 10 giorni. Per la gestione del dolore post-operatorio, somministrare il tramadolo tramite iniezione intramuscolare.
- Follow-up post epatectomia
- Per rilevare prontamente eventuali recidive postoperatorie o lesioni metastatiche, condurre esami di follow-up mensili per i primi 3 mesi dopo l'intervento chirurgico. Dopo questo periodo, programmare gli esami ogni 3 mesi per i successivi 2 anni e poi ogni 6 mesi per i successivi 3 anni, fino a un totale di 5 anni dopo l'intervento.
Risultati
La risonanza magnetica ha rivelato una riduzione del volume del fegato, una superficie epatica ondulata e ragadi epatiche allargate dei pazienti in questo studio. Una massa quasi sferica, che misura circa 7,2 cm x 5,6 cm x 6,6 cm, è stata identificata nel lobo posteriore destro del fegato. La massa ha mostrato segnali misti bassi all'imaging pesato in T1 (T1WI), segnali misti alti all'imaging pesato in T2 (T2WI) e segnali alti all'imaging pesato in diffusione (DWI). Ha mostrato confini chiari e un aumento eterogeneo della fase arteriosa, suggerendo la possibilità di cirrosi epatica e HCC (Figura 1).
Durante le manovre del catetere, è stata eseguita una valutazione angiografica per confermare l'assenza di vasi tumorali originati dall'aorta addominale, dalle arterie diaframmatiche e dall'arteria mesenterica superiore. All'angiografia all'origine del tronco celiaco, il ramo segmentale dell'arteria epatica destra (S6 o ramo inferiore destro) mostrava tortuosità e dilatazione pronunciate. Questa osservazione ha stabilito che il tumore epatico riceveva l'apporto vascolare esclusivamente da questo singolo ramo arterioso (Figura 2A). Una pre-valutazione fondamentale per l'ittrio-90 TARE prevede la mappatura dei test utilizzando la perfusione di Tc-99m MAA, sfruttando la distribuzione della dose comparabile tra le microsfere di Tc-99m MAA e y-90. Dopo l'iniezione di MAA Tc-99m, è stata delineata la zona di perfusione per il MAA Tc-99m, con il volume di perfusione calcolato per il tumore bersaglio pari a 246,27 mL (Figura 2A). I pazienti che dimostrano un LSF superiore al 20% sono a maggior rischio di danno polmonare indotto da radiazioni, il che li rende in genere candidati inadatti per il trattamento conY-90 22. Un TNR più elevato indica un effetto tumoricida più potente pur aderendo alla dose massima consentita di radiazioni epatiche. L'LSF calcolato si è attestato a 17,17% e il TNR è stato registrato a 8,2 (Figura 2B).
Il modello di partizione, rispetto ai metodi Medical Internal Radiation Dose (MIRD) e Body Surface Area (BSA), fornisce una stima personalizzata della dose di radiazioni superiore tenendo conto del TNR, migliorando la pianificazione del trattamento individualizzata. I risultati del modello di partizione indicano dosi di radiazioni di 36,6 Gy per il fegato normale (al di sotto della soglia di 40 Gy), 17,6 Gy per il tessuto polmonare (entro il limite di 20 Gy) e una dose di picco di 300 Gy per il tumore, che richiede un'attività della microsfera di Y-90 di 1,36 GBq (Figura 3A). Dopo la terapia TARE con ittrio-90 (Figura 3B), è stata eseguita una scansione PET/TC, che non ha indicato alcuna diffusione fuori bersaglio o discrepanze di copertura (Figura 3C).
A 1 mese dopo il trattamento con Y-90 TARE, il tumore è stato ridotto a 6 cm e il livello di AFP è diminuito a 21.155 ng/mL. A 3 mesi dal trattamento, il tumore non ha mostrato cambiamenti significativi. Dato il persistente alto rischio di recidiva, è stato iniziato il trattamento con un inibitore di PD-1. A 5 mesi dalla terapia con ittrio-90 TARE (2 mesi dopo l'inizio del trattamento con inibitore di PD-1), la lesione si era ulteriormente ridotta a 4 cm e il livello di AFP era diminuito drasticamente a 1,84 ng/mL (Figura 4 e Tabella 1).
Vengono presentate immagini del tumore durante l'epatectomia sia in luce bianca che in fluorescenza (Figura 5A). I campioni tumorali ottenuti dall'epatectomia sono stati trasformati in sezioni congelate per patologia macroscopica. Quando esaminati al microscopio, non hanno rivelato cellule tumorali, deposizione di microsfere di ittrio-90, significativa infiltrazione linfocitaria e cambiamenti cirrotici nel tessuto epatico normale adiacente23 (Figura 5B). A 12 mesi dall'intervento, sono stati condotti il follow-up e la valutazione della recidiva, con l'imaging MRI che non indicava alcuna evidenza di recidiva o metastasi (Figura 5C).
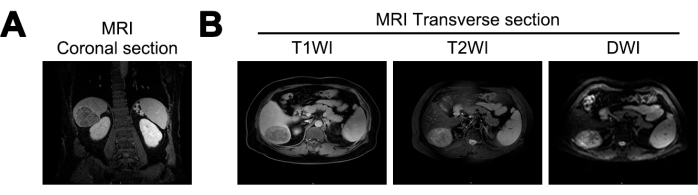
Figura 1: Imaging a risonanza magnetica (MRI) alla diagnosi iniziale. (A) Sezione coronale del segnale di risonanza magnetica T1 Weighted Imaging (T1WI), (B) sezioni trasversali dei segnali MRI T1WI, T2 Weighted Imaging (T2WI) e Diffusion Weighted Imaging (DWI). Clicca qui per visualizzare una versione più grande di questa figura.
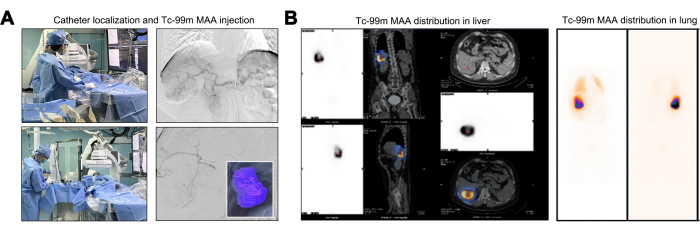
Figura 2: Iniezione e distribuzione di albumina macroaggregata tecnezio-99m (Tc-99m MAA). (A) Illustrazione del processo di iniezione dell'albumina macroaggregata tecnezio-99m (Tc-99m MAA). (B) Presentazione della distribuzione della dose di 99mTc MAA nel fegato. Clicca qui per visualizzare una versione più grande di questa figura.
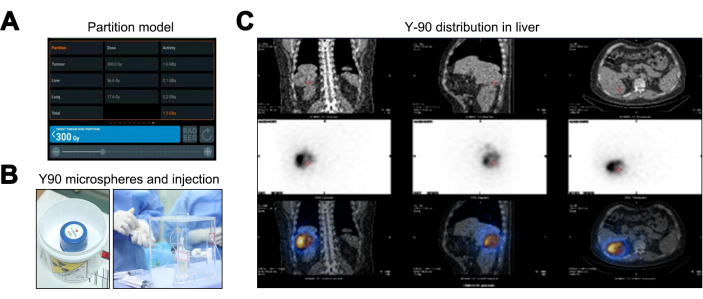
Figura 3: Processo di trattamento con radioembolizzazione transarteriosa con ittrio-90 (Y-90 TARE). (A) Rappresentazione dei dati calcolati utilizzando il modello di partizione. (B) L'imballaggio e l'iniezione delle microsfere di ittrio-90. (C) Tomografia computerizzata a emissione di fotone singolo/Tomografia computerizzata (SPECT/CT) per convalidare la distribuzione del dosaggio delle microsfere di Y-90. Clicca qui per visualizzare una versione più grande di questa figura.
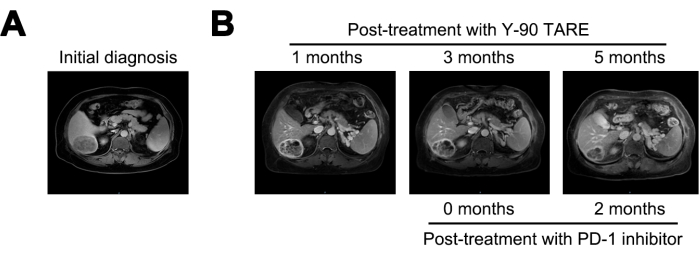
Figura 4: Confronto dei tumori. (A) Presentazione dell'immagine della risonanza magnetica alla diagnosi iniziale, mentre (B) visualizza le immagini della risonanza magnetica a 1, 3 e 5 mesi dopo il trattamento con Y-90 TARE. Il trattamento con inibitore della morte cellulare programmata 1 (PD-1) è stato eseguito 3 mesi dopo la tara con ittrio-90. Il paziente è stato sottoposto a trattamento con un inibitore PD-1 3 mesi dopo la procedura di tara con ittrio-90. Clicca qui per visualizzare una versione più grande di questa figura.
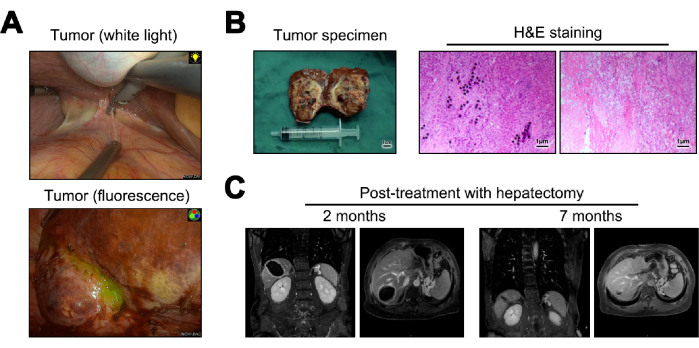
Figura 5: Epatectomia e successivo follow-up. (A) Presentazione del tumore osservato intraoperatoriamente. (B) Illustrazione del campione tumorale postoperatorio e colorazione con ematossilina ed eosina (H&E). (C) Immagini MRI a 2 e 12 mesi dopo l'intervento. Clicca qui per visualizzare una versione più grande di questa figura.
| Post-trattamento con Y-90 TARE | |||||
| Diagnosi iniziale | 1 mese | 3 mesi | 5 mesi | ||
| AFP (ng/mL) | 66840 | 21155 | 19535 | 1.84 | |
Tabella 1: Misurazione del livello di AFP post-trattamento.
Discussione
Per i pazienti con HCC che presentano fattori di recidiva ad alto rischio, una prognosi avversa persiste anche dopo l'epatectomia curativa, sottolineando l'importanza di un'efficace terapia neoadiuvante per aumentare i tassi di sopravvivenza24,25. Rispetto ai trattamenti interventistici, Y-90 TARE vanta un tasso di controllo locale superiore26. Mentre l'ittrio-90 TARE può attivare la risposta antitumoraledell'organismo 22, l'uso combinato di otricotrico con inibitori di PD-1 nella terapia neoadiuvante per il cancro del fegato non è stato ancora riportato. Questo studio esamina retrospettivamente un caso di ittrio-90 TARE neoadiuvante seguito da un trattamento con anticorpi monoclonali anti-PD-1 in un paziente con carcinoma epatocellulare con fattori di recidiva ad alto rischio che ha raggiunto la remissione completa. Presenta un protocollo di trattamento dettagliato come riferimento.
Diversi punti chiave nel protocollo di questo studio meritano attenzione. In primo luogo, dato il potenziale di degradazione e ridistribuzione di MAA99, l'imaging SPECT/CT deve essere eseguito entro 1-2 ore dall'iniezione di MA99. In secondo luogo, è imperativo calcolare meticolosamente la dose di microsfere di ittrio-90 per prevenire il posizionamento ectopico e il dosaggio eccessivo, che potrebbero portare a danni epatici e polmonari. Infine, considerando la chirurgia post-neoadiuvante, una resezione non anatomica che garantisca margini chiari può essere preferibile per accorciare la durata dell'intervento chirurgico e ridurre al minimo l'immunosoppressione correlata alla chirurgia.
Nel presente studio, il paziente ha mostrato sintomi di disturbi del sonno e costipazione dopo la terapia neoadiuvante. Questi sono stati affrontati utilizzando eszopiclone per i disturbi del sonno e compresse rivestite entericamente di bisacodile per la stitichezza. Ciò suggerisce che le reazioni avverse correlate a Y-90 TARE e all'inibitore di PD-1 sono minime e possono essere gestite farmacologicamente. Inoltre, l'it-90 TARE e l'inibitore di PD-1 non hanno indotto edema del tessuto epatico o della lesione, grave adesione o aumento della fragilità, quest'ultimo dei quali potrebbe precipitare un sanguinamento significativo o una resezione incompleta durante la successiva rimozione chirurgica. Di conseguenza, Y-90 TARE non ha interferito né ha influito sulle successive procedure chirurgiche.
Sulla base dei livelli di AFP e delle variazioni della lesione, abbiamo somministrato in sequenza la terapia con anticorpi monoclonali anti-PD-1 dopo Y-90 TARE. Dopo 5 mesi, la lesione ha raggiunto una risposta patologica completa (pCR), indicando che la tempistica e la scelta del trattamento erano appropriate. L'aggiustamento della strategia di trattamento prima del periodo di risposta mediano in Y-90 TARE può ridurre efficacemente il rischio di progressione della malattia27. Tuttavia, sebbene il grado di risoluzione della lesione sia notevolmente correlato con la sopravvivenza alla resezione del carcinoma post-epatico28, se un successivo intervento chirurgico sia giustificato per i casi di pCR indotta da Y-90 TARE rimane un argomento per ulteriori indagini. Inoltre, la tempistica e il dosaggio ottimali del trattamento con anticorpi monoclonali anti-90 TARE e anti-PD-1, nonché la tempistica e l'approccio migliori per la successiva chirurgia, devono ancora essere ulteriormente convalidati. Inoltre, l'alto costo dell'intero processo di trattamento può imporre un onere finanziario significativo ai pazienti.
Nel nostro caso, si ipotizza che l'insorgenza di una pCR dopo il trattamento con Y-90 TARE e inibitore di PD-1 sia correlata a diversi fattori nel presente studio. Inizialmente, si considera la dose di radiazioni intratumorali; abbiamo impiegato una metodologia convenzionale basata su Tc-99m MAA (modello di partizione) per valutare la dose di trattamento con Y-9024. In particolare, a causa dell'elevato TNR del paziente, la dose di radiazioni che permeava la lesione in questo studio era elevata, con microsfere di Y-90 che coprivano completamente il tumore, ottenendo così un effetto curativo. In secondo luogo, non può essere trascurata una significativa infiltrazione di cellule immunitarie all'interno del tumore, che indica un ruolo fondamentale dell'immunità antitumorale del paziente nei confronti della pCR. Considerando che questa era la diagnosi iniziale del paziente e che il tumore non era in uno stadio avanzato, l'immunità antitumorale intrinseca persisteva. A seguito della morte delle cellule tumorali indotta da Y-90 TARE e dall'inibitore di PD-1, può essere innescata una risposta infiammatoria, che aumenta l'esposizione all'antigene tumorale, attiva l'immunità antitumorale dell'ospite e culmina nell'infiltrazione delle cellule immunitarie e nella sua conseguente azione tumoricida29. Inoltre, la nostra ricerca precedente ha individuato una correlazione tra l'infiammazione epatica peritumorale e la resistenza al tumore, che potrebbe potenzialmente esacerbare la tolleranza immunitaria epatica30,31. Sebbene in questo studio fossero presenti alterazioni cirrotiche epatiche nel tessuto peritumorale del paziente, non è stata osservata alcuna risposta infiammatoria significativa e tutti gli esami correlati all'epatite B non sono stati significativi. Ciò suggerisce che il microambiente immunitario epatico del paziente appartiene a un sottogruppo potenzialmente modificabile, per il quale l'Y-90 TARE e l'inibitore di PD-1 rappresentano una strategia cruciale nel potenziamento del microambiente immunitario epatico.
L'implementazione del trattamento con Y-90 TARE richiede condizioni rigorose e sforzi di collaborazione in più reparti, tra cui medicina nucleare, radiologia interventistica, chirurgia epatobiliare, imaging e oncologia. Il potenziale di complicanze indotte dalle radiazioni come polmonite, ulcere gastriche e pancreatite acuta sottolinea la necessità di calcoli meticolosi della dose. Le valutazioni di simulazione preoperatoria e le stime della dose condotte dal reparto di medicina nucleare possono prolungare il ciclo di trattamento con Y90 TARE, portando potenzialmente alla progressione del tumore. Y90 TARE potrebbe non essere adatto a tutti i tumori del fegato, in particolare quelli con metastasi intraepatiche multiple e tumori epatici diffusi o di piccolo diametro (<0,5 cm), a causa delle difficoltà nel differenziare le aree tumorali dal tessuto epatico normale, che possono portare a una stima errata della dose. I rapporti sull'uso di Y90 in combinazione con inibitori di PD-1 per la terapia neoadiuvante nel carcinoma epatocellulare sono limitati. Sono ancora necessari studi clinici su larga scala per comprovarne l'efficacia e i dettagli terapeutici.
In sintesi, la combinazione di Y-90 TARE e un inibitore di PD-1 presenta un approccio sicuro ed efficace per il trattamento neoadiuvante dei pazienti con HCC. Questa strategia non solo allevia il carico tumorale locale e riduce al minimo le micrometastasi nella massima misura possibile, ma lo fa anche senza aumentare il rischio di progressione della malattia. Di conseguenza, ha il potenziale per prolungare il periodo libero da recidiva postoperatoria per i pazienti. Offriamo un protocollo replicabile e fattibile per il trattamento neoadiuvante di pazienti con HCC ad alto rischio.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che possano essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Questo studio è stato finanziato dalla National Natural Science Foundation of China (82303287), dalla Guangdong Basic and Applied Basic Research Foundation (2021A1515110083), dai progetti scientifici e tecnologici di Guangzhou (202201010267), dai fondi per la ricerca di base per le università centrali (21621058).
Materiali
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
Riferimenti
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon