Method Article
Y-90 방사선색전술 및 PD-1 억제제는 간세포암종에서 선행 치료제입니다.
* 이 저자들은 동등하게 기여했습니다
요약
본 연구는 초기 재발 위험이 높은 간세포암(HCC) 환자에서 간절제술로 이어지는 효과적인 선행 전략으로서 Yttrium-90 Trans-Arterial Radioembolization(Y-90 TARE)과 항PD-1 단클론 항체를 결합하는 방법론적 잠재력을 보여줍니다. 이 접근 방식의 안전성, 타당성 및 단계별 절차 지침을 강조합니다.
초록
이 연구는 고위험 간세포암(HCC) 환자를 위한 포괄적인 치료 프로토콜을 보여주며, Y-90 경동맥 방사선색전술(TARE) 및 PD-1(Programmed Cell Death-1) 억제제를 선행 요법으로 병용하는 데 중점을 둡니다. 사례 보고서를 통해 강조된 이 보고서는 유사한 치료 개입에 대한 단계별 참고 자료를 제공합니다. Y-90 TARE와 PD-1 억제제 치료 후 간절제술을 받은 환자에 대한 후향적 분석이 수행되었다. 주요 인구 통계 및 임상 세부 사항은 치료 선택을 안내하기 위해 입원 시 기록되었습니다. Y-90 용기 적합성 및 투여량 계산은 테크네튬-99m(Tc-99m) 거대 응집형 알부민(MAA) 관류 매핑 테스트를 기반으로 했습니다. Y-90 마이크로스피어에 의한 병변 범위는 단일 광자 방출 컴퓨터 단층 촬영/컴퓨터 단층 촬영(SPECT/CT) 융합 이미징을 통해 확인되었으며, 이상 반응 및 후속 결과를 꼼꼼하게 문서화했습니다. 우측 간엽의 HCC가 7.2cm(T1bN0M0, BCLC A, CNLC Ib)이고 초기 알파태아단백(AFP) 수치가 66,840ng/mL인 환자는 재발 위험이 높고 초기 수술 거부로 인해 Y-90 용기 투고를 선택했습니다. 폐 입환 분획(LSF) 및 비종양 비율(TNR)을 포함한 치료법의 매개변수는 치료 한계 내에 있었습니다. 총 1.36GBq Y-90이 투여되었습니다. 치료 1개월 후 종양은 부분 괴사와 함께 6cm로 줄어들었고 AFP 수치는 21,155ng/mL로 떨어져 3개월 동안 안정적으로 유지되었습니다. 3개월 후, PD-1 억제제 치료로 종양이 4cm로 더 감소하고 AFP가 1.84ng/mL로 감소했습니다. 그런 다음 환자는 간 절제술을 받았습니다. 조직병리학적으로 완전한 종양 괴사가 확인되었습니다. 수술 후 12개월이 지났을 때, 추적 관찰 세션에서 종양 재발이나 전이가 관찰되지 않았다. 이 프로토콜은 재발 위험이 높은 간세포암 환자의 수술에 대한 가교 전략으로 Y-90 TARE와 PD-1 억제제의 효과적인 조합을 보여주며, 이 접근 방식을 구현하기 위한 실용적인 지침을 제공합니다.
서문
간세포암종(Hepatocellular carcinoma, HCC)은 전 세계적으로 원발성 간암 사례의 85%-90%를 차지하며, 소화계에 널리 퍼져 있는 악성 종양이다1 . 이 문제는 중국에서 더욱 심각한데, 중국에서는 간암이 4번째로 흔한 악성 종양이자 암 관련 사망률의 두 번째 주요 원인이다 2,3. 이러한 문제를 더욱 복잡하게 만드는 것은 간절제술 후 높은 재발률이며, 이는 2년 이내에 상당한 수의 환자에서 관찰됩니다. 이러한 재발은 종종 치료적 내성과 공격적인 악성 형태로 진화하여 치명적인 결과를 빠르게 초래합니다. 결과적으로, 간절제술 후 재발을 완화하는 것은 간세포암 환자의 생존율을 연장하는 데 중요하다 4,5.
선행 요법(Neoadjuvant therapy)은 종양의 완전 제거율(R0 절제술)을 높이고, 영상에서 볼 수 없는 미세 전이성 질환을 제거하고, 수술 후 재발 위험을 줄이고, 환자의 장기 생존을 연장하는 것을 목표로 수술 전에 시행하는 포괄적인 치료법을 말한다6. 비해부학적 절제술, 현미경적 혈관 침범, 32ng/mL를 초과하는 혈청 AFP 수치 상승, 5cm 이상의 종양 크기, 다발성 종양 및 기저 간경변7 등 고위험 요인을 보이는 간세포암 환자에게 특히 적합합니다. 선행 요법의 레퍼토리는 경피적 동맥 화학색전술(TACE), 간 동맥 주입 화학요법(HAIC) 및 선택적 내부 방사선 요법(SIRT)과 같은 다양한 기술을 포함합니다. 이들은 종종 단독으로 또는 조합하여 적용되는 표적 면역 요법과 통합됩니다8.
이트륨-90 경동맥 방사선색전술(Y-90 TARE)은 선택적 내부 방사선 요법(SIRT)의 특수한 형태로, 수술이 불가능한 원발성 간암 및 간 전이에 대한 중요한 치료 옵션입니다. 탁월한 국소 제어율로 유명한 Y-90 TARE는 종양 부위에 직접 표적 고선량 β방사선을 전달하여 탁월하며, 평균 투과 거리가 2.5mm에 불과하여 인접한 건강한 조직을 보호하는 데 도움이 됩니다9. 이트륨-90 미세구 선택적 내부 방사선 요법(90Y-SIRT)은 1970년 이래 50년 이상 간 악성 종양 치료에 임상적으로 활용되어 왔으며, 20년 이상 대규모 임상 적용이 확인되었다10. 그 안전성과 효능은 지난 세기에 유럽과 미국에서 승인 된 이후 입증되었습니다. 이트륨-90 방사선 요법은 수십 년 동안 국제적으로 수행되어 왔으며 풍부한 임상 데이터를 산출했습니다 11,12,13. 또한 주기율표 39위에 위치한 합성 방사성 원소인 이트륨-90은 고순도 베타선을 높은 에너지로 방출합니다. 반감기(64.2시간)가 짧고 조직 침투 거리가 제한되어 있어 수술 후 격리의 필요성을 없애줍니다 14,15,16. 또한, 혈관 기술 및 충치 산물은 인체에 무해하다15,17. 동시에 항 PD-1 단클론 항체는 암세포에 대한 면역 세포의 세포독성 잠재력을 젊어지게 합니다. 초기 단계의 간세포암 환자에서 더 강력한 면역 프로필이 확인됨에 따라 PD-1 억제제는 선행 환경에서 점점 더 많이 활용되고 있습니다. 기능적으로 이러한 PD-1 단클론 항체는 Y-90 TARE에 의해 유도된 면역원성 세포 사멸을 강화하여 면역 체계의 종양 세포 인식 및 제거 능력을 향상시킵니다. Y-90 TARE의 메커니즘은 β방사선을 통한 직접적인 종양 세포 파괴를 포함하며, 이는 종양 이질성과 면역 회피를 해결하여 PD-1 단클론 항체의 영향을 증가시킵니다. 그러나 현재로서는 선행 요법에서 Y-90 TARE와 PD-1 억제제의 병용 사용에 대한 포괄적인 연구가 상대적으로 부족하다는 점에 유의하는 것이 중요하다 18,19,20.
이 사례 연구는 간절제술로 이어지는 선행 요법으로서 PD-1 억제제와 결합된 Y-90 TARE의 과정, 안전성 및 잠재력을 보여주는 실용적인 가이드 역할을 합니다. 이 선행 요법 후 간 절제술로 치료받은 간암 환자에 대한 후향적 평가를 수행함으로써 치료 단계를 자세히 설명하고 부작용을 관리하며 결과를 평가합니다. 본 연구의 목적은 임상의들이 고위험 간세포암 환자를 관리하는 데 Y-90 용기 및 PD-1 억제제 요법을 적용하는 데 있어 포괄적인 청사진을 제공하는 것을 목표로 한다.
사례 발표:
환자는 49세 남성으로 키 168cm, 체중 62kg, 총 간 용적(VOI) 1236mL, 종양 용적 157mL, 목표 종양 관류 용적 246mL를 가지고 있었습니다. 총 폐 용적은 2124mL였으며 LSF는 17.17%, TNR은 8.2였습니다. 그는 우측 간엽(T1bN0M0, BCLC A, CNLC Ib)에 7.2cm 크기의 HCC를 가지고 있었고 초기 알파태아단백(AFP) 수치는 66,840ng/mL였습니다. 환자의 수술 전 ECOG-PS(Eastern Cooperative Oncology Group Performance Status)는 0점으로 평가되었습니다. 그는 Y-90 TARE를 선택하기 전에 어떠한 약물 치료도 받지 않았는데, 이는 재발 위험이 높고 초기 수술 거부로 인해 선택되었습니다.
프로토콜
치료 절차는 제남대학교 제1부속병원의 기관 검토 위원회의 승인을 받았습니다. 연구에 포함된 참가자로부터 정보에 입각한 동의를 얻었습니다.
1. 선행 요법을 위한 환자 선택
- 포함 기준
- 완전한 외과적 제거(R0 절제술)가 가능한 병변이 있는 환자를 선택합니다.
- 비해부학적 절제술, 혈관 침습, 32ng/mL를 초과하는 혈청 AFP 수치 상승, 5cm 이상의 종양 크기, 다발성 종양의 존재 및 기저 간경변을 포함하여 재발 위험이 높은 환자를 선택합니다.
- 제외 기준
- 초기 진단 시 외과적 치료가 필요한 고위험 재발 요인이 있는 환자를 제외합니다. Y90 치료를 감당할 수 없는 환자는 제외합니다.
2. Y-90 적응증 및 선량 평가
- 종양 혈액 공급을 결정하기 위한 DSA 혈관 조영술
- 시술을 위해 환자에게 누운 자세로 눕도록 요청하십시오. 정기적인 소독 및 드레이핑을 수행합니다. 마취를 위해 대퇴 동맥 천자 부위에 4% 리도카인 용액을 국소적으로 도포합니다.
- 일상적인 손 씻기 절차를 준수하고, 수술복을 착용하고, 멸균 장갑을 착용하십시오.
- Seldinger 기술을 사용하여 오른쪽 총대퇴동맥에 미세 천자 바늘을 삽입합니다. 식염수 세척 시스템에 연결된 덮개를 배치하여 이를 따르십시오.
- 대퇴 동맥 천자와 카테터 삽입이 성공적이면(밝은 빨간색 동맥혈이 관찰됨) 혈관 조영술 카테터를 체강 몸통으로 전진시킵니다. 영상 촬영 결과 간동맥 이외의 종양 공급 혈관이 있는 것으로 확인되면 상장간막 동맥(superior ghostenteric artery), 횡격막 하부동맥(infra-diaphragmatic artery) 등에 혈관 조영술을 수행하여 종양 섭식 혈관을 확인합니다.
- 체강 줄기의 근원에서 혈관 조영술을 실시하여 간 종양이 우측 간동맥의 고독한 분지에 의해서만 공급되는지 확인합니다.
- 우측 간동맥의 우측 하분지에 초선택적 카테터 삽입을 위해 동축 마이크로 카테터 기법을 활용합니다. 공급 용기의 위치를 확인하기 위해 혈관 조영술을 수행합니다.
- 테크네튬-99m(Tc-99m) MAA 주입 및 이미징
- 마이크로 카테터를 통해 공급 동맥에 2mCi의 Tc-99m MAA를 주입합니다.
참고: 이 절차는 간 악성 종양 치료에서 90Y 미세구 근접 치료에 대한 선량 측정, 이미징 및 품질 보증 절차에 대한 미국 의학 물리학자 협회의 권장 사항에 따라 수행됩니다. Tc-99m MAA의 권장 용량은 2-4 mCi (74-148 MBq) 16로 설정됩니다. Tc-99m MAA의 투여량은 고정되어 있으며 환자의 체중, 신체 표면적 또는 병변의 크기에 따라 달라지지 않는다는 점에 유의하는 것이 중요합니다. - 원뿔형 컴퓨터 단층촬영(CBCT)을 수행하여 간내 Tc-99m MAA 분포의 표적 종양 영역을 설명합니다. 간선상(arterial phase) 동안 시상면(sagittal), 코로나(coronal) 및 축(axial view)에서 지역을 수동으로 윤곽을 그립니다.
- CBCT의 SEG4 Properties 옵션을 사용하여 표적 종양 영역의 부피를 계산합니다.
- 마이크로 카테터를 통해 공급 동맥에 2mCi의 Tc-99m MAA를 주입합니다.
- LSF, TNR 및 Y90 마이크로스피어 선량 측정 계산
- 스캐너에서 스캔 모드(SPECT 및 CT) 매개변수를 구성하고 Tc-99m MAA 주입 후 1-2시간 이내에 환자에 대한 SPECT/CT 이미징을 수행합니다. 융합 기능을 선택하여 SPECT 및 CT 이미지를 통합하여 간, 폐 및 기타 장기에서 Tc-99m MAA의 분포를 확인할 수 있습니다.
- 평면 이미징을 사용하여 폐 션트 분율(LSF)을 계산합니다.
- 관심 영역(ROI)을 수동으로 그려 평면 이미지에서 간, 오른쪽 폐 및 왼쪽 폐의 전방 및 후방 보기에서 Tc-99m MAA의 분포를 식별할 수 있는 간과 폐 내의 뚜렷한 영역을 표시합니다. 이 단계는 핵의학 기술자가 수행합니다.
참고: 폐 션트 분획(LSF)은 간에서 양쪽 폐로 션트하는 99mTc-MAA의 분획을 나타냅니다. 핵의학 기술자는 평면 이미징을 활용하여 전방 및 후방 시야 모두에서 간과 폐(왼쪽 및 오른쪽 폐에 대해 별도로) 주변의 ROI를 수동으로 그립니다. 그런 다음 각 부품에 대한 계수 결과를 이 워크스테이션에서 얻습니다. - 표준 핵의학 워크스테이션을 사용하여 각 ROI에 대한 카운트를 계산합니다. 다음 공식을 사용합니다.
폐 수 =

- 다음 방정식을 사용하여 LSF를 계산합니다.

- 관심 영역(ROI)을 수동으로 그려 평면 이미지에서 간, 오른쪽 폐 및 왼쪽 폐의 전방 및 후방 보기에서 Tc-99m MAA의 분포를 식별할 수 있는 간과 폐 내의 뚜렷한 영역을 표시합니다. 이 단계는 핵의학 기술자가 수행합니다.
- SPECT/CT 영상의 3차원(3D) 분할 응용 프로그램을 사용하여 종양-정상 간 비율(TNR)을 계산합니다.
- 컴퓨터화된 단층 촬영 절편을 기반으로 종양과 정상 간 영역을 모두 포함하도록 동일한 크기의 개별 ROI를 수동으로 그릴 수 있습니다.
- 워크스테이션을 사용하여 각 ROI에서 정상 간의 단위 세포당 평균 수에 대한 종양의 단위 세포당 평균 수를 계산합니다.
- 다음 방정식을 사용하여 TNR 비율을 계산합니다.

- 계산 결과를 기반으로 Y-90 RE(DAVYR) 애플리케이션의 용량 및 활성 시각화 도구에서 파티션 모델 방정식을 사용하여 규정된 활성(Gbq) 및 용량(Gy)을 구합니다.
3. Y-90 살갈퀴 처리
- 2단계에서 설명한 접근 방식을 따른 다음 2.1단계에서 확인된 혈액 공급 동맥에 대해 직접 혈관 조영술을 수행합니다.
- 현재 혈관 조영술 이미지를 2단계의 이미지와 비교하여 공급 동맥의 위치를 보다 정확하게 확인합니다.
- 초선택적 카테터 삽입 후 카테터를 공급 동맥으로 전진시킨 다음 이미 계산된 용량과 활성으로 Y90 미세구를 공급 동맥에 주입합니다.
- Y-90 TARE의 경우 가슴에서 골반 바로 위까지 전용 전신 PET/CT 스캔을 받으십시오. 80 s - 110 s, 120 kVp, 40 mA, 1 s 튜브 회전, 4 mm 슬라이스 시준 및 8 mm/s(즉, 피치, 2) 베드 속도 매개변수를 사용하여 PET-CT를 수행합니다.
- PET/CT 이미지에 그려진 볼륨 ROI에서 TNR을 평가한 다음 Tc-99m MAA 분포의 SPECT/CT 이미지에서 얻은 TNR과 비교하여 Y-90의 분포를 확인합니다.
- Tc-99m MAA 및 Y-90 마이크로스피어를 분배 및 주입할 때 납 앞치마, 눈 보호대 및 납 장갑과 같은 적절한 보호 장비를 착용하십시오.
- Y-90 TARE 치료 후 특별한 치료를 하지 않으며, Y-90 치료를 받은 환자는 방사선 위험을 최소화하기 위해 7일 동안 다른 사람과의 밀접한 접촉을 피하도록 요청합니다.
4. Y90 요법 후 순차적 PD-1 억제제 치료
- Y90 치료 후 최소 2개월 동안 병변 안정성을 관찰합니다. 일관된 모니터링을 위해 적절한 이미징 방식을 사용합니다. 환자를 재평가하여 재발 위험이 높은 요인이 있는지 확인합니다.
- 고위험 요인이 확인되면 면역 요법에 대한 환자의 적합성을 평가하여 금기 사항이 없는지 확인합니다. 환자의 재정적 고려 사항에 따라 니볼루맙(Nivolumab) 또는 펨브롤리주맙(Pembrolizumab)과 같은 적절한 PD-1 억제제를 선택합니다.
- 선택한 억제제를 1-2주기로 투여하며, 각각 21일씩 간격을 둡니다. 2mg/mL의 생리식염수 100mL를 사용하여 1시간 동안 말초 정맥 주사를 통해 조제된 PD-1 억제제를 투여하여 PD-1 억제제 요법의 1주기를 완료합니다.
- 치료 후 평가 및 후속 조치
- PD-1 억제제 요법을 완료한 후, 사전 치료에 사용된 것과 동일한 후속 영상 연구 및 종양 표지자 연구.
- 표준 평가 기준21을 사용하여 PD-1 억제제 요법에 대한 환자의 월별 반응을 평가합니다.
5. Y90 용기 및 PD-1 억제제에 따른 간절제술
- 간절제술 결정: PD-1 억제제 요법 후 최소 2개월 동안 병변의 안정성을 평가하기 위해 이전에 적용한 것과 동일한 방사선 기술을 사용하여 치료 부위를 평가하고 재발에 대한 고위험 요인이 없는지 확인합니다.
- 간 절제술을 위한 수술 전 준비: 종양 절제 가장자리를 정확하게 정의하고 전이성 병변이 있는지 검사하기 위해 수술 3일 전에 환자에게 인도시아닌 그린을 투여합니다.
- 수술
- 누운 상태에 있는 환자에게 전신 마취를 위한 기관 삽관을 수행합니다. 상복부 부위에 대해 유두 라인까지 상부, 치골 교감선보다 하위, 측면으로 중간 겨드랑이 라인까지 확장되는 외과적 소독을 수행합니다.
- 복막강에 들어가면 복강경을 사용하여 간 및 주변 구조를 철저히 검사하여 이상 또는 전이성 병소가 있는지 확인합니다.
- 집게로 오른쪽 간의 아래쪽 경계를 들어 올려 간의 세그먼트 6(S6)에 위치한 종양을 노출시킵니다.
- 인도시아닌 그린을 정맥 주사한 후 형광 이미징 모드로 전환하여 종양의 범위를 주의 깊게 평가하고 인접 조직으로의 침입이나 심각한 유착이 없는지 확인합니다.
- 우측 간, 후복막, 우측 신장 사이의 결합 조직을 조화로운 메스를 사용하여 절개합니다. 진행은 오른쪽 삼각형 인대와 관상 동맥 인대를 우수하게 해부하여 두 번째 porta hepatis를 노출시킵니다.
- 오리부리 집게를 사용하여 간을 왼쪽으로 수축시켜 오른쪽 엽을 완전히 노출시킵니다.
- 형광 이미징 모드를 사용하여 종양과 인접한 건강한 조직 사이의 가장자리를 명확하게 묘사합니다.
- 단극 소작 고리를 사용하여 종양 가장자리에서 약 1-2cm 떨어진 곳에 절제 안내선을 표시합니다.
- 문맥과 간동맥에서 혈관 유입을 일시적으로 차단하여 수술 중 출혈을 줄입니다. 15분 폐색 후 5분 재관류 주기로 지혈대를 조입니다.
- 조화로운 메스로 가이드 라인을 따라 간 실질을 조심스럽게 횡단합니다. 메스로 작은 담관과 혈관을 응고시키고 먼저 고정한 다음 더 큰 구조를 절제합니다.
- 종양 표본을 절제한 후 조직병리학적 평가를 위해 보냅니다.
- 간 절단 표면을 따뜻한 생리식염수로 헹구고 양극성 응고로 지혈을 달성합니다. 흡수성 봉합사를 사용하여 모든 절개 부위를 봉합합니다. 환자는 수술 후 10일 동안 입원했습니다. 수술 후 통증 관리를 위해 근육 주사를 통해 트라마돌을 투여합니다.
- 간절제술 후 후속 조치
- 수술 후 잠재적인 재발 또는 전이성 병변을 즉시 감지하기 위해 수술 후 첫 3개월 동안 매월 추적 검사를 실시합니다. 이 기간이 지나면 다음 2년 동안 3개월마다 검사 일정을 잡고, 그 다음 3년 동안 6개월마다 검사 일정을 잡고, 수술 후 최대 5년까지 검사를 예약합니다.
결과
MRI는 이 연구에서 환자의 간 용적 감소, 간 표면의 물결 모양 및 간 균열 확대를 보여주었습니다. 대략 7.2 cm x 5.6 cm x 6.6 cm 크기의 거의 구형에 가까운 덩어리가 간의 오른쪽 후엽에서 확인되었습니다. 이 종괴는 T1 가중 영상(T1WI)에서 혼합된 낮은 신호, T2 가중 영상(T2WI)에서 혼합된 높은 신호, 확산 가중 영상(DWI)에서 높은 신호를 나타냈습니다. 이는 명확한 경계와 이질적인 동맥기 강화를 보였으며, 이는 간경변 및 간세포암의 가능성을 시사합니다(그림 1).
카테터 조작 중 복부 대동맥, 횡격막 동맥 및 상장간막 동맥에서 유래하는 종양 영양 혈관이 없는지 확인하기 위해 혈관 조영술 평가를 수행했습니다. 셀리악 몸통의 기원에서 혈관 조영술에서 오른쪽 간 동맥(S6 또는 오른쪽 하쪽 가지)의 분절 분지가 뚜렷한 비틀림과 팽창을 나타냈습니다. 이 관찰을 통해 간 종양은 이 단일 동맥 분지에서만 혈관 공급을 받는다는 것을 확인했습니다(그림 2A). Y-90 TARE에 대한 기본적인 사전 평가에는 Tc-99m MAA와 Y-90 마이크로스피어 간의 비교 가능한 선량 분포를 활용하여 Tc-99m MAA 관류를 사용한 매핑 테스트가 포함됩니다. Tc-99m MAA 주입 후 Tc-99m MAA에 대한 관류 영역이 설명되었으며, 표적 종양에 대해 계산된 관류 부피는 246.27mL였습니다(그림 2A). LSF가 20% 이상인 환자는 방사선으로 인한 폐 손상 위험이 증가하여 일반적으로 Y-90 치료에 적합하지 않습니다22. TNR이 증가하면 최대 허용 가능한 간 방사선 선량을 준수하는 동시에 더 강력한 종양 살해 효과를 나타냅니다. 계산된 LSF는 17.17%였고 TNR은 8.2로 등록되었습니다(그림 2B).
MERD(Medical Internal Radiation Dose) 및 BSA(Body Surface Area) 방법과 비교하여 파티션 모델은 TNR을 고려하여 우수한 맞춤형 방사선량 추정을 제공하여 개별화된 치료 계획을 강화합니다. 분할 모델의 결과는 정상 간(40Gy 임계값 미만)의 경우 36.6Gy, 폐 조직의 경우 17.6Gy(20Gy 한계 내), 종양의 경우 최대 방사선 선량 300Gy를 나타내므로 1.36GBq의 Y-90 미세구 활성이 필요합니다(그림 3A). Y-90 용기 요법 후(그림 3B), PET/CT 스캔을 수행했으며, 이는 off-target spread 또는 coverage 불일치가 없음을 나타냅니다(그림 3C).
Y-90 TARE를 투여한 지 1개월 후 종양은 6cm로 감소하였고, AFP 수치는 21,155ng/mL로 감소하였다. 치료 3개월 후 종양은 유의미한 변화를 보이지 않았다. 지속적으로 높은 재발 위험이 있기 때문에 PD-1 억제제를 사용한 치료가 시작되었습니다. Y-90 TARE 요법 후 5개월(PD-1 억제제 치료 시작 2개월 후)에 병변은 4cm로 더 감소했고 AFP 수치는 1.84ng/mL로 급격히 감소했습니다(그림 4 및 표 1).
백색광과 형광 하에서 간 절제술 중 종양의 이미지가 제시됩니다(그림 5A). 간절제술에서 얻은 종양 표본은 총체적 병리학을 위해 동결 절편으로 변형되었습니다. 현미경으로 검사했을 때, 그들은 종양 세포, Y-90 미세구의 침착, 상당한 림프구 침투 및 인접한 정상 간 조직에서 간경화 변화를 나타내지 않았습니다23 (그림 5B). 수술 후 12개월에 추적 관찰 및 재발 여부를 평가한 결과, MRI 영상에서 재발이나 전이의 증거가 없는 것으로 나타났습니다(그림 5C).
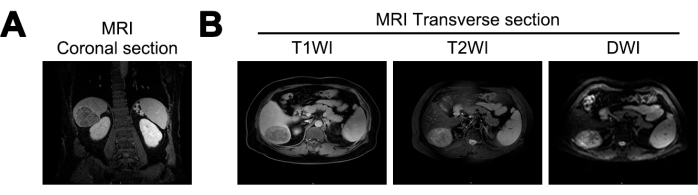
그림 1: 초기 진단 시 MRI(Magnetic-Resonance Imaging) 영상. (A) MRI T1 Weighted Imaging(T1WI) 신호의 관상 단면, (B) MRI T1WI, T2WI(T2 Weighted Imaging) 및 DWI(Diffusion Weighted Imaging) 신호의 횡단면. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
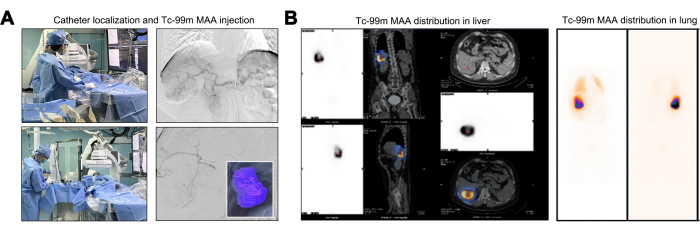
그림 2: 테크네튬-99m 매크로응집형 알부민(Tc-99m MAA)의 주입 및 분포. (A) 테크네튬-99m 거대응집형 알부민(Tc-99m MAA)의 주입 과정 그림. (B) 간에서 99mTc MAA의 선량 분포 제시. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
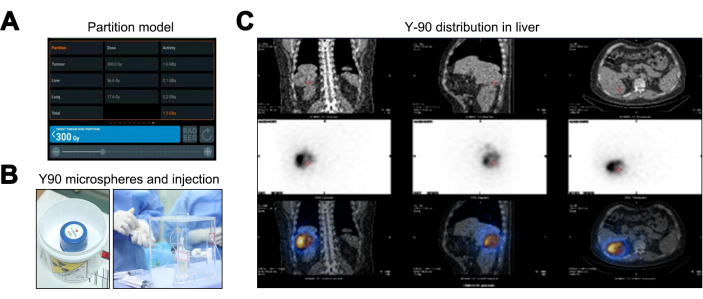
그림 3: 이트륨-90 경동맥 방사선색전술(Y-90 TARE) 치료 과정. (A) 파티션 모델을 사용하여 계산된 데이터의 묘사. (B) Y-90 마이크로스피어의 포장 및 주입. (C) Y-90 마이크로스피어의 투여량 분포를 검증하기 위한 SPECT/CT(Single-photon Emission Computed Tomography/Computed Tomography(SPECT/CT). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
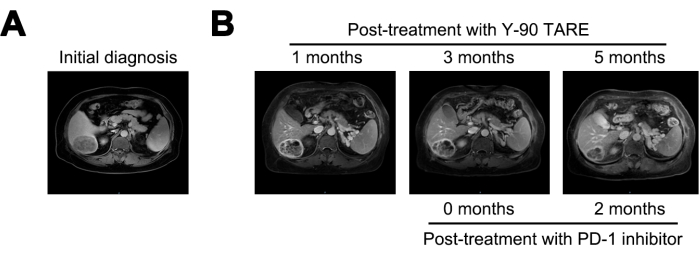
그림 4: 종양 비교. (A) 초기 진단 시 MRI 이미지를 표시하고, (B) Y-90 TARE로 치료 후 1개월, 3개월, 5개월에 MRI 이미지를 표시합니다. 프로그램된 세포사멸-1(PD-1) 억제제 치료는 Y-90 TARE 3개월 후에 시행되었다. 환자는 Y-90 TARE 시술 후 3개월 후에 PD-1 억제제로 치료를 받았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
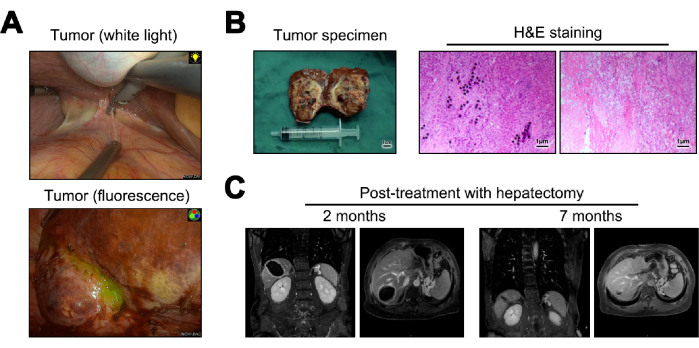
그림 5: 간절제술 및 후속 조치. (A) 수술 중 관찰된 종양의 양상. (B) 수술 후 종양 표본 및 Hematoxylin 및 Eosin (H&E) 염색의 그림. (C) 수술 후 2개월 및 12개월 시점의 MRI 영상. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| Y-90 TARE를 사용한 후처리 | |||||
| 초기 진단 | 1 개월 | 3 개월 | 5 개월 | ||
| AFP(ng/mL) | 66840 | 21155 | 19535 | 1.84 | |
표 1: 처리 후 AFP 레벨 측정.
토론
고위험 재발 인자를 보이는 간세포암 환자의 경우, 근치적 간절제술 이후에도 좋지 않은 예후가 지속되고 있으며, 이는 생존율 향상을 위한 효과적인 선행요법의 중요성을 강조한다24,25. 중재적 치료와 비교했을 때, Y-90 TARE는 우수한 국소 방제율26을 자랑한다. Y-90 TARE는 신체의 항종양 반응을 활성화할 수 있지만, 22, 간암에 대한 선행 요법에서 Y-90과 PD-1 억제제를 병용하는 것은 아직 보고되지 않았다. 본 연구는 완전 관해를 달성한 고위험 재발 인자를 가진 간암(HCC) 환자에서 선행 Y-90 TARE에 이어 항-PD-1 단일클론 항체 치료를 받은 사례를 후향적으로 검토한다. 참고할 수 있는 자세한 치료 프로토콜을 제시합니다.
이 연구의 프로토콜에서 몇 가지 핵심 사항에 주의를 기울일 필요가 있습니다. 첫째, MAA99의 분해 및 재분포 가능성을 감안할 때 SPECT/CT 이미징은 MA99 주입 후 1-2시간 이내에 수행해야 합니다. 둘째, Y-90 미세구의 투여량을 꼼꼼하게 계산하여 간 및 폐 손상으로 이어질 수 있는 이소성 배치 및 과도한 투여를 방지하는 것이 필수적입니다. 마지막으로, 선행 수술 후 수술을 고려할 때, 수술 기간을 단축하고 수술 관련 면역 억제를 최소화하기 위해서는 명확한 여백을 확보하는 비해부학적 절제술이 바람직할 수 있습니다.
본 연구에서 환자는 선행 요법 후 수면 장애와 변비 증상을 보였다. 이러한 증상은 수면 장애에 대한 eszopiclone과 변비에 대한 bisacodyl enteric-coated 정제를 사용하여 해결되었습니다. 이는 Y-90 Tare 및 PD-1 억제제와 관련된 이상반응이 미미하고 약리학적으로 관리될 수 있음을 시사합니다. 또한, Y-90 TARE와 PD-1 억제제는 간 조직이나 병변 부종, 심한 유착 또는 취약성 증가를 유발하지 않았으며, 후자는 차후 외과적 제거 시 상당한 출혈 또는 불완전한 절제를 촉진할 수 있었다. 결과적으로 Y-90 TARE는 후속 수술 절차를 방해하거나 영향을 미치지 않았습니다.
AFP 수치와 병변의 변화에 따라 Y-90 TARE에 이어 항-PD-1 단일클론 항체 요법을 순차적으로 시행했다. 5개월 후, 병변은 병리학적 완전 반응(pCR)을 달성하여 치료 시기와 선택이 적절했음을 나타냅니다. Y-90 용기 중량의 반응 기간 중앙값이 도래하기 전에 치료 전략을 조정하면 질병 진행 위험을 효과적으로 줄일 수 있다27. 그러나, 병변 해소의 정도가 간암 절제술 후 생존율28과 뚜렷한 상관관계가 있음에도 불구하고, Y-90 TARE에 의해 유도된 pCR 증례에 대한 차후의 외과적 개입이 정당화되는지는 여전히 추가 조사의 대상이다. 또한, Y-90 TARE와 항-PD-1 단클론 항체 치료의 최적 시기와 투여량, 그리고 후속 수술을 위한 최선의 시기와 접근법은 아직 검증되지 않았다. 또한 전체 치료 과정의 높은 비용은 환자에게 상당한 재정적 부담을 줄 수 있습니다.
본 사례에서 Y-90 용기 및 PD-1 억제제 치료 후 pCR의 발생은 현재 연구의 여러 요인과 상관관계가 있는 것으로 가정됩니다. 처음에는 종양 내 방사선 선량이 고려됩니다. Y-90 치료 선량24를 평가하기 위해 Tc-99m MAA(분할 모델)를 기반으로 하는 기존 방법론을 사용했습니다. 특히 본 연구에서는 환자의 높은 TNR로 인해 병변에 투과되는 방사선량이 증가하여 Y-90 미세구가 종양을 종합적으로 덮음으로써 치료 효과를 얻을 수 있었습니다. 둘째, 종양 내 상당한 면역 세포 침투는 pCR에 대한 환자의 항종양 면역의 중추적인 역할을 나타냅니다. 이것이 환자의 초기 진단이고 종양이 진행된 단계가 아니라는 점을 고려할 때 내재적 항종양 면역이 지속되었습니다. Y-90 용기 및 PD-1 억제제에 의해 유도된 종양 세포 사멸 후, 염증 반응이 유발되어 종양 항원 노출이 향상되고 숙주 항종양 면역이 활성화되며 면역 세포 침투 및 그에 따른 종양 살해 작용이 절정에 달할 수 있습니다29. 또한, 본 연구에서는 종양주위 간염증과 종양저항성 사이의 상관관계를 확인했으며, 이는 잠재적으로 간면역관용을 악화시킬 수 있다30,31. 이 연구에서 환자의 종양 주위 조직에 간 간경화 변화가 존재했지만, 유의미한 염증 반응은 관찰되지 않았으며, 모든 B형 간염 관련 검사는 특이한 결과를 보이지 않았습니다. 이는 환자의 간 면역 미세환경이 잠재적으로 수정 가능한 하위 그룹에 속하며, Y-90 TARE와 PD-1 억제제는 간 면역 미세환경을 강화하는 데 중요한 전략을 나타냅니다.
Y-90 TARE의 시행은 핵의학, 중재적 방사선학, 간담도 수술, 영상 및 종양학을 포함한 여러 부서에 걸친 엄격한 조건과 협력 노력을 필요로 합니다. 폐렴, 위궤양, 급성 췌장염과 같은 방사선 유발 합병증의 가능성은 세심한 선량 계산의 필요성을 강조합니다. 핵의학과에서 실시하는 수술 전 시뮬레이션 평가 및 용량 추정은 Y90 TARE 치료 주기를 연장하여 잠재적으로 종양 진행으로 이어질 수 있습니다. Y90 TARE는 모든 간암, 특히 다발성 간내 전이 및 미만성 또는 소직경(<0.5cm) 간암이 있는 암에 적합하지 않을 수 있으며, 이는 종양 부위를 정상 간 조직과 구별하는 데 어려움이 있어 투여 오차로 이어질 수 있기 때문입니다. 간세포암에서 선행요법을 위한 PD-1 억제제와 Y90의 사용에 대한 보고는 제한적이다. 그 효능과 치료 세부 사항을 입증하기 위해서는 여전히 대규모 임상 연구가 필요합니다.
요약하면, Y-90 TARE와 PD-1 억제제의 조합은 간암 환자의 선행 치료를 위한 안전하고 효과적인 접근법을 제시합니다. 이 전략은 국소 종양 부담을 완화하고 미세 전이를 최대한 최소화할 뿐만 아니라 질병 진행 위험을 증가시키지 않습니다. 결과적으로, 환자의 수술 후 재발 없는 기간을 연장할 수 있는 잠재력을 가지고 있습니다. 우리는 고위험 간세포암 환자의 선행 치료를 위해 복제 가능하고 실현 가능한 프로토콜을 제공합니다.
공개
저자는 이 연구가 잠재적인 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계가 없는 상태에서 수행되었다고 선언합니다.
감사의 말
본 연구는 중국국가자연과학재단(82303287), 광동기초 및 응용기초연구재단(2021A1515110083), 광저우 과학기술프로젝트(202201010267), 중앙대학 기초연구기금(21621058)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
참고문헌
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유