Method Article
ラテックスミルク注射による軟部および硬部組織手術に影響を与える口腔粘膜の血管経路の検出
要約
ここでは、ラテックスミルク注射による血管の染色について説明します。この手順は、口腔粘膜の詳細な巨視的血管マッピングのための口腔血液供給の解剖学的知識を提供するだけでなく、合併症を予防し、術後の創傷治癒を促進するための適切なフラップ設計の理解を提供します。
要約
この方法論的研究では、口腔粘膜の巨視的な血管経路を視覚化することを目的としています。死体には、ティールの防腐処理用の溶液を注入して固定し、組織の自然な色、新鮮な質感、弾力性を保ちました。ラテックスミルク注射は、血管を染色するために使用される技術です。ティールのエンバーミング法とラテックスミルク注射の組み合わせにより、外科医は生の標本に取り組み、口腔粘膜内の血管の分布と吻合を巨視的に特定して、歯周および顎顔面手術におけるフラップ/切開設計を行うことができます。ラテックスミルクには放射線不透過性材料が含まれており、臨床医は血管の経路をX線写真で視覚化できます。ティールエンバーミングとラテックスミルク注入の正しい調整のためのステップバイステップのプロトコルが説明されています。両方の方法を組み合わせて適用することで、臨床医は解剖学的構造を実用的に理解することができます。その結果、適切な切開部とフラップを設計でき、患者の手術中の神経血管損傷、術中出血、術後の罹患率を防ぐことができます。
概要
インプラント、歯槽骨、および歯周手術で適切な切開またはフラップを設計するためには、解剖学的知識が重要です1,2。口腔粘膜は、外頸動脈(ECA)の亜枝から生じる複雑なパターンの血管を持っています。上顎骨と下顎骨は、それらを取り巻く結合組織とともに、主に上顎動脈(MA)、顔面動脈(FA)、および舌動脈(LA)の枝によって灌流されます3,4,5。臨床的な観点からは、血管経路の視覚化は、臨床医が術中出血と術後の罹患率を減らすために必要です6。経口外科的介入を行う臨床医は、創傷治癒と血管新生の最適な条件を確立するために、血管経路の位置を認識する必要があります7。口腔粘膜の動脈分布と静脈分布の詳細な説明により、口腔外科医と歯周病専門医は、最適化された計画により、手術中の合併症のリスクを最小限に抑えることができます。
文献には、インドインク注入や腐食鋳造8,9,10など、口腔粘膜の血管を染色するためのさまざまな方法があります。好ましい染色方法の1つは、ラテックスミルク7,8,9,10,11,12を使用する。Haenssgen12が定義したように、ラテックスミルクは、タンニン、タンパク質、樹脂、糖、油、アルカロイド、および空気12にさらされると凝固するガムによって形成される液体複合エマルジョンです。ラテックスは一般に赤色の着色剤と混合され、総頸動脈(CCA)またはECAに注入されて、それらの枝と枝の経過を視覚化します。血管は赤く染まり、解剖中に目立ちます。この方法は、ex vivoマクロおよびミクロの確定的な解析による血管の可視化を通じて臨床医に貴重なデータを提供し、確固たる解剖学的基礎を確立します。ラテックスミルクには放射線不透過性物質が含まれているため、この方法は従来のX線と3Dコンピューター断層撮影(CT)の両方で優れた視覚化を示します5。
頭部標本13、14、15の防腐処理に使用できるいくつかの種類の固定液が文献で説明され、比較されている。Walter Thielは、1992年にティールのソリューションを導入しました16,17。この溶液は、組織および血管16,17,18,19,20の自然な色を保存する。検出可能な臭いがなく、体の一部分の組織弾力性を維持し、死体の抗菌保存と同様に、新しい手術装置の開発や外科医のスキルの評価に役立つ可能性があります16,17,18,19,20。
プロトコル
ラテックスミルクの注入方法は、ヒトの死体に対して両側から使用され、オーストリアのグラーツ医科大学の巨視的および臨床解剖学部門に寄贈されました。これは、部門の寄付プログラムに準拠し、シュタイアーマルク州の埋葬法に従って行われます。10人の新鮮な死体(男性5人、女性5人、43〜90歳)が選ばれました。口腔粘膜の血管の経路を、層ごとの解剖プロトコルとCTと組み合わせて利用して分析しました。
ラテックスミルクの注射と口腔粘膜の血管の検査(図1 および 図2)
- 頭頂骨の間の矢状縫合糸の中心をドリルで貫通し( 材料の表を参照)、上矢状静脈洞に到達します。
- 胸鎖乳突筋に平行な頸動脈三角形の切開部をNr.20またはNr.15の外科用ブレードで設計します。次に、Weitlanerリトラクター(140 mm、3/4歯)で皮膚、脂肪組織、筋肉の端を分離し、手術部位を露出させます。
- Nr.15外科用ブレードを使用してCCAを静かに露出させ、鋸歯状のドレッシング鉗子を使用して端をブロックします。
- その後、CCAと上矢状静脈洞を金属製のカテーテルで慎重にカニューレ挿入します。
- CCAの両側に交互の結び目がある結紮糸を使用してカテーテルを分離します。圧力下で注入されたときにティールの血管内溶液やラテックスミルクが漏れないように、カテーテルを非常にしっかりと固定します。
- その後、CCAと上矢状洞を介して、空気圧ポンプシステム(0.25〜0.5 bar)を使用して、血管内溶液(ティールまたはリン酸緩衝液など)と同時に死体組織を灌流します10〜15分間。
注:血管内および防腐剤の主成分は、硝酸アンモニウム(固定剤)、硝酸カリウム(固定剤)、4-クロロ-3-メチルフェノール(固定剤)、亜硫酸ナトリウム(固定剤)、ホウ酸(消毒)、エチレングリコール(組織の可塑性の保存)、お湯(組織の軟化)、およびホルマリン(消毒、組織固定剤、および防腐剤)16,17,18,19,20。 - (オプション)ラテックスミルクを注入する前に、20〜30mLの希釈アンモニアを注入して血管を透明にします。
- 赤色の着色剤を150 mLのラテックスミルクと慎重に混合します( 材料の表を参照)。
- 空気圧ポンプシステムを使用して、混合物をCCAに約10〜15分間注入します。
注意: ラテックスミルクの混合と注入中は、できるだけ泡が出ないように注意してください。気泡が存在すると、血管内に隙間ができ、死体に対して行われる外科的介入中に動脈が破裂する可能性があります。 - 注射中は、同じ圧力またはわずかに高い圧力を使用して、ラテックスミルクを口腔顔面領域の細い血管に完全に分配します。
- CCAとサブブランチを完全に充填および染色した後、注入されたラテックスミルクの排出を防ぐために、外科用血管クランプでそれらを塞ぎます。
- クロムバナジウム耐食性鋼タンク内のティール溶液で試験片を約6〜8か月間防腐処理します。
- 死体をジッパーポリエチレンのビニール袋に入れて、クロロクレゾールなどの抗真菌剤や防腐剤を使用してさらに6か月間保管します。この間、過剰な量の細胞外液が体外に押し出され、標本は解剖の準備が整います。
注:固定期間の完了後、顎顔面領域の組織と血管は準備ができており、解剖の硬さに耐えることができます。染色された動脈はCTスキャンで分析できます。口蓋、前庭、舌、および顎顔面領域の一部の亜枝は、粘膜を除去せずに観察できます。最後に、2.5倍の倍率のルーペとNr.15Cサージカルブレードを使用して標本を解剖します。粘膜の挙上は、染色された動脈を層ごとに解剖することで行うことができ、血管の経過とその変化を巨視的に評価することができます。
結果
ティールの溶液を人間の死体の固定剤として使用すると、外科技術や侵襲的な臨床処置のトレーニングが可能になります。ティールのソリューションの重要な利点の1つは、軟組織と硬組織の自然な色を維持することです。ティールの溶液は、ホルムアルデヒドなど他の多くの固定剤に比べて刺激が少ないです。その使用により、顎関節、咀嚼筋、舌骨上筋の柔軟性が得られ、歯胞の死体手術が容易になります。また、神経血管束の質感は損なわれず、外科医にとって外科技術の実践をより便利にするのに役立ちます。ティールの防腐処理法とその後のラテックスミルク注入を組み合わせることで、顎顔面領域の動脈、特に口腔前庭と口蓋に赤色のラテックスを注入するという、無臭で新鮮な死体を自然な粘稠度で調製するための明確でわかりやすいアプローチです(図3、 図4)。ラテックスミルクに放射線不透過性物質が存在するため、臨床医は頭部標本のX線写真(CT)分析(図5)を行うことができます。その後、血管の経路を肉眼的に観察して、インプラント埋入、副鼻腔底の隆起、または歯周および顎顔面手術中に切開またはフラップをどこでどのように作成するかを理解できます。基本的な固形解剖学的構造を理解した結果、手術を行うときに許容できる術後血管新生と一次創傷治癒が達成される可能性があります。
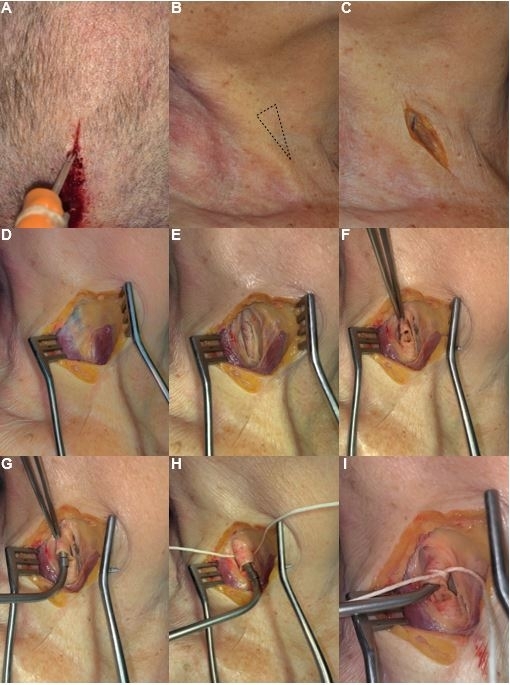
図1:ティールの溶液とラテックスミルクの注入に関するステップバイステップのプロトコル。 (A)ティール溶液の注射のための上矢状洞へのカテーテル留置。(B)頸動脈三角の局在。(C)胸鎖乳突筋に平行な切開を設計する。(D)皮膚接触の分離と子宮頸部脂肪組織の除去。(E)胸鎖乳突筋(外側)と舌骨筋の下腹(内側)との間の頸動脈鞘と頸筋膜の解剖。(F)解剖された総頸動脈の準備。(G)総頸動脈におけるカテーテルの調整。(H)カテーテルの固定と分離。(I)ティール液の注射と赤色のラテックスミルク注射の準備ができている分離カテーテル。 この図の拡大版を表示するには、ここをクリックしてください。
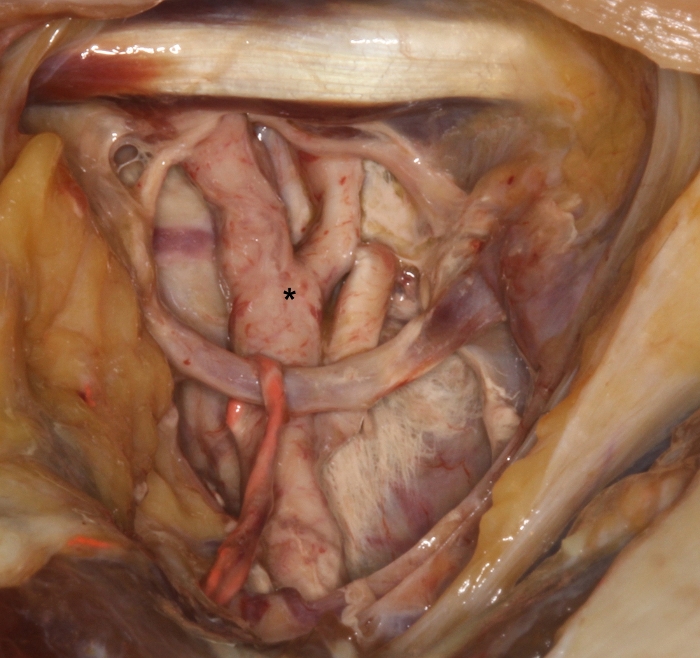
図2:外頸動脈(*)に硬化した赤色のラテックスミルクのデモンストレーションと、頸動脈三角の上部にそのサブブランチがあります。この図の拡大版を表示するには、ここをクリックしてください。
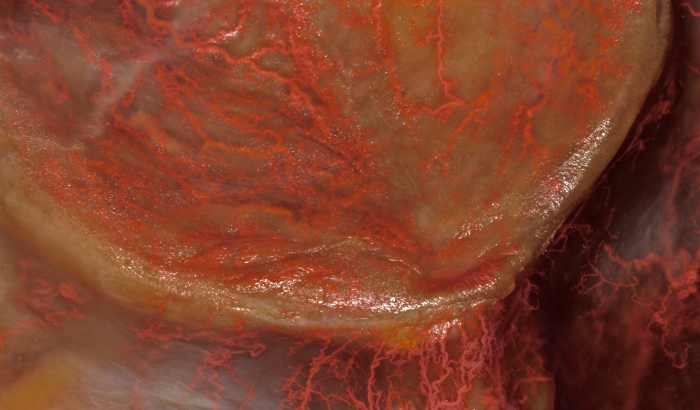
図3:口蓋の血管調査。 大口蓋および鼻口蓋枝の口蓋粘膜分布は、巨視的に見えます。 この図の拡大版を表示するには、ここをクリックしてください。

図4:口腔前庭の血管調査。 (A)上口唇(*)動脈と後上歯槽(**)動脈の水平経路と、それらの小枝が上部前庭粘膜に供給する。(B)上顎前庭の動脈の垂直方向。 この図の拡大版を表示するには、ここをクリックしてください。
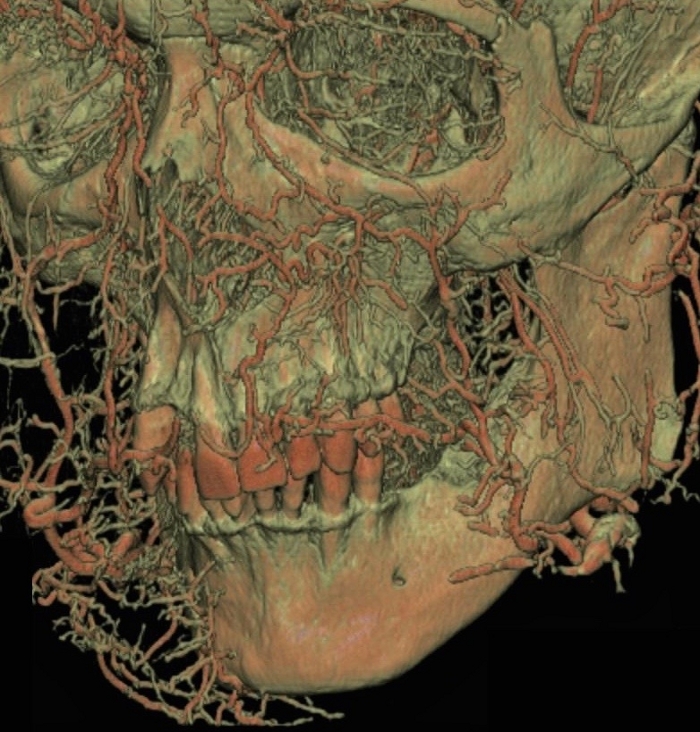
図5:顎顔面領域に赤色のラテックスミルクを注入したさまざまな動脈経路のCT画像。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ティールのエンバーミング法とラテックスミルク注入法のユニークな組み合わせにより、口腔顎顔面外科医と歯周病医は、異なる血管の方向を観察しながら新鮮な標本で練習することができます4,19,20。ただし、血栓による閉塞や、処置中に材料を小動脈に押し込むのに十分な圧力を使用していないため、小径血管の染色にはいくつかの制限がある場合があります。
ティールのエンバーミング法には、重要な重要な利点があります。例えば、死体は自然な色で保存されています16,17,20。組織20,21の弾力性と弾力性の維持のために、これは手術および口腔外科的介入19,22,23を実証するための優れた方法である。ティール法は、ホルムアルデヒドなどの他の固定法に比べて無臭で毒性が低いため、試料作製がより便利になります16,17,18,20。2011年、ベンケドラは、ティールの溶液とホルマリン24を比較して、固定されていない骨格筋線維と固定骨格筋線維の組織学的特徴を調査しました。ティール法では、コラーゲン線維の配置と筋肉の完全性は、他の方法と比較して整列したままであった24。さらに、超音波ガイド下研究では、ティールエンバーミング法が放射線科医や麻酔科医にとってより現実的な結果をもたらすことが報告されています25。
口腔粘膜の血管の正確な経路と吻合に関する情報が不十分であり、手術で不適切なフラップデザインを引き起こす可能性があります。ラテックスミルクの注入は血管を染色し、その結果、血管が見えるようになります4,11。これにより、軟組織と硬組織の解剖学的および生理学的関係を発見することにより、軟組織と硬組織の解剖が容易になります。ラテックスミルクのもう一つの重要な特徴は、酸化鉛(II、IV)の存在により放射線不透過性であることです。そのため、CT解析により血管の経路を立体的に観察することができ、オペレーターは解剖学的および血管学的調査に従って手術を計画することができます。結果として、神経損傷、過度の出血26、およびさまざまな口腔外科的介入における組織壊死や一次創傷治癒の遅延27などの術後合併症を防ぐ適切な切開を設計することができる。
開示事項
著者には利益相反はありません。
謝辞
著者は、グラーツ大学の肉眼的および臨床解剖学部門のすべての同僚に特に感謝したいと思います。センメルワイス大学の解剖学、組織学、発生学の学部の共同研究者。また、センメルワイス大学歯周病学部のペーター・ヴィンディッシュ教授も、彼らの仕事とサポートに対して感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| Nr. 20 surgical blade | Braun, Tuttlingen, Germany | ||
| 2.5x magnification loupes | Harmonycom | ||
| 4-chloro-3-methylphenol | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Air pressure pump system | Heiz-Hofstätter, Graz, Austria | ||
| Ammonium nitrate | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Block End Serrated Dressing Forceps | VETisco, Chesterfield, England | ||
| Boric acid | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Chlorocresol | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Chrome Vanadium Corrosion Resistant Steel tanks | |||
| Computed tomography (CT) | Siemens, Emotion, Munich, Germany | ||
| Diluted ammonia | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Drill (PSR, 10.8,LI-2) | Bosch AG, Gerlingen, Germany | ||
| Ethylene glycol | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Formalin | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Hot water | ——————— | ||
| Latexmilch (latex milk) | Creato, Zitzmann Zentrale, Baden, Germany | ||
| Metal catheter | Grall Enterprise, Graz, Austria | ||
| Nr. 15 surgical blade | Braun, Tuttlingen, Germany | ||
| Nr. 15C surgical blade | Braun, Tuttlingen, Germany | ||
| Pintasol red E-L3 mix paste | Mixol-products Diebold GmbH, Kirchheim, Germany | Color agent | |
| Potassium nitrate | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Sodium sulfite | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Surgical vessel clamp | Grall, Graz Austria | ||
| Weitlaner Retractor (Self-Retaining) 140mm 3/4 Teeth | VETisco, Chesterfield, England | ||
| Zipper polyethylene bags (plastics) | Wettlinger, Kunststoffe, Vienna, Austria |
参考文献
- Kleinheinz, J., Büchter, A., Kruse-Lösler, B., Weingart, D., Joos, U. Incision design in implant dentistry based on vascularization of the mucosa. Clinical Oral Implants Research. 16 (5), 518-523 (2005).
- Koymen, R., et al. Flap and incision design in implant surgery: clinical and anatomical study. Surgical and Radiologic Anatomy. 31 (4), 301-306 (2009).
- Choi, J., Park, H. S. The clinical anatomy of the maxillary artery in the pterygopalatine fossa. Journal of Oral and Maxillofacial Surgery. 61 (1), 72-78 (2003).
- Shahbazi, A., et al. Analysis of blood supply in the hard palate and maxillary tuberosity-clinical implications for flap design and soft tissue graft harvesting (a human cadaver study). Clinical Oral Investigations. 23 (3), 1153-1160 (2019).
- Pilsl, U., Anderhuber, F., Neugebauer, S. The Facial Artery-The Main Blood Vessel for the Anterior Face. Dermatologic Surgery. 42 (2), 203-208 (2016).
- Akolkar, A. R., et al. Bleeding control measures during oral and maxillofacial surgical procedures: A systematic review. Journal of Dental Research and Review. 4 (4), 79-89 (2017).
- Arnold, F., West, D. C. Angiogenesis in wound healing. Pharmacology & Therapeutics. 52 (3), 407-422 (1991).
- Yu, Q. X., et al. The microvasculature of human oral mucosa using vascular corrosion casts and India ink injection. I. Tongue papillae. Scanning Microscopy. 6 (1), 255-262 (1992).
- Yu, Q. X., Pang, K. M., Ran, W., Philipsen, H. P., Chen, X. H. The microvasculature of human infant oral mucosa using vascular corrosion casts and india ink injection. II. Palate and lip. Scanning Microscopy. 8 (1), 133-139 (1994).
- Bergeron, L., Tang, M., Morris, S. F. A review of vascular injection techniques for the study of perforator flaps. Plastic and Reconstructive Surgery. 117 (6), 2050-2057 (2006).
- Alvernia, J. E., Pradilla, G., Mertens, P., Lanzino, G., Tamargo, R. J. Latex injection of cadaver heads: technical note. Neurosurgery. 67, 362-367 (2010).
- Haenssgen, K., Makanya, A. N., Djonov, V. Casting Materials and their Application in Research and Teaching. Microscopy and Microanalysis. 20 (2), 493-513 (2014).
- Jaung, R., Cook, P., Blyth, P. A comparison of embalming fluids for use in surgical workshops. Clinical Anatomy. 24 (2), 155-161 (2011).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anatomical Sciences Education. 8 (1), 86-91 (2015).
- Hayashi, S., et al. Saturated salt solution method: a useful cadaver embalming for surgical skills training. Medicine. 93 (27), 196 (2014).
- Thiel, W. The preservation of the whole corpse with natural color. Annals of Anatomy. 174 (3), 185-195 (1992).
- Thiel, W. An arterial substance for subsequent injection during the preservation of the whole corpse. Annals of Anatomy. 174 (3), 197-200 (1992).
- Thiel, W. Ergänzung für die Konservierung ganzer Leichen nach W. Thiel. Annals of Anatomy. 184 (3), 267-269 (2002).
- Okada, R., et al. Thiel's method of embalming and its usefulness in surgical assessments. Nihon Jibiinkoka Gakkai Kaiho. 115 (8), 791-794 (2012).
- Ottone, N. E., Vargas, C. A., Fuentes, R., Del Sol, M. Walter Thiel's Embalming Method. Review of Solutions and Applications in Different Fields of Biomedical Research. International Journal of Morphology. 34 (4), 1442-1454 (2016).
- Peuker, E. T., Werkmeister, R., Pera, F., Joos, U., Filler, T. J. Surgical procedures in mouth, jaw and facial surgery in Thiel embalmed body donors. Mund Kiefer Gesichtschir. 5 (2), 141-143 (2001).
- Wolff, K. D., Kesting, M., Mücke, T., Rau, A., Hölzle, F. Thiel embalming technique: a valuable method for microvascular exercise and teaching of flap raising. Microsurgery. 28 (4), 273-278 (2008).
- Hölzle, F., et al. Thiel embalming technique: a valuable method for teaching oral surgery and implantology. Clinical Implant Dentistry and Related Research. 14 (1), 121-126 (2012).
- Benkhadra, M., et al. Flexibility of Thiel's embalmed cadavers: the explanation is probably in the muscles. Surgical and Radiologic Anatomy. 33 (4), 365-368 (2011).
- Benkhadra, M., et al. Comparison of fresh and Thiel's embalmed cadavers according to the suitability for ultrasound-guided regional anesthesia of the cervical region. Surgical and Radiologic Anatomy. 31 (7), 531-535 (2009).
- Lamas Pelayo, J. Intraoperative complications during oral implantology. Medicina Oral, Patología Oral y Cirugía Bucal. 13 (4), 239-243 (2008).
- Lim, G., Lin, G. H., Monje, A., Chan, H. L., Wang, H. L. Wound Healing Complications Following Guided Bone Regeneration for Ridge Augmentation: A Systematic Review and Meta-Analysis. The International Journal of Oral & Maxillofacial Implants. 33 (1), 41-50 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved