Method Article
Detección de las vías vasculares de la mucosa oral que influyen en las cirugías de tejidos blandos y duros mediante inyección de leche de látex
En este artículo
Resumen
Aquí, describimos la tinción de los vasos sanguíneos utilizando inyecciones de leche de látex. Este procedimiento proporciona conocimiento anatómico del suministro de sangre oral para el mapeo vascular macroscópico detallado de la mucosa oral, así como la comprensión del diseño adecuado del colgajo para prevenir complicaciones y promover la cicatrización de heridas postoperatorias.
Resumen
En este estudio metodológico, el propósito fue visualizar la vía vascular macroscópica de la mucosa oral. Los cadáveres se inyectaban y se fijaban con la solución de Thiel para embalsamar para mantener el color natural, la textura fresca y la elasticidad de los tejidos. La inyección de leche de látex es una técnica utilizada para manchar los vasos sanguíneos. Una combinación del método de embalsamamiento de Thiel y la inyección de leche de látex permite a los cirujanos trabajar con una muestra cruda e identificar la distribución y anastomosis de los vasos macroscópicamente en la mucosa oral para el diseño de colgajos/incisiones en cirugías periodontales y maxilofaciales. La leche de látex contiene material radiopaco que permite a los médicos visualizar radiográficamente la vía de los vasos sanguíneos. Se describe un protocolo paso a paso para el correcto ajuste del embalsamamiento Thiel y la inyección de leche de látex. La aplicación combinada de ambos métodos permite al clínico comprender las estructuras anatómicas de manera práctica. Como resultado, se pueden diseñar incisiones y colgajos adecuados, lo que evita el daño neurovascular, el sangrado intraoperatorio y la morbilidad postoperatoria durante la cirugía del paciente.
Introducción
Para diseñar una incisión o colgajo adecuado en cirugías de implantes, dentoalveolares y periodontales, el conocimiento anatómico es crucial 1,2. La mucosa oral posee un intrincado patrón de vasos sanguíneos que surgen de las subramas de la arteria carótida externa (ECA). El maxilar y la mandíbula, junto con los tejidos conectivos circundantes, están perfundidos principalmente por las ramas de la arteria maxilar (MA), la arteria facial (FA) y la arteria lingual (LA)3,4,5. Desde el punto de vista clínico, la visualización de las vías de los vasos sanguíneos es necesaria para que los clínicos disminuyan el sangrado intraoperatorio y la morbilidad postoperatoria6. Los clínicos que realizan intervenciones quirúrgicas orales deben conocer la ubicación de las vías vasculares para establecer las condiciones óptimas para la cicatrización de heridas y la angiogénesis7. Una descripción detallada de la distribución arterial y venosa de la mucosa oral permitiría a los cirujanos orales y periodoncistas minimizar el riesgo de complicaciones durante la cirugía mediante una planificación optimizada.
Existen varios métodos en la literatura para teñir los vasos sanguíneos de la mucosa oral, como la inyección de tinta china y la fundición por corrosión 8,9,10. Uno de los métodos de tinción preferidos utiliza leche de látex 7,8,9,10,11,12. Tal y como la definió Haenssgen12, la leche de látex como una emulsión líquida compleja formada por taninos, proteínas, resinas, azúcares, aceites, alcaloides y gomas que se coagula al exponerse al aire12. El látex generalmente se mezcla con un agente de color rojo y se inyecta en la arteria carótida común (CCA) o ECA para visualizar el curso de sus ramas y subramas. Los vasos sanguíneos se tiñen de rojo y se vuelven más prominentes durante la disección. Este método proporciona datos valiosos para los clínicos a través de la visualización de los vasos sanguíneos mediante análisis macro y microscópicos ex vivo definitivos, estableciendo una base anatómica sólida. Debido a la presencia de una sustancia radiopaca en la leche de látex, el método muestra una excelente visualización tanto en rayos X tradicionales como en tomografía computarizada (TC) 3D5.
En la literatura se explican y comparan varios tipos de soluciones fijadoras que se pueden utilizar para embalsamar especímenes de cabeza 13,14,15. Walter Thiel introdujo la solución de Thiel en 199216,17. Esta solución conserva el color natural de los tejidos y vasos 16,17,18,19,20. No tiene olor detectable y mantiene la elasticidad de los tejidos de las partes del cuerpo, así como la preservación antimicrobiana de los cadáveres, y puede ser útil para el desarrollo de nuevos dispositivos quirúrgicos o la evaluación de la habilidad de un cirujano 16,17,18,19,20.
Protocolo
El método de inyección de leche de látex se utilizó bilateralmente en cadáveres humanos, los cuales fueron donados al Departamento de Anatomía Macroscópica y Clínica de la Universidad Médica de Graz, Austria, cumpliendo con el Programa de Donaciones del Departamento y de acuerdo con la ley de entierro de Estiria. Se seleccionaron 10 cadáveres frescos (5 hombres y 5 mujeres, con edades comprendidas entre los 43 y los 90 años). Se analizó el recorrido de los vasos sanguíneos en la mucosa oral, utilizado en combinación con un protocolo de disección capa por capa y TC.
Inyección de leche de látex junto con el examen de los vasos sanguíneos de la mucosa oral (Figura 1 y Figura 2)
- Penetre en el centro de la sutura sagital entre los huesos parietales con un taladro (ver Tabla de Materiales) para llegar al seno sagital superior.
- Diseñe una incisión en los triángulos carotídeos paralelos al músculo esternocleidomastoideo con cuchillas quirúrgicas Nr. 20 o Nr. 15. A continuación, separe los bordes de la piel, el tejido adiposo y los músculos con un retractor Weitlaner (140 mm, 3/4 dientes) para exponer el sitio quirúrgico.
- Revele suavemente los CCA con las cuchillas quirúrgicas Nr. 15 y bloquee el extremo con pinzas de vendaje dentadas.
- Después de eso, cánula los CCA y el seno sagital superior cuidadosamente con un catéter metálico.
- Aísle el catéter mediante una ligadura con nudos alternos a cada lado del CCA. Fije el catéter de forma muy segura para evitar cualquier fuga de la solución intravascular de Thiel o de la leche de látex cuando se inyecta bajo presión.
- Posteriormente, perfundir los tejidos del cadáver a través de los CCA y el seno sagital superior simultáneamente con una solución intravascular (por ejemplo, solución tampón de Thiel o de fosfato) utilizando un sistema de bomba de presión de aire (0,25-0,5 bar) durante ~10-15 min.
NOTA: Los componentes principales de la solución de Thiel intravascular y de embalsamamiento están compuestos por nitrato de amonio (fijador), nitrato de potasio (fijador), 4-cloro-3-metilfenol (fijador), sulfito de sodio (fijador), ácido bórico (desinfección), etilenglicol (preservación de la plasticidad de los tejidos), agua caliente (ablandamiento de los tejidos), así como formalina (desinfección, fijador de tejidos y embalsamamiento)16,17,18,19,20. - (Opcional) Antes de la inyección de la leche de látex, inyecte 20-30 ml de amoníaco diluido para limpiar los vasos.
- Mezcle cuidadosamente un agente de color rojo con 150 mL de leche de látex (ver Tabla de Materiales).
- Inyecte la mezcla utilizando un sistema de bomba de presión de aire durante unos 10-15 minutos en los CCA.
NOTA: Tenga cuidado durante la mezcla e inyección de la leche de látex para mantenerla lo más libre de burbujas posible. Si hay una burbuja, se desarrolla un espacio dentro del vaso, lo que podría resultar en la ruptura de la arteria durante la intervención quirúrgica realizada en el cadáver. - Durante la inyección, use la misma presión o un poco más alta para distribuir completamente la leche de látex en los vasos más finos de la región orofacial.
- Después de completar el llenado y la tinción de los CCA y las subramas, obstruya con pinzas de vasos quirúrgicos para evitar la salida de la leche de látex inyectada.
- Embalsamar las muestras durante aproximadamente 6 a 8 meses en la solución de Thiel dentro de tanques de acero resistente a la corrosión con cromo vanadio.
- Mantenga los cadáveres en bolsas plásticas de polietileno con cierre durante otros 6 meses con agentes antifúngicos y conservantes como el clorocresol. Durante este período, la cantidad excesiva de líquido extracelular es expulsada del cuerpo y las muestras quedan listas para la disección.
NOTA: Una vez finalizado el período de fijación, los tejidos y los vasos sanguíneos de la región maxilofacial están listos y son capaces de soportar la rigidez de la disección. Las arterias teñidas se pueden analizar mediante tomografías computarizadas. Algunas de las subramas en el paladar, el vestíbulo, la lengua y la región maxilofacial son observables sin necesidad de extirpar la mucosa. Finalmente, las muestras se diseccionan utilizando lupas de aumento de 2,5x y cuchillas quirúrgicas Nr. 15C. La elevación de la mucosa se puede realizar diseccionando las arterias teñidas capa por capa, y el curso de los vasos y sus variaciones se pueden evaluar macroscópicamente.
Resultados
Utilizando la solución de Thiel como fijador para cadáveres humanos, se hace posible la formación en técnicas quirúrgicas y procedimientos clínicos invasivos. Una de las ventajas críticas de la solución de Thiel es el mantenimiento del color natural de los tejidos blandos y duros. La solución de Thiel es menos irritante en comparación con muchos otros fijadores, como el formaldehído. Su uso da como resultado la flexibilidad de las articulaciones temporomandibulares y de los músculos masticatorios y suprahioides, lo que facilita las cirugías de cadáveres dentoalveolares. Además, la textura de los haces neurovasculares se mantiene intacta y ayuda a que la práctica de las técnicas quirúrgicas sea más conveniente para el cirujano. La combinación del método de embalsamamiento de Thiel y la posterior inyección de leche de látex es un enfoque claro y directo para preparar cadáveres frescos, libres de olor y con consistencia natural, en los que las arterias de la región maxilofacial, especialmente el vestíbulo oral y el paladar, se inyectan con un látex de color rojo (Figura 3, Figura 4). La presencia de material radiopaco en la leche de látex permite al clínico realizar análisis radiográficos (TC) (Figura 5) de la muestra de cabeza. Posteriormente, se puede observar macroscópicamente la trayectoria de los vasos para comprender dónde y cómo crear una incisión o un colgajo durante la colocación de implantes, la elevación del piso del seno o las cirugías periodontales y maxilofaciales. Como resultado de la comprensión de la anatomía sólida básica, se puede lograr una angiogénesis postoperatoria aceptable y una cicatrización primaria de la herida al realizar la cirugía.
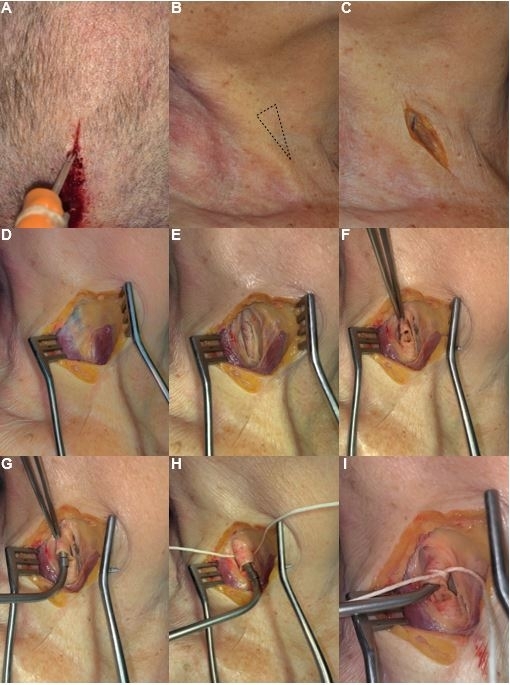
Figura 1: Protocolo paso a paso para la solución de Thiel y la inyección de leche de látex. (A) Colocación de catéter en el seno sagital superior para la inyección de la solución de Thiel. (B) Localización del trígono carotídeo. (C) Diseño de una incisión paralela al músculo esternocleidomastoideo. (D) Separación de los contactos de la piel y eliminación del tejido adiposo cervical. (E) Disección de la vaina carotídea y la fascia cervical entre el músculo esternocleidomastoideo (lateralmente) y el vientre inferior del músculo omohioideo (medialmente). (F) Preparación de una arteria carótida común disecada. (G) Ajuste del catéter en una arteria carótida común. (H) Fijación y aislamiento del catéter. (I) Catéter aislado listo para la inyección de la solución de Thiel y la inyección de leche de látex de color rojo. Haga clic aquí para ver una versión más grande de esta figura.
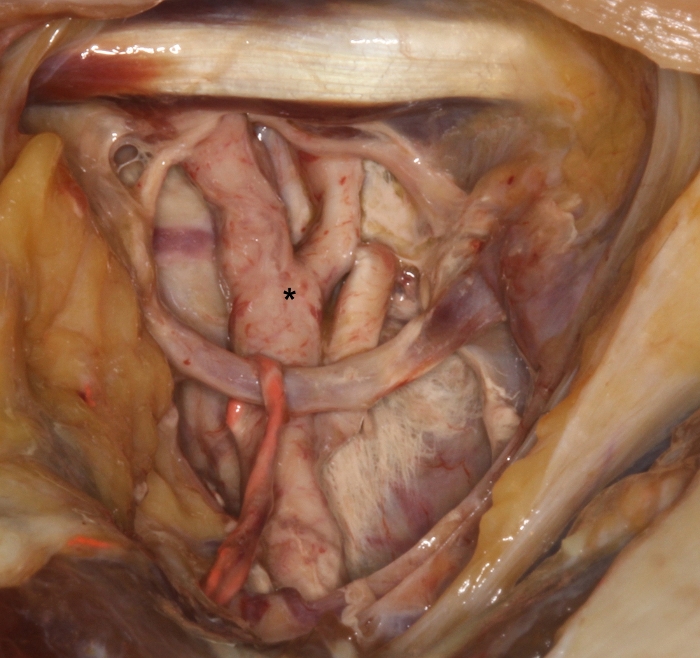
Figura 2: Demostración de leche de látex endurecida de color rojo en la arteria carótida externa (*) con sus subramas en la parte superior del trígono carotídeo. Haga clic aquí para ver una versión más grande de esta figura.
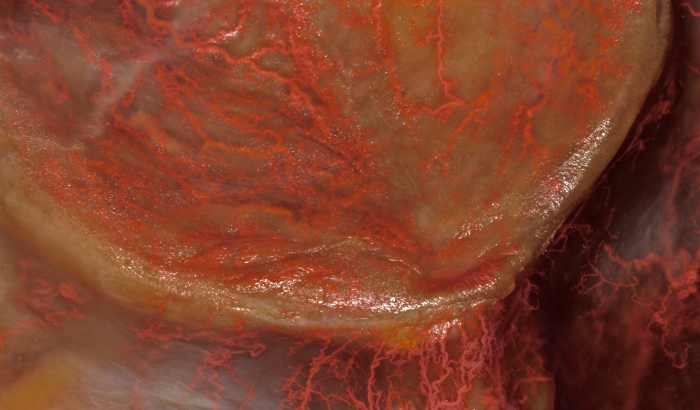
Figura 3: Estudio vascular del paladar. La distribución de la mucosa palatina de las ramas palatinas mayor y nasopalatinas es visible macroscópicamente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Estudio vascular del vestíbulo oral. (A) Trayecto horizontal de las arterias labial superior (*) y alveolar superior posterior (**) con sus subramas que irrigan la mucosa vestibular superior. (B) Orientación vertical de las arterias en el vestíbulo maxilar. Haga clic aquí para ver una versión más grande de esta figura.
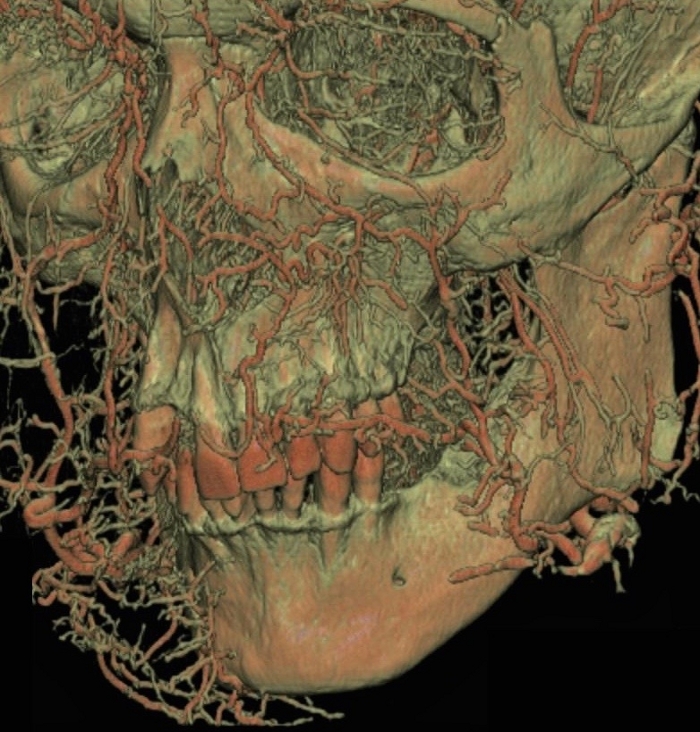
Figura 5: Imágenes de TC de las diversas vías arteriales inyectadas con la leche de látex de color rojo en la región maxilofacial. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La combinación única de los métodos de embalsamamiento e inyección de leche de látex de Thiel permite a los cirujanos orales-maxilofaciales y periodoncistas practicar con especímenes frescos mientras observan las direcciones de los diferentes vasos 4,19,20. Sin embargo, puede haber algunas limitaciones con la tinción de vasos de diámetro pequeño debido a la obstrucción por coágulos o al no usar suficiente presión para empujar el material hacia las arterias pequeñas durante el procedimiento.
El método de embalsamamiento de Thiel contiene ventajas vitales cruciales. Por ejemplo, los cadáveres se conservan en su color natural 16,17,20. Debido al mantenimiento de la resiliencia y elasticidad de los tejidos20,21, este es un excelente método para demostrar la cirugía y las intervenciones quirúrgicas orales 19,22,23. Debido a que el método de Thiel es inodoro y menos tóxico en comparación con otros métodos de fijación como el formaldehído, hace que la preparación de la muestra sea más conveniente 16,17,18,20. En 2011, Benkhedra investigó las características histológicas de las fibras musculares esqueléticas fijas y no fijadas comparando la solución de Thiel y la formalina24. Con el método de Thiel, la disposición de las fibras de colágeno y la integridad de los músculos se mantuvieron alineados en comparación con el otro método24. Además, la investigación guiada por ultrasonido ha reportado que el método de embalsamamiento de Thiel da resultados más realistas para radiólogos y anestesiólogos25.
No hay suficiente información sobre el recorrido preciso y la anastomosis de los vasos en la mucosa oral, lo que puede producir un diseño de colgajo inadecuado en la cirugía. La inyección de leche de látex mancha los vasos sanguíneos y, como resultado, se vuelven visibles 4,11. Esto facilita la disección de tejidos blandos y duros al descubrir su relación anatómica y fisiológica con los vasos. Otra característica esencial de la leche de látex es que es radiopaca debido a la presencia de óxido de plomo (II, IV). Por lo tanto, el recorrido de los vasos se puede observar tridimensionalmente mediante análisis de TC, lo que permite al operador planificar la cirugía de acuerdo con un estudio anatómico y vascular. Como consecuencia, se puede diseñar una incisión adecuada que evite el daño nervioso, el sangrado excesivo26 y las complicaciones postoperatorias como la necrosis tisular y el retraso en la cicatrización de la herida primaria27 en diferentes intervenciones quirúrgicas orales.
Divulgaciones
Los autores no tienen ningún conflicto de intereses.
Agradecimientos
Los autores quieren agradecer especialmente a todos los colaboradores del Departamento de Anatomía Macroscópica y Clínica de la Universidad de Graz; los colaboradores del Departamento de Anatomía, Histología y Embriología de la Universidad de Semmelweis; así como al Prof. Dr. Péter Windisch del Departamento de Periodoncia de la Universidad de Semmelweis por su trabajo y apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| Nr. 20 surgical blade | Braun, Tuttlingen, Germany | ||
| 2.5x magnification loupes | Harmonycom | ||
| 4-chloro-3-methylphenol | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Air pressure pump system | Heiz-Hofstätter, Graz, Austria | ||
| Ammonium nitrate | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Block End Serrated Dressing Forceps | VETisco, Chesterfield, England | ||
| Boric acid | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Chlorocresol | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Chrome Vanadium Corrosion Resistant Steel tanks | |||
| Computed tomography (CT) | Siemens, Emotion, Munich, Germany | ||
| Diluted ammonia | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Drill (PSR, 10.8,LI-2) | Bosch AG, Gerlingen, Germany | ||
| Ethylene glycol | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Formalin | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Hot water | ——————— | ||
| Latexmilch (latex milk) | Creato, Zitzmann Zentrale, Baden, Germany | ||
| Metal catheter | Grall Enterprise, Graz, Austria | ||
| Nr. 15 surgical blade | Braun, Tuttlingen, Germany | ||
| Nr. 15C surgical blade | Braun, Tuttlingen, Germany | ||
| Pintasol red E-L3 mix paste | Mixol-products Diebold GmbH, Kirchheim, Germany | Color agent | |
| Potassium nitrate | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Sodium sulfite | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Surgical vessel clamp | Grall, Graz Austria | ||
| Weitlaner Retractor (Self-Retaining) 140mm 3/4 Teeth | VETisco, Chesterfield, England | ||
| Zipper polyethylene bags (plastics) | Wettlinger, Kunststoffe, Vienna, Austria |
Referencias
- Kleinheinz, J., Büchter, A., Kruse-Lösler, B., Weingart, D., Joos, U. Incision design in implant dentistry based on vascularization of the mucosa. Clinical Oral Implants Research. 16 (5), 518-523 (2005).
- Koymen, R., et al. Flap and incision design in implant surgery: clinical and anatomical study. Surgical and Radiologic Anatomy. 31 (4), 301-306 (2009).
- Choi, J., Park, H. S. The clinical anatomy of the maxillary artery in the pterygopalatine fossa. Journal of Oral and Maxillofacial Surgery. 61 (1), 72-78 (2003).
- Shahbazi, A., et al. Analysis of blood supply in the hard palate and maxillary tuberosity-clinical implications for flap design and soft tissue graft harvesting (a human cadaver study). Clinical Oral Investigations. 23 (3), 1153-1160 (2019).
- Pilsl, U., Anderhuber, F., Neugebauer, S. The Facial Artery-The Main Blood Vessel for the Anterior Face. Dermatologic Surgery. 42 (2), 203-208 (2016).
- Akolkar, A. R., et al. Bleeding control measures during oral and maxillofacial surgical procedures: A systematic review. Journal of Dental Research and Review. 4 (4), 79-89 (2017).
- Arnold, F., West, D. C. Angiogenesis in wound healing. Pharmacology & Therapeutics. 52 (3), 407-422 (1991).
- Yu, Q. X., et al. The microvasculature of human oral mucosa using vascular corrosion casts and India ink injection. I. Tongue papillae. Scanning Microscopy. 6 (1), 255-262 (1992).
- Yu, Q. X., Pang, K. M., Ran, W., Philipsen, H. P., Chen, X. H. The microvasculature of human infant oral mucosa using vascular corrosion casts and india ink injection. II. Palate and lip. Scanning Microscopy. 8 (1), 133-139 (1994).
- Bergeron, L., Tang, M., Morris, S. F. A review of vascular injection techniques for the study of perforator flaps. Plastic and Reconstructive Surgery. 117 (6), 2050-2057 (2006).
- Alvernia, J. E., Pradilla, G., Mertens, P., Lanzino, G., Tamargo, R. J. Latex injection of cadaver heads: technical note. Neurosurgery. 67, 362-367 (2010).
- Haenssgen, K., Makanya, A. N., Djonov, V. Casting Materials and their Application in Research and Teaching. Microscopy and Microanalysis. 20 (2), 493-513 (2014).
- Jaung, R., Cook, P., Blyth, P. A comparison of embalming fluids for use in surgical workshops. Clinical Anatomy. 24 (2), 155-161 (2011).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anatomical Sciences Education. 8 (1), 86-91 (2015).
- Hayashi, S., et al. Saturated salt solution method: a useful cadaver embalming for surgical skills training. Medicine. 93 (27), 196 (2014).
- Thiel, W. The preservation of the whole corpse with natural color. Annals of Anatomy. 174 (3), 185-195 (1992).
- Thiel, W. An arterial substance for subsequent injection during the preservation of the whole corpse. Annals of Anatomy. 174 (3), 197-200 (1992).
- Thiel, W. Ergänzung für die Konservierung ganzer Leichen nach W. Thiel. Annals of Anatomy. 184 (3), 267-269 (2002).
- Okada, R., et al. Thiel's method of embalming and its usefulness in surgical assessments. Nihon Jibiinkoka Gakkai Kaiho. 115 (8), 791-794 (2012).
- Ottone, N. E., Vargas, C. A., Fuentes, R., Del Sol, M. Walter Thiel's Embalming Method. Review of Solutions and Applications in Different Fields of Biomedical Research. International Journal of Morphology. 34 (4), 1442-1454 (2016).
- Peuker, E. T., Werkmeister, R., Pera, F., Joos, U., Filler, T. J. Surgical procedures in mouth, jaw and facial surgery in Thiel embalmed body donors. Mund Kiefer Gesichtschir. 5 (2), 141-143 (2001).
- Wolff, K. D., Kesting, M., Mücke, T., Rau, A., Hölzle, F. Thiel embalming technique: a valuable method for microvascular exercise and teaching of flap raising. Microsurgery. 28 (4), 273-278 (2008).
- Hölzle, F., et al. Thiel embalming technique: a valuable method for teaching oral surgery and implantology. Clinical Implant Dentistry and Related Research. 14 (1), 121-126 (2012).
- Benkhadra, M., et al. Flexibility of Thiel's embalmed cadavers: the explanation is probably in the muscles. Surgical and Radiologic Anatomy. 33 (4), 365-368 (2011).
- Benkhadra, M., et al. Comparison of fresh and Thiel's embalmed cadavers according to the suitability for ultrasound-guided regional anesthesia of the cervical region. Surgical and Radiologic Anatomy. 31 (7), 531-535 (2009).
- Lamas Pelayo, J. Intraoperative complications during oral implantology. Medicina Oral, Patología Oral y Cirugía Bucal. 13 (4), 239-243 (2008).
- Lim, G., Lin, G. H., Monje, A., Chan, H. L., Wang, H. L. Wound Healing Complications Following Guided Bone Regeneration for Ridge Augmentation: A Systematic Review and Meta-Analysis. The International Journal of Oral & Maxillofacial Implants. 33 (1), 41-50 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados