Method Article
Nouvelle fusion intersomatique transforaminale lombaire mini-ouverte
Dans cet article
Résumé
Le protocole introduit un nouveau TLIF mini-ouvert, qui peut réduire considérablement la perte de sang peropératoire, obtenant des résultats peu invasifs avec une récupération améliorée.
Résumé
La fusion intersomatique lombaire transforaminale (TLIF) est une intervention chirurgicale efficace et populaire pour gérer diverses pathologies de la colonne vertébrale, en particulier les maladies dégénératives. Depuis l’avènement du TLIF, les chirurgiens ont adopté des techniques mini-invasives. Actuellement, le TLIF peut être réalisé par des approches transforaminales par chirurgie ouverte, chirurgie mini-invasive ou endoscopie percutanée. Cette étude fournit une description détaillée d’un TLIF ouvert modifié avec des vis pédiculaires percutanées, appelé TLIF mini-ouvert. L’objectif est de présenter la faisabilité de cette procédure et ses résultats préliminaires. L’intervention est pratiquée depuis janvier 2021 et le nombre de patients répondant aux critères d’inclusion a dépassé les 300. Les données recueillies comprennent la durée de l’opération, la perte de sang, le temps ambulatoire, les taux d’hématocrite et les complications périopératoires. Les symptômes cliniques sont évalués à 1 semaine, 3 mois et 12 mois après l’opération. Les scores de l’échelle visuelle analogique (EVA) pour les douleurs au bas du dos et aux jambes et l’indice d’invalidité Oswestry (ODI) sont évalués. L’imagerie par résonance magnétique est réalisée en préopératoire et 12 mois en postopératoire pour mesurer la section transversale des muscles paraspinaux. Les taux de fusion intersomatique lombaire sont évalués à l’aide de tomodensitogrammes. La procédure peut être appliquée à la plupart des maladies dégénératives lombaires courantes dans la pratique clinique. Les données actuellement recueillies indiquent que la durée moyenne de fonctionnement pour les procédures à un seul niveau était de 102,3 min et de 130,2 min pour les procédures à plusieurs niveaux. La perte de sang peropératoire était en moyenne de 62,5 ml pour les chirurgies à un seul niveau et de 108,3 ml pour les chirurgies à plusieurs niveaux. Les scores EVA et ODI ont montré des améliorations significatives après l’opération (p < 0,001), ce qui a permis d’obtenir des différences minimes cliniquement importantes. Les taux d’atrophie musculaire paraspinale étaient de 2,5 % du côté symptomatique et de 1,2 % du côté asymptomatique. Les changements dans les zones transversales et les taux d’atrophie ne sont pas statistiquement significatifs (p > 0,05). MO-TLIF est efficace et réalisable pour traiter les maladies dégénératives lombaires, en particulier dans les cas à plusieurs niveaux, avec des lésions musculaires minimales et des temps d’opération plus courts.
Introduction
La maladie dégénérative lombaire (LDD) est répandue parmi la population âgée, se manifestant souvent par une hernie discale lombaire et une sténose spinale lombaire, se manifestant par des maux de dos chroniques et des symptômes neurologiques1. Depuis son introduction dans les années 1980, la fusion intersomatique lombaire transforaminale (TLIF) a évolué et reste l’une des procédures chirurgicales les plus classiques et les mieux établies pour le traitement des maladies dégénératives lombaires2. En 2002, Foley et al. ont introduit la chirurgie mini-invasive de fusion intersomatique lombaire transforaminale (MIS-TLIF)3,4,5. En 2012, Osman et al. ont rapporté l’utilisation d’un endoscope monocanal sur la fusion lombaire 6,7. En 2018, Kim et Choi ont introduit l’endoscopie biportale unilatérale (UBE), l’appliquant avec succès aux procédures TLIF, la nommant TLIF ENDOSCOPIQUE BIPORTALE (BE-TLIF)8.
L’adoption progressive du MIS-TLIF et du PE-TLIF au cours des dernières années a considérablement amélioré les résultats cliniques et la satisfaction des patients par rapport aux chirurgies traditionnelles9. Certains chercheurs pensent même que les techniques endoscopiques finiront par remplacer la chirurgie ouverte. Cependant, la chirurgie ouverte traditionnelle s’améliore continuellement et devient moins invasive, le TLIF modifié émergeant comme une procédure ouverte largement acceptée10. Le TLIF modifié consiste à inciser le fascia lombo-dorsal le long de l’apophyse épineuse, à détacher méticuleusement les muscles et les ligaments attachés à l’apophyse épineuse et à la lame sous le périoste et à exposer les pédicules vertébraux sans dissection extensive ni rétraction prolongée. Cette technique permet d’obtenir des résultats mini-invasifs similaires à ceux de l’approche de Wiltse11.
Dans ce contexte, cette étude propose de manière innovante une nouvelle avancée sur l’approche mini-invasive, mini-ouverte TLIF (MO-TLIF), assistée par des vis pédiculaires percutanées. De nombreuses études rapportent que la chirurgie lombaire postérieure entraîne souvent une atrophie musculaire paraspinale postopératoire, peut-être liée à une rétraction prolongée des muscles du dos pendant la chirurgie, qui est associée à des douleurs lombaires (LBP) et à des symptômes radiculaires 12,13,14. Mengiardi et al. ont constaté qu’une infiltration accrue de graisse dans le muscle multifidus entraîne souvent des douleurs chroniques au bas du dos7, tandis que Hyun et al. ont suggéré un lien entre la radiculopathie lombaire et l’atrophie de dénervation musculaire12. D’autres études ont montré que l’atrophie musculaire paraspinale est étroitement liée à l’apparition et à l’aggravation des symptômes de la maladie dégénérative lombaire15. La quantité et la fonction des muscles paraspinaux jouent un rôle crucial dans le maintien de l’équilibre sagittal lombaire-pelvien et sont essentiels à la stabilité lombaire postopératoire16. Par conséquent, l’impact sur les muscles paraspinaux est une considération essentielle dans le choix de l’approche chirurgicale et de la technique de fusion vertébrale, les approches antérieures ou postérieures peu invasives réduisant la perturbation musculaire17.
Cette étude analyse prospectivement l’efficacité clinique à court terme et les modifications des muscles paraspinaux chez les patients atteints de dégénérescence lombaire à un ou plusieurs niveaux traités par MO-TLIF (47 hommes et 49 femmes d’un âge moyen de 54,8 ± 17,5 ans, comme le montre le tableau 1). Nous avons évalué l’efficacité chirurgicale, la perte de sang, les résultats de fusion, la douleur et les scores fonctionnels, ainsi que la perturbation du muscle paraspinal, en comparant ces résultats avec des patients subissant un TLIF modifié au cours de la même période. Cette comparaison vise à explorer les avantages du MO-TLIF dans le traitement des maladies dégénératives lombaires, en particulier son impact sur les muscles paraspinaux.
Protocole
Cette étude a été réalisée conformément aux principes de la Déclaration d’Helsinki. L’approbation a été accordée par le Comité d’éthique du deuxième hôpital affilié de l’Université Soochow (n° JD-LK2023045-I01). Le consentement éclairé a été obtenu de tous les participants inclus dans l’étude. Toutes les images de l’article ont obtenu le consentement éclairé des participants humains à la recherche.
1. Critères d’inclusion et d’exclusion
- Utilisez les critères d’inclusion suivants : Diagnostic clinique d’une hernie discale lombaire à un ou plusieurs niveaux, d’une sténose spinale lombaire, d’une instabilité lombaire ou d’un spondylolisthésis lombaire de grade I ou II ; Douleur persistante au bas du dos et/ou douleur à la jambe, engourdissement ou faiblesse qui n’a pas répondu au traitement conservateur depuis 3 mois.
- Utilisez les critères d’exclusion suivants : Chirurgie de révision ; présence d’une scoliose, d’une spondylarthrite ankylosante, de nouvelles fractures vertébrales, de tumeurs de la colonne vertébrale ou d’autres tumeurs malignes ; spondylolisthésis lombaire de grade III ou supérieur ; patients atteints de troubles de la coagulation.
2. Intervention chirurgicale
- Préparation préopératoire
- Placez tous les patients qui subissent une intervention chirurgicale sous anesthésie générale sur une table de chirurgie de la colonne vertébrale radiotransparente. Placez un coussin ou un coussin de soutien de taille appropriée sous la région thoracique et pelvienne pour élever la poitrine et le bassin, respectivement. Ajustez la hauteur et l’angle des supports pour maximiser l’exposition intersomatique et permettre à l’abdomen de s’affaisser librement pour éviter la compression de la veine cave inférieure.
REMARQUE : Généralement, une lordose lombaire antérieure de 10° à 15° et une inclinaison pelvienne appropriée sont considérées comme optimales pour obtenir la meilleure exposition de l’espace intervertébral. Des réglages précis pendant l’opération sont cruciaux pour équilibrer l’exposition souhaitée et la sécurité du patient. - Commencer par l’identification du segment L5-S1 ; utiliser un guide de localisation sous fluoroscopie de l’arceau sur la base des vues antéropostérieures standard pour déterminer le segment de lésion et la projection de surface des pédicules sur le corps du patient.
- À l’aide d’un marqueur, marquez les incisions chirurgicales de la ligne médiane, les projections de surface des pédicules, ainsi que les incisions de 1 cm au bord latéral des projections des pédicules.
- Désinfectez le site chirurgical avec de l’iodophore en trois applications distinctes, en étendant le désinfectant d’au moins 15 cm au-delà de l’incision prévue pour créer une marge antiseptique adéquate. Veillez à ne pas étaler ou enlever les marques préopératoires.
- Placez quatre champs stériles autour du site d’incision. Appliquez des champs chirurgicaux aux extrémités céphalique et caudale du champ opératoire. Couvrez la zone chirurgicale avec un grand champ stérile, en le fixant en place.
- Placez tous les patients qui subissent une intervention chirurgicale sous anesthésie générale sur une table de chirurgie de la colonne vertébrale radiotransparente. Placez un coussin ou un coussin de soutien de taille appropriée sous la région thoracique et pelvienne pour élever la poitrine et le bassin, respectivement. Ajustez la hauteur et l’angle des supports pour maximiser l’exposition intersomatique et permettre à l’abdomen de s’affaisser librement pour éviter la compression de la veine cave inférieure.
- Mise en place du canal d’accès chirurgical
- Faites une incision longitudinale de 3 cm le long de la ligne marquée dans le bas du dos à l’aide d’une lame #10 (Figure 1). Coupez la peau, le tissu sous-cutané et le fascia thoraco-lombaire avec un électrotome à haute fréquence en séquence.
- Détachez les muscles paraspinaux le long de l’apophyse épineuse pour exposer l’apophyse épineuse affectée, la lame et une partie de l’articulation facettaire avec un électrotome à haute fréquence. Placez l’écarteur de lame sur le bord extérieur de la facette supérieure de la vertèbre inférieure pour exposer le champ chirurgical, en établissant généralement le canal d’approche en 5 minutes.
- Décompression
- Utilisez un couteau à os à ultrasons ou un couteau à os ordinaire pour enlever l’apophyse sous-articulaire supérieure et une partie de l’apophyse supraépineuse inférieure. Retirez une partie du ligamentum flavum ventral pour exposer la dure-mère et les racines nerveuses. Pendant ce temps, préservez le ligamentum flavum dorsal et la graisse épidurale pour minimiser la perturbation de l’anatomie normale du canal rachidien.
- Si une décompression bilatérale ou une sténose controlatérale est nécessaire, inclinez la table de chirurgie vertébrale radiotransparente vers le côté controlatéral. Retirez la base de l’apophyse épineuse et réséquez le ligamentum flavum hypertrophique jusqu’à ce que le renfoncement latéral controlatéral soit atteint. Cette approche permet d’obtenir une décompression complète à 270°.
- Rétractez les racines nerveuses et le sac dural à l’aide d’un écarteur de racines nerveuses pour exposer la zone opératoire. Incisez l’anneau fibreux avec un scalpel #11. Retirez le noyau pulpeux avec un Kerrison et grattez le cartilage de la plaque d’extrémité avec un rongeur osseux pour exposer l’extrémité osseuse. Dilater séquentiellement l’espace intervertébral à l’aide d’un ciseau à disque intervertébral et affleurer avec une solution saline normale pour obtenir l’hémostase.
- Coupez les apophyses articulaires excisées et une partie de la lame à l’aide d’un rongeur osseux pour créer des fragments osseux d’environ 2 mm2 . Emballez une partie de ces greffes osseuses dans la cage et placez les fragments restants dans l’espace intervertébral. Positionnez la cage au centre de l’espace intervertébral.
- Utilisez un couteau à os à ultrasons ou un couteau à os ordinaire pour enlever l’apophyse sous-articulaire supérieure et une partie de l’apophyse supraépineuse inférieure. Retirez une partie du ligamentum flavum ventral pour exposer la dure-mère et les racines nerveuses. Pendant ce temps, préservez le ligamentum flavum dorsal et la graisse épidurale pour minimiser la perturbation de l’anatomie normale du canal rachidien.
- Fermeture de l’incision
- Confirmer que la position du dispositif de fusion intervertébrale est satisfaisante par fluoroscopie latérale et antéro-postérieure. Utilisez un décapant neural pour sonder le sac dural et les racines nerveuses pour une bonne mobilité, pas de compression et pas de sténose du canal rachidien.
- Rincer l’espace intervertébral avec une solution saline. Utilisez des sutures résorbables 3-0 pour fermer la couche de fascia avec une technique de verrouillage et effectuez une suture continue pour la couche de graisse. Suturez la peau à l’aide d’agrafes ou de sutures, selon la préférence et les exigences cliniques. Cette procédure ne nécessite pas la mise en place régulière du drainage.
- Placement de la fixation interne et incision fermée
- Faites une incision de 1 cm aux sites de projection des pédicules des vertèbres au-dessus et au-dessous de l’espace intervertébral ciblé (les marqueurs ont été réalisés en préopératoire).
- Effectuez les procédures suivantes sous fluoroscopie de l’arceau pour éviter les violations du pédicule ou les dommages aux nerfs environnants. Insérez une aiguille de trocart pointue à travers la peau pour accéder au pédicule. Assurer un positionnement précis de l’aiguille au point d’entrée prévu.
- Une fois l’aiguille correctement placée, utilisez un alésoir de petit diamètre pour agrandir progressivement le canal pédiculaire, en assurant un espace suffisant pour la vis pédiculaire. Utilisez un système de guidage dédié pour insérer la vis pédiculaire et les bielles dans le canal alésé, puis serrez les bouchons à vis. Irriguez l’incision avec une solution saline pour obtenir une hémostase complète.
- Utilisez des sutures résorbables 3-0 pour fermer l’incision couche par couche et recouvrez d’un pansement. Vérifiez l’activité des membres inférieurs en postopératoire.
REMARQUE : Pour les chirurgies à plusieurs niveaux, l’incision médiane postérieure est d’environ 4 cm pour deux segments et de 5 cm pour trois segments (Figure 2). Le canal d’approche chirurgicale peut être établi à l’aide de la même méthode, en ne changeant que la position de l’écarteur de la lame pour décompresser plusieurs espaces intervertébraux. L’extension légère de l’incision à plusieurs niveaux peut augmenter l’espace opératoire, ce qui rend la procédure plus pratique et offre une meilleure exposition sans augmenter considérablement les traumatismes et les saignements.
3. Évaluation clinique
- Rassemblez les données suivantes en préopératoire, en peropératoire, 1 semaine en postopératoire, 3 mois en postopératoire et 12 mois en postopératoire. Enregistrez le temps de l’opération, la perte de sang, le temps ambulatoire postopératoire, le temps de suivi, les complications et les scores de l’échelle visuelle analogique (EVA) et de l’indice d’invalidité d’Oswestry (ODI), qui sont largement utilisés pour les douleurs lombaires et des membres inférieurs18.
- Mesurez la perte de sang visible pendant l’opération à l’aide d’un sac d’aspiration gradué. Soustrayez le volume de liquides, tels que la solution saline, utilisés pendant la procédure. De plus, estimez le volume sanguin absorbé par la gaze en pesant la gaze imbibée de sang.
- Utilisez l’hématocrite préopératoire et postopératoire (Hct) pour calculer la perte de sang. Déterminez le volume sanguin estimé (VEB) du patient à l’aide de la formule de Nadler19 :
VEB (mL)= [k1 x taille (m)3 + k2 x poids (kg) + k3] x 1000]
Pour les mâles : k1=0,3669, k2=0,03219, k3=0,6041. Pour les femelles : k1=0,3561, k2=0,03308, k3=0,1833. - Par la suite, calculez la perte de sang totale (VLB) à l’aide de la formule brute20
VLB (mL)=VEB (mL) x (HctPre−HctPost)/HctAve
où HctPre représente l’hématocrite préopératoire, HctPost est la valeur d’hématocrite mesurée le deuxième jour postopératoire et HctAve est la moyenne de HctPre et HctPost. - Utilisez la radiographie latérale et la tomodensitométrie (TDM) pour évaluer la fusion intervertébrale21. Effectuer l’imagerie par résonance magnétique (IRM) en préopératoire et 1 an en postopératoire pour émuler la section transversale (CSA) des muscles paraspinaux des segments de lésion. Calculer les propriétés de l’infiltration de graisse à l’aide de l’ImageJ22 (Figure 3).
4. Analyse statistique
- Comparez les scores VAS et ODI avant et après la chirurgie à l’aide d’un test t à échantillons appariés. Comparez la section transversale mesurée avec l’IRM T2WI sur les segments opérationnels avant et après l’opération. Toutes les analyses statistiques ont été effectuées à l’aide de SPSS. Les données sont présentées sous forme de moyenne ± d’écart-type, et p < 0,05 a été considéré comme significatif.
Résultats
Pour les opérations à un seul niveau (n = 50), la durée moyenne de l’opération était de 102,3 min (plage de 75 à 160 minutes) et de 130,2 minutes (plage de 112 à 185 minutes) pour les chirurgies à plusieurs niveaux (n = 46). La perte sanguine peropératoire moyenne était de 62,5 mL pour l’intervention à un seul niveau (plage de 35 à 125 mL), et pour l’intervention à plusieurs niveaux, elle était de 108,3 mL (tableau 2). Le tableau 3 montre les sections transversales préopératoires et postopératoires et les niveaux d’infiltration de graisse des muscles paraspinaux bilatéraux.
Avant l’opération, l’ASC du côté de la décompression était de 2088,4 ± 226,7 mm2, et du côté controlatéral, de 2081,8 ± 238,6 mm2, sans montrer de différence significative. À 1 an après l’opération, l’ASC du côté de la décompression était de 2077,9 ± 225,5 mm2, et du côté controlatéral, elle était de 2076,1 ± 235,5 mm2. Le taux d’atrophie du côté de la décompression était de 2,5 %, alors qu’il était de 1,2 % du côté controlatéral, sans différence statistiquement significative (p > 0,05).
Le taux d’infiltration de graisse du côté de la décompression était de 22,14 % ± 9,21 % en préopératoire et de 22,09 % ± 9,04 % en postopératoire. Du côté controlatéral, le taux d’infiltration de graisse était de 21,78 % ± 8,71 % en préopératoire et de 22,20 % ± 9,19 % en postopératoire. Il n’y avait pas de différences statistiquement significatives dans la comparaison de l’ASC, que ce soit avant et après l’opération du même côté ou entre le côté décompression et le côté controlatéral. Des données détaillées sur la perturbation du muscle paraspinal sont fournies dans les tableaux 3 et 4.
Ces résultats indiquent que la perte de sang peropératoire dans le MO-TLIF est inférieure à celle du TLIF ouvert traditionnel tout en étant comparable à celle du BE-TLIF. La durée chirurgicale est nettement plus courte que celle du BE-TLIF, mais similaire à celle du TLIF ouvert traditionnel. De plus, sur la base de la réussite de plus de 400 procédures à ce jour, MO-TLIF a considérablement réduit l’invasivité musculaire, démontrant à peine une augmentation des lésions musculaires du côté de la décompression par rapport au côté controlatéral.
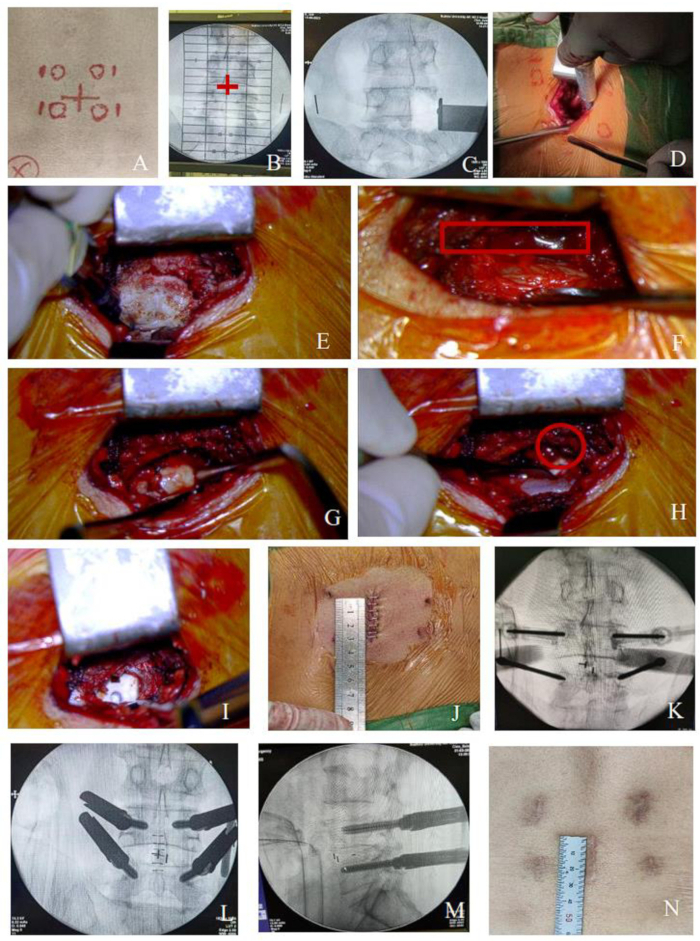
Figure 1 : Procédure de MO-TLIF pour la lésion à un seul niveau. (A-B) L’espace intervertébral et la projection du pédicule ont été déterminés par fluoroscopie à arceau, comme l’a montré la croix rouge. Ensuite, marquez l’incision chirurgicale le long de l’apophyse épineuse entre les deux espaces intervertébraux et à 1,5 cm latéralement du pédicule marquez les points de ponction des vis pédiculaires percutanées. (C-I) Diagrammes schématiques du champ opératoire pendant le processus de décompression (la racine nerveuse était entourée d’une ligne continue rouge). (J) Incision centrale de 3 cm pour une lésion à un seul niveau. (K-M) Processus de mise en place percutanée des vis. (N) L’incision après la guérison. Veuillez cliquer ici pour voir une version agrandie de cette figure.
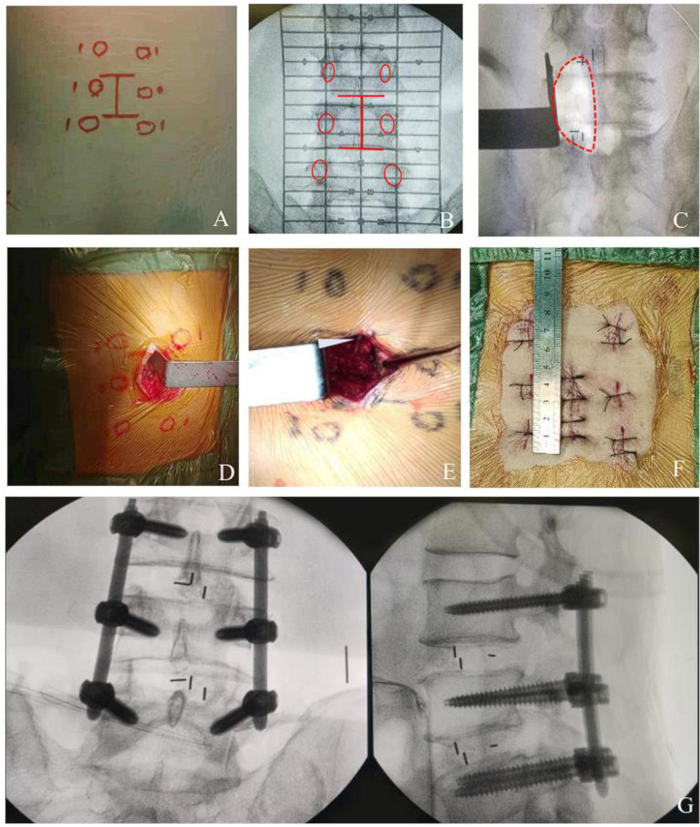
Figure 2 : Procédure de MO-TLIF pour une lésion à plusieurs niveaux. (A-B) Ligne de marque à plusieurs niveaux sur la peau. (C-E) domaine chirurgical de décompression à plusieurs niveaux. (F) Photographie postopératoire montrant l’incision dans MO-TLIF d’environ 4 cm pour une chirurgie à deux segments. (G) Photographie du MO-TLIF montrant les vis pédiculaires et les cages en place. Veuillez cliquer ici pour voir une version agrandie de cette figure.
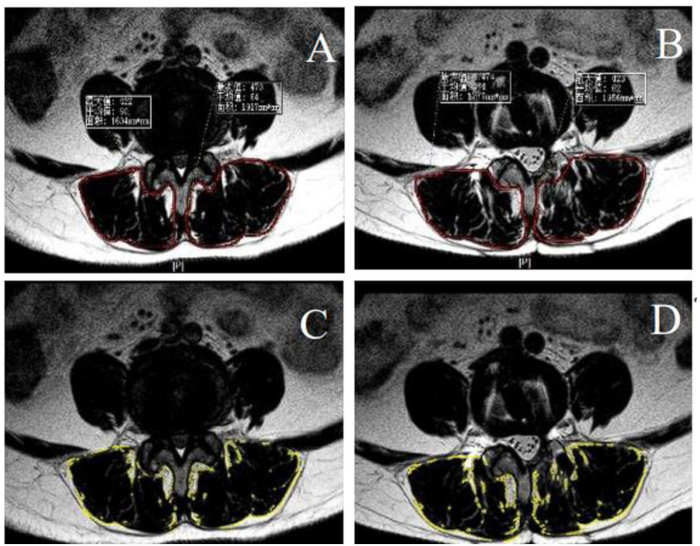
Figure 3 : Infiltration de graisse préopératoire et postopératoire et section transversale du muscle paraspinal. (A-B) Zones transversales préopératoires et postopératoires du muscle paraspinal entourées de la ligne rouge. (C-D) L’infiltration graisseuse préopératoire et postopératoire du muscle paraspinal, en calculant les propriétés par ImageJ, était entourée de la ligne jaune. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Caractéristiques | Valeurs |
| Âge moyen (années) | 54,8 ± 17,5 |
| Sexe (H/F) | 47/49 |
| Diagnostic | |
| Spondylolisthésis lombaire | 21 |
| Hernie discale lombaire avec instabilité segmentaire | 45 |
| Sténose foraminale lombaire avec instabilité segmentaire | 30 |
| IMC | 23,9 ± 2,8 |
| Niveau de fonctionnement | |
| À un seul niveau | |
| L3-4 | 5 |
| L4-5 | 24 |
| L5-S1 | 21 |
| Multi-niveaux | |
| L3-5 | 18 |
| L4-S1 | 24 |
| L3-S1 | 4 |
| Période de suivi (mois) | 13.2 ± 2.1 |
Tableau 1 : Caractéristiques démographiques des patients.
| Métrique | À un seul niveau | Multi-niveaux |
| Hématocrite préopératoire ( %) | 41,6 ± 4,8 | 42,7 ± 7,1 |
| Hématocrite postopératoire ( %) | 38,5 ± 3,4 | 38,8 ± 6,8 |
| Perte de sang peropératoire (mL) | 62,5 ± 28,2 | 108,3 ± 31,2 |
| Estimation de la perte totale de sang (mL) | 213,9 ± 124,8 | 282,8 ± 155,9 |
| Temps de fonctionnement (min) | 102,3 ± 17,2 | 130,2 ± 18,3 |
| Temps de déambulation postopératoire (jours) | 1,7 ± 0,4 | 2,0 ± 0,5 |
Tableau 2 : Données périopératoires.
| Côté | CSA (mm2) | FI ( %) |
| Préopératoire | ||
| Côté décompression | 2088.4 ± 226.7 | 22.14 ± 9.21 |
| Côté controlatéral | 2081,8 ± 238,6 | 22.09 ± 9.04 |
| Postopératoire | ||
| Côté décompression | 2077,9 ± 225,5 | 21.78 ± 8.71 |
| Côté controlatéral | 2076.1 ± 235.5 | 22.20 ± 9.19 |
Tableau 3 : ACS du muscle paraspinal préopératoire et postopératoire et infiltration de graisse.
| Moyenne ± ET (mm2) | Valeur p | |
| Côté décompression préopératoire - Côté controlatéral préopératoire | 6,59 ± 36,65 | 0.081 |
| Côté décompression préopératoire - Côté décompression postopératoire | 10.51 ± 59.68 | 0.088 |
| Côté controlatéral préopératoire - Côté controlatéral postopératoire | 5,77 ± 30,84 | 0.07 |
| Côté controlatéral postopératoire - Côté décompression postopératoire | 1,85 ± 80,48 | 0.822 |
Tableau 4 : Comparaison efficace des muscles paraspinaux. Toutes les analyses statistiques ont été effectuées à l’aide d’un test t à échantillons appariés.
Discussion
Au cours de la dernière décennie, MIS-TLIF, PE-TLIF et BE-TLIF sont progressivement devenus des alternatives à la chirurgie ouverte traditionnelle TLIF, offrant des avantages en termes de traumatisme, de perte de sang et de récupération postopératoire23. Certains chercheurs pensent même que la chirurgie de fusion lombaire assistée par endoscopie remplacera éventuellement la chirurgie ouverte. Cependant, notre étude montre que la chirurgie TLIF ouverte a également fait des progrès significatifs en termes de techniques mini-invasives. Tout en conservant la simplicité et la large applicabilité des procédures ouvertes traditionnelles, elle a permis d’obtenir des résultats cliniques et des effets mini-invasifs similaires aux techniques endoscopiques mini-invasives.
En préopératoire, nous marquons la projection du pédicule, les points d’entrée de l’aiguille de ponction, les segments cibles, l’espace intervertébral et l’incision chirurgicale. Cependant, nous recommandons de vérifier à nouveau le segment par fluoroscopie avant la décompression. En effet, même un léger changement d’angle lors de la dissection peut entraîner des erreurs segmentaires, car nous avons rencontré deux cas de ce type lors de nos chirurgies. Après la dissection, un scalpel osseux à ultrasons est couramment utilisé pour effectuer une ostéotomie et exposer le canal rachidien. Lorsqu’il s’agit du canal rachidien, il est conseillé de conserver partiellement le ligamentum flavum pour réduire l’adhérence des cicatrices, en enlevant uniquement les parties excessivement épaisses qui compriment les nerfs. Si une décompression controlatérale du canal central est nécessaire, l’angle du lit chirurgical peut être ajusté pour enlever une partie de l’os radiculaire de l’apophyse épineuse, réalisant ainsi une décompression du côté opposé. La décompression latérale bilatérale peut nécessiter une dissection bilatérale. Lors de la décompression, pour des raisons de sécurité, il n’est pas nécessaire d’exposer complètement la racine sortante ; Un crochet peut être utilisé pour sonder autour de la racine nerveuse, et s’il y a suffisamment d’espace, une manipulation extensive n’est pas nécessaire. Une fois la décompression et la fusion terminées, la petite incision centrale peut être fermée et des vis pédiculaires percutanées peuvent être placées, ce qui peut raccourcir le temps de rétraction sur les muscles paraspinaux. En termes de sélection de cage, MO-TLIF peut utiliser des cages de fusion de la même taille que les TLIF ouverts traditionnels sans avoir besoin de cages plus petites ou extensibles, ce qui permet de restaurer la hauteur du disque et de réduire le risque d’affaissement de la cage24. Une méta-analyse a suggéré que la cage droite occupe une plus grande surface de la plaque d’extrémité que la cage en forme de banane, créant ainsi une meilleure répartition de la pression, ce qui peut contribuer à un taux d’affaissement plus faible25. Cette étude n’a révélé qu’un seul cas d’affaissement de la cage au cours du suivi. MO-TLIF peut également réaliser une décompression excessive du côté controlatéral, ce qui le rend adapté à la laminotomie unilatérale pour la décompression bilatérale (ULBD). Cela augmente efficacement la surface du canal rachidien, bien qu’une analyse statistique plus approfondie soit nécessaire pour mesurer les améliorations de la hauteur intervertébrale, des angles lombaires et de la surface du canal rachidien.
En raison de la petite taille de l’incision centrale, il ne convient pas aux chirurgies de révision qui nécessitent le remplacement de la fixation interne. Toutefois, cette approche reste applicable dans la plupart des autres cas. Par exemple, dans les chirurgies impliquant quatre segments, deux petites incisions centrales peuvent être utilisées, chaque incision gérant la décompression de deux segments.
La technique MO-TLIF peut être réalisée sous visualisation directe ou à l’aide d’outils visuels tels que des loupes ou des microscopes. Dans cette étude, les patients subissant un MO-TLIF à plusieurs niveaux ont montré de bons résultats, avec une durée moyenne de chirurgie de 108,3 minutes et une perte de sang moyenne de 130,2 ml. La dissection sous-périostée limitée et la rétraction musculaire minimale peuvent protéger les muscles paraspinaux, entraînant des résultats cliniques et un impact musculaire similaires à ceux de la chirurgie de fusion lombaire assistée par endoscopie.
Dans un avenir prévisible, les techniques endoscopiques ou tubulaires pourraient ne pas remplacer complètement les approches chirurgicales ouvertes. MO-TLIF peut effectuer une chirurgie ouverte mini-invasive tout en conservant les avantages uniques de la chirurgie ouverte, tels que la commodité des opérations à plusieurs niveaux, un temps opératoire plus court, une courbe d’apprentissage fluide, l’absence d’instruments spécialisés et la conservation des ressources en eau. Les recherches de Zhang et al. indiquent que le temps opératoire pour le PE-TLIF est de 202 ± 31,4 min avec une perte de sang de 73 ± 26,4 ml, ce qui est significativement inférieur à la perte de sang peropératoire pour le MIS-TLIF (192 ± 18,9 min, 129 ± 31,7 ml), bien que le temps de l’opération soit plus long26. En revanche, une étude menée par Xue et al. a révélé que le temps opératoire pour le PE-TLIF (140,3 ± 35,6 min) est plus court que pour le MIS-TLIF (170,6 ± 54,8 min), la perte de sang peropératoire pour le PE-TLIF (65,6 ± 15,3 ml) étant inférieure à celle du MIS-TLIF (140,5 ± 21,5 ml)27. Les différences dans la durée de la chirurgie peuvent être liées à la compétence du chirurgien. Les méta-analyses montrent que le temps opératoire moyen pour le PE-TLIF est de 155 min avec une perte de sang peropératoire moyenne de 101,1 ml, tandis que le MIS-TLIF a un temps opératoire moyen de 181,1 min et une perte de sang peropératoire de 174 ml28,29.
La perte de sang peropératoire pour le MO-TLIF à un seul niveau (64,5 ± 30,2 mL) est similaire à celle du PE-TLIF et meilleure que celle du MIS-TLIF, avec une durée opératoire significativement plus courte (102,3 ± 17,2 min). MO-TLIF est avantageux pour les opérations à plusieurs niveaux, avec une incision à un seul niveau de 3 cm prolongée de 1 cm en proximal ou en distal pour chaque niveau supplémentaire. Cette approche permet des opérations de décompression avec une extension minimale de l’incision et seulement une légère augmentation de la perte de sang et du temps d’opération.
En conclusion, bien que les techniques endoscopiques mini-invasives présentent des avantages évidents, l’évolution continue des procédures ouvertes mini-invasives comme MO-TLIF continue d’offrir des avantages uniques, en maintenant leur pertinence et leur efficacité en chirurgie de la colonne vertébrale.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Cette étude a été soutenue par un fonds de la Fondation nationale des sciences naturelles de Chine en 2021 (numéro de projet : 82474251) et un fonds du projet scientifique et technologique de la Commission de la santé de Suzhou en 2024 (numéro de projet : LCZX202307).
matériels
| Name | Company | Catalog Number | Comments |
| Absorbable sutures | Suzhou Jiahe | VT401L | |
| Blade | KYUAN | T00100 | |
| C-arm fluoroscopy | Siemens | Siremobile Compact L | |
| High frequency electrotome | Zhejiang Huatong | 20162010692 | |
| Iodophor | Likang High-tech | 31005102 | |
| Lumbar fusion cage | Shandong Weigao | GJXT310417 | |
| Premier posterior spine minimally invasive nail rod system | Shandong Weigao | GJXT310417 | |
| Suture | MERSILK | SA86G | |
| Ultrasonic bone knife | SMTP Technology | XD860A |
Références
- Souslian, F. G., Patel, P. D. Review and analysis of modern lumbar spinal fusion techniques. Brit J Neurosurg. 38, 61-67 (2024).
- Mobbs, R. J., Phan, K., Malham, G., Seex, K., Rao, P. J. Lumbar interbody fusion: Techniques, indications and comparison of interbody fusion options including plif, tlif, mi-tlif, olif/atp, llif and alif. J Spine Surg. 1 (1), 2-18 (2015).
- Foley, K. T., Gupta, S. K., Justis, J. R., Sherman, M. C. Percutaneous pedicle screw fixation of the lumbar spine. Neurosurg Focus. 10 (4), E10(2001).
- Zhao, J., Zhang, F., Chen, X., Yao, Y. Posterior interbody fusion using a diagonal cage with unilateral transpedicular screw fixation for lumbar stenosis. J Clin Neurosci. 18 (3), 324-328 (2011).
- Foley, K. T., Lefkowitz, M. A. Advances in minimally invasive spine surgery. Clin Neurosurg. 49, 499-517 (2002).
- Kambin, P. Arthroscopic microdiscectomy. Arthroscopy. 8 (3), 287-295 (1992).
- Osman, S. G. Endoscopic transforaminal decompression, interbody fusion, and percutaneous pedicle screw implantation of the lumbar spine: A case series report. Int J Spine Surg. 6, 157-166 (2012).
- Kim, J. E., Choi, D. J. Biportal endoscopic transforaminal lumbar interbody fusion with arthroscopy. Clin Orthop Surg. 10 (2), 248-252 (2018).
- Derman, P. B., Albert, T. J. Interbody fusion techniques in the surgical management of degenerative lumbar spondylolisthesis. Curr Rev Musculoskelet Med. 10 (4), 530-538 (2017).
- Meng, F. J., et al. Comparison research of mMO-TLIF via midline approach versus MIS-TLIF via Wiltse approach for thoracolumbar surgery. Orthop J China. 28, 118-122 (2020).
- Li, S. W., et al. Comparison of mMO-TLIF via midline incision versus MIS-TLIF via Wiltse approach in lumbar degenerative disease. Indian J Orthop. 58, 1278-1287 (2024).
- Anand, N., Hamilton, J. F., Perri, B., Miraliakbar, H., Goldstein, T. Cantilever tlif with structural allograft and rhbmp2 for correction and maintenance of segmental sagittal lordosis: Long-term clinical, radiographic, and functional outcome. Spine. 31 (20), E748-E753 (2006).
- Shafaq, N., et al. Asymmetric degeneration of paravertebral muscles in patients with degenerative lumbar scoliosis. Spine. 37 (16), 1398-1406 (2012).
- Laasonen, E. M. Atrophy of sacrospinal muscle groups in patients with chronic, diffusely radiating lumbar back pain. Neuroradiology. 26 (1), 9-13 (1984).
- Hira, K., et al. Relationship of sagittal spinal alignment with low back pain and physical performance in the general population. Sci Rep. 11 (1), 20604(2021).
- Hiyama, A., et al. The correlation analysis between sagittal alignment and cross-sectional area of paraspinal muscle in patients with lumbar spinal stenosis and degenerative spondylolisthesis. BMC Musculoskelet Disord. 20 (1), 352(2019).
- Singh, K., et al. A perioperative cost analysis comparing single-level minimally invasive and open transforaminal lumbar interbody fusion. Spine J. 14 (8), 1694-1701 (2014).
- Phan, K., Rao, P. J., Kam, A. C., Mobbs, R. J. Minimally invasive versus open transforaminal lumbar interbody fusion for treatment of degenerative lumbar disease: systematic review and meta-analysis. Eur Spine J. 24 (5), 1017-1030 (2015).
- Nadler, S. B., Hidalgo, J. H., Bloch, T. Prediction of blood volume in normal human adults. Surgery. 51 (2), 224-232 (1962).
- Gross, J. B. Estimating allowable blood loss: corrected for dilution. Anesthesiology. 58 (3), 277-280 (1983).
- Bridwell, K. H., Lenke, L. G., Mcenery, K. W., Baldus, C., Blanke, K. Anterior fresh frozen structural allografts in the thoracic and lumbar spine. Spine. 20 (12), 1410-1418 (1995).
- Jacob, K. C., et al. The effect of the severity of preoperative disability on patient-reported outcomes and patient satisfaction following minimally invasive transforaminal lumbar interbody fusion. World Neurosurg. 159, E334-E346 (2022).
- Ba, Z., et al. Percutaneous endoscopical transforaminal approach versus plf to treat the single-level adjacent segment disease after plf/plif: 1-2 years follow-up. Int J Surg. 42, 22-26 (2017).
- Zhang, H., et al. Percutaneous endoscopic transforaminal lumbar interbody fusion: Technique note and comparison of early outcomes with minimally invasive transforaminal lumbar interbody fusion for lumbar spondylolisthesis. Int J Gen Med. 14, 549-558 (2021).
- Amer, S., Gaby, K., Jean, T., Khalil, K., Mohammad, D. Transforaminal lumbar interbody fusion using banana-shaped and cages: meta-analysis of and outcomes. Eur Spine J. 32, 3158-3166 (2023).
- Xue, Y. D., Diao, W. B., Ma, C., Li, J. Lumbar degenerative disease treated by percutaneous endoscopic transforaminal lumbar interbody fusion or minimally invasive surgery-transforaminal lumbar interbody fusion: A case-matched comparative study. J Orthop Surg Res. 16 (1), 696(2021).
- Zhu, L., et al. Comparison of clinical outcomes and complications between percutaneous endoscopic and minimally invasive transforaminal lumbar interbody fusion for degenerative lumbar disease: A systematic review and meta-analysis. Pain Physician. 24 (6), 441-452 (2021).
- Song, Y. F., et al. Percutaneous endoscopic versus minimally invasive transforaminal lumbar interbody fusion for lumbar degenerative diseases: A meta-analysis. Wideochir Inne Tech Maloinwazyjne. 17 (4), 591-600 (2022).
- Aoki, Y., et al. Influence of pelvic incidence-lumbar lordosis mismatch on surgical outcomes of short-segment transforaminal lumbar interbody fusion. BMC Musculoskelet Disord. 16, 213(2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon