Method Article
Hücresel metabolizmayı incelemek için multimodal optik görüntüleme platformu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Etiketsiz optik görüntüleme modalitelerini birleştiren çok modlu bir platform kullanarak, hücresel dinamikleri ve metabolizmayı görselleştirmek ve ölçmek için bir protokol geliştirdik. Çoklu foton floresansı, ikinci harmonik üretimi ve uyarılmış Raman saçılma mikroskobu yoluyla görüntüleme yoluyla, hücresel ve moleküler çevreye bütünsel bir genel bakış oluşturabiliriz.
Özet
Optik görüntüleme teknolojileri, biyolojik örneklerden yüksek uzamsal çözünürlükte hem morfolojik hem de fonksiyonel bilgi elde etme yetenekleri nedeniyle biyomedikal çalışmalarda kritik öneme sahiptir. Bu optik süreçler, fotonlar ve hücreler, dokular veya organlar içindeki moleküller arasında saçılma, absorpsiyon, emisyon ve harmonik oluşturma gibi çeşitli ışık molekülü etkileşimlerinden yararlanır. Konvansiyonel biyomedikal görüntüleme tarihsel olarak tek bir modalitenin uygulanmasına odaklanmış olsa da, son araştırmalar bu çeşitli tekniklerin tamamlayıcı içgörüler sağladığını ve bunların birleşik çıktılarının yaşlanma süreçlerindeki moleküler değişiklikler ve hastalık gelişimi ve hücre biyolojisindeki temeller hakkında daha kapsamlı bir anlayış sunduğunu göstermiştir.
Son yıllarda, etiketsiz optik görüntüleme yöntemleri ilerlemiş ve hücresel ve hücre altı ortamların ayrıntılı olarak araştırılmasını sağlamıştır. Örneğin, çoklu foton floresan (MPF) sadece hedeflenen protein görüntülemeyi kolaylaştırmakla kalmaz, aynı zamanda otofloresan koenzimler aracılığıyla metabolik aktiviteyi ölçerek yüksek penetrasyon derinliği ve uzamsal çözünürlük sağlar. İkinci Harmonik Nesil (SHG), hücre dışı matristeki kollajen gibi yapıları görüntülemek için kullanılırken, Uyarılmış Raman Saçılması (SRS), kimyasal bağları ve moleküler bileşimi hücre altı çözünürlükle yerinde haritalandırır.
MPF, SHG ve SRS modalitelerini birleştiren multimodal bir görüntüleme platformu geliştirdik. Bu modalitelerin tek bir platforma entegrasyonu, hücreler, dokular, organlar ve hatta bedenler içindeki aynı lokalizasyondan çok yönlü bilgilerin elde edilmesini sağlayarak, hücresel metabolizma, hücre dışı matris yapısı ve moleküler bileşim arasındaki karmaşık ilişkilerin daha ayrıntılı bir şekilde araştırılmasını kolaylaştırır. Bu multimodal sistem, hücre altı çözünürlük, derin doku penetrasyonu, yerinde canlı hücre/doku görüntülemenin yanı sıra konum ayarlamaları, cihaz değiştirme veya analiz sonrası hizalamaya gerek kalmadan etiketsiz algılama ve anlık ortak kayıt sunar. Burada, bu multimodal platformla etiketsiz görüntüleme için bir protokol sunuyoruz ve yaşlanma ve hastalıkları incelemek için hücre ve dokularda hücresel metabolizmayı ve moleküler heterojenliği karakterize etmedeki uygulamasını gösteriyoruz.
Giriş
Optik biyomedikal görüntüleme, biyolojik yapı ve işlev anlayışımızı geliştirmede çok önemli olmuştur. Görüntüler, uyarma ışığının modüle edilmesi ve ışık-doku etkileşimlerinden gelen sinyallerin algılanmasıyla oluşturulur. Hans ve Zacharias Janssen tarafından 1590 civarında geliştirilen ilk bileşik mikroskop, bir tüpte iki dışbükey lens kullandı ve 30x1'e kadar büyütme sağladı. Modern optik mikroskoplar, yüzyıllar süren ilerlemeleri takiben, artık 1-3 nm 2,3 kadar ince çözünürlüklere ulaşabilmektedir. Yüksek çözünürlük sunmanın yanı sıra, gelişmiş görüntüleme sistemleri artık daha derin doku penetrasyonu, daha fazla verimlilik ve minimum numune hasarı sağlayarak onları özellikle canlı hücre ve doku görüntüleme için uygun hale getiriyor. Etiketsiz görüntüleme, hücre içi süreçleri kesintiye uğratmadan veya numune bütünlüğünden ödün vermeden bilgi topladığı için özellikle avantajlıdır.
Çoklu foton floresan (MPF) mikroskobu, özellikle iki fotonlu floresan mikroskobu, etiketsiz görüntüleme için yaygın olarak kullanılmaktadır. Doğrusal tek foton absorpsiyonu ve emisyonuna dayanan geleneksel floresan mikroskobunun aksine, MPF uyarımı, birleşik enerjisi tek bir florofor molekülünü 4,5 uyaran birden fazla fotonun aynı anda emilmesini içerir. Tipik olarak kızılötesi spektrumdaki bu fotonlar, tek foton uyarımı için gereken enerjinin yarısına veya daha azına sahiptir. Bu doğrusal olmayan süreçte odak noktasındaki daha uzun dalga boyları ve lokalize uyarma, daha düşük saçılma, daha derin doku penetrasyonu ve daha az fototoksisite ile sonuçlanır.
Hücresel metabolik bilgi, indirgenmiş nikotinamid adenin dinükleotid (NADH) ve flavin adenin dinükleotid (FAD) gibi endojen metabolik substratlardan otofloresan sinyallerinin tespiti yoluyla etiketsiz MPF mikroskobu ile yakalanabilir. Bu koenzimler, farklı uyarma ve emisyon spektrumları sergiler ve redoks oranı (NADH/FAD) olarak bilinen floresan yoğunluk oranları, hücrenin oksidatif durumunu yansıtır. Britton Chance'in 1979'da redoks oranı kavramını ilk kez ortaya atmasından bu yana, NAD(P)H/FAD, NAD(P)H/(FAD + NAD(P)H) ve FAD/(FAD + NAD(P)H) dahil olmak üzere ek oranlar önerilmiştir 6,7,8,9. Bu optik redoks oranlarının MPF görüntüleme yoluyla ölçülmesi, metabolik dinamikler hakkında değerli bilgiler sağlar. Örneğin, MPF görüntüleme, kanser hücrelerini değişmiş metabolizmalarına dayalı olarak normal hücrelerden ayırt edebilir ve kanser teşhisi potansiyelini gösterir 10,11,12. Bununla birlikte, MPF tabanlı otofloresan algılamanın sınırlamaları vardır. Keratin gibi diğer içsel floroforlar, floresan yoğunluğuna katkıda bulunarak spektral karışmaya ve yanlış sinyal yorumlamasına13 yol açabilir. Ek olarak, redoks oranı yalnızca genel hücresel oksidasyon-indirgeme değişikliklerini yansıtır ve farklı kaynaklardan (örneğin, sitoplazmik veya mitokondriyal) NADH arasında veya NADH ile NADH (P) arasında ayrım yapmaz, çünkü her ikisi de 450 nm'de benzer spektral zirveler sergiler, bu da harmanlanmış yoğunluk sinyallerine neden olur14.
İlk olarak 1980'lerde biyomedikal alanda gösterilen doğrusal olmayan bir optik süreç olan İkinci Harmonik Nesil (SHG), hücresel yapıların etiketsiz görüntülenmesi için yaygın olarak kullanılmaktadır15,16. MPF'ye benzer şekilde, SHG, ultra hızlı darbeli bir lazerden aynı enerjiye sahip iki fotonun aynı anda emilmesini içerir. Bu fotonlar, gelen ışığın frekansının iki katı yeni bir foton yaymak için yeniden birleştirilir ve bu da ikinci harmonik sinyalin algılanmasıyla sonuçlanır. Bu doğrusal olmayan optik etkileşim, yalnızca ikinci harmonik sinyali17,18 üretmek için bir polarizasyonu indüklemek için sıfırdan farklı bir ikinci dereceden duyarlılık sergileyen sentrosimetrik olmayan malzemelerde meydana gelir. Bu, SHG'yi ekzojen floresan boyalar 15,17,19,20 gerektirmeden filamentli proteinleri ve kollajen, miyozin ve tübülin gibi fibriler yapıları görüntülemek için özellikle etkili kılar. Fibroz ve kollajenin bolluğu, sertliği, hizalaması ve yapısındaki anormallik, iltihaplanma ve kanser gibi birçok durumda yaygındır ve SHG'yi belirli hastalık durumları için verimli ve invaziv olmayan tespit için umut verici bir araç haline getirir 21,22,23. Meme, yumurtalık ve cilt kanserleri üzerine yapılan çalışmalar da dahil olmak üzere onkolojik araştırmalarda SHG görüntülemenin yaygın olarak uygulanması, hem temel araştırmalarda hem de potansiyel klinik uygulamalarda kritik rolünü vurgulamıştır 24,25,26,27.
Farklı moleküller, gelen ışık tarafından uyarıldığında değişen derecelerde esnek olmayan saçılmaya neden olan farklı titreşim enerji seviyeleri sergiler - ilk olarak 1928'de C. V. Raman tarafından karakterize edilen bir fenomen28. Raman etkisi, o zamandan beri, dışsal etiketleme olmaksızın moleküler ve doku bileşimlerinin tespiti için optik mikroskopide yaygın olarak kullanılmaktadır. Hem Uyarılmış Raman Saçılması (SRS) hem de tutarlı anti-Stokes Raman Saçılması (CARS), moleküler titreşimleri tutarlı bir şekilde uyarır ve geleneksel Spontan Raman Spektroskopisine kıyasla daha güçlü bir sinyal üretmek için ışığın doğrusal olmayan etkileşiminden yararlanır. SRS fenomeni ilk olarak 1962'de bildirilmiştir29. 2008 yılında, bu mekanizma üç boyutlu çoklu foton görüntülemeye entegre edildi ve moleküler titreşim geçişleri30 nedeniyle Pompa ve Stokes kirişlerindeki yoğunluk değişikliklerine dayalı olarak kimyasalların seçici olarak algılanmasına izin verdi. Bu yöntem, rezonans olmayan arka plan parazitini en aza indirerek CARS'ınkini aşan temiz bir yoğunluk sinyali üretir. SRS görüntüleme, çoğullanmış ve hiperspektral görüntüleme sağlamada, çoklu kimyasal bağların aynı anda tespit edilmesini sağlamada ve önemli penetrasyon derinliğine sahip numunelerde moleküler bileşimin yüksek çözünürlüklü görselleştirilmesine izin vermede mükemmeldir. Nispeten yeni bir teknik olmasına rağmen, SRS görüntülemenin hem klinik tanı hem de metabolik araştırmalarda in vivo ve in vitro olarak etkili olduğu kanıtlanmıştır 30,31,32,33,34,35,36. Örneğin, SRS, lipid-protein oranını ölçerek beyin tümörü ile infiltre edilen dokuları korteks ve beyaz cevherden ayırt edebilir ve tümör sınırlarının etiketsiz, invaziv olmayan bir şekilde tanımlanmasını sağlar37,38. Ek olarak, genellikle yaşlanma ile ilgili ve kanserle ilişkili hastalıkların ayırt edici özellikleri olarak kabul edilen metabolik değişiklikler, ağır su (D2O) ile muamele edilen numunelerde karbon-döteryum bağlarının tespit edilmesiyle elde edilen SRS kullanılarak kantitatif olarak değerlendirilebilir ve protein sentezi, lipogenez ve diğer makromoleküler metabolik süreçlerin kantitatif ölçümüne izin verir 31,33,34,35,36. Metabolitleri yüksek zamansal ve mekansal çözünürlükle izleme yeteneği, SRS'yi daha geniş klinik uygulamalar için potansiyele sahip, hastalık araştırması ve teşhisi için umut verici bir araç olarak konumlandırmaktadır.
Multimodal görüntüleme, biyomedikal araştırmalarda güçlü bir yaklaşım olarak ortaya çıkmıştır ve aynı örnekteki karmaşık biyolojik sistemler hakkında daha kapsamlı bir anlayış kazanmak için iki veya daha fazla görüntüleme yöntemini entegre etmiştir. 2018 yılında, iki fotonlu floresan (2PF), üç fotonlu floresan (3PF), SHG ve üçüncü harmonik üretimi (THG)39 entegre eden etiketsiz bir otofloresan-multiharmonik (SLAM) mikroskopi tekniği tanıtıldı. Bu yaklaşım, hücresel etkileşimlerin, dinamik süreçlerin ve tümör mikroçevresi içindeki bireysel bileşenlerin eşzamanlı olarak görselleştirilmesini kolaylaştırır. SLAM mikroskobu, numune için minimum bozulma ve azaltılmış lazer gücü gereksinimleri sunarak derin doku profillemesi sağlar ve intravital izleme için daha güvenli bir yöntem sağlar40. Cerrahi prosedürler sırasında in situ kanser tespiti için içsel floresan spektroskopisi, yaygın yansıma spektroskopisi ve Raman spektroskopisini birleştiren başka bir multimodal modalite geliştirilmiştir41. Ek olarak, CARS, SHG ve iki fotonlu floresanı (TPF) entegre eden yakın zamanda tasarlanmış çok modlu doğrusal olmayan bir endoskopi sistemi, biyolojik örnekleri mikron altı ve hücre altı uzamsal çözünürlükte görüntüleme yeteneğini göstermiştir42. Kombine 2PF ve SRS mikroskobu benzer şekilde dokuların, hücrelerin ve organellerin yüksek çözünürlüklü, in-vivo görüntülenmesi için kullanılmıştır 42,43,44,45. Ortaya çıkan bu multimodal görüntüleme teknikleri, bireysel modalitelerin güçlü yönlerinden yararlanarak gelişmiş çözünürlük, penetrasyon derinliği ve görüntü elde etme verimliliğine yol açar ve böylece klinik ve cerrahi uygulamalar için önemli bir potansiyel gösterir.
Bu çok modaliteli yaklaşım, tek modaliteli görüntülemeye göre giderek daha fazla tercih edilmektedir, çünkü bireysel tekniklerle ilişkili sınırlamaları azaltırken daha geniş bir ölçüm yelpazesi sağlar. Daha önce tartışıldığı gibi, MPF, metabolik değişiklikleri yansıtmak için endojen floresanı ölçer, SHG, biyolojik numunelerde kollajen gibi merkezyosimetrik olmayan yapıları görüntüleyebilir ve SRS, titreşim modlarına dayalı olarak ayırt edici Raman sinyalleri üreten yüksek yoğunluklu kimyasal bağlar nedeniyle ağırlıklı olarak proteinleri ve lipitleri tespit eder. Tutarlı özellikleri ve doğrusal olmayan optik özelliklerin ortak prensibi göz önüne alındığında, bu görüntüleme modaliteleri, ultra kısa darbeli lazerler kullanan tek bir mikroskop kurulumuna entegre edilebilir ve biyolojik süreçlerin daha eksiksiz bir görünümünü sağlamak için lokalize bölgelerde çeşitli biyobelirteçlerin elde edilmesine olanak tanır44,45. Bu makale, biyomedikal araştırma uygulamaları için MPF, SHG ve SRS'yi entegre eden çok modlu bir görüntüleme platformunun uygulanmasına yönelik bir protokolün ana hatlarını çizmektedir.
Protokol
1. Etiketsiz multimodal görüntüleme deneyleri
NOT: Bu protokol, etiketsiz multimodal görüntülemenin kurulum ve edinme prosedürüne odaklanır.
- Multimodal mikroskobun kurulumu (Şekil 1A) ve sistem kalibrasyonu
- Lazeri ısıtın ve yaklaşık 15-20 dakika bekleyin.
- Kontrol ünitelerini ve monitörleri aşağıdaki sırayla açın: Kontrol kutusu | Dokunmatik panel denetleyicisi | Ana lazer uzaktan kumanda için AC adaptör Alt lazer uzaktan kumanda için AC adaptörü.
- Si fotodiyot dedektörünü ve kilitli amplifikatörü açın.
- Pompa lazer ışınlarını ve Stokes ışınını yapılandırın. Lazer sistemini 780 nm'den 990 nm'ye ayarlanabilen bir pompa ışını, 5 - 6 ps darbe genişliği ve 80 MHz tekrarlama oranı ile kurun. Stokes lazer ışını, 6 ps darbe ve 80 MHz tekrarlama oranı ile 1.031 nm'lik sabit bir dalga boyuna sahiptir. Hizalama plakasında görünmesi için hem pompa hem de Stokes kirişlerinin düşük güçte (en az 20 mW) olduğundan emin olun.
- Pompaların ve Stokes ışınlarının uzamsal örtüşmesini kontrol etmek için optik yola (lazer kutusunun hemen arkasına) bir hizalama plakası yerleştirin ve hizalama plakasının merkezinde her iki nokta da üst üste gelene kadar aynayı ayarlayın.
NOT: Pompalar ve Stokes ışınları kabaca üst üste binmiş olsa da, iki lazer ışınının uzamsal örtüşmesinin ince ayarı, optimum SRS sinyalini elde edebilir. - Uzamsal örtüşmeden sonra, önce OPO kontrol yazılımına tıklayarak PSD (Konuma Duyarlı Dedektör) ile ince ayar yapın. Optik aynayı 1 (OM1) dikkatlice ayarlamak için altıgen tuşu kullanın ve merkezden minimum sapmayı hedeflemek için XY konum değişikliği için PSD ekranını izleyin. Ardından, daha hassas ayarlamalar yapmak için, konum göstergesi PSD ekranında ortalanana kadar optik ayna 2 (OM2) üzerindeki altıgen tuşu kullanın.
NOT: OM1 ve OM2, lazer hizalamasını ayarlamak için OPO kafasındaki iki aynadır. - Son olarak, iris diyafram görüntüsünü görüş alanının merkezine taşımak için iki kondansatör merkezleme vidasını çevirerek kondansatörü ortalayın.
NOT: Alan iris diyaframı, objektife giren ışık huzmesinin çapını kısıtlayabilir ve böylece yabancı ışığı hariç tutarak görüntü kontrastını iyileştirebilir.
- Etiketsiz multimodal görüntüleme elde etme adımları
- Yüksek sayısal açıklıklı (1.4 NA) yağ kondansatörüne yağ sürün ve mikroskop lamını yağlı kondansatörün üzerine monte edin. Son olarak, 25x su objektifi için mikroskop lamına büyük bir su damlası yerleştirin. Mikroskobun güvenli bir şekilde monte edildiğinden ve taşınmaz olduğundan emin olun ve ardından biyolojik numunenin parlak alan görüntüsü 25x su objektifi altında görülebilene kadar odağı ayarlamak için z aşamasını ayarlayın.
- Görüntüleme işlemine doğru sırayla başlayın: MPF'nin görüntü kalitesini ve hassas analizini etkileyecek foto ağartmayı önlemek için MPF, SHG ve SRS. MPF ve SHG arasında hızlı bir şekilde geçiş yapmak için pompa kirişinden sabit Stokes kirişine geçin.
NOT: Pompa lazerinin 800 nm'den (NADH ve FAD otofloresan) 791,3 nm'ye (CH3 Raman kayması) ayarlanması 1-2 dakika sürebilir. - Her modalite için görüntü çözünürlüğünü (512 x 512 piksel) ve uygun bekleme süresini seçin. Ortalama kare 8'ün üzerinde olan MPF ve SHG için 3 μs/piksel kullanın. SRS modalitesi için ortalama kare 2 ile 40 μs/piksel kullanın.
NOT: Ortalama kare, kaydetmeden önce ortalaması alınacak görüntü sayısı anlamına gelir. - MPF ile otofloresan elde etmek için Stokes lazer ışınını kapatın ve heyecan verici NADH ve flavin için pompa lazerini 800 nm'ye ayarlayın. FVOPT filtre küpünü NADH ve flavin için sırasıyla 460 ± 10 nm ve 515 ± 10 nm ile ışık yoluna takın. Numune üzerindeki güç bu nedenle yaklaşık 15 mW'dir.
- SHG kullanarak kollajen lifi sinyalini elde edin. Pompa lazer ışınını kapatın, yalnızca stokes lazer ışını kullanın ve gücü 500 mW olarak ayarlayın. Yalnızca 515 nm filtreyle ilgili kanalı alın.
- SRS kullanarak proteinlerin ve lipitlerin uzamsal dağılımını elde edin. Her iki lazer ışınını da açık tutun ve lazer ışını frekansını her molekül için belirli titreşim moduna uyacak şekilde ayarlayın.
NOT: Tipik olarak, CH3 için 791.3 nm, CH2 için 797 nm, doymamış lipitler için 787 nm ve doymuş lipitler için 794.6 kullanılır. Numune üzerindeki güç bu nedenle yaklaşık 40 mW'dir. - SRS hiperspektral görüntü veri kümelerini elde etmek için, taramayı seçmek için OPO kontrol yazılımını açın, dalga boyu aralığını 780 nm ile 806.5 nm arasında ayarlayın ve en az 60 yığın sayısı seçin. Ardından, hiperspektral görüntü yığınını yakalayın.
NOT: Elde edilen veri seti, her biri belirli bir Raman kaymasındaki (2.700 cm-1'den 3.150 cm-1'e) uzamsal dağılımı temsil eden 60 görüntü içerir. Hiperspektral çekim süresi, görüntünün görüş alanına (FOV) ve tarama süresine bağlıdır, ancak 512 x 512 görüntü için yaklaşık 5 dakika ile 8 dakika arasında olacaktır. Daha büyük görüntüler için, 2 saat sonra meydana gelebilecek herhangi bir foto hasarı önlemek için (numunenin kalınlığına ve FOV boyutuna bağlı olarak) lazer altında kalan süreyi en aza indirmeye özen gösterilmelidir. - Aynı ilgi bölgelerinin (ROI'ler) tüm resimlerini aynı klasöre kaydedin. Görüntü formatı Olympus .oir dosyasıdır.
2. Görüntü analizi
- Kaydedilen tüm ham görüntüleri açmak için görüntü işleme yazılımını kullanın, böylece rengi atayın ve görüntü gösterimi için ölçek çubuğunu ekleyin. Ayrıca, optik redoks oranı ve lipid doymamışlık analizi için NADH ve doygunluk yağ asitlerinin (SFA'lar, 2.880 cm-1) ikili maskesini oluşturmak için kullanın.
NOT: Maske yoğunluğunun yalnızca 0 ve 1 olduğundan emin olun. - Herhangi bir aşağı akış analizi yapmak için evde oluşturulmuş python betiğini kullanın (kod https://github.com/lingyanshi2020/HSI_Analysis'da mevcuttur).
NOT: Bu komut dosyası, hem kontrol hem de kanser örneklerinden birden fazla ilgi bölgesini (ROI) işlemek için tasarlanmıştır. Komut dosyasının ana işlevi yalnızca iki girdi gerektirir: kontrol için dosya yolları ve kanser görüntü klasörleri.- Aynı temel ada sahip görüntüleri eşleştirerek klasörleri yineleyin (ör. "roi_1_flavin.tif", "roi_1_nadh.tif", "roi1_mask.tif").
- Eşleşen görüntülerin her kümesi için, komut dosyasının oransal analiz gerçekleştirmesine ve bu hesaplamalara dayalı olarak yeni oransal görüntüler oluşturmasına izin verin.
Optik redoks oranı flavin / (NADH + flavin) olarak hesaplanır.
Lipid doymamışlığı şu şekilde hesaplanır: USFA'lar / (SFA'lar + USFA'lar), burada USFA'lar doymamış yağ asitlerini temsil eder. - Görüntülerdeki tüm oran ölçümleri daha sonra kolay manipülasyon için bir pandas DataFrame'de saklanır. Tek yönlü ANOVA gerçekleştirin ve niceleme için çubuk grafiği veya kutu grafiği yapmak için "ggplot" styple veya seaborn ile matplotlib kullanın.
- Çıkarılmış (CH3 - CH2) bir görüntü oluşturmak için 2.930 cm-1 (CH 3) ve 2.850 cm-1 (CH2) görüntüleri kullanın. Ardından, dijital histoloji görüntüsünü46 oluşturmak için RGB renk uzayında CH2 görüntüsü CH3 - CH2 görüntüsünü H&E boyamayı taklit eden özel bir LUT ile karıştırın.
- Hiperspektral SRS görüntülerinin alınmasından sonra, görüntüleri spektral benzerliklere göre bölümlere ayırmak için k-ortalama kümelemesini yapmak için ev yapımı python komut dosyasını kullanın (kod şu adreste mevcuttur: https://github.com/lingyanshi2020/HSI_Analysis).
- .tiff görüntü yığınlarını tifffile paketiyle yükleyin. SRS hiperspektral görüntü yığınını (x, y, spektrum) 2B diziye (pikseller, spektrumlar) yeniden şekillendirin.
- Tanımlanan sayıda kümeyle bu 2B diziye k-means algoritmasını dağıtmak için scikit-learn paketini kullanın.
- Elde edilen küme etiketlerini orijinal görüntü boyutlarına geri döndürerek bir segmentasyon haritası oluşturun.
- Her kümeye benzersiz renkler atayın ve doku içindeki farklı biyokimyasal bileşimleri temsil eden sahte renkli bir görüntü oluşturun.
- Her kümenin spektrumlarını ortalama değer (düz çizgi) ve standart sapma (gölge alan) ile çizmek için matplotlib kullanın
- SRS hiperspektral görüntü veri kümeleri47 ile uzamsal etiketsiz lipid alt tipi algılamasını oluşturmak için MATLAB kullanarak cezalandırılmış referans eşleştirme SRS (PRM-SRS) protokolünün protokolünü izleyin.
- Görüntüleri düzenleyin ve 300 dpi .tif biçiminde kaydedin.
Sonuçlar
Şekil 2'deki görüntüler, FAD ve NADH'nin otofloresansının elde edilmesi için protokolün yanı sıra protein, toplam lipitler, doymamış lipitler ve doymuş lipitler için dört SRS kanalının izlenmesinden elde edilen sonuçları temsil etmektedir. Burada ayrıca RGB renk harmanlama yoluyla protokolde açıklandığı gibi sözde histolojik bir görüntü oluşturuyoruz. MPF ve SRS kanallarının alınması, daha sonra oransal analizde kullanılacak görüntü dosyalarını sağlar. Bu analizin bir örneği, insan akciğer dokusu üzerinde Şekil 3'te görülebilir. Protokolde görüntü elde edilmesinin ardından, Python veya ImageJ kullanan görüntü analiz metodolojimiz, nicel metabolik bilgi sağlamak için farklı kanalların oranından yararlanır. Şekil 3'ün lipid doymamışlığı ve optik redoks oranı görüntülerinde gösterildiği gibi, oransal analiz, nispi metabolik aktivite ve moleküler bileşimin dağılımının bir renk haritasını sağlar. Bu ölçümleri, belirli dokuların, patolojilerin veya farklı biyolojik faktörlerin metabolik yolaklarındaki ve lipid içeriğindeki değişikliklerle ilgili gözlemler yapmak için kullandık. Şekil 4'te görüldüğü gibi, bu, 2D mikroskopi görüntüsündeki dağılımına ek olarak oksidatif stres ve lipid doymamışlığının ortalama değerlerini karşılaştırarak sağlıklı ve tümör dokusunun kantitatif bir karşılaştırmasını sağlayabilir.
MPF ve SRS görüntülerinin oransal analizi için, genellikle Eşitlik (1) ve (2) ile gösterildiği gibi optik redoks ve doymamışlık oranını hedefleriz.
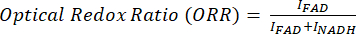 (1)
(1)
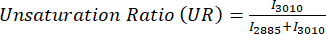 (2)
(2)
Burada I C, C kanalındaki piksellerin yoğunluğudur. Böylece piksel başına oranı ölçüyor ve bu metabolik ve moleküler belirteçlerin uzamsal dağılımını elde ediyoruz.
Oransal analize ek olarak, Şekil 4 , multimodal platformumuz için başka bir potansiyel uygulama yolunu da göstermektedir: hiperspektral görüntü analizi. Bu protokolde açıklandığı gibi, ayarlanabilir bir pompa ışını kullanarak birden fazla lazer dalga boyunda bir tarama gerçekleştirerek bir SRS hiperspektral görüntüsü elde edebiliriz. Bu, mikroskopi görüntüsündeki her piksel için Raman kayma spektrumunun CH bölgesini yeniden yapılandırmamıza olanak tanır ve hem Raman spektroskopisi tarafından sağlanan kimyasal bilgileri hem de optik mikroskopi tarafından sağlanan uzamsal bilgileri birleştirir. Görüntü analizi iş akışında, bu hiperspektral görüntüleri analiz etmek için uygulanan iki tekniği vurguluyoruz: biyomolekül tespiti için PRM-SRS ve k-ortalama kümeleme. Şekil 4E , bir fare hepatik tümörünün görüntüsü üzerinde PRM-SRS uygulamasını göstermektedir. PRM-SRS algoritması, Raman spektrumundaki kaymalar için bir ceza ile ayarlanan her bir piksel için spektrumlar arasındaki korelasyonu sağlar; Algoritma daha sonra lipitlerin her biri için olasılık dağılımı görüntüleri üretir.
Piksel spektrumlarının K-ortalama kümelenmesi, belirli spektral fenotiplerin gruplandırılmasını görselleştirmek için uyguladığımız başka bir tekniktir ve sırasıyla yoğunluk ve spektral şekil yoluyla bağ konsantrasyonu ve moleküler bileşim ile ayırmayı sağlar. Şekil 5 , protokolümüzde k-ortalama kümeleme yoluyla görüntü analizinin nasıl uygulanabileceğine dair bir örnek sunmaktadır. K-ortalama kümelerinin, SRS kanallarından veya psödo-Hematoksilen ve Eozin histolojik boyamadan (H&E) kolayca ayırt edilemeyen özelliklerden daha fazla kümelenme sağlamanın yanı sıra, psödo-histoloji figürlerinden gelen özelliklerle yapısal olarak hizalanmasını bekliyoruz. PRM-SRS ve k-means kümeleme analizi, eksojen problamaya gerek kalmadan spesifik analitler ve moleküler bağlar hakkında kimyasal ve yarı hedeflenebilir bilgiler sağlayarak bu etiketsiz görüntüleme platformunu tamamlar.
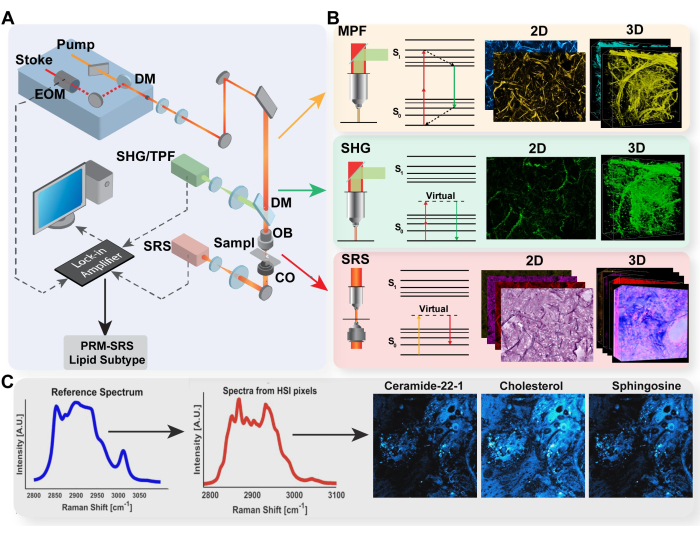
Şekil 1: Multimodal görüntüleme platformu ve PRM-SRS biyomolekül tespitinin diyagramı. (A) MPF / TPF, SHG ve SRS görüntüleme sistemi için donanım kurulum şeması. (B) TPF, SHG ve SRS için ışık yolu ve Jablonski diyagramı, her modalite için temsili olarak elde edilen görüntülerle. (C) Spontan Raman spektroskopisi ve SRS hiperspektral görüntüleme arasında spektral referans eşleştirmesi için PRM-SRS iş akışı diyagramı. Kısaltmalar: MPF = çoklu foton floresan; TPF = iki fotonlu floresan; SHG = ikinci harmonik üretimi; SRS = uyarılmış Raman saçılması; PRM = cezalandırılmış referans eşleştirme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
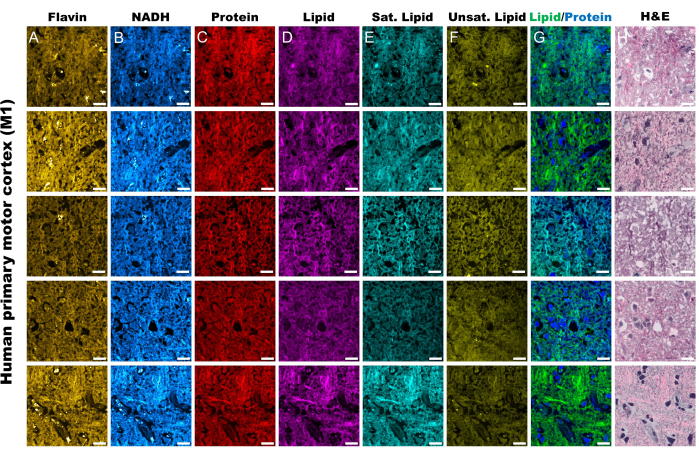
Şekil 2: İnsan primer motor korteks dokusundan (M1) MPF ve SRS kanalları. (A,B) Flavin / FAD ve NADH için MPF otofloresan kanalları. (C-F) Belirli Raman kayma zirvelerinde yakalanan SRS kanalları; proteinler için CH3 asimetrik germe zirvesi (2,930 cm-1), lipitler için CH2 asimetrik gerilme zirvesi (2,845 cm-1), doymuş yağ asitleri için 2,885 cm-1 tepe noktası ve doymamış yağ asitleri için 3,010 cm-1 tepe noktasıdır. (G) İlgili uzamsal dağılımlarını ana hatlarıyla belirtmek için SRS proteini (mavi) ve lipid (yeşil) kanalları birleştirildi. (H) SRS psödo-histolojik görüntüler (SRH), H&E boyamasını yansıtır. Ölçek çubukları = 20 μm. Kısaltmalar: MPF = çoklu foton floresan; FAD = flavin adenin dinükleotidi; NADH = indirgenmiş nikotinamid adenin dinükleotid; SRS = uyarılmış Raman saçılması; SRH = SRS histolojisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
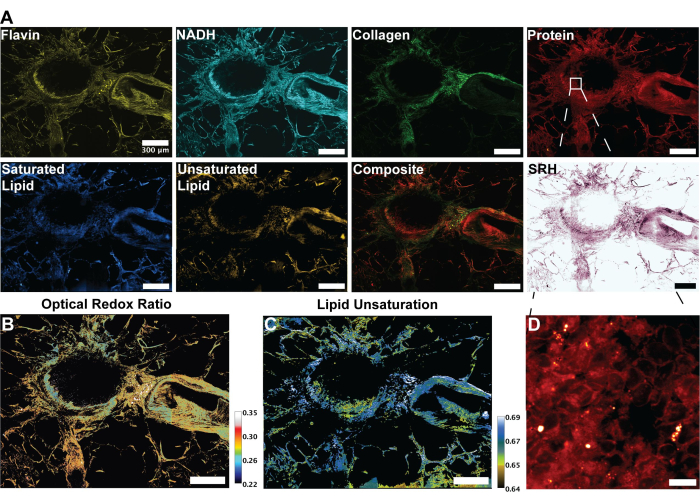
Şekil 3: MPF, SHG ve SRS görüntüleri ve insan akciğer dokusunun analizi. (A) Flavin / FAD ve NADH için MPF otofloresansı, kollajen lifleri için SHG sinyali, protein (2,930 cm-1), lipid (2,845 cm-1), doymuş lipitler (2,885 cm-1) ve doymamış lipitler (3,010 cm-1) zirveleri ve çoklu modalitelerin kompozit birleştirilmiş görüntüsü. (B) Optik redoks oranının oransal görüntüsü. (C) Lipid doymamışlığının oransal görüntüsü. (D) Bronşların iç tabakasındaki epitel hücrelerinin yakınlaştırılmış görüntüsü. Ölçek çubukları = 200 μm. Kısaltmalar: MPF = çoklu foton floresan; SHG = ikinci harmonik üretimi; SRS = uyarılmış Raman saçılması; FAD = flavin adenin dinükleotidi; NADH = indirgenmiş nikotinamid adenin dinükleotidi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
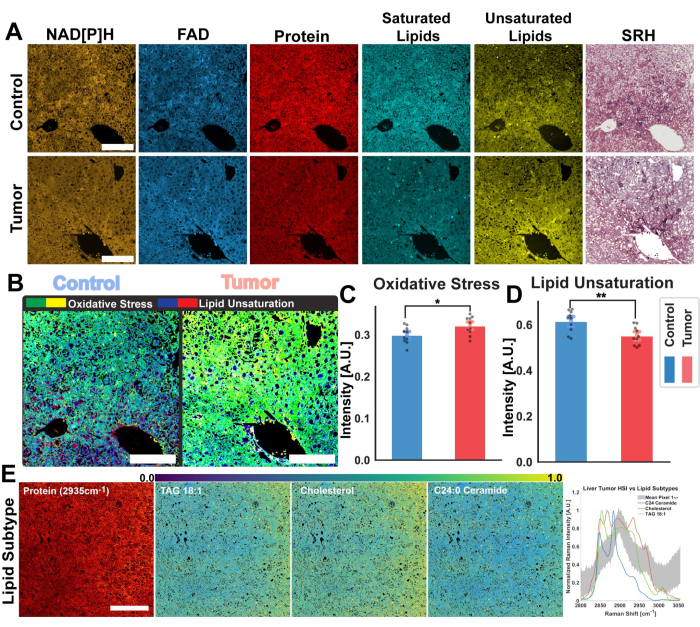
Şekil 4: Fare karaciğer tümörlerinin oransal ve hiperspektral analizi. (A) NAD [P] H ve FAD için MPF otofloresan görüntüleri, toplam protein, doymuş ve doymamış lipid için SRS kanalları ve sağlıklı kontrol faresi karaciğeri (üst) ve tümörlü (alt) doku için psödo-histolojik görüntüler. (B) Optik redoks oranı ile ölçülen oksidatif stres (sarı-yeşil) ve kontrol (sol) ve tümör (sağ) dokularından hesaplanan lipid doymamışlığı (mavi-kırmızı). Ölçek çubukları = 100 μm. (C,D) Kontrol (mavi) ve tümör (kırmızı) karaciğer örnekleri arasındaki oksidatif stres ve lipid doymamışlığındaki oransal farklılıkları gösteren çubuk grafikler. Anlamlılık istatistikleri: * p ≤ 0.05 anlamlılık için, ** p ≤ 0.01 anlamlılık için. (E) Hiperspektral görüntülerden elde edilen PRM-SRS lipid alt tipi analiz sonuçları. Soldan sağa: Yapısal referans için SRS protein kanalı, ölçek çubuğu = 100 μm, lipid alt tiplerinin olasılık dağılımı görüntüsü (TAG 18:1, Kolesterol ve C24:0 Seramid). CH bölgesi boyunca SRS HSI'den lipid alt tipi referans spektrumlarının ve ortalama piksel spektrumlarının grafiği. Kısaltmalar: MPF = çoklu foton floresan; SRS = uyarılmış Raman saçılması; NAD [P] H = indirgenmiş nikotinamid adenin dinükleotid fosfat; FAD = flavin adenin dinükleotidi; HSI = hiperspektral görüntüler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
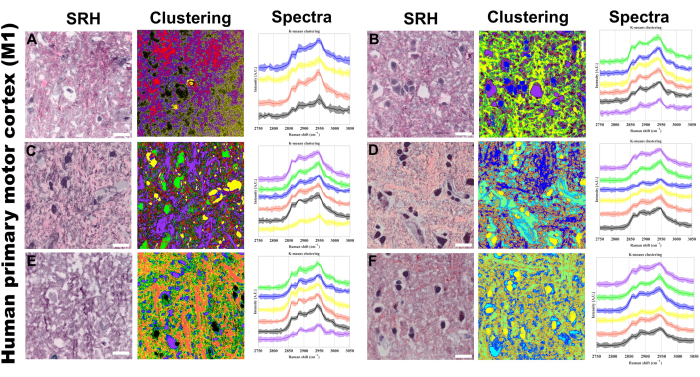
Şekil 5: SRS İnsan primer motor korteksinde (M1) hiperspektral k-ortalama kümelenmesi. (AF) Altı temsili bölge şunları gösterir: solda: H&E benzeri doku görselleştirmesi sağlayan uyarılmış Raman Histolojisi (SRH) görüntüleri; orta: karşılık gelen k-ortalama kümeleme sonuçları; Sağ: ortalama yoğunluklara (düz çizgiler) ve standart sapmalara (gölgeli alanlar) sahip kümeye özgü Raman spektral profilleri. 4 ila 6 arasında değişen sentroid sayısı şu anlama gelir. Denetimsiz kümeleme kullanıldı, bu nedenle kümelenmiş görüntülerdeki farklı renkler, k-ortalama algoritması tarafından tanımlanan farklı kimyasal bileşimleri temsil eder. Her küme (benzersiz bir renkle temsil edilir), CH germe bölgesindeki benzer spektral profillere sahip bölgelere karşılık gelir. Ölçek çubuğu = 20 μm. Kısaltmalar: SRH = SRS histolojisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu çok modlu sistem, çok çeşitli biyolojik kökenler ve patolojik koşullar boyunca numunelerin moleküler ortamının bütünsel bir görselleştirmesini yakalamak için güçlü bir görüntüleme platformudur. Farklı etiketsiz modalitelerden yararlanmanın avantajı, tek bir etiketsiz görüntüleme tekniğinde aksi takdirde zor veya imkansız olabilecek tamamlayıcı bilgiler edinme ve belirli analitleri hedefleme kapasitesinde yatmaktadır. Spesifik olarak, bu yazıda bahsedilen üç doğrusal olmayan görüntüleme tekniği (SRS, MPF, SHG), makromolekül bileşiminin, optik redoks oranı yoluyla enerji dinamiklerinin ve hücre dışı matris bileşimi ve morfolojisi 6,48,49 dahil olmak üzere yapısal bilgilerin nicelleştirilmesine izin verir. Ayrıca, her bir görüntüleme modalitesini ayrı ayrı kullanmakla karşılaştırıldığında, tek bir birleşik mikroskop sistemi ile görüntüleme, anında görüntü kaydına ve daha kısa numune saklama sürelerine olanak tanır. Muhtemelen konfokal floresan mikroskobuna kıyasla daha düşük fotomaruziyet nedeniyle, yukarıdaki protokolde belirtildiği gibi her bir modaliteyi sırayla elde etmek için belirli zaman noktalarını kullanarak bu yaklaşımla canlı hücre görüntüleme bile gerçekleştirdik. Bireysel avantajlarının yanı sıra, multimodal platform, farklı biyobelirteçlerin etiketsiz ölçümü yoluyla biyolojik durumla ilgili çoklu perspektiflerden de yararlanır.
Otofloresan proteinlerin MPF yoluyla etiketsiz görüntülenmesi, öncelikle, FAD'nin FAD + 'ya oksidasyonu ve NAD + 'nın NADH50'ye indirgenmesi ile kolaylaştırılan redoks reaksiyonlarının bir ölçüsü olan optik redoks oranının nicelleştirilmesine yönlendirilmiştir. Bu, ATP nesli6 için iki ana yol olan oksidatif fosforilasyon ve glikoliz arasındaki nispi aktivitenin bir ölçümünü sağladığı için hücreler ve dokular içindeki metabolizmanın önemli bir belirtecidir. Spesifik olarak, NADH konsantrasyonundaki azalmalar ve FAD + 'daki artışlar, mitokondride artan oksidatif fosforilasyon için bir belirteçtir; Bu arada, sitoplazmada artan glikoliz için bunun tersi geçerlidir. Enerji üretiminde bir metabolik yolu diğerine tercih etme eğilimi, kanserle bağlantılı çeşitli patolojik değişiklikler ve yol aktivasyonları ile ilişkilendirilmiştir ve bu da ORR'nin erken tespit belirteciolarak potansiyel kullanımını vurgulamaktadır 6,51.
Benzer şekilde, SHG fibröz kollajen sinyalinin elde edilmesi, sağlık için biyolojik bir belirteçin miktarını belirlemek ve görselleştirmek için doğrusal olmayan etiketsiz bir görüntüleme yönteminden yararlanır. SHG, sentrosimetrik olmayan yapıları nedeniyle Tip I-III kollajenin dağılımını etkili bir şekilde takip edebilir. SHG ile ölçülen fibröz kollajen proteinleri, kanser ve fibrozis dahil olmak üzere birçok hastalık için önemli tanı belirteçleri olarak kabul edilmiştir 25,26,27,52,53. Hastalık için bir belirteç olarak tespit edilmesinin yanı sıra, SHG yoluyla kollajen alımımız, fibröz kollajenin hücre dışı matrisin bileşimindeki rolü ve dokular arasındaki yapısal sınırlar nedeniyle hücre ve dokulardaki yapı için güçlü bir gösterge görevi görebilir 54,55. SHG kollajen sinyali aracılığıyla, hücresel zarlar için eksojen bir belirteçleyiciye ihtiyaç duymadan ayrı hücrelerin veya farklı doku fonksiyonel birimlerinin bilinçli gözlemlerini yapabiliriz. Genel olarak, kollajen fibrillerinin SHG miktar tayini, diğer etiketsiz görüntüleme teknikleriyle entegre edildiğinde hem tanısal yetenek hem de analiz kolaylığı açısından net bir fayda sağlar.
SRS mikroskobunu kullanarak, özellikle lipitler ve yağ asitleri için makromolekül bileşimi için çeşitli belirteçler yakalayabiliriz. Bu protokolde, aynı numune içinde lipid doymamışlığının oransal analizi için doymamış ve doymuş yağ asitleri için SRS sinyalinin nasıl elde edileceğini açıklıyoruz. IR'ye yakın verim için 25x su objektifine sahip dik bir lazer tarama mikroskobu uygulandı. Lazer ışınları numuneden geçti ve yüksek sayısal açıklıklı bir yağ kondansatörü (1.4 NA) ile toplandı. Stokes ışınını bloke etmek için yüksek bir OD kısa geçiren filtre (950 nm) kullanılırken, uyarılmış Raman kaybı sinyalini algılamak için yalnızca pompa ışınının bir Si fotodiyot dedektörüne ulaşmasına izin verildi. Fotodiyottan gelen çıkış akımı sonlandırıldı ve filtrelendi. Daha sonra, 20 MHz'de bir kilitleme amplifikatörü, sıfır faz kayması ile X'teki akımı demodüle etti ve bir yazılım modülü, lazer tarama sırasında görüntüyü oluşturmak için demodüle edilmiş sinyali kullandı.
Çalışmalar, lipid doymamışlığındaki değişikliklerin hücresel ve organel zarı üzerinde derin bir etkiye sahip olduğunu ve lipid metabolizmasındaki bir düzensizliğin kanser ve nörodejeneratif hastalıklar dahil olmak üzere çeşitli hastalıklar için güçlü bir belirteç olabileceğini göstermiştir 56,57,58,59. Lipid düzensizliğine daha kapsamlı bir genel bakış için, SRS hiperspektral görüntüleme kullanarak alt tip bileşimini analiz ediyoruz. SRS hiperspektral görüntüleri (HSI'ler), SRS mikroskobu tarafından elde edilen yüksek çözünürlüklü uzamsal bilgileri, protokolde açıklandığı gibi sıralı ayarlama yoluyla Raman spektroskopisinin kimyasal olarak önemli sinyaliyle birleştirir. Bu piksel spektrumları daha sonra k-ortalamaları ile kümeleme ve PRM-SRS ile biyomolekül tespiti olmak üzere iki yöntemle analiz edilir.
Piksel spektrumlarının K-ortalama kümelenmesi, SRS sinyal yoğunluğu ile moleküler bağ konsantrasyonu60,61 arasındaki doğrusal ilişki nedeniyle 2B görüntü içindeki bölgelerin moleküler konsantrasyon ve bileşime göre ayrılmasına neden olur. Bu metodoloji sayesinde, piksel spektrumları ve paylaşılan spektral sentroidin öngördüğü şekilde belirli moleküler fenotiplere sahip bölgeleri tespit etmek için protokolü uyguluyoruz. Belirli piksellerdeki farklı moleküler ifadenin kapsamlı bir incelemesi için, spontan Raman spektroskopisi ile yakalanan belirli bir molekül için bir referans spektrumu ile SRS HSI ediniminden elde edilen piksel spektrumları arasında spektral eşleştirme gerçekleştirmek için PRM-SRS'yi uyguluyoruz. Bunu yaparken, eksojen problar veya etiketler kullanmadan farklı moleküller için ifade olasılığını belirleyebiliriz. Bu analiz, dokular ve biyolojik modeller arasında belirli lipid alt tiplerini izleme yeteneğini ve lipid bileşimi değişikliklerindeki patolojik değişiklikleri ve dolayısıyla dislipidemiyi tanımlama kapasitesini göstermiştir47. Ayrıca, silika lifleri boyunca pikosaniye darbe yayılımının spektral bölünmesi yoluyla spektral çözünürlüğün iyileştirilmesindeki son gelişmeler, SRS HSI'nin etiketsiz biyokimyasal görselleştirme için bir modalite olarak uygulanmasını daha da teşvik etmektedir62. Protokolde vurgulanan bu yöntemler aracılığıyla, etiketsiz bir SRS modalitesi kullanarak kapsamlı oransal ve spektral analiz yapmak için bir platform oluşturuyoruz.
Bu tekniklerin göreceli karmaşıklığına ve yeniliğine ek olarak, yaklaşımımızda dikkate alınması gereken bazı önemli sınırlamalar vardır. Yaygın olarak kullanılan femtosaniye lazerlerin aksine, pikosaniye darbeli lazer ile MPF görüntülerinin elde edilmesi, daha yüksek florofor uyarma gücü gerektirir ve foto ağartma riski taşır. Bunu göz önünde bulundurarak, numune üzerindeki lazer gücü olayını azaltarak platformumuzdan kaynaklanan potansiyel foto hasarı azaltmak için yukarıdaki protokolü optimize ettik. Ayrıca, önceki çalışmalar, NADH ve FAD'nin MPF otofloresan görüntülemesinden optik redoks oranını değerlendirme yeteneğini göstermiş olsa da, floresan ömür boyu görüntüleme mikroskobu (FLIM), enerji metabolizmasını değerlendirmede daha yüksek doğruluk göstermiştir 63,64,65. Bunun nedeni, farklı floresan ömürlerine dayalı olarak proteine bağlı ve bağlanmamış NADH ve FAD konsantrasyonlarını ayırt etme yeteneğidir, MPF'nin yetenekleriyle karşılaştırıldığında, bu, FLIM'in oksidatif fosforilasyon ve glikoliz dahil olmak üzere farklı enerji yollarından metabolik aktivitenin kapsamlı çalışmaları için kullanılmasına izin vermiştir 16,63,64,65,66,67, 68. Bu protokol FLIM'i hariç tutsa da, modalitenin yakın gelecekte bu görüntüleme platformuna entegre edilmesini ve şu anda gerçekleştirdiğimiz enerji metabolizması analizini geliştirmesini bekliyoruz. Bununla birlikte, burada kurulan protokol ile, biyolojik yapı metabolizmasını birden fazla perspektiften ölçebilen multimodal bir görüntüleme yaklaşımı için bir iş akışı ve donanım kurulumu sunuyoruz.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Dr. Gloria Pryhuber ve HuBMAP ekip üyelerine insan akciğer dokusu dilimleri sağladıkları için teşekkür ederiz. İnsan beyin dokularını sağladığı için Dr. Kun Zhang'a teşekkür ederiz. Ayrıca fare karaciğeri örnekleri sağladığı için Dr. Gen-Sheng Feng'e teşekkür ederiz. NIHU54DK134301, NIH R01GM149976, NIH U01AI167892, NIH R01HL170107, NIH 5R01NS111039, NIH R21NS125395, NIH U54CA132378, UCSD Başlangıç fonları, Sloan Araştırma Görevlisi Ödülü ve CZI DAF2023-328667 Ödülü'nün desteğini kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 460 nm Filter Cube | Olympus | OCT-ET 460/50M32 | |
| Bandpass Filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| DC power supply | TopWard | 6302D | |
| Dichroic Mount | Thorlabs | KM100CL | |
| FIJI ImageJ | ImageJ | ||
| High NA oil condenser | Olympus | 6-U130 | |
| High O.D. shortpass filter | Thorlabs | 950 nm | |
| Inverted Laser Scanning Microscope | Olympus | FV1200MPE | |
| Lock-in Amplifier | Zurich Instruments | ||
| picoEmerald Laser System | Applied Physics & Electronics, Inc. | Synchronized pulsed pump beam (tunable 720–990 nm wavelength, 5–6 ps pulse width, and 80 MHz repetition rate) and Stokes (wavelength at 1032 nm, 6 ps pulse width, and 80 MHz repetition rate) | |
| SI Photodiode Detector | Home Built | ||
| Touch Panel Controller | Olympus | ||
| VF-300 Compresstome | Precisionary |
Referanslar
- Wollman, A. J. M., Nudd, R., Hedlund, E. G., Leake, M. C. From Animaculum to single molecules: 300 years of the light microscope. Open Biol. 5 (4), 150019(2015).
- Vicidomini, G., Bianchini, P., Diaspro, A. STED super-resolved microscopy. Nat Methods. 15 (3), 173-182 (2018).
- Weber, M., et al. MINSTED fluorescence localization and nanoscopy. Nat Photonics. 15 (5), 361-366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. , (1990).
- Hell, S. W., et al. Three-photon excitation in fluorescence microscopy. J Biomed Optics. 1 (1), 71-74 (1996).
- Alhallak, K., Rebello, L. G., Muldoon, T. J., Quinn, K. P., Rajaram, N. Optical redox ratio identifies metastatic potential-dependent changes in breast cancer cell metabolism. Biomed Opt Express. 7 (11), 4364-4374 (2016).
- Pena, A. -M., et al. Multiphoton FLIM imaging of NADH and FAD to analyze cellular metabolic activity of reconstructed human skin in response to UVA light. Multiphoton Microscopy in the Biomedical Sciences XIX. 10882, 23-33 (2019).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomed Opt Express. 11 (10), 5674-5688 (2020).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. J Biol Chem. 254 (11), 4764-4771 (1979).
- Ostrander, J. H., et al. Optical redox ratio differentiates breast cancer cell lines based on estrogen receptor status. Cancer Res. 70 (11), (2010).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proc Natl Acad Sci USA. 104 (49), 19494-19499 (2007).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Cancer Res. 74 (11), 3067-3075 (2014).
- Malak, M., James, J., Grantham, J., Ericson, M. B. Contribution of autofluorescence from intracellular proteins in multiphoton fluorescence lifetime imaging. Sci Rep. 12, 16584(2022).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using NADH and NADPH autofluorescence. Free Radic Biol Med. 100, 53-65 (2016).
- Roth, S., Freund, I. Second harmonic generation in collagen. J Chem Phys. 70 (4), 1637-1643 (1979).
- Freund, I., Deutsch, M. Second-harmonic microscopy of biological tissue. Opt Lett. 11 (2), 94(1986).
- Boyd, R. W., Gaeta, A. L., Giese, E. Nonlinear optics. Springer Handbook of Atomic, Molecular, and Optical Physics. Drake, G. W. F. , Springer. 1097-1110 (2023).
- Aghigh, A., et al. Second harmonic generation microscopy: a powerful tool for bio-imaging. Biophys Rev. 15 (1), 43-70 (2023).
- Mohler, W., Millard, A. C., Campagnola, P. J. Second harmonic generation imaging of endogenous structural proteins. Methods. 29 (1), 97-109 (2003).
- Cox, G. Biological applications of second harmonic imaging. Biophys Rev. 3 (3), 131(2011).
- Brown, E., et al. Dynamic imaging of collagen and its modulation in tumors in vivo using second-harmonic generation. Nat Med. 9 (6), 796-800 (2003).
- Keikhosravi, A., Bredfeldt, J. S., Sagar, A. K., Eliceiri, K. W. Chapter 28 - Second-harmonic generation imaging of cancer. Methods Cell Bio. 123, 531-546 (2014).
- Hui Mingalone, C. K., et al. Bioluminescence and second harmonic generation imaging reveal dynamic changes in the inflammatory and collagen landscape in early osteoarthritis. Lab Invest. 98 (5), 656-669 (2018).
- Tsafas, V., et al. Polarization-dependent second-harmonic generation for collagen-based differentiation of breast cancer samples. J Biophotonics. 13 (10), e202000180(2020).
- Nadiarnykh, O., LaComb, R. B., Brewer, M. A., Campagnola, P. J. Alterations of the extracellular matrix in ovarian cancer studied by Second Harmonic Generation imaging microscopy. BMC Cancer. 10, 94(2010).
- Xiong, S. Y., Yang, J. G., Zhuang, J. Nonlinear spectral imaging of human normal skin, basal cell carcinoma and squamous cell carcinoma based on two-photon excited fluorescence and second-harmonic generation. Laser Phys. 21 (10), 1844-1849 (2011).
- Tilbury, K., Campagnola, P. J. Applications of second-harmonic generation imaging microscopy in ovarian and breast cancer. Perspect Medicin Chem. 7, 21-32 (2015).
- Raman, C. V., Krishnan, K. S. A New type of secondary radiation. Nature. 121 (3048), 501-502 (1928).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Phys Rev Lett. 9 (11), 455-457 (1962).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Li, Y., et al. Microglial lipid droplet accumulation in tauopathy brain is regulated by neuronal AMPK. Cell Metab. 36 (6), 1351-1370.e8 (2024).
- Lu, F. -K., et al. Label-free neurosurgical pathology with stimulated Raman imaging. Cancer Res. 76 (12), 3451-3462 (2016).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nat Commun. 9 (1), 2995(2018).
- Zhang, L., et al. Spectral tracing of deuterium for imaging glucose metabolism. Nat Biomed Eng. 3 (5), 402-413 (2019).
- Li, Y., et al. Bioorthogonal stimulated Raman scattering imaging uncovers lipid metabolic dynamics in Drosophila brain during aging. GEN Biotechnol. 2 (3), 247-261 (2023).
- Li, X., et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by stimulated Raman scattering microscopy. Anal Chem. 91 (3), 2279-2287 (2019).
- Ji, M., et al. Detection of human brain tumor infiltration with quantitative stimulated Raman scattering microscopy. Sci Transl Med. 7 (309), 309ra163(2015).
- Ji, M., et al. Rapid, label-free detection of brain tumors with stimulated Raman scattering microscopy. Sci Transl Med. 5 (201ra119), 201ra119(2013).
- You, S., et al. Intravital imaging by simultaneous label-free autofluorescence-multiharmonic microscopy. Nat Commun. 9, 2125(2018).
- You, S., et al. Label-free deep profiling of the tumor microenvironment. Cancer Res. 81 (9), 2534-2544 (2021).
- Jermyn, M., et al. Highly accurate detection of cancer in situ with intraoperative, label-free, multimodal optical spectroscopy. Cancer Res. 77 (14), 3942-3950 (2017).
- Pshenay-Severin, E., et al. Multimodal nonlinear endomicroscopic imaging probe using a double-core double-clad fiber and focus-combining micro-optical concept. Light Sci Appl. 10 (1), 207(2021).
- Wu, W., Li, X., Qu, J. Y., He, S. In vivo imaging of biological tissues with combined two-photon fluorescence and stimulated Raman scattering microscopy. J Vis Exp. (178), e63411(2021).
- Li, X., Jiang, M., Lam, J. W. Y., Tang, B. Z., Qu, J. Y. Mitochondrial imaging with combined fluorescence and stimulated Raman scattering microscopy using a probe of the aggregation-induced emission characteristic. J Am Chem Soc. 139 (47), 17022-17030 (2017).
- Li, Z., et al. Multimodal imaging of metabolic activities for distinguishing subtypes of breast cancer. Biomed Opt Express. 14 (11), 5764-5780 (2023).
- Fung, A. A., et al. Label-free optical biopsy reveals biomolecular and morphological features of diabetic kidney tissue in 2D and 3D. , (2024).
- Zhang, W., et al. Multi-molecular hyperspectral PRM-SRS microscopy. Nat Commun. 15 (1), 1599(2024).
- Xu, F. X., et al. Discrimination of lipid composition and cellular localization in human liver tissues by stimulated Raman scattering microscopy. J Biomed Opt. 29 (1), 016008(2024).
- Zoumi, A., Yeh, A., Tromberg, B. J. Imaging cells and extracellular matrix in vivo by using second-harmonic generation and two-photon excited fluorescence. Proc Natl Acad Sci USA. 99 (17), 11014-11019 (2002).
- Liaudanskaya, V., et al. Mitochondria dysregulation contributes to secondary neurodegeneration progression post-contusion injury in human 3D in vitro triculture brain tissue model. Cell Death Dis. 14 (8), 1-15 (2023).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, sub-types and early treatment response in breast cancer. Cancer Res. 73 (20), 6164-6174 (2013).
- Conklin, M. W., et al. Aligned collagen is a prognostic signature for survival in human breast carcinoma. Am J Pathol. 178 (3), 1221-1232 (2011).
- Sun, W., et al. Nonlinear optical microscopy: use of second harmonic generation and two-photon microscopy for automated quantitative liver fibrosis studies. J Biomed Optics. 13 (6), 064010(2008).
- Nejim, Z., Navarro, L., Morin, C., Badel, P. Quantitative analysis of second harmonic generated images of collagen fibers: a review. Res Biomed Eng. 39 (1), 273-295 (2023).
- Burke, K., Brown, E. The use of second harmonic generation to image the extracellular matrix during tumor progression. Intravital. 3 (3), e984509(2015).
- Balasubramanian, P., Prabhakaran, M. P., Sireesha, M., Ramakrishna, S. Collagen in human tissues: Structure, function, and biomedical implications from a tissue engineering perspective. Polymer Composites - Polyolefin Fractionation - Polymeric Peptidomimetics - Collagens. Abe, A., Kausch, H. H., Möller, M., Pasch, H. 251, 173-206 (2012).
- Dadsena, S., et al. Lipid unsaturation promotes BAX and BAK pore activity during apoptosis. Nat Commun. 15, 4700(2024).
- Barelli, H., Antonny, B. Lipid unsaturation and organelle dynamics. Curr Opin Cell Biol. 41, 25-32 (2016).
- Harayama, T., Antonny, B. Beyond fluidity: The role of lipid unsaturation in membrane function. Cold Spring Harb Perspect Biol. 15 (7), a041409(2023).
- Yoon, H., Shaw, J. L., Haigis, M. C., Greka, A. Lipid metabolism in sickness and in health: Emerging regulators of lipotoxicity. Mol Cell. 81 (18), 3708-3730 (2021).
- Villazon, J., Shi, L. Utilizing K-means clustering on hyperspectral DO-SRS images of the mouse hippocampus. CLEO 2024, Technical Digest Series. , Optica Publishing Group. (2024).
- Fu, D., et al. Quantitative chemical imaging with multiplex stimulated Raman scattering microscopy. J Am Chem Soc. 134 (8), 3623-3626 (2012).
- Periasamy, A., Diaspro, A. Special section guest editorial: Multiphoton microscopy. J Biomed Optics. 8 (3), 327(2003).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proc Natl Acad Sci USA. 89 (4), 1271-1275 (1992).
- Blacker, T. S., et al. Separating NADH and NADPH fluorescence in live cells and tissues using FLIM. Nat Commun. 5, 3936(2014).
- Xiong, H., et al. Background-free imaging of chemical bonds by a simple and robust frequency-modulated stimulated Raman scattering microscopy. Opt Express. 28 (10), 15663-15677 (2020).
- Georgakoudi, I., Quinn, K. P. Label-free optical metabolic imaging in cells and tissues. Annu Rev Biomed Eng. 25, 413-443 (2023).
- Alam, S. R., Wallrabe, H., Christopher, K. G., Siller, K. H., Periasamy, A. Characterization of mitochondrial dysfunction due to laser damage by 2-photon FLIM microscopy. Sci Rep. 12 (1), 11938(2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır