Method Article
세포 대사 연구를 위한 멀티모달 광학 이미징 플랫폼
* 이 저자들은 동등하게 기여했습니다
요약
label-free 광학 이미징 방식을 결합한 멀티모달 플랫폼을 활용하여 세포 역학 및 신진대사를 시각화하고 정량화하기 위한 프로토콜을 개발했습니다. 다광자 형광, 2차 고조파 생성 및 유도 라만 산란 현미경을 통한 이미징을 통해 세포 및 분자 환경에 대한 전체적인 개요를 생성할 수 있습니다.
초록
광학 이미징 기술은 높은 공간 해상도에서 생물학적 표본에서 형태학적 및 기능적 정보를 모두 얻을 수 있는 능력으로 인해 생물 의학 연구에서 매우 중요합니다. 이러한 광학 프로세스는 광자와 세포, 조직 또는 기관 내의 분자 사이의 산란, 흡수, 방출 및 조화 생성과 같은 다양한 빛-분자 상호 작용을 이용합니다. 기존의 생체 의학 이미징은 역사적으로 단일 양식을 적용하는 데 중점을 두었지만, 최근 연구에 따르면 이러한 다양한 기술은 상호 보완적인 통찰력을 제공하고 결합된 출력은 노화 과정의 분자 변화 및 질병 발달 및 세포 생물학의 기초에 대한 보다 포괄적인 이해를 제공합니다.
지난 수십 년 동안 label-free 광학 이미징 방법이 발전하여 세포 및 세포 내 환경을 자세히 탐색할 수 있게 되었습니다. 예를 들어, 다광자 형광(MPF)은 표적 단백질 이미징을 용이하게 할 뿐만 아니라 자가형광 코엔자임을 통해 대사 활동을 정량화하여 높은 침투 깊이와 공간 해상도를 달성합니다. SHG(Second Harmonic Generation)는 세포 외 기질의 콜라겐과 같은 구조를 이미지화하는 데 사용되며, SRS(Stimulated Raman Scattering)는 세포 내 해상도로 화학 결합 및 분자 구성을 현장에서 매핑합니다.
당사는 MPF, SHG 및 SRS 양식을 결합한 다중 모드 이미징 플랫폼을 개발했습니다. 이러한 양식을 단일 플랫폼에 통합하면 세포, 조직, 기관 또는 신체 내에서 동일한 국소화로부터 다면적인 정보를 획득할 수 있으므로 세포 대사, 세포 외 기질 구조 및 분자 구성 간의 복잡한 관계를 보다 자세히 탐색할 수 있습니다. 이 멀티모달 시스템은 세포 내 해상도, 심층 조직 침투, 현장 라이브 셀/조직 이미징뿐만 아니라 위치 조정, 장치 전환 또는 분석 후 정렬이 필요 없는 무표지 검출 및 즉각적인 공동 정합을 제공합니다. 여기에서는 이 멀티모달 플랫폼을 사용한 무표지 이미징을 위한 프로토콜을 제시하고 노화 및 질병 연구를 위한 세포 대사 및 세포 및 조직의 분자 이질성을 특성화하는 데 이 프로토콜의 적용을 시연합니다.
서문
광학 생체 의학 이미징은 생물학적 구조와 기능에 대한 이해를 발전시키는 데 중추적인 역할을 했습니다. 이미지는 여기광을 조절하고 빛과 조직 간의 상호 작용에서 신호를 감지하여 생성됩니다. 1590년경 Hans와 Zacharias Janssen이 개발한 최초의 복합 현미경은 튜브에 두 개의 볼록 렌즈를 사용하여 최대 30x1의 배율을 제공했습니다. 수세기에 걸친 발전에 힘입어 현대 광학 현미경은 이제 1-3nm 2,3의 미세한 해상도를 달성할 수 있습니다. 고급 이미징 시스템은 고해상도를 제공할 뿐만 아니라 이제 더 깊은 조직 침투, 더 높은 효율성 및 최소한의 샘플 손상을 제공하여 라이브 셀 및 조직 이미징에 특히 적합합니다. label-free 이미징은 세포 내 프로세스를 방해하거나 시료 무결성을 손상시키지 않고 정보를 캡처하기 때문에 특히 유리합니다.
다광자 형광(MPF) 현미경, 특히 이광자 형광 현미경은 무표지 이미징에 광범위하게 사용되어 왔습니다. 선형 단일 광자 흡수 및 방출에 의존하는 기존의 형광 현미경과 달리 MPF 여기는 여러 광자의 동시 흡수를 포함하며, 결합 에너지는 단일 형광단 분자 4,5를 여기시킵니다. 일반적으로 적외선 스펙트럼에 있는 이러한 광자는 단일 광자 여기에 필요한 에너지의 절반 이하를 소유합니다. 이 비선형 공정에서 초점에서 더 긴 파장과 국부적인 여기(excitation)는 산란을 낮추고 조직 침투를 더 깊게 하며 광독성을 감소시킵니다.
감소된 니코틴아미드 아데닌 디뉴클레오티드(NADH) 및 플라빈 아데닌 디뉴클레오티드(FAD)와 같은 내인성 대사 기질에서 자가형광 신호를 검출하여 무표지 MPF 현미경으로 세포 대사 정보를 캡처할 수 있습니다. 이러한 코엔자임은 뚜렷한 excitation 및 emission 스펙트럼을 나타내며, 산화 환원 비율(NADH/FAD)로 알려진 형광 강도 비율은 세포의 산화 상태를 반영합니다. Britton Chance가 1979년 레독스 비율의 개념을 처음 도입한 이래로 NAD(P)H/FAD, NAD(P)H/(FAD + NAD(P)H) 및 FAD/(FAD + NAD(P)H)를 포함한 추가 비율이 제안되었습니다 6,7,8,9. MPF 이미징을 통해 이러한 광학 산화 환원 비율을 정량화하면 대사 역학에 대한 귀중한 통찰력을 얻을 수 있습니다. 예를 들어, MPF 이미징은 변경된 신진대사를 기반으로 암세포와 정상 세포를 구별할 수 있으며, 이는 암 진단에 대한 잠재력을 입증합니다 10,11,12. 그러나 MPF 기반 자가형광 검출에는 한계가 있습니다. 케라틴과 같은 다른 고유 형광단은 형광 강도에 기여하여 스펙트럼 누화와 부정확한 신호 해석을 유발할 수 있습니다13. 또한, 산화 환원 비율은 전체 세포 산화 환원 변화만 반영하며, 둘 다 450nm에서 유사한 스펙트럼 피크를 나타내기 때문에 다른 소스(예: 세포질 또는 미토콘드리아)의 NADH 또는 NADH와 NAD(P)H를 구별하지 않습니다14.
1980 년대에 생물 의학 분야에서 처음으로 입증 된 비선형 광학 프로세스 인 SHG (Second Harmonic Generation)는 세포 구조의 무표지 이미징에 널리 활용되었습니다15 , 16 . MPF와 유사하게 SHG는 초고속 펄스 레이저에서 동일한 에너지의 두 광자를 동시에 흡수하는 것을 포함합니다. 이 광자는 재결합되어 입사광 주파수의 두 배인 새로운 광자를 방출하여 2차 고조파 신호를 감지합니다. 이러한 비선형 광학 상호 작용은 제2 고조파 신호17,18을 생성하기 위한 편광을 유도하기 위해 0이 아닌 2차 민감도를 나타내는 비중심대칭 재료에서만 발생합니다. 이로 인해 SHG는 외인성 형광 염료 15,17,19,20를 필요로 하지 않고 콜라겐, 미오신 및 튜불린과 같은 필라멘트 단백질 및 섬유소 구조를 이미징하는 데 특히 효과적입니다. 섬유증과 콜라겐의 풍부함, 뻣뻣함, 정렬 및 구조의 이상은 염증 및 암과 같은 많은 조건에서 널리 퍼져 있기 때문에 SHG는 특정 질병 상태에 대한 효율적이고 비침습적인 검출을 위한 유망한 도구입니다 21,22,23. 유방암, 난소암 및 피부암에 대한 연구를 포함한 종양학 연구에서 SHG 이미징의 광범위한 적용은 기초 연구와 잠재적인 임상 응용 모두에서 중요한 역할을 강조했습니다 24,25,26,27.
서로 다른 분자는 뚜렷한 진동 에너지 수준을 나타내며, 이는 입사광에 의해 여기될 때 다양한 정도의 비탄성 산란을 유발하며, 이는 1928년 C. V. Raman에 의해 처음 특징지어지는 현상입니다28. 이후 라만 효과는 외인성 표지 없이 분자 및 조직 구성을 검출하기 위해 광학 현미경 검사에서 광범위하게 활용되었습니다. SRS(Stimulated Raman Scattering)와 CARS(Coherent anti-Stokes Raman Scattering)는 모두 분자 진동을 응집되게 여기하고 빛의 비선형 상호 작용을 활용하여 기존의 자발적 라만 분광법에 비해 더 강력한 신호를 생성합니다. SRS 현상은 1962 년에 처음보고되었습니다29. 2008년에 이 메커니즘은 3차원 다광자 이미징에 통합되어 분자 진동 전이로 인한 펌프 및 스톡스 빔의 강도 변화를 기반으로 화학 물질을 선택적으로 검출할 수 있게 되었습니다30. 이 방법은 비공진 배경 간섭을 최소화하여 CARS를 능가하는 깨끗한 강도 신호를 생성합니다. SRS 이미징은 다중화 및 초분광 이미징을 제공하는 데 탁월하여 여러 화학 결합을 동시에 검출할 수 있고 상당한 침투 깊이를 가진 표본의 분자 구성을 고해상도로 시각화할 수 있습니다. 비교적 새로운 기술이지만 SRS 이미징은 임상 진단 및 대사 연구, 생체 내 및 체외 모두에서 효과적인 것으로 입증되었습니다 30,31,32,33,34,35,36. 예를 들어, SRS는 지질 대 단백질 비율을 정량화하여 뇌종양 침윤 조직을 피질 및 백질에서 구별할 수 있으며, 표지가 없는 비침습적 방식으로 종양 가장자리를 묘사할 수 있습니다37,38. 또한, 노화 관련 및 암 관련 질병의 특징으로 간주되는 대사 변화는 중수(D2O)로 처리된 샘플에서 탄소-중수소 결합을 검출하여 얻은 SRS를 사용하여 정량적으로 평가할 수 있으며, 단백질 합성, 지방 형성 및 기타 고분자 대사 과정의 정량적 측정이 가능합니다 31,33,34,35,36. 높은 시간 및 공간 해상도로 대사 산물을 추적할 수 있는 기능은 SRS를 질병 조사 및 진단을 위한 유망한 도구로 자리매김하고 있으며 더 광범위한 임상 응용 분야에 대한 잠재력을 가지고 있습니다.
멀티모달 이미징은 생물의학 연구에서 강력한 접근 방식으로 부상했으며, 두 개 이상의 이미징 방식을 통합하여 동일한 표본 내의 복잡한 생물학적 시스템에 대한 보다 포괄적인 이해를 얻을 수 있습니다. 2018년에는 이광자 형광(2PF), 삼광자 형광(3PF), SHG 및 3차 고조파 생성(THG)39을 통합한 무표지 자가형광 다중고조파(SLAM) 현미경 기법이 도입되었습니다. 이 접근 방식은 세포 상호 작용, 동적 프로세스 및 종양 미세환경 내의 개별 구성 요소를 동시에 시각화할 수 있도록 합니다. SLAM 현미경은 섭동을 최소화하고 샘플에 대한 레이저 출력 요구 사항을 줄여 심층 조직 프로파일링을 가능하게 하고 생체 내 모니터링을 위한 보다 안전한 방법을 제공합니다40. 고유 형광 분광법(intrinsic fluorescence spectroscopy), 확산 반사 분광법(diffuse reflectance spectroscopy) 및 라만 분광법(Raman spectroscopy)을 결합한 또 다른 다중 모드 방식은 수술 절차 중 제자리암 검출을 위해 개발되었다41. 또한 CARS, SHG 및 이광자 형광(TPF)을 통합하는 최근 설계된 다중 모드 비선형 내시경 시스템은 서브미크론 및 서브 세포 공간 해상도42에서 생물학적 샘플을 이미지화할 수 있는 기능을 입증했습니다. 결합된 2PF 및 SRS 현미경은 조직, 세포 및 소기관의 고해상도 생체 내 이미징에 유사하게 활용되었습니다 42,43,44,45. 이러한 새로운 다중 모드 이미징 기술은 개별 양식의 강점을 활용하여 해상도, 침투 깊이 및 이미지 획득 효율성을 개선하여 임상 및 수술 응용 분야에서 상당한 잠재력을 보여줍니다.
이 다중 모드 접근 방식은 개별 기술과 관련된 제한 사항을 완화하면서 더 넓은 범위의 측정을 제공하기 때문에 단일 모드 이미징보다 점점 더 선호되고 있습니다. 앞서 논의한 바와 같이, MPF는 대사 변화를 반영하기 위해 내인성 형광을 측정하고, SHG는 생물학적 샘플에서 콜라겐과 같은 비중심 대칭 구조를 이미지화할 수 있으며, SRS는 진동 모드를 기반으로 독특한 라만 신호를 생성하는 화학 결합의 높은 밀도로 인해 단백질과 지질을 주로 검출합니다. 일관성 있는 특성과 비선형 광학 특성의 공유 원리를 감안할 때, 이러한 이미징 방식은 초단파 펄스 레이저를 사용하는 단일 현미경 설정에 통합될 수 있으며, 이를 통해 국소 영역에서 다양한 바이오마커를 획득하여 생물학적 과정에 대한 보다 완전한 관점을 제공할 수 있습니다44,45. 이 백서에서는 생물 의학 연구 응용 분야를 위해 MPF, SHG 및 SRS를 통합하는 다중 모드 이미징 플랫폼을 구현하기 위한 프로토콜을 간략하게 설명합니다.
프로토콜
1. Label-free 멀티모달 이미징 실험
참고: 이 프로토콜은 label-free 멀티모달 이미징의 설정 및 획득 절차에 중점을 둡니다.
- 멀티모달 현미경 설정(그림 1A) 및 시스템 보정
- 레이저를 예열하고 약 15-20분 정도 기다립니다.
- 제어 장치와 모니터의 전원을 다음 순서로 켭니다: Control box | 터치 패널 컨트롤러 | 메인 레이저 리모컨용 AC 어댑터, 보조 레이저 리모컨용 AC 어댑터.
- Si 포토다이오드 검출기와 락인앰플리파이어의 전원을 켭니다.
- 펌프 레이저 빔과 스톡스 빔을 구성합니다. 780 nm - 990 nm, 5 - 6 ps 펄스 폭 및 80 MHz 반복률로 조정 가능한 펌프 빔으로 레이저 시스템을 설정합니다. Stokes 레이저 빔은 1,031nm의 고정 파장과 6ps 펄스 및 80MHz 반복률을 갖습니다. 펌프와 Stokes 빔이 모두 정렬 플레이트에서 볼 수 있도록 저전력(최소 20mW)인지 확인합니다.
- 광학 경로(레이저 상자 바로 뒤)에 하나의 정렬 플레이트를 배치하여 펌프와 스톡스 빔의 공간적 중복을 확인하고 정렬 플레이트의 중심에서 두 지점이 겹칠 때까지 미러를 조정합니다.
참고: 펌프와 스톡스 빔이 대략적으로 겹치지만 두 레이저 빔의 공간적 겹침을 미세 조정하면 최적의 SRS 신호를 얻을 수 있습니다. - 공간 중첩 후 먼저 OPO 제어 소프트웨어를 클릭하여 PSD(Position Sensitive Detector)로 미세 조정합니다. 육각 키를 사용하여 광학 미러 1(OM1)을 조심스럽게 조정하고 중심에서 최소한의 편차를 목표로 PSD 디스플레이에서 XY 위치 변경을 관찰합니다. 그런 다음 보다 정밀하게 조정하려면 위치 표시기가 PSD 디스플레이의 중앙에 올 때까지 광학 미러 2(OM2)의 육각 키를 사용합니다.
알림: OM1 및 OM2는 레이저 정렬을 조정하기 위해 OPO 헤드에 있는 두 개의 미러입니다. - 마지막으로, 두 개의 콘덴서 센터링 나사를 돌려 콘덴서를 중앙에 배치하여 조리개 다이어프램 이미지를 시야의 중앙으로 이동합니다.
알림: 필드 아이리스 다이어프램은 대물렌즈로 들어오는 광선의 직경을 제한하여 외부 빛을 배제하여 이미지 대비를 개선할 수 있습니다.
- Label-free 멀티모달 이미징 획득 단계
- 높은 수치의 조리개(1.4NA) 오일 콘덴서에 오일을 바르고 현미경 슬라이드를 오일이 있는 콘덴서에 장착합니다. 마지막으로, 25x 물 대물렌즈의 현미경 슬라이드에 큰 물방울을 놓습니다. 현미경이 단단히 장착되고 움직일 수 없는지 확인한 다음 z s를 조정합니다.tage 생물학적 샘플의 명시야 이미지가 25x 물 대물렌즈 아래에서 볼 수 있을 때까지 초점을 조정합니다.
- MPF의 이미지 품질과 정확한 분석에 영향을 미치는 광표백을 방지하기 위해 MPF, SHG 및 SRS의 올바른 순서로 이미징 프로세스를 시작하십시오. MPF와 SHG 사이를 빠르게 전환하려면 펌프 빔에서 고정 스톡스 빔으로 전환하십시오.
참고: 펌프 레이저를 800nm(NADH 및 FAD 자가형광)에서 791.3nm(CH3 라만 시프트)로 조정하는 데 1-2분이 걸릴 수 있습니다. - 이미지 해상도(512 x 512 픽셀)와 각 모달리티에 적합한 체류 시간을 선택합니다. 평균 프레임이 3 이상인 MPF 및 SHG에 대해 8μs/픽셀을 사용합니다. SRS 모달리티에 대해 평균 프레임 2와 함께 40μs/픽셀을 사용합니다.
참고: 평균 프레임은 저장하기 전에 평균화할 이미지 수를 의미합니다. - MPF로 자가형광을 획득하려면 Stokes 레이저 빔을 끄고 펌프 레이저를 800nm로 조정하여 NADH 및 flavin을 자극합니다. FVOPT 필터 큐브를 NADH 및 flavin에 대해 각각 460 ± 10nm 및 515 ± 10nm의 광 경로에 설치합니다. 따라서 샘플의 전력은 약 15mW입니다.
- SHG를 사용하여 콜라겐 섬유 신호를 획득합니다. 펌프 레이저 빔을 끄고 스톡스 레이저 빔만 사용하고 전력을 500mW로 설정합니다. 515nm 필터와 관련된 채널만 획득합니다.
- SRS를 사용하여 단백질과 지질의 공간 분포를 구합니다. 두 레이저 빔을 모두 켜진 상태로 유지하고 각 분자의 특정 진동 모드와 일치하도록 레이저 빔 주파수를 조정합니다.
참고: 일반적으로 CH3에는 791.3nm, CH2에는 797nm, 불포화 지질에는 787nm, 포화 지질에는 794.6nm가 사용됩니다. 따라서 샘플의 전력은 약 40mW입니다. - SRS 초분광 이미지 데이터 세트를 획득하려면 OPO 제어 소프트웨어를 열어 스윕을 선택하고, 파장 범위를 780nm에서 806.5nm로 설정하고, 60 이상의 스택 번호를 선택합니다. 그런 다음 초분광 이미지 스택을 캡처합니다.
참고: 결과 데이터 세트에는 60개의 이미지가 포함되어 있으며, 각 이미지는 특정 라만 이동(2,700cm-1에서 3,150cm-1까지)에서의 공간 분포를 나타냅니다. 초분광 획득 시간은 이미지의 시야(FOV) 및 스캔 시간에 따라 다르지만 512 x 512 이미지의 경우 약 5분에서 8분 사이입니다. 더 큰 이미지의 경우 2시간 후에 발생할 수 있는 광손상을 방지하기 위해 레이저 아래의 지속 시간을 최소화하도록 주의해야 합니다(샘플의 두께 및 FOV 크기에 따라 다름). - 동일한 관심 영역(ROI)의 모든 이미지를 동일한 폴더에 저장합니다. 이미지 형식은 Olympus .oir 파일입니다.
2. 이미지 분석
- 이미지 처리 소프트웨어를 사용하여 저장된 모든 원시 이미지를 열고 색상을 할당하고 이미지 표시에 대한 배율 막대를 추가합니다. 또한 광학 산화 환원 비율 및 지질 불포화 분석을 위한 NADH 및 포화 지방산(SFA, 2,880cm-1) 이미지의 이진 마스크를 생성하는 데 사용할 수 있습니다.
참고: 마스크 강도가 0과 1만 있는지 확인하십시오. - 집에서 빌드한 Python 스크립트를 사용하여 다운스트림 분석을 수행합니다(코드는 https://github.com/lingyanshi2020/HSI_Analysis 에서 사용 가능).
참고: 이 스크립트는 대조군 샘플과 암 샘플 모두에서 여러 관심 영역(ROI)을 처리하도록 설계되었습니다. 스크립트의 main 기능에는 control 및 cancer image 폴더의 파일 경로라는 두 가지 입력만 필요합니다.- 폴더를 반복하여 기본 이름이 같은 이미지(예: "roi_1_flavin.tif", "roi_1_nadh.tif", "roi1_mask.tif")를 찾습니다.
- 일치하는 각 이미지 세트에 대해 스크립트가 비율계량 분석을 수행하고 이러한 계산을 기반으로 새로운 비율계량 이미지를 생성하도록 합니다.
광학 산화 환원 비율은 flavin/(NADH + flavin)으로 계산됩니다.
지질 불포화도는 USFAs / (SFAs + USFAs)로 계산되며, 여기서 USFAs는 불포화 지방산을 나타냅니다. - 그런 다음 이미지의 모든 비율계량 값은 쉽게 조작할 수 있도록 pandas DataFrame에 저장됩니다. 일원 ANOVA를 수행하고 matplotlib를 styple "ggplot" 또는 seaborn과 함께 사용하여 정량화를 위한 barplot 또는 boxplot을 수행합니다.
- 2,930cm-1(CH3) 및 2,850cm-1(CH2) 이미지를 사용하여 빼낸(CH3 - CH2) 이미지를 생성합니다. 그런 다음 RGB 색 공간의 CH2 이미지 CH3 - CH2 이미지를 H&E 염색을 모방한 사용자 정의 LUT와 혼합하여 디지털 조직학 이미지46을 생성합니다.
- 초분광 SRS 이미지를 획득한 후 집에서 빌드한 Python 스크립트를 사용하여 k-means 클러스터링을 수행하고 스펙트럼 유사성을 기반으로 이미지를 분할합니다(코드는 https://github.com/lingyanshi2020/HSI_Analysis 에서 사용 가능).
- tifffile 패키지를 사용하여 .tiff 이미지 스택을 불러옵니다. SRS 초분광 이미지 스택(x, y, 스펙트럼)을 2D 배열(픽셀, 스펙트럼)로 재구성합니다.
- scikit-learn 패키지를 사용하여 정의된 클러스터 수로 이 2D 배열에 k-means 알고리즘을 배포합니다.
- 결과로 생성된 클러스터 레이블을 원래 이미지 차원으로 다시 형태 변경하여 분할 맵을 만듭니다.
- 각 클러스터에 고유한 색상을 할당하여 조직 내의 다양한 생화학적 조성을 나타내는 거짓 색상 이미지를 생성합니다.
- matplotlib를 사용하여 평균값(실선)과 표준편차(그림자 영역)를 사용하여 각 군집의 스펙트럼을 플로팅합니다
- MATLAB을 사용하여 PRM-SRS(PENALIZED REFERENCE MATCHING SRS) 프로토콜의 프로토콜에 따라 SRS 초분광 이미지 데이터셋47을 사용하여 공간 레이블이 없는 지질 아형을 검출합니다.
- 이미지를 구성하고 300dpi .tif 형식으로 저장합니다.
결과
그림 2의 이미지는 단백질, 총 지질, 불포화 지질 및 포화 지질에 대한 4개의 SRS 채널뿐만 아니라 FAD 및 NADH의 자가형광을 획득하기 위한 프로토콜을 따름으로써 얻은 결과를 나타냅니다. 여기에서 우리는 또한 RGB 색상 혼합을 통해 프로토콜에 설명된 대로 의사 조직학적 이미지를 생성합니다. MPF 및 SRS 채널을 획득하면 나중에 비율 계량 분석에 사용할 이미지 파일이 제공됩니다. 이 분석의 예는 인간의 폐 조직에 대한 그림 3에서 볼 수 있습니다. 프로토콜에서 이미지 획득에 이어 Python 또는 ImageJ를 활용한 이미지 분석 방법론은 개별 채널의 비율을 활용하여 정량적 대사 정보를 제공합니다. 그림 3의 지질 불포화 및 광학 산화 환원 비율 이미지에서 볼 수 있듯이, 비율계량 분석은 상대적인 대사 활성 및 분자 조성의 분포에 대한 컬러 맵을 제공합니다. 우리는 이러한 측정을 활용하여 특정 조직, 병리학 또는 뚜렷한 생물학적 요인의 대사 경로 및 지질 함량의 변화에 관한 관찰을 수행했습니다. 그림 4에서 볼 수 있듯이, 이는 2D 현미경 이미지에서의 분포 외에도 산화 스트레스와 지질 불포화의 평균값을 비교하여 건강한 조직과 종양 조직의 정량적 비교를 제공할 수 있습니다.
MPF 및 SRS 이미지의 비율계량 분석을 위해 일반적으로 Eq (1) 및 (2)에서 볼 수 있듯이 광학 산화 환원 및 불포화 비율을 대상으로 합니다.
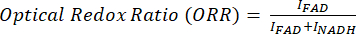 (1)
(1)
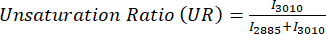 (2)
(2)
여기서 I C는 채널 C의 픽셀 강도입니다. 따라서 우리는 픽셀당 비율을 측정하고 이러한 대사 및 분자 마커의 공간 분포를 획득합니다.
비율계량적 분석 외에도 그림 4 는 멀티모달 플랫폼의 또 다른 잠재적 응용 분야인 초분광 이미지 분석을 보여줍니다. 이 프로토콜에 설명된 바와 같이, 조정 가능한 펌프 빔을 사용하여 여러 레이저 파장에 걸쳐 스윕을 수행하여 SRS 초분광 이미지를 획득할 수 있습니다. 이를 통해 현미경 이미지 내의 각 픽셀에 대한 라만 이동 스펙트럼의 CH 영역을 재구성할 수 있으며, 라만 분광법에서 제공하는 화학 정보와 광학 현미경에서 제공하는 공간 정보를 모두 결합할 수 있습니다. 이미지 분석을 위한 워크플로우에서는 이러한 초분광 이미지를 분석하기 위해 구현된 두 가지 기술, 즉 생체 분자 검출을 위한 PRM-SRS와 k-평균 클러스터링을 강조합니다. 그림 4E 는 마우스 간 종양 이미지에 PRM-SRS를 적용한 것을 보여줍니다. PRM-SRS 알고리즘은 라만 스펙트럼의 이동에 대한 페널티로 조정된 각 개별 픽셀에 대한 스펙트럼 간의 상관 관계를 제공합니다. 그런 다음 알고리즘은 각 지질에 대한 확률 분포 이미지를 생성합니다.
픽셀 스펙트럼의 K-means 클러스터링은 특정 스펙트럼 표현형의 그룹화를 시각화하기 위해 구현하는 또 다른 기술로, 각각 강도와 스펙트럼 모양을 통한 결합 농도 및 분자 구성에 의한 분리를 가능하게 합니다. 그림 5 는 k-means 클러스터링을 통한 이미지 분석을 프로토콜에 적용할 수 있는 방법의 예를 제공합니다. 우리는 k-mean clusters가 SRS 채널 또는 pseudo-Hematoxylin 및 Eosin 조직학적 염색(H&E)에서 쉽게 식별되지 않는 feature로부터 추가 클러스터링을 제공하는 것 외에도 pseudo-histology figure의 특징과 구조적으로 정렬될 것으로 기대합니다. PRM-SRS 및 k-means 클러스터링 분석은 외인성 프로빙(exogenous probing) 없이 특정 분석물 및 분자 결합에 대한 화학적 및 반표적 가능한 정보를 제공하여 이 무표지 이미징 플랫폼을 보완합니다.
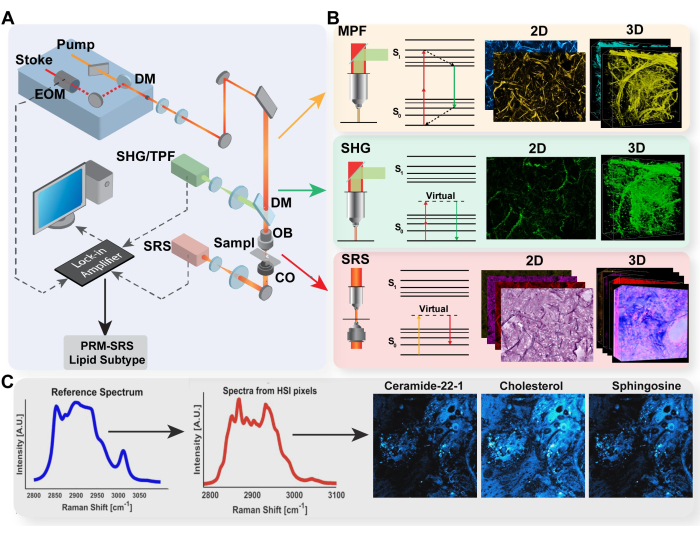
그림 1: 멀티모달 이미징 플랫폼 및 PRM-SRS 생체 분자 검출 다이어그램. (A) MPF/TPF, SHG 및 SRS 이미징 시스템에 대한 하드웨어 설정 다이어그램. (B) TPF, SHG 및 SRS에 대한 광 경로 및 Jablonski 다이어그램과 각 양식에 대한 대표적인 획득 이미지. (C) 자발적 라만 분광법과 SRS 초분광 이미징 간의 스펙트럼 참조 일치를 위한 PRM-SRS 워크플로우 다이어그램. 약어: MPF = 다광자 형광; TPF = 이광자 형광; SHG = 2차 고조파 발생; SRS = 유도 라만 산란; PRM = 페널티가 있는 참조 일치. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
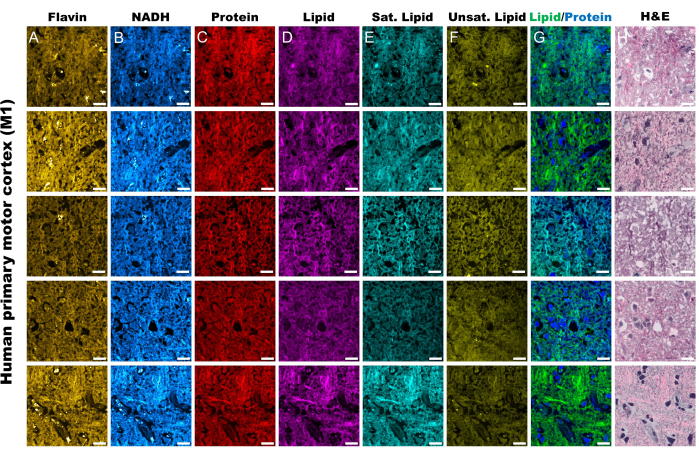
그림 2: 인간 1차 운동 피질 조직(M1)의 MPF 및 SRS 채널. (A,B) Flavin/FAD 및 NADH를 위한 MPF 자가형광 채널. (씨-에프) 특정 라만 이동 피크에서 캡처된 SRS 채널; 단백질에 대한 CH3 비대칭 스트레칭 피크 (2,930 cm-1), 지질에 대한 CH2 비대칭 스트레칭 피크 (2,845 cm-1), 포화 지방산에 대한 2,885 cm-1 피크, 불포화 지방산에 대한 3,010 cm-1 피크. (G) SRS 단백질(파란색) 및 지질(녹색) 채널을 병합하여 각각의 공간 분포를 간략하게 설명했습니다. (H) H&E 염색을 반영하는 SRS 유사 조직학적 이미지(SRH). 눈금 막대 = 20μm. 약어: MPF = 다광자 형광; FAD = 플라빈 아데닌 디뉴클레오티드; NADH = 환원된 니코틴아미드 아데닌 디뉴클레오티드; SRS = 유도 라만 산란; SRH = SRS 조직학. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
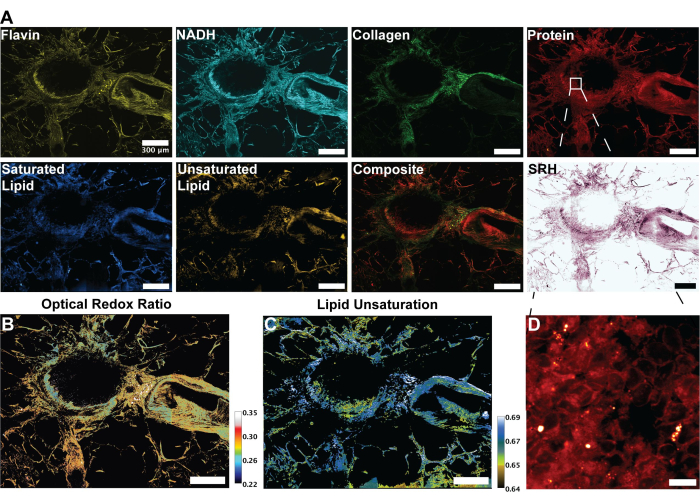
그림 3: MPF, SHG 및 SRS 이미지 및 인간 폐 조직 분석. (A) 플라빈/FAD 및 NADH에 대한 MPF 자가형광, 콜라겐 섬유에 대한 SHG 신호, 단백질(2,930cm-1), 지질(2,845cm-1), 포화 지질(2,885cm-1) 및 불포화 지질(3,010cm-1) 피크에 대한 SRS 신호 및 여러 양식의 복합 병합 이미지. (B) 광학 산화 환원 비율의 비율계량 이미지. (C) 지질 불포화의 비율계량 이미지. (D) 기관지 내층에 있는 상피 세포의 확대 이미지. 스케일 바 = 200μm. 약어: MPF = 다광자 형광; SHG = 2차 고조파 발생; SRS = 유도 라만 산란; FAD = 플라빈 아데닌 디뉴클레오티드; NADH = 감소된 니코틴아미드 아데닌 디뉴클레오티드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
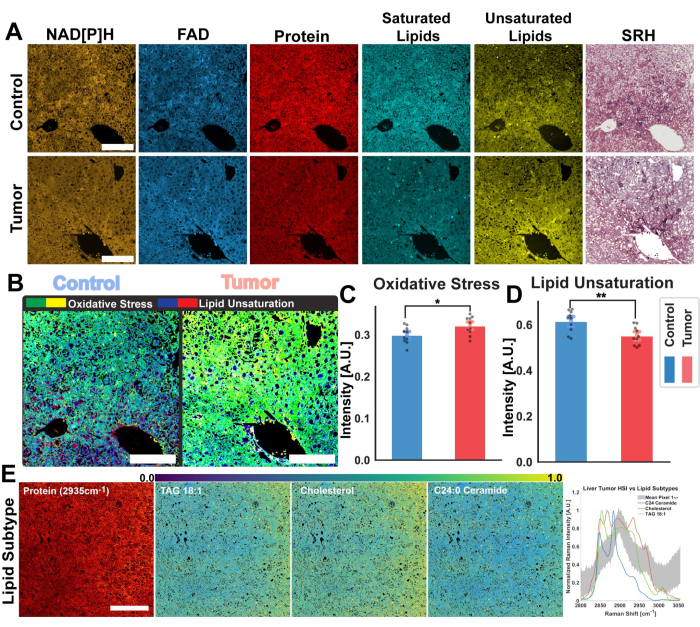
그림 4: 마우스 간 종양에 대한 비율계량 및 초분광 분석. (A) NAD[P]H 및 FAD에 대한 MPF 자가형광 이미지, 총 단백질, 포화 및 불포화 지질에 대한 SRS 채널, 건강한 대조군 마우스 간(위) 및 종양(아래) 조직에 대한 유사 조직학적 이미지. (B) 광학 산화 환원 비율로 측정한 산화 스트레스(황록색)와 대조군(왼쪽) 및 종양(오른쪽) 조직에서 계산된 지질 불포화(청적색). 스케일 바 = 100 μm. (C,D) 대조군(파란색) 간 샘플과 종양(빨간색) 간 샘플 간의 산화 스트레스 및 지질 불포화의 비율 계량적 차이를 보여주는 막대 그래프. 유의성 통계량: p ≤ 0.05의 유의성에 대한 *, p ≤ 0.01의 유의성에 대한 **. (E) 초분광 이미지의 PRM-SRS 지질 아형 분석 결과. 왼쪽에서 오른쪽으로: 구조 참조를 위한 SRS 단백질 채널, 스케일 바 = 100μm, 지질 아형(TAG 18:1, 콜레스테롤 및 C24:0 세라마이드)의 확률 분포 이미지. CH 영역에 걸친 SRS HSI의 지질 아형 참조 스펙트럼 및 평균 픽셀 스펙트럼의 그래프. 약어: MPF = 다광자 형광; SRS = 유도 라만 산란; NAD[P]H = 환원된 니코틴아미드 아데닌 디뉴클레오티드 포스페이트; FAD = 플라빈 아데닌 디뉴클레오티드; HSI = 초분광 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
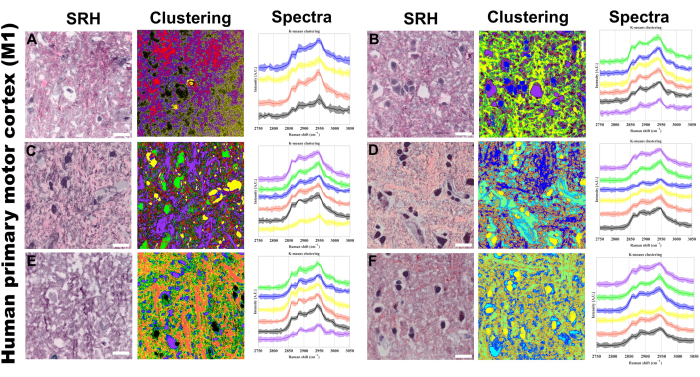
그림 5: 인간 1차 운동 피질(M1)에 대한 SRS 초분광 k-평균 클러스터링. (A-F) 다음을 보여주는 6개의 대표 영역: 왼쪽: H&E와 유사한 조직 시각화를 제공하는 SRH(Stimulated Raman Histology) 이미지; 가운데: 해당 k-means 클러스터링 결과; 오른쪽: 평균 강도(실선)와 표준 편차(음영 영역)가 있는 클러스터별 라만 스펙트럼 프로파일. 4에서 6 사이의 중심 수. 비지도 클러스터링이 사용되었으므로 클러스터링된 이미지의 다양한 색상은 k-means 알고리즘으로 식별된 고유한 화학 조성을 나타냅니다. 각 클러스터(고유한 색상으로 표시)는 CH 스트레칭 영역에서 유사한 스펙트럼 프로파일을 가진 영역에 해당합니다. 스케일 바 = 20μm. 약어: SRH = SRS 조직학. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 멀티모달 시스템은 광범위한 생물학적 기원과 병리학적 조건에 걸쳐 샘플의 분자 환경을 전체적으로 시각화하기 위한 강력한 이미징 플랫폼입니다. 다양한 label-free 방식을 활용하는 이점은 보완적인 정보를 획득하고 단일 label-free 이미징 기술로는 어렵거나 불가능할 수 있는 특정 분석물을 표적으로 삼을 수 있다는 것입니다. 특히, 본 논문에서 언급한 세 가지 비선형 이미징 기술(SRS, MPF, SHG)은 거대분자 구성, 광학 산화 환원 비율을 통한 에너지 역학, 세포 외 기질 구성 및 형태를 포함한 구조 정보의 정량화를 가능하게 합니다 6,48,49. 또한 각 단일 이미징 방식을 개별적으로 활용하는 것과 비교하여 하나의 결합된 현미경 시스템으로 이미징하면 즉각적인 이미지 등록과 샘플 보관 시간을 단축할 수 있습니다. 우리는 컨포칼 형광 현미경 검사에 비해 광노출이 낮기 때문에 이러한 접근 방식으로 라이브 셀 이미징을 수행하기도 했는데, 이는 위의 프로토콜에 명시된 대로 각 양식을 순차적으로 획득하기 위해 선택한 시점을 사용합니다. 개별적인 장점 외에도 멀티모달 플랫폼은 다양한 바이오마커의 무표지 측정을 통해 생물학적 상태에 대한 다양한 관점의 이점을 누릴 수 있습니다.
MPF를 통한 자가형광 단백질의 무표지 이미징은 주로 FAD가 FAD+로 산화되고 NAD+가 NADH50으로 환원됨으로써 촉진되는 산화 환원 반응의 측정인 광학 산화 환원 비율의 정량화에 중점을 두었습니다. 이것은 ATP 세대의 두 가지 주요 경로인 산화적 인산화(oxidative phosphorylation)와 해당과정(glycolysis) 사이의 상대적 활성을 측정하기 때문에 세포와 조직 내 신진대사의 중요한 지표입니다6. 구체적으로, NADH 농도의 감소와 FAD+의 증가는 미토콘드리아에서 산화적 인산화가 증가했음을 나타내는 지표입니다. 한편, 세포질의 해당작용 증가에 대해서는 그 반대입니다. 에너지 생산에서 한 대사 경로를 다른 대사 경로보다 선호하는 경향은 암과 관련된 여러 병리학적 변화 및 경로 활성화와 관련이 있으며, 이는 조기 발견 마커로서 ORR의 잠재적 사용을 강조합니다 6,51.
마찬가지로, SHG 섬유성 콜라겐 신호의 획득은 비선형 무표지 이미징 방식을 활용하여 건강에 대한 생물학적 마커를 정량화하고 시각화합니다. SHG는 비중심 대칭 구조로 인해 I-III형 콜라겐의 분포를 효과적으로 추적할 수 있습니다. SHG로 측정한 섬유상 콜라겐 단백질은 암과 섬유증을 포함한 여러 질병의 중요한 진단 마커로 인식되고 있습니다 25,26,27,52,53. 질병의 표지자로서의 검출 외에도 SHG를 통한 콜라겐 획득은 세포 외 기질의 구성과 조직 전체의 구조적 경계에서 섬유 콜라겐의 역할로 인해 세포와 조직의 구조에 대한 강력한 지표 역할을 할 수 있습니다54,55. SHG 콜라겐 신호를 통해 세포막에 대한 외인성 마커가 필요 없이 별도의 세포 또는 별개의 조직 기능 단위에 대해 정보에 입각한 관찰을 할 수 있습니다. 전반적으로, 콜라겐 원섬유의 SHG 정량화는 다른 label-free 이미징 기술과 통합될 때 진단 능력과 분석 용이성 모두에 분명한 이점을 제공합니다.
SRS 현미경을 활용하여 거대분자 구성, 특히 지질 및 지방산에 대한 여러 마커를 캡처할 수 있습니다. 이 프로토콜에서는 동일한 시료 내에서 지질 불포화의 비율계량 분석을 위해 불포화 지방산 및 포화 지방산에 대한 SRS 신호를 획득하는 방법을 설명합니다. 근적외선 처리량을 위해 25x 물 대물렌즈가 있는 직립 레이저 스캐닝 현미경이 적용되었습니다. 레이저 빔은 샘플을 통과하여 높은 수치 조리개 오일 응축기(1.4 NA)에 의해 수집되었습니다. 높은 O.D. 단역 통과 필터(950nm)를 사용하여 스톡스 빔을 차단하면서 펌프 빔이 Si 포토다이오드 검출기에 도달하여 자극된 라만 손실 신호를 감지할 수 있도록 했습니다. 포토다이오드의 출력 전류가 종단 및 필터링되었습니다. 그 후, 20MHz의 락인앰플리파이어는 제로 위상 편이로 X의 전류를 복조했고, 소프트웨어 모듈은 복조된 신호를 사용하여 레이저 스캐닝 중에 이미지를 생성했습니다.
연구에 따르면 지질 불포화 농도의 변화는 세포와 세포 소기관막에 지대한 영향을 미치며, 지질 대사의 조절 장애는 암 및 신경퇴행성 질환을 포함한 여러 질병의 강력한 지표가 될 수 있습니다 56,57,58,59. 지질 조절 장애에 대한 보다 포괄적인 개요를 위해 SRS 초분광 이미징을 사용하여 아형 구성을 분석합니다. SRS 초분광 이미지(HSI)는 프로토콜에 설명된 대로 순차적 튜닝을 통해 SRS 현미경으로 획득한 고해상도 공간 정보와 화학적으로 중요한 라만 분광법의 신호를 결합합니다. 그런 다음 이러한 픽셀 스펙트럼은 k-means를 통한 클러스터링과 PRM-SRS를 사용한 생체 분자 검출의 두 가지 방법으로 분석됩니다.
픽셀 스펙트럼의 K-means 클러스터링은 SRS 신호 강도와 분자 결합 농도60,61 사이의 선형 관계로 인해 분자 농도 및 구성에 의해 2D 이미지 내 영역을 분리합니다. 이 방법론을 통해 우리는 픽셀 스펙트럼 및 공유 스펙트럼 중심에 의해 규정된 대로 특정 분자 표현형을 가진 영역을 확인하기 위해 프로토콜을 적용합니다. 특정 픽셀에서 뚜렷한 분자 발현을 철저히 검사하기 위해 PRM-SRS를 구현하여 자발적 라만 분광법으로 캡처된 특정 분자에 대한 참조 스펙트럼과 SRS HSI 획득의 픽셀 스펙트럼 간의 스펙트럼 일치를 수행합니다. 그렇게 함으로써, 우리는 외인성 프로브나 표지를 사용하지 않고 별개의 분자에 대한 발현 확률을 결정할 수 있습니다. 이 분석은 조직 및 생물학적 모델 전반에 걸쳐 특정 지질 아형을 추적할 수 있는 능력과 지질 조성 변화의 병리학적 변화를 식별하여 이상지질혈증을 식별할 수 있는 능력을 입증했습니다47. 또한, 실리카 섬유를 통한 피코초 펄스 전파의 스펙트럼 분할을 통해 스펙트럼 분해능을 개선하는 최근의 발전은 무표지 생화학적 시각화를 위한 양식으로 SRS HSI의 적용을 더욱 장려합니다62. 프로토콜에서 강조된 이러한 방법을 통해 당사는 label-free SRS 양식을 활용하여 포괄적인 비율계량 및 스펙트럼 분석을 수행할 수 있는 플랫폼을 구축합니다.
이러한 기술의 상대적인 복잡성과 참신함 외에도 접근 방식에서 고려해야 할 몇 가지 중요한 제한 사항이 있습니다. 일반적으로 사용되는 펨토초 레이저와 달리 피코초 펄스 레이저로 MPF 이미지를 획득하려면 더 높은 형광단 여기력이 필요하며 광표백의 위험이 있습니다. 이를 염두에 두고 우리는 표본에 가해지는 레이저 출력을 줄여 플랫폼의 잠재적인 광손상을 완화하기 위해 위의 프로토콜을 최적화했습니다. 또한, 이전 연구에서는 NADH 및 FAD의 MPF 자가형광 이미징에서 광학 산화 환원 비율을 평가할 수 있는 능력을 입증한 반면, 형광 수명 이미징 현미경(FLIM)은 에너지 대사를 평가하는 데 더 높은 정확도를 보여주었습니다 63,64,65. 이것은 MPF의 기능에 비교된 그들의 명백한 형광 일생에 근거를 둔 NADH와 FAD의 단백질 바운스와 언바운드 농도를 구별하는 기능 때문이, 이것은 FLIM가 산화 인산화와 해당과정 16,63,64,65,66,67를 포함하여 명백한 에너지 통로에서 변화 활동의 포괄적인 학문에 사용되는 것을 허용했습니다, 68. 이 프로토콜은 FLIM을 제외하지만, 가까운 장래에 이 이미징 플랫폼에 양식이 통합되어 현재 수행하는 에너지 대사 분석을 향상시킬 것으로 기대합니다. 그럼에도 불구하고, 여기에 확립된 프로토콜을 통해 여러 관점에서 생물학적 구조 대사를 측정할 수 있는 다중 모드 이미징 접근 방식을 위한 워크플로우 및 하드웨어 설정을 제시합니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
인간 폐 조직 절편을 제공해 주신 Gloria Pryhuber 박사와 HuBMAP 팀원들에게 감사드립니다. 인간의 뇌 조직을 제공해 주신 Kun Zhang 박사님께 감사드립니다. 또한 쥐 간 샘플을 제공해 주신 Gen-Sheng Feng 박사님께도 감사드립니다. NIHU54DK134301, NIH R01GM149976, NIH U01AI167892, NIH R01HL170107, NIH 5R01NS111039, NIH R21NS125395, NIH U54CA132378, UCSD Startup funds, Sloan Research Fellow Award 및 CZI DAF2023-328667 Award의 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 460 nm Filter Cube | Olympus | OCT-ET 460/50M32 | |
| Bandpass Filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| DC power supply | TopWard | 6302D | |
| Dichroic Mount | Thorlabs | KM100CL | |
| FIJI ImageJ | ImageJ | ||
| High NA oil condenser | Olympus | 6-U130 | |
| High O.D. shortpass filter | Thorlabs | 950 nm | |
| Inverted Laser Scanning Microscope | Olympus | FV1200MPE | |
| Lock-in Amplifier | Zurich Instruments | ||
| picoEmerald Laser System | Applied Physics & Electronics, Inc. | Synchronized pulsed pump beam (tunable 720–990 nm wavelength, 5–6 ps pulse width, and 80 MHz repetition rate) and Stokes (wavelength at 1032 nm, 6 ps pulse width, and 80 MHz repetition rate) | |
| SI Photodiode Detector | Home Built | ||
| Touch Panel Controller | Olympus | ||
| VF-300 Compresstome | Precisionary |
참고문헌
- Wollman, A. J. M., Nudd, R., Hedlund, E. G., Leake, M. C. From Animaculum to single molecules: 300 years of the light microscope. Open Biol. 5 (4), 150019(2015).
- Vicidomini, G., Bianchini, P., Diaspro, A. STED super-resolved microscopy. Nat Methods. 15 (3), 173-182 (2018).
- Weber, M., et al. MINSTED fluorescence localization and nanoscopy. Nat Photonics. 15 (5), 361-366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. , (1990).
- Hell, S. W., et al. Three-photon excitation in fluorescence microscopy. J Biomed Optics. 1 (1), 71-74 (1996).
- Alhallak, K., Rebello, L. G., Muldoon, T. J., Quinn, K. P., Rajaram, N. Optical redox ratio identifies metastatic potential-dependent changes in breast cancer cell metabolism. Biomed Opt Express. 7 (11), 4364-4374 (2016).
- Pena, A. -M., et al. Multiphoton FLIM imaging of NADH and FAD to analyze cellular metabolic activity of reconstructed human skin in response to UVA light. Multiphoton Microscopy in the Biomedical Sciences XIX. 10882, 23-33 (2019).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomed Opt Express. 11 (10), 5674-5688 (2020).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. J Biol Chem. 254 (11), 4764-4771 (1979).
- Ostrander, J. H., et al. Optical redox ratio differentiates breast cancer cell lines based on estrogen receptor status. Cancer Res. 70 (11), (2010).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proc Natl Acad Sci USA. 104 (49), 19494-19499 (2007).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Cancer Res. 74 (11), 3067-3075 (2014).
- Malak, M., James, J., Grantham, J., Ericson, M. B. Contribution of autofluorescence from intracellular proteins in multiphoton fluorescence lifetime imaging. Sci Rep. 12, 16584(2022).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using NADH and NADPH autofluorescence. Free Radic Biol Med. 100, 53-65 (2016).
- Roth, S., Freund, I. Second harmonic generation in collagen. J Chem Phys. 70 (4), 1637-1643 (1979).
- Freund, I., Deutsch, M. Second-harmonic microscopy of biological tissue. Opt Lett. 11 (2), 94(1986).
- Boyd, R. W., Gaeta, A. L., Giese, E. Nonlinear optics. Springer Handbook of Atomic, Molecular, and Optical Physics. Drake, G. W. F. , Springer. 1097-1110 (2023).
- Aghigh, A., et al. Second harmonic generation microscopy: a powerful tool for bio-imaging. Biophys Rev. 15 (1), 43-70 (2023).
- Mohler, W., Millard, A. C., Campagnola, P. J. Second harmonic generation imaging of endogenous structural proteins. Methods. 29 (1), 97-109 (2003).
- Cox, G. Biological applications of second harmonic imaging. Biophys Rev. 3 (3), 131(2011).
- Brown, E., et al. Dynamic imaging of collagen and its modulation in tumors in vivo using second-harmonic generation. Nat Med. 9 (6), 796-800 (2003).
- Keikhosravi, A., Bredfeldt, J. S., Sagar, A. K., Eliceiri, K. W. Chapter 28 - Second-harmonic generation imaging of cancer. Methods Cell Bio. 123, 531-546 (2014).
- Hui Mingalone, C. K., et al. Bioluminescence and second harmonic generation imaging reveal dynamic changes in the inflammatory and collagen landscape in early osteoarthritis. Lab Invest. 98 (5), 656-669 (2018).
- Tsafas, V., et al. Polarization-dependent second-harmonic generation for collagen-based differentiation of breast cancer samples. J Biophotonics. 13 (10), e202000180(2020).
- Nadiarnykh, O., LaComb, R. B., Brewer, M. A., Campagnola, P. J. Alterations of the extracellular matrix in ovarian cancer studied by Second Harmonic Generation imaging microscopy. BMC Cancer. 10, 94(2010).
- Xiong, S. Y., Yang, J. G., Zhuang, J. Nonlinear spectral imaging of human normal skin, basal cell carcinoma and squamous cell carcinoma based on two-photon excited fluorescence and second-harmonic generation. Laser Phys. 21 (10), 1844-1849 (2011).
- Tilbury, K., Campagnola, P. J. Applications of second-harmonic generation imaging microscopy in ovarian and breast cancer. Perspect Medicin Chem. 7, 21-32 (2015).
- Raman, C. V., Krishnan, K. S. A New type of secondary radiation. Nature. 121 (3048), 501-502 (1928).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Phys Rev Lett. 9 (11), 455-457 (1962).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Li, Y., et al. Microglial lipid droplet accumulation in tauopathy brain is regulated by neuronal AMPK. Cell Metab. 36 (6), 1351-1370.e8 (2024).
- Lu, F. -K., et al. Label-free neurosurgical pathology with stimulated Raman imaging. Cancer Res. 76 (12), 3451-3462 (2016).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nat Commun. 9 (1), 2995(2018).
- Zhang, L., et al. Spectral tracing of deuterium for imaging glucose metabolism. Nat Biomed Eng. 3 (5), 402-413 (2019).
- Li, Y., et al. Bioorthogonal stimulated Raman scattering imaging uncovers lipid metabolic dynamics in Drosophila brain during aging. GEN Biotechnol. 2 (3), 247-261 (2023).
- Li, X., et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by stimulated Raman scattering microscopy. Anal Chem. 91 (3), 2279-2287 (2019).
- Ji, M., et al. Detection of human brain tumor infiltration with quantitative stimulated Raman scattering microscopy. Sci Transl Med. 7 (309), 309ra163(2015).
- Ji, M., et al. Rapid, label-free detection of brain tumors with stimulated Raman scattering microscopy. Sci Transl Med. 5 (201ra119), 201ra119(2013).
- You, S., et al. Intravital imaging by simultaneous label-free autofluorescence-multiharmonic microscopy. Nat Commun. 9, 2125(2018).
- You, S., et al. Label-free deep profiling of the tumor microenvironment. Cancer Res. 81 (9), 2534-2544 (2021).
- Jermyn, M., et al. Highly accurate detection of cancer in situ with intraoperative, label-free, multimodal optical spectroscopy. Cancer Res. 77 (14), 3942-3950 (2017).
- Pshenay-Severin, E., et al. Multimodal nonlinear endomicroscopic imaging probe using a double-core double-clad fiber and focus-combining micro-optical concept. Light Sci Appl. 10 (1), 207(2021).
- Wu, W., Li, X., Qu, J. Y., He, S. In vivo imaging of biological tissues with combined two-photon fluorescence and stimulated Raman scattering microscopy. J Vis Exp. (178), e63411(2021).
- Li, X., Jiang, M., Lam, J. W. Y., Tang, B. Z., Qu, J. Y. Mitochondrial imaging with combined fluorescence and stimulated Raman scattering microscopy using a probe of the aggregation-induced emission characteristic. J Am Chem Soc. 139 (47), 17022-17030 (2017).
- Li, Z., et al. Multimodal imaging of metabolic activities for distinguishing subtypes of breast cancer. Biomed Opt Express. 14 (11), 5764-5780 (2023).
- Fung, A. A., et al. Label-free optical biopsy reveals biomolecular and morphological features of diabetic kidney tissue in 2D and 3D. , (2024).
- Zhang, W., et al. Multi-molecular hyperspectral PRM-SRS microscopy. Nat Commun. 15 (1), 1599(2024).
- Xu, F. X., et al. Discrimination of lipid composition and cellular localization in human liver tissues by stimulated Raman scattering microscopy. J Biomed Opt. 29 (1), 016008(2024).
- Zoumi, A., Yeh, A., Tromberg, B. J. Imaging cells and extracellular matrix in vivo by using second-harmonic generation and two-photon excited fluorescence. Proc Natl Acad Sci USA. 99 (17), 11014-11019 (2002).
- Liaudanskaya, V., et al. Mitochondria dysregulation contributes to secondary neurodegeneration progression post-contusion injury in human 3D in vitro triculture brain tissue model. Cell Death Dis. 14 (8), 1-15 (2023).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, sub-types and early treatment response in breast cancer. Cancer Res. 73 (20), 6164-6174 (2013).
- Conklin, M. W., et al. Aligned collagen is a prognostic signature for survival in human breast carcinoma. Am J Pathol. 178 (3), 1221-1232 (2011).
- Sun, W., et al. Nonlinear optical microscopy: use of second harmonic generation and two-photon microscopy for automated quantitative liver fibrosis studies. J Biomed Optics. 13 (6), 064010(2008).
- Nejim, Z., Navarro, L., Morin, C., Badel, P. Quantitative analysis of second harmonic generated images of collagen fibers: a review. Res Biomed Eng. 39 (1), 273-295 (2023).
- Burke, K., Brown, E. The use of second harmonic generation to image the extracellular matrix during tumor progression. Intravital. 3 (3), e984509(2015).
- Balasubramanian, P., Prabhakaran, M. P., Sireesha, M., Ramakrishna, S. Collagen in human tissues: Structure, function, and biomedical implications from a tissue engineering perspective. Polymer Composites - Polyolefin Fractionation - Polymeric Peptidomimetics - Collagens. Abe, A., Kausch, H. H., Möller, M., Pasch, H. 251, 173-206 (2012).
- Dadsena, S., et al. Lipid unsaturation promotes BAX and BAK pore activity during apoptosis. Nat Commun. 15, 4700(2024).
- Barelli, H., Antonny, B. Lipid unsaturation and organelle dynamics. Curr Opin Cell Biol. 41, 25-32 (2016).
- Harayama, T., Antonny, B. Beyond fluidity: The role of lipid unsaturation in membrane function. Cold Spring Harb Perspect Biol. 15 (7), a041409(2023).
- Yoon, H., Shaw, J. L., Haigis, M. C., Greka, A. Lipid metabolism in sickness and in health: Emerging regulators of lipotoxicity. Mol Cell. 81 (18), 3708-3730 (2021).
- Villazon, J., Shi, L. Utilizing K-means clustering on hyperspectral DO-SRS images of the mouse hippocampus. CLEO 2024, Technical Digest Series. , Optica Publishing Group. (2024).
- Fu, D., et al. Quantitative chemical imaging with multiplex stimulated Raman scattering microscopy. J Am Chem Soc. 134 (8), 3623-3626 (2012).
- Periasamy, A., Diaspro, A. Special section guest editorial: Multiphoton microscopy. J Biomed Optics. 8 (3), 327(2003).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proc Natl Acad Sci USA. 89 (4), 1271-1275 (1992).
- Blacker, T. S., et al. Separating NADH and NADPH fluorescence in live cells and tissues using FLIM. Nat Commun. 5, 3936(2014).
- Xiong, H., et al. Background-free imaging of chemical bonds by a simple and robust frequency-modulated stimulated Raman scattering microscopy. Opt Express. 28 (10), 15663-15677 (2020).
- Georgakoudi, I., Quinn, K. P. Label-free optical metabolic imaging in cells and tissues. Annu Rev Biomed Eng. 25, 413-443 (2023).
- Alam, S. R., Wallrabe, H., Christopher, K. G., Siller, K. H., Periasamy, A. Characterization of mitochondrial dysfunction due to laser damage by 2-photon FLIM microscopy. Sci Rep. 12 (1), 11938(2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유