Method Article
פלטפורמת הדמיה אופטית מולטי-מודאלית לחקר חילוף החומרים התאי
* These authors contributed equally
In This Article
Summary
תוך שימוש בפלטפורמה רב-מודאלית המשלבת שיטות הדמיה אופטיות ללא תוויות, פיתחנו פרוטוקול להדמיה וכימות של דינמיקה תאית וחילוף חומרים. באמצעות הדמיה באמצעות פלואורסצנציה רב-פוטונית, דור הרמוני שני ומיקרוסקופ פיזור רמאן מגורה, אנו יכולים ליצור סקירה הוליסטית של הסביבה התאית והמולקולרית.
Abstract
טכנולוגיות הדמיה אופטית הן קריטיות במחקרים ביו-רפואיים בשל יכולתן להשיג מידע מורפולוגי ופונקציונלי מדגימות ביולוגיות ברזולוציה מרחבית גבוהה. תהליכים אופטיים אלה מנצלים אינטראקציות שונות של מולקולות אור, כגון פיזור, ספיגה, פליטה ויצירה הרמונית, בין פוטונים למולקולות בתוך תאים, רקמות או איברים. בעוד שהדמיה ביו-רפואית קונבנציונלית התמקדה היסטורית ביישום שיטה אחת, מחקרים עדכניים הראו כי טכניקות מגוונות אלה מספקות תובנות משלימות, והתפוקות המשולבות שלהן מציעות הבנה מקיפה יותר של שינויים מולקולריים בתהליכי הזדקנות והתפתחות מחלות ויסודות בביולוגיה של התא.
בעשורים האחרונים התקדמו שיטות הדמיה אופטיות ללא תוויות, המאפשרות חקירה מפורטת של סביבות תאיות ותת-תאיות. לדוגמה, פלואורסצנציה רב-פוטונית (MPF) לא רק מאפשרת הדמיית חלבון ממוקדת אלא גם מכמתת פעילות מטבולית באמצעות קו-אנזימים אוטו-פלואורסצנטיים, ומשיגה עומק חדירה גבוה ורזולוציה מרחבית. הדור ההרמוני השני (SHG) משמש להדמיית מבנים כמו קולגן במטריצה החוץ-תאית, בעוד שפיזור רמאן מגורה (SRS) ממפה קשרים כימיים והרכב מולקולרי באתרם ברזולוציה תת-תאית.
פיתחנו פלטפורמת הדמיה רב-מודאלית המשלבת שיטות MPF, SHG ו-SRS. השילוב של שיטות אלה בפלטפורמה אחת מאפשר רכישת מידע רב פנים מאותו לוקליזציה בתוך תאים, רקמות, איברים או אפילו גופים, מה שמקל על חקירה מפורטת יותר של היחסים המורכבים בין חילוף החומרים התאי, מבנה המטריצה החוץ-תאית, וההרכב המולקולרי. מערכת רב-מודאלית זו מציעה רזולוציה תת-תאית, חדירת רקמות עמוקות, הדמיית תאים חיים/רקמות באתר , כמו גם זיהוי ללא תוויות ורישום משותף מיידי ללא צורך בהתאמות מיקום, החלפת מכשיר או יישור לאחר הניתוח. כאן, אנו מציגים פרוטוקול להדמיה ללא תווית עם פלטפורמה רב-מודאלית זו ומדגימים את יישומו באפיון חילוף החומרים התאי, והטרוגניות מולקולרית בתאים וברקמות לחקר הזדקנות ומחלות.
Introduction
הדמיה ביו-רפואית אופטית הייתה מרכזית בקידום ההבנה שלנו לגבי המבנה והתפקוד הביולוגיים. התמונות נוצרות על ידי אפנון אור עירור וזיהוי אותות מאינטראקציות אור-רקמה. המיקרוסקופ המורכב הראשון, שפותח על ידי הנס וזכריה יאנסן בסביבות 1590, השתמש בשתי עדשות קמורות בצינור, וסיפקו הגדלה של עד 30x1. מיקרוסקופים אופטיים מודרניים, לאחר מאות שנים של התקדמות, יכולים כעת להשיג רזולוציות עדינות כמו 1-3 ננומטר 2,3. בנוסף להצעת רזולוציה גבוהה, מערכות הדמיה מתקדמות מספקות כעת חדירה עמוקה יותר לרקמות, יעילות רבה יותר ונזק מינימלי לדגימה, מה שהופך אותן למתאימות במיוחד להדמיית תאים ורקמות חיים. הדמיה ללא תוויות היא יתרון במיוחד מכיוון שהיא לוכדת מידע מבלי לשבש תהליכים תוך-תאיים או לפגוע בשלמות הדגימה.
מיקרוסקופיה פלואורסצנטית רב-פוטונית (MPF), במיוחד מיקרוסקופיה פלואורסצנטית דו-פוטונית, שימשה באופן נרחב להדמיה ללא תוויות. בניגוד למיקרוסקופיה פלואורסצנטית קונבנציונלית, המסתמכת על ספיגה ופליטה ליניארית של פוטון בודד, עירור MPF כרוך בספיגה בו זמנית של פוטונים מרובים, שהאנרגיה המשולבת שלהם מעוררת מולקולת פלואורופור בודדת 4,5. פוטונים אלה, בדרך כלל בספקטרום האינפרא אדום, מחזיקים במחצית או פחות מהאנרגיה הנדרשת לעירור פוטון בודד. אורכי הגל הארוכים יותר והעירור המקומי בנקודת המוקד בתהליך לא ליניארי זה מביאים לפיזור נמוך יותר, חדירה עמוקה יותר לרקמות ופוטוטוקסיות מופחתת.
ניתן ללכוד מידע מטבולי תאי על ידי מיקרוסקופ MPF ללא תווית באמצעות זיהוי אותות אוטופלואורסצנטיים ממצעים מטבוליים אנדוגניים, כגון ניקוטינמיד אדנין דינוקלאוטיד מופחת (NADH) ופלווין אדנין דינוקלאוטיד (FAD). קו-אנזימים אלה מציגים ספקטרום עירור ופליטה מובהק, ויחס עוצמת הקרינה שלהם, המכונה יחס חמצון חיזור (NADH/FAD), משקף את מצב החמצון של התא. מאז שבריטון צ'אנס הציגה לראשונה את הרעיון של יחס חמצון חיזור בשנת 1979, הוצעו יחסים נוספים, כולל NAD(P)H/FAD, NAD(P)H/(FAD + NAD(P)H), ו-FAD/(FAD + NAD(P)H), 6,7,8,9. כימות יחסי חמצון חיזור אופטיים אלה באמצעות הדמיית MPF מספק תובנה חשובה לגבי הדינמיקה המטבולית. לדוגמה, הדמיית MPF יכולה להבחין בין תאים סרטניים לתאים רגילים על סמך חילוף החומרים המשתנה שלהם, מה שמדגים את הפוטנציאל שלו לאבחון סרטן 10,11,12. עם זאת, לזיהוי אוטופלואורסצנטי מבוסס MPF יש מגבלות. פלואורופורים פנימיים אחרים, כגון קרטין, עשויים לתרום לעוצמת הקרינה, מה שמוביל לדיבור צולב ספקטרלי ולפרשנות אותות לא מדויקת13. בנוסף, יחס החיזור משקף רק את השינויים הכוללים בהפחתת חמצון תאים ואינו מבחין בין NADH ממקורות שונים (למשל, ציטופלזמי או מיטוכונדריאלי) או בין NADH ל-NAD(P)H, מכיוון ששניהם מציגים שיאים ספקטרליים דומים ב-450 ננומטר, וכתוצאה מכך אותות עוצמה מעורבבים14.
הדור ההרמוני השני (SHG), תהליך אופטי לא ליניארי שהודגם לראשונה בתחום הביו-רפואי בשנות ה-80, נמצא בשימוש נרחב להדמיה ללא תוויות של מבנים תאיים15,16. בדומה ל-MPF, SHG כרוך בספיגה בו-זמנית של שני פוטונים בעלי אותה אנרגיה מלייזר פועם מהיר במיוחד. פוטונים אלה משולבים מחדש כדי לפלוט פוטון חדש בתדירות כפולה מהאור הפוגע, וכתוצאה מכך מתגלה האות ההרמוני השני. אינטראקציה אופטית לא ליניארית זו מתרחשת אך ורק בחומרים לא צנטרו-סימטריים המציגים רגישות מסדר שני שאינה אפס לגרום לקיטוב ליצירת האות ההרמוני השני17,18. זה הופך את SHG ליעיל במיוחד להדמיית החלבונים החוטים והמבנים הסיביים, כגון קולגן, מיוזין וטובולין, מבלי לדרוש צבעי פלואורסצנטיים אקסוגניים 15,17,19,20. החריגות בשפע, בנוקשות, ביישור ובמבנה של פיברוזיס וקולגן נפוצות במצבים רבים כגון דלקת וסרטן, מה שהופך את SHG לכלי מבטיח לזיהוי יעיל ולא פולשני למצבי מחלה מסוימים 21,22,23. היישום הנרחב של הדמיית SHG במחקר אונקולוגי, כולל מחקרים על סרטן השד, השחלות והעור, הדגיש את תפקידו המכריע הן במחקר בסיסי והן ביישומים קליניים פוטנציאליים 24,25,26,27.
מולקולות שונות מציגות רמות אנרגיית רטט שונות, הגורמות לדרגות שונות של פיזור לא אלסטי כאשר הן נרגשות על ידי אור מקרי - תופעה שאופיינה לראשונה על ידי C. V. Raman בשנת 192828. מאז נעשה שימוש נרחב באפקט ראמאן במיקרוסקופיה אופטית לאיתור קומפוזיציות מולקולריות ורקמות ללא תיוג אקסוגני. גם פיזור רמאן מגורה (SRS) וגם פיזור רמאן קוהרנטי נגד סטוקס (CARS) מעוררים תנודות מולקולריות באופן קוהרנטי וממנפים את האינטראקציה הלא ליניארית של האור כדי לייצר אות חזק יותר בהשוואה לספקטרוסקופיה ספונטנית קונבנציונלית. תופעת ה-SRS דווחה לראשונה ב-196229. בשנת 2008, מנגנון זה שולב בהדמיה תלת מימדית רב-ממדית, המאפשרת זיהוי סלקטיבי של כימיקלים על סמך שינויי עוצמה בקרני המשאבה וסטוקס עקב מעברי רטט מולקולריים30. שיטה זו ממזערת הפרעות רקע שאינן תהודה, ויוצרת אות עוצמה נקי העולה על זה של CARS. הדמיית SRS מצטיינת במתן הדמיה מרובה והיפרספקטרלית, המאפשרת זיהוי בו זמנית של קשרים כימיים מרובים ומאפשרת הדמיה ברזולוציה גבוהה של הרכב מולקולרי בדגימות בעלות עומק חדירה ניכר. למרות שמדובר בטכניקה חדשה יחסית, הדמיית SRS הוכחה כיעילה הן באבחון קליני והן במחקר מטבולי, in vivo ו-in vitro 30,31,32,33,34,35,36. לדוגמה, SRS יכול להבדיל בין רקמות שחדרו לגידול במוח לבין קליפת המוח והחומר הלבן על ידי כימות יחס השומנים לחלבון, מה שמאפשר תיחום של שולי הגידול בצורה נטולת תווית ולא פולשנית37,38. בנוסף, ניתן להעריך כמותית שינויים מטבוליים, הנחשבים לעתים קרובות לסימני היכר של מחלות הקשורות להזדקנות ולסרטן, באמצעות SRS שהושג על ידי זיהוי קשרי פחמן-דאוטריום בדגימות שטופלו במים כבדים (D2O), המאפשר מדידה כמותית של סינתזת חלבונים, ליפוגנזה ותהליכים מטבוליים מקרומולקולריים אחרים 31,33,34,35,36. היכולת לעקוב אחר מטבוליטים ברזולוציה גבוהה בזמן ובמרחב מציבה את SRS ככלי מבטיח לחקירת ואבחון מחלות, עם פוטנציאל ליישומים קליניים רחבים יותר.
הדמיה רב-מודאלית התגלתה כגישה רבת עוצמה במחקר ביו-רפואי, המשלבת שתי שיטות הדמיה או יותר כדי להשיג הבנה מקיפה יותר של מערכות ביולוגיות מורכבות באותה דגימה. בשנת 2018 הוצגה טכניקת מיקרוסקופיה אוטופלואורסצנטית-מולטי-הרמונית (SLAM) ללא תוויות, המשלבת פלואורסצנציה דו-פוטונית (2PF), פלואורסצנציה תלת-פוטונית (3PF), SHG ודור הרמוני שלישי (THG)39. גישה זו מאפשרת הדמיה בו זמנית של אינטראקציות תאיות, תהליכים דינמיים ורכיבים בודדים בתוך מיקרו-סביבת הגידול. מיקרוסקופ SLAM מציע הפרעה מינימלית ודרישות כוח לייזר מופחתות לדגימה, מה שמאפשר פרופיל רקמות עמוק ומספק שיטה בטוחה יותר לניטור תוך חיוני40. שיטה רב-מודאלית נוספת, המשלבת ספקטרוסקופיה פלואורסצנטית פנימית, ספקטרוסקופיה של החזר מפוזר וספקטרוסקופיה של ראמאן, פותחה לגילוי סרטן באתרו במהלך פרוצדורות כירורגיות41. בנוסף, מערכת אנדוסקופיה לא ליניארית רב-מודאלית שתוכננה לאחרונה, המשלבת CARS, SHG ופלואורסצנציה דו-פוטונית (TPF), הדגימה את היכולת לצלם דגימות ביולוגיות ברזולוציה מרחבית תת-מיקרונית ותת-תאית42. מיקרוסקופיה משולבת של 2PF ו-SRS שימשה באופן דומה להדמיה ברזולוציה גבוהה של רקמות, תאים ואברונים 42,43,44,45. טכניקות הדמיה מולטי-מודאליות מתפתחות אלה רותמות את החוזקות של שיטות בודדות, מה שמוביל לשיפור הרזולוציה, עומק החדירה ויעילות רכישת התמונה, ובכך מראות פוטנציאל ניכר ליישומים קליניים וכירורגיים.
גישה רב-מודאלית זו מועדפת יותר ויותר על פני הדמיה חד-מודאלית מכיוון שהיא מספקת מגוון רחב יותר של מדידות תוך הפחתת המגבלות הקשורות לטכניקות בודדות. כפי שנדון קודם לכן, MPF מודד פלואורסצנטיות אנדוגנית כדי לשקף שינויים מטבוליים, SHG יכול לדמות מבנים לא צנטרו-סימטריים כגון קולגן בדגימות ביולוגיות, ו-SRS מזהה בעיקר חלבונים ושומנים בשל הצפיפות הגבוהה של קשרים כימיים המייצרים אותות ראמאן ייחודיים על סמך מצבי הרטט שלהם. בהתחשב בתכונותיהם הקוהרנטיות והעיקרון המשותף של תכונות אופטיות לא ליניאריות, ניתן לשלב שיטות הדמיה אלה במערך מיקרוסקופ יחיד תוך שימוש בלייזרים פולסים קצרים במיוחד, המאפשרים רכישה של סמנים ביולוגיים שונים באזורים מקומיים כדי לספק תצוגה מלאה יותר של תהליכים ביולוגיים44,45. מאמר זה מתאר פרוטוקול ליישום פלטפורמת הדמיה רב-מודאלית המשלבת MPF, SHG ו-SRS ליישומי מחקר ביו-רפואי.
Protocol
1. ניסויי הדמיה מולטי-מודאליים ללא תוויות
הערה: פרוטוקול זה מתמקד בהליך ההגדרה והרכישה של הדמיה רב-מודאלית ללא תוויות.
- הגדרת המיקרוסקופ הרב-מודאלי (איור 1A) וכיול המערכת
- מחממים את הלייזר ומחכים כ-15-20 דקות.
- הפעל את יחידות הבקרה והמסכים ברצף הבא: תיבת בקרה | בקר לוח מגע | מתאם AC לשלט לייזר ראשי מתאם AC לשלט לייזר משנה.
- הפעל את גלאי הפוטו-דיודה Si ואת מגבר הנעילה.
- הגדר את קרני הלייזר של המשאבה ואת קרן סטוקס. הגדר את מערכת הלייזר עם קרן משאבה הניתנת לכוונון מ-780 ננומטר ל-990 ננומטר, רוחב דופק של 5 - 6 ps וקצב חזרה של 80 מגה-הרץ. לקרן הלייזר של סטוקס אורך גל קבוע של 1,031 ננומטר עם דופק של 6 ps וקצב חזרה של 80 מגה-הרץ . ודא שגם קורות המשאבה וגם קורות סטוקס הן בהספק נמוך (לפחות 20 mW) כדי להיות גלויות על לוחית היישור.
- הנח לוחית יישור אחת בנתיב האופטי (מיד אחרי תיבת הלייזר) כדי לבדוק את החפיפה המרחבית של המשאבות וקרני סטוקס וכוונן את המראה עד ששתי הנקודות חופפות במרכז לוחית היישור.
הערה: למרות שהמשאבות וקרני סטוקס חופפות באופן גס, כוונון עדין של החפיפה המרחבית של שתי קרני לייזר יכול להשיג את אות ה-SRS האופטימלי. - לאחר חפיפה מרחבית, כוונון עדין עם ה-PSD (גלאי רגיש למיקום) על ידי לחיצה ראשונה על תוכנת הבקרה OPO . השתמש במקש המשושה כדי לכוונן בזהירות את המראה האופטית 1 (OM1) וצפה בתצוגת ה-PSD לשינוי מיקום ה-XY כדי לכוון לסטייה המינימלית מהמרכז. לאחר מכן, כדי לבצע התאמות מדויקות יותר, השתמש במקש המשושה במראה האופטית 2 (OM2) עד שמחוון המיקום יהיה ממורכז בתצוגת ה-PSD.
הערה: OM1 ו-OM2 הן שתי מראות בראש OPO כדי להתאים את יישור הלייזר. - לבסוף, מרכז את המעבה על ידי סיבוב שני הברגים המרכזיים את המעבה כדי להזיז את תמונת דיאפרגמת הקשתית למרכז שדה הראייה.
הערה: דיאפרגמת קשתית השדה יכולה להגביל את קוטר אלומת האור הנכנסת למטרה ובכך להוציא אור זר, ולשפר את ניגודיות התמונה.
- שלבי קליטת הדמיה רב-מודאלית ללא תוויות
- מרחו שמן על מעבה השמן בעל הצמצם המספרי הגבוה (1.4 NA) והרכיבו את שקופית המיקרוסקופ על המעבה המשומן. לבסוף, הנח טיפת מים גדולה על שקופית המיקרוסקופ עבור מטרת המים פי 25. ודא שהמיקרוסקופ מותקן היטב ובלתי ניתן להזזה ולאחר מכן כוונן את z stage כדי לכוונן את המיקוד עד שניתן יהיה לראות את תמונת השדה הבהיר של הדגימה הביולוגית מתחת למטרת המים פי 25.
- התחל את תהליך ההדמיה ברצף הנכון: MPF, SHG ו-SRS כדי למנוע פוטוהלבנה, מה שישפיע על איכות התמונה והניתוח המדויק של MPF. כדי לעבור בין MPF ל-SHG במהירות, עבור מקרן המשאבה לקורת סטוקס הקבועה.
הערה: כוונון לייזר המשאבה מ-800 ננומטר (NADH ו-FAD autofluorescence) ל-791.3 ננומטר (CH3 Raman Shift) יכול להימשך 1-2 דקות. - בחר את רזולוציית התמונה (512 x 512 פיקסלים) ואת זמן ההשתהות המתאים לכל אופן. השתמש ב-8 מיקרון/פיקסל עבור MPF ו-SHG עם מסגרת ממוצעת מעל 3. השתמש ב-40 מיקרו-שניות/פיקסל עם מסגרת ממוצעת 2 לשיטת SRS.
הערה: המסגרת הממוצעת פירושה מספר התמונות שיש לחשב בממוצע לפני השמירה. - כדי לרכוש אוטופלואורסצנטיות עם MPF, כבה את קרן הלייזר של סטוקס וכוון את לייזר המשאבה ל-800 ננומטר לקבלת NADH ופלבין מרגשים. התקן את קוביית המסנן FVOPT בנתיב האור עם 460 ± 10 ננומטר ו-515 ± 10 ננומטר עבור ה-NADH והפלבין, בהתאמה. ההספק על המדגם הוא אפוא כ-15 מגוואט.
- רכשו את אות סיבי הקולגן באמצעות SHG. כבה את קרן הלייזר של המשאבה, השתמש רק בקרן לייזר של סטוקס, והגדר את ההספק ל-500 מגוואט. רכוש רק את הערוץ הקשור למסנן 515 ננומטר.
- השג את ההתפלגות המרחבית של חלבונים ושומנים באמצעות SRS. השאר את שתי קרני הלייזר דולקות והתאם את תדר קרן הלייזר כך שיתאים למצב הרטט הספציפי עבור כל מולקולה.
הערה: בדרך כלל, 791.3 ננומטר משמש ל-CH3, 797 ננומטר משמש ל-CH2, 787 ננומטר לשומנים בלתי רוויים, ו-794.6 ננומטר לשומנים רוויים. ההספק על הדגימה הוא אפוא כ-40 מגוואט. - כדי לרכוש את מערכי הנתונים של התמונה ההיפרספקטרלית של SRS, פתח את תוכנת הבקרה OPO כדי לבחור טאטא, הגדר את טווח אורכי הגל מ-780 ננומטר ל-806.5 ננומטר ובחר מספר מחסנית של לפחות 60. לאחר מכן, לכוד את ערימת התמונות ההיפר-ספקטרלית.
הערה: מערך הנתונים המתקבל מכיל 60 תמונות, שכל אחת מהן מייצגת את ההתפלגות המרחבית בשינוי ראמאן ספציפי (מ-2,700 ס"מ-1 ל-3,150 ס"מ-1). זמן הרכישה ההיפרספקטרלית תלוי בשדה הראייה (FOV) של התמונה ובזמן הסריקה, אך יהיה בערך בין 5 דקות ל-8 דקות עבור תמונה של 512 x 512. עבור תמונות גדולות יותר, יש להקפיד למזער את משך הזמן מתחת ללייזר כדי למנוע נזק לאור, שעלול להתרחש לאחר שעתיים (תלוי בעובי הדגימה ובגודל ה-FOV). - שמור את כל התמונות באותם אזורי עניין (ROI) באותה תיקייה. פורמט התמונה הוא קובץ Olympus .oir.
2. ניתוח תמונות
- השתמש בתוכנת עיבוד תמונה כדי לפתוח את כל התמונות הגולמיות השמורות כדי להקצות את הצבע ולהוסיף את סרגל קנה המידה לתצוגת התמונה. השתמש בו גם כדי ליצור את המסכה הבינארית של תמונות NADH וחומצות שומן רוויות (SFAs, 2,880 ס"מ-1) ליחס חמצון חיזור אופטי וניתוח אי רוויה של שומנים.
הערה: ודא שעוצמת המסכה כוללת רק 0 ו-1. - השתמש בסקריפט הפיתון הביתי כדי לבצע כל ניתוח במורד הזרם (הקוד זמין בכתובת https://github.com/lingyanshi2020/HSI_Analysis).
הערה: סקריפט זה נועד לעבד אזורי עניין מרובים (ROI) הן מדגימות בקרה והן מדגימות סרטן. הפונקציה העיקרית של הסקריפט דורשת שתי כניסות בלבד: נתיבי הקבצים עבור תיקיות הבקרה ותמונות הסרטן.- חזור על התיקיות, והתאם תמונות עם אותו שם בסיס (למשל, "roi_1_flavin.tif", "roi_1_nadh.tif", "roi1_mask.tif").
- עבור כל קבוצה של תמונות תואמות, תנו לסקריפט לבצע ניתוח רציומטרי וליצור תמונות רציומטריות חדשות על סמך החישובים האלה.
יחס החמצון האופטי מחושב כ- flavin / (NADH + flavin).
אי רוויה של שומנים מחושבת כ: USFAs / (SFAs + USFAs) כאשר USFAs מייצגים חומצות שומן בלתי רוויות. - כל ערכי היחס מהתמונות מאוחסנים לאחר מכן ב-pandas DataFrame למניפולציה קלה. בצע ANOVA חד כיווני והשתמש ב-matplotlib עם styple "ggplot" או seaborn כדי לבצע את ה-barplot או boxplot לכימות.
- השתמש בתמונות 2,930 ס"מ-1 (CH3) ו-2,850 ס"מ-1 (CH2) כדי ליצור תמונה מופחתת (CH3 - CH2). לאחר מכן, מזג את תמונת CH2 CH3 - CH2 במרחב צבעים RGB עם LUT מותאם אישית המחקה צביעה של H&E כדי ליצור את תמונת ההיסטולוגיה הדיגיטלית46.
- לאחר רכישת תמונות SRS היפר-ספקטרליות, השתמש בסקריפט הפיתון הביתי כדי לבצע את אשכולות k-means כדי לפלח את התמונות על סמך קווי דמיון ספקטרליים (הקוד זמין ב-https://github.com/lingyanshi2020/HSI_Analysis).
- טען את אוספי התמונות .tiff בחבילת tifffile. עצב מחדש את ערימת התמונות ההיפר-ספקטרלית של SRS (x, y, ספקטרה) למערך דו-ממדי (פיקסלים, ספקטרום).
- השתמש בחבילת scikit-learn כדי לפרוס אלגוריתם k-means למערך דו-ממדי זה, עם מספר האשכולות המוגדר
- עצב מחדש את תוויות האשכול המתקבלות בחזרה למידות התמונה המקוריות, וצור מפת פילוח.
- הקצה צבעים ייחודיים לכל אשכול, וצור תמונה בצבע כוזב המייצגת הרכבים ביוכימיים שונים בתוך הרקמה.
- השתמש ב-matplotlib כדי לשרטט את הספקטרום של כל אשכול עם ערך ממוצע (קו מלא) וסטיית תקן (אזור צל)
- עקוב אחר הפרוטוקול של פרוטוקול התאמת ההפניה העונשית SRS (PRM-SRS) באמצעות MATLAB כדי ליצור את זיהוי תת-סוג השומנים המרחבי ללא תווית עם מערכי נתונים של תמונה היפרספקטרלית SRS47.
- ארגן את התמונות ושמור אותן בפורמט .tif של 300 dpi.
תוצאות
התמונות באיור 2 מייצגות את התוצאות המתקבלות ממעקב אחר הפרוטוקול לרכישת אוטופלואורסצנציה של FAD ו-NADH כמו גם ארבעת ערוצי ה-SRS עבור חלבון, סך השומנים, השומנים הבלתי רוויים והשומנים הרוויים. כאן אנו מייצרים גם תמונה פסאודו-היסטולוגית כמתואר בפרוטוקול באמצעות מיזוג צבעים RGB. רכישת ערוצי MPF ו-SRS מספקת את קבצי התמונה שישמשו מאוחר יותר בניתוח רציומטרי. דוגמה לניתוח זה ניתן לראות באיור 3 על רקמת ריאה אנושית. לאחר רכישת תמונה בפרוטוקול, מתודולוגיית ניתוח התמונות שלנו המשתמשת ב-Python או ImageJ ממנפת את היחס בין ערוצים נפרדים כדי לספק מידע מטבולי כמותי. כפי שמוצג בתמונות אי רוויה של שומנים ויחס חמצון חיזור אופטי באיור 3, הניתוח היחסי מספק מפת צבע של התפלגות הפעילות המטבולית היחסית וההרכב המולקולרי. מינפנו את המדידות הללו כדי לבצע תצפיות לגבי השינויים במסלולים המטבוליים ותכולת השומנים של רקמה ספציפית, פתולוגיות או גורמים ביולוגיים מובחנים. כפי שניתן לראות באיור 4, זה יכול לספק השוואה כמותית של רקמה בריאה ורקמת גידול על ידי השוואת הערכים הממוצעים של מתח חמצוני ואי רוויה של שומנים בנוסף להפצתו בתמונת מיקרוסקופיה דו-ממדית.
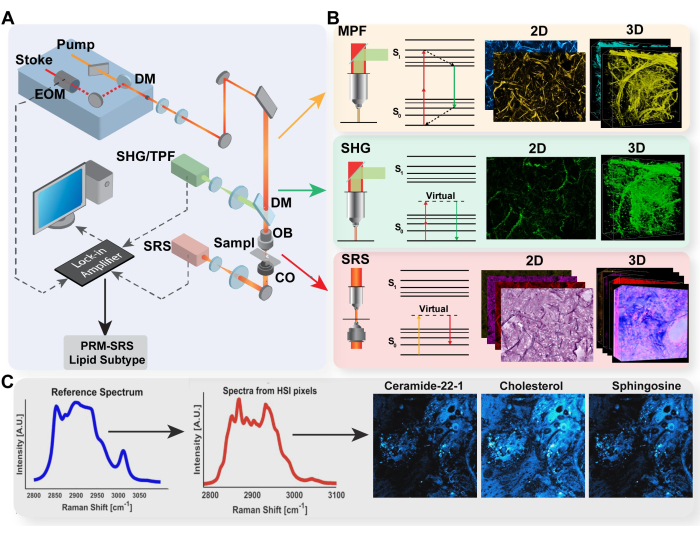
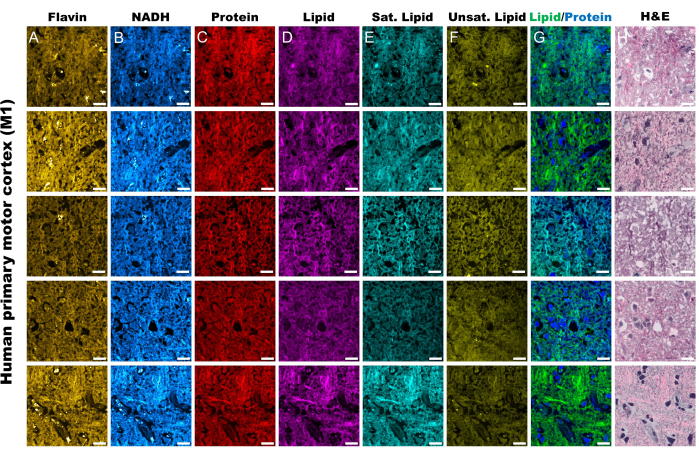
לניתוח רציומטרי של תמונות MPF ו-SRS, אנו מכוונים בדרך כלל ליחס החמצון האופטי ואי הרוויה, כפי שמוצג על ידי Eq (1) ו-(2).
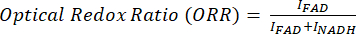 (1)
(1)
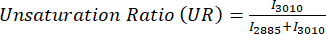 (2)
(2)
כאשר IC היא עוצמת הפיקסלים מערוץ C. לפיכך, אנו מודדים את היחס לפיקסל ורוכשים את ההתפלגות המרחבית של סמנים מטבוליים ומולקולריים אלה.
בנוסף לניתוח היחסי, איור 4 מדגים גם אפיק יישום פוטנציאלי נוסף עבור הפלטפורמה הרב-מודאלית שלנו: ניתוח תמונה היפרספקטרלית. כפי שמתואר בפרוטוקול זה, אנו יכולים לרכוש תמונה היפרספקטרלית SRS על ידי ביצוע סריקה על פני אורכי גל לייזר מרובים על ידי שימוש בקרן משאבה מתכווננת. זה מאפשר לנו לשחזר את אזור ה-CH של ספקטרום היסט ראמאן עבור כל פיקסל בתוך תמונת המיקרוסקופיה, ולהצטרף הן למידע הכימי המסופק על ידי ספקטרוסקופיית ראמאן והן למידע המרחבי המסופק על ידי מיקרוסקופיה אופטית. בזרימת העבודה לניתוח תמונה, אנו מדגישים שתי טכניקות המיושמות לניתוח תמונות היפרספקטרליות אלה: PRM-SRS לזיהוי ביומולקולות ואשכולות k-means. איור 4E מציג את היישום של PRM-SRS על תמונה של גידול בכבד של עכבר. אלגוריתם PRM-SRS מספק את המתאם בין הספקטרום עבור כל פיקסל בודד, המותאם על ידי עונש על תזוזות בספקטרום ראמאן; לאחר מכן האלגוריתם מייצר תמונות התפלגות הסתברות עבור כל אחד מהשומנים.
אשכול K-means של ספקטרום הפיקסלים הוא טכניקה נוספת שאנו מיישמים כדי לדמיין את הקיבוץ של פנוטיפים ספקטרליים ספציפיים, המאפשרים הפרדה לפי ריכוז הקשר וההרכב המולקולרי באמצעות עוצמה וצורה ספקטרלית בהתאמה. איור 5 מספק דוגמה לאופן שבו ניתן ליישם ניתוח תמונה באמצעות אשכולות k-means בפרוטוקול שלנו. אנו מצפים שצבירי k-mean יתיישרו מבחינה מבנית עם מאפיינים מהנתונים הפסאודו-היסטולוגיים בנוסף לספק אשכולות נוספים מתכונות שלא ניתן להבחין בהן בקלות מערוצי SRS או מהצביעה ההיסטולוגית הפסאודו-המטוקסילין ואוזין (H&E). ניתוח אשכולות PRM-SRS ו-k-means משלימים את פלטפורמת ההדמיה נטולת התווית הזו על ידי מתן מידע כימי וחצי ממוקד לגבי אנליטים ספציפיים וקשרים מולקולריים ללא צורך בבדיקה אקסוגנית.
איור 1: דיאגרמה של פלטפורמת הדמיה רב-מודאלית וזיהוי ביו-מולקולות PRM-SRS. (A) תרשים של הגדרת חומרה עבור מערכת הדמיה MPF/TPF, SHG ו-SRS. (B) נתיב אור ודיאגרמת יבלונסקי עבור TPF, SHG ו-SRS עם תמונות נרכשות מייצגות עבור כל שיטה. (C) דיאגרמת זרימת עבודה PRM-SRS להתאמת ייחוס ספקטרלי בין ספקטרוסקופיה ספונטנית של Raman להדמיה היפרספקטרלית SRS. קיצורים: MPF = פלואורסצנטיות רב-פוטונית; TPF = פלואורסצנטיות דו-פוטונית; SHG = דור הרמוני שני; SRS = פיזור רמאן מגורה; PRM = התאמת הפניות מוענשות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 2: תעלות MPF ו-SRS מרקמת קליפת המוח המוטורית הראשונית האנושית (M1). (א,ב) תעלות אוטופלואורסצנטיות MPF עבור Flavin/FAD ו-NADH. (ג-ו) ערוצי SRS שנלכדו בשיאים ספציפיים של משמרת ראמאן; שיא המתיחה הא-סימטרי CH3 (2,930 ס"מ-1) לחלבונים, שיא המתיחה הא-סימטרי CH2 (2,845 ס"מ-1) לשומנים, שיא 2,885 ס"מ-1 לחומצות שומן רוויות, ושיא 3,010 ס"מ-1 לחומצות שומן בלתי רוויות. (G) תעלות חלבון SRS (כחול) ושומנים (ירוק) ממוזגות כדי לתאר את ההתפלגות המרחבית שלהן. (H) תמונות פסאודו-היסטולוגיות (SRH) של SRS המשקפות צביעה של H&E. פסי קנה מידה = 20 מיקרומטר. קיצורים: MPF = פלואורסצנטיות רב-פוטונית; FAD = פלבין אדנין דינוקלאוטיד; NADH = ניקוטינמיד אדנין דינוקלאוטיד מופחת; SRS = פיזור רמאן מגורה; SRH = היסטולוגיה של SRS. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
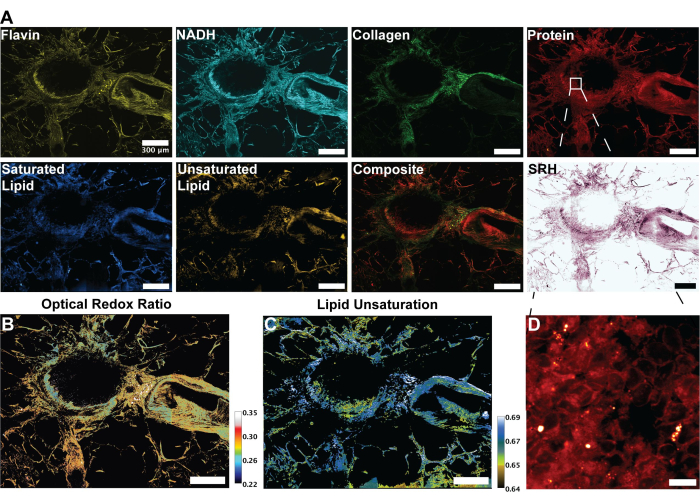
איור 3: תמונות MPF, SHG ו-SRS וניתוח של רקמת ריאה אנושית. (A) אוטופלואורסצנטיות MPF עבור Flavin/FAD ו-NADH, אות SHG עבור סיבי קולגן, אות SRS עבור חלבון (2,930 ס"מ-1), ליפידים (2,845 ס"מ-1), שומנים רוויים (2,885 ס"מ-1) ושומנים בלתי רוויים (3,010 ס"מ-1), ותמונה ממוזגת מורכבת של האופנים המרובים. (B) תמונה רציומטרית של יחס חמצון חיזור אופטי. (C) תמונה רציומטרית של אי-רוויה של שומנים. (D) תמונה מוגדלת של תאי אפיתל בשכבה הפנימית של הסמפונות. פסי קנה מידה = 200 מיקרומטר. קיצורים: MPF = פלואורסצנטיות רב-פוטונית; SHG = דור הרמוני שני; SRS = פיזור רמאן מגורה; FAD = פלבין אדנין דינוקלאוטיד; NADH = ניקוטינמיד אדנין דינוקלאוטיד מופחת. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
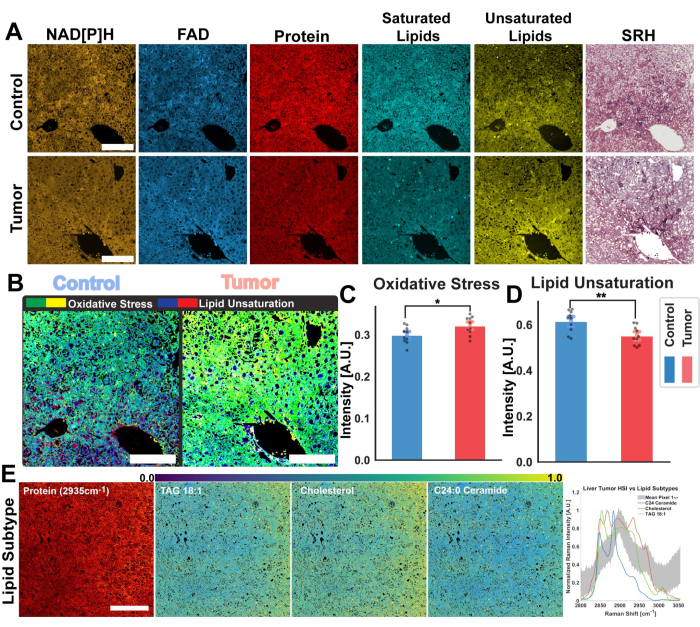
איור 4: ניתוח רציומטרי והיפרספקטרלי של גידולי כבד בעכברים. (A) תמונות אוטופלואורסצנטיות MPF עבור NAD[P]H ו-FAD, תעלות SRS עבור חלבון כולל, שומנים רוויים ובלתי רוויים, ותמונות פסאודו-היסטולוגיות עבור כבד עכבר ביקורת בריא (למעלה) ורקמת גידול (תחתונה). (B) עקה חמצונית (צהוב-ירוק), כפי שנמדד על ידי יחס חמצון חיזור אופטי, ואי-רוויה של שומנים (כחול-אדום) המחושבת מרקמות הביקורת (משמאל) והגידול (מימין). פסי קנה מידה = 100 מיקרומטר. (C,D) גרפים עמודות המדגימים הבדלים יחסיים בעקה חמצונית ואי רוויה של שומנים בין דגימות כבד בקרה (כחול) וגידול (אדום). סטטיסטיקת מובהקות: * עבור מובהקות של p ≤ 0.05, ** עבור מובהקות של p ≤ 0.01. (E) ניתוח תת-סוג שומנים PRM-SRS נובע מתמונות היפרספקטרליות. משמאל לימין: ערוץ חלבון SRS לייחוס מבני, סרגל קנה מידה = 100 מיקרומטר, תמונת התפלגות הסתברות של תת-סוגים של שומנים (TAG 18:1, כולסטרול ו-C24:0 סרמיד). גרף של ספקטרום ייחוס תת-סוג ליפידים וספקטרום פיקסלים ממוצע מ-SRS HSI על פני אזור CH. קיצורים: MPF = פלואורסצנטיות רב-פוטונית; SRS = פיזור רמאן מגורה; NAD[P]H = ניקוטינמיד אדנין דינוקלאוטיד פוספט מופחת; FAD = פלבין אדנין דינוקלאוטיד; HSI = תמונות היפרספקטרליות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
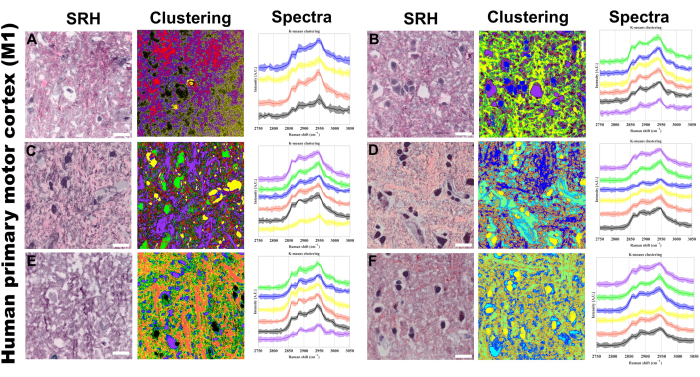
איור 5: התקבצות k-means היפרספקטרלית SRS בקליפת המוח המוטורית הראשונית האנושית (M1). (A-F) שישה אזורים מייצגים המציגים: משמאל: תמונות היסטולוגיה של רמאן מגורה (SRH) המספקות הדמיית רקמות דמויות H&E; באמצע: תוצאות אשכולות k-means תואמות; מימין: פרופילים ספקטרליים של ראמאן ספציפיים לאשכול עם עוצמות ממוצעות (קווים מוצקים) וסטיות תקן (אזורים מוצלים). מספר המרכזים שנע בין 4 ל -6 פירושו. נעשה שימוש באשכולות לא מפוקחים, כך שצבעים שונים בתמונות המקובצות מייצגים הרכבים כימיים מובהקים שזוהו על ידי אלגוריתם k-means. כל צביר (מיוצג על ידי צבע ייחודי) מתאים לאזורים עם פרופילים ספקטרליים דומים באזור המתיחה CH. סרגל קנה מידה = 20 מיקרומטר. קיצורים: SRH = היסטולוגיה של SRS. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
מערכת רב-מודאלית זו היא פלטפורמת הדמיה רבת עוצמה ללכידת הדמיה הוליסטית של הסביבה המולקולרית של דגימות על פני מגוון רחב של מקורות ביולוגיים ומצבים פתולוגיים. היתרון במינוף שיטות שונות ללא תוויות טמון ביכולת לרכוש מידע משלים ולמקד אנליטים ספציפיים שאחרת עשויים להיות קשים או בלתי אפשריים בטכניקת הדמיה אחת ללא תוויות. באופן ספציפי, שלוש טכניקות ההדמיה הלא ליניאריות (SRS, MPF, SHG) המוזכרות במאמר זה מאפשרות לכמת את הרכב המקרומולקולות, דינמיקת אנרגיה באמצעות יחס חמצון חיזור אופטי ומידע מבני, כולל הרכב מטריצה חוץ-תאית ומורפולוגיה 6,48,49. יתר על כן, בהשוואה לשימוש בכל שיטת הדמיה בודדת בנפרד, הדמיה עם מערכת מיקרוסקופ משולבת אחת מאפשרת רישום תמונה מיידי וזמני אחסון דגימה קצרים יותר. אפילו ביצענו הדמיית תאים חיים בגישה זו, אולי בשל החשיפה הנמוכה יותר לאור בהשוואה למיקרוסקופיה פלואורסצנטית קונפוקלית, תוך שימוש בנקודות זמן נבחרות כדי לרכוש כל שיטה ברצף כפי שנקבע בפרוטוקול לעיל. מלבד היתרונות האישיים שלהם, הפלטפורמה הרב-מודאלית נהנית גם מנקודות המבט המרובות על מצב ביולוגי באמצעות מדידה ללא תווית של סמנים ביולוגיים שונים.
הדמיה ללא תווית של חלבונים אוטו-פלואורסצנטיים באמצעות MPF הופנתה בעיקר לכימות יחס החמצון האופטי, מדד לתגובות חמצון חיזור המקלות על ידי חמצון FAD ל-FAD+ והפחתת NAD+ ל-NADH50. זהו סמן משמעותי לחילוף החומרים בתוך תאים ורקמות מכיוון שהוא מספק מדידה של הפעילות היחסית בין זרחון חמצוני לגליקוליזה, שני המסלולים העיקריים לדור ATP6. באופן ספציפי, ירידה בריכוז NADH ועלייה ב-FAD+ הם סמן לזרחון חמצוני מוגבר במיטוכונדריה; בינתיים, ההפך נכון לגבי גליקוליזה מוגברת בציטופלזמה. הנטייה להעדיף מסלול מטבולי אחד על פני השני בייצור אנרגיה נקשרה למספר שינויים פתולוגיים והפעלות מסלולים הקשורים לסרטן, מה שמדגיש את השימוש הפוטנציאלי ב-ORR כסמן לגילוי מוקדם 6,51.
באופן דומה, רכישת אות קולגן סיבי SHG ממנפת שיטת הדמיה לא ליניארית ללא תווית כדי לכמת ולדמיין סמן ביולוגי לבריאות. SHG יכול לעקוב ביעילות אחר התפלגות הקולגן מסוג I-III בשל המבנה הלא צנטרו-סימטרי שלהם. חלבוני קולגן סיביים שנמדדו על ידי SHG הוכרו כסמני אבחון חשובים למספר מחלות כולל סרטן ופיברוזיס 25,26,27,52,53. בנוסף לזיהויו כסמן למחלות, רכישת הקולגן שלנו באמצעות SHG יכולה לשמש אינדיקטור חזק למבנה בתאים וברקמות בשל תפקידו של קולגן סיבי בהרכב המטריצה החוץ-תאית וגבולות מבניים על פני רקמות54,55. באמצעות אות הקולגן SHG, אנו יכולים לבצע תצפיות מושכלות של תאים נפרדים או יחידות תפקודיות נפרדות של רקמות ללא צורך בסמן אקסוגני לממברנות התאים. בסך הכל, כימות SHG של סיבי קולגן מציג יתרון ברור הן ליכולת האבחון והן לקלות הניתוח בשילוב עם טכניקות הדמיה אחרות ללא תוויות.
באמצעות מיקרוסקופ SRS, אנו יכולים ללכוד מספר סמנים להרכב מקרומולקולות, במיוחד עבור שומנים וחומצות שומן. בפרוטוקול זה, אנו מתארים כיצד לרכוש את אות ה-SRS עבור חומצות שומן בלתי רוויות ורוויות לניתוח רציומטרי של אי רוויה בשומנים באותה דגימה. מיקרוסקופ סריקת לייזר זקוף עם מטרת מים פי 25 יושם לתפוקה קרובה ל-IR. קרני הלייזר עברו דרך הדגימה ונאספו על ידי מעבה שמן בעל צמצם מספרי גבוה (1.4 NA). מסנן מעבר קצר OD גבוה (950 ננומטר) שימש לחסימת אלומת סטוקס תוך שהוא מאפשר רק לאלומת המשאבה להגיע לגלאי פוטו-דיודה Si כדי לזהות את אות אובדן הרמאן המגורה. זרם היציאה מהפוטו-דיודה הופסק וסיונן. לאחר מכן, מגבר נעילה ב -20 מגה-הרץ ביטל את הזרם ב- X עם הסטת פאזה אפס, ומודול תוכנה השתמש באות המפוזר כדי ליצור את התמונה במהלך סריקת לייזר.
מחקרים הראו כי לשינויים באי רוויה של שומנים יש השפעה עמוקה על קרום התא והאברונים וחוסר ויסות בחילוף החומרים של השומנים יכול להוות סמן חזק למספר מחלות, כולל סרטן ומחלות ניווניות 56,57,58,59. לסקירה מקיפה יותר של חוסר ויסות שומנים, אנו מנתחים את הרכב תת-הסוגים באמצעות הדמיה היפרספקטרלית SRS. תמונות היפרספקטרליות SRS (HSIs) משלבות את המידע המרחבי ברזולוציה גבוהה שנרכש על ידי מיקרוסקופ SRS עם האות המשמעותי מבחינה כימית של ספקטרוסקופיית ראמאן באמצעות כוונון רציף כמתואר בפרוטוקול. ספקטרום הפיקסלים הללו מנותח לאחר מכן בשתי שיטות, אשכולות באמצעות k-means וזיהוי ביומולקולות עם PRM-SRS.
אשכול K-means של ספקטרום הפיקסלים מביא להפרדת אזורים בתוך תמונה דו-ממדית לפי ריכוז מולקולרי והרכב עקב הקשר הליניארי בין עוצמת אות SRS לריכוז הקשר המולקולרי60,61. באמצעות מתודולוגיה זו, אנו מיישמים את הפרוטוקול כדי לברר אזורים בעלי פנוטיפים מולקולריים ספציפיים כפי שנקבעו על ידי ספקטרום הפיקסלים והצנטרואיד הספקטרלי המשותף. לבחינה יסודית של הביטוי המולקולרי המובהק בפיקסלים ספציפיים, אנו מיישמים PRM-SRS לביצוע התאמה ספקטרלית בין ספקטרום ייחוס למולקולה ספציפית שנלכדה בספקטרוסקופיה ספונטנית של ראמאן לבין ספקטרום הפיקסלים מרכישת SRS HSI. בכך אנו יכולים לקבוע את ההסתברות לביטוי עבור מולקולות נפרדות מבלי להשתמש בבדיקות או תוויות אקסוגניות. ניתוח זה הוכיח את היכולת לעקוב אחר תת-סוגים מסוימים של שומנים על פני רקמות ומודלים ביולוגיים, ואת היכולת לזהות שינויים פתולוגיים בשינויים בהרכב השומנים ובכך דיסליפידמיה47. יתר על כן, ההתקדמות האחרונה בשיפור הרזולוציה הספקטרלית באמצעות פיצול ספקטרלי של התפשטות דופק פיקו-שנייה באמצעות סיבי סיליקה מתמרצת עוד יותר את היישום של SRS HSI כשיטה להדמיה ביוכימית ללא תווית62. באמצעות שיטות אלה המודגשות בפרוטוקול, אנו מקימים פלטפורמה לביצוע ניתוח רציומטרי וספקטרלי מקיף תוך שימוש בשיטת SRS ללא תוויות.
בנוסף למורכבות היחסית והחידוש של טכניקות אלה, ישנן כמה מגבלות חשובות בגישה שלנו שיש לקחת בחשבון. רכישת תמונות MPF עם לייזר פועם פיקו-שנייה, בניגוד ללייזרים הפמטו-שניות הנפוצים, דורשת כוח עירור פלואורופור גבוה יותר ומסתכנת בפוטו-הלבנה. עם זאת בחשבון, ביצענו אופטימיזציה של הפרוטוקול לעיל כדי להפחית את נזקי האור הפוטנציאליים מהפלטפורמה שלנו על ידי הפחתת אירוע כוח הלייזר על הדגימה. יתר על כן, בעוד שמחקרים קודמים הוכיחו את היכולת להעריך את יחס החמצון החיזור האופטי מהדמיית אוטופלואורסצנציה MPF של NADH ו-FAD, מיקרוסקופ הדמיה פלואורסצנטי לכל החיים (FLIM) הוכיח דיוק גבוה יותר בהערכת חילוף החומרים האנרגטי 63,64,65. זאת בשל היכולת להבדיל בין ריכוזים קשורים לחלבון ולא קשורים של NADH ו-FAD על סמך אורך החיים הקרינה המובהק שלהם, בהשוואה ליכולות של MPF, זה איפשר להשתמש ב-FLIM למחקרים מקיפים של פעילות מטבולית ממסלולי אנרגיה שונים, כולל זרחון חמצוני וגליקוליזה 16,63,64,65,66,67, 68. בעוד שפרוטוקול זה אינו כולל FLIM, אנו מצפים שהשיטה תשולב בפלטפורמת הדמיה זו בעתיד הקרוב, ותשפר את ניתוח חילוף החומרים האנרגטי שאנו מבצעים כיום. עם זאת, עם הפרוטוקול שנקבע כאן, אנו מציגים זרימת עבודה ומערך חומרה לגישת הדמיה רב-מודאלית שיכולה למדוד מטבוליזם של מבנה ביולוגי ממספר נקודות מבט.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
אנו מודים לד"ר גלוריה פריהובר ולחברי צוות HuBMAP שלה על אספקת פרוסות רקמת ריאה אנושית. אנו מודים לד"ר קון ז'אנג על אספקת רקמות מוח אנושיות. אנו גם מודים לד"ר Gen-Sheng Feng על שסיפק דגימות כבד של עכברים. אנו מודים לתמיכה מ-NIHU54DK134301, NIH R01GM149976, NIH U01AI167892, NIH R01HL170107, NIH 5R01NS111039, NIH R21NS125395, NIH U54CA132378, קרנות סטארט-אפ של UCSD, פרס עמית מחקר סלואן ופרס CZI DAF2023-328667.
Materials
| Name | Company | Catalog Number | Comments |
| 460 nm Filter Cube | Olympus | OCT-ET 460/50M32 | |
| Bandpass Filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| DC power supply | TopWard | 6302D | |
| Dichroic Mount | Thorlabs | KM100CL | |
| FIJI ImageJ | ImageJ | ||
| High NA oil condenser | Olympus | 6-U130 | |
| High O.D. shortpass filter | Thorlabs | 950 nm | |
| Inverted Laser Scanning Microscope | Olympus | FV1200MPE | |
| Lock-in Amplifier | Zurich Instruments | ||
| picoEmerald Laser System | Applied Physics & Electronics, Inc. | Synchronized pulsed pump beam (tunable 720–990 nm wavelength, 5–6 ps pulse width, and 80 MHz repetition rate) and Stokes (wavelength at 1032 nm, 6 ps pulse width, and 80 MHz repetition rate) | |
| SI Photodiode Detector | Home Built | ||
| Touch Panel Controller | Olympus | ||
| VF-300 Compresstome | Precisionary |
References
- Wollman, A. J. M., Nudd, R., Hedlund, E. G., Leake, M. C. From Animaculum to single molecules: 300 years of the light microscope. Open Biol. 5 (4), 150019(2015).
- Vicidomini, G., Bianchini, P., Diaspro, A. STED super-resolved microscopy. Nat Methods. 15 (3), 173-182 (2018).
- Weber, M., et al. MINSTED fluorescence localization and nanoscopy. Nat Photonics. 15 (5), 361-366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. , (1990).
- Hell, S. W., et al. Three-photon excitation in fluorescence microscopy. J Biomed Optics. 1 (1), 71-74 (1996).
- Alhallak, K., Rebello, L. G., Muldoon, T. J., Quinn, K. P., Rajaram, N. Optical redox ratio identifies metastatic potential-dependent changes in breast cancer cell metabolism. Biomed Opt Express. 7 (11), 4364-4374 (2016).
- Pena, A. -M., et al. Multiphoton FLIM imaging of NADH and FAD to analyze cellular metabolic activity of reconstructed human skin in response to UVA light. Multiphoton Microscopy in the Biomedical Sciences XIX. 10882, 23-33 (2019).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomed Opt Express. 11 (10), 5674-5688 (2020).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. J Biol Chem. 254 (11), 4764-4771 (1979).
- Ostrander, J. H., et al. Optical redox ratio differentiates breast cancer cell lines based on estrogen receptor status. Cancer Res. 70 (11), (2010).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proc Natl Acad Sci USA. 104 (49), 19494-19499 (2007).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Cancer Res. 74 (11), 3067-3075 (2014).
- Malak, M., James, J., Grantham, J., Ericson, M. B. Contribution of autofluorescence from intracellular proteins in multiphoton fluorescence lifetime imaging. Sci Rep. 12, 16584(2022).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using NADH and NADPH autofluorescence. Free Radic Biol Med. 100, 53-65 (2016).
- Roth, S., Freund, I. Second harmonic generation in collagen. J Chem Phys. 70 (4), 1637-1643 (1979).
- Freund, I., Deutsch, M. Second-harmonic microscopy of biological tissue. Opt Lett. 11 (2), 94(1986).
- Boyd, R. W., Gaeta, A. L., Giese, E. Nonlinear optics. Springer Handbook of Atomic, Molecular, and Optical Physics. Drake, G. W. F. , Springer. 1097-1110 (2023).
- Aghigh, A., et al. Second harmonic generation microscopy: a powerful tool for bio-imaging. Biophys Rev. 15 (1), 43-70 (2023).
- Mohler, W., Millard, A. C., Campagnola, P. J. Second harmonic generation imaging of endogenous structural proteins. Methods. 29 (1), 97-109 (2003).
- Cox, G. Biological applications of second harmonic imaging. Biophys Rev. 3 (3), 131(2011).
- Brown, E., et al. Dynamic imaging of collagen and its modulation in tumors in vivo using second-harmonic generation. Nat Med. 9 (6), 796-800 (2003).
- Keikhosravi, A., Bredfeldt, J. S., Sagar, A. K., Eliceiri, K. W. Chapter 28 - Second-harmonic generation imaging of cancer. Methods Cell Bio. 123, 531-546 (2014).
- Hui Mingalone, C. K., et al. Bioluminescence and second harmonic generation imaging reveal dynamic changes in the inflammatory and collagen landscape in early osteoarthritis. Lab Invest. 98 (5), 656-669 (2018).
- Tsafas, V., et al. Polarization-dependent second-harmonic generation for collagen-based differentiation of breast cancer samples. J Biophotonics. 13 (10), e202000180(2020).
- Nadiarnykh, O., LaComb, R. B., Brewer, M. A., Campagnola, P. J. Alterations of the extracellular matrix in ovarian cancer studied by Second Harmonic Generation imaging microscopy. BMC Cancer. 10, 94(2010).
- Xiong, S. Y., Yang, J. G., Zhuang, J. Nonlinear spectral imaging of human normal skin, basal cell carcinoma and squamous cell carcinoma based on two-photon excited fluorescence and second-harmonic generation. Laser Phys. 21 (10), 1844-1849 (2011).
- Tilbury, K., Campagnola, P. J. Applications of second-harmonic generation imaging microscopy in ovarian and breast cancer. Perspect Medicin Chem. 7, 21-32 (2015).
- Raman, C. V., Krishnan, K. S. A New type of secondary radiation. Nature. 121 (3048), 501-502 (1928).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Phys Rev Lett. 9 (11), 455-457 (1962).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Li, Y., et al. Microglial lipid droplet accumulation in tauopathy brain is regulated by neuronal AMPK. Cell Metab. 36 (6), 1351-1370.e8 (2024).
- Lu, F. -K., et al. Label-free neurosurgical pathology with stimulated Raman imaging. Cancer Res. 76 (12), 3451-3462 (2016).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nat Commun. 9 (1), 2995(2018).
- Zhang, L., et al. Spectral tracing of deuterium for imaging glucose metabolism. Nat Biomed Eng. 3 (5), 402-413 (2019).
- Li, Y., et al. Bioorthogonal stimulated Raman scattering imaging uncovers lipid metabolic dynamics in Drosophila brain during aging. GEN Biotechnol. 2 (3), 247-261 (2023).
- Li, X., et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by stimulated Raman scattering microscopy. Anal Chem. 91 (3), 2279-2287 (2019).
- Ji, M., et al. Detection of human brain tumor infiltration with quantitative stimulated Raman scattering microscopy. Sci Transl Med. 7 (309), 309ra163(2015).
- Ji, M., et al. Rapid, label-free detection of brain tumors with stimulated Raman scattering microscopy. Sci Transl Med. 5 (201ra119), 201ra119(2013).
- You, S., et al. Intravital imaging by simultaneous label-free autofluorescence-multiharmonic microscopy. Nat Commun. 9, 2125(2018).
- You, S., et al. Label-free deep profiling of the tumor microenvironment. Cancer Res. 81 (9), 2534-2544 (2021).
- Jermyn, M., et al. Highly accurate detection of cancer in situ with intraoperative, label-free, multimodal optical spectroscopy. Cancer Res. 77 (14), 3942-3950 (2017).
- Pshenay-Severin, E., et al. Multimodal nonlinear endomicroscopic imaging probe using a double-core double-clad fiber and focus-combining micro-optical concept. Light Sci Appl. 10 (1), 207(2021).
- Wu, W., Li, X., Qu, J. Y., He, S. In vivo imaging of biological tissues with combined two-photon fluorescence and stimulated Raman scattering microscopy. J Vis Exp. (178), e63411(2021).
- Li, X., Jiang, M., Lam, J. W. Y., Tang, B. Z., Qu, J. Y. Mitochondrial imaging with combined fluorescence and stimulated Raman scattering microscopy using a probe of the aggregation-induced emission characteristic. J Am Chem Soc. 139 (47), 17022-17030 (2017).
- Li, Z., et al. Multimodal imaging of metabolic activities for distinguishing subtypes of breast cancer. Biomed Opt Express. 14 (11), 5764-5780 (2023).
- Fung, A. A., et al. Label-free optical biopsy reveals biomolecular and morphological features of diabetic kidney tissue in 2D and 3D. , (2024).
- Zhang, W., et al. Multi-molecular hyperspectral PRM-SRS microscopy. Nat Commun. 15 (1), 1599(2024).
- Xu, F. X., et al. Discrimination of lipid composition and cellular localization in human liver tissues by stimulated Raman scattering microscopy. J Biomed Opt. 29 (1), 016008(2024).
- Zoumi, A., Yeh, A., Tromberg, B. J. Imaging cells and extracellular matrix in vivo by using second-harmonic generation and two-photon excited fluorescence. Proc Natl Acad Sci USA. 99 (17), 11014-11019 (2002).
- Liaudanskaya, V., et al. Mitochondria dysregulation contributes to secondary neurodegeneration progression post-contusion injury in human 3D in vitro triculture brain tissue model. Cell Death Dis. 14 (8), 1-15 (2023).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, sub-types and early treatment response in breast cancer. Cancer Res. 73 (20), 6164-6174 (2013).
- Conklin, M. W., et al. Aligned collagen is a prognostic signature for survival in human breast carcinoma. Am J Pathol. 178 (3), 1221-1232 (2011).
- Sun, W., et al. Nonlinear optical microscopy: use of second harmonic generation and two-photon microscopy for automated quantitative liver fibrosis studies. J Biomed Optics. 13 (6), 064010(2008).
- Nejim, Z., Navarro, L., Morin, C., Badel, P. Quantitative analysis of second harmonic generated images of collagen fibers: a review. Res Biomed Eng. 39 (1), 273-295 (2023).
- Burke, K., Brown, E. The use of second harmonic generation to image the extracellular matrix during tumor progression. Intravital. 3 (3), e984509(2015).
- Balasubramanian, P., Prabhakaran, M. P., Sireesha, M., Ramakrishna, S. Collagen in human tissues: Structure, function, and biomedical implications from a tissue engineering perspective. Polymer Composites - Polyolefin Fractionation - Polymeric Peptidomimetics - Collagens. Abe, A., Kausch, H. H., Möller, M., Pasch, H. 251, 173-206 (2012).
- Dadsena, S., et al. Lipid unsaturation promotes BAX and BAK pore activity during apoptosis. Nat Commun. 15, 4700(2024).
- Barelli, H., Antonny, B. Lipid unsaturation and organelle dynamics. Curr Opin Cell Biol. 41, 25-32 (2016).
- Harayama, T., Antonny, B. Beyond fluidity: The role of lipid unsaturation in membrane function. Cold Spring Harb Perspect Biol. 15 (7), a041409(2023).
- Yoon, H., Shaw, J. L., Haigis, M. C., Greka, A. Lipid metabolism in sickness and in health: Emerging regulators of lipotoxicity. Mol Cell. 81 (18), 3708-3730 (2021).
- Villazon, J., Shi, L. Utilizing K-means clustering on hyperspectral DO-SRS images of the mouse hippocampus. CLEO 2024, Technical Digest Series. , Optica Publishing Group. (2024).
- Fu, D., et al. Quantitative chemical imaging with multiplex stimulated Raman scattering microscopy. J Am Chem Soc. 134 (8), 3623-3626 (2012).
- Periasamy, A., Diaspro, A. Special section guest editorial: Multiphoton microscopy. J Biomed Optics. 8 (3), 327(2003).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proc Natl Acad Sci USA. 89 (4), 1271-1275 (1992).
- Blacker, T. S., et al. Separating NADH and NADPH fluorescence in live cells and tissues using FLIM. Nat Commun. 5, 3936(2014).
- Xiong, H., et al. Background-free imaging of chemical bonds by a simple and robust frequency-modulated stimulated Raman scattering microscopy. Opt Express. 28 (10), 15663-15677 (2020).
- Georgakoudi, I., Quinn, K. P. Label-free optical metabolic imaging in cells and tissues. Annu Rev Biomed Eng. 25, 413-443 (2023).
- Alam, S. R., Wallrabe, H., Christopher, K. G., Siller, K. H., Periasamy, A. Characterization of mitochondrial dysfunction due to laser damage by 2-photon FLIM microscopy. Sci Rep. 12 (1), 11938(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved