Method Article
Farelerde ve Sıçanlarda Merkezi Sinir Sistemi Hedeflemesi için Gen Tedavisi Vektörlerinin Lomber İntratekal Enjeksiyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Lomber intratekal enjeksiyon, gen terapisini merkezi sinir sistemine iletmek için translasyonel olarak ilgili bir uygulama yolunu temsil eder. Yenidoğan, juvenil ve yetişkin farelerde ve sıçanlarda lomber intratekal enjeksiyonlar için bu kapsamlı standartlaştırılmış protokol, araştırmacılara klinik öncesi gen tedavisi çalışmaları için bu tekniği benimsemede rehberlik etmeyi amaçlamaktadır.
Özet
Nörolojik hastalıkları tedavi etmek için merkezi sinir sistemini hedeflemenin bir yöntemi, lomber intratekal uygulama yolunun kullanılmasını içerir. Bu yaklaşım, beyin omurilik sıvısına doğrudan erişmek ve tercihen merkezi sinir sistemi içindeki hücreleri hedeflemek için kan-beyin bariyerini atlar. Lomber intratekal enjeksiyon yolunu kullanan çok sayıda yayınlanmış klinik öncesi çalışma, gen tedavisi klinik çalışmalarının geliştirilmesine katkıda bulunmuştur; Bununla birlikte, açıklanan protokoller değişkendir ve birden çok kaynağa dağılmıştır. Burada, preklinik gen tedavisi çalışmaları için yenidoğan, juvenil ve yetişkin farelerde ve sıçanlarda lomber intratekal enjeksiyonlar için kapsamlı bir protokol seti sunulmaktadır. Uygun eğitim ile bu enjeksiyon tekniği hızlı ve güvenilir bir şekilde gerçekleştirilebilir. Her gelişim aşamasında enjeksiyon protokolünün detaylandırılmasına ek olarak, çalışma sonuçlarını etkileyebilecek enjeksiyon hacmi gibi ilişkili parametreler tartışılmaktadır. Merkezi sinir sistemini hedeflemek için lomber intratekal enjeksiyonların uygulanmasını göstermek için, başarılı veya başarısız bir enjeksiyonun ardından beyin, omurilik ve periferik dokularda adeno ilişkili virüs serotip 9'un ekspresyonu sunulur.
Giriş
Küresel merkezi sinir sistemi (CNS) iletimi gerektiren, ancak aksi takdirde gen terapisi için iyi adaylar olan nörolojik hastalıkların tedavisinde bir zorluk, büyük ölçüde CNS'nin ve ilgili hücre tiplerinin verimsiz hedeflenmesine bağlanmıştır1. Mühendislik dağıtım araçları ile küresel CNS hücre ve doku hedeflemesini optimize etmek için önemli miktarda araştırma devam etmektedir 1,2. Bununla birlikte, viral vektörlerin belirli kombinasyonları ve uygulama yolları kullanılarak mevcut gen terapisi vektör teknolojisi ile makul ölçüde yaygın vektör iletimi hala elde edilebilir 3,4. Tek seferlik bir tedaviden yaygın CNS iletimi elde etmek için mevcut altın standart, beyin omurilik sıvısına (BOS) doğrudan enjeksiyon ile birlikte adeno ilişkili virüs serotip 9'u (AAV9) kullanmaktır.
Doğrudan BOS enjeksiyonları için üç tipik uygulama yolu vardır: lomber intratekal (IT), intraserebroventriküler (ICV) ve intrasisternal (ICM)5. Bu uygulama yollarının her biri, CNS ve periferik dokularda farklı biyodağılım modellerine neden olur, ancak hepsi, nörolojik hastalık patolojisine ve fenotiplerine katkıda bulunan CNS'deki hücrelere ulaşmak için kan-beyin bariyerini (BBB) atlama avantajına sahiptir6. Lomber IT enjeksiyonu, klinik prosedür rutin ve basit olduğundan, ICV ve ICM enjeksiyonlarına kıyasla daha az invazivlik ile insanlarda klinik ilaç iletimi kullanımı için standarttır.
Lomber IT enjeksiyonu, anestezik ve analjezik alanlarda kolayca kullanılan ve ilk makalesi 1885'te yayınlanan yerleşik bir tekniktir7. Yetişkin farelerde lomber IT enjeksiyonları için ilk protokol 1980'de yayınlandı8 ve o zamandan beri yaygın olarak benimsenmiş ve gözden geçirilmiştir9. Bu protokollerde küçük ayarlamalar veya iyileştirmeler yapılmıştır 10,11,12, ürün koruma tekniği de dahil olmak üzere 13. Yetişkin sıçanlarda lomber IT enjeksiyonları için protokoller de ilk olarak 1976'da, kronik uygulama için kateterizasyon14 ve tek seferlik tedaviler için doğrudan enjeksiyon15 ile yayınlandı. Daha yakın zamanlarda, gruplar yenidoğan veya juvenil farelerde ve sıçanlarda lomber IT enjeksiyonları için protokoller yayınlamıştır16,17.
CNS'deki BBB ve hedef hücreleri atlamak için bu tekniğin geniş çapta benimsenmesi ve doğrulanması, nörolojik hastalıkların tedavisi için çok sayıda başarılı gen terapisi, klinik öncesi ve klinik çalışmalara yol açmıştır. Nörolojik hastalıkları modelleyen farelerde, sıçanlarda ve insan olmayan primatlarda pozitif etkinlik ve güvenlik verileri, bu hastalıklar için klinik fayda potansiyeli konusunda heyecan ve ilgi uyandırmıştır 18,19,20,21,22,23. Bu çalışmaların bir kısmı şu anda klinik çalışmalardadır (örneğin, clinicaltrials.gov tanımlayıcılar NCT02362438, NCT04737460, NCT03381729 ve NCT05518188)3,6. Bu makalede, farklı yaşlardaki farelerde ve sıçanlarda lomber IT enjeksiyonları için, BOS'u çıkarmadan, translasyonel gen terapisi projeleri için benimsenebilecek basit bir protokol açıklanmaktadır. Bu protokol, yaygın olarak benimsenen halihazırda mevcut protokollere benzer; Bununla birlikte, beraberindeki video görselleriyle birlikte kolay erişim ve referans için bu ilgili protokollere tek bir yerde atıfta bulunmanın değeri vardır. Bu protokol, doğum sonrası gün (P) 0-1'de yenidoğan fareleri ve sıçanları ve genç fareler ve sıçanlar P21) için enjeksiyonu açıklar ve farelerde P1'de başarılı ve başarısız bir lomber IT enjeksiyonundan temsili sonuçlar elde edilir. Tartışmada, bu prosedürü gerçekleştirirken dikkatli olunması gereken yaygın yanlış adımlar ve belirli ayrıntıların yanı sıra klinik öncesi bir çalışmaya başlamadan önce bu enjeksiyonların nasıl uygulanacağına dair öneriler ele alınmaktadır.
Protokol
Burada açıklanan prosedürler, Texas Üniversitesi Güneybatı Tıp Merkezi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmıştır. Fareleri içeren protokoller için P1-P28 yaşlarındaki vahşi tip C57BL6 / J erkek ve dişi fareler kullanıldı. Sıçanları içeren protokoller için P1-P56 yaşlarındaki vahşi tip Sprague-Dawley erkek ve dişi sıçanlar kullanıldı. Bölüm 3'te açıklanan sağkalım cerrahisinin yanı sıra, diğer tüm prosedürlerin sadece anlık rahatsızlığa neden olduğu kabul edilir ve anestezik veya analjezik kullanımını gerektirmez. Bireyler, laboratuvar hayvanlarını anlık rahatsızlıktan daha fazlası için izlemeli ve anestezik ve analjeziklerin gerekliliği konusunda IACUC ve veterinerlik personelinden rehberlik almalıdır. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda verilmiştir.
1. Farelerin lomber IT enjeksiyonu >P21
- Hazırlık
- İstenen konsantrasyon(lar)da gen terapisi vektörü ve bir kontrol çözeltisi (genellikle vektör üretiminde kullanılan formülasyon tamponu) dahil olmak üzere enjeksiyon çözeltilerini hazırlayın. Enjeksiyon solüsyonları steril olmalı ve işlem boyunca steril kalmalıdır.
NOT: Tüm solüsyonlar prosedür süresince buz üzerinde tutulmalıdır. - Şırınga ve iğne, pipet ve enjeksiyon solüsyonu dahil tüm malzemeleri toplayın ve sterilize edin. Biyogüvenlik kabinlerinin kullanımı ve enjekte edici madde maruziyeti ile ilgili kurumsal yönergeleri izleyin. Burada açıklanan prosedürler 2. sınıf bir biyogüvenlik kabininde gerçekleştirilmiştir.
- Mikrolitrelik bir pipet kullanarak, istenen enjeksiyon çözeltisi hacmini ölçün ve steril parafin filme aktarın. 5 μL'lik bir enjeksiyon hacmi yaygın olarak kullanılır ve yetişkin fareler için hedef hacim olarak kabul edilir >P21 (Tablo 1).
NOT: Gerekirse ses seviyesi artırılabilir; Bununla birlikte, hayvanlar daha büyük enjeksiyon hacimlerine karşı advers reaksiyonlar açısından yakından izlenmelidir. Enjeksiyon hacmi ve advers reaksiyonlar hakkında ayrıntılar için Tartışma bölümüne bakın. Çözelti ayrıca doğrudan pipet ucundan bir şırıngaya aktarılabilir veya enjeksiyon çözeltisi hacmini doğrudan ölçmek için kalibre edilmiş gaz geçirmez mikrolitre şırıngalar kullanılabilir. - Solüsyonu 30 G 0,5 inçlik bir iğne ile mikrolitrelik bir şırıngaya çekin, herhangi bir hava kabarcığı çizmemeye dikkat edin.
NOT: İğne ölçüsü ve uzunluğu cilt penetrasyonunu etkileyebilir. Kullanılacak şırınganın boyutu göz önüne alındığında, enjeksiyon hacmi şırınga kapasitesinin %10'undan az olmamalıdır. Şırınga kapasitesinin %50'sinden daha büyük hacimler için, pistona işaret parmağınızla kolayca bastırılabildiğinden emin olun. Pistona kolayca bastırılamıyorsa, daha büyük kapasiteli bir şırınga kullanın.
- İstenen konsantrasyon(lar)da gen terapisi vektörü ve bir kontrol çözeltisi (genellikle vektör üretiminde kullanılan formülasyon tamponu) dahil olmak üzere enjeksiyon çözeltilerini hazırlayın. Enjeksiyon solüsyonları steril olmalı ve işlem boyunca steril kalmalıdır.
- Frenleyici
- Baskın eli kullanarak, bilinçli (uyuşturulmamış) fareyi kuyruğundan bir kağıt havlu üzerinde tutun. Kağıt havlu, fareyi dizginlemeye, sakinleştirmeye ve ısırmasını önlemeye yardımcı olacaktır. Fare, vücudun yan yüzü size bakacak şekilde nötr yüzüstü pozisyonda olmalıdır.
NOT: İşlemden önce fareleri bu kısıtlamaya alıştırmak veya alıştırmak gerekli değildir. Fareler kısıtlama nedeniyle mücadele edebilir, ancak belirli bir ağrı tepkisi ortaya çıkarmamalıdır. Anlık ağrı yanıtlarından daha fazlası gözlenirse, analjezik uygulaması gerekli olabilir; Veteriner rehberliği isteyin. - Baskın olmayan eliyle, kağıt havlunun bir kısmını farenin başının ve üst gövdesinin üzerine katlayın ve baskın olmayan başparmak ile işaret parmağı arasındaki pelvik kuşağı sıkıca kavrayın. Avucun, farenin başının etrafında durarak tutulduğundan emin olun. Farenin iliak tepesi aşikar olmalı ve her parmağın distal falanksının merkezine yerleştirilmelidir (Şekil 1A,B).
NOT: El veya kağıt havludan alınan kısıtlama solunumu bozmamalıdır. - Omurganın düzgün hizalanmasını sağlamak için kuyruğun tabanını yavaşça döndürün. Farenin pelvisi, lomber omurganın vertebral süreçleri çalışma yüzeyine dik olacak şekilde kare olmalıdır.
- Farenin sırt bel bölgesini %70 alkol hazırlama pedi ile temizleyin.
- Enjeksiyon yerini görselleştirmeye yardımcı olmak için saçı ~ 2-6 mm kraniyal iliak kreste ayırın.
- L4-L5 veya L5-L6 intervertebral boşluğu, iliak krestin ~ 2-6 mm kraniyalini hissedin.
NOT: Tam mesafe, farenin boyutuna ve yaşına bağlı olarak değişir.
- Baskın eli kullanarak, bilinçli (uyuşturulmamış) fareyi kuyruğundan bir kağıt havlu üzerinde tutun. Kağıt havlu, fareyi dizginlemeye, sakinleştirmeye ve ısırmasını önlemeye yardımcı olacaktır. Fare, vücudun yan yüzü size bakacak şekilde nötr yüzüstü pozisyonda olmalıdır.
- Enjeksiyon
- Baskın elinizi kullanarak, mikrolitre şırınganın merkezini tutun ve L4-L5 veya L5-L6 intervertebral boşlukta fare omurgasına dik olarak konumlandırın. Şırınganın pistonuna, elinizi aşırı hareket ettirmeden işaret parmağınızla bastırılabildiğinden emin olun. İğnenin eğimi farenin kafasına bakacak şekilde, cildi intervertebral boşluk üzerinde delin.
- İğnenin ucunda intervertebral boşluğun etrafındaki kemiğin kenarları hissedildiğinde, şırınganın açısını 30-45 dereceye düşürün (Şekil 1A).
- İğne, ani bir kuyruk hareketine neden olacak şekilde omurlar arası boşluğa kaymalı ve omurlar arasına sıkıca kenetlenmelidir.
- Şırınganın yerinden çıkmamasına dikkat ederek, çözeltiyi 10 saniye içinde vermek için pistona sabit bir şekilde bastırın.
- Çözeltinin dağılmasını sağlamak ve geri akışı önlemek için pistona tamamen bastırdıktan sonra şırıngayı 15-30 saniye yerinde tutun.
- Şırıngayı fareden aynı 30-45 derecelik giriş açısında yumuşak ve yavaş bir şekilde çekin. İğne geri çekilirken, geri akışı önlemek için şırıngayı döndürün.
NOT: Şırıngayı döndürürken iğneyi ilerletmemeye dikkat edin, çünkü bu omurilikte fiziksel hasara neden olabilir. - Fareyi kısıtlamadan serbest bırakın ve ev kafesine geri koyun.
- Enjeksiyondan sonra fareyi anormal ambulasyon, motor bozukluğu, solunum anormallikleri ve koordinasyon açısından izleyin. Advers reaksiyonlarla ilgili ek ayrıntılar için Tartışmaya bakın.
- Üreticinin tavsiyelerine uyarak ekipmanı temizleyin. Çoklu enjeksiyonlar için, her gen terapisi vektörü ve kontrol çözeltisi için farklı şırıngalar önerilir.
NOT: Çıkarılabilir iğneler birden çok kez temizlenebilir, sterilize edilebilir ve yeniden kullanılabilir; Bununla birlikte, hayvana zarar verebilecekleri ve kaçırılan enjeksiyon olasılığını artırabilecekleri için kör iğneler kullanılmamalıdır. Kör bir iğne cildi kolayca delmez ve uygun şekilde atılmalıdır. Şırıngalar sınırlıysa, gen terapisi vektörüne geçmeden önce tüm araç enjeksiyonlarının tamamlanması ve daha yüksek dozlar uygulanmadan önce en düşük gen terapisi dozunun enjekte edilmesi tavsiye edilir. - Hayvanlar arasında ekipmanın sterilizasyonu için kurumsal yönergeleri izleyin.
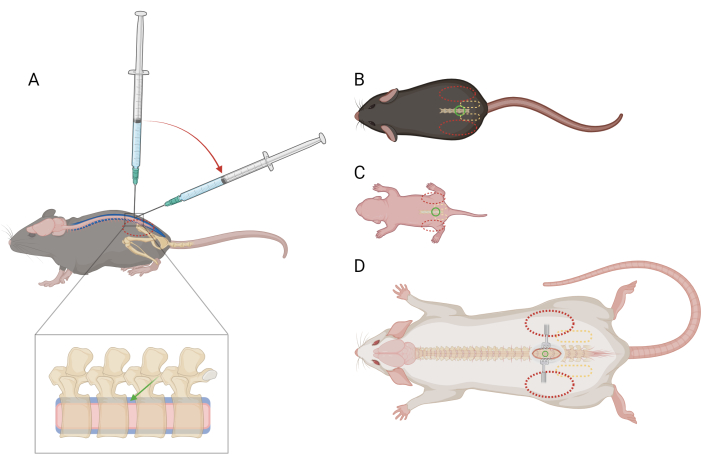
Şekil 1: Farelerde ve sıçanlarda lomber intratekal enjeksiyon için parmak ve şırınga yerleştirme şeması. (A) Lomber IT enjeksiyonu sırasında iğne yerleşimini ve şırınga açısı geçişini gösteren bir farenin >P21 yanal görünümü. Kesikli kırmızı oval, farenin iliak tepesi üzerinde parmağın konumunu gösterir. Omurganın büyütülmüş bir görünümü, yaklaşık iğne yerleşimi (yeşil ok) ve omurilik (pembe) ile intratekal boşluğu (mavi) gösterir. (B) bir farenin >P21, (C) bir farenin D) bir sıçanın >P21), iğne yerleştirme (yeşil daire), pelvik kuşak (kesikli sarı oval) ve parmak yerleştirme (kesikli kırmızı oval) için referans noktaları olan sırt görünümü. Kesi yeri ve ekartörler de (D)'de gösterilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Farelerin ve sıçanların lomber IT enjeksiyonu
- Hazırlık
- Adım 1.1'i izleyin. Bunun tek istisnası, adım 1.1.3'teki enjeksiyon hacmidir.
NOT: Yenidoğan fareler (P0-P1) için önerilen enjeksiyon hacimleri 3 μL'yi, genç fareler (P5-P7) için 5 μL'yi ve genç fareler (P10) için önerilen enjeksiyon hacimleri 10 μL'yi geçmemelidir. Yenidoğan sıçanlar (P0-P1) için önerilen enjeksiyon hacimleri 5 μL'yi, genç sıçanlar (P5-P7) için 10 μL'yi ve genç sıçanlar (P10) için 30 μL'yi geçmemelidir (Tablo 1).
- Adım 1.1'i izleyin. Bunun tek istisnası, adım 1.1.3'teki enjeksiyon hacmidir.
- Frenleyici
- Baskın elinizi kullanarak fareyi/fareyi kuyruğundan bir kağıt havlu üzerinde tutun. Fare/sıçan, vücudun yan yüzü size bakacak şekilde nötr yüzüstü pozisyonda olmalıdır.
NOT: Fareler / sıçanlar kısıtlama nedeniyle mücadele edebilir, ancak belirli bir ağrı tepkisi ortaya çıkarmamalıdır. Anlık ağrı yanıtlarından daha fazlası gözlenirse, analjezik uygulaması gerekli olabilir; Veteriner rehberliği isteyin. - Baskın olmayan başparmak ve işaret parmağı arasındaki pelvik kemeri nazikçe ama sıkıca kavrayın. İliak kret palpe edilebilir olmalı ve her parmağın distal falanksının merkezine yerleştirilmelidir (Şekil 1C).
NOT: Bu yaşta ısırılma endişesi yoktur, bu nedenle kağıt havluyu farenin/farenin üzerine sarmak gerekli değildir. Daha büyük sıçan yavrularını hareketsiz tutmak için P5-10 sıçanlarda kağıt havlu kullanmak gerekebilir. - Omurganın düzgün hizalanmasını sağlamak için kuyruğun tabanını yavaşça döndürün. Farenin/sıçanın pelvisi kare olmalıdır, böylece lomber omurganın vertebral süreçleri çalışma yüzeyine dik olur.
- Farenin/sıçanın dorsal bel bölgesini %70 alkol hazırlama pedi ile sürün.
- Enjeksiyon yerini görselleştirmeye yardımcı olmak için saçı, mümkünse ~ 1-3 mm kraniyal olarak iliak kreste ayırın. Hedef alanın görselleştirilmesi genç farelerde/sıçanlarda daha kolaydır. Saçsız yenidoğanlarda intervertebral boşlukta bir girinti görülebilir.
- L4-L5 veya L5-L6 intervertebral boşluğu, iliak krestin ~ 1-3 mm kraniyalini hissedin veya görselleştirin.
NOT: Tam mesafe, farenin/sıçanın boyutuna ve yaşına bağlı olarak değişir.
- Baskın elinizi kullanarak fareyi/fareyi kuyruğundan bir kağıt havlu üzerinde tutun. Fare/sıçan, vücudun yan yüzü size bakacak şekilde nötr yüzüstü pozisyonda olmalıdır.
- Enjeksiyon
- Baskın eli kullanarak, mikrolitre şırınganın merkezini tutun ve fare/sıçan omurgasına 30-45 derecelik bir açıyla yerleştirin. İğnenin eğimi farenin/sıçanın başına bakacak şekilde, cildi intervertebral boşluğa yaklaşık 1-3 mm caudle delin. Şırınganın açılı oryantasyonu nedeniyle, cilde yerleştirme noktası intervertebral boşluğa hafifçe kaudaldir.
NOT: Bu mesafe, farenin/farenin yaşına ve boyutuna göre değişebilir. - Adımların geri kalanı, farelerin >P21) 1.3.3.3.10 adımlarıyla aynıdır.
- Baskın eli kullanarak, mikrolitre şırınganın merkezini tutun ve fare/sıçan omurgasına 30-45 derecelik bir açıyla yerleştirin. İğnenin eğimi farenin/sıçanın başına bakacak şekilde, cildi intervertebral boşluğa yaklaşık 1-3 mm caudle delin. Şırınganın açılı oryantasyonu nedeniyle, cilde yerleştirme noktası intervertebral boşluğa hafifçe kaudaldir.
3. Sıçanların lomber IT enjeksiyonu >P21
NOT: Literatürde anestezisiz tekniklerden daha kapsamlı cerrahi yaklaşımlara kadar tanımlanmış çok sayıda IT enjeksiyon prosedürü vardır14,15. Minimal invaziv bir teknik kullanılarak doğrudan enjeksiyon için bir prosedür, hafif anestezi ve küçük bir cilt insizyonu kullanılarak tarif edilir. İzofluran gazı gibi anestezi kullanımı, kısıtlamaya yardımcı olabilir, kas sistemini gevşetebilir ve enjeksiyon sırasında hareketi önleyebilir. Enjeksiyon bölgesi üzerinde deride küçük bir kesi yapmak, intervertebral boşluğun görselleştirilmesine izin vererek ve kalın deriden delme ihtiyacını ortadan kaldırarak enjeksiyonun doğruluğunu artırır. Kesi nedeniyle anestezik ve analjezik kullanımı gereklidir. Uygulama ile, P21'den daha yaşlı sıçanlarda anestezi veya kullanıcının takdirine bağlı olarak ve bekleyen kurumsal gereksinimlere bağlı olarak bir insizyon olmadan lomber IT enjeksiyonları yapmak mümkündür15. Laboratuvar hayvanları için anestezi, uygun analjezikler ve hayatta kalma cerrahisi ile ilgili kurumsal yönergeleri ve hususları izleyin.
- Hazırlık
- Adım 1.1'i izleyin. Bunun tek istisnası, adım 1.1.3'teki enjeksiyon hacmi ve adım 1.1.4'teki iğne boyutudur. Sıçanlar için enjeksiyon hacimleri yaşa ve vücut büyüklüğüne göre büyük ölçüde değişebilir. Farklı yaşlarda enjeksiyon hacmi hakkında daha fazla bilgi için Tartışma bölümüne bakın (Tablo 1).
NOT: Yetişkin sıçanlar için 27 G x 1 "iğne önerilir, çünkü daha küçük ölçülü iğneler bükülebilir ve daha kısa iğneler intratekal boşluğa yeterince nüfuz etmeyebilir. İstenirse daha uzun (1,25-1,5 inç) bir iğne kullanılabilir. - Tercih edilen ve onaylanmış anestezik kullanarak sıçanı uyuşturun (kurumsal olarak onaylanmış protokolleri izleyerek).
NOT: Burada açıklanan prosedürler için, sıçanlar izofluran gazı kullanılarak uyuşturuldu ve lokal anestezik olarak 1: 1 lidokain karışımı: bupivakain kullanıldı. Vücut ısısı, prosedür ve iyileşme boyunca onaylanmış bir harici ısı kaynağı kullanılarak korunmalıdır. - Her hayvan için standart aseptik cerrahi alan hazırlığını takip edin. Kısacası sırt bel bölgesini tıraş edin ve cildi cerrahi bir ovma, betadin ve %70 izopropil alkol ile hazırlayın.
- Adım 1.1'i izleyin. Bunun tek istisnası, adım 1.1.3'teki enjeksiyon hacmi ve adım 1.1.4'teki iğne boyutudur. Sıçanlar için enjeksiyon hacimleri yaşa ve vücut büyüklüğüne göre büyük ölçüde değişebilir. Farklı yaşlarda enjeksiyon hacmi hakkında daha fazla bilgi için Tartışma bölümüne bakın (Tablo 1).
- Cerrahi prosedür
- Fareyi, vücudun yanal yüzü size bakacak şekilde nötr yüzüstü pozisyona getirin.
- Pelvik kemeri palpe edin, iliak krest ve lumbosakral bileşkeyi tanımlayın. Sıçanlarda >P21, vertebral süreçler kolayca tanımlanabilir.
- Bir neşter kullanarak L4-L5 veya L5-L6 intervertebral boşluk üzerinde 1 cm'lik bir kesi yapın. Kesi sadece cildi ve alttaki fasyayı içermeli ve kası sağlam bırakmalıdır.
NOT: İşlemin geri kalanında cildi açık tutmak için ekartörler kullanmak faydalı olacaktır. - Baskın olmayan başparmak ve işaret parmağı arasındaki pelvik kemeri nazikçe ama sıkıca kavrayın. İliak kret palpe edilebilir olmalı ve her parmağın distal falanksının merkezine yerleştirilmelidir (Şekil 1D). İntervertebral boşluğu bulmak için sırtın orta hattı boyunca araştırmak için sivrisinek forseps kullanın.
- Enjeksiyon
- Baskın eli kullanarak, mikrolitre şırınganın merkezini tutun ve L4-L5 veya L5-L6 intervertebral boşlukta sıçan omurgasına dik olarak konumlandırın. Şırınganın pistonunun, elin aşırı hareketi olmadan işaret parmağıyla bastırılabildiğinden emin olun. İğnenin eğimi sıçanın başına bakacak şekilde, kası iğne ile intervertebral boşluk üzerinde delin.
- İğneyi intervertebral boşluğa ilerletin.
NOT: İğne, vertebral süreçler arasından geçerken hafif bir dirence sahip olabilir ve bu boşluktan geçmek için şırınganın açısının biraz ayarlanması gerekebilir. Bununla birlikte, omurgaya dik olarak yaklaşık 90 derece kalmalıdır. İğne intratekal boşluğa girerken bir patlama hissedilecektir. Anestezik parametrelere bağlı olarak, bir kuyruk veya bacak hareketi fark edilebilir veya edilmeyebilir. İğne omurlar arasına sıkıca kenetlenmelidir. - Şırıngayı yerinden çıkarmamaya dikkat ederek, çözeltiyi 30 saniye içinde vermek için pistona bastırın.
NOT: Farelerdeki enjeksiyonların aksine, bu yöntemi kullanarak sıçanlarda >P21) şırınga açısını azaltmak mümkün olmayabilir. Aşırı basınç oluşumunu önlemek için daha büyük hacimler daha yavaş bir hızda enjekte edilmelidir. - Çözeltinin dağılmasını sağlamak ve geri akışı önlemek için pistona tamamen bastırdıktan sonra şırıngayı 30-60 saniye yerinde tutun.
- Şırıngayı fareden düzgün bir şekilde geri çekin. İğne geri çekilirken, geri akışı önlemek için şırıngayı döndürün.
NOT: Şırıngayı döndürürken iğneyi ilerletmemeye dikkat edin, çünkü bu omurilikte fiziksel hasara neden olabilir. - Dikiş veya yara klipsleri gibi onaylanmış bir yöntem kullanarak cilt kesisini kapatın. Bu protokolde kullanılan sıçanlar için, cilt 5-0 PDS II sütür kullanılarak sürekli intradermal veya basit kesintili bir paternle kapatıldı.
- Fareyi anesteziden kurtarın.
- 1.3.9-1.3.10 adımlarını ve tüm ameliyat sonrası bakım yönergelerini izleyin.
Sonuçlar
Gen terapisi vektör iletimini birçok faktör etkileyebilse de, dokunun histolojik boyanması lomber intratekal (IT) enjeksiyonların başarısını belirlemek için en doğru yöntem olmaya devam etmektedir. Enjeksiyonu takiben gen terapisi vektörünün merkezi sinir sistemi (CNS) içindeki geniş ve eşit dağılımı, başarılı bir prosedürün göstergesidir. Şekil 2C , enjeksiyondan 4 ay sonra, yenidoğan (P1) farelerde 1.3 × 1011 vg / fare dozunda JeT promotörü altında zayıf her yerde bulunan transgen ekspresyonunu yönlendiren kendi kendini tamamlayan bir AAV9 aracılı gen terapisinin başarılı bir enjeksiyonunu temsil eder. Gen terapisi tarafından sağlanan transgeni hedef alan bir prob kullanan RNAscope analizi, lomber omurilik, servikal omurilik ve beyindeki geniş dağılımı ortaya çıkarır. Karaciğer ve kalbin bir bölümü, doğrudan beyin omurilik sıvısı (BOS) enjeksiyonu ile bile, gen terapisi vektörünün periferik dokulara hala dağıtılabileceğini vurgulamak için dahil edilmiştir.

Şekil 2: P1'de enjeksiyondan 4 ay sonra fare CNS ve periferik dokunun lekeli 5 mikronluk doku bölümleri. Kırmızı boyama, RNAscope yoluyla transgen ekspresyonunu gösterir ve çekirdeklerin mavi karşı boyanması hematoksilen yoluyla yapılır. (A) Bir kontrol formülasyon tamponu ile enjeksiyon. (B) Bir AAV9 vektörü (scAAV9_JeT-hDDX3Xopt-SpA) ile başarısız intraparankimal enjeksiyon. (C) AAV9 vektörü (scAAV9_JeT-hDDX3Xopt-SpA) ile başarılı lomber IT enjeksiyonu. (B) ve (C)'de kullanılan gen terapisi vektörü, translasyonel olarak anlamlı bir 1.3E11 vg / fare dozunda verildi. Ölçek çubuğu: üst panel (5 mm); alt panel (1 mm). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 2B'de gösterildiği gibi, beyindeki ekspresyon eksikliği ile eşleştirilmiş lomber omurilikteki konsantre ekspresyon, omuriliğin intraparankimal enjeksiyonunu gösterebilir ve başarısız bir enjeksiyon olarak kabul edilmelidir. Bu, iğne omurgaya çok fazla sokulduğunda, intratekal boşluğu geçtiğinde ve omuriliğe girdiğinde olur. Ek olarak, omurilik ve beyinde çok düşük veya hiç ekspresyon olmaması (gösterilmemiştir), geniş CNS dağılımının beklendiği durumlarda bir vektör ve dozun kullanıldığı varsayılarak, başarısız bir hedef dışı enjeksiyon olarak kabul edilmelidir. Bunun nedeni iğnenin yeterince uzağa sokulmamasından veya orta hatta yanal olmasından kaynaklanabilir.
Başarılı enjeksiyonlardan gözlemlenen ekspresyon paternleri, örnek olarak aşağıdaki sekiz faktöre bağlı olarak farklılık gösterebilir: (1) enjeksiyon yaşı, (2) önceden var olan bağışıklık, (3) infüzyon hızı, (4) gen terapisi vektörü, (5) gen terapisi dozu, (6) hücre yüzey proteinleri, (7) tropizm ve (8) varsa, transgen ekspresyonunu yönlendirmek için uygun bir promotör seçimi6. Ekspresyon paternleri farklılık gösterebilse de, doz AAV9 gibi etkili bir vektörle yeterince yüksek olduğu sürece geniş, eşit, yaygın dağılım evrensel olacaktır.
Lomber IT enjeksiyon başarısını doğrulamak için histolojik analiz kullanmanın başlıca sınırlamaları, uzun bekleme süreleri - nekropsiler yapıldıktan ve doku toplandıktan sonra bir çalışmanın sonuna kadar beklemek - ve büyük bir gen terapisi çalışmasında tüm farelerden alınan dokuyu işlemek için gereken kapsamlı kaynaklardır. Ne yazık ki, deneyimlerimiz, pozitif veya negatif bir enjeksiyonun anlık ve doğrudan göstergelerinin güvenilmez olabileceği yönündedir; Bununla birlikte, iğne intratekal boşluğa girerken kuyruk hareketi refleksi, gerçek zamanlı olarak başarılı konumlandırmanın iyi bir göstergesidir ve muhtemelen başarılı bir enjeksiyonu gösterir. İğne, anestezi uygulanmamış bir fare/sıçanda cildi delerken, intratekal boşluğa giren iğneye kuyruk hareketi tepkisi ile bir seğirmeyi karıştırmayın. NMDA, P maddesi ve lidokain gibi farmakolojik ajanların eğitimde veya deneysel enjeksiyon çözeltisi ile karıştırılarak kullanılmasının, enjeksiyon başarısının daha acil bir göstergesini sağladığı bildirilmiştir 9,11,24. Bu ajanlar göz önüne alındığında, gen terapisi vektörü ile uyumluluklarını değerlendirmek önemlidir.
Tartışmalar
Lomber IT enjeksiyonu, CNS hastalıklarınıntedavisi için BOS'a güvenilir bir şekilde bir gen terapisi vektörü ileten hızlı ve minimal invaziv bir prosedürdür 5,6. Prosedür translasyonel olarak ilgilidir ve burada açıklanan protokol, yenidoğanlardan yetişkinlere kadar her yaştaki farelerde ve sıçanlarda bu uygulama yolunun nasıl gerçekleştirileceğini detaylandırır. Bu protokolü, her yaştan fareler ve sıçanlar için tanımlamak, destekleyici videolar sağlamanın yanı sıra, araştırmacılara gen terapisi uygulaması için bu yöntemin benimsenmesinde yardımcı olmak önemlidir. Laboratuvarımızın deneyimi, bu protokolün zaman içinde birden fazla kullanıcı ve çalışmada tutarlı bir şekilde uygulanabileceği yönündedir 18,25,26,27,28,29,30.
Genç farelerde/sıçanlarda lomber IT enjeksiyonu yapılırken yaşlı farelere/sıçanlara kıyasla önemli farklılıklar vardır, en önemlisi iğnenin omurgaya sokulduğu açı ve enjekte edilen önerilen hacim. Bildirilen lomber IT enjeksiyon hacimleri, çalışmalar arasında ve türler arasında önemli ölçüde farklılık göstermektedir31. BOS ve serebral kan akışını tehlikeye atabilecek, rahatsızlığa neden olabilecek ve hidrosefali, iskemi, hücresel hasar ve ölüm dahil olmak üzere kronik nörolojik komplikasyonlara yol açabilecek intrakraniyal basınçta (ICP) uzun süreli yükselmeleri önlemek için enjeksiyon hacminin dikkate alınması önemlidir32,33. ICP, vücut ağırlığı ile doğrudan ilişkilendirilemeyen BOS, serebral kan ve CNS dokusunun hacmi ile belirlenir. Normal işleyişte, ICP, BOS hacmi, serebral kan hacmi, solunum, vücut pozisyonu, BOS üretim hızı ve BOS kana BOS drenaj hızı dahil olmak üzere birçok faktör tarafından otoregüle edilir33,34. Bu nedenle, IT enjeksiyon hacimleri vücut ağırlığı 25,27,28,30 yerine BOS özelliklerine (Tablo 1) göre belirlenmelidir. Her türde her yaşta enjekte edilmesi önerilen hacimler kalın harflerle belirtilmiştir.
| IT Enjeksiyon Hacmi | Yetişkin BOS Değerleri | |||||||
| P0-1 (μL) | P5-7 (μL) | P10 (μL) | >P21 (μL) | Toplam Hacim (μL) | Üretim Hızı (μL/dak) | Ciro (h) | Kafa İçi Basıncı (mm Hg) | |
| Fare | 3 | 5 | 5-10 arası | 5-20 arası | 30-4025,30 | 0,32-0,3525,30 | 1.7-225,30 | 5,0 +/- 0,528 |
| Sıçan | 5 | 5-10 | 10-30 | 10-200 (20-75) | 15025 | 1.7-2.825 | 2-2,6625 | 8.6 +/- 1.7,27 |
Tablo 1: Farklı yaşlardaki fareler ve sıçanlar için lomber IT enjeksiyon hacimlerinin özeti. Kalın değerler önerilir ve güvenli bir şekilde teslim edilmiştir. Mümkün olan maksimum hacimler resmi olarak değerlendirilmemiştir. Farelerde ve sıçanlarda bilinen BOS parametreleri (toplam hacim, üretim hızı, ciro ve intrakraniyal basınç) hakkında ek bilgiler referans olarak dahil edilmiştir.
Tek seferlik bolus IT enjeksiyon hacimleri için üst eşik ile ilgili olarak alan genelinde bilgi eksikliği vardır. BOS hacminin bilindiği yetişkin insanlarda, sıçanlarda ve farelerde, toplam BOS hacminde% 30'luk bir artışın kronik yaralanma veya hastalıklara neden olduğu görülmemektedir 31,33,35,36. Juvenil veya neonatal farelerde bilinen BOS hacimlerinin olmaması, benzer bir ekstrapolasyonu imkansız hale getirir. Bazı gruplar genç hayvanlarda BOS hacmine ve üretimine bakmaya başlıyor37. Bu alanlardaki ek araştırmalar doğrulanana kadar, enjeksiyon hacmi araştırmacı tarafından bildirilen değerlere tabi olmaya devam edecektir.
Fareler ve sıçanlar, özellikle daha genç yaşlarda veya yüksek enjeksiyon hacimleriyle tedavi edildiklerinde, kasların esnemesine, uzuvların uzamasına, hızlı nefes almaya veya birkaç dakika içinde kendi kendine çözülmesi gereken geçici arka ayak felcine neden olabilir. Aşırı durumlarda, akut ICP yükselmeleri ölümcül olabilen kardiyovasküler ve solunum anormalliklerine neden olabilir32,33. 24 saat sonra herhangi bir işlem sonrası anormallik devam ederse, fareler / sıçanlar çalışmadan çıkarılmalı ve insancıl bir şekilde ötenazi yapılmalıdır. İğne çok uzağa sokulursa ve omuriliği etkilerse kalıcı arka bacak felci meydana gelebilir. Bu, lomber IT enjeksiyonu yapılırken yapılan yaygın bir hatadan kaynaklanabilir: pistona basarken kuyruk hareketinden sonra şırınganın hareketi. Şırınga ve iğne hareketinden kaçınılmalıdır. İlk delinme ile doğru pozisyon elde edilemezse, aynı yerde ikinci bir deneme yapılabilir. İkinci deneme de başarısız olursa, bir sonraki intervertebral boşluğu hedeflemek için iğne pozisyonunu değiştirmeyi deneyin. Birden fazla iğne çubuğunun daha sonra başarılı bir enjeksiyonun sızmasına neden olabileceğini unutmayın.
Lomber IT enjeksiyonunda uzmanlaşmak zaman alabilir. Enjeksiyonları bir terminal prosedürü olarak uygulamak için, Evans mavisi veya 0.2 mikron filtrelenmiş McCormick yeşil boyası (Şekil 3) gibi onaylanmış bir boya çözeltisi kullanarak veya Temsili Sonuçlar bölümünde ele alınan farmakolojik ajanlarla yukarıdaki protokolü izleyin. Enjeksiyonda sorun gidermek ve ustalaşmak için boya kullanılması önerilir, çünkü bir enjeksiyonun başarılı mı yoksa başarısız mı olduğunu 1 dakika içinde söylemek kolaydır. Boya ile uygulama sadece hayatta kalmayan prosedürler içindir, çünkü hayvanlar doğrudan CNS'ye uygulandığında boyaya karşı bir reaksiyon geliştirebilir. Bu reaksiyon, başarılı bir enjeksiyondan sonraki bir dakika içinde ortaya çıkabilir ve hızlı kaşıntı ve kıvranma hareketleri ile karakterizedir. Rahatsızlığı en aza indirmek için bu reaksiyon gözlendiğinde hayvanlara hemen ötenazi yapılmalıdır. Başarılı bir uygulama boya enjeksiyonundan sonra, boya omurgada lokalize kalacaktır (yakındaki periferik dokuda boya yoktur) ve omurgayı beyincik, beyin ve koku alma ampullerine doğru hareket ettirecektir. P1'de cilt, boyanın kuyruktaki omurgadan aşağı doğru hareket ettiği görülebilecek kadar şeffaftır. Boya birkaç dakika içinde beyne ulaşmazsa, enjeksiyon başarısız olur.

Şekil 3: Başarılı lomber IT enjeksiyonları sonrası beyindeki McCormick yeşil boyası. Tüm beyinler, 5 μL boya enjekte edilen P21 farelerinden alınır ve ventral görünümde gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Viral titre ve dozlar gibi klinik öncesi araştırma tasarımı için ilgili ilişkili parametreler hakkında ek bilgi için, daha önce yayınlanmış incelemelerebakın 3,6,31.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
AAV9 vektörünü ürettiği için UT Güneybatı AAV Viral Vektör Çekirdek Tesisine ve Şekil 2'de sunulan dokuyu işlediği ve boyadığı için Gray Lab'da Araştırma Bilimcisi Yuhui Hu'ya teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
Referanslar
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16(2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778(2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565(2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229(2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31(2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463(2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761(2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575(2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217(2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392(2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650(2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832(2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286(2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413(2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197(2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8(2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır