Method Article
마우스와 쥐에서 중추 신경계 표적화를 위한 유전자 치료 벡터의 요추 내 주입
요약
요추 척추내 주사는 중추 신경계에 유전자 요법을 전달하기 위한 번역적으로 관련된 투여 경로를 나타냅니다. 신생아, 청소년 및 성인 마우스와 쥐의 요추 척추 내 주사에 대한 이 포괄적이고 표준화된 프로토콜은 연구자들이 전임상 유전자 치료 연구에 이 기술을 채택하도록 안내하는 것을 목표로 합니다.
초록
신경 질환을 치료하기 위해 중추 신경계를 표적으로 삼는 한 가지 방법은 요추 척추 내 투여 경로를 활용하는 것입니다. 이 접근법은 혈액-뇌 장벽을 우회하여 뇌척수액에 직접 접근하고 중추 신경계 내의 세포를 우선적으로 표적으로 삼습니다. 요추 척수강내 주사 경로를 사용하는 여러 발표된 전임상 연구는 유전자 치료 임상 시험의 개발에 기여했습니다. 그러나 설명된 프로토콜은 가변적이며 여러 리소스에 분산되어 있습니다. 여기에서는 전임상 유전자 치료 연구를 위한 신생아, 청소년 및 성인 마우스와 쥐의 요추 척추 내 주사에 대한 포괄적인 프로토콜 세트를 제시합니다. 적절한 교육을 통해 이 주입 기술을 빠르고 안정적으로 수행할 수 있습니다. 각 발달 단계에서 주사 프로토콜을 자세히 설명하는 것 외에도 연구 결과에 영향을 미칠 수 있는 주사량과 같은 관련 매개변수에 대해 논의합니다. 중추 신경계를 표적으로 하는 요추 내 주사의 적용을 입증하기 위해 뇌, 척수 및 말초 조직에서 아데노 관련 바이러스 혈청형 9의 발현을 성공 또는 실패한 주사 후 제시합니다.
서문
전세계 중추신경계(CNS) 전달이 필요하지만 유전자 치료의 좋은 후보인 신경 질환을 치료하는 데 있어 어려움은 주로 CNS 및 관련 세포 유형1의 비효율적인 표적화에 기인합니다. 전달 매개체 엔지니어링을 통해 전 세계 CNS 세포 및 조직 표적화를 최적화하기 위한 상당한 양의 연구가 진행 중입니다 1,2. 그러나 현재의 유전자 치료 벡터 기술로는 바이러스 벡터와 투여 경로의 특정 조합을 사용하여 상당히 광범위한 벡터 전달을 달성할 수 있습니다 3,4. 일회성 치료로 광범위한 CNS 전달을 얻기 위한 현재 황금 표준은 아데노 관련 바이러스 혈청형 9(AAV9)를 뇌척수액(CSF)에 직접 주사하는 것과 함께 사용하는 것입니다.
CSF 직접 주사를 위한 일반적인 투여 경로는 요추내(IT), 뇌강내(ICV), 수조내(ICM)의 세 가지입니다5. 이러한 투여 경로는 각각 중추신경계와 말초 조직에서 서로 다른 생체 내 분포 패턴을 가져오지만, 모두 혈액뇌장벽(BBB)을 우회하여 신경 질환 병리학 및 표현형에 기여하는 중추신경계의 세포에 도달하는 이점이 있습니다6. 요추 IT 주사는 임상 절차가 일상적이고 간단하며 ICV 및 ICM 주사에 비해 침습성이 적기 때문에 인간에서 임상 약물 전달 사용의 표준입니다.
요추 IT 주사는 마취제 및 진통 분야에서 쉽게 사용되는 확립 된 기술로, 1885년에 발표 된 첫 번째 논문 7. 성체 쥐의 요추 IT 주사에 대한 첫 번째 프로토콜은 1980년에 발표되었으며8 이후 널리 채택되고 검토되었습니다9. 이러한 프로토콜에 대한 약간의 조정 또는 개선이 이루어졌으며10,11,12 제품 보존 기술 13을 포함합니다. 성체 쥐의 요추 주사에 대한 프로토콜도 1976년에 처음 발표되었는데, 만성 투여를 위한 카테터 삽입14과 일회성 치료를 위한 직접 주사15가 있었다. 보다 최근에는 신생아 또는 청소년 마우스와 쥐에 대한 요추 IT 주사에 대한 프로토콜을 발표했습니다16,17.
중추신경계에서 BBB 및 표적 세포를 우회하기 위한 이 기술의 광범위한 채택 및 검증은 신경 질환 치료를 위한 여러 성공적인 유전자 치료, 전임상 및 임상 연구로 이어졌습니다. 신경 질환을 모델링하는 생쥐, 쥐 및 비인간 영장류에 대한 긍정적인 효능 및 안전성 데이터는 이러한 질병에 대한 임상적 이점의 잠재력에 대한 흥분과 관심을 불러일으켰습니다 18,19,20,21,22,23. 이러한 연구 중 소수는 현재 임상시험 중입니다(예: clinicaltrials.gov 식별자 NCT02362438, NCT04737460, NCT03381729 및 NCT05518188)3,6. 이 기사에서는 CSF를 제거하지 않고 중개 유전자 치료 프로젝트에 채택할 수 있는 다양한 연령의 마우스와 쥐에서 요추 IT 주사를 위한 간단한 프로토콜을 설명합니다. 이 프로토콜은 널리 채택된 이미 사용 가능한 프로토콜과 유사합니다. 그러나 이러한 관련 프로토콜을 한 곳에서 쉽게 액세스하고 참조할 수 있도록 함께 제공되는 비디오 비주얼과 함께 인용하는 것은 가치가 있습니다. 이 프로토콜은 출생 후 일(P) 0-1, 어린 마우스 및 쥐P21)에 대한 주사를 마우스의 P1에서 요추 IT 주사의 성공 및 실패의 대표적인 결과와 함께 설명합니다. 논의에서는 이 절차를 수행하는 동안 세심한 주의가 필요한 일반적인 실수 및 특정 세부 사항뿐만 아니라 전임상 연구를 시작하기 전에 이러한 주사를 연습하는 방법에 대한 권장 사항을 다룹니다.
프로토콜
여기에 설명된 절차는 텍사스 대학교 사우스웨스턴 메디컬 센터(University of Texas Southwestern Medical Center)의 기관 동물 관리 및 사용 위원회(IACUC)의 승인을 받았습니다. P1-P28세의 야생형 C57BL6/J 수컷 및 암컷 마우스는 마우스와 관련된 프로토콜에 사용되었습니다. P1-P56세의 야생형 Sprague-Dawley 수컷 및 암컷 쥐를 쥐와 관련된 프로토콜에 사용했습니다. 섹션 3에 설명된 생존 수술을 제외하고, 다른 모든 절차는 일시적인 불편함만 유발하는 것으로 간주되며 마취제나 진통제의 사용을 필요로 하지 않습니다. 개인은 일시적인 불편함 이상의 것이 있는지 실험실 동물을 모니터링해야 하며 마취제 및 진통제의 필요성에 대해 IACUC 및 수의사에게 지침을 구해야 합니다. 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나와 있습니다.
1. 마우스의 요추 IT 주사 >P21
- 준비
- 원하는 농도의 유전자 치료 벡터와 대조 용액(일반적으로 벡터 생산에 사용되는 제형 완충액)을 포함한 주입 용액을 준비합니다. 주사 용액은 멸균되어야 하며 절차 전반에 걸쳐 멸균 상태를 유지해야 합니다.
알림: 모든 용액은 절차 기간 동안 얼음 위에서 유지해야 합니다. - 주사기와 바늘, 피펫 및 주사 용액을 포함한 모든 재료를 수집하고 소독합니다. 생물 안전 캐비닛 사용 및 주사제 노출에 관한 기관 지침을 따르십시오. 여기에 설명된 절차는 클래스 2 생물 안전성 캐비닛에서 수행되었습니다.
- 마이크로리터 피펫을 사용하여 원하는 주입 용액의 부피를 측정하고 이를 멸균 파라핀 필름으로 옮깁니다. 5μL의 주입량이 일반적으로 사용되며 성체 마우스의 목표 부피로 취급됩니다>P21(표 1).
알림: 필요한 경우 볼륨을 높일 수 있습니다. 그러나 동물의 경우 더 많은 주입량에 대한 부작용이 있는지 면밀히 모니터링해야 합니다. 주입량 및 부작용에 대한 자세한 내용은 Discussion 섹션을 참조하십시오. 용액은 또한 피펫 팁에서 주사기로 직접 이동하거나 보정된 기밀 마이크로리터 주사기를 사용하여 주입 용액 부피를 직접 측정할 수 있습니다. - 기포가 생기지 않도록 주의하면서 30G 0.5인치 바늘을 사용하여 마이크로리터 주사기에 용액을 넣습니다.
참고: 바늘 게이지와 길이는 피부 침투에 영향을 줄 수 있습니다. 사용하는 주사기의 크기를 고려할 때 주입량은 주사기 용량의 10% 이상이어야 합니다. 주사기 용량의 50%보다 큰 부피의 경우 플런저를 검지 손가락으로 쉽게 누를 수 있는지 확인하십시오. 플런저를 쉽게 누를 수 없는 경우 더 큰 용량의 주사기를 사용하십시오.
- 원하는 농도의 유전자 치료 벡터와 대조 용액(일반적으로 벡터 생산에 사용되는 제형 완충액)을 포함한 주입 용액을 준비합니다. 주사 용액은 멸균되어야 하며 절차 전반에 걸쳐 멸균 상태를 유지해야 합니다.
- 금지
- 주로 사용하는 손을 사용하여 의식이 있는(마취되지 않은) 쥐의 꼬리를 종이 타월로 잡습니다. 종이 타월은 쥐가 무는 것을 억제하고 진정시키며 방지하는 데 도움이 됩니다. 마우스는 신체의 측면이 사용자를 향하도록 중립에 엎드린 위치에 있어야 합니다.
참고: 시술 전에 이 구속구에 대해 마우스를 훈련시키거나 습관화할 필요는 없습니다. 생쥐는 자제력으로 인해 어려움을 겪을 수 있지만 특정 통증 반응을 유발해서는 안 됩니다. 일시적인 통증 반응 이상이 관찰되는 경우, 진통제 투여가 필요할 수 있습니다. 수의사의 지도를 받으십시오. - 주로 사용하지 않는 손으로 종이 타월의 일부를 마우스의 머리와 상체 위로 접고 주로 사용하지 않는 엄지 손가락과 검지 사이의 골반 거들을 단단히 잡습니다. 손바닥이 오목으로 되어 마우스 머리 주위에 놓여 있는지 확인합니다. 마우스의 장골능은 만져질 수 있어야 하며 각 손가락의 원위 지골 중앙에 위치해야 합니다(그림 1A, B).
알림: 손이나 종이 타월을 자제해도 호흡이 손상되지 않아야 합니다. - 척추의 적절한 정렬을 보장하기 위해 꼬리 바닥을 부드럽게 회전합니다. 쥐의 골반은 요추의 척추 돌기가 작업 표면에 수직이 되도록 정사각형이어야 합니다.
- 70% 알코올 준비 패드로 마우스의 등쪽 요추 부위를 면봉으로 닦습니다.
- 주입 위치를 시각화하는 데 도움이 되도록 장골능까지 두개골 ~2-6mm 두개골을 가르십시오.
- L4-L5 또는 L5-L6 추간 공간, 장골 능선에서 ~2-6mm 두개골을 느낍니다.
참고: 정확한 거리는 마우스의 크기와 수명에 따라 다릅니다.
- 주로 사용하는 손을 사용하여 의식이 있는(마취되지 않은) 쥐의 꼬리를 종이 타월로 잡습니다. 종이 타월은 쥐가 무는 것을 억제하고 진정시키며 방지하는 데 도움이 됩니다. 마우스는 신체의 측면이 사용자를 향하도록 중립에 엎드린 위치에 있어야 합니다.
- 주사
- 주로 사용하는 손을 사용하여 마이크로리터 주사기의 중앙을 잡고 L4-L5 또는 L5-L6 추간 공간에서 마우스 척추에 수직으로 배치합니다. 주사기의 플런저를 손의 과도한 움직임 없이 검지로 누를 수 있는지 확인하십시오. 바늘의 경사가 마우스의 머리를 향하도록 하여 추간 공간 위의 피부에 구멍을 뚫습니다.
- 주삿바늘 끝에서 추간 공간 주위의 뼈 가장자리가 느껴지면 주사기의 각도를 30-45도로 줄입니다(그림 1A).
- 바늘이 추간 공간으로 미끄러져 들어가 갑작스런 꼬리 튕김을 유발해야 하며 척추 사이에 단단히 고정되어야 합니다.
- 주사기가 옮겨지지 않도록 주의하고 플런저를 꾸준히 눌러 10초 이내에 용액을 전달합니다.
- 플런저를 완전히 누른 후 15-30초 동안 주사기를 제자리에 유지하여 용액이 소멸되고 역류를 방지합니다.
- 동일한 30-45도 진입 각도에서 마우스에서 주사기를 부드럽고 천천히 빼냅니다. 바늘을 빼낼 때 주사기를 회전시켜 역류를 방지합니다.
알림: 주사기를 돌릴 때 척수에 물리적 손상을 줄 수 있으므로 바늘을 앞으로 내밀지 않도록 주의하십시오. - 안전 장치에서 마우스를 풀고 가정용 케이지로 다시 넣습니다.
- 주입 후 마우스에 비정상적인 보행, 운동 장애, 호흡 이상 및 협응력이 있는지 모니터링합니다. 부작용에 대한 자세한 내용은 토론을 참조하십시오.
- 제조업체의 권장 사항에 따라 장비를 청소하십시오. 다중 주사의 경우 각 유전자 치료 벡터와 대조 용액에 대해 다른 주사기가 권장됩니다.
알림: 탈착식 바늘은 여러 번 청소, 살균 및 재사용할 수 있습니다. 그러나 무딘 바늘은 동물에게 해를 끼칠 수 있고 주사를 놓칠 가능성을 높일 수 있으므로 사용해서는 안 됩니다. 무딘 바늘은 피부에 쉽게 구멍을 뚫지 않으므로 적절하게 버려야 합니다. 주사기가 제한되어 있는 경우, 유전자 치료 벡터를 진행하기 전에 모든 차량 주사를 완료하고 더 높은 용량을 투여하기 전에 가장 낮은 유전자 치료 용량을 주입하는 것이 좋습니다. - 동물 간 장비 살균에 대한 제도적 지침을 따르십시오.
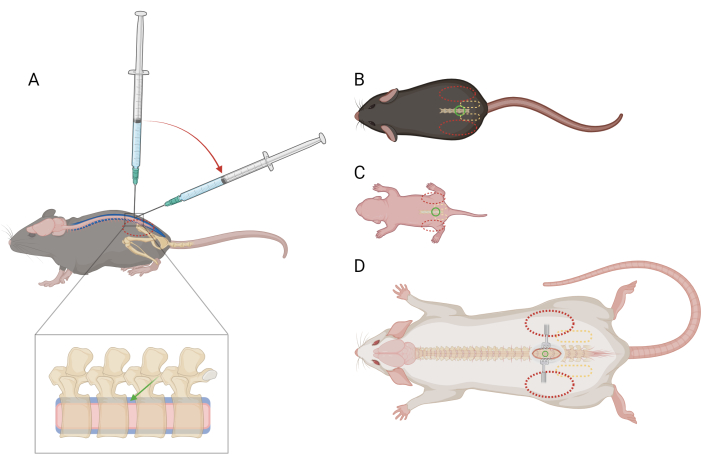
그림 1: 마우스와 쥐에서 요추 척추 내 주사를 위한 손가락 및 주사기 배치 개략도. (A) 요추 IT 주사 중 바늘 배치 및 주사기 각도 전환을 보여주는 마우스 >P21의 측면 보기. 빨간색 점선 타원은 마우스의 장골 능선 위에 손가락이 있음을 나타냅니다. 척추를 확대하면 대략적인 바늘 위치(녹색 화살표)와 척수(분홍색)가 있는 척추 내 공간(파란색)이 표시됩니다. (B) 마우스>P21, (C) 마우스D) 쥐>P21의 등쪽 모습, 바늘 배치(녹색 원), 골반 거들(노란색 파선, 타원), 손가락 위치(빨간색 파선 타원)에 대한 기준점이 있습니다. 절개 부위와 견인부도 (D)에 묘사되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 생쥐와 쥐의 요추 IT 주사
- 준비
- 1.1단계를 따릅니다. 유일한 예외는 1.1.3단계의 주입 부피입니다.
참고: 신생아 마우스(P0-P1)의 권장 주입량은 3μL를 초과해서는 안 되며, 어린 마우스(P5-P7)의 경우 5μL를 초과해서는 안 되며, 청소년 마우스(P10)의 경우 10μL를 초과하지 않아야 합니다.신생아 쥐(P0-P1)의 권장 주입량은 5μL를 초과해서는 안 되며, 어린 쥐(P5-P7)의 경우 10μL를 초과해서는 안 되며, 어린 쥐(P10)의 경우 30μL를 초과해서는 안 됩니다(표 1).
- 1.1단계를 따릅니다. 유일한 예외는 1.1.3단계의 주입 부피입니다.
- 금지
- 주로 사용하는 손을 사용하여 종이 타월로 마우스/쥐의 꼬리를 잡습니다. 마우스/쥐는 신체의 측면이 당신을 향하도록 중립적으로 엎드린 위치에 있어야 합니다.
참고: 생쥐/쥐는 구속으로 인해 어려움을 겪을 수 있지만 특정 통증 반응을 유발해서는 안 됩니다. 일시적인 통증 반응 이상이 관찰되는 경우, 진통제 투여가 필요할 수 있습니다. 수의사의 지도를 받으십시오. - 주로 사용하지 않는 엄지와 검지 사이의 골반 거들을 부드럽지만 단단히 잡습니다. 장골능은 만져질 수 있어야 하며 각 손가락의 원위 지골 중앙에 위치해야 합니다(그림 1C).
참고: 이 나이에는 물릴 염려가 없으므로 마우스/쥐 위에 종이 타월을 감쌀 필요가 없습니다. 더 큰 새끼 쥐를 가만히 두기 위해 P5-10 쥐의 경우 종이 타월을 사용해야 할 수도 있습니다. - 척추의 적절한 정렬을 보장하기 위해 꼬리 바닥을 부드럽게 회전합니다. 쥐/쥐의 골반은 요추의 척추 돌기가 작업 표면에 수직이 되도록 정사각형이어야 합니다.
- 70% 알코올 준비 패드로 마우스/쥐의 등쪽 요추 부위를 면봉으로 닦습니다.
- 해당되는 경우 주입 위치를 시각화하는 데 도움이 되도록 장골능에서 두개골 ~1-3mm를 절단합니다. 목표 영역의 시각화는 어린 마우스/쥐에서 더 쉽습니다. 털이 없는 신생아의 경우 추간 공간에서 움푹 들어간 곳을 볼 수 있습니다.
- L4-L5 또는 L5-L6 추간 공간, 장골능에서 두개골 ~1-3mm를 느끼거나 시각화합니다.
알림: 정확한 거리는 마우스/쥐의 크기와 나이에 따라 다릅니다.
- 주로 사용하는 손을 사용하여 종이 타월로 마우스/쥐의 꼬리를 잡습니다. 마우스/쥐는 신체의 측면이 당신을 향하도록 중립적으로 엎드린 위치에 있어야 합니다.
- 주사
- 주로 사용하는 손을 사용하여 마이크로리터 주사기의 중심을 잡고 마우스/쥐 척추에 대해 30-45도 각도로 배치합니다. 바늘의 경사가 마우스/쥐의 머리를 향하도록 하여 피부를 추간 공간까지 약 1-3mm caudle로 뚫습니다. 주사기의 각도 방향 때문에 피부에 삽입되는 지점은 추간 공간에서 약간 꼬리 방향입니다.
알림: 이 거리는 마우스/쥐의 나이와 크기에 따라 변경될 수 있습니다. - 나머지 단계는 마우스 >P21의 1.3.3-1.3.10 단계와 동일합니다.
- 주로 사용하는 손을 사용하여 마이크로리터 주사기의 중심을 잡고 마우스/쥐 척추에 대해 30-45도 각도로 배치합니다. 바늘의 경사가 마우스/쥐의 머리를 향하도록 하여 피부를 추간 공간까지 약 1-3mm caudle로 뚫습니다. 주사기의 각도 방향 때문에 피부에 삽입되는 지점은 추간 공간에서 약간 꼬리 방향입니다.
3. 쥐의 요추 IT 주사 >P21
참고: 문헌에 기술된 여러 가지 IT 주입 절차가 있으며, 이는 무마취 기술에서 보다 광범위한 수술 방법에 이르기까지 다양합니다 14,15. 최소 침습 기술을 사용한 직접 주사 절차는 가벼운 마취와 작은 피부 절개를 사용하여 설명됩니다. 이소플루란 가스와 같은 마취제를 사용하면 주사 중 억제, 근육 이완 및 움직임을 방지하는 데 도움이 될 수 있습니다. 주사 부위 위의 피부를 작게 절개하면 추간 공간을 시각화할 수 있고 두꺼운 피부를 뚫을 필요가 없어 주입의 정확도가 향상됩니다. 절개 부위로 인해 마취제와 진통제의 사용이 필요합니다. 연습을 통해, P21 이상의 쥐에서 사용자의 재량에 따라 마취 또는 절개 없이 요추 IT 주사를 시행할 수 있으며, 이는 계류 중인 제도적 요구 사항15. 실험실 동물에 대한 마취, 적절한 진통제 및 생존 수술에 관한 기관 지침 및 고려 사항을 따릅니다.
- 준비
- 1.1단계를 따릅니다. 단, 1.1.3단계의 주입량과 1.1.4단계의 바늘 크기는 예외입니다. 쥐의 주사량은 나이와 신체 크기에 따라 크게 다를 수 있습니다. 다양한 연령에서의 주입량에 대한 자세한 내용은 Discussion 섹션을 참조하십시오(표 1).
알림: 성인 쥐의 경우 27G x 1" 바늘을 사용하는 것이 좋으며, 작은 게이지 바늘은 구부러질 수 있고 짧은 바늘은 척추 내 공간을 적절하게 관통하지 못할 수 있습니다. 원하는 경우 더 긴(1.25-1.5") 바늘을 사용할 수 있습니다. - 선호되고 승인된 마취제를 사용하여 쥐를 마취합니다(기관에서 승인한 프로토콜에 따름).
참고: 여기에 설명된 절차를 위해 쥐는 이소플루란 가스와 리도카인의 1:1 혼합물을 사용하여 마취했습니다: 부피바카인은 국소 마취제로 사용되었습니다. 체온은 절차와 회복 전반에 걸쳐 승인된 외부 열원을 사용하여 유지되어야 합니다. - 각 동물에 대한 표준 무균 수술 부위 준비를 따릅니다. 간단히 등쪽 요추 부위를 면도하고 수술용 스크럽, 베타딘, 70% 이소프로필 알코올로 피부를 준비합니다.
- 1.1단계를 따릅니다. 단, 1.1.3단계의 주입량과 1.1.4단계의 바늘 크기는 예외입니다. 쥐의 주사량은 나이와 신체 크기에 따라 크게 다를 수 있습니다. 다양한 연령에서의 주입량에 대한 자세한 내용은 Discussion 섹션을 참조하십시오(표 1).
- 수술
- 쥐를 몸의 측면이 당신을 향하도록 중립적으로 엎드린 위치에 놓습니다.
- 골반 띠를 촉진하여 장골능(iliac crest)과 요추 접합부(lumbosacral junction)를 확인합니다. 쥐 >P21에서는 척추 과정을 쉽게 확인할 수 있습니다.
- 메스를 사용하여 L4-L5 또는 L5-L6 추간 공간을 1cm 절개합니다. 절개 부위는 피부와 기저 근막만 포함해야 하며 근육은 그대로 유지되어야 합니다.
참고: 절차의 나머지 부분 동안 견인기를 사용하여 피부를 열린 상태로 유지하는 것이 도움이 됩니다. - 주로 사용하지 않는 엄지와 검지 사이의 골반 거들을 부드럽지만 단단히 잡습니다. 장골능은 만져질 수 있어야 하며 각 손가락의 원위 지골 중앙에 위치해야 합니다(그림 1D). 모기 집게를 사용하여 등의 정중선을 따라 탐색하여 추간 공간을 찾습니다.
- 주사
- 주로 사용하는 손을 사용하여 마이크로리터 주사기의 중심을 잡고 L4-L5 또는 L5-L6 추간 공간에서 쥐 척추에 수직으로 배치합니다. 주사기의 플런저가 손의 과도한 움직임 없이 검지로 눌릴 수 있는지 확인하십시오. 바늘의 경사가 쥐의 머리를 향하게 하여 바늘로 추간 공간 위에 근육을 뚫습니다.
- 바늘을 추간 공간으로 전진시킵니다.
참고: 바늘은 척추 돌기 사이를 통과할 때 약간의 저항이 있을 수 있으며 이 틈을 통과하기 위해 주사기의 각도를 약간 조정해야 할 수도 있습니다. 그러나 척추에 수직으로 약 90도를 유지해야 합니다. 바늘이 척추 내 공간으로 들어갈 때 팝이 느껴질 것입니다. 마취 매개변수에 따라 꼬리 또는 다리 튕기는 것이 눈에 띄거나 눈에 띄지 않을 수 있습니다. 바늘은 척추 사이에 단단히 고정되어야 합니다. - 주사기가 제자리에서 벗어나지 않도록 주의하면서 플런저를 눌러 30초 이내에 용액을 전달하십시오.
참고: 생쥐에 주사하는 것과는 반대로, 이 방법을 사용하여 쥐 >P21의 주사기 각도를 줄이지 못할 수 있습니다. 과도한 압력 상승을 방지하기 위해 더 느린 속도로 더 많은 양을 주입해야 합니다. - 플런저를 완전히 누른 후 30-60초 동안 주사기를 제자리에 유지하여 용액이 소멸되고 역류를 방지합니다.
- 쥐에게서 주사기를 부드럽게 빼냅니다. 바늘을 빼낼 때 주사기를 회전시켜 역류를 방지합니다.
알림: 주사기를 돌릴 때 척수에 물리적 손상을 줄 수 있으므로 바늘을 앞으로 내밀지 않도록 주의하십시오. - 봉합사 또는 상처 클립과 같은 승인된 방법을 사용하여 피부 절개 부위를 봉합합니다. 이 프로토콜에 사용된 랫드의 경우, 5-0 PDS II 봉합사를 사용하여 피부를 연속적인 피내 또는 단순 단속 패턴으로 닫았습니다.
- 마취에서 쥐를 회복하십시오.
- 1.3.9-1.3.10 단계와 모든 수술 후 관리 지침을 따르십시오.
결과
많은 요인이 유전자 치료 벡터 형질도입에 영향을 미칠 수 있지만, 조직의 조직학적 염색은 요추내(IT) 주사의 성공을 결정하는 가장 정확한 방법으로 남아 있습니다. 주사 후 중추신경계(CNS) 내에서 유전자 치료 벡터가 광범위하고 균일하게 분포되어 있다는 것은 성공적인 시술을 나타냅니다. 그림 2C 는 주입 4개월 후 신생아(P1) 마우스에서 1.3 × 1011 vg/마우스의 용량으로 JeT 프로모터 하에서 약한 유비쿼터스 전이유전자 발현을 유도하는 자가 보완 AAV9 매개 유전자 치료의 성공적인 주입을 나타냅니다. 유전자 요법에 의해 전달된 전이유전자를 표적으로 하는 프로브를 사용한 RNAscope 분석은 요추, 경추 척수 및 뇌의 광범위한 분포를 보여줍니다. 간과 심장의 한 부분이 포함되어 있으며, 뇌척수액(CSF)을 직접 주사하더라도 유전자 치료 벡터가 여전히 말초 조직에 분포할 수 있음을 강조합니다.

그림 2: P1 주입 4개월 후 마우스 CNS 및 말초 조직의 염색된 5미크론 조직 절편. 빨간색 염색은 RNAscope를 통한 전이유전자 발현을 나타내고, 핵의 파란색 대조염색은 헤마톡실린을 통해 수행됩니다. (A) 대조군 제형 완충액을 사용한 주입. (B) AAV9 벡터(scAAV9_JeT-hDDX3Xopt-SpA)를 사용한 실질내 주입 실패. (C) AAV9 벡터(scAAV9_JeT-hDDX3Xopt-SpA)를 사용한 성공적인 요추 IT 주사. (B) 및 (C)에 사용된 유전자 치료 벡터는 1.3E11 vg/mouse의 번역 관련 용량으로 투여되었습니다. 스케일 바: 상단 패널(5mm); 하단 패널(1mm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 2B에서 볼 수 있듯이 요추 척수의 집중적인 발현과 뇌의 발현 부족은 척수의 실질 내 주사를 나타낼 수 있으며 실패한 주사로 간주되어야 합니다. 이것은 바늘이 척추 안으로 너무 깊숙이 삽입되어 척추내 공간을 지나 척수로 삽입될 때 발생합니다. 또한, 척수와 뇌에서 매우 낮거나 발현이 없는 경우(표시되지 않음)도 광범위한 CNS 분포가 예상되는 곳에서 벡터와 용량이 사용된다는 가정하에 실패한 off-target 주사로 간주되어야 합니다. 이것은 바늘을 충분히 멀리 삽입하지 않았거나 정중선의 측면에 있기 때문일 수 있습니다.
성공적인 주입에서 관찰된 발현 패턴은 다음과 같은 8가지 요인으로 인해 달라질 수 있습니다: (1) 주입 연령, (2) 기존 면역, (3) 주입 속도, (4) 유전자 치료 벡터, (5) 유전자 요법 용량, (6) 세포 표면 단백질, (7) tropism, (8) 해당되는 경우 transgene 발현을 유도하기 위한 적절한 promoter선택 6. 발현 패턴은 다를 수 있지만, AAV9와 같은 효과적인 벡터로 용량이 충분히 높은 경우 광범위하고 균일하며 광범위한 분포는 보편적일 것입니다.
요추 IT 주입의 성공을 확인하기 위해 조직학적 분석을 사용하는 것의 주요 한계는 부검을 수행하고 조직을 채취한 후 연구가 끝날 때까지 기다리는 긴 대기 시간과 대규모 유전자 치료 연구에서 모든 마우스의 조직을 처리하는 데 필요한 광범위한 자원입니다. 불행히도, 우리의 경험에 따르면 긍정적 또는 부정적 주사에 대한 즉각적이고 직접적인 지표는 신뢰할 수 없을 수 있습니다. 그러나 바늘이 척추 내 공간으로 들어갈 때 꼬리를 튕기는 반사는 실시간으로 성공적인 위치 지정을 나타내는 좋은 지표이며 성공적인 주입을 나타낼 가능성이 높습니다. 바늘이 마취되지 않은 쥐/쥐의 피부를 뚫고 바늘이 척수 내 공간으로 들어가는 것에 대해 꼬리를 튕기는 반응을 보일 때 경련을 혼동하지 마십시오. NMDA, 물질 P 및 리도카인과 같은 약리학적 제제를 훈련 중 또는 실험적 주사 용액과 혼합하여 사용하면 주입 성공의 보다 즉각적인 지표를 제공하는 것으로 보고되었습니다 9,11,24. 이러한 제제를 고려하는 경우 유전자 치료 벡터와의 호환성을 평가하는 것이 중요합니다.
토론
요추 IT 주사는 중추신경계 질환 치료를 위해 유전자 치료 벡터를 뇌척수액에 안정적으로 전달하는 빠르고 최소 침습적인 시술입니다 5,6. 이 절차는 번역과 관련이 있으며, 여기에 설명된 프로토콜은 신생아에서 성인에 이르기까지 모든 연령대의 마우스와 쥐에서 이 투여 경로를 수행하는 방법을 자세히 설명합니다. 모든 연령대의 생쥐와 쥐에 대해 이 프로토콜을 정의하고 지원 비디오를 제공하여 연구자가 유전자 치료 관리를 위해 이 방법을 채택하는 데 도움을 주는 것이 중요합니다. 우리 실험실의 경험에 따르면 이 프로토콜은 시간이 지남에 따라 여러 사용자와 연구에 걸쳐 일관되게 구현될 수 있습니다 18,25,26,27,28,29,30.
나이가 많은 마우스/쥐와 비교하여 젊은 마우스/쥐에서 요추 IT 주사를 수행할 때 중요한 차이점이 있으며, 특히 바늘이 척추에 삽입되는 각도와 주사하는 권장 부피가 가장 중요합니다. 보고된 요추 IT 주사량은 연구와 종에 따라 상당히 다르다31. 뇌척수액과 뇌피의 흐름을 방해하고, 불편함을 유발하며, 수두증, 허혈, 세포 손상 및 사망을 포함한 만성 신경학적 합병증을 유발할 수 있는 두개내압(ICP)의 장기적인 상승을 피하기 위해서는 주사량을 고려하는 것이 중요하다32,33. ICP는 CSF, 대뇌혈 및 CNS 조직의 부피에 의해 결정되며, 이는 체중과 직접적인 상관관계가 없습니다. 정상적인 기능에서 ICP는 CSF 용적, 뇌 혈액량, 호흡, 신체 위치, CSF 생성 속도 및 CSF가 혈액으로 배출되는 속도를 포함한 많은 요인에 의해 자동 조절됩니다33,34. 따라서 IT 주입량은 체중25,27,28,30 대신 CSF 특성(표 1)을 기준으로 결정해야 합니다. 각 종의 각 연령에 주입할 권장 용량은 굵게 표시되어 있습니다.
| IT 주입 볼륨 | 성인 CSF 수치 | |||||||
| P0-1 (μL) | P5-7 (μL) | P10 (μL) | >P21 (μL) | 총 부피(μL) | 생산 속도(μL/min) | 회전율 (h) | 두개내 압력(mm Hg) | |
| 마우스 | 3 | 5 | 5-10년 | 5-20명 | 30-40년 25,30분 | 0.32-0.3525,30 | 1.7-225,30 호 | 5.0 +/- 0.528 |
| 쥐 | 5 | 5-10 | 10-30 | 10-200 (20-75) | 150호25호 | 1.7-2.825 | 2-2.6625 | 8.6 +/- 1.7,27 |
표 1: 다양한 연령대의 마우스와 랫드에 대한 요추 IT 주사량 요약. 굵은 글씨체가 권장되며 안전하게 전달되었습니다. 가능한 최대 볼륨은 공식적으로 평가되지 않았습니다. 생쥐와 쥐의 알려진 CSF 매개변수(총 부피, 생산 속도, 회전율 및 두개내압)에 대한 추가 정보가 참조용으로 포함되어 있습니다.
일회성 bolus IT 주입량에 대한 상한 임계값에 대한 업계 전반에 걸쳐 지식이 부족합니다. CSF 부피가 알려진 성인 인간, 쥐 및 마우스에서 총 CSF 부피가 30% 증가해도 만성 부상이나 질병을 유발하지 않는 것으로 보인다 31,33,35,36. 어린 마우스나 신생아 마우스에서 알려진 CSF 부피가 부족하기 때문에 유사한 외삽이 불가능합니다. 일부 연구진에서는 어린 동물의 뇌척수액(CSF) 부피와 생산량을 조사하기 시작했다37. 이 분야에 대한 추가 조사가 입증될 때까지 주입량은 계속해서 연구자가 보고한 값에 따릅니다.
생쥐와 쥐는 특히 어린 나이에 치료하거나 주사량이 많을 때 근육 굴곡, 팔다리 확장, 빠른 호흡 또는 일시적인 뒷다리 마비를 유발할 수 있으며 몇 분 이내에 저절로 해결됩니다. 극단적인 경우, 급성 ICP 상승은 치명적일 수 있는 심혈관 및 호흡기 이상을 유발할 수 있습니다32,33. 24시간 후에도 시술 후 이상이 지속되면 마우스/쥐를 연구에서 제거하고 인도적으로 안락사시켜야 합니다. 지속적인 뒷다리 마비는 바늘이 너무 많이 삽입되어 척수에 영향을 미치면 발생할 수 있습니다. 이것은 요추 IT 주사를 수행하는 동안 흔한 실수 때문일 수 있습니다 : 플런저를 누르면서 꼬리를 튕긴 후 주사기를 움직입니다. 주사기와 바늘의 움직임은 피해야 합니다. 첫 번째 펑크로 올바른 위치를 얻을 수 없는 경우 동일한 위치에서 두 번째 시도를 할 수 있습니다. 두 번째 시도도 실패하면 다음 추간 공간을 대상으로 바늘 위치를 변경해 보십시오. 여러 개의 바늘 찌르기는 이후에 성공적인 주입의 누출로 이어질 수 있습니다.
요추 IT 주사에 능숙해지는 데는 시간이 걸릴 수 있습니다. 주사를 말단 절차로 시행하려면 Evans blue 또는 0.2 microns filtered McCormick green dye(그림 3)와 같은 승인된 염료 용액을 사용하거나 Representative Results 섹션에서 다루는 약리제를 사용하여 위의 프로토콜을 따르십시오. 주입이 성공했는지 실패했는지 1분 이내에 쉽게 알 수 있기 때문에 문제를 해결하고 주입을 마스터하기 위해 염료를 사용하는 것이 좋습니다. 염료를 사용한 연습은 동물이 CNS에 직접 투여될 때 염료에 대한 반응을 일으킬 수 있으므로 비생존 절차에만 해당됩니다. 이 반응은 성공적인 주사 후 1분 이내에 발생할 수 있으며 빠른 가려움증과 꿈틀거리는 움직임이 특징입니다. 불편함을 최소화하기 위해 이러한 반응이 관찰되면 동물을 즉시 안락사시켜야 합니다. 성공적인 염료 주입 후 염료는 척추에 국한된 상태를 유지하고(주변 말초 조직에는 염료가 없음) 척추를 따라 소뇌, 대뇌 및 후각구로 이동합니다. P1에서 피부는 염료가 꼬리의 척추를 따라 내려가는 것을 볼 수 있을 만큼 투명합니다. 염료가 몇 분 이내에 뇌에 도달하지 않으면 주입이 실패합니다.

그림 3: 요추 IT 주사를 성공적으로 시행한 후 뇌에서 맥코믹 녹색 염료. 모든 뇌는 5μL 염료를 주입한 P21 마우스에서 추출한 것으로, 복부 뷰에 표시되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
바이러스 역가 및 용량과 같은 전임상 시험 설계와 관련된 관련 매개변수에 대한 추가 정보는 이전에 발표된 문헌고찰 3,6,31을 참조한다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
AAV9 벡터를 제조해 준 UT Southwestern AAV Viral Vector Core Facility와 그림 2에 제시된 조직을 처리하고 염색한 Gray Lab의 연구 과학자인 Yuhui Hu에게 감사의 뜻을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
참고문헌
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16 (2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778 (2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565 (2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229 (2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31 (2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463 (2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761 (2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575 (2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217 (2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392 (2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650 (2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832 (2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286 (2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413 (2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197 (2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유