Method Article
腰椎鞘内注射基因治疗载体靶向小鼠和大鼠中枢神经系统
摘要
腰椎鞘内注射代表了向中枢神经系统提供基因治疗的转化相关给药途径。这种用于新生儿、幼年和成年小鼠和大鼠腰椎鞘内注射的综合标准化方案旨在指导研究人员采用该技术进行临床前基因治疗研究。
摘要
一种针对中枢神经系统治疗神经系统疾病的方法涉及利用腰椎鞘内给药途径。这种方法绕过血脑屏障,直接进入脑脊液,并优先靶向中枢神经系统内的细胞。多项已发表的采用腰椎鞘内注射途径的临床前研究为基因治疗临床试验的发展做出了贡献;但是,所描述的协议是可变的,并且分散在多个资源中。在这里,提出了一套用于新生儿、幼年和成年小鼠和大鼠腰椎鞘内注射的全面方案,用于临床前基因治疗研究。通过适当的培训,这种注射技术可以快速可靠地进行。除了详细说明每个发育阶段的注射方案外,还讨论了可能影响研究结果的相关参数,例如注射量。为了证明腰椎鞘内注射靶向中枢神经系统的应用,在注射成功或不成功后,展示了腺相关病毒血清型 9 在脑、脊髓和外周组织中的表达。
引言
治疗需要整体中枢神经系统 (CNS) 递送但其他方面是基因治疗良好候选者的神经系统疾病的挑战,这在很大程度上归因于对 CNS 和相关细胞类型的低效靶向1。正在进行大量研究,以通过工程递送载体优化全球 CNS 细胞和组织靶向 1,2。然而,使用病毒载体和给药途径的某些组合,目前的基因治疗载体技术仍然可以实现相当广泛的载体递送 3,4。目前从一次性治疗中获得广泛 CNS 递送的金标准是使用腺相关病毒血清型 9 (AAV9) 并直接注射到脑脊液 (CSF) 中。
直接 CSF 注射有三种典型的给药途径:腰椎鞘内注射 (IT)、脑室内注射 (ICV) 和脑池内注射 (ICM)5。这些给药途径中的每一种都会导致 CNS 和外周组织中不同的生物分布模式,但它们都具有绕过血脑屏障 (BBB) 到达 CNS 中导致神经系统疾病病理学和表型的细胞的好处6。腰椎 IT 注射是人类临床给药的标准,因为临床程序是常规和直接的,与 ICV 和 ICM 注射相比,侵入性更小。
腰椎 IT 注射是一种成熟的技术,很容易用于麻醉和镇痛领域,第一篇论文发表于 18857。成年小鼠腰椎 IT 注射的第一个方案于 1980 年发表8,此后被广泛采用和审查9。对这些协议进行了轻微的调整或改进 10,11,12,包括产品保存技术 13。成年大鼠腰椎 IT 注射方案也于 1976 年首次发表,其中慢性给药的导管插入术14 和一次性治疗的直接注射15。最近,研究小组发布了对新生或幼年小鼠和大鼠进行腰椎 IT 注射的方案16,17。
该技术的广泛采用和验证以绕过 CNS 中的 BBB 和靶细胞,导致多项成功的基因治疗临床前和临床研究用于治疗神经系统疾病。小鼠、大鼠和非人灵长类动物模拟神经系统疾病的积极疗效和安全性数据激起了人们对这些疾病临床益处潜力的兴奋和兴趣 18,19,20,21,22,23。其中一些研究现在正处于临床试验阶段(例如,clinicaltrials.gov 标识符 NCT02362438、NCT04737460、NCT03381729 和 NCT05518188)3,6。在本文中,描述了一种在不同年龄的小鼠和大鼠中进行腰椎 IT 注射的简单方案,无需去除 CSF,可用于转化基因治疗项目。该协议类似于已广泛采用的可用协议;但是,将这些相关协议放在一个地方以便于访问和参考以及随附的视频视觉效果是有价值的。该方案解释了在出生后第 0-1 天对新生小鼠和大鼠以及幼年小鼠和大鼠 P21 进行注射,具有小鼠 P1 腰椎 IT 注射成功和不成功的代表性结果。在讨论中,讨论了执行此程序时需要仔细注意的常见错误和具体细节,以及有关如何在开始临床前研究之前练习这些注射的建议。
研究方案
此处描述的程序已获得德克萨斯大学西南医学中心的机构动物护理和使用委员会 (IACUC) 的批准。野生型 C57BL6/J 雄性和雌性小鼠,年龄为 P1-P28,用于涉及小鼠的方案。野生型 Sprague-Dawley 雄性和雌性大鼠,年龄为 P1-P56,用于涉及大鼠的方案。除了第 3 节中描述的生存手术外,所有其他手术都被认为只会引起短暂的不适,不需要使用麻醉剂或镇痛药。个人应监测实验动物的不适,而不仅仅是短暂的不适,并就麻醉剂和镇痛药的必要性向他们的 IACUC 和兽医工作人员寻求指导。 材料表中提供了所用试剂和设备的详细信息。
1. 小鼠腰椎 IT 注射 >P21
- 制备
- 制备注射液,包括所需浓度的基因治疗载体和对照溶液(通常是载体生产中使用的制剂缓冲液)。注射液应该是无菌的,并且在整个手术过程中应保持无菌。
注意:在手术过程中,所有溶液都应保持在冰上。 - 收集并消毒所有材料,包括注射器和针头、移液管和注射液。遵循有关使用生物安全柜和注射剂暴露的机构指南。此处描述的程序是在 2 级生物安全柜中进行的。
- 使用微量移液器,测量所需体积的注射液并将其转移到无菌石蜡膜上。通常使用 5 μL 的进样体积,并将其视为成年小鼠 >P21 的目标体积(表 1)。
注意: 如有必要,可以增加音量;然而,应密切监测动物对较大注射量的不良反应。有关注射量和不良反应的详细信息,请参阅讨论部分。溶液也可以直接从移液器吸头转移到注射器上,或者可以使用校准的气密微升注射器直接测量注射液体积。 - 用 30 G 0.5 英寸针头将溶液吸入微升注射器中,注意不要吸入任何气泡。
注意:针规和长度会影响皮肤渗透。在考虑要使用的注射器的尺寸时,注射量不应小于注射器容量的 10%。对于大于注射器容量 50% 的体积,请确保可以用食指轻松按下柱塞。如果无法轻易压下柱塞,请使用更大容量的注射器。
- 制备注射液,包括所需浓度的基因治疗载体和对照溶液(通常是载体生产中使用的制剂缓冲液)。注射液应该是无菌的,并且在整个手术过程中应保持无菌。
- 抑制
- 用惯用手,在纸巾上握住有意识的(未麻醉的)老鼠的尾巴。纸巾将有助于约束、镇静并防止老鼠咬人。鼠标应处于中立俯卧位置,身体的侧面面向您。
注意:在手术前没有必要训练或使小鼠适应这种约束。小鼠可能会因约束而挣扎,但不应引起特定的疼痛反应。如果观察到的疼痛反应超过短暂,则可能需要服用镇痛药;寻求兽医指导。 - 用非惯用手将纸巾的一部分折叠在鼠标的头部和上半身,并牢牢抓住非惯用拇指和食指之间的骨盆带。确保手掌呈杯状,放在鼠标头周围。小鼠的髂嵴应该是可触及的,并位于每个手指远端指骨的中心(图 1A,B)。
注意:避免使用手巾或纸巾不应损害呼吸。 - 轻轻旋转尾巴的底部,以确保脊柱正确对齐。小鼠的骨盆应该是方形的,这样腰椎的椎突垂直于工作表面。
- 用 70% 酒精制备垫擦拭小鼠的背侧腰部区域。
- 将头发从颅骨 ~2-6 毫米分开到髂嵴,以帮助可视化注射位置。
- 感觉 L4-L5 或 L5-L6 椎间隙,颅骨到髂嵴 ~2-6 毫米。
注意:确切的距离因鼠标的大小和使用年限而异。
- 用惯用手,在纸巾上握住有意识的(未麻醉的)老鼠的尾巴。纸巾将有助于约束、镇静并防止老鼠咬人。鼠标应处于中立俯卧位置,身体的侧面面向您。
- 注射
- 用惯用手握住微升注射器的中心,将其垂直于小鼠脊柱放置在 L4-L5 或 L5-L6 椎间隙处。确保可以用食指按下注射器的柱塞,而手不会过度移动。将针头的斜面朝向小鼠头部,刺穿椎间隙的皮肤。
- 当在针尖感觉到椎间间隙周围的骨头边缘时,将注射器的角度减小到 30-45 度(图 1A)。
- 针头应滑入椎间隙,导致突然的尾巴甩动,并应紧紧夹在椎骨之间。
- 注意不要移位注射器,稳定按下柱塞以在 10 秒内输送溶液。
- 完全按下柱塞后,将注射器固定到位 15-30 秒,以允许溶液消散并防止回流。
- 以相同的 30-45 度入射角平稳缓慢地从鼠标中抽出注射器。当针头抽出时,旋转注射器以防止回流。
注意: 旋转注射器时要小心不要推进针头,因为这可能会对脊髓造成物理损伤。 - 将鼠标从约束装置中松开,然后将其放回原壳笼中。
- 注射后监测小鼠的异常行走、运动障碍、呼吸异常和协调性。有关不良反应的更多详细信息,请参阅讨论。
- 按照制造商的建议清洁设备。对于多次注射,建议为每种基因治疗载体和对照溶液使用不同的注射器。
注意:可拆卸针头可以多次清洁、消毒和重复使用;但是,不应使用钝针,因为它们会伤害动物并增加漏服的可能性。钝针不容易刺穿皮肤,应适当丢弃。如果注射器有限,建议在进行基因治疗载体之前完成所有载体注射,并在施用更高剂量之前注射最低的基因治疗剂量。 - 遵循动物之间设备消毒的机构指南。
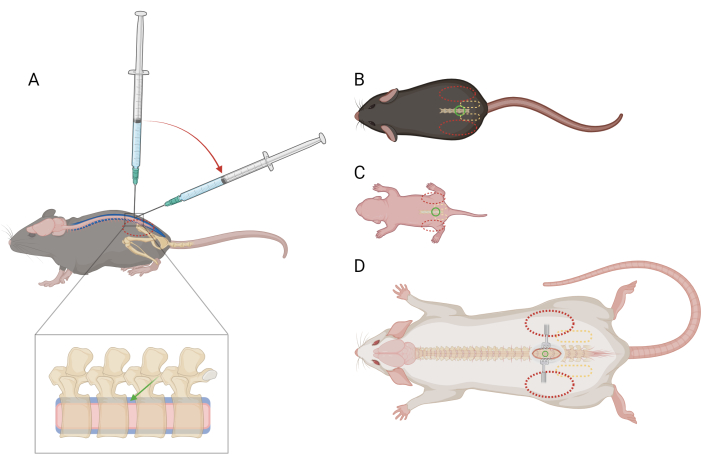
图 1:小鼠和大鼠腰椎鞘内注射的手指和注射器放置示意图。 (A) 小鼠 >P21) 的侧视图,显示腰椎 IT 注射过程中针头放置和注射器角度过渡。红色虚线椭圆表示手指在鼠标髂嵴上的位置。脊柱的放大视图显示了鞘内间隙(蓝色)和针头的大致位置(绿色箭头)和脊髓(粉红色)。(B) 小鼠 >P21)、(C) 小鼠 D) 大鼠 >P21 的背视图,带有针头放置(绿色圆圈)、骨盆带(黄色虚线椭圆形)和手指放置(红色虚线椭圆形)的参考点。切口部位和牵开器也描绘在 (D) 中。 请单击此处查看此图的较大版本。
2. 小鼠和大鼠的腰椎 IT 注射
- 制备
- 按照步骤 1.1 进行作。唯一的例外是步骤 1.1.3 中的进样体积。
注意:新生小鼠 (P0-P1) 的推荐注射量不应超过 3 μL,幼年小鼠 (P5-P7) 的推荐注射量不应超过 5 μL,幼年小鼠 (P10) 的推荐注射量不应超过 10 μL。新生大鼠 (P0-P1) 的推荐注射量不应超过 5 μL,幼年大鼠 (P5-P7) 的推荐注射量不应超过 10 μL,幼年大鼠 (P10) 的推荐注射量不应超过 30 μL(表 1)。
- 按照步骤 1.1 进行作。唯一的例外是步骤 1.1.3 中的进样体积。
- 抑制
- 用惯用手在纸巾上握住老鼠/老鼠的尾巴。小鼠/大鼠应处于中立俯卧姿势,身体的侧面面向您。
注意:小鼠/大鼠可能会因约束而挣扎,但不应引起特定的疼痛反应。如果观察到的疼痛反应超过短暂,则可能需要服用镇痛药;寻求兽医指导。 - 轻轻但牢固地抓住非惯用拇指和食指之间的骨盆带。髂嵴应该是可触及的,并位于每个手指远端指骨的中心(图1C)。
注意:在这个年龄,不用担心被咬,所以不需要用纸巾包住老鼠/老鼠。可能需要在 P5-10 大鼠中使用纸巾以保持较大的大鼠幼崽静止不动。 - 轻轻旋转尾巴的底部,以确保脊柱正确对齐。小鼠/大鼠的骨盆应该是方形的,这样腰椎的椎突垂直于工作表面。
- 用 70% 酒精制备垫擦拭小鼠/大鼠的背侧腰部区域。
- 将头发(如果适用)从颅骨 ~1-3 毫米到髂嵴分开,以帮助可视化注射位置。在年轻的小鼠/大鼠中,目标区域的可视化更容易。在无毛新生儿中,椎间隙可见凹陷。
- 感觉或观察 L4-L5 或 L5-L6 椎间隙,颅骨到髂嵴 ~1-3 毫米。
注意:确切的距离取决于小鼠/大鼠的大小和年龄。
- 用惯用手在纸巾上握住老鼠/老鼠的尾巴。小鼠/大鼠应处于中立俯卧姿势,身体的侧面面向您。
- 注射
- 用惯用手握住微升注射器的中心,并将其与小鼠/大鼠脊柱成 30-45 度角。将针头的斜面朝向小鼠/大鼠的头部,刺穿距椎间隙约 1-3 毫米的皮肤。由于注射器的方向是倾斜的,皮肤上的插入点略微偏向椎间隙的尾部。
注意: 此距离可能会随着小鼠/大鼠的年龄和大小而变化。 - 其余步骤与小鼠 >P21) 的步骤 1.3.3-1.3.10 相同。
- 用惯用手握住微升注射器的中心,并将其与小鼠/大鼠脊柱成 30-45 度角。将针头的斜面朝向小鼠/大鼠的头部,刺穿距椎间隙约 1-3 毫米的皮肤。由于注射器的方向是倾斜的,皮肤上的插入点略微偏向椎间隙的尾部。
3. 大鼠腰椎 IT 注射 >P21
注意:文献中描述了多种 IT 注射程序,从未麻醉技术到更广泛的手术方法14,15。描述了使用微创技术直接注射的手术,使用轻度麻醉和小皮肤切口。使用麻醉剂,例如异氟醚气体,可以帮助克制、放松肌肉组织并防止注射过程中的运动。在注射部位的皮肤上做一个小切口可以提高注射的准确性,因为它可以观察椎间间隙并且无需穿刺厚皮肤。由于切口,需要使用麻醉剂和镇痛药。通过实践,可以在没有麻醉或切口的情况下对 P21 以上的大鼠进行腰椎 IT 注射,由用户自行决定并等待机构要求15。遵循有关实验室动物麻醉、适当镇痛药和存活手术的机构指南和注意事项。
- 制备
- 按照步骤 1.1 进行作。唯一的例外是步骤 1.1.3 中的进样体积和步骤 1.1.4 中的针尺寸。大鼠的注射量可能因年龄和体型而异。有关不同年龄注射量的更多信息,请参阅讨论部分(表 1)。
注意:建议成年大鼠使用 27 G x 1“ 针头,因为较小规格的针头可能会弯曲,而较短的针头可能无法充分穿透鞘内间隙。如果需要,可以使用更长的 (1.25-1.5“) 针头。 - 使用首选和批准的麻醉剂麻醉大鼠(遵循机构批准的方案)。
注意:对于此处描述的程序,使用异氟醚气体和利多卡因的 1:1 混合物麻醉大鼠:使用布比卡因作为局部麻醉剂。在整个手术和恢复过程中,应使用经批准的外部热源保持体温。 - 为每只动物遵循标准的无菌手术部位准备。简而言之,剃掉背侧腰部区域,并用手术磨砂膏、优碘和 70% 异丙醇准备皮肤。
- 按照步骤 1.1 进行作。唯一的例外是步骤 1.1.3 中的进样体积和步骤 1.1.4 中的针尺寸。大鼠的注射量可能因年龄和体型而异。有关不同年龄注射量的更多信息,请参阅讨论部分(表 1)。
- 手术
- 将大鼠置于中立俯卧位,身体的侧面面向您。
- 触诊骨盆带,识别髂嵴和腰骶交界处。在大鼠 >P21 中,可以很容易地识别椎突。
- 使用手术刀在 L4-L5 或 L5-L6 椎间隙上做 1 厘米的切口。切口应仅涉及皮肤和下面的筋膜,保持肌肉完整。
注意:在手术的剩余时间里,使用牵开器保持皮肤张开是有帮助的。 - 轻轻但牢固地抓住非惯用拇指和食指之间的骨盆带。髂嵴应该是可触及的,并位于每个手指远端指骨的中心(图1D)。使用蚊子镊子沿着背部中线探查,以定位椎间隙。
- 注射
- 用惯用手握住微升注射器的中心,并将其垂直于大鼠脊柱放置在 L4-L5 或 L5-L6 椎间隙处。确保可以用食指按下注射器的柱塞,而手不会过度移动。将针头的斜面朝向大鼠的头部,用针头在椎间隙上刺穿肌肉。
- 将针头推进到椎间隙。
注意:针头在椎突之间通过时可能会有轻微的阻力,并且可能需要稍微调整注射器的角度才能通过这个间隙。但是,它应保持大约 90 度,垂直于脊柱。当针头进入鞘内间隙时,会感觉到爆裂声。根据麻醉参数,尾巴或腿部甩动可能明显,也可能不明显。针头应紧紧夹在椎骨之间。 - 小心不要将注射器移出位置,按下柱塞以在 30 秒内输送溶液。
注:与小鼠注射相反,使用此方法可能无法减小大鼠 >P21 的注射器角度。较大的体积应以较慢的速度进样,以防止压力过度积聚。 - 完全按下柱塞后,将注射器固定到位 30-60 秒,以允许溶液消散并防止回流。
- 从大鼠身上顺利取出注射器。当针头抽出时,旋转注射器以防止回流。
注意: 旋转注射器时要小心不要推进针头,因为这可能会对脊髓造成物理损伤。 - 使用经批准的方法(如缝合或伤口夹)闭合皮肤切口。对于该方案中使用的大鼠,使用 5-0 PDS II 缝合线以连续的皮内或简单的间断模式闭合皮肤。
- 将大鼠从麻醉中恢复过来。
- 遵循步骤 1.3.9-1.3.10 和所有术后护理指南。
结果
尽管许多因素会影响基因治疗载体转导,但组织组织学染色仍然是确定腰椎鞘内 (IT) 注射成功的最准确方法。注射后基因治疗载体在中枢神经系统 (CNS) 内广泛而均匀的分布表明手术成功。 图 2C 表示注射后 4 个月,在新生 (P1) 小鼠中以 1.3 ×10 11 vg/小鼠的剂量成功注射自互补的 AAV9 介导的基因疗法,在 JeT 启动子下驱动弱的普遍转基因表达。使用靶向基因疗法递送的转基因的探针进行 RNAscope 分析,揭示了在腰椎脊髓、颈脊髓和大脑中的广泛分布。包括肝脏和心脏的一部分,以强调即使直接注射脑脊液 (CSF),基因治疗载体仍然可以分布到外周组织。

图 2:注射 4 个月后在 P1 处对小鼠 CNS 和外周组织进行染色的 5 微米组织切片。 红色染色表示通过 RNAscope 进行转基因表达,蓝色细胞核复染通过苏木精完成。(A) 用对照制剂缓冲液进样。(B) 使用 AAV9 载体 (scAAV9_JeT-hDDX3Xopt-SpA) 进行实质内注射不成功。(C) 使用 AAV9 载体 (scAAV9_JeT hDDX3Xopt-SpA) 成功注射腰椎 IT。(B) 和 (C) 中使用的基因治疗载体以 1.3E11 vg/小鼠的翻译相关剂量给药。比例尺:顶板 (5 mm);底板 (1 mm)。 请单击此处查看此图的较大版本。
如 图 2B 所示,腰脊髓中的集中表达与大脑中的表达缺乏配对,可能表明脊髓实质内注射,应被视为注射失败。当针头插入脊柱太深、越过鞘内间隙并进入脊髓时,就会发生这种情况。此外,在脊髓和大脑中非常低或没有表达(未显示)也应被视为脱靶注射失败,假设在预期 CNS 分布较宽的地方使用载体和剂量。这可能是由于针头插入的距离不够远或位于中线的外侧。
由于以下八个因素,从成功注射中观察到的表达模式可能会有所不同:(1) 注射年龄,(2) 预先存在的免疫力,(3) 输注速率,(4) 基因治疗载体,(5) 基因治疗剂量,(6) 细胞表面蛋白,(7) 嗜性,以及 (8) 如果适用,选择适当的启动子来驱动转基因表达6.虽然表达模式可能不同,但只要剂量足够高且使用有效载体(如 AAV9)即可,广泛、均匀、广泛的分布将是普遍的。
使用组织学分析来确认腰椎 IT 注射成功的主要限制是等待时间长 - 等到研究结束,在进行尸检并收集组织之后 - 如果在大型基因治疗研究中处理所有小鼠的组织,则需要大量资源。不幸的是,我们的经验是,阳性或阴性注射的直接和直接指标可能不可靠;然而,当针头进入鞘内间隙时,甩尾反射是实时定位成功的良好指标,可能表明注射成功。不要混淆抽搐,因为针头刺穿未麻醉的小鼠/大鼠的皮肤,对针头进入鞘内间隙的反应是甩尾巴。据报道,在训练中使用 NMDA、P 物质和利多卡因等药物或与实验注射液混合,可以更直接地表明注射成功 9,11,24。如果考虑这些药物,评估它们与基因治疗载体的相容性很重要。
讨论
腰椎 IT 注射是一种快速且微创的手术,可可靠地将基因治疗载体输送到 CSF 中,以治疗 CNS 疾病 5,6。该程序具有翻译相关性,此处描述的方案详细说明了如何在从新生儿到成人的所有年龄段的小鼠和大鼠中执行这种给药途径。重要的是要为所有年龄的小鼠和大鼠定义该协议,并提供支持视频,以帮助研究人员采用这种方法进行基因治疗管理。我们实验室的经验是,该协议可以在多个用户和研究中随着时间的推移一致地实施18、25、26、27、28、29、30。
与老年小鼠/大鼠相比,年轻小鼠/大鼠进行腰椎 IT 注射时存在重要差异,最明显的是针头插入脊柱的角度和推荐的注射量。报告的腰椎 IT 注射量因研究和物种而异31。考虑注射量对于避免颅内压 (ICP) 的长期升高很重要,颅内压 (ICP) 会损害脑脊液和脑血的流动,引起不适,并导致慢性神经系统并发症,包括脑积水、缺血、细胞损伤和死亡32,33。ICP 由 CSF、脑血和 CNS 组织的体积决定,而 CSF 和 CNS 组织的体积不能与体重直接相关。在正常功能下,ICP 受许多因素的自动调节,包括 CSF 体积、脑血容量、呼吸、体位、CSF 生成速率和 CSF 引流到血液中的速度33,34。因此,应根据 CSF 特性(表 1)而不是体重 25,27,28,30 来确定 IT 注射量。每个物种在每个年龄的推荐注射量以粗体表示。
| IT 注入量 | 成人 CSF 值 | |||||||
| P0-1 (微升) | P5-7 (微升) | P10 (微升) | >P21 (微升) | 总体积 (μL) | 生产速率 (μL/min) | 失误 (h) | 颅内压 (mm Hg) | |
| 小 鼠 | 3 | 5 | 5-10 | 5-20 | 30-4025,30 | 0.32-0.3525,30 | 1.7-225,30 | 5.0 +/- 0.528 |
| 大 鼠 | 5 | 5-10 | 10-30 | 10-200 (20-75) | 15025 元 | 1.7-2.825 | 2-2.6625 | 8.6 +/- 1.7,27 |
表 1:不同年龄小鼠和大鼠的腰椎 IT 注射量总结。 建议使用粗体值,并且已安全交付。尚未正式评估最大可能卷。包括有关小鼠和大鼠已知 CSF 参数(总体积、产生速率、周转率和颅内压)的其他信息以供参考。
整个领域缺乏关于一次性推注 IT 注射量上限的知识。在已知 CSF 体积的成年人、大鼠和小鼠中,CSF 总体积增加 30% 似乎不会导致慢性损伤或疾病 31,33,35,36。幼年或新生小鼠中缺乏已知的 CSF 体积,因此不可能进行类似的推断。一些小组开始研究年轻动物的 CSF 体积和产量37。在这些领域的额外调查得到证实之前,注射量将继续受研究者报告的值的约束。
小鼠和大鼠,尤其是在年轻时或用高注射量治疗时,可能会引起肌肉弯曲、四肢伸展、呼吸急促或暂时性后肢麻痹,这些应该会在几分钟内自行消退。在极端情况下,急性 ICP 升高会导致心血管和呼吸系统异常,这可能是致命的32,33。如果 24 小时后任何术后异常仍然存在,则应将小鼠/大鼠从研究中移出并人道安乐死。如果针头插入得太深,影响脊髓,则可能导致持续性后肢麻痹。这可能是由于进行腰椎 IT 注射时的一个常见错误:在按下柱塞的同时,抽尾后注射器会移动。应避免注射器和针头移动。如果初始穿刺无法获得正确的位置,则可以在同一位置进行第二次尝试。如果第二次尝试也未成功,请尝试改变针头位置以瞄准下一个椎间隙。请注意,多次针刺可能会导致随后成功注射的泄漏。
精通腰椎 IT 注射可能需要时间。要将注射作为最终程序进行练习,请按照上述方案使用经批准的染料溶液,例如伊文思蓝或 0.2 微米过滤的麦考密克绿染料(图 3)或使用代表性结果部分中涉及的药物。建议使用染料来排除故障并掌握进样过程,因为很容易在 1 min 内判断进样是成功还是失败。使用染料的练习仅用于非存活程序,因为动物在直接施用染料时会对染料产生反应。这种反应可以在注射成功后一分钟内发生,其特征是快速瘙痒和蠕动。一旦观察到这种反应,应立即对动物实施安乐死,以尽量减少不适。成功练习染料注射后,染料将保持在脊柱中(附近外周组织中没有染料),并沿脊柱向上移动到小脑、大脑和嗅球。在 P1 处,皮肤足够透明,可以看到染料沿着尾部的脊柱向下移动。如果染料在几分钟内没有到达大脑,则注射失败。

图 3:成功练习腰椎 IT 注射后大脑中的麦考密克绿染料。 所有大脑均来自注射了 5 μL 染料的 P21 小鼠,并显示在腹视图中。 请单击此处查看此图的较大版本。
有关临床前试验设计的相关参数(如病毒滴度和剂量)的更多信息,请参阅以前发表的综述 3,6,31。
披露声明
作者声明没有利益冲突。
致谢
我们要感谢 UT 西南 AAV 病毒载体核心设施制造 AAV9 载体,感谢格雷实验室的研究科学家 Yuhui 胡 对 图 2 中所示的组织进行处理和染色。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
参考文献
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16 (2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778 (2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565 (2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229 (2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31 (2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463 (2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761 (2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575 (2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217 (2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392 (2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650 (2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832 (2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286 (2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413 (2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197 (2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。