Method Article
マウスおよびラットにおける中枢神経系を標的とした遺伝子治療ベクターの腰椎髄腔内注射
要約
腰椎髄腔内注射は、中枢神経系に遺伝子治療を実施するための翻訳的に関連する投与経路を表しています。新生児、若年、成体のマウスおよびラットにおける腰椎髄腔内注射のためのこの包括的な標準化されたプロトコルは、研究者がこの技術を前臨床遺伝子治療研究に採用する際の指針となることを目的としています。
要約
神経疾患を治療するために中枢神経系を標的とする1つの方法には、腰椎髄腔内投与経路の利用が含まれます。このアプローチは、血液脳関門を迂回して脳脊髄液に直接アクセスし、中枢神経系内の細胞を優先的に標的にします。腰椎髄腔内注射ルートを採用した複数の発表された前臨床研究は、遺伝子治療の臨床試験の開発に貢献しています。ただし、説明されているプロトコルは変動し、複数のリソースに分散しています。ここでは、前臨床遺伝子治療研究のための新生児、若年、および成体のマウスおよびラットにおける腰椎髄腔内注射の包括的なプロトコルのセットが提示されます。適切なトレーニングを受ければ、この注入技術は迅速かつ確実に行うことができます。各開発段階での注入プロトコルを詳しく説明するだけでなく、研究結果に影響を与える可能性のある注入量などの関連パラメータについても説明します。中枢神経系を標的とするための腰椎髄腔内注射の適用を実証するために、脳、脊髄、および末梢組織におけるアデノ随伴ウイルス血清型9の発現が、注射の成功または失敗後に提示されます。
概要
全体的な中枢神経系(CNS)の送達を必要とする神経疾患の治療における課題は、それ以外では遺伝子治療の有力な候補であり、主にCNSおよび関連する細胞タイプの非効率的な標的化に起因しています1。エンジニアリングデリバリービークル1,2により、グローバルなCNS細胞および組織ターゲティングを最適化するために、かなりの量の研究が進行中です。しかし、現在の遺伝子治療用ベクター技術では、ウイルスベクターと投与経路の特定の組み合わせを使用して、合理的に広範なベクター送達を達成することができます3,4。1回の治療で広範なCNS送達を得るための現在のゴールドスタンダードは、アデノ随伴ウイルス血清型9(AAV9)を脳脊髄液(CSF)への直接注射と一緒に使用することです。
CSFの直接注射には、腰椎髄腔内(IT)、脳室内(ICV)、槽内(ICM)の3つの典型的な投与経路があります5。これらの投与経路はそれぞれ、CNSと末梢組織に異なる生体内分布パターンをもたらしますが、それらはすべて、血液脳関門(BBB)をバイパスして神経疾患の病理と表現型に寄与するCNSの細胞に到達するという利点があります6。腰椎IT注射は、臨床手順が日常的で簡単で、ICVやICM注射に比べて侵襲性が低いため、ヒトでの臨床薬物送達の使用の標準です。
腰椎IT注射は、麻酔薬や鎮痛薬の分野ですぐに使用できる確立された技術であり、最初の論文は1885年に発表されました7。成体マウスにおける腰椎IT注射の最初のプロトコルは1980年に発表され8、それ以来広く採用され、レビューされています9。これらのプロトコルに対するわずかな調整または改善がなされた10、11、12、これには、製品保存技術13が含まれる。成体ラットにおける腰椎IT注射のプロトコルも1976年に初めて発表され、慢性投与のためのカテーテル法14と1回限りの治療のための直接注射15が行われた。最近では、グループは新生児または若年マウスおよびラット16,17における腰椎IT注射のプロトコルを公開しています。
この技術が BBB をバイパスし、中枢神経系の標的細胞をバイパスする広範な採用と検証により、神経疾患の治療のための複数の遺伝子治療前臨床および臨床研究が成功しています。神経疾患をモデル化するマウス、ラット、および非ヒト霊長類における肯定的な有効性および安全性のデータは、これらの疾患に対する臨床的利益の可能性について興奮と関心をそそった18,19,20,21,22,23。これらの研究のうち、一握りは現在臨床試験中です(例えば、clinicaltrials.gov 識別子 NCT02362438、NCT04737460、NCT03381729、およびNCT05518188)3,6。この記事では、CSFを除去せずに、トランスレーショナル遺伝子治療プロジェクトに採用できる、さまざまな年齢のマウスとラットの腰椎IT注射の簡単なプロトコルについて説明します。このプロトコルは、広く採用されているすでに利用可能なプロトコルと似ています。ただし、これらの関連プロトコルを1か所に引用して、アクセスと参照を容易にすること、および付随するビデオビジュアルには価値があります。このプロトコルは、出生後 (P) 0-1 の新生児マウスとラット、および幼若マウスとラット P21) の注射について説明し、マウスの P1 での腰椎 IT 注射の成功と失敗の代表的な結果を示します。ディスカッションでは、この手順を実行する際に注意が必要な一般的な失敗と特定の詳細、および前臨床試験を開始する前にこれらの注射を実践する方法に関する推奨事項について説明します。
プロトコル
ここに記載されている手順は、テキサス大学サウスウェスタン医療センターの動物管理および使用委員会(IACUC)によって承認されました。P1〜P28の野生型C57BL6/J雄および雌マウスを、マウスを含むプロトコルに使用した。P1〜P56歳の野生型Sprague-Dawleyの雄および雌のラットを、ラットを含むプロトコルに使用した。セクション3で説明したサバイバル手術を除けば、他のすべての手術は一時的な不快感を引き起こすだけと考えられており、麻酔薬や鎮痛薬の使用は必要ありません。個人は、実験動物に一時的な不快感以上のものがないか監視し、麻酔薬と鎮痛薬の必要性についてIACUCと獣医スタッフに指導を求める必要があります。使用した試薬および機器の詳細は 、材料表に記載されています。
1. マウスの腰椎IT注射 >P21
- 準備
- 目的の濃度の遺伝子治療ベクターとコントロール溶液(通常はベクター製造に使用される製剤バッファー)を含む注射液を調製します。注射液は無菌であるべきであり、手順全体を通して無菌のままであるべきです。
注:すべての溶液は、手順の期間中、氷上で維持する必要があります。 - 注射器と針、ピペット、注射液を含むすべての材料を収集して消毒します。バイオセーフティキャビネットの使用と注射剤への曝露に関する機関のガイドラインに従ってください。ここで説明する手順は、クラス2のバイオセーフティキャビネットで実施されました。
- マイクロリットルのピペットを使用して、必要な量の注入溶液を測定し、滅菌パラフィンフィルムに移します。注入量は5μLが一般的に使用され、成体マウスの目標容量として扱われます>P21(表1))。
注意: 必要に応じて音量を上げることができます。ただし、動物は、大量の注射に対する副作用がないか注意深く監視する必要があります。.注射量と副作用の詳細については、ディスカッションセクションを参照してください。.また、溶液をピペットチップから直接シリンジに移したり、校正済みの気密マイクロリットルシリンジを使用して注入溶液の量を直接測定することもできます。 - 30 G 0.5インチの針でマイクロリットルの注射器に溶液を引き出し、気泡を引き出さないように注意してください。.
注:針のゲージと長さは、皮膚の浸透に影響を与える可能性があります。使用するシリンジのサイズを考慮すると、注入量はシリンジ容量の10%を下回らないようにする必要があります。シリンジ容量の50%を超える容量の場合は、プランジャーが人差し指で簡単に押せることを確認してください。プランジャーが押し下げられにくい場合は、容量の大きいシリンジを使用してください。
- 目的の濃度の遺伝子治療ベクターとコントロール溶液(通常はベクター製造に使用される製剤バッファー)を含む注射液を調製します。注射液は無菌であるべきであり、手順全体を通して無菌のままであるべきです。
- 抑制
- 利き手を使用して、意識のある(麻酔されていない)マウスの尻尾をペーパータオルで保持します。ペーパータオルは、ネズミを拘束し、落ち着かせ、噛むのを防ぐのに役立ちます。マウスは、体の側面が手前を向くように、中立腹臥位にある必要があります。
注:手順の前にマウスをこの拘束に訓練または慣れさせる必要はありません。マウスは拘束のために苦労することがありますが、特定の痛みの反応を引き出すべきではありません。一時的な痛みの反応以上の反応が観察される場合は、鎮痛薬の投与が必要になる場合があります。獣医師の指導を求めてください。 - 利き手ではない方の手で、ペーパータオルの一部をマウスの頭と上半身に折り、利き手ではない親指と人差し指の間の骨盤帯をしっかりとつかみます。手のひらがカップ状になり、マウスの頭の周りに置かれていることを確認します。マウスの腸骨稜は触知可能で、各指の遠位指節骨の中心に配置されている必要があります(図1A、B)。
注意: 手やペーパータオルからの拘束は呼吸を損なうべきではありません。. - 尾の付け根をゆっくりと回転させて、背骨が適切に位置合わせされるようにします。マウスの骨盤は、腰椎の椎突起が作業面に対して垂直になるように、正方形であるべきです。
- マウスの背側腰部を70%アルコール調製パッドで綿棒で拭きます。
- 髪の毛を頭蓋骨~2〜6mmの腸骨稜に分けて、注射位置を視覚化します。
- L4-L5またはL5-L6の椎間空間、腸骨稜まで頭蓋骨まで~2-6mmの感触。
注意: 正確な距離は、マウスのサイズと年齢によって異なります。
- 利き手を使用して、意識のある(麻酔されていない)マウスの尻尾をペーパータオルで保持します。ペーパータオルは、ネズミを拘束し、落ち着かせ、噛むのを防ぐのに役立ちます。マウスは、体の側面が手前を向くように、中立腹臥位にある必要があります。
- 注射
- 利き手を使用して、マイクロリットル注射器の中心を持ち、L4-L5またはL5-L6椎間腔でマウスの背骨に対して垂直に配置します。シリンジのプランジャーが人差し指で押し下げられることがあり、手を過度に動かさないようにしてください。針の斜角をマウスの頭に向けて、椎間腔に皮膚を穿刺します。
- 椎間腔の周りの骨の端が針の先端で感じられる場合は、注射器の角度を30〜45度に減らします(図1A)。
- 針が椎間腔に滑り込み、突然のテールフリックを引き起こし、椎骨の間にしっかりと固定する必要があります。
- シリンジがずれないように注意しながら、プランジャーをしっかりと押し下げて、10秒以内に溶液を送達します。
- プランジャーを完全に押し下げた後、シリンジを15〜30秒間所定の位置に保持して、溶液の散逸を可能にし、逆流を防ぎます。
- シリンジをマウスから同じ30〜45度のエントリー角度でスムーズかつゆっくりと引き抜きます。針が引き抜かれたら、逆流を防ぐためにシリンジを回転させます。
注意: シリンジを回転させるときは、脊髄に物理的な損傷を与える可能性があるため、針を前進させないように注意してください。 - マウスを拘束具から外し、ホームケージに戻します。
- 注射後のマウスの歩行異常、運動障害、呼吸異常、協調性について監視します。副作用に関する詳細については、ディスカッションを参照してください。.
- メーカーの推奨に従って機器を清掃してください。複数回の注射では、遺伝子治療ベクターと制御溶液ごとに異なるシリンジが推奨されます。
注:取り外し可能な針は、複数回洗浄、滅菌、および再利用できます。ただし、鈍い針は動物に害を及ぼし、注射を見逃す可能性を高める可能性があるため、使用しないでください。鈍い針は皮膚に簡単に穴を開けないため、適切に廃棄する必要があります。注射器が限られている場合は、遺伝子治療ベクターに進む前にすべてのビヒクル注射を完了し、高用量を投与する前に最も低い遺伝子治療用量を注入することをお勧めします。. - 動物間の機器の滅菌に関する制度上のガイドラインに従ってください。
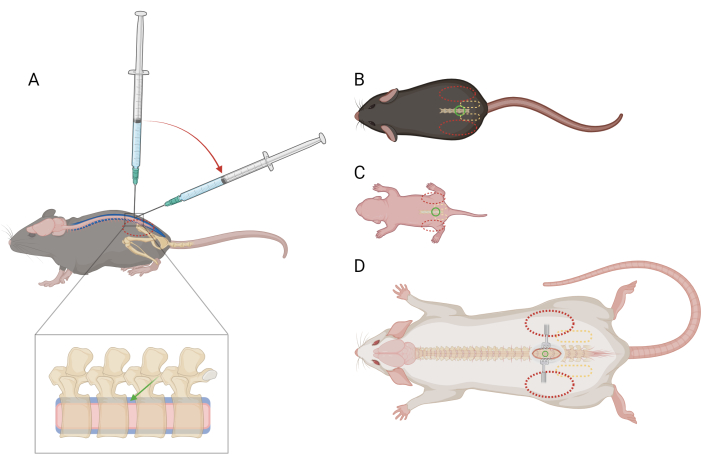
図1:マウスとラットの腰椎髄腔内注射のための指と注射器の配置の概略図(A)マウスの側面図>P21は、腰椎IT注射中の針の配置と注射器の角度の遷移を示しています。赤い破線の楕円は、マウスの腸骨稜の上に指が配置されていることを示します。脊椎の拡大図は、髄腔内空間(青)とおおよその針の配置(緑の矢印)と脊髄(ピンク)を示しています。(B)マウス>P21)、(C)マウスD)ラット>P21)の背側図、針の配置(緑の円)、骨盤帯(黄色の破線の楕円)、指の配置(赤の破線の楕円)の基準点。切開部位とリトラクターも(D)に描かれています。この図の拡大版を表示するには、ここをクリックしてください。
2. マウスおよびラットの腰椎IT注射
- 準備
- 手順1.1に従います。唯一の例外は、ステップ 1.1.3 の注入量です。
注:新生児マウス(P0-P1)の推奨注射量は3 μLを超えてはなりません、若年マウス(P5-P7)は5 μLを超えてはなりません、若年マウス(P10)の推奨注射量は10 μLを超えてはなりません。 新生仔ラット(P0-P1)の推奨注射量は5 μLを超えないように、若行ラット(P5-P7)は10 μLを超えないように、幼若ラット(P10)は30 μLを超えてはなりません(表1)。
- 手順1.1に従います。唯一の例外は、ステップ 1.1.3 の注入量です。
- 抑制
- 利き手を使って、ペーパータオルの上でマウス/ラットの尻尾を持ちます。マウス/ラットは、体の側面があなたに向けて中立腹臥位にある必要があります。
注:マウス/ラットは拘束のために苦労する可能性がありますが、特定の痛みの反応を引き出すべきではありません。一時的な痛みの反応以上の反応が観察される場合は、鎮痛薬の投与が必要になる場合があります。獣医師の指導を求めてください。 - 利き手ではない親指と人差し指の間の骨盤帯を優しく、しかししっかりとつかみます。腸骨稜は触知可能であり、各指の遠位指骨の中心に配置されている必要があります(図1C)。
注:この年齢では、噛まれる心配はないので、マウス/ラットにペーパータオルを巻く必要はありません。P5-10ラットでは、大きなラットの子犬を動かさないようにするために、ペーパータオルを使用する必要があるかもしれません。 - 尾の付け根をゆっくりと回転させて、背骨が適切に位置合わせされるようにします。マウス/ラットの骨盤は、腰椎の椎突が作業面に対して垂直になるように正方形にする必要があります。
- マウス/ラットの背側腰部を70%アルコール調製パッドで綿棒で拭きます。
- 必要に応じて、頭蓋骨を腸骨稜まで 1 ~ 3 mm 分して、注射位置を視覚化します。標的領域の視覚化は、若いマウス/ラットでより容易です。無毛の新生児では、椎間腔にくぼみが見られることがあります。
- L4-L5またはL5-L6の椎間空間、腸骨稜までの頭蓋骨1~3mmを感じたり、視覚化したりします。
注:正確な距離は、マウス/ラットのサイズと年齢によって異なります。
- 利き手を使って、ペーパータオルの上でマウス/ラットの尻尾を持ちます。マウス/ラットは、体の側面があなたに向けて中立腹臥位にある必要があります。
- 注射
- 利き手を使用して、マイクロリットルシリンジの中央を持ち、マウス/ラットの背骨に対して30〜45度の角度で配置します。.針の斜角をマウス/ラットの頭に向けて、椎間腔に対して約1〜3 mmのコードルで皮膚を穿刺します。シリンジの向きが角度がついているため、皮膚への挿入点は椎間腔に対してわずかに尾側にあります。
注意: この距離は、マウス/ラットの年齢とサイズによって変わる場合があります。 - 残りのステップは、マウスのステップ1.3.3〜1.3.10と同じです>P21。
- 利き手を使用して、マイクロリットルシリンジの中央を持ち、マウス/ラットの背骨に対して30〜45度の角度で配置します。.針の斜角をマウス/ラットの頭に向けて、椎間腔に対して約1〜3 mmのコードルで皮膚を穿刺します。シリンジの向きが角度がついているため、皮膚への挿入点は椎間腔に対してわずかに尾側にあります。
3. ラットの腰椎IT注射 >P21
注:文献には、麻酔なしの技術からより広範な外科的アプローチまで、複数のIT注入手順が記載されています14,15。低侵襲技術を使用した直接注射の手順は、光麻酔と小さな皮膚切開を使用して説明されています。イソフルランガスなどの麻酔を使用すると、拘束を助け、筋肉組織をリラックスさせ、注射中の動きを防ぐことができます。注射部位の上の皮膚を小さく切開すると、椎間空間が可視化され、厚い皮膚に穴を開ける必要がなくなり、注射の精度が向上します。切開のため、麻酔薬と鎮痛薬の使用が必要です。実践により、P21より古いラットにおいて、麻酔や切開を行わずに、ユーザーの裁量で、また保留中の施設要件15で腰椎IT注射を行うことが可能である。麻酔、適切な鎮痛薬、実験動物の生存手術に関する施設のガイドラインと考慮事項に従ってください。
- 準備
- 手順1.1に従います。唯一の例外は、ステップ 1.1.3 の注入量とステップ 1.1.4 のニードルサイズです。ラットの注射量は、年齢や体格によって大きく異なります。さまざまな年齢での注入量の詳細については、ディスカッションのセクションを参照してください(表 1)。
注:27 G x 1インチの針は、小さなゲージの針が曲がる可能性があり、短い針が髄腔内空間に十分に浸透しない可能性があるため、成体のラットに推奨されます。必要に応じて、より長い(1.25-1.5インチ)針を使用できます。 - 推奨および承認された麻酔薬を使用してラットに麻酔をかけます (施設で承認されたプロトコルに従います)。
注:ここで説明する手順では、ラットをイソフルランガスを使用して麻酔し、リドカインの1:1混合物:ブピバカインを局所麻酔薬として使用しました。体温は、手順と回復全体を通じて、承認された外部熱源を使用して維持する必要があります。 - 各動物の標準的な無菌手術部位の準備に従ってください。簡単に言えば、背側の腰部を剃り、外科用スクラブ、ベタジン、70%イソプロピルアルコールで皮膚を準備します。
- 手順1.1に従います。唯一の例外は、ステップ 1.1.3 の注入量とステップ 1.1.4 のニードルサイズです。ラットの注射量は、年齢や体格によって大きく異なります。さまざまな年齢での注入量の詳細については、ディスカッションのセクションを参照してください(表 1)。
- 手術
- ラットを中立腹臥位に置き、体の側面を正面に向けてください。
- 骨盤帯を触診し、腸骨稜と腰仙骨接合部を特定します。ラット>P21では、椎骨突起を容易に同定することができる。
- メスを使用して、L4-L5またはL5-L6の椎間腔に1cmの切開を行います。切開は、筋肉を無傷のままにして、皮膚とその下にある筋膜のみを含む必要があります。
注:残りの手順では、リトラクターを使用して皮膚を開いたままにしておくと便利です。 - 利き手ではない親指と人差し指の間の骨盤帯を優しく、しかししっかりとつかみます。腸骨稜は触知可能で、各指の遠位指骨の中心に配置する必要があります(図1D)。蚊の鉗子を使用して、背中の正中線に沿ってプローブし、椎間腔を見つけます。
- 注射
- 利き手を使用して、マイクロリットル注射器の中心を持ち、L4-L5またはL5-L6椎間腔でラットの背骨に対して垂直に配置します。.シリンジのプランジャーが人差し指で押し下げられると、手が過度に動かさずになれることを確認してください。針の斜角をラットの頭に向けて、椎間腔に針で筋肉を穿刺します。
- 針を椎間腔に進めます。
注:針は椎骨突起間を通過するときにわずかな抵抗がある可能性があり、このギャップを通過するために注射器の角度をわずかに調整する必要がある場合があります。ただし、脊椎に対して垂直に約90度にとどまる必要があります。針が髄腔内空間に入ると、ポップが感じられます。麻酔薬のパラメータに応じて、尻尾や脚のフリックが目立つ場合とそうでない場合があります。針は椎骨の間にしっかりと固定する必要があります。 - シリンジを位置からずらしないように注意して、プランジャーを押し下げて30秒以内に溶液を送達します。
注:マウスでの注射とは対照的に、この方法を使用してラット>P21の注射器角度を小さくすることは不可能かもしれません。過剰な圧力の蓄積を防ぐために、より大きな量をゆっくりと注入する必要があります。 - プランジャーを完全に押し下げた後、シリンジを30〜60秒間所定の位置に保持して、溶液の放散を可能にし、逆流を防ぎます。
- ラットからシリンジをスムーズに引き抜きます。針が引き抜かれたら、逆流を防ぐためにシリンジを回転させます。
注意: シリンジを回転させるときは、脊髄に物理的な損傷を与える可能性があるため、針を前進させないように注意してください。 - 縫合糸や創傷クリップなどの承認された方法を使用して、皮膚の切開を閉じます。このプロトコルで使用されたラットの場合、皮膚は5-0 PDS II縫合糸を使用して連続的な皮内または単純な中断パターンで閉じられました。
- ラットを麻酔から回復させます。
- 手順1.3.9-1.3.10およびすべての術後ケアガイドラインに従ってください。
結果
遺伝子治療のベクター形質導入には多くの要因が影響しますが、組織の組織学的染色は、腰椎髄腔内(IT)注射の成功を判断するための最も正確な方法であることに変わりはありません。注射後の中枢神経系(CNS)内での遺伝子治療ベクターの広範かつ均一な分布は、成功した手順を示しています。 図2C は、注射後4ヵ月間、新生児(P1)マウスにおいて、JeTプロモーターの下で弱い遍在性導入遺伝子発現を1.3 × 1011 vg/マウスで駆動する自己相補型AAV9媒介遺伝子治療の成功した注射を示しています。遺伝子治療によって送達された導入遺伝子を標的とするプローブを使用したRNAscope解析により、腰椎、頸髄、および脳に広く分布していることが明らかになります。肝臓と心臓の一部は、直接脳脊髄液(CSF)注射を行っても、遺伝子治療ベクターを末梢組織に分配できることを強調するために含まれています。

図2:マウスCNSの5ミクロン組織切片およびP1注入後4か月の末梢組織。 赤色染色はRNAscopeによる導入遺伝子発現を示し、核の青色対比染色はヘマトキシリンを介して行われます。(A)コントロール製剤バッファーによる注入。(B)AAV9ベクター(scAAV9_JeT-hDDX3Xopt-SpA)による実質内注射の失敗。(C)AAV9ベクター(scAAV9_JeT-hDDX3Xopt-SpA)による腰椎IT注入の成功。(B)および(C)で使用した遺伝子治療ベクターは、1.3E11 vg/マウスの翻訳関連用量で投与されました。スケールバー:トップパネル(5 mm);底面パネル(1 mm)。 この図の拡大版を表示するには、ここをクリックしてください。
図2Bに示すように、腰椎での集中的な発現と脳での発現の欠如は、脊髄の実質内注射を示している可能性があり、注射の失敗と見なす必要があります。これは、針が脊柱に挿入されすぎ、髄腔内空間を過ぎて脊髄に挿入された場合に発生します。さらに、脊髄と脳での発現が非常に低いか、まったく発現しない場合(図には示されていません)も、広範なCNS分布が予想される場所でベクターと用量が使用されていると仮定して、失敗したオフターゲット注射と見なす必要があります。これは、針が十分に挿入されていないか、正中線に対して横になっていることが原因である可能性があります。
成功した注射から観察される発現パターンは、例として次の8つの要因によって異なる可能性があります:(1)注射時の年齢、(2)既存の免疫、(3)注入速度、(4)遺伝子治療ベクター、(5)遺伝子治療の用量、(6)細胞表面タンパク質、(7)親和性、および(8)該当する場合は、導入遺伝子発現を促進するための適切なプロモーターの選択6.発現パターンは異なる場合がありますが、AAV9などの有効なベクターで用量が十分に高い限り、広範で均一で広範な分布は普遍的です。
組織学的解析を使用して腰椎IT注射の成功を確認する場合の主な制限は、長時間の待ち時間(剖検が行われて組織が収集された後、研究が終了するまで待つこと)と、大規模な遺伝子治療研究ですべてのマウスの組織を処理する場合に必要な広範なリソースです。残念ながら、私たちの経験では、陽性または陰性の注射の即時かつ直接的な指標は信頼性が低い場合があります。ただし、針が髄腔内空間に入るときの尾フリック反射は、リアルタイムでの位置決めが成功したことを示す良い指標であり、注射が成功したことを示している可能性があります。針が麻酔されていないマウス/ラットの皮膚を突き刺し、針が髄腔内空間に入ることに対してテールフリック反応を示すため、けいれんを混同しないでください。NMDA、サブスタンスP、リドカインなどの薬理学的薬剤の使用は、トレーニング中または実験用注射液と混合して、注射成功のより即時の指標を提供することが報告されています9,11,24。これらの薬剤を検討する際には、遺伝子治療ベクターとの適合性を評価することが重要です。
ディスカッション
腰椎IT注射は、CNS疾患の治療のために遺伝子治療ベクターをCSFに確実に送達する迅速かつ低侵襲の手順です5,6。この手順は翻訳的に関連性があり、ここで説明するプロトコルは、新生児から成体までのすべての年齢のマウスおよびラットでこの投与経路をどのように実施するかを詳述しています。このプロトコルをすべての年齢のマウスとラットに定義し、サポートビデオを提供することで、研究者がこの方法を遺伝子治療投与に採用するのを支援することが重要です。私たちの研究室の経験では、このプロトコルは、時間の経過とともに複数のユーザーと研究にわたって一貫して実装できます18,25,26,27,28,29,30。
若いマウス/ラットと高齢のマウス/ラットで腰椎IT注射を行う場合、特に針を脊椎に挿入する角度と注射する推奨量に重要な違いがあります。報告された腰椎IT注射の量は、研究間および種間でかなり異なります31。脳内圧(ICP)の長期にわたる上昇を避けるためには、注射量の考慮が重要であり、これはCSFと脳血の流れを損ない、不快感を引き起こし、水頭症、虚血、細胞損傷、および死亡を含む慢性的な神経学的合併症につながる可能性があります32,33。ICPは、CSF、脳血、およびCNS組織の体積によって決定され、体重と直接相関することはできません。正常に機能しているとき、ICPは、CSF量、脳血液量、呼吸、体位、CSF産生率、および血液中へのCSF排出速度33,34を含む多くの要因によって自動調節されます。したがって、IT注入量は、体重25,27,28,30ではなく、CSF特性(表1)に基づいて決定する必要があります。各種の各年齢での注入推奨量は太字で示されています。
| ITインジェクション量 | 成人のCSF値 | |||||||
| P0-1 (μL) | P5-7 (μL) | P10 (μL) | >P21 (μL) | 総容量(μL) | 生産速度(μL /分) | ターンオーバー(h) | 頭蓋内圧(mmHg) | |
| マウス | 3 | 5 | 5-10 | 5-20歳 | 30-4025,30 | 0.32-0.3525,30 | 1.7-225,30 | 5.0 +/- 0.528 |
| ラット | 5 | 5-10 | 10-30 | 10〜200 (20〜75) | 15025 | 1.7-2.825 | 2-2.6625 | 8.6 +/- 1.7,27 |
表1:異なる年齢のマウスとラットの腰椎IT注射量の概要。 太字の値は推奨され、安全に配送されています。可能な最大ボリュームは正式に評価されていません。マウスとラットの既知のCSFパラメータ(総量、産生率、代謝回転、頭蓋内圧)に関する追加情報が参考のために含まれています。
1回限りのボーラスIT注入量の上限に関する知識は、この分野全体で不足しています。CSF量が知られている成人のヒト、ラット、およびマウスでは、総CSF量の30%の増加は、慢性的な損傷または疾患を引き起こさないようです31,33,35,36。若年マウスまたは新生児マウスでは既知のCSF量がないため、同様の外挿は不可能です。一部のグループは、若い動物のCSFの量と生産に注目し始めています37。これらの領域での追加調査が実証されるまで、注入量は引き続き医師が報告した値の対象となります。
マウスやラットは、特に若年で治療したり、注射量が多い場合、筋肉の屈曲、手足の伸展、急速な呼吸、または数分以内に自己回復するはずの一時的な後肢麻痺を引き起こすことがあります。極端な場合、急性のICP上昇は心血管および呼吸器の異常を引き起こす可能性があり、これは致命的となる可能性があります32,33。24時間後も処置後の異常が続く場合は、マウス/ラットを研究から削除し、人道的に安楽死させる必要があります。.針が挿入されすぎて脊髄に影響を与えると、持続的な後肢麻痺が発生する可能性があります。これは、腰椎IT注射を行う際のよくある間違い、つまりプランジャーを押し下げながらテールフリック後のシリンジの動きが原因である可能性があります。注射器と針の動きは避けてください。.最初の穿刺で正しい位置を取得できない場合は、同じ場所で2回目の試行を行うことができます。2回目の試みも失敗した場合は、針の位置を変更して、次の椎間腔をターゲットにしてみてください。複数の針刺しは、その後の成功した注射の漏れにつながる可能性があることに注意してください。.
腰椎ITインジェクションに習熟するには時間がかかる場合があります。最終手順として注射を実践するには、Evans blueまたは0.2ミクロンのろ過されたMcCormickグリーン色素(図3)などの承認された色素溶液を使用するか、代表的な結果のセクションで対処した薬理学的薬剤を使用して、上記のプロトコルに従います。注入のトラブルシューティングと習得には、注入が成功したか失敗したかを1分以内に簡単に判断できるため、色素の使用をお勧めします。染料の練習は、動物がCNSに直接投与すると染料に対する反応を起こす可能性があるため、非生存手順のみを対象としています。この反応は、注射が成功してから1分以内に発生する可能性があり、急速なかゆみと身もだえの動きが特徴です。この反応が観察されたら、不快感を最小限に抑えるために、動物はすぐに安楽死させる必要があります。練習用色素注入が成功した後、染料は脊椎に局在したままになり(近くの末梢組織に色素はありません)、脊柱を上って小脳、大脳、および嗅球に移動します。P1では、皮膚は十分に透明であるため、染料が尾の脊柱を下って移動しているのが見えます。色素が数分以内に脳に到達しない場合、注射は失敗します。

図3:腰椎IT注射の練習が成功した後の脳内のマコーミックグリーン染料。 すべての脳は、5μLの色素を注入したP21マウスからのものであり、腹側図に示されています。 この図の拡大版を表示するには、ここをクリックしてください。
ウイルス力価や投与量など、前臨床試験デザインに関連する関連パラメータに関する追加情報については、以前に発表されたレビュー3,6,31を参照してください。
開示事項
著者は、利益相反を宣言しません。
謝辞
AAV9ベクターを製造してくださったUT Southwestern AAV Viral Vector Core Facilityと、 図2に示されている組織の処理と染色を行ってくださったGray Labの研究員Yuhui Huに感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
参考文献
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16 (2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778 (2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565 (2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229 (2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31 (2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463 (2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761 (2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575 (2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217 (2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392 (2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650 (2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832 (2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286 (2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413 (2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197 (2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved