Method Article
הזרקה תוך-מותנית של וקטורים של ריפוי גנטי למיקוד מערכת העצבים המרכזית בעכברים וחולדות
* These authors contributed equally
In This Article
Summary
זריקה תוך-מותנית מייצגת דרך מתן רלוונטית לתרגום למתן טיפול גנטי למערכת העצבים המרכזית. פרוטוקול סטנדרטי מקיף זה לזריקות תוך-מותניות בעכברים וחולדות בילודים, צעירים ובוגרים נועד להנחות חוקרים באימוץ טכניקה זו למחקרי ריפוי גנטי פרה-קליניים.
Abstract
שיטה אחת להתמקד במערכת העצבים המרכזית לטיפול במחלות נוירולוגיות כוללת שימוש בנתיב המתן המותני. גישה זו עוקפת את מחסום הדם-מוח כדי לגשת ישירות לנוזל המוח והשדרה ולהעדיף לכוון לתאים בתוך מערכת העצבים המרכזית. מחקרים פרה-קליניים רבים שפורסמו המשתמשים במסלול ההזרקה התוך-מותני תרמו לפיתוח ניסויים קליניים בריפוי גנטי; עם זאת, הפרוטוקולים המתוארים משתנים ומפוזרים על פני משאבים מרובים. כאן, מוצגת קבוצה מקיפה של פרוטוקולים לזריקות תוך-מותניות בעכברים וחולדות בילודים, צעירים ובוגרים למחקרי ריפוי גנטי פרה-קליניים. עם הכשרה נכונה, ניתן לבצע טכניקת הזרקה זו במהירות ובאמינות. בנוסף לפירוט פרוטוקול ההזרקה בכל שלב התפתחותי, נדונים פרמטרים נלווים, כגון נפח ההזרקה, שיכולים להשפיע על תוצאות המחקר. כדי להדגים את היישום של זריקות תוך-מותניות להתמקדות במערכת העצבים המרכזית, הביטוי של סרוטיפ 9 של נגיף הקשור לאדנו במוח, בחוט השדרה וברקמות ההיקפיות מוצג לאחר הזרקה מוצלחת או לא מוצלחת.
Introduction
אתגר בטיפול במחלות נוירולוגיות הדורשות אספקת מערכת העצבים המרכזית הגלובלית (CNS) אך מועמדות טובות לריפוי גנטי מיוחס במידה רבה למיקוד לא יעיל של מערכת העצבים המרכזית וסוגי תאים רלוונטיים1. כמות משמעותית של מחקר נמשכת כדי לייעל את מיקוד התאים והרקמות הגלובליים של מערכת העצבים המרכזית על ידי רכבי אספקה הנדסיים 1,2. עם זאת, עדיין ניתן להשיג העברת וקטור נרחבת למדי עם הטכנולוגיה הנוכחית של וקטור ריפוי גנטי, תוך שימוש בשילובים מסוימים של וקטורים ויראליים ודרכי מתן 3,4. תקן הזהב הנוכחי להשגת אספקה נרחבת של מערכת העצבים המרכזית מטיפול חד פעמי הוא שימוש בסרוטיפ 9 של נגיף הקשור לאדנו-(AAV9) יחד עם הזרקה ישירה לנוזל המוח (CSF).
ישנם שלושה דרכי מתן אופייניות לזריקות CSF ישירות: תוך-תקל מותני (IT), תוך-מוחי (ICV) ותוך ציסטרנלי (ICM)5. כל אחד מדרכי המתן הללו מביא לדפוסי הפצה ביולוגיים שונים במערכת העצבים המרכזית וברקמות ההיקפיות, אך לכולם יש את היתרון של עקיפת מחסום הדם-מוח (BBB) כדי להגיע לתאים במערכת העצבים המרכזית התורמים לפתולוגיה של מחלות נוירולוגיות ופנוטיפים6. הזרקת ה-IT המותני היא הסטנדרט לשימוש במתן תרופות קליניות בבני אדם, שכן ההליך הקליני הוא שגרתי ופשוט, עם פחות פולשניות בהשוואה לזריקות ICV ו-ICM.
הזרקת ה-IT המותני היא טכניקה מבוססת המשמשת בקלות בתחומי ההרדמה ומשככי הכאבים, כאשר המאמר הראשון פורסם בשנת 18857. הפרוטוקול הראשון להזרקות IT מותני בעכברים בוגרים פורסם בשנת 19808, ומאז הוא אומץ ונבדק באופן נרחב9. התאמות או שיפורים קלים בפרוטוקולים אלה בוצעו 10,11,12, כולל טכניקה לשימור מוצר13. פרוטוקולים להזרקות IT מותני בחולדות בוגרות פורסמו גם הם לראשונה בשנת 1976, עם צנתור למתן כרוני14 והזרקה ישירה לטיפולים חד פעמיים15. לאחרונה, קבוצות פרסמו פרוטוקולים להזרקות IT מותני בעכברים וחולדות יילודים או צעירים16,17.
אימוץ ותיקוף נרחב של טכניקה זו כדי לעקוף את תאי ה-BBB ותאי המטרה במערכת העצבים המרכזית הובילו למספר מחקרים פרה-קליניים וקליניים מוצלחים לטיפול במחלות נוירולוגיות. נתוני יעילות ובטיחות חיוביים בעכברים, חולדות ופרימטים לא אנושיים המודלים מחלות נוירולוגיות עוררו התרגשות ועניין סביב פוטנציאל התועלת הקלינית למחלות אלה 18,19,20,21,22,23. קומץ מהמחקרים הללו נמצאים כעת בניסויים קליניים (לדוגמה, מזהי clinicaltrials.gov NCT02362438, NCT04737460, NCT03381729 ו-NCT05518188)3,6. במאמר זה מתואר פרוטוקול פשוט להזרקות IT מותני בעכברים וחולדות בגילאים שונים, מבלי להסיר CSF, שניתן לאמץ לפרויקטים של ריפוי גנטי תרגומי. פרוטוקול זה דומה לפרוטוקולים שכבר זמינים ומאומצים באופן נרחב; עם זאת, יש ערך בציטוט הפרוטוקולים הרלוונטיים הללו במקום אחד לגישה ועיון נוחים, יחד עם הוויזואליה הנלווית לווידאו. פרוטוקול זה מסביר את ההזרקה לעכברים וחולדות יילודים ביום שלאחר הלידה (P) 0-1 ולעכברים וחולדות צעירים P21, עם תוצאות מייצגות מהזרקת IT מותני מוצלחת ולא מוצלחת ב-P1 בעכברים. בדיון נדונים טעויות נפוצות ופרטים ספציפיים הדורשים תשומת לב קפדנית בעת ביצוע הליך זה, כמו גם המלצות כיצד לתרגל זריקות אלו לפני תחילת מחקר פרה-קליני.
Protocol
הנהלים המתוארים כאן אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) במרכז הרפואי של אוניברסיטת טקסס סאות'ווסטרן. עכברים זכרים ונקבות מסוג C57BL6/J, בגילאי P1-P28, שימשו לפרוטוקולים הכוללים עכברים. חולדות זכר ונקבה מסוג Sprague-Dawley, בגילאי P1-P56, שימשו לפרוטוקולים הכוללים חולדות. מלבד ניתוח ההישרדות המתואר בסעיף 3, כל שאר ההליכים נחשבים כגורמים לאי נוחות רגעית בלבד ואינם דורשים שימוש בחומרי הרדמה או משככי כאבים. אנשים צריכים לעקוב אחר חיות מעבדה ליותר מאי נוחות רגעית ולבקש הדרכה מה-IACUC והצוות הווטרינרי שלהם לגבי הצורך בחומרי הרדמה ומשככי כאבים. פרטים על הריאגנטים והציוד המשמשים מסופקים בטבלת החומרים.
1. הזרקת IT מותני של עכברים >P21
- הכנה
- הכינו את תמיסות ההזרקה, כולל וקטור הטיפול הגנטי בריכוז/ים הרצויים ותמיסת בקרה (בדרך כלל מאגר הפורמולציה המשמש לייצור וקטור). תמיסות ההזרקה צריכות להיות סטריליות ולהישאר סטריליות לאורך כל ההליך.
הערה: יש לשמור את כל התמיסות על קרח למשך ההליך. - אסוף וחטא את כל החומרים, כולל מזרק ומחט, פיפטה ותמיסת הזרקה. פעל לפי הנחיות מוסדיות לגבי שימוש בארונות בטיחות ביולוגית וחשיפה להזרקה. הנהלים המתוארים כאן נערכו בארון בטיחות ביולוגית מסוג 2.
- בעזרת פיפטה מיקרוליטר מודדים את הנפח הרצוי של תמיסת ההזרקה ומעבירים אותו לסרט פרפין סטרילי. נפח הזרקה של 5 מיקרוליטר נמצא בשימוש נפוץ ומתייחס אליו כנפח היעד לעכברים בוגרים >P21 (טבלה 1).
הערה: ניתן להגביר את עוצמת הקול במידת הצורך; עם זאת, יש לעקוב מקרוב אחר בעלי חיים לאיתור תגובות שליליות לכמויות הזרקה גדולות יותר. עיין בסעיף הדיון לפרטים על נפח ההזרקה ותגובות שליליות. ניתן גם להעביר את התמיסה ישירות מקצה הפיפטה למזרק, או להשתמש במזרקי מיקרוליטר אטומים לגז כדי למדוד ישירות את נפח תמיסת ההזרקה. - משוך את התמיסה למזרק מיקרוליטר עם מחט 30 גרם 0.5 אינץ', היזהר לא למשוך בועות אוויר.
הערה: מד המחט ואורכו יכולים להשפיע על חדירת העור. כאשר בוחנים את גודל המזרק לשימוש, נפח ההזרקה לא צריך להיות פחות מ-10% מקיבולת המזרק. עבור נפחים גדולים מ-50% מקיבולת המזרק, ודא שניתן ללחוץ על הבוכנה בקלות עם האצבע המורה. אם לא ניתן ללחוץ על הבוכנה בקלות, השתמש במזרק בעל קיבולת גדולה יותר.
- הכינו את תמיסות ההזרקה, כולל וקטור הטיפול הגנטי בריכוז/ים הרצויים ותמיסת בקרה (בדרך כלל מאגר הפורמולציה המשמש לייצור וקטור). תמיסות ההזרקה צריכות להיות סטריליות ולהישאר סטריליות לאורך כל ההליך.
- ריסון
- בעזרת היד הדומיננטית, החזיקו את העכבר המודע (הלא מורדם) בזנב על מגבת נייר. מגבת הנייר תעזור לרסן, להרגיע ולמנוע מהעכבר לנשוך. העכבר צריך להיות במצב נוטה ניטרלי כשההיבט הצדדי של הגוף פונה אליך.
הערה: אין צורך לאמן או להרגיל עכברים לריסון זה לפני ההליך. עכברים עשויים להיאבק בגלל איפוק אך לא צריכים לעורר תגובת כאב ספציפית. אם נצפות יותר מתגובות כאב רגעיות, ייתכן שיהיה צורך במתן משככי כאבים; פנה להדרכה וטרינרית. - ביד הלא דומיננטית, קפלו חלק ממגבת הנייר על הראש ופלג הגוף העליון של העכבר ותפסו בחוזקה את חגורת האגן בין האגודל הלא דומיננטי לאצבע המורה. ודא שכף היד מכוסה, מונחת סביב ראש העכבר. פסגת הכסל של העכבר צריכה להיות מוחשית וממוקמת במרכז הפלנקס הדיסטלי של כל אצבע (איור 1A,B).
הערה: ריסון מהיד או ממגבת נייר לא אמור לפגוע בנשימה. - סובב בעדינות את בסיס הזנב כדי להבטיח יישור נכון של עמוד השדרה. אגן העכבר צריך להיות מרובע, כך שתהליכי החוליות של עמוד השדרה המותני יהיו בניצב למשטח העבודה.
- ספוג את אזור המותני הגבי של העכבר עם כרית הכנה של 70% אלכוהול.
- חלק את השיער ~2-6 מ"מ גולגולת לפסגת הכסל כדי לעזור לדמיין את מיקום ההזרקה.
- הרגישו את החלל הבין חולייתי L4-L5 או L5-L6, ~ 2-6 מ"מ גולגולת לפסגת הכסל.
הערה: המרחק המדויק משתנה בהתאם לגודל וגיל העכבר.
- בעזרת היד הדומיננטית, החזיקו את העכבר המודע (הלא מורדם) בזנב על מגבת נייר. מגבת הנייר תעזור לרסן, להרגיע ולמנוע מהעכבר לנשוך. העכבר צריך להיות במצב נוטה ניטרלי כשההיבט הצדדי של הגוף פונה אליך.
- זריקה
- בעזרת היד הדומיננטית, החזק את מרכז מזרק המיקרוליטר ומקם אותו בניצב לעמוד השדרה של העכבר בחלל הבין חולייתי L4-L5 או L5-L6. ודא שניתן ללחוץ על הבוכנה של המזרק עם האצבע המורה ללא תנועה מוגזמת של היד. כששיפוע המחט פונה לראש העכבר, יש לנקב את העור מעל החלל הבין חולייתי.
- כאשר שולי העצם סביב החלל הבין חולייתי מורגשים בקצה המחט, הפחיתו את זווית המזרק ל-30-45 מעלות (איור 1A).
- המחט צריכה להחליק לחלל הבין חולייתי ולגרום להחלקת זנב פתאומית, ויש להדק אותה בחוזקה בין החוליות.
- הקפד לא לעקור את המזרק, לחץ על הבוכנה בהתמדה כדי לספק את התמיסה תוך 10 שניות.
- החזק את המזרק במקומו למשך 15-30 שניות לאחר לחיצה מלאה על הבוכנה כדי לאפשר פיזור של התמיסה ולמנוע זרימה חוזרת.
- משוך בצורה חלקה ואיטית את המזרק מהעכבר באותה זווית כניסה של 30-45 מעלות. כאשר המחט נמשכת, סובב את המזרק כדי למנוע זרימה חוזרת.
הערה: היזהר לא לקדם את המחט בעת סיבוב המזרק, מכיוון שהדבר עלול לגרום לנזק פיזי לחוט השדרה. - שחרר את העכבר מהריסון והחזיר אותו לכלוב הביתי.
- עקוב אחר העכבר לאחר ההזרקה לאיתור אמבולציה חריגה, ליקוי מוטורי, הפרעות נשימה וקואורדינציה. ראה את הדיון לפרטים נוספים לגבי תגובות שליליות.
- נקה ציוד בהתאם להמלצות היצרן. עבור זריקות מרובות, מומלץ להשתמש במזרקים שונים עבור כל וקטור טיפול גנטי ותמיסת בקרה.
הערה: ניתן לנקות, לעקר ולעשות שימוש חוזר במחטים נשלפות מספר פעמים; עם זאת, אין להשתמש במחטים עמומות מכיוון שהן עלולות לפגוע בבעל החיים ולהגביר את הסבירות להחמצת זריקות. מחט עמומה לא תנקב את העור בקלות ויש להשליך אותה כראוי. אם המזרקים מוגבלים, מומלץ להשלים את כל הזריקות לרכב לפני שממשיכים לווקטור הטיפול הגנטי ולהזריק את המינון הנמוך ביותר של טיפול גנטי לפני מתן מינונים גבוהים יותר. - עקוב אחר הנחיות מוסדיות לעיקור ציוד בין בעלי חיים.
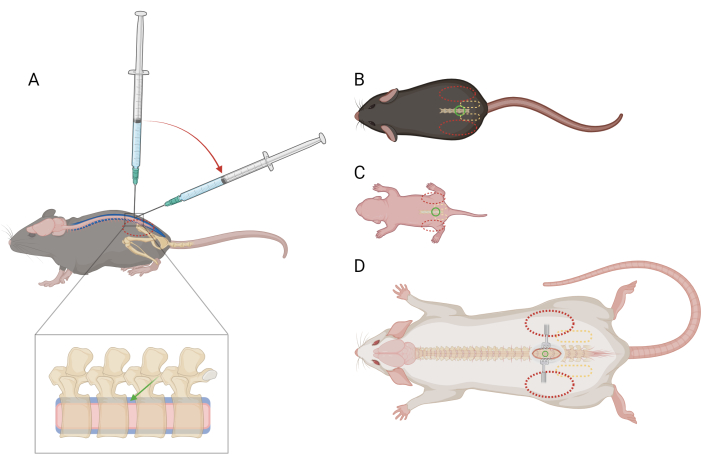
איור 1: סכמטי של מיקום האצבע והמזרק עבור הזרקה תוך-תקלית מותנית בעכברים וחולדות. (A) מבט רוחבי של עכבר >P21 המראה את מיקום המחט ומעבר זווית המזרק במהלך הזרקת IT מותני. האליפסה האדומה המקווקו מציינת את מיקום האצבע מעל פסגת הכסל של העכבר. תצוגה מוגדלת של עמוד השדרה מציגה את החלל התוך-תאי (כחול) עם מיקום מחט משוער (חץ ירוק) ואת חוט השדרה (ורוד). מבט גבי של (B) עכבר >P21, (C) עכבר D) חולדה >P21, עם נקודות ייחוס למיקום מחט (עיגול ירוק), חגורת אגן (אליפסה צהובה מקווקו) ומיקום אצבעות (אליפסה אדומה מקווקו). אתר החתך והמחזירים מתוארים גם ב-(D). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. הזרקת IT מותני של עכברים וחולדות
- הכנה
- בצע את שלב 1.1. היוצא מן הכלל היחיד הוא נפח ההזרקה בשלב 1.1.3.
הערה: נפחי ההזרקה המומלצים לעכברים יילודים (P0-P1) לא יעלו על 3 מיקרוליטר, לעכברים צעירים (P5-P7) לא יעלו על 5 מיקרוליטר, ולעכברים צעירים (P10) לא יעלו על 10 מיקרוליטר. נפחי ההזרקה המומלצים לחולדות יילודים (P0-P1) לא יעלו על 5 מיקרוליטר, לחולדות צעירות (P5-P7) לא יעלו על 10 מיקרוליטר, ולחולדות צעירות (P10) לא יעלו על 30 מיקרוליטר (טבלה 1).
- בצע את שלב 1.1. היוצא מן הכלל היחיד הוא נפח ההזרקה בשלב 1.1.3.
- ריסון
- בעזרת היד הדומיננטית, החזיקו את העכבר/חולדה בזנב על מגבת נייר. העכבר/חולדה צריכים להיות במצב נוטה ניטרלי כשההיבט הצדדי של הגוף פונה אליך.
הערה: עכברים/חולדות עשויים להיאבק עקב איפוק אך לא אמורים לעורר תגובת כאב ספציפית. אם נצפות יותר מתגובות כאב רגעיות, ייתכן שיהיה צורך במתן משככי כאבים; פנה להדרכה וטרינרית. - אחזו בעדינות אך בחוזקה בחגורת האגן בין האגודל הלא דומיננטי לאצבע המורה. פסגת הכסל צריכה להיות מוחשית וממוקמת במרכז הפלנקס הדיסטלי של כל אצבע (איור 1C).
הערה: בגיל זה אין חשש מנשיכה, ולכן אין צורך לעטוף את מגבת הנייר על העכבר/חולדה. ייתכן שיהיה צורך להשתמש במגבת נייר בחולדות P5-10 כדי לשמור על גורי החולדות הגדולים יותר. - סובב בעדינות את בסיס הזנב כדי להבטיח יישור נכון של עמוד השדרה. אגן העכבר/חולדה צריך להיות מרובע כך שתהליכי החוליות של עמוד השדרה המותני יהיו מאונכים למשטח העבודה.
- ספוג את אזור המותני הגבי של העכבר/חולדה עם כרית הכנה של 70% אלכוהול.
- חלק את השיער, אם ישים, ~1-3 מ"מ גולגולת לפסגת הכסל כדי לעזור לדמיין את מיקום ההזרקה. הדמיה של אזור המטרה קלה יותר בעכברים/חולדות צעירים יותר. ביילודים חסרי שיער ניתן לראות שקע בחלל הבין חולייתי.
- הרגישו או דמיינו את החלל הבין חולייתי L4-L5 או L5-L6, ~ 1-3 מ"מ גולגולת לפסגת הכסל.
הערה: המרחק המדויק משתנה בהתאם לגודל וגיל העכבר/חולדה.
- בעזרת היד הדומיננטית, החזיקו את העכבר/חולדה בזנב על מגבת נייר. העכבר/חולדה צריכים להיות במצב נוטה ניטרלי כשההיבט הצדדי של הגוף פונה אליך.
- זריקה
- בעזרת היד הדומיננטית, החזק את מרכז מזרק המיקרוליטר ומקם אותו בזווית של 30-45 מעלות לעמוד השדרה של העכבר/חולדה. כאשר שיפוע המחט פונה לראש העכבר/חולדה, יש לנקב את העור כ-1-3 מ"מ לחלל הבין חולייתי. בגלל הכיוון הזוויתי של המזרק, נקודת ההחדרה על העור היא מעט זנב לחלל הבין חולייתי.
הערה: מרחק זה עשוי להשתנות עם גיל וגודל העכבר/חולדה. - שאר השלבים זהים לשלבים 1.3.3-1.3.10 של עכברים >P21.
- בעזרת היד הדומיננטית, החזק את מרכז מזרק המיקרוליטר ומקם אותו בזווית של 30-45 מעלות לעמוד השדרה של העכבר/חולדה. כאשר שיפוע המחט פונה לראש העכבר/חולדה, יש לנקב את העור כ-1-3 מ"מ לחלל הבין חולייתי. בגלל הכיוון הזוויתי של המזרק, נקודת ההחדרה על העור היא מעט זנב לחלל הבין חולייתי.
3. הזרקת IT מותני של חולדות >P21
הערה: ישנם מספר הליכי הזרקת IT המתוארים בספרות, החל מטכניקות ללא הרדמה ועד לגישות כירורגיות נרחבות יותר14,15. הליך להזרקה ישירה בטכניקה זעיר פולשנית מתואר באמצעות הרדמה קלה וחתך עור קטן. השימוש בהרדמה, כגון גז איזופלורן, יכול לעזור באיפוק, להרפות את השרירים ולמנוע תנועה במהלך ההזרקה. ביצוע חתך קטן בעור מעל מקום ההזרקה משפר את דיוק ההזרקה בכך שהוא מאפשר הדמיה של החלל הבין חולייתי ומבטל את הצורך לנקב דרך עור עבה. בשל החתך נדרש שימוש בחומרי הרדמה ומשככי כאבים. עם תרגול, ניתן לבצע הזרקות IT מותניות בחולדות מעל P21 ללא הרדמה או חתך לפי שיקול דעתו של המשתמש ודרישות מוסדיות ממתינות15. עקוב אחר הנחיות ושיקולים מוסדיים לגבי הרדמה, משככי כאבים מתאימים וניתוחי הישרדות לחיות מעבדה.
- הכנה
- בצע את שלב 1.1. היוצאים מן הכלל היחידים הם נפח ההזרקה בשלב 1.1.3 וגודל המחט בשלב 1.1.4. נפחי הזרקה לחולדות יכולים להשתנות מאוד לפי גיל וגודל גוף. עיין בסעיף הדיון למידע נוסף על נפח ההזרקה בגילאים שונים (טבלה 1).
הערה: מחט בגודל 27 גרם x 1 אינץ' מומלצת לחולדות בוגרות, מכיוון שמחטים קטנות יותר עלולות להתכופף, ומחטים קצרות יותר עשויות שלא לחדור כראוי לחלל התוך-תקלי. ניתן להשתמש במחט ארוכה יותר (1.25-1.5 אינץ') במידת הצורך. - להרדים את החולדה באמצעות חומר ההרדמה המועדף והמאושר (בהתאם לפרוטוקולים שאושרו על ידי המוסד).
הערה: עבור ההליכים המתוארים כאן, חולדות הורדמו באמצעות גז איזופלורן ותערובת 1:1 של לידוקאין: בופיבקאין שימש כחומר הרדמה מקומי. יש לשמור על טמפרטורת הגוף באמצעות מקור חום חיצוני מאושר לאורך כל ההליך וההתאוששות. - עקוב אחר ההכנה הסטנדרטית של אתר כירורגי אספטי לכל בעל חיים. בקצרה, גלחו את אזור המותניים הגבי והכינו את העור עם קרצוף כירורגי, בטדין ו-70% אלכוהול איזופרופיל.
- בצע את שלב 1.1. היוצאים מן הכלל היחידים הם נפח ההזרקה בשלב 1.1.3 וגודל המחט בשלב 1.1.4. נפחי הזרקה לחולדות יכולים להשתנות מאוד לפי גיל וגודל גוף. עיין בסעיף הדיון למידע נוסף על נפח ההזרקה בגילאים שונים (טבלה 1).
- הליך כירורגי
- הנח את החולדה במצב נוטה ניטרלי כשההיבט הצדדי של הגוף פונה אליך.
- ממשש את חגורת האגן, זיהוי פסגת הכסל וצומת הלומבוסקרל. בחולדות >P21 ניתן לזהות בקלות את תהליכי החוליות.
- בעזרת אזמל, בצע חתך של 1 ס"מ מעל החלל הבין חולייתי L4-L5 או L5-L6. החתך צריך לערב רק את העור ואת הפאשיה הבסיסית, ולהשאיר את השריר שלם.
הערה: כדאי להשתמש במחזירים כדי להחזיק את העור פתוח במהלך שארית ההליך. - אחזו בעדינות אך בחוזקה בחגורת האגן בין האגודל הלא דומיננטי לאצבע המורה. פסגת הכסל צריכה להיות מוחשית וממוקמת במרכז הפלנקס הדיסטלי של כל אצבע (איור 1D). השתמש במלקחיים נגד יתושים כדי לחקור לאורך קו האמצע של הגב כדי לאתר את החלל הבין חולייתי.
- זריקה
- בעזרת היד הדומיננטית, החזק את מרכז מזרק המיקרוליטר ומקם אותו בניצב לעמוד השדרה של החולדה בחלל הבין חולייתי L4-L5 או L5-L6. ודא שניתן ללחוץ על הבוכנה של המזרק עם האצבע המורה ללא תנועה מוגזמת של היד. כששיפוע המחט פונה לראש החולדה, יש לנקב את השריר עם המחט מעל החלל הבין חולייתי.
- קדם את המחט לחלל הבין חולייתי.
הערה: למחט עשויה להיות התנגדות קלה כשהיא עוברת בין תהליכי החוליות, וייתכן שיהיה צורך לכוונן מעט את זווית המזרק כדי לעבור דרך פער זה. עם זאת, הוא צריך להישאר בערך 90 מעלות, בניצב לעמוד השדרה. פיצוץ יורגש כאשר המחט נכנסת לחלל התוך-תקלי. בהתאם לפרמטרים של הרדמה, תנועת זנב או רגל עשויה להיות מורגשת או לא. יש להדק את המחט בחוזקה בין החוליות. - היזהר לא להזיז את המזרק ממקומו, לחץ על הבוכנה כדי לספק את התמיסה תוך 30 שניות.
הערה: בניגוד להזרקות בעכברים, ייתכן שלא ניתן יהיה להפחית את זווית המזרק בחולדות >P21 בשיטה זו. יש להזריק כמויות גדולות יותר בקצב איטי יותר כדי למנוע הצטברות לחץ מוגזמת. - החזק את המזרק במקומו למשך 30-60 שניות לאחר לחיצה מלאה על הבוכנה כדי לאפשר פיזור של התמיסה ולמנוע זרימה חוזרת.
- משוך בצורה חלקה את המזרק מהחולדה. כאשר המחט נמשכת, סובב את המזרק כדי למנוע זרימה חוזרת.
הערה: היזהר לא לקדם את המחט בעת סיבוב המזרק, מכיוון שהדבר עלול לגרום לנזק פיזי לחוט השדרה. - סגור את חתך העור בשיטה מאושרת, כגון תפרים או קליפסים לפצעים. עבור החולדות ששימשו בפרוטוקול זה, העור נסגר בתבנית תוך-עורית רציפה או פשוטה באמצעות תפר 5-0 PDS II.
- להחזיר את החולדה מההרדמה.
- בצע את השלבים 1.3.9-1.3.10 ואת כל הנחיות הטיפול לאחר הניתוח.
תוצאות
למרות שגורמים רבים יכולים להשפיע על התמרת וקטור ריפוי גנטי, צביעה היסטולוגית של רקמות נותרה השיטה המדויקת ביותר לקביעת ההצלחה של זריקות תוך-מותניות (IT). פיזור רחב ואחיד של וקטור הריפוי הגנטי בתוך מערכת העצבים המרכזית (CNS) לאחר ההזרקה מעיד על הליך מוצלח. איור 2C מייצג הזרקה מוצלחת של טיפול גנטי משלים עצמי בתיווך AAV9 המניע ביטוי טרנסגנים חלש בכל מקום תחת מקדם JeT במינון של 1.3 ×10 11 vg לעכבר בעכברים יילודים (P1), 4 חודשים לאחר ההזרקה. ניתוח RNAscope, באמצעות בדיקה המכוונת לטרנסגן המועבר על ידי הטיפול הגנטי, חושף פיזור רחב בחוט השדרה המותני, חוט השדרה הצווארי והמוח. חלק מהכבד והלב כלול כדי להדגיש שאפילו עם הזרקה ישירה של נוזל המוח השדרתי (CSF), וקטור הריפוי הגנטי עדיין יכול להיות מופץ לרקמות היקפיות.

איור 2: קטעי רקמה מוכתמים של 5 מיקרון של מערכת העצבים המרכזית של העכבר ורקמה היקפית 4 חודשים לאחר ההזרקה ב-P1. צביעה אדומה מצביעה על ביטוי טרנסגנים באמצעות RNAscope, וצביעה כחולה של גרעינים נעשית באמצעות המטוקסילין. (A) הזרקה עם מאגר ניסוח בקרה. (B) הזרקה תוך-פרנכימלית לא מוצלחת עם וקטור AAV9 (scAAV9_JeT-h DDX3Xopt-SpA). (C) הזרקת IT מותנית מוצלחת עם וקטור AAV9 (scAAV9_JeT-hDDX3Xopt-SpA). וקטור הריפוי הגנטי המשמש ב-(B) ו-(C) ניתן במינון רלוונטי לתרגום של 1.3E11 vg/עכבר. סרגל קנה מידה: פאנל עליון (5 מ"מ); לוח תחתון (1 מ"מ). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
ביטוי מרוכז בחוט השדרה המותני בשילוב עם חוסר ביטוי במוח, כפי שמוצג באיור 2B, עשוי להצביע על הזרקה תוך-פרנכימלית של חוט השדרה ויש להתייחס אליו כזריקה כושלת. זה קורה כאשר המחט מוחדרת רחוק מדי לתוך עמוד השדרה, מעבר לחלל התוך-תקלי ולתוך חוט השדרה. בנוסף, ביטוי נמוך מאוד או ללא ביטוי בחוט השדרה ובמוח (לא מוצג) צריך להיחשב גם כזריקה כושלת מחוץ למטרה, בהנחה שנעשה שימוש בווקטור ומינון כאשר צפויה התפלגות רחבה של מערכת העצבים המרכזית. זה יכול להיות בגלל אי החדרת המחט מספיק רחוק או מהיותה לרוחב לקו האמצע.
דפוסי הביטוי שנצפו מהזרקות מוצלחות יכולים להיות שונים בשל שמונת הגורמים הבאים כדוגמאות: (1) גיל בעת ההזרקה, (2) חסינות קיימת, (3) קצב עירוי, (4) וקטור טיפול גנטי, (5) מינון של טיפול גנטי, (6) חלבונים על פני התא, (7) טרופיזם, ו-(8) אם רלוונטי, בחירת מקדם מתאימה להנעת ביטוי טרנסגנים6. בעוד שדפוסי הביטוי יכולים להיות שונים, התפוצה הרחבה, האחידה והנרחבת תהיה אוניברסלית כל עוד המינון גבוה מספיק עם וקטור יעיל, כגון AAV9.
המגבלות העיקריות של שימוש בניתוח היסטולוגי כדי לאשר את הצלחת הזרקת ה-IT המותני הן זמני ההמתנה הארוכים - המתנה לסוף המחקר, לאחר ביצוע נתיחות ואיסוף רקמות - ומשאבים נרחבים הדרושים לעיבוד רקמה מכל העכברים במחקר ריפוי גנטי גדול. למרבה הצער, הניסיון שלנו מלמד שאינדיקטורים מיידיים וישירים לזריקה חיובית או שלילית יכולים להיות לא אמינים; עם זאת, רפלקס תנועת הזנב כאשר המחט נכנסת לחלל התוך-תקלי הוא אינדיקטור טוב למיקום מוצלח בזמן אמת וככל הנראה מעיד על הזרקה מוצלחת. אל תבלבלו עווית כאשר המחט חודרת את העור בעכבר/חולדה לא מורדמת עם תגובת תנועת זנב למחט הנכנסת לחלל התוך-תקלי. דווח כי השימוש בתרופות פרמקולוגיות כגון NMDA, חומר P ולידוקאין, בין אם באימונים או בשילוב עם תמיסת ההזרקה הניסיונית, מספק אינדיקציה מיידית יותר להצלחת ההזרקה 9,11,24. אם בוחנים חומרים אלה, חשוב להעריך את תאימותם לווקטור הטיפול הגנטי.
Discussion
הזרקת ה-IT המותני היא הליך מהיר וזעיר פולשני המעביר באופן אמין וקטור טיפול גנטי לתוך ה-CSF לטיפול במחלות מערכת העצבים המרכזית 5,6. ההליך רלוונטי מבחינה תרגמית, והפרוטוקול המתואר כאן מפרט כיצד לבצע דרך מתן זו בעכברים וחולדות בכל הגילאים, מיילודים ועד בוגרים. חשוב להגדיר פרוטוקול זה עבור עכברים וחולדות בכל הגילאים, יחד עם מתן סרטונים תומכים, כדי לסייע לחוקרים באימוץ שיטה זו למתן ריפוי גנטי. הניסיון של המעבדה שלנו הוא שניתן ליישם פרוטוקול זה באופן עקבי על משתמשים מרובים ומחקרים לאורך זמן 18,25,26,27,28,29,30.
ישנם הבדלים חשובים בעת ביצוע הזרקת IT מותני בעכברים/חולדות צעירים יותר בהשוואה לעכברים/חולדות מבוגרים יותר, בעיקר הזווית שבה המחט מוחדרת לעמוד השדרה והנפח המומלץ המוזרק. נפחי הזרקת ה-IT המותניים המדווחים משתנים במידה ניכרת בין מחקרים ובין מינים31. התחשבות בנפח ההזרקה חשובה כדי למנוע עליות ארוכות טווח בלחץ התוך גולגולתי (ICP), שעלולות לפגוע בזרימת CSF ודם מוחי, לגרום לאי נוחות ולהוביל לסיבוכים נוירולוגיים כרוניים, כולל הידרוצפלוס, איסכמיה, פגיעה תאית ומוות32,33. ICP נקבע על ידי נפח ה-CSF, הדם המוחי ורקמת ה-CNS, שלא ניתן לתאם ישירות למשקל הגוף. בתפקוד תקין, ה-ICP מווסת אוטומטית על ידי גורמים רבים, כולל נפח CSF, נפח דם מוחי, נשימה, תנוחת גוף, קצב ייצור CSF וקצב ניקוז CSF לדם 33,34. לכן יש לקבוע את נפחי הזרקת ה-IT על סמך מאפייני CSF (טבלה 1) במקום משקל גוף 25,27,28,30. נפחים מומלצים להזרקה בכל גיל בכל מין מצוינים בהדגשה.
| נפח הזרקת IT | ערכי CSF למבוגרים | |||||||
| P0-1 (מיקרוליטר) | P5-7 (מיקרוליטר) | P10 (מיקרוליטר) | >P21 (מיקרוליטר) | נפח כולל (μL) | קצב ייצור (מיקרוליטר לדקה) | מחזור (ח) | לחץ תוך גולגולתי (מ"מ כספית) | |
| עכברים | 3 | 5 | 5-10 | 5-20 | 30-4025,30 | 0.32-0.3525,30 | 1.7-225,30 | 5.0 +/- 0.528 |
| חולדות | 5 | 5-10 | 10-30 | 10-200 (20-75) | 15025 | 1.7-2.825 | 2-2.6625 | 8.6 +/- 1.7,27 |
טבלה 1: סיכום נפחי הזרקת IT מותני לעכברים וחולדות בגילאים שונים. ערכים מודגשים מומלצים ונמסרו בבטחה. הנפחים המרביים האפשריים לא הוערכו רשמית. מידע נוסף על פרמטרים ידועים של CSF - נפח כולל, קצב ייצור, תחלופה ולחץ תוך גולגולתי - בעכברים וחולדות כלול לעיון.
קיים חוסר ידע ברחבי התחום לגבי הסף העליון לנפחי הזרקת IT בולוס חד פעמיים. בבני אדם בוגרים, חולדות ועכברים שבהם נפח CSF ידוע, נראה כי עלייה של 30% בנפח ה-CSF הכולל אינה גורמת לפציעה כרונית או למחלות 31,33,35,36. היעדר נפחי CSF ידועים בעכברים צעירים או יילודים הופך אקסטרפולציה דומה לבלתי אפשרית. קבוצות מסוימות מתחילות להסתכל על נפח וייצור CSF בבעלי חיים צעיריםיותר 37. עד שיוכחו חקירות נוספות בתחומים אלה, נפח ההזרקה ימשיך להיות כפוף לערכים המדווחים על ידי החוקרים.
עכברים וחולדות, במיוחד כאשר הם מטופלים בגילאים צעירים יותר או עם נפחי הזרקה גבוהים, עלולים לעורר כיפוף שרירים, הארכת גפיים, נשימה מהירה או שיתוק זמני בגפיים האחוריות שאמור להיפתר מעצמו תוך מספר דקות. במקרים קיצוניים, עלייה חריפה ב-ICP עלולה לגרום להפרעות לב וכלי דם ונשימה, שעלולות להיות קטלניות32,33. אם חריגות כלשהן לאחר ההליך נמשכות לאחר 24 שעות, יש להוציא את העכברים/חולדות מהמחקר ולהמית אותם בהמתת חסד אנושית. שיתוק מתמשך בגפיים האחוריות יכול להתרחש אם המחט מוחדרת רחוק מדי, ומשפיעה על חוט השדרה. זה יכול לנבוע מטעות נפוצה בעת ביצוע הזרקת IT מותני: תנועת המזרק לאחר החלקת הזנב תוך כדי לחיצה על הבוכנה. יש להימנע מתנועת מזרק ומחט. אם לא ניתן להשיג את המיקום הנכון עם הפנצ'ר הראשוני, ניתן לבצע ניסיון שני באותו מיקום. אם גם הניסיון השני לא מצליח, נסה לשנות את מיקום המחט כדי למקד לחלל הבין חולייתי הבא. שימו לב שמספר דקירות מחט עלול להוביל לדליפה של הזרקה מוצלחת לאחר מכן.
להיות מיומן בהזרקת IT מותני יכול לקחת זמן. כדי לתרגל את ההזרקות כהליך טרמינלי, עקוב אחר הפרוטוקול לעיל באמצעות תמיסת צבע מאושרת, כגון כחול אוונס או צבע ירוק מקורמיק מסונן 0.2 מיקרון (איור 3) או עם התרופות המטופלות בסעיף התוצאות המייצגות. מומלץ להשתמש בצבע כדי לפתור בעיות ולשלוט בהזרקה מכיוון שקל לדעת אם ההזרקה הייתה הצלחה או כישלון תוך דקה אחת. תרגול עם צבע הוא להליכים שאינם הישרדות בלבד, מכיוון שבעלי חיים יכולים לפתח תגובה לצבע כאשר הם ניתנים ישירות למערכת העצבים המרכזית. תגובה זו יכולה להתרחש תוך דקה מהזרקה מוצלחת ומאופיינת בתנועות גירוד והתפתלות מהירות. יש להמית את בעלי החיים מיד לאחר שנצפתה תגובה זו כדי למזער את אי הנוחות. לאחר הזרקת צבע מוצלחת, הצבע יישאר ממוקם בעמוד השדרה (ללא צבע ברקמה ההיקפית הסמוכה), ויעבור במעלה עמוד השדרה אל המוח הקטן, המוח הקטן ונורות הריח. ב-P1, העור שקוף מספיק כך שניתן לראות את הצבע נע במורד עמוד השדרה בזנב. אם הצבע לא מגיע למוח תוך מספר דקות, ההזרקה נכשלת.

איור 3: צבע ירוק מקורמיק במוח לאחר תרגול מוצלח של הזרקות IT מותני. כל המוחות הם מעכברי P21 שהוזרקו להם צבע של 5 מיקרוליטר ומוצגים במבט הגחוני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
למידע נוסף על פרמטרים רלוונטיים הקשורים לתכנון ניסויים פרה-קליניים, כמו טיטר ומינונים ויראליים, ראה סקירות שפורסמו בעבר 3,6,31.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
ברצוננו להודות למתקן הליבה הווקטורי הנגיפי של UT Southwestern AAV על ייצור וקטור AAV9 ול-Yuhui Hu, מדען מחקר במעבדה האפורה, על עיבוד וצביעה של הרקמה המוצגת באיור 2.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
References
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16 (2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778 (2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565 (2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229 (2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31 (2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463 (2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761 (2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575 (2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217 (2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392 (2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650 (2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832 (2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286 (2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413 (2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197 (2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved