Method Article
Injeção intratecal lombar de vetores de terapia gênica para direcionamento do sistema nervoso central em camundongos e ratos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Uma injeção intratecal lombar representa uma via de administração translacionalmente relevante para administrar terapia gênica ao sistema nervoso central. Este protocolo padronizado abrangente para injeções intratecais lombares em camundongos e ratos neonatais, juvenis e adultos visa orientar os pesquisadores na adoção dessa técnica para estudos pré-clínicos de terapia gênica.
Resumo
Um método para atingir o sistema nervoso central para o tratamento de doenças neurológicas envolve a utilização da via de administração intratecal lombar. Essa abordagem contorna a barreira hematoencefálica para acessar diretamente o líquido cefalorraquidiano e, preferencialmente, atingir as células do sistema nervoso central. Vários estudos pré-clínicos publicados empregando a via de injeção intratecal lombar contribuíram para o desenvolvimento de ensaios clínicos de terapia genética; no entanto, os protocolos descritos são variáveis e dispersos em vários recursos. Aqui, é apresentado um conjunto abrangente de protocolos para injeções intratecais lombares em camundongos e ratos neonatais, juvenis e adultos para estudos de terapia gênica pré-clínica. Com treinamento adequado, essa técnica de injeção pode ser realizada de forma rápida e confiável. Além de detalhar o protocolo de injeção em cada estágio de desenvolvimento, são discutidos parâmetros associados, como volume de injeção, que podem influenciar os resultados do estudo. Para demonstrar a aplicação de injeções intratecais lombares para atingir o sistema nervoso central, a expressão do sorotipo 9 do vírus adeno-associado no cérebro, medula espinhal e tecidos periféricos é apresentada após uma injeção bem-sucedida ou malsucedida.
Introdução
Um desafio no tratamento de doenças neurológicas que requerem entrega global do sistema nervoso central (SNC), mas são boas candidatas à terapia gênica, tem sido amplamente atribuído ao direcionamento ineficiente do SNC e dos tipos de células relevantes1. Uma quantidade substancial de pesquisas está em andamento para otimizar o direcionamento global de células e tecidos do SNC por meio de veículos de entrega de engenharia 1,2. No entanto, a entrega de vetores razoavelmente difundida ainda pode ser alcançada com a atual tecnologia de vetores de terapia genética, usando certas combinações de vetores virais e vias de administração 3,4. O padrão-ouro atual para obter a entrega generalizada do SNC a partir de um tratamento único é usar o sorotipo 9 do vírus adeno-associado (AAV9) juntamente com uma injeção direta no líquido cefalorraquidiano (LCR).
Existem três vias típicas de administração para injeções diretas de LCR: intratecal lombar (IT), intracerebroventricular (ICV) e intracisternal (ICM)5. Cada uma dessas vias de administração resulta em diferentes padrões de biodistribuição no SNC e nos tecidos periféricos, mas todas têm o benefício de contornar a barreira hematoencefálica (BHE) para alcançar as células do SNC que contribuem para a patologia e fenótipos de doenças neurológicas6. A injeção lombar de IT é o padrão para o uso clínico de drug delivery em humanos, pois o procedimento clínico é rotineiro e direto, com menos invasividade em comparação com as injeções de ICV e ICM.
A injeção lombar de IT é uma técnica estabelecida e prontamente utilizada nas áreas anestésica e analgésica, com o primeiro trabalho publicado em 18857. O primeiro protocolo para injeções lombares de IT em camundongos adultos foi publicado em 19808 e, desde então, tem sido amplamente adotado e revisado9. Pequenos ajustes ou melhorias nesses protocolos foram feitos 10,11,12, incluindo uma técnica de conservação do produto 13. Protocolos para injeções lombares de IT em ratos adultos também foram publicados pela primeira vez em 1976, com cateterismo para administração crônica14 e injeção direta para tratamentos únicos15. Mais recentemente, grupos publicaram protocolos para injeções lombares de TI em camundongos e ratos neonatais ou juvenis16,17.
A ampla adoção e validação dessa técnica para contornar a BHE e as células-alvo no SNC levaram a vários estudos pré-clínicos e clínicos de terapia genética bem-sucedidos para o tratamento de doenças neurológicas. Dados positivos de eficácia e segurança em camundongos, ratos e primatas não humanos que modelam doenças neurológicas despertaram entusiasmo e interesse em torno do potencial de benefício clínico para essas doenças 18,19,20,21,22,23. Alguns desses estudos estão agora em ensaios clínicos (por exemplo, identificadores clinicaltrials.gov NCT02362438, NCT04737460, NCT03381729 e NCT05518188)3,6. Neste artigo, é descrito um protocolo simples para injeções lombares de TI em camundongos e ratos de diferentes idades, sem remover o LCR, que pode ser adotado para projetos de terapia gênica translacional. Este protocolo é semelhante aos protocolos já disponíveis que são amplamente adotados; no entanto, há valor em citar esses protocolos relevantes em um só lugar para facilitar o acesso e a referência, juntamente com os recursos visuais de vídeo que os acompanham. Este protocolo explica a injeção para camundongos e ratos neonatais no dia pós-natal (P) 0-1 e camundongos e ratos juvenis P21, com resultados representativos de uma injeção lombar de TI bem-sucedida e malsucedida em P1 em camundongos. Na discussão, são abordados erros comuns e detalhes específicos que requerem atenção cuidadosa durante a realização deste procedimento, bem como recomendações sobre como praticar essas injeções antes de iniciar um estudo pré-clínico.
Protocolo
Os procedimentos aqui descritos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) do Centro Médico do Sudoeste da Universidade do Texas. Camundongos machos e fêmeas C57BL6/J do tipo selvagem, com idade P1-P28, foram usados para protocolos envolvendo camundongos. Ratos selvagens da raça Sprague-Dawley, machos e fêmeas, com idade P1-P56, foram utilizados para protocolos envolvendo ratos. Além da cirurgia de sobrevivência descrita na seção 3, todos os outros procedimentos são considerados como causadores apenas de desconforto momentâneo e não requerem o uso de anestésicos ou analgésicos. Os indivíduos devem monitorar os animais de laboratório quanto a mais do que desconforto momentâneo e buscar orientação de sua equipe IACUC e veterinária sobre a necessidade de anestésicos e analgésicos. Detalhes dos reagentes e equipamentos utilizados são fornecidos na Tabela de Materiais.
1. Injeção lombar de TI de camundongos >P21
- Preparação
- Preparar as soluções injetáveis, incluindo o vector de terapia génica na(s) concentração(ões) desejada(s) e uma solução de controlo (normalmente o tampão de formulação utilizado na produção do vector). As soluções injetáveis devem ser estéreis e permanecer estéreis durante todo o procedimento.
NOTA: Todas as soluções devem ser mantidas em gelo durante o procedimento. - Reúna e higienize todos os materiais, incluindo seringa e agulha, pipeta e solução injetável. Siga as diretrizes institucionais quanto ao uso de cabines de biossegurança e exposição a injetantes. Os procedimentos aqui descritos foram realizados em uma cabine de biossegurança classe 2.
- Usando uma pipeta de microlitro, meça o volume desejado de solução de injeção e transfira-o para um filme de parafina estéril. Um volume de injeção de 5 μL é comumente usado e é tratado como o volume alvo para camundongos adultos >P21 (Tabela 1).
NOTA: O volume pode ser aumentado se necessário; no entanto, os animais devem ser monitorizados de perto quanto a reações adversas a volumes de injeção maiores. Consulte a seção Discussão para obter detalhes sobre o volume de injeção e reações adversas. A solução também pode ser transferida diretamente da ponta da pipeta para uma seringa, ou seringas calibradas de microlitros à prova de gás podem ser usadas para medir diretamente o volume da solução de injeção. - Aspire a solução para uma seringa de microlitros com uma agulha de 30 G 0,5", com cuidado para não formar bolhas de ar.
NOTA: O calibre e o comprimento da agulha podem afetar a penetração na pele. Ao considerar o tamanho da seringa a ser usada, o volume de injeção não deve ser inferior a 10% da capacidade da seringa. Para volumes superiores a 50% da capacidade da seringa, certifique-se de que o êmbolo possa ser facilmente pressionado com o dedo indicador. Se o êmbolo não puder ser pressionado facilmente, use uma seringa de maior capacidade.
- Preparar as soluções injetáveis, incluindo o vector de terapia génica na(s) concentração(ões) desejada(s) e uma solução de controlo (normalmente o tampão de formulação utilizado na produção do vector). As soluções injetáveis devem ser estéreis e permanecer estéreis durante todo o procedimento.
- Restrição
- Usando a mão dominante, segure o rato consciente (não anestesiado) pela cauda em uma toalha de papel. A toalha de papel ajudará a conter, acalmar e evitar que o rato morda. O mouse deve estar na posição neutra de bruços com o aspecto lateral do corpo voltado para você.
NOTA: Não é necessário treinar ou habituar camundongos a esta contenção antes do procedimento. Os camundongos podem ter dificuldades devido à contenção, mas não devem provocar uma resposta específica à dor. Se forem observadas respostas mais do que momentâneas à dor, pode ser necessária a administração de analgésicos; procure orientação veterinária. - Com a mão não dominante, dobre uma parte da toalha de papel sobre a cabeça e a parte superior do corpo do mouse e segure firmemente a cintura pélvica entre o polegar não dominante e o dedo indicador. Certifique-se de que a palma da mão esteja em forma de concha, apoiada ao redor da cabeça do mouse. A crista ilíaca do camundongo deve ser palpável e posicionada no centro da falange distal de cada dedo (Figura 1A, B).
NOTA: A contenção da mão ou da toalha de papel não deve prejudicar a respiração. - Gire suavemente a base da cauda para garantir o alinhamento adequado da coluna. A pelve do camundongo deve ser quadrada, de modo que os processos vertebrais da coluna lombar sejam perpendiculares à superfície de trabalho.
- Limpe a região lombar dorsal do camundongo com uma almofada de preparação com álcool a 70%.
- Separe o cabelo ~ 2-6 mm cranial à crista ilíaca para ajudar a visualizar o local da injeção.
- Sinta o espaço intervertebral L4-L5 ou L5-L6, ~ 2-6 mm cranial à crista ilíaca.
NOTA: A distância exata é variável dependendo do tamanho e da idade do mouse.
- Usando a mão dominante, segure o rato consciente (não anestesiado) pela cauda em uma toalha de papel. A toalha de papel ajudará a conter, acalmar e evitar que o rato morda. O mouse deve estar na posição neutra de bruços com o aspecto lateral do corpo voltado para você.
- Injecção
- Usando a mão dominante, segure o centro da seringa de microlitro e posicione-a perpendicularmente à coluna vertebral do camundongo no espaço intervertebral L4-L5 ou L5-L6. Certifique-se de que o êmbolo da seringa pode ser pressionado com o dedo indicador sem movimento excessivo da mão. Com o chanfro da agulha voltado para a cabeça do camundongo, perfure a pele sobre o espaço intervertebral.
- Quando as bordas do osso ao redor do espaço intervertebral forem sentidas na ponta da agulha, reduza o ângulo da seringa para 30-45 graus (Figura 1A).
- A agulha deve deslizar para o espaço intervertebral, causando um movimento repentino da cauda, e deve ser firmemente presa entre as vértebras.
- Tomando cuidado para não deslocar a seringa, pressione o êmbolo firmemente para fornecer a solução em 10 s.
- Segure a seringa no lugar por 15-30 s depois de pressionar totalmente o êmbolo para permitir a dissipação da solução e evitar o refluxo.
- Retire suave e lentamente a seringa do mouse no mesmo ângulo de entrada de 30 a 45 graus. À medida que a agulha é retirada, gire a seringa para evitar o refluxo.
NOTA: Tenha cuidado para não avançar a agulha ao girar a seringa, pois isso pode causar danos físicos à medula espinhal. - Solte o mouse da restrição e devolva-o à gaiola inicial.
- Monitore o mouse após a injeção quanto a deambulação anormal, comprometimento motor, anormalidades respiratórias e coordenação. Consulte a Discussão para obter detalhes adicionais sobre reações adversas.
- Limpe o equipamento seguindo as recomendações do fabricante. Para injeções múltiplas, são recomendadas seringas diferentes para cada vetor de terapia gênica e solução de controle.
NOTA: As agulhas removíveis podem ser limpas, esterilizadas e reutilizadas várias vezes; no entanto, agulhas cegas não devem ser usadas, pois podem prejudicar o animal e aumentar a probabilidade de injeções perdidas. Uma agulha cega não perfura a pele facilmente e deve ser descartada adequadamente. Se as seringas forem limitadas, é aconselhável completar todas as injeções de veículo antes de prosseguir para o vetor de terapia gênica e injetar a dose mais baixa de terapia gênica antes de administrar doses mais altas. - Siga as diretrizes institucionais para esterilização de equipamentos entre animais.
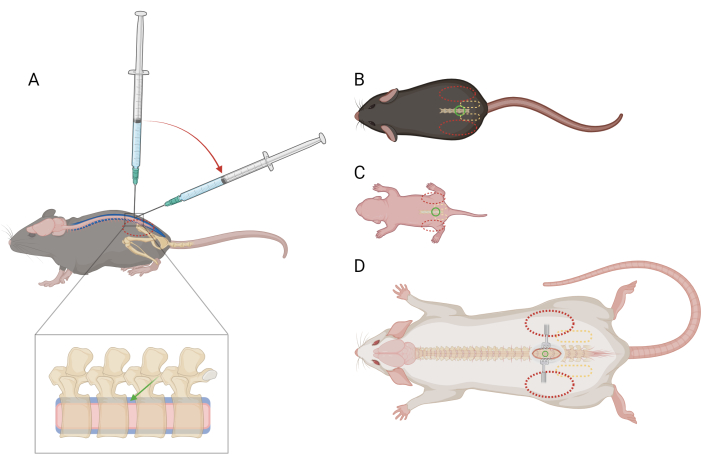
Figura 1: Esquema da colocação do dedo e da seringa para injeção intratecal lombar em camundongos e ratos. (A) Vista lateral de um camundongo >P21 mostrando a colocação da agulha e a transição do ângulo da seringa durante uma injeção lombar de IT. O oval vermelho tracejado indica o posicionamento do dedo sobre a crista ilíaca do camundongo. Uma visão ampliada da coluna vertebral mostra o espaço intratecal (azul) com posicionamento aproximado da agulha (seta verde) e a medula espinhal (rosa). Vista dorsal de (B) um camundongo >P21, (C) um camundongo D) um rato >P21, com pontos de referência para colocação de agulha (círculo verde), cintura pélvica (oval amarelo tracejado) e colocação de dedos (oval vermelho tracejado). O local da incisão e os afastadores também estão representados em (D). Clique aqui para ver uma versão maior desta figura.
2. Injeção lombar de TI de camundongos e ratos
- Preparação
- Siga o passo 1.1. A única exceção é o volume de injeção na etapa 1.1.3.
NOTA: Os volumes de injeção recomendados para camundongos neonatais (P0-P1) não devem exceder 3 μL, para camundongos juvenis (P5-P7) não devem exceder 5 μL e para camundongos juvenis (P10) não devem exceder 10 μL. Os volumes de injeção recomendados para ratos neonatais (P0-P1) não devem exceder 5 μL, para ratos juvenis (P5-P7) não devem exceder 10 μL e para ratos juvenis (P10) não devem exceder 30 μL (Tabela 1).
- Siga o passo 1.1. A única exceção é o volume de injeção na etapa 1.1.3.
- Restrição
- Usando a mão dominante, segure o camundongo/rato pela cauda em uma toalha de papel. O camundongo / rato deve estar na posição neutra de bruços com o aspecto lateral do corpo voltado para você.
NOTA: Camundongos / ratos podem ter dificuldades devido à contenção, mas não devem provocar uma resposta específica à dor. Se forem observadas respostas mais do que momentâneas à dor, pode ser necessária a administração de analgésicos; procure orientação veterinária. - Segure suavemente, mas com firmeza, a cintura pélvica entre o polegar não dominante e o dedo indicador. A crista ilíaca deve ser palpável e posicionada no centro da falange distal de cada dedo (Figura 1C).
NOTA: Nessa idade, não há preocupação em ser mordido, portanto, não é necessário enrolar a toalha de papel sobre o camundongo / rato. Pode ser necessário usar uma toalha de papel em ratos P5-10 para manter os filhotes de ratos maiores parados. - Gire suavemente a base da cauda para garantir o alinhamento adequado da coluna. A pelve do camundongo / rato deve ser quadrada para que os processos vertebrais da coluna lombar fiquem perpendiculares à superfície de trabalho.
- Limpe a região lombar dorsal do camundongo / rato com uma almofada de preparação com álcool a 70%.
- Separe o cabelo, se aplicável, ~ 1-3 mm cranial à crista ilíaca para ajudar a visualizar o local da injeção. A visualização da área-alvo é mais fácil em camundongos/ratos mais jovens. Em neonatos sem pelos, um recuo pode ser visto no espaço intervertebral.
- Sinta ou visualize o espaço intervertebral L4-L5 ou L5-L6, ~ 1-3 mm cranial à crista ilíaca.
NOTA: A distância exata é variável dependendo do tamanho e da idade do camundongo/rato.
- Usando a mão dominante, segure o camundongo/rato pela cauda em uma toalha de papel. O camundongo / rato deve estar na posição neutra de bruços com o aspecto lateral do corpo voltado para você.
- Injecção
- Usando a mão dominante, segure o centro da seringa de microlitro e posicione-a em um ângulo de 30 a 45 graus em relação à coluna vertebral do camundongo/rato. Com o bisel da agulha voltado para a cabeça do camundongo/rato, perfure a pele aproximadamente 1-3 mm para o espaço intervertebral. Devido à orientação angular da seringa, o ponto de inserção na pele é ligeiramente caudal ao espaço intervertebral.
NOTA: Esta distância pode mudar com a idade e o tamanho do camundongo/rato. - O restante das etapas é idêntico às etapas 1.3.3-1.3.10 de camundongos >P21.
- Usando a mão dominante, segure o centro da seringa de microlitro e posicione-a em um ângulo de 30 a 45 graus em relação à coluna vertebral do camundongo/rato. Com o bisel da agulha voltado para a cabeça do camundongo/rato, perfure a pele aproximadamente 1-3 mm para o espaço intervertebral. Devido à orientação angular da seringa, o ponto de inserção na pele é ligeiramente caudal ao espaço intervertebral.
3. Injeção lombar de TI de ratos >P21
NOTA: Existem vários procedimentos de injeção de IT descritos na literatura, variando de técnicas não anestesiadas a abordagens cirúrgicas mais extensas14,15. Um procedimento para injeção direta usando uma técnica minimamente invasiva é descrito usando anestesia leve e uma pequena incisão na pele. O uso de anestesia, como o gás isoflurano, pode ajudar na contenção, relaxar a musculatura e impedir o movimento durante a injeção. Fazer uma pequena incisão na pele sobre o local da injeção melhora a precisão da injeção, permitindo a visualização do espaço intervertebral e eliminando a necessidade de perfurar a pele grossa. Devido à incisão, é necessário o uso de anestésicos e analgésicos. Com a prática, é possível realizar injeções lombares de TI em ratos maiores que P21 sem anestesia ou incisão, a critério do usuário e dependendo das exigências institucionais15. Siga as diretrizes e considerações institucionais sobre anestesia, analgésicos apropriados e cirurgia de sobrevivência para animais de laboratório.
- Preparação
- Siga o passo 1.1. As únicas exceções são o volume de injeção na etapa 1.1.3 e o tamanho da agulha na etapa 1.1.4. Os volumes de injeção para ratos podem variar muito de acordo com a idade e o tamanho do corpo. Consulte a seção Discussão para obter mais informações sobre o volume de injeção em diferentes idades (Tabela 1).
NOTA: Uma agulha de 27 G x 1" é recomendada para ratos adultos, pois agulhas de calibre menor podem dobrar e agulhas mais curtas podem não penetrar adequadamente no espaço intratecal. Uma agulha mais longa (1,25-1,5") pode ser usada, se desejado. - Anestesiar o rato usando o anestésico preferido e aprovado (seguindo os protocolos aprovados institucionalmente).
NOTA: Para os procedimentos aqui descritos, os ratos foram anestesiados com isoflurano e uma mistura 1:1 de lidocaína: a bupivacaína foi usada como anestésico local. A temperatura corporal deve ser mantida usando uma fonte de calor externa aprovada durante todo o procedimento e recuperação. - Siga a preparação asséptica padrão do local cirúrgico para cada animal. Resumidamente, raspe a região lombar dorsal e prepare a pele com uma esfoliação cirúrgica, betadina e álcool isopropílico 70%.
- Siga o passo 1.1. As únicas exceções são o volume de injeção na etapa 1.1.3 e o tamanho da agulha na etapa 1.1.4. Os volumes de injeção para ratos podem variar muito de acordo com a idade e o tamanho do corpo. Consulte a seção Discussão para obter mais informações sobre o volume de injeção em diferentes idades (Tabela 1).
- Procedimento cirúrgico
- Coloque o rato na posição neutra de bruços com o aspecto lateral do corpo voltado para você.
- Palpe a cintura pélvica, identificando a crista ilíaca e a junção lombossacral. Em ratos >P21, os processos vertebrais podem ser facilmente identificados.
- Usando um bisturi, faça uma incisão de 1 cm sobre o espaço intervertebral L4-L5 ou L5-L6. A incisão deve envolver apenas a pele e a fáscia subjacente, deixando o músculo intacto.
NOTA: É útil usar afastadores para manter a pele aberta durante o restante do procedimento. - Segure suavemente, mas com firmeza, a cintura pélvica entre o polegar não dominante e o dedo indicador. A crista ilíaca deve ser palpável e posicionada no centro da falange distal de cada dedo (Figura 1D). Use uma pinça de mosquito para sondar ao longo da linha média das costas para localizar o espaço intervertebral.
- Injecção
- Usando a mão dominante, segure o centro da seringa de microlitro e posicione-a perpendicularmente à coluna vertebral do rato no espaço intervertebral L4-L5 ou L5-L6. Certifique-se de que o êmbolo da seringa pode ser pressionado com o dedo indicador sem movimento excessivo da mão. Com o bisel da agulha voltado para a cabeça do rato, perfure o músculo com a agulha sobre o espaço intervertebral.
- Avance a agulha para o espaço intervertebral.
NOTA: A agulha pode ter uma ligeira resistência ao passar entre os processos vertebrais, e o ângulo da seringa pode precisar ser ligeiramente ajustado para passar por esse espaço. No entanto, deve permanecer aproximadamente 90 graus, perpendicular à coluna. Um estalo será sentido quando a agulha entrar no espaço intratecal. Dependendo dos parâmetros anestésicos, um movimento da cauda ou da perna pode ou não ser perceptível. A agulha deve ser firmemente presa entre as vértebras. - Com cuidado para não mover a seringa para fora da posição, pressione o êmbolo para fornecer a solução em 30 s.
NOTA: Ao contrário das injeções em camundongos, pode não ser possível reduzir o ângulo da seringa em ratos >P21 usando este método. Volumes maiores devem ser injetados a uma taxa mais lenta para evitar o acúmulo excessivo de pressão. - Segure a seringa no lugar por 30-60 s depois de pressionar totalmente o êmbolo para permitir a dissipação da solução e evitar o refluxo.
- Retire suavemente a seringa do rato. À medida que a agulha é retirada, gire a seringa para evitar o refluxo.
NOTA: Tenha cuidado para não avançar a agulha ao girar a seringa, pois isso pode causar danos físicos à medula espinhal. - Feche a incisão na pele usando um método aprovado, como sutura ou clipes de ferida. Para os ratos utilizados neste protocolo, a pele foi fechada em padrão intradérmico contínuo ou simples interrompido com sutura 5-0 PDS II.
- Recupere o rato da anestesia.
- Siga as etapas 1.3.9-1.3.10 e todas as diretrizes de cuidados pós-operatórios.
Resultados
Embora muitos fatores possam influenciar a transdução do vetor da terapia gênica, a coloração histológica do tecido continua sendo o método mais preciso para determinar o sucesso das injeções intratecais lombares (IT). A distribuição ampla e uniforme do vetor de terapia gênica no sistema nervoso central (SNC) após a injeção é indicativa de um procedimento bem-sucedido. A Figura 2C representa uma injeção bem-sucedida de uma terapia gênica auto-complementar mediada por AAV9 conduzindo a expressão fraca de transgene onipresente sob o promotor JeT em uma dose de 1,3 × 1011 vg / camundongo em camundongos neonatais (P1), 4 meses após a injeção. A análise de RNAscope, usando uma sonda direcionada ao transgene fornecido pela terapia gênica, revela ampla distribuição na medula espinhal lombar, medula espinhal cervical e cérebro. Uma seção do fígado e do coração é incluída para destacar que, mesmo com a injeção direta de líquido cefalorraquidiano (LCR), o vetor de terapia gênica ainda pode ser distribuído para os tecidos periféricos.

Figura 2: Seções de tecido coradas de 5 mícrons do SNC de camundongo e tecido periférico 4 meses após a injeção em P1. A coloração vermelha indica a expressão do transgene via RNAscópio, e a contracoloração azul dos núcleos é feita via hematoxilina. (A) Injeção com um tampão de formulação de controle. (B) Injeção intraparenquimatosa malsucedida com um vetor AAV9 (scAAV9_JeT-hDDX3Xopt-SpA). (C) Injeção de TI lombar bem-sucedida com um vetor AAV9 (scAAV9_JeT-hDDX3Xopt-SpA). O vetor de terapia gênica usado em (B) e (C) foi administrado em uma dose translacionalmente relevante de 1,3E11 vg / camundongo. Barra de escala: painel superior (5 mm); painel inferior (1 mm). Clique aqui para ver uma versão maior desta figura.
A expressão concentrada na medula espinhal lombar emparelhada com a falta de expressão no cérebro, conforme mostrado na Figura 2B, pode indicar uma injeção intraparenquimatosa da medula espinhal e deve ser considerada uma injeção malsucedida. Isso acontece quando a agulha é inserida muito longe na coluna vertebral, além do espaço intratecal e na medula espinhal. Além disso, a expressão muito baixa ou nenhuma expressão na medula espinhal e no cérebro (não mostrada) também deve ser considerada uma injeção fora do alvo com falha, supondo que um vetor e uma dose estejam sendo usados onde se espera uma ampla distribuição do SNC. Isso pode ser devido a não inserir a agulha longe o suficiente ou por ser lateral à linha média.
Os padrões de expressão observados em injeções bem-sucedidas podem diferir devido aos oito fatores a seguir, como exemplos: (1) idade na injeção, (2) imunidade pré-existente, (3) taxa de infusão, (4) vetor de terapia gênica, (5) dose de terapia gênica, (6) proteínas de superfície celular, (7) tropismo e (8) se aplicável, uma escolha de promotor apropriada para impulsionar a expressão do transgene6. Embora os padrões de expressão possam diferir, a distribuição ampla, uniforme e generalizada será universal, desde que a dose seja suficientemente alta com um vetor eficaz, como o AAV9.
As principais limitações do uso da análise histológica para confirmar o sucesso da injeção lombar de IT são os extensos tempos de espera - esperando até o final de um estudo, após a realização de necropsias e coleta de tecido - e extensos recursos necessários para processar tecido de todos os camundongos em um grande estudo de terapia genética. Infelizmente, nossa experiência tem sido que indicadores imediatos e diretos de uma injeção positiva ou negativa podem não ser confiáveis; no entanto, o reflexo de movimento da cauda quando a agulha entra no espaço intratecal é um bom indicador de posicionamento bem-sucedido em tempo real e provavelmente indica uma injeção bem-sucedida. Não confunda uma contração quando a agulha perfura a pele em um camundongo/rato não anestesiado com uma resposta de movimento da cauda à agulha que entra no espaço intratecal. O uso de agentes farmacológicos como NMDA, substância P e lidocaína, seja em treinamento ou misturado com a solução experimental de injeção, tem sido relatado como uma indicação mais imediata do sucesso da injeção 9,11,24. Se considerar esses agentes, é importante avaliar sua compatibilidade com o vetor da terapia gênica.
Discussão
A injeção lombar de IT é um procedimento rápido e minimamente invasivo que fornece de forma confiável um vetor de terapia gênica no LCR para o tratamento de doenças do SNC 5,6. O procedimento é translacionalmente relevante, e o protocolo descrito aqui detalha como realizar essa via de administração em camundongos e ratos em todas as idades, de neonatos a adultos. É importante definir este protocolo para camundongos e ratos de todas as idades, juntamente com o fornecimento de vídeos de apoio, para ajudar os investigadores na adoção deste método para administração de terapia gênica. A experiência do nosso laboratório é que este protocolo pode ser implementado de forma consistente em vários usuários e estudos ao longo do tempo 18,25,26,27,28,29,30.
Existem diferenças importantes ao realizar a injeção lombar de IT em camundongos/ratos mais jovens em comparação com camundongos/ratos mais velhos, principalmente o ângulo em que a agulha é inserida na coluna e o volume recomendado que é injetado. Os volumes de injeção lombar de IT relatados variam consideravelmente entre os estudos e entre as espécies31. A consideração do volume de injeção é importante para evitar elevações duradouras da pressão intracraniana (PIC), que podem comprometer o fluxo liquórico e o sangue cerebral, causar desconforto e levar a complicações neurológicas crônicas, incluindo hidrocefalia, isquemia, lesão celular e morte 32,33. A PIC é determinada pelo volume do LCR, do sangue cerebral e do tecido do SNC, que não podem ser diretamente correlacionados com o peso corporal. Em funcionamento normal, a PIC é autorregulada por muitos fatores, incluindo volume de LCR, volume de sangue cerebral, respiração, posição corporal, taxa de produção de LCR e taxa de drenagem de LCR para o sangue33,34. Os volumes de injeção de IT devem, portanto, ser determinados com base nas propriedades do LCR (Tabela 1) em vez do peso corporal 25,27,28,30. Os volumes recomendados para injetar em cada idade em cada espécie são indicados em negrito.
| Volume de injeção de TI | Valores do LCR em adultos | |||||||
| P0-1 (μL) | P5-7 (μL) | P10 (μL) | >P21 (μL) | Volume total (μL) | Taxa de produção (μL / min) | Volume de negócios (h) | Pressão intracraniana (mm Hg) | |
| Mouses | 3 | 5 | 5-10 | 5-20 | 30-4025,30 | 0,32-0,3525,30 | 1.7-225,30 | 5,0 +/- 0,528 |
| Ratos | 5 | 5-10 | 10-30 | 10-200 (20-75) | 15025 | 1,7-2,825 | 2-2,6625 | 8,6 +/- 1,7,27 |
Tabela 1: Resumo dos volumes de injeção lombar de IT para camundongos e ratos em diferentes idades. Valores em negrito são recomendados e foram entregues com segurança. Os volumes máximos possíveis não foram formalmente avaliados. Informações adicionais sobre os parâmetros conhecidos do LCR - volume total, taxa de produção, renovação e pressão intracraniana - em camundongos e ratos estão incluídas para referência.
Há uma falta de conhecimento em todo o campo sobre o limite superior para volumes de injeção única de TI em bolus. Em humanos adultos, ratos e camundongos onde o volume do LCR é conhecido, um aumento de 30% no volume total do LCR não parece causar lesões crônicas ou doenças 31,33,35,36. A falta de volumes conhecidos de LCR em camundongos juvenis ou neonatais torna impossível uma extrapolação semelhante. Alguns grupos estão começando a olhar para o volume e a produção de LCR em animais mais jovens37. Até que investigações adicionais nessas áreas sejam comprovadas, o volume de injeção continuará sujeito aos valores relatados pelo investigador.
Camundongos e ratos, especialmente quando tratados em idades mais jovens ou com altos volumes de injeção, podem provocar flexão dos músculos, extensão dos membros, respiração rápida ou paralisia temporária dos membros posteriores que devem se resolver em poucos minutos. Em casos extremos, as elevações agudas da PIC podem causar anormalidades cardiovasculares e respiratórias, que podem ser mortais32,33. Se alguma anormalidade pós-procedimento persistir após 24 horas, os camundongos/ratos devem ser removidos do estudo e sacrificados humanamente. A paralisia persistente dos membros posteriores pode ocorrer se a agulha for inserida muito longe, impactando a medula espinhal. Isso pode ser devido a um erro comum ao realizar a injeção lombar de IT: movimento da seringa após o movimento da cauda enquanto pressiona o êmbolo. O movimento da seringa e da agulha deve ser evitado. Se a posição correta não puder ser adquirida com a punção inicial, uma segunda tentativa no mesmo local pode ser feita. Se a segunda tentativa também não for bem-sucedida, tente alterar a posição da agulha para atingir o próximo espaço intervertebral. Observe que várias picadas de agulha podem levar ao vazamento de uma injeção subsequentemente bem-sucedida.
Tornar-se proficiente na injeção lombar de TI pode levar tempo. Para praticar as injeções como um procedimento terminal, siga o protocolo acima usando uma solução de corante aprovada, como azul de Evans ou corante verde McCormick filtrado a 0,2 mícrons (Figura 3) ou com os agentes farmacológicos abordados na seção Resultados Representativos. O uso de corante é recomendado para solucionar problemas e dominar a injeção, pois é fácil saber se uma injeção foi bem-sucedida ou fracassada em 1 minuto. A prática com corante é apenas para procedimentos de não sobrevivência, pois os animais podem desenvolver uma reação ao corante quando administrado diretamente ao SNC. Essa reação pode ocorrer dentro de um minuto após uma injeção bem-sucedida e é caracterizada por coceira rápida e movimentos de contorção. Os animais devem ser imediatamente sacrificados assim que essa reação for observada para minimizar o desconforto. Após uma injeção de corante de prática bem-sucedida, o corante permanecerá localizado na coluna vertebral (sem corante no tecido periférico próximo) e subirá pela coluna vertebral até o cerebelo, cérebro e bulbos olfatórios. Em P1, a pele é transparente o suficiente para que o corante possa ser visto descendo pela coluna vertebral na cauda. Se o corante não atingir o cérebro em alguns minutos, a injeção falha.

Figura 3: Corante verde McCormick no cérebro após injeções lombares de TI bem-sucedidas. Todos os cérebros são de camundongos P21 injetados com corante de 5 μL e são mostrados na visão ventral. Clique aqui para ver uma versão maior desta figura.
Para obter informações adicionais sobre parâmetros associados relevantes para o desenho de ensaios pré-clínicos, como título e doses virais, consulte as revisões publicadas anteriormente 3,6,31.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Gostaríamos de agradecer ao UT Southwestern AAV Viral Vector Core Facility pela fabricação do vetor AAV9 e a Yuhui Hu, Cientista Pesquisador do Laboratório Gray, pelo processamento e coloração do tecido apresentado na Figura 2.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
Referências
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16(2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778(2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565(2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229(2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31(2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463(2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761(2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575(2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217(2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392(2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650(2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832(2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286(2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413(2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197(2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8(2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados