Method Article
الحقن داخل القراب القطني لنواقل العلاج الجيني لاستهداف الجهاز العصبي المركزي في الفئران والجرذان
* These authors contributed equally
In This Article
Summary
يمثل الحقن داخل القراب القطني طريقا مناسبا للإعطاء لتوصيل العلاج الجيني إلى الجهاز العصبي المركزي. يهدف هذا البروتوكول الموحد الشامل للحقن داخل القراب القطني في الفئران والجرذان حديثي الولادة والأحداث والبالغين إلى توجيه الباحثين في اعتماد هذه التقنية لدراسات العلاج الجيني قبل السريري.
Abstract
تتضمن إحدى طرق استهداف الجهاز العصبي المركزي لعلاج الأمراض العصبية استخدام طريق الإعطاء داخل القراب القطني. يتجاوز هذا النهج الحاجز الدموي الدماغي للوصول مباشرة إلى السائل النخاعي واستهداف الخلايا بشكل تفضيلي داخل الجهاز العصبي المركزي. ساهمت العديد من الدراسات قبل السريرية المنشورة التي تستخدم طريق الحقن داخل القراب القطني في تطوير التجارب السريرية للعلاج الجيني. ومع ذلك ، فإن البروتوكولات الموصوفة متغيرة ومشتتة عبر موارد متعددة. هنا ، يتم تقديم مجموعة شاملة من البروتوكولات للحقن داخل القراب القطني في الفئران والجرذان حديثي الولادة والأحداث والبالغين لدراسات العلاج الجيني قبل السريري. مع التدريب المناسب ، يمكن إجراء تقنية الحقن هذه بسرعة وموثوقية. بالإضافة إلى تفصيل بروتوكول الحقن في كل مرحلة من مراحل التطور ، تتم مناقشة المعلمات المرتبطة ، مثل حجم الحقن ، التي يمكن أن تؤثر على نتائج الدراسة. لإثبات تطبيق الحقن داخل القراب القطنية لاستهداف الجهاز العصبي المركزي ، يتم تقديم التعبير عن النمط المصلي للفيروس المرتبط بالغدة 9 في الدماغ والحبل الشوكي والأنسجة الطرفية بعد الحقن الناجح أو غير الناجح.
Introduction
يعزى التحدي في علاج الأمراض العصبية التي تتطلب توصيل الجهاز العصبي المركزي العالمي (CNS) ولكنها مرشحة جيدة للعلاج الجيني إلى حد كبير إلى الاستهداف غير الفعال للجهاز العصبي المركزي وأنواع الخلايا ذات الصلة1. يجري قدر كبير من الأبحاث لتحسين استهداف الخلايا والأنسجة العالمية للجهاز العصبي المركزي من خلال مركبات التوصيل الهندسية1،2. ومع ذلك ، لا يزال من الممكن تحقيق إيصال النواقل على نطاق واسع إلى حد معقول باستخدام تقنية ناقلات العلاج الجيني الحالية ، باستخدام مجموعات معينة من النواقل الفيروسية وطرق الإعطاء3،4. المعيار الذهبي الحالي للحصول على توصيل الجهاز العصبي المركزي على نطاق واسع من العلاج لمرة واحدة هو استخدام النمط المصلي للفيروس المرتبط بالغدة 9 (AAV9) جنبا إلى جنب مع الحقن المباشر في السائل الدماغي النخاعي (CSF).
هناك ثلاثة طرق نموذجية للإعطاء للحقن السائل الدماغي النخاعي المباشر: داخل القراب القطني (IT) ، داخل المخ البطيني (ICV) ، وداخل الخزف (ICM)5. ينتج عن كل طريق من طرق الإدارة هذه أنماط توزيع حيوي مختلفة في الجهاز العصبي المركزي والأنسجة الطرفية ، ولكن جميعها تتمتع بميزة تجاوز الحاجز الدموي الدماغي (BBB) للوصول إلى الخلايا الموجودة في الجهاز العصبي المركزي التي تساهم في أمراض الأمراض العصبية والأنماط الظاهرية6. حقن تكنولوجيا المعلومات القطني هو المعيار لاستخدام توصيل الأدوية السريرية في البشر ، حيث أن الإجراء السريري روتيني ومباشر ، مع توغل أقل مقارنة بحقن ICV و ICM.
حقن تكنولوجيا المعلومات القطنية هو تقنية راسخة تستخدم بسهولة في مجالات التخدير والمسكنات ، مع نشر أول ورقة بحثية في عام 18857. تم نشر أول بروتوكول لحقن تكنولوجيا المعلومات القطنية في الفئران البالغة في عام 19808 ، ومنذ ذلك الحين تم اعتماده ومراجعته على نطاقواسع 9. تم إجراء تعديلات أو تحسينات طفيفة على هذهالبروتوكولات 10،11،12 ، بما في ذلك تقنية الحفاظ على المنتج13. كما تم نشر بروتوكولات حقن تكنولوجيا المعلومات القطنية في الفئران البالغة لأول مرة في عام 1976 ، مع القسطرة للإعطاء المزمن14 والحقن المباشر للعلاجات لمرةواحدة 15. في الآونة الأخيرة ، نشرت المجموعات بروتوكولات لحقن تكنولوجيا المعلومات القطنية في الفئران والجرذان حديثي الولادة أو الأحداث16،17.
أدى الاعتماد الواسع لهذه التقنية والتحقق من صحتها لتجاوز BBB والخلايا المستهدفة في الجهاز العصبي المركزي إلى العديد من الدراسات الناجحة للعلاج الجيني قبل السريري والسريري لعلاج الأمراض العصبية. أثارت بيانات الفعالية والسلامة الإيجابية في الفئران والجرذان والرئيسيات غير البشرية التي تضع نمذجة الأمراض العصبية الإثارة والاهتمام حول إمكانية الفائدة السريرية لهذه الأمراض18،19،20،21،22،23. حفنة من هذه الدراسات الآن في التجارب السريرية (على سبيل المثال ، معرفات clinicaltrials.gov NCT02362438 و NCT04737460 و NCT03381729 و NCT05518188)3،6. في هذه المقالة ، يتم وصف بروتوكول بسيط لحقن تكنولوجيا المعلومات القطنية في الفئران والجرذان من مختلف الأعمار ، دون إزالة السائل الدماغي النخاعي ، والذي يمكن اعتماده لمشاريع العلاج الجيني الانتقالي. يشبه هذا البروتوكول البروتوكولات المتاحة بالفعل والتي تم اعتمادها على نطاق واسع. ومع ذلك ، هناك قيمة في الاستشهاد بهذه البروتوكولات ذات الصلة في مكان واحد لسهولة الوصول إليها والرجوع إليها ، جنبا إلى جنب مع مرئيات الفيديو المصاحبة. يشرح هذا البروتوكول حقن الفئران والجرذان حديثي الولادة في يوم ما بعد الولادة (P) 0-1 والفئران والجرذان الصغيرة P21 ، مع نتائج تمثيلية من حقن تكنولوجيا المعلومات القطنية الناجح وغير الناجح في P1 في الفئران. في المناقشة ، تتم معالجة الأخطاء الشائعة والتفاصيل المحددة التي تتطلب عناية دقيقة أثناء تنفيذ هذا الإجراء ، بالإضافة إلى توصيات حول كيفية ممارسة هذه الحقن قبل البدء في دراسة قبل السريرية.
Protocol
تمت الموافقة على الإجراءات الموضحة هنا من قبل اللجنة المؤسسية لرعاية واستخدامه (IACUC) في المركز الطبي بجامعة تكساس ساوث وسترن. تم استخدام الفئران من النوع البري C57BL6 / J ، الذين تتراوح أعمارهم بين P1-P28 ، للبروتوكولات التي تشمل الفئران. تم استخدام ذكور وإناث الفئران من النوع البري Sprague-Dawley ، الذين تتراوح أعمارهم بين P1-P56 ، للبروتوكولات التي تنطوي على الفئران. بصرف النظر عن جراحة البقاء على قيد الحياة الموضحة في القسم 3 ، تعتبر جميع الإجراءات الأخرى تسبب إزعاجا مؤقتا فقط ولا تتطلب استخدام التخدير أو المسكنات. يجب على الأفراد مراقبة المختبر بحثا عن أكثر من الانزعاج اللحظي وطلب التوجيه من IACUC والموظفين البيطريين حول ضرورة التخدير والمسكنات. وترد تفاصيل الكواشف والمعدات المستخدمة في جدول المواد.
1. حقن تكنولوجيا المعلومات القطنية للفئران >P21
- اعداد
- تحضير محاليل الحقن، بما في ذلك ناقل العلاج الجيني بالتركيز (التركيزات) المطلوبة ومحلول التحكم (عادة ما يكون المخزن المؤقت للتركيبة المستخدم في إنتاج نواقل النواقل). يجب أن تكون محاليل الحقن معقمة ويجب أن تظل معقمة طوال العملية.
ملاحظة: يجب الحفاظ على جميع المحاليل على الجليد طوال مدة الإجراء. - اجمع وقم بتعقيم جميع المواد ، بما في ذلك المحقنة والإبرة والماصة ومحلول الحقن. اتبع الإرشادات المؤسسية فيما يتعلق باستخدام خزانات السلامة الحيوية والتعرض للحقن. تم إجراء الإجراءات الموضحة هنا في خزانة السلامة البيولوجية من الفئة 2.
- باستخدام ماصة ميكرولتر ، قم بقياس الحجم المطلوب لمحلول الحقن ونقله إلى طبقة البارافين المعقمة. يشيع استخدام حجم الحقن البالغ 5 ميكرولتر ويتم التعامل معه على أنه الحجم المستهدف للفئران البالغة >P21 (الجدول 1).
ملاحظة: يمكن زيادة مستوى الصوت إذا لزم الأمر ؛ ومع ذلك ، يجب مراقبة عن كثب بحثا عن ردود الفعل السلبية لأحجام الحقن الأكبر. راجع قسم المناقشة للحصول على تفاصيل حول حجم الحقن وردود الفعل السلبية. يمكن أيضا نقل المحلول مباشرة من طرف الماصة إلى حقنة، أو يمكن استخدام محاقن ميكرولتر معايرة محكمة الغلق بالغاز لقياس حجم محلول الحقن مباشرة. - ارسم المحلول في حقنة ميكرولتر بإبرة 30 جم 0.5 بوصة ، مع الحرص على عدم سحب أي فقاعات هواء.
ملاحظة: يمكن أن يؤثر مقياس الإبرة وطولها على اختراق الجلد. عند النظر في حجم المحقنة المراد استخدامها ، يجب ألا يقل حجم الحقن عن 10٪ من سعة المحقنة. بالنسبة للأحجام التي تزيد عن 50٪ من سعة الحقنة ، تأكد من إمكانية الضغط على المكبس بسهولة بإصبعك السبابة. إذا تعذر الضغط على المكبس بسهولة ، فاستخدم حقنة ذات سعة أكبر.
- تحضير محاليل الحقن، بما في ذلك ناقل العلاج الجيني بالتركيز (التركيزات) المطلوبة ومحلول التحكم (عادة ما يكون المخزن المؤقت للتركيبة المستخدم في إنتاج نواقل النواقل). يجب أن تكون محاليل الحقن معقمة ويجب أن تظل معقمة طوال العملية.
- تقييد
- باستخدام اليد المهيمنة ، أمسك الفأر الواعي (غير المخدر) من الذيل على منشفة ورقية. ستساعد المنشفة الورقية على ضبط النفس والتهدئة ومنع الماوس من العض. يجب أن يكون الماوس في وضع الانبطاح المحايد مع الجانب الجانبي للجسم في مواجهتك.
ملاحظة: ليس من الضروري تدريب الفئران أو تعويدها على هذا التقييد قبل الإجراء. قد تكافح الفئران بسبب ضبط النفس ولكن لا ينبغي أن تثير استجابة ألم محددة. إذا لوحظت أكثر من استجابات الألم اللحظية, قد يكون من الضروري إعطاء المسكنات; اطلب التوجيه البيطري. - باستخدام اليد غير المهيمنة ، قم بطي جزء من المنشفة الورقية فوق رأس الماوس والجزء العلوي من جسمه وامسك حزام الحوض بإحكام بين الإبهام والسبابة غير المهيمنة. تأكد من أن راحة اليد مقعرة ، وتستريح حول رأس الماوس. يجب أن تكون القمة الحرقفية للفأر محسوسة وموضوعة في وسط الكتائب البعيدة لكل إصبع (الشكل 1 أ ، ب).
ملاحظة: يجب ألا يضعف ضبط النفس من اليد أو المناشف الورقية التنفس. - قم بتدوير قاعدة الذيل برفق لضمان المحاذاة المناسبة للعمود الفقري. يجب أن يكون حوض الفأر مربعا ، بحيث تكون العمليات الفقرية للعمود الفقري القطني متعامدة مع سطح العمل.
- امسح المنطقة القطنية الظهرية للفأر باستخدام وسادة تحضير للكحول بنسبة 70٪.
- قم بتقسيم الشعر ~ 2-6 مم إلى القمة الحرقفية للمساعدة في تصور موقع الحقن.
- اشعر بالفضاء الفقري L4-L5 أو L5-L6 ، ~ 2-6 مم في الجمجمة إلى القمة الحرقفية.
ملاحظة: المسافة الدقيقة متغيرة حسب حجم الماوس وعمره.
- باستخدام اليد المهيمنة ، أمسك الفأر الواعي (غير المخدر) من الذيل على منشفة ورقية. ستساعد المنشفة الورقية على ضبط النفس والتهدئة ومنع الماوس من العض. يجب أن يكون الماوس في وضع الانبطاح المحايد مع الجانب الجانبي للجسم في مواجهتك.
- حقن
- باستخدام اليد المهيمنة ، أمسك مركز حقنة الميكرولتر وضعها بشكل عمودي على العمود الفقري للفأر في الفضاء الفقري L4-L5 أو L5-L6. تأكد من أن مكبس المحقنة يمكن ضغطه بإصبعك السبابة دون حركة يدك المفرطة. مع مواجهة شطبة الإبرة لرأس الفأر ، قم بثقب الجلد فوق الفراغ الفقري.
- عندما يتم الشعور بحواف العظم حول الفضاء الفقري عند طرف الإبرة ، قلل زاوية المحقنة إلى 30-45 درجة (الشكل 1 أ).
- يجب أن تنزلق الإبرة إلى الفراغ الفقري مما يتسبب في نفض الغبار المفاجئ في الذيل ، ويجب تثبيتها بإحكام بين الفقرات.
- مع الحرص على عدم إزاحة المحقنة ، اضغط على المكبس بثبات لتوصيل المحلول في غضون 10 ثوان.
- امسك المحقنة في مكانها لمدة 15-30 ثانية بعد الضغط الكامل على المكبس للسماح بتبديد المحلول ومنع التدفق العكسي.
- اسحب المحقنة بسلاسة وببطء من الماوس بنفس زاوية الدخول 30-45 درجة. عند سحب الإبرة ، قم بتدوير المحقنة لمنع التدفق العكسي.
ملاحظة: توخي الحذر حتى لا تتقدم الإبرة عند تدوير المحقنة ، لأن ذلك قد يتسبب في تلف جسدي للحبل الشوكي. - حرر الماوس من التقييد وأعده إلى قفص المنزل.
- راقب الماوس بعد الحقن بحثا عن التجوال غير الطبيعي ، والضعف الحركي ، وتشوهات التنفس ، والتنسيق. انظر المناقشة للحصول على تفاصيل إضافية حول ردود الفعل السلبية.
- تنظيف المعدات باتباع توصيات الشركة المصنعة. بالنسبة للحقن المتعددة ، يوصى باستخدام محاقن مختلفة لكل ناقل للعلاج الجيني ومحلول التحكم.
ملاحظة: يمكن تنظيف الإبر القابلة للإزالة وتعقيمها وإعادة استخدامها عدة مرات ؛ ومع ذلك ، لا ينبغي استخدام الإبر الباهتة لأنها يمكن أن تضر بالحيوان وتزيد من احتمالية الحقن الفائتة. لن تثقب الإبرة الباهتة الجلد بسهولة ويجب التخلص منها بشكل مناسب. إذا كانت المحاقن محدودة ، فمن المستحسن إكمال جميع حقن السيارة قبل الشروع في ناقل العلاج الجيني وحقن أقل جرعة من العلاج الجيني قبل إعطاء جرعات أعلى. - اتبع الإرشادات المؤسسية لتعقيم المعدات بين.
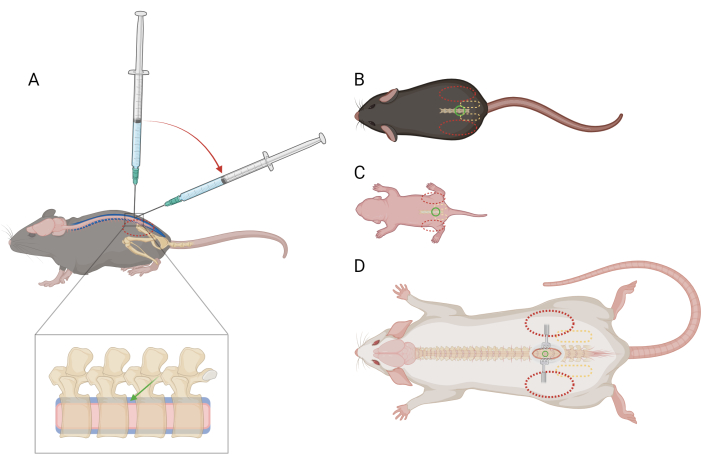
الشكل 1: تخطيطي لوضع الإصبع والحقنة للحقن داخل القراب القطني في الفئران والجرذان. (أ) منظر جانبي للفأر >P21 يظهر وضع الإبرة وانتقال زاوية المحقنة أثناء حقن تكنولوجيا المعلومات القطنية. يشير الشكل البيضاوي الأحمر المتقطع إلى وضع الإصبع فوق القمة الحرقفية للفأر. يظهر منظر موسع للعمود الفقري الفراغ داخل القراب (الأزرق) مع وضع الإبرة التقريبي (السهم الأخضر) والحبل الشوكي (الوردي). منظر ظهري ل (B) فأر >P21 ، (C) فأر D) فأر >P21 ، مع نقاط مرجعية لوضع الإبرة (الدائرة الخضراء) ، وحزام الحوض (بيضاوي أصفر متقطع) ، ووضع الإصبع (بيضاوي أحمر متقطع). كما تم تصوير موقع الشق والضاعات في (د). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. حقن تكنولوجيا المعلومات القطنية للفئران والجرذان
- اعداد
- اتبع الخطوة 1.1. الاستثناء الوحيد هو حجم الحقن في الخطوة 1.1.3.
ملاحظة: يجب ألا تتجاوز أحجام الحقن الموصى بها للفئران حديثة الولادة (P0-P1) 3 ميكرولتر، وللفئران اليافعة (P5-P7) يجب ألا تتجاوز 5 ميكرولتر، وللفئران الصغيرة (P10) يجب ألا تتجاوز 10 ميكرولتر. يجب ألا تتجاوز أحجام الحقن الموصى بها للفئران حديثة الولادة (P0-P1) 5 ميكرولتر، وللفئران الصغيرة (P5-P7) يجب ألا تتجاوز 10 ميكرولتر، وللفئران الصغيرة (P10) يجب ألا تتجاوز 30 ميكرولتر (الجدول 1).
- اتبع الخطوة 1.1. الاستثناء الوحيد هو حجم الحقن في الخطوة 1.1.3.
- تقييد
- باستخدام اليد المهيمنة ، أمسك الفأر / الجرذ من الذيل على منشفة ورقية. يجب أن يكون الفأر / الجرذ في وضع الانبطاح المحايد مع الجانب الجانبي للجسم في مواجهتك.
ملاحظة: قد تكافح الفئران / الفئران بسبب ضبط النفس ولكن لا ينبغي أن تثير استجابة ألم محددة. إذا لوحظت أكثر من استجابات الألم اللحظية, قد يكون من الضروري إعطاء المسكنات; اطلب التوجيه البيطري. - أمسك حزام الحوض برفق ولكن بقوة بين الإبهام والسبابة غير المهيمنة. يجب أن تكون القمة الحرقفية محسوسة وموضوعة في وسط الكتائب البعيدة لكل إصبع (الشكل 1 ج).
ملاحظة: في هذا العمر ، لا داعي للقلق بشأن التعرض للعض ، لذا لا يلزم لف المنشفة الورقية فوق الماوس / الفئران. قد يكون من الضروري استخدام منشفة ورقية في الفئران P5-10 للحفاظ على صغار الفئران الأكبر حجما. - قم بتدوير قاعدة الذيل برفق لضمان المحاذاة المناسبة للعمود الفقري. يجب أن يكون حوض الفأر / الجرذ مربعا بحيث تكون العمليات الفقرية للعمود الفقري القطني متعامدة مع سطح العمل.
- امسح المنطقة القطنية الظهرية للفأر / الجرذ باستخدام وسادة تحضير للكحول بنسبة 70٪.
- قم بتقسيم الشعر ، إن أمكن ، ~ 1-3 مم في الجمجمة إلى القمة الحرقفية للمساعدة في تصور موقع الحقن. يكون تصور المنطقة المستهدفة أسهل في الفئران / الفئران الأصغر سنا. في حديثي الولادة عديمي الشعر ، يمكن رؤية فجوة في الفضاء الفقري.
- اشعر أو تصور الفضاء الفقري L4-L5 أو L5-L6 ، ~ 1-3 مم في الجمجمة إلى القمة الحرقفية.
ملاحظة: المسافة الدقيقة متغيرة حسب حجم وعمر الفأر / الفأر.
- باستخدام اليد المهيمنة ، أمسك الفأر / الجرذ من الذيل على منشفة ورقية. يجب أن يكون الفأر / الجرذ في وضع الانبطاح المحايد مع الجانب الجانبي للجسم في مواجهتك.
- حقن
- باستخدام اليد المهيمنة ، أمسك مركز حقنة الميكرولتر وضعها بزاوية 30-45 درجة على العمود الفقري للفأر / الفئران. مع وجود شطبة الإبرة في مواجهة رأس الفأر / الفأر ، قم بثقب الجلد حوالي 1-3 مم في الفراغ الفقري. بسبب الاتجاه الزاوي للحقنة ، تكون نقطة الإدخال على الجلد ذيلية قليلا إلى الفضاء الفقري.
ملاحظة: قد تتغير هذه المسافة مع عمر وحجم الفأر / الفأر. - تتطابق بقية الخطوات مع الخطوات 1.3.3-1.3.10 من الفئران >P21.
- باستخدام اليد المهيمنة ، أمسك مركز حقنة الميكرولتر وضعها بزاوية 30-45 درجة على العمود الفقري للفأر / الفئران. مع وجود شطبة الإبرة في مواجهة رأس الفأر / الفأر ، قم بثقب الجلد حوالي 1-3 مم في الفراغ الفقري. بسبب الاتجاه الزاوي للحقنة ، تكون نقطة الإدخال على الجلد ذيلية قليلا إلى الفضاء الفقري.
3. حقن تكنولوجيا المعلومات القطنية للفئران >P21
ملاحظة: هناك العديد من إجراءات حقن تكنولوجيا المعلومات الموضحة في الأدبيات ، بدءا من التقنيات غير المخدرة إلى الأساليب الجراحية الأكثر شمولا14،15. يتم وصف إجراء الحقن المباشر باستخدام تقنية طفيفة التوغل باستخدام التخدير الخفيف وشق صغير في الجلد. يمكن أن يساعد استخدام التخدير ، مثل غاز الأيزوفلوران ، في ضبط النفس وإرخاء العضلات ومنع الحركة أثناء الحقن. يؤدي إجراء شق صغير في الجلد فوق موقع الحقن إلى تحسين دقة الحقن من خلال السماح بتصور المساحة الفقرية والقضاء على الحاجة إلى ثقب الجلد السميك. بسبب الشق ، يلزم استخدام التخدير والمسكنات. من خلال الممارسة ، من الممكن إجراء حقن تكنولوجيا المعلومات القطنية في الفئران الأكبر من P21 دون تخدير أو شق وفقا لتقدير المستخدم والمتطلبات المؤسسية المعلقة15. اتبع الإرشادات والاعتبارات المؤسسية المتعلقة بالتخدير والمسكنات المناسبة وجراحة البقاء على قيد الحياة لحيوانات المختبر.
- اعداد
- اتبع الخطوة 1.1. الاستثناءات الوحيدة هي حجم الحقن في الخطوة 1.1.3 وحجم الإبرة في الخطوة 1.1.4. يمكن أن تختلف أحجام الحقن للفئران اختلافا كبيرا حسب العمر وحجم الجسم. انظر قسم المناقشة لمعرفة المزيد عن حجم الحقن في مختلف الأعمار (الجدول 1).
ملاحظة: يوصى باستخدام إبرة 27 جم × 1 بوصة للفئران البالغة ، حيث قد تنحني إبر القياس الأصغر ، وقد لا تخترق الإبر الأقصر المساحة داخل القراب بشكل كاف. يمكن استخدام إبرة أطول (1.25-1.5 بوصة) إذا رغبت في ذلك. - تخدير الجرذ باستخدام المخدر المفضل والمعتمد (باتباع البروتوكولات المعتمدة مؤسسيا).
ملاحظة: بالنسبة للإجراءات الموضحة هنا ، تم تخدير الفئران باستخدام غاز الأيزوفلوران وخليط 1: 1 من الليدوكائين: تم استخدام بوبيفاكائين كمخدر موضعي. يجب الحفاظ على درجة حرارة الجسم باستخدام مصدر حرارة خارجي معتمد طوال الإجراء والتعافي. - اتبع إعداد موقع الجراحة المعقمة القياسي لكل. باختصار ، حلق المنطقة القطنية الظهرية وقم بإعداد الجلد بمقشر جراحي وبيتادين وكحول 70٪ من الأيزوبروبيل.
- اتبع الخطوة 1.1. الاستثناءات الوحيدة هي حجم الحقن في الخطوة 1.1.3 وحجم الإبرة في الخطوة 1.1.4. يمكن أن تختلف أحجام الحقن للفئران اختلافا كبيرا حسب العمر وحجم الجسم. انظر قسم المناقشة لمعرفة المزيد عن حجم الحقن في مختلف الأعمار (الجدول 1).
- الإجراء الجراحي
- ضع الجرذ في وضع الانبطاح المحايد مع الجانب الجانبي للجسم في مواجهتك.
- ملامسة حزام الحوض, تحديد القمة الحرقفية والوصلة القطنية العجزية. في الفئران >P21 ، يمكن التعرف بسهولة على العمليات الفقرية.
- باستخدام مشرط ، قم بعمل شق 1 سم فوق الفراغ الفقري L4-L5 أو L5-L6. يجب أن يشمل الشق الجلد واللفافة الأساسية فقط ، مما يترك العضلات سليمة.
ملاحظة: من المفيد استخدام المباعدات لإبقاء الجلد مفتوحا خلال الفترة المتبقية من الإجراء. - أمسك حزام الحوض برفق ولكن بقوة بين الإبهام والسبابة غير المهيمنة. يجب أن تكون القمة الحرقفية محسوسة وموضوعة في وسط الكتائب البعيدة لكل إصبع (الشكل 1 د). استخدم ملقط البعوض للتحقيق على طول خط الوسط من الظهر لتحديد موقع الفضاء الفقري.
- حقن
- باستخدام اليد المهيمنة ، أمسك مركز حقنة الميكرولتر وضعها بشكل عمودي على العمود الفقري للفئران في الفضاء الفقري L4-L5 أو L5-L6. تأكد من أن مكبس المحقنة يمكن ضغطه بإصبع السبابة دون حركة مفرطة لليد. مع وجود شطبة الإبرة في مواجهة رأس الفئران ، قم بثقب العضلات بالإبرة فوق الفضاء الفقري.
- تقدم الإبرة إلى الفضاء الفقري.
ملاحظة: قد يكون للإبرة مقاومة طفيفة أثناء مرورها بين العمليات الفقرية ، وقد تحتاج زاوية المحقنة إلى التعديل قليلا لتمريرها عبر هذه الفجوة. ومع ذلك ، يجب أن تظل حوالي 90 درجة ، عموديا على العمود الفقري. سيشعر بالفرقعة عندما تدخل الإبرة إلى الفضاء داخل القراب. اعتمادا على معايير التخدير ، قد يكون نفض الغبار عن الذيل أو الساق ملحوظا وقد لا يكون ملحوظا. يجب تثبيت الإبرة بإحكام بين الفقرات. - مع الحرص على عدم تحريك المحقنة خارج موضعها ، اضغط على المكبس لتوصيل المحلول في غضون 30 ثانية.
ملاحظة: على عكس الحقن في الفئران ، قد لا يكون من الممكن تقليل زاوية المحقنة في الفئران >P21 باستخدام هذه الطريقة. يجب حقن كميات أكبر بمعدل أبطأ لمنع تراكم الضغط المفرط. - امسك المحقنة في مكانها لمدة 30-60 ثانية بعد الضغط الكامل على المكبس للسماح بتبديد المحلول ومنع التدفق العكسي.
- اسحب المحقنة بسلاسة من الفئران. عند سحب الإبرة ، قم بتدوير المحقنة لمنع التدفق العكسي.
ملاحظة: توخي الحذر حتى لا تتقدم الإبرة عند تدوير المحقنة ، لأن ذلك قد يتسبب في تلف جسدي للحبل الشوكي. - أغلق شق الجلد باستخدام طريقة معتمدة، مثل خياطة أو مشابك الجرح. بالنسبة للفئران المستخدمة في هذا البروتوكول ، تم إغلاق الجلد في نمط مستمر داخل الأدمة أو بسيط متقطع باستخدام خياطة 5-0 PDS II.
- استعادة الفئران من التخدير.
- اتبع الخطوات 1.3.9-1.3.10 وجميع إرشادات الرعاية بعد الجراحة.
النتائج
على الرغم من أن العديد من العوامل يمكن أن تؤثر على نقل نواقل العلاج الجيني ، إلا أن التلوين النسيجي للأنسجة يظل الطريقة الأكثر دقة لتحديد نجاح الحقن داخل القراب القطني (IT). يدل التوزيع الواسع والمتساوي لناقل العلاج الجيني داخل الجهاز العصبي المركزي (CNS) بعد الحقن على نجاح الإجراء. يمثل الشكل 2C حقنة ناجحة للعلاج الجيني التكميلي ذاتيا بوساطة AAV9 الذي يؤدي إلى التعبير الضعيف المعدل للجينات في كل مكان تحت محفز JeT بجرعة 1.3 × 1011 vg / فأر في الفئران حديثي الولادة (P1) ، بعد 4 أشهر من الحقن. يكشف تحليل RNAscope ، باستخدام مسبار يستهدف الجينات المعدلة وراثيا بواسطة العلاج الجيني ، عن توزيع واسع في النخاع الشوكي القطني والحبل الشوكي العنقي والدماغ. يتم تضمين جزء من الكبد والقلب لتسليط الضوء على أنه حتى مع الحقن المباشر للسائل النخاعي (CSF) ، لا يزال من الممكن توزيع ناقل العلاج الجيني على الأنسجة المحيطية.

الشكل 2: أقسام الأنسجة الملطخة 5 ميكرون من الجهاز العصبي المركزي للفأر والأنسجة الطرفية بعد 4 أشهر من الحقن في P1. يشير التلوين الأحمر إلى التعبير الجيني المعدل عبر RNAscope ، ويتم إجراء التلوين الأزرق للنوى عن طريق الهيماتوكسيلين. (أ) الحقن بمحلول تركيبة تحكم. (ب) الحقن غير الناجح داخل المتني بناقل AAV9 (scAAV9_JeT-hDDX3Xopt-SpA). (ج) حقن تكنولوجيا المعلومات القطني بنجاح باستخدام ناقل AAV9 (scAAV9_JeT-hDDX3Xopt-SpA). تم إعطاء ناقل العلاج الجيني المستخدم في (B) و (C) بجرعة ذات صلة مترجمة تبلغ 1.3E11 vg / فأر. شريط المقياس: اللوحة العلوية (5 مم) ؛ اللوحة السفلية (1 مم). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
قد يشير التعبير المركز في الحبل الشوكي القطني المقترن بنقص التعبير في الدماغ ، كما هو موضح في الشكل 2 ب ، إلى حقن داخل الحبل الشوكي ويجب اعتباره حقنة فاشلة. يحدث هذا عندما يتم إدخال الإبرة بعيدا جدا في العمود الفقري ، بعد الفراغ داخل القراب ، وفي الحبل الشوكي. بالإضافة إلى ذلك ، يجب أيضا اعتبار التعبير المنخفض جدا أو المعدوم في الحبل الشوكي والدماغ (غير معروض) حقنة فاشلة خارج الهدف ، بافتراض أنه يتم استخدام ناقل وجرعة حيث يتوقع توزيع الجهاز العصبي المركزي على نطاق واسع. قد يكون هذا بسبب عدم إدخال الإبرة بعيدا بما فيه الكفاية أو من كونها جانبية إلى خط الوسط.
يمكن أن تختلف أنماط التعبير التي لوحظت من الحقن الناجح بسبب العوامل الثمانية التالية كأمثلة: (1) العمر عند الحقن ، (2) مناعة موجودة مسبقا ، (3) معدل التسريب ، (4) ناقل العلاج الجيني ، (5) جرعة العلاج الجيني ، (6) بروتينات سطح الخلية ، (7) الانتحاء ، و (8) إن أمكن ، خيار محفز مناسب لدفع التعبير الجينات المعدلةوراثيا 6. في حين أن أنماط التعبير يمكن أن تختلف ، فإن التوزيع الواسع ، وحتى ، الواسع النطاق سيكون عالميا طالما أن الجرعة عالية بما فيه الكفاية مع ناقل فعال ، مثل AAV9.
تتمثل القيود الرئيسية لاستخدام التحليل النسيجي لتأكيد نجاح حقن تكنولوجيا المعلومات القطنية في أوقات الانتظار الطويلة - الانتظار حتى نهاية الدراسة ، بعد إجراء التشريح وجمع الأنسجة - والموارد الواسعة اللازمة لمعالجة الأنسجة من جميع الفئران في دراسة كبيرة للعلاج الجيني. لسوء الحظ ، كانت تجربتنا أن المؤشرات الفورية والمباشرة للحقن الإيجابي أو السلبي يمكن أن تكون غير موثوقة. ومع ذلك ، فإن منعكس نفض الغبار عند دخول الإبرة إلى الفضاء داخل القراب يعد مؤشرا جيدا على الموضع الناجح في الوقت الفعلي ومن المحتمل أن يشير إلى نجاح الحقن. لا تخلط بين الارتعاش لأن الإبرة تخترق الجلد في فأر / فأر غير مخدر مع استجابة نفض الغبار الذيل للإبرة التي تدخل الفضاء داخل القراب. تم الإبلاغ عن استخدام العوامل الدوائية مثل NMDA والمادة P والليدوكائين ، إما في التدريب أو ممزوجا بمحلول الحقن التجريبي ، لتوفير مؤشر فوري أكثر على نجاح الحقن9،11،24. إذا كنت تفكر في هذه العوامل ، فمن المهم تقييم توافقها مع ناقل العلاج الجيني.
Discussion
حقن تكنولوجيا المعلومات القطنية هو إجراء سريع وبسيط التوغل يوفر بشكل موثوق ناقل العلاج الجيني إلى السائل الدماغي النخاعي لعلاج أمراض الجهاز العصبي المركزي5،6. الإجراء ذو صلة انتقالية ، ويفصل البروتوكول الموصوف هنا كيفية أداء هذا المسار من الإعطاء في الفئران والجرذان من جميع الأعمار ، من حديثي الولادة إلى البالغين. من المهم تحديد هذا البروتوكول للفئران والجرذان من جميع الأعمار ، إلى جانب توفير مقاطع فيديو داعمة ، لمساعدة الباحثين في اعتماد هذه الطريقة لإدارة العلاج الجيني. تتمثل تجربة مختبرنا في أنه يمكن تنفيذ هذا البروتوكول باستمرار عبر العديد من المستخدمين والدراسات بمرور الوقت18،25،26،27،28،29،30.
هناك اختلافات مهمة عند إجراء حقن تكنولوجيا المعلومات القطنية في الفئران / الفئران الأصغر سنا مقارنة بالفئران / الفئران الأكبر سنا ، وأبرزها الزاوية التي يتم عندها إدخال الإبرة في العمود الفقري والحجم الموصى به الذي يتم حقنه. تختلف أحجام حقن تكنولوجيا المعلومات القطنية المبلغ عنها اختلافا كبيرا عبر الدراسات وعبر الأنواع31. يعد النظر في حجم الحقن أمرا مهما لتجنب الارتفاعات طويلة الأمد في الضغط داخل الجمجمة (ICP) ، والتي يمكن أن تضر بتدفق السائل الدماغي النخاعي والدم الدماغي ، وتسبب عدم الراحة ، وتؤدي إلى مضاعفات عصبية مزمنة ، بما في ذلك استسقاء الرأس ونقص التروية وإصابة الخلايا والموت32،33. يتم تحديد برنامج المقارنات الدولية من خلال حجم السائل الدماغي النخاعي والدم الدماغي وأنسجة الجهاز العصبي المركزي ، والتي لا يمكن ربطها ارتباطا مباشرا بوزن الجسم. في الأداء الطبيعي ، يتم تنظيم برنامج المقارنات الدولية تلقائيا بواسطة العديد من العوامل ، بما في ذلك حجم السائل الدماغي النخاعي ، وحجم الدم الدماغي ، والتنفس ، ووضع الجسم ، ومعدل إنتاج السائل الدماغي النخاعي ، ومعدل تصريف السائل الدماغي النخاعي في الدم33،34. لذلك ، يجب تحديد أحجام حقن تكنولوجيا المعلومات بناء على خصائص السائل الدماغي النخاعي (الجدول 1) بدلا من وزنالجسم 25،27،28،30. يشار إلى الأحجام الموصى بها للحقن في كل عمر في كل نوع بالخط العريض.
| حجم حقن تكنولوجيا المعلومات | قيم السائل الدماغي النخاعي للبالغين | |||||||
| P0-1 (ميكرولتر) | P5-7 (ميكرولتر) | P10 (ميكرولتر) | > P21 (ميكرولتر) | الحجم الكلي (ميكرولتر) | معدل الإنتاج (ميكرولتر / دقيقة) | معدل الدوران (ح) | الضغط داخل الجمجمة (مم زئبق) | |
| فئران | 3 | 5 | 5-10 | 5-20 | 30-4025,30 | 0.32-0.3525,30 | 1.7-225,30 | 5.0 +/- 0.528 |
| جرذان | 5 | 5-10 | 10-30 | 10-200 (20-75) | 15025 | 1.7-2.825 | 2-2.6625 | 8.6 +/- 1.7,27 |
الجدول 1: ملخص أحجام حقن تكنولوجيا المعلومات القطنية للفئران والجرذان في مختلف الأعمار. يوصى باستخدام قيم غامقة وقد تم تسليمها بأمان. لم يتم تقييم الحد الأقصى للأحجام الممكنة رسميا. يتم تضمين معلومات إضافية حول معلمات السائل الدماغي النخاعي المعروفة - الحجم الإجمالي ومعدل الإنتاج ومعدل الدوران والضغط داخل الجمجمة - في الفئران والجرذان كمرجع.
هناك نقص في المعرفة في جميع أنحاء المجال فيما يتعلق بالعتبة العليا لأحجام حقن تكنولوجيا المعلومات لمرة واحدة. في البشر البالغين والجرذان والفئران حيث يعرف حجم السائل الدماغي النخاعي ، لا يبدو أن الزيادة بنسبة 30٪ في إجمالي حجم السائل الدماغي النخاعي تسبب إصابة مزمنة أو أمراض31،33،35،36. إن عدم وجود أحجام معروفة للنخاعي الدماغي الشوكي في الفئران الصغيرة أو حديثي الولادة يجعل استقراء مماثل مستحيلا. بدأت بعض المجموعات في النظر إلى حجم السائل الدماغي النخاعي وإنتاجه في الأصغرسنا 37. وإلى أن يتم إثبات التحقيقات الإضافية في هذه المجالات، سيظل حجم الحقن خاضعا للقيم التي أبلغ عنها المحققون.
قد تثير الفئران والجرذان ، خاصة عند علاجها في سن أصغر أو بكميات عالية من الحقن ، ثني العضلات ، أو تمديد الأطراف ، أو التنفس السريع ، أو شلل الأطراف الخلفية المؤقت الذي يجب أن يحل ذاتيا في غضون بضع دقائق. في الحالات القصوى ، يمكن أن تسبب ارتفاعات ICP الحادة تشوهات في القلب والأوعية الدموية والجهاز التنفسي ، والتي يمكن أن تكون مميتة32،33. إذا استمرت أي تشوهات ما بعد الإجراء بعد 24 ساعة ، فيجب إزالة الفئران / الفئران من الدراسة والقتل الرحيم بشكل إنساني. يمكن أن يحدث شلل مستمر في الأطراف الخلفية إذا تم إدخال الإبرة بعيدا جدا ، مما يؤثر على الحبل الشوكي. يمكن أن يكون هذا بسبب خطأ شائع أثناء إجراء حقن تكنولوجيا المعلومات القطني: حركة المحقنة بعد نفض الغبار عن الذيل أثناء الضغط على المكبس. يجب تجنب حركة الحقنة والإبرة. إذا تعذر الحصول على الموضع الصحيح مع الثقب الأولي ، فيمكن إجراء محاولة ثانية في نفس الموقع. إذا لم تنجح المحاولة الثانية أيضا ، فحاول تغيير موضع الإبرة لاستهداف الفضاء الفقري التالي. لاحظ أن العصي الإبر المتعددة قد تؤدي إلى تسرب الحقن الناجح لاحقا.
قد يستغرق التقاء حقن تكنولوجيا المعلومات القطني وقتا. لممارسة الحقن كإجراء نهائي ، اتبع البروتوكول أعلاه باستخدام محلول صبغة معتمد ، مثل إيفانز الأزرق أو صبغة ماكورميك الخضراء المفلترة بمقدار 0.2 ميكرون (الشكل 3) أو مع العوامل الدوائية التي يتم تناولها في قسم النتائج التمثيلية. يوصى باستخدام الصبغة لاستكشاف الأخطاء وإتقانها وإتقانها لأنه من السهل معرفة ما إذا كان الحقن ناجحا أو فشلا في غضون 1 دقيقة. الممارسة مع الصبغة هي لإجراءات عدم البقاء على قيد الحياة فقط ، حيث يمكن للحيوانات أن تتطور إلى رد فعل تجاه الصبغة عند إعطاؤها مباشرة إلى الجهاز العصبي المركزي. يمكن أن يحدث رد الفعل هذا في غضون دقيقة واحدة من الحقن الناجح ويتميز بحركات الحكة والارتباك السريعة. يجب القتل الرحيم للحيوانات على الفور بمجرد ملاحظة رد الفعل هذا لتقليل الانزعاج. بعد حقن صبغة الممارسة الناجحة ، ستبقى الصبغة موضعية في العمود الفقري (لا توجد صبغة في الأنسجة المحيطية القريبة) ، وتتحرك لأعلى العمود الفقري إلى المخيخ والمخ والبصيلات الشمية. في P1 ، يكون الجلد شفافا بدرجة كافية بحيث يمكن رؤية الصبغة تتحرك أسفل العمود الفقري في الذيل. إذا لم تصل الصبغة إلى الدماغ في غضون بضع دقائق ، فشل الحقن.

الشكل 3: صبغة ماكورميك الخضراء في الدماغ بعد الممارسة الناجحة لحقن تكنولوجيا المعلومات القطنية. جميع الأدمغة مأخوذة من فئران P21 تم حقنها بصبغة 5 ميكرولتر وتظهر في المنظر البطني. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
للحصول على معلومات إضافية حول المعلمات ذات الصلة لتصميم التجارب قبل السريرية ، مثل العيار والجرعات الفيروسية ، انظر المراجعات المنشورةسابقا 3 ، 6 ، 31.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نود أن نشكر منشأة UT Southwestern AAV Viral Vector Core لتصنيع ناقل AAV9 و Yuhui Hu ، عالم الأبحاث في المختبر الرمادي ، لمعالجة وتلطيخ الأنسجة المعروضة في الشكل 2.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
References
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16 (2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778 (2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565 (2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229 (2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31 (2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463 (2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761 (2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575 (2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217 (2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392 (2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650 (2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832 (2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286 (2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413 (2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197 (2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved