Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Иммунокомпетентная мышиная модель для лазерной интерстициальной термотерапии глиобластомы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Глиобластома является разрушительной формой первичного рака головного мозга, и лазерная интерстициальная тепловая терапия становится многообещающей альтернативой традиционной хирургической резекции при неоперабельной глиобластоме. Этот протокол описывает оптимизированную доклиническую мышиную модель, которая может быть использована для изучения эффектов лечения или адъювантного и комбинаторного лечения.
Аннотация
Глиобластома (ГБ), наиболее агрессивная форма первичного рака головного мозга, составляет примерно половину всех первичных опухолей головного мозга высокой степени злокачественности у взрослых и не имеет лечения. Лазерная интерстициальная термическая терапия (ЛИТТ) является одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) методом лечения ГБ и используется у пациентов, которые не могут быть кандидатами на обычную хирургическую резекцию. Несмотря на то, что клиническая эффективность ЛИТТ была установлена, исследования, выходящие за рамки клинических исследований и серий случаев, ограничены и затруднены из-за отсутствия установленной модели на животных. В этом протоколе используются мыши C57BL/6 и сингенная клеточная линия CT2A глиомы рака для точного повторения человеческого GB, а также используется легированный неодимом лазер на иттрий-алюминиевом гранате (Nd:YAG) с длиной волны 1064 нм, который используется в одной из двух одобренных FDA систем LITT, что обеспечивает превосходную доклиническую значимость. Успешное создание этой мышиной модели LITT обеспечит ценную платформу для исследования уникальных особенностей абляции LITT и ее влияния на микроокружение опухоли, что потенциально может привести к улучшению терапевтических стратегий.
Введение
Рак является основной причиной смерти номер один в Канаде. Глиобластома (ГБ), наиболее распространенная форма агрессивной опухоли головного мозга, составляет от 48% до 60% всех первичных опухолей головного мозга высокой степени злокачественностиу взрослых. Прогноз для ГБ особенно мрачный: 5-летняя чистая выживаемость составляет 4,8% при традиционном лечении, включая хирургическую резекцию, химио- и лучевую терапию.
Лазерная интерстициальная термическая терапия (LITT) является одобренной FDA процедурой с использованием лазера для гипертермической абляции опухолей in-situ у пациентов с неоперабельными опухолями головного мозга и представляет собой привлекательную терапевтическую альтернативу традиционной хирургической резекции3. Тем не менее, подробная и хорошо охарактеризованная мышиная модель лечения ЛИТТ при ГБ отсутствует, что препятствует доклиническим исследованиям.
Этот протокол направлен на демонстрацию оптимизированной доклинической мышиной модели для лечения ГБ с помощью ЛИТТ. Для этой модели мы решили использовать мышей C57BL/6 и линию сингенных клеток глиомы CT2A в первую очередь потому, что CT2A близко повторяет ГБ человека высокой степени злокачественности с аналогичными гистологическими особенностями, инвазивностью, химио- и радиорезистентностью, а также стволовыми особенностями с самообновлением и восстановлением опухолей4. Эти характеристики обеспечивают отличную платформу для различных исследований, связанных с иммунными реакциями или новыми терапевтическими стратегиями. Кроме того, технические аспекты этого протокола LITT также легко адаптируются для других моделей мышей алло- и ксенотрансплантатов 4,5,6, которые будут обсуждаться далее.
Преимущества этого протокола включают в себя стабильные результаты с простой, но эффективной парадигмой лечения ЛИТТ. Используемый лазер на основе иттрий-алюминиевого граната (Nd:YAG) с длиной волны волны 1064 нм аналогичен тому, который используется в клинической практике в одной из двух систем, одобренных FDA, что позволяет проводить эксперименты, которые тесно связаны с клиническим применением LITT для лечения глиомы высокой степени злокачественности. Основным недостатком этого протокола является чрезвычайная осторожность, которую необходимо проявлять как во время имплантации опухолевых клеток, так и при лечении ЛИТТ для достижения воспроизводимых результатов. Кроме того, из-за агрессивной природы клеточной линии CT2A протокол очень чувствителен ко времени. Большинство экспериментов должно быть завершено максимум за 20 дней, что может ограничить исследования некоторых адаптивных иммунных реакций или других клеточных и молекулярных механизмов, происходящих в течение более длительного периода времени.
протокол
Этика животных для этого протокола была одобрена Комитетом по уходу за животными Университета Манитобы в соответствии с этическими принципами, установленными Канадским советом по уходу за животными (CCAC). В этом протоколе использовались 8-12-недельные иммунокомпетентные мыши C57BL/6 и сингенная клеточная линия глиомы CT2A для доклинической модели с широким спектром применений, включая эксперименты, направленные на гистологический анализ, иммунологические изменения или комбинаторные терапевтические вмешательства. Протокол может быть легко адаптирован к другим видам мышей или клеточным линиям в зависимости от требований эксперимента.
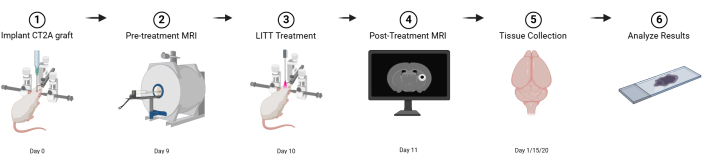
Рисунок 1: Графическая схема базового плана эксперимента. Создано с BioRender.com Нажмите здесь, чтобы просмотреть увеличенную версию этой фигурки.
1. Коротко о подготовке клеток (День 0)
- Перед началом культивирования клеток убедитесь, что корпус и все необходимые пипетки полностью стерилизованы ультрафиолетом и этанолом.
- Нагрейте DMEM/F12 с 10% FBS-средой, фосфатно-солевым буфером (PBS) и трипсином до комнатной температуры (RT) на водяной бане.
- Выведите пипетку из колбы T25 и кратковременно промойте ячейки PBS. Добавьте в клетки 1 мл трипсина и инкубируйте в течение 30-60 с, пока клетки не отделятся от колбы.
- Подтвердите отделенные клетки под световым микроскопом и добавьте 4 мл среды, чтобы остановить ферментативную активность трипсина.
- Подсчитывайте ячейки с помощью автоматического счетчика ячеек.
- Смешайте 10 мкл клеточной суспензии с 10 мкл трипанового синего, затем добавьте 10 мкл на предметное стекло для подсчета клеток.
- Вставьте предметное стекло в машину для подсчета клеток и запишите общее количество клеток, количество живых клеток и процент живых клеток.
ПРИМЕЧАНИЕ: Если автоматическая машина для подсчета клеток недоступна, ручной подсчет может быть выполнен с помощью гемоцитометра.
- Рассчитайте клетки, необходимые для всех запланированных инъекций.
ПРИМЕЧАНИЕ: Для CT2A рекомендуется 5000 клеток на 1,5 мкл вводимого объема и минимум 100 мкл общего объема для каждого препарата. - Вращайте клетки при давлении 134 x g в течение 5 минут, чтобы гранулировать клетки и аспирировать как можно больше среды.
- Ресуспендируйте клеточную гранулу с 5% экстрактом базальной мембраны в PBS до объема, необходимого в микроцентрифужной пробирке. В то время как пробирки меньшего размера лучше всего подходят для приготовления клеточной суспензии, пробирка объемом 2 мл лучше подходит для хранения во время операции, поскольку клетки с меньшей вероятностью слипаются в более закругленное дно и легко перераспределяются с легким движением пальца.
- Держите клетки на льду для инъекций, готовя свежие клеточные суспензии каждые 4-5 ч по мере необходимости.
2. Ортотопическая имплантация (день 0)
- Подготовьте операционную область и убедитесь, что все необходимые инструменты стерильны и готовы к использованию.
- Обезболивайте мышей изофлураном (3% испаряется в 1 л/минО2) в камере при одновременном контроле частоты дыхания (целевой показатель 60 уд/мин).
- Получение и регистрация веса животного для дозирования препарата.
- Тщательно брейте операционную область, чтобы избежать попадания глаз, ушей и усов.
- Переложите животное в стереотаксическую рамку.
- Поместите резцы в отверстие прикусочной планки и отрегулируйте носовой конус до плотного расположения, затянув фиксирующий винт.
- Проверьте глубину анестезии с помощью двустороннего пощипывания пальцев задних конечностей и, при необходимости, закрепите череп с помощью ушных штифтов и отрегулируйте голову животного в нейтральное, ровное положение.
- Контролируйте температуру тела животного с помощью смазаемого ректального температурного зонда и обеспечьте дополнительный прогрев при температуре 37 °C с помощью подогревающей прокладки под телом.
ВНИМАНИЕ: Будьте осторожны, чтобы не перетянуть носовой конус, так как даже умеренное давление на носовую кость может вызвать остановку дыхания. Если используется электрическая грелка (например, грелка для террариума), убедитесь, что настройки температуры точны, а заданная температура остается постоянной.
- Обильно нанесите офтальмологическую мазь на оба глаза, чтобы предотвратить высыхание.
- Вводите профилактические инъекции и проверяйте глубину анестезии.
- Введите подкожно мелоксикам или другое обезболивающее лекарство длительного действия в соответствии с местными рекомендациями по лечению животных (например, 5,0 мг/кг мелоксикама) с помощью шприца 28 г x 1/2 дюйма.
- Введите инъекцию 20 мг/кг подогретого физиологического раствора для профилактической инфузионной поддержки во время длительных процедур.
- Уменьшите количество анестетика до 1,5%-2,0% изофлурана для поддержания целевой частоты дыхания.
- Используя асептическую технику, задрапируйте животное и подготовьте операционную зону.
- С помощью стерильного ватного тампона нанесите обеззараживающий раствор повидон-йода или хлоргексидина. Начиная медиально с места разреза и вращая тампон после каждого прохода, двигайтесь к краям, затем с помощью свежего стерильного ватного тампона нанесите 70% этанол на место таким же образом.
- Повторите скраб с йодом, а затем добавьте 70% этанол еще два раза (всего 3 раза каждый).
- Повторно проверьте глубину анестезии перед тем, как приступить к хирургическому воздействию. Внимательно следите за частотой дыхания на протяжении всей процедуры и при необходимости корректируйте анестетик.
- Начиная со средней линии и немного позади глаз, сделайте среднесагиттальный разрез 1-1,5 см в каудальном направлении с помощью клинкового скальпеля #15. В качестве альтернативы можно расширить короткий разрез скальпеля ножницами по радужной оболочке.
ПРИМЕЧАНИЕ: Разрезы должны начинаться по средней линии, но при односторонних инъекциях могут быть слегка наклонены в сторону, чтобы облегчить одновременную визуализацию и доступ к Брегме и месту расположения заусенца. - С помощью стерильной ватной палочки отразите края раны, чтобы визуализировать череп, и аккуратно сотрите всю соединительную ткань с этой области.
- При необходимости используйте стерильный ватный тампон, смоченный в перекиси водорода, чтобы очистить поверхность черепа и визуализировать черепные швы.
- Найдите Брегму в том месте, где левый и правый корональные швы сходятся на средней линии с сагиттальным швом (см. Рисунок 2).
- Используя нетоксичную цветную акриловую смолу и стерильную деревянную зубочистку или что-то подобное, сделайте очень маленькую отметку над Bregma.
ПРИМЕЧАНИЕ: В некоторых случаях левый и правый корональные швы не отражают друг друга; В таких случаях используйте «линию наилучшего соответствия», чтобы приблизительно определить, где они должны пересекаться вдоль средней сагиттальной плоскости.
- Используя нетоксичную цветную акриловую смолу и стерильную деревянную зубочистку или что-то подобное, сделайте очень маленькую отметку над Bregma.
- Следите за тем, чтобы голова животного не была наклонена или повернута (т.е. в ровной плоскости).
- Нулевые стереотаксические координаты на Брегме. Координата x относится к движению в медиально-латеральной плоскости (ML), координата y — в передне-задней плоскости (AP) и z-координата — в дорсально-вентральной плоскости (DV).
- Убедитесь, что Lambda находится в той же плоскости DV, что и Bregma (т.е. z = 0 на обоих ориентирах). Аналогично, при расстоянии +2,0 мм (x = 2) и -2,0 мм (x = -2,0) латерально от Брегмы, убедитесь, что череп находится в той же плоскости, при этом координаты DV/z примерно равны. Убедитесь, что череп надежно закреплен и не двигается после каких-либо регулировок.
- Просверлите скважину с заусенцами на +2,0 мм (ML) и +0,5 мм (AP) из Bregma (рис. 3).
- С помощью насадки для стереотаксического сверла осторожно опустите кончик сверла до тех пор, пока он не соприкоснется с Брегмой и обнулите координаты.
- Слегка поднимите сверло и настройте сверло в соответствии с соответствующими координатами AP и ML.
- Опускайте сверло медленно, следя за тем, чтобы заусенцы проступали только через череп.
- Как вариант, с помощью микролитрового шприца в стереотаксической рамке, опустите иглу до ее контакта с Брегмой и обнулите координаты.
- Слегка приподнимите иглу и подстройтесь под соответствующие координаты AP и ML.
- Опустите кончик до тех пор, пока он не коснется черепа, и отметьте точное местоположение.
- Слегка приподнимите иглу и сделайте небольшую отметку в целевом месте хирургическим маркером.
- Поднимите или поверните игольницу в сторону и с помощью ручной дрели проделайте заусенцы в черепе, стараясь не повредить мозг под ней. ВНИМАНИЕ: Как правило, старые самцы мышей имеют относительно более толстые черепа и требуют более обширного сверления. Ручное сверление должно выполняться осторожно, с минимальным давлением, так как внезапные прорывы через череп могут повредить основные мозговые оболочки и/или мозг.
ПРИМЕЧАНИЕ: Для размещения датчика термопары во время процедуры LITT необходимо удлинение отверстия для заусенцев. Это может быть легче сделать во время первоначальной инъекционной операции и способствует более быстрой и оптимизированной операции LITT. В качестве альтернативы, отверстие заусенца может быть расширено таким же образом во время операции LITT, что может снизить риск роста экстракраниальной опухоли.
- Создайте второе отверстие для заусенцев на расстоянии +3,0 мм ML и +0,5 мм AP (1,0 мм латерально от места инъекции) для термопары.
- Следуйте процедуре сверления, описанной на предыдущем шаге.
- Чтобы избежать трудностей, связанных с восстановлением кости, удалите кость между двумя отверстиями.
ПРИМЕЧАНИЕ: Рекомендуется использовать +2,0 мм ML, +0,5 мм AP и -2,5 мм DV из Брегмы в качестве координат для имплантации опухоли. Такое расположение в верхнем стриатуме приводит к постоянному росту опухоли, который хорошо переносится животными, однако протокол может быть адаптирован и к другим локализациям.
- Приготовьте суспензию клеток глиомы мыши CT2A в микролитровом шприце (5000 клеток в 1,5 мкл).
- Извлеките заранее подготовленную микроцентрифужную пробирку с клетками изо льда и аккуратно поверните кончиком пальца для подвешивания.
- Аккуратно наберите 2 мкл в шприц объемом 5 мкл или 10 мкл, стараясь не допустить образования пузырьков.
- Сцедите 0,5 μл, чтобы удалить воздух и убедиться, что игла загрунтована и работает правильно.
- Протрите стержень иглы спиртовым тампоном, чтобы удалить сцеженную жидкость и любые клетки на наружной поверхности (которые могут вызвать рост лептоменингеальной опухоли).
- Загрузите шприц в шприцевую помпу микроинъектора (или ручную стереотаксическую насадку) и медленно опустите иглу.
- Медленно опустите иглу на глубину (z = -3,0 мм) и сделайте паузу на 1 минуту.
- Медленно втяните иглу на 0,5 мм (z = -2,50 мм) и введите клетки (≤ 0,5 мкл/мин). Следите за тем, чтобы область вокруг шприца оставалась сухой с помощью микрохирургического губчатого копья, стараясь не повредить иглу.
- Подождите минимум 2 минуты после завершения инъекции, затем медленно втяните шприц в течение 3-4 минут. Убедитесь, что первые 4-5 интервалов втягивания составляют 100 мкм на ретракцию, чтобы избежать смещения клеток из их первоначального места инъекции.
- С помощью спиртового тампона аккуратно протрите внешнюю сторону иглы от крови или жидкости, а затем промойте и очистите шприц в соответствии с рекомендациями производителя. Используйте PBS и дистиллированную воду между инъекциями, чтобы игла не закупорилась. Когда инъекции будут завершены, обильно промойте иглу 70% этанолом, чтобы удалить все оставшиеся клетки из иглы.
ВНИМАНИЕ: Если не промывать иглу после каждой инъекции, это может привести к закупорке. При введении более одного типа клеток используйте отдельную иглу для каждого типа, чтобы избежать возможного перекрестного загрязнения.
- Повторно приблизьте разрез, стараясь слегка оторвать края раны, чтобы нижележащая дерма соприкасалась. Закройте рану с помощью зажима для раны или 3 прерывистых швов с помощью шва 5-0. Нанесите на закрытую рану раствор повидон-йода.
- Извлеките животное из стереотаксической рамки и поместите его в обитую бумагой клетку для восстановления на согревающую прокладку, установленную на 37 °C. Убедитесь, что грудь лежит до тех пор, как животное будет переведена обратно в домашнюю клетку, с помощью небольшой миски с влажным кормом, расположенной на полу клетки.
- Наблюдайте за животным не реже двух раз в день, начиная со дня операции, в течение следующих 2 дней. Повторно вводите мелоксикам через 24 ч, 48 ч и 72 ч или в соответствии с рекомендациями учреждения.

Рисунок 2: Графическая иллюстрация черепа мыши и важные анатомические ориентиры для стереотаксической хирургии. Создано с BioRender.com Нажмите здесь, чтобы просмотреть увеличенную версию этой фигурки.
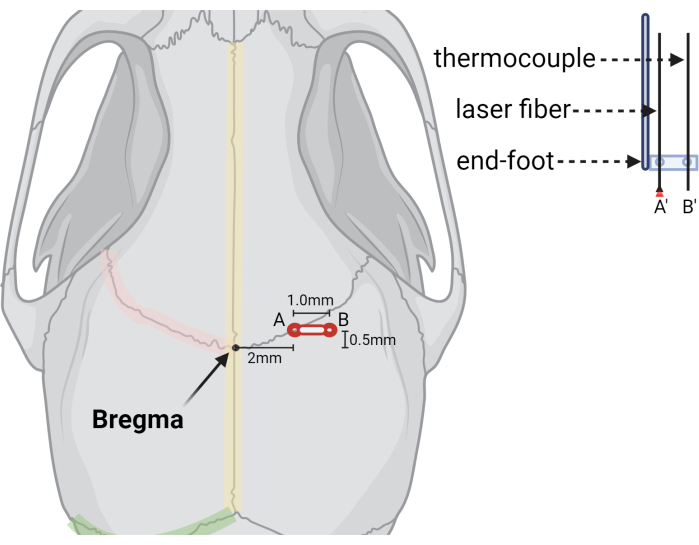
Рисунок 3: Графическая иллюстрация с указанием мест расположения заусенцев и лазерной аппаратуры. Иллюстрация, показывающая взаимное расположение ориентира в Брегме, (A) начальное отверстие для лазерного волокна (A') и (B) второе, или расширенное, отверстие для зонда термопары (B'). Справа показано вырезное изображение датчиков лазерного волокна и термопары, иллюстрирующее, как преобразователи стабилизируются в стереотаксической торцевой ножке с предварительно просверленными отверстиями нужного размера и расстояния. Создано с BioRender.com Нажмите здесь, чтобы просмотреть увеличенную версию этой фигурки.
3. Мониторинг опухолевой нагрузки до ЛИТТ (день 9)
- Проведите Т2-взвешенную магнитно-резонансную томографию (МРТ) в соответствии с рекомендациями учреждения, чтобы оценить рост опухоли за день до ЛИТТ.
ПРИМЕЧАНИЕ: Опухоли должны быть ~1,5-2,0 мм в диаметре.- Получите подходящее корональное сканирование всего мозга мыши с использованием следующих параметров: быстрая спиновая эхо-последовательность, TR = 5000 мс, TE = 45 мс, эхо-последовательности = 7, FOV = 30 x 30 мм2, размер матрицы = 250 x 256, общее количество срезов = 18, толщина среза = 0,3 мм, средние значения = 2.
ПРИМЕЧАНИЕ: Также рекомендуется проводить периодическую МРТ, начиная примерно с 6-го дня после имплантации, чтобы подтвердить успешную аллотрансплантацию и контролировать рост опухоли, особенно во время первоначальных экспериментов, поскольку даже незначительные изменения в процедуре могут изменить сроки. CT2A очень агрессивен, и за животными необходимо внимательно следить. Для этой цели хорошо подходит Т2-взвешенное корональное сканирование. Использование меченых флуоресцентными или люциферин-меченными CT2A клеток в сочетании с системой визуализации in vivo (IVIS) также может быть целесообразным в тех случаях, когда доступ к МРТ мелких животных недоступен. Однако кинетика роста и другие характеристики опухоли будут отличаться от этого протокола.
- Получите подходящее корональное сканирование всего мозга мыши с использованием следующих параметров: быстрая спиновая эхо-последовательность, TR = 5000 мс, TE = 45 мс, эхо-последовательности = 7, FOV = 30 x 30 мм2, размер матрицы = 250 x 256, общее количество срезов = 18, толщина среза = 0,3 мм, средние значения = 2.
4. Операция LITT (день 10)
- Как указано выше в разделе 2, повторите шаги 2.1-2.13 для подготовки животного к ЛИТТ.
ПРИМЕЧАНИЕ: Заживление ран после предыдущей операции может находиться на разных стадиях в зависимости от вида и вариаций экспериментального графика. Помните о более тонких или нежных тканях при повторном выполнении разреза. - С помощью стерильного тампона с ватным наконечником аккуратно очистите череп, удаляя любую ткань, скрывающую Bregma или ранее сделанное отверстие от заусенца. При необходимости просверлите отверстие для заусенца, хотя из-за скорости образования опухоли CT2A ожидается незначительный рост кости или вообще не ожидается.
- Когда крепление LITT установлено в стереотаксической раме, обнулите координаты в точке Брегма для наконечника лазерного волокна.
ВНИМАНИЕ: Лазерное волокно очень хрупкое и трескается при сгибании. Будьте осторожны и остановитесь, как только кончик лазерного волокна коснется черепа. - Слегка поднимите наконечник и переместитесь к нужным координатам ML и AP, затем медленно опустите щупы до целевой координаты DV, чтобы добраться до цели (2,0 мм ML, 0,5 мм AP, -2,0 мм DV).
- Установите параметры обработки LITT: Режим: непрерывный; Мощность: 1 Вт
- Переключите лазер из режима ожидания в режим Active и включите лазер на 60 с с помощью ножной педали. Если температура превысит 46 °C, сделайте короткую паузу, а затем снова включите ее, стараясь поддерживать температуру как можно ближе к 46 °C.
- Медленно втяните лазерную сборку и аккуратно протрите лазерное волокно и термопару спиртовым тампоном. Поверните узел в сторону, следя за тем, чтобы щупы не соприкасались с рамой.
- Закройте рану и восстановите животное, как описано в шагах 2.18-2.20 после имплантации опухоли выше.
5. Оценка после LITT (День 11)
- Проведите Т2-взвешенную МРТ после LITT на следующий день после лечения LITT, чтобы оценить успешность абляции опухоли LITT с использованием последовательности и параметров, описанных на шаге 3.1 выше.
ПРИМЕЧАНИЕ: Кроме того, последовательность восстановления инверсии с ослаблением жидкости (FLAIR) также может быть полезна для оценки послеоперационного отека. - Проведите последующее сканирование до окончания исследования для мониторинга изменений после лечения или повторного роста опухоли.
6. Окончание обучения (День 11/День 15/День 20)
- Усыпляйте животных в выбранных экспериментальных конечных точках в соответствии с рекомендациями учреждения.
ПРИМЕЧАНИЕ: Конечные точки позже 20-го дня невозможны с помощью CT2A, даже при чрезвычайно низком количестве инокуляций, поскольку контрольные животные (т.е. с имитацией хирургического вмешательства или отсутствием лечения) и некоторые животные группы лечения могут быть умирающими и требовать эвтаназии. Для более длительных экспериментов рассмотрите альтернативные модели клеток глиомы мыши. - Соберите ткани для фиксации и обработки.
- Выполните перфузию сердца с 4% параформальдегидом (PFA) и соберите интересующие ткани.
- После фиксации мозговой ткани путем погружения в 4% PFA на ночь при температуре 4 °C.
- Обрабатывайте образцы с использованием стандартных методов анализа с фиксированным формалином парафином (FFPE) или с фиксированной заморозкой.
7. Анализ
- Подтвердите успешную абляцию LITT с помощью Т2-взвешенной МРТ и подтвердите с помощью основных гистологических методов, таких как окрашивание гематоксилином и эозином.
- Выполните любые дополнительные анализы, необходимые для экспериментов (например, иммуногистохимия, иммунофлюоресценция).
Результаты
Успешную имплантацию опухоли CT2A и лечение ЛИТТ можно охарактеризовать с помощью Т2-взвешенной МРТ, как показано на рисунках 4, 5 и 6. МР-изображения были получены с помощью сверхпроводящего магнита без криогена 7 ...
Обсуждение
Существует быстро растущий объем литературы о LITT; Однако в основном он ограничен клиническими исследованиями на людях или сериями случаев. Действительно, было продемонстрировано несколько потенциальных преимуществ для ЛИТТ, включая более низкую частоту послеопера?...
Раскрытие информации
Мы благодарны за поддержку со стороны Monteris Medical, в том числе за безвозмездную передачу лазерного оборудования.
Благодарности
Источниками финансирования этого проекта являются Совет по естественным наукам и инженерии Канады (NSERC)-Alliance, Mitacs-Accelerate, Research Manitoba-IPOC, Канадские институты исследований в области здравоохранения (CIHR) CGS-M и Стипендия для выпускников Университета Манитобы. Клеточная линия глиомы CT2A щедро пожертвована доктором Питером Феччи из Университета Дьюка, Дарем, Северная Каролина. Мы также хотели бы поблагодарить Лабораторию гистологической службы и Центр визуализации мелких животных и материалов Университета Манитобы за их прекрасную техническую помощь в этом проекте.
Материалы
| Name | Company | Catalog Number | Comments |
| Absorbion Spears | FST | 18105-01 | Hemostatic sponges. |
| Adson tissue forceps | FST | 11006-12 | |
| C57BL/6 mice | Jackson Laboratories | Strain #000664 | 6 to 12 week old male and female |
| Cotton Tipped Applicators (6") | Electron Microscopy Sciences | 72308 | |
| CT2A glioma cell line | Generously donated from Dr. Peter Fecci, Duke University. | ||
| Cultrex Reduced Growth Factor Basement Membrane Extract, PathClear | Biotechne, R&D systems | 3433-010-01 | |
| DMEM/F-12, HEPES | Gibco, ThermoFisher Scientific | 11330032 | |
| Dual-chamber slides | BIO-RAD | 1450003 | |
| Eppendorf Safe-Lock Tubes 2.0 mL | Eppendorf | 22363352 | |
| Ethyl Alcohol Anhydrous | Greenfield Global | P016EAAN | Dilute to 70% with ddH2O |
| Fetal Bovine Serum, qualified, Canada | Gibco, ThermoFisher Scientific | 12483020 | |
| Glad Press-n-Seal plastic wrap | Amazon.ca | 12587704417 | |
| High speed drill | Kopf Instruments | Model 1474 | |
| K & J Thermocouple temerpature meter | Omega | HH509R | |
| Metacam (meloxicam) | WDDC | 114424 | |
| Microinjection syringe pump | WPI | UMP3T-1 | |
| Microliter syringe (700 Series) | Hamilton | 87908 | Custom needles are available. A steep needle bevel helps with precise delivery, and a shorter needle length helps with stability. |
| Needle driver/Needle Holder | FST | 12500-12 | A fine tip is most suitable due to the confined working space, but many styles are suitable based on handle preference. |
| Opixcare Plus opthalmic ointment | WDDC | 135941 | |
| Phosphate Buffered Saline (10x) | Fisher bioreagents | BP399-4 | Dilute to 1x with ddH2O |
| Povidone-iodine | ThermoFisher Scientific | 3955-16 | Aliquat into into smaller tubes for use with cotton tipped applicators. |
| Saline (normal) | WDDC | 126588 | |
| Scalpel, single use (#15 Blade) | Feather | Feather NO15 | |
| Scissors, fine surgical | FST | 91460-11 | Fine student scissors, Iris, or Bonn are all suitable. |
| Stereotactic frame | Kopf Instruments | Model 940 | With digital display console and mouse nose-cone and ear-bars. |
| Stereotactic syringe holder | Kopf Instruments | Model 1772-F | If not using an injection pump. |
| Sutures (5-0 monofilament) | Ethicon | MCP463G | Monocryl violet monofilament with reverse cutting tip |
| Syringe, 28 G (0.5 mL) | BD | BD 329461 | BD Lo-Dose U-100 Insulin Syringes |
| TC20 Automated Cell Counter | BIO-RAD | 1450102 | |
| Thermocouple probe, fine diameter (Type K) | Omega | TJM-CA316-IM025G-150 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco, ThermoFisher Scientific | 25200072 | |
| Vetbond by 3M, veterinary tissue glue | WDDC | 126125 | |
| Wahl Peanut Clippers | WDDC/Wahl | 100963 | Also available directly from manufacturer. |
| Warming pad | Bensen Medical | 70308/121873 | Any similar item can be used. |
| Webcol Alcohol preps | Electron Microscopy Sciences | 71005-20 | Alcohol prep wipe, 2-ply, medium size. |
Ссылки
- Canadian Cancer Society. . Cancer Statistics 2023. , (2023).
- . Glioblastoma Research Organization Available from: https://www.gbmresearch.org (2024)
- Carpentier, A., et al. Laser thermal therapy: Real-time MRI-guided and computer-controlled procedures for metastatic brain tumors. Lasers Surg Med. 43 (10), 943-950 (2011).
- Haddad, A. F., et al. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv. 3 (1), vdab100 (2021).
- Chokshi, C. R., Savage, N., Venugopal, C., Singh, S. K. A patient-derived xenograft model of glioblastoma. STAR Protoc. 1 (3), 100179 (2020).
- Alcaniz, J., et al. Clinically relevant glioblastoma patient-derived xenograft models to guide drug development and identify molecular signatures. Front Oncol. 13, 1129627 (2023).
- Muir, M., et al. Laser interstitial thermal therapy for newly diagnosed glioblastoma. Lasers Med Sci. 37 (3), 1811-1820 (2022).
- Muir, M., Traylor, J. I., Gadot, R., Patel, R., Prabhu, S. S. Repeat laser interstitial thermal therapy for recurrent primary and metastatic intracranial tumors. Surg Neurol Int. 13, 311 (2022).
- De Groot, J. F., et al. Efficacy of laser interstitial thermal therapy (LITT) for newly diagnosed and recurrent IDH wild-type glioblastoma. Neurooncol Adv. 4 (1), vdac040 (2022).
- Holste, K. G., Orringer, D. A. Laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdz035 (2020).
- Leuthardt, E. C., Voigt, J., Kim, A. H., Sylvester, P. A single-center cost analysis of treating primary and metastatic brain cancers with either brain laser interstitial thermal therapy (LITT) or craniotomy. Pharmacoecon Open. 1 (1), 53-63 (2017).
- Bastos, D. C. D. A., et al. Predictors of local control of brain metastasis treated with laser interstitial thermal therapy. Neurosurgery. 87 (1), 112-122 (2020).
- Darbinyan, A., Leelatian, N., Fomchenko, E. I. Histological changes associated with laser interstitial thermal therapy for radiation necrosis: illustrative cases. J Neurosurg Case Lessons. 4 (1), CASE21373 (2022).
- Grant, G. A., Porter, B. E., Li, D., Barros Guinle, M. I., Kaur, H. Approach, complications, and outcomes for 37 consecutive pediatric patients undergoing laser ablation for medically refractory epilepsy at Stanford Children's Health. J Neurosurg Pediatr. 33 (1), 1-11 (2023).
- Ogasawara, C., et al. Laser interstitial thermal therapy for cerebral cavernous malformations: A systematic review of indications, safety, and outcomes. World Neurosurg. 166, 279-287.e1 (2022).
- Satzer, D., Mahavadi, A., Lacy, M., Grant, J. E., Warnke, P. Interstitial laser anterior capsulotomy for obsessive-compulsive disorder: lesion size and tractography correlate with outcome. J Neurol Neurosurg Psychiatry. 93 (3), 317-323 (2022).
- Salehi, A., et al. Therapeutic enhancement of blood-brain and blood-tumor barriers permeability by laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdaa071 (2020).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены