É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo murino imunocompetente para terapia térmica intersticial a laser de glioblastoma
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O glioblastoma é uma forma devastadora de câncer cerebral primário, e a terapia térmica intersticial a laser está emergindo como uma alternativa promissora à ressecção cirúrgica convencional para glioblastoma inoperável. Este protocolo descreve um modelo de camundongo pré-clínico otimizado que pode ser usado para estudar os efeitos do tratamento ou tratamentos adjuvantes e combinatórios.
Resumo
O glioblastoma (GB), a forma mais agressiva de câncer cerebral primário, é responsável por aproximadamente metade de todos os tumores cerebrais primários de alto grau em adultos e não tem cura. A terapia térmica intersticial a laser (LITT) é um tratamento aprovado pela Food and Drug Administration (FDA) para GB e é usada em pacientes que podem não ser candidatos à ressecção cirúrgica convencional. Embora a eficácia clínica do LITT tenha sido estabelecida, a pesquisa além dos estudos de casos clínicos e séries de casos é limitada e prejudicada pela falta de um modelo animal estabelecido. Este protocolo usa camundongos C57BL / 6 e linha celular de glioma de glioma CT2A singênico para recapitular de perto o GB humano, ao mesmo tempo em que usa um laser de granada de ítrio e alumínio dopado com neodímio de 1064 nm (Nd: YAG), como é usado em um dos dois sistemas LITT aprovados pela FDA, proporcionando excelente relevância pré-clínica. O estabelecimento bem-sucedido deste modelo murino LITT fornecerá uma plataforma valiosa para investigar as características únicas da ablação LITT e seus efeitos no microambiente tumoral, potencialmente levando a melhores estratégias terapêuticas.
Introdução
O câncer é a principal causa de morte no Canadá. O glioblastoma (GB), a forma mais comum de tumor cerebral agressivo, é responsável por 48% a 60% de todos os tumores cerebrais primários de alto grau em adultos1. O prognóstico para GB é especialmente sombrio, com uma sobrevida líquida de 5 anos de 4,8% com tratamentos convencionais, incluindo ressecção cirúrgica, quimioterapia e radioterapia 1,2.
A Terapia Térmica Intersticial a Laser (LITT) é um procedimento aprovado pela FDA que usa um laser para ablação de tumor in-situ hipertérmico em pacientes com tumores cerebrais inoperáveis e fornece uma alternativa terapêutica atraente à ressecção cirúrgica convencional3. No entanto, falta um modelo murino detalhado e bem caracterizado para o tratamento LITT da GB, dificultando a pesquisa pré-clínica.
Este protocolo visa mostrar um modelo murino pré-clínico otimizado para o tratamento de GB com LITT. Optamos por usar camundongos C57BL / 6 e a linha celular de glioma singênico CT2A para este modelo principalmente porque CT2A recapitula de perto GB humano de alto grau com características histológicas semelhantes, invasividade, quimio e radiorresistência e características semelhantes a caules com auto-renovação e restabelecimento de tumores4. Essas características fornecem uma excelente plataforma para uma variedade de estudos envolvendo respostas imunes ou novas estratégias terapêuticas. Além disso, os aspectos técnicos deste protocolo LITT também são facilmente adaptáveis para outros modelos murinos de aloenxerto e xenoenxerto 4,5,6, que serão discutidos mais adiante.
As vantagens deste protocolo incluem resultados consistentes com um paradigma de tratamento LITT, simples, mas eficaz. O laser de granada de ítrio-alumínio dopado com neodímio de 1064 nm (Nd:YAG) empregado é o mesmo usado clinicamente em um dos dois sistemas atualmente aprovados pela FDA, permitindo experimentos que se aproximam da aplicação clínica do LITT para o tratamento de glioma de alto grau. A principal desvantagem deste protocolo é o extremo cuidado que deve ser tomado durante o implante de células tumorais e o tratamento LITT para obter resultados reprodutíveis. Além disso, devido à natureza agressiva da linha celular CT2A, o protocolo é altamente sensível ao tempo. A maioria dos experimentos precisará ser concluída em no máximo 20 dias, o que pode limitar as investigações de algumas respostas imunes adaptativas ou outros mecanismos celulares e moleculares que ocorrem em um curso de tempo mais longo.
Protocolo
A ética animal para este protocolo foi aprovada pelo Comitê de Cuidados com Animais da Universidade de Manitoba, de acordo com as diretrizes éticas estabelecidas pelo Conselho Canadense de Cuidados com Animais (CCAC). Este protocolo usou camundongos imunocompetentes C57BL/6 de 8 a 12 semanas de idade e a linha celular de glioma singênico CT2A para um modelo pré-clínico com uma ampla gama de aplicações, incluindo experimentos focados em análise histológica, alterações imunológicas ou intervenções terapêuticas combinatórias. O protocolo pode ser facilmente adaptado a outras espécies de camundongos ou linhagens celulares com base nos requisitos experimentais.
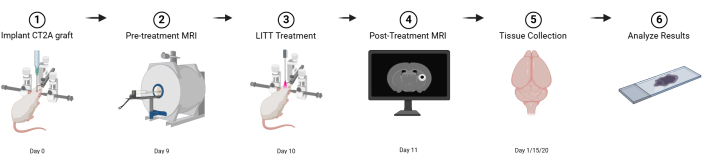
Figura 1: Esquema gráfico do projeto experimental básico. Criado com BioRender.com Clique aqui para ver uma versão maior desta figura.
1. Preparação de células em resumo (Dia 0)
- Antes de iniciar a cultura de células, certifique-se de que o gabinete e todas as pipetas necessárias estejam completamente esterilizadas com UV e etanol.
- Aqueça o DMEM/F12 com 10% de meio FBS, solução salina tamponada com fosfato (PBS) e tripsina à temperatura ambiente (RT) em banho-maria.
- Pipetar o meio do balão T25 e lavar brevemente as células com PBS. Adicione 1 mL de tripsina às células e incube por 30-60 s até que as células se desprendam do frasco.
- Confirme as células destacadas sob um microscópio óptico e adicione 4 mL de meio para interromper a atividade enzimática da tripsina.
- Conte células usando um contador de células automatizado.
- Misture 10 μL da suspensão celular com 10 μL de azul de tripano e, em seguida, adicione 10 μL à lâmina de contagem de células.
- Insira o slide na máquina de contagem de células e registre a contagem total de células, a contagem de células vivas e a porcentagem de células vivas.
NOTA: Se uma máquina automatizada de contagem de células não estiver disponível, uma contagem manual pode ser realizada usando um hemocitômetro.
- Calcule as células necessárias para todas as injeções planejadas.
NOTA: Para CT2A, recomenda-se 5000 células por 1,5 μL de volume injetado e um mínimo de 100 μL de volume total para cada preparação. - Gire as células a 134 x g por 5 min para pellet as células e aspire o máximo de meio possível.
- Ressuspenda o pellet celular com 5% de extrato de membrana basal em PBS para o volume necessário em um tubo de microcentrífuga. Embora tubos menores sejam mais adequados para preparar a suspensão celular, um tubo de 2 mL é melhor para armazenamento durante a cirurgia, pois as células são menos propensas a se aglomerar no fundo mais arredondado e redistribuir prontamente com movimentos suaves.
- Mantenha as células no gelo para injeção, preparando suspensões de células frescas a cada 4-5 h, conforme necessário.
2. Implante ortotópico (Dia 0)
- Prepare a área cirúrgica e certifique-se de que todos os instrumentos necessários estejam estéreis e prontos para uso.
- Anestesiar o camundongo usando isoflurano (3% vaporizado em 1 L / min O2) em uma câmara enquanto monitora a frequência respiratória (alvo de 60 bpm).
- Obtenha e registre o peso do animal para dosagem de medicamentos.
- Depile a área cirúrgica com cuidado para evitar os olhos, orelhas e bigodes.
- Transfira o animal para um quadro estereotáxico.
- Coloque os incisivos no orifício da barra de mordida e ajuste o nariz até ficar firme, apertando o parafuso de retenção para prender.
- Verifique a profundidade da anestesia com pinças bilaterais dos dedos dos pés posteriores e, se apropriado, prenda o crânio usando alfinetes e ajuste a cabeça do animal para uma posição neutra e nivelada.
- Monitore as temperaturas centrais dos animais usando uma sonda de temperatura retal lubrificada e forneça aquecimento suplementar a 37 °C usando uma almofada de aquecimento sob o corpo.
CUIDADO: Tome cuidado para não apertar demais o nariz, pois mesmo uma pressão moderada no osso nasal pode causar parada respiratória. Se for usada uma almofada de aquecimento elétrico (por exemplo, uma almofada de aquecimento para um terrário), certifique-se de que as configurações de temperatura sejam precisas e que a temperatura definida permaneça constante.
- Aplique pomada oftálmica generosamente em ambos os olhos para evitar o ressecamento.
- Administre injeções profiláticas e verifique a profundidade do anestésico.
- Injete meloxicam subcutâneo (s.c.) ou outro analgésico de ação prolongada de acordo com as diretrizes locais para animais (por exemplo, 5,0 mg/kg de meloxicam) usando uma seringa de 28 G x 1/2".
- Administre uma injeção de 20 mg / kg s.c. solução salina normal pré-aquecida para suporte profilático de fluidos durante procedimentos mais longos.
- Reduza o anestésico para 1,5% -2,0% de isoflurano para manter a frequência respiratória desejada.
- Usando uma técnica asséptica, arme o animal e prepare a área cirúrgica.
- Usando um cotonete estéril, aplique uma solução desinfetante de iodopovidona ou clorexidina. Começando medialmente no local da incisão e girando o cotonete após cada passagem, trabalhe para fora e, em seguida, usando um cotonete estéril fresco, aplique etanol a 70% no local de maneira semelhante.
- Repita a esfoliação com iodo seguido de etanol a 70% mais duas vezes (3 vezes no total, cada).
- Verifique novamente a profundidade do anestésico antes de prosseguir com a exposição cirúrgica. Monitore de perto a taxa de respiração durante todo o procedimento e ajuste o anestésico conforme necessário.
- Começando na linha média e ligeiramente posterior aos olhos, faça uma incisão sagital média de 1-1,5 cm na direção caudal usando um bisturi de lâmina # 15. Como alternativa, estenda uma pequena incisão de bisturi com uma tesoura de íris.
NOTA: As incisões devem começar na linha média, mas, para injeções unilaterais, podem ser ligeiramente inclinadas lateralmente para facilitar a visualização e o acesso simultâneos de Bregma e a localização do orifício da rebarba. - Usando um cotonete estéril, reflita as bordas da ferida para visualizar o crânio e esfregue suavemente qualquer tecido conjuntivo da área.
- Se necessário, use um cotonete estéril embebido em peróxido de hidrogênio para limpar a superfície do crânio e visualizar as suturas cranianas.
- Localize Bregma onde as suturas coronais esquerda e direita se encontram na linha média com a sutura sagital (ver Figura 2).
- Usando uma resina acrílica colorida não tóxica e um palito de dente de madeira estéril ou similar, faça uma marca muito pequena sobre o Bregma.
NOTA: Em alguns casos, as suturas coronais esquerda e direita não se espelham; Nesses casos, use uma 'linha de melhor ajuste' para aproximar onde eles devem se cruzar ao longo do plano sagital médio.
- Usando uma resina acrílica colorida não tóxica e um palito de dente de madeira estéril ou similar, faça uma marca muito pequena sobre o Bregma.
- Certifique-se de que a posição da cabeça do animal não esteja inclinada ou girada (ou seja, em um plano plano).
- Zero coordenadas estereotáxicas em Bregma. A coordenada x refere-se ao movimento no plano médio-lateral (ML), a coordenada y no plano ântero-posterior (AP) e a coordenada z no plano dorsal-ventral (DV).
- Certifique-se de que o Lambda esteja no mesmo plano DV que o Bregma (ou seja, z = 0 em ambos os pontos de referência). Da mesma forma, em +2,0 mm (x = 2) e -2,0 mm (x = -2,0) laterais ao Bregma, certifique-se de que o crânio esteja no mesmo plano, com a coordenada DV/z sendo aproximadamente igual. Certifique-se de que o crânio esteja seguro e não se mova após nenhum ajuste.
- Faça um furo de rebarba a +2.0 mm (ML) e +0.5 mm (AP) de Bregma (Figura 3).
- Usando um acessório de broca estereotáxica, abaixe cuidadosamente a ponta da broca até que ela entre em contato com Bregma e zere as coordenadas.
- Levante ligeiramente a broca e ajuste a broca para as coordenadas AP e ML apropriadas.
- Abaixe a broca lentamente, tomando cuidado para rebarbar apenas o crânio.
- Alternativamente, usando uma seringa de microlitro no quadro estereotáxico, abaixe a ponta da agulha até que ela entre em contato com Bregma e zere as coordenadas.
- Levante ligeiramente a agulha e ajuste para as coordenadas AP e ML apropriadas.
- Abaixe a ponta até tocar o crânio e anote a localização exata.
- Levante ligeiramente a agulha e faça uma pequena marca no local alvo com um marcador cirúrgico.
- Levante ou gire o porta-agulhas para fora do caminho e, usando uma furadeira manual, rebarba no crânio, tomando cuidado para evitar danificar o cérebro por baixo. CUIDADO: Em geral, camundongos machos mais velhos têm crânios relativamente mais grossos e requerem perfuração mais extensa. A perfuração manual deve ser feita com cuidado, aplicando pressão mínima, pois quebras repentinas no crânio danificarão as meninges subjacentes e/ou o cérebro.
NOTA: Uma extensão do orifício de rebarba é necessária para acomodar a sonda do termopar durante o procedimento LITT. Isso pode ser feito mais facilmente durante a cirurgia de injeção inicial e facilita uma cirurgia LITT mais rápida e simplificada. Alternativamente, o orifício de rebarba pode ser estendido da mesma maneira durante a cirurgia LITT, o que pode reduzir o risco de crescimento de tumor extracraniano.
- Crie um segundo orifício de rebarba a +3,0 mm ML e +0,5 mm AP (1,0 mm lateral ao local de injeção) para o termopar.
- Siga o procedimento de perfuração conforme descrito na etapa anterior.
- Para evitar dificuldades relacionadas ao crescimento ósseo, remova o osso entre os dois orifícios.
NOTA: Recomenda-se o uso de +2,0 mm ML, +0,5 mm AP e -2,5 mm DV da Bregma como coordenadas para implantação do tumor. Esta localização no estriado superior produz crescimento tumoral consistente, que é bem tolerado pelos animais - no entanto, o protocolo pode ser adaptado a outros locais.
- Prepare a suspensão de células de glioma de camundongo CT2A em seringa de microlitro (5000 células em 1,5 μL).
- Remova o tubo de microcentrífuga pré-preparado de células do gelo e agite suavemente com a ponta do dedo para ressuspender.
- Aspire suavemente 2 μL em uma seringa de 5 μL ou 10 μL, tomando cuidado para evitar bolhas.
- Expresse 0,5 μL para remover qualquer ar e garantir que a agulha esteja preparada e funcionando corretamente.
- Limpe a haste da agulha com um cotonete embebido em álcool para remover o fluido extraído e quaisquer células na superfície externa (o que pode causar o crescimento do tumor leptomeníngeo).
- Carregue a seringa em uma bomba de seringa microinjetora (ou acessório estereotáxico manual) e abaixe lentamente a agulha.
- Abaixe a agulha lentamente até a profundidade (z = -3,0 mm) e faça uma pausa de 1 min.
- Retraia lentamente a agulha 0,5 mm (z = -2,50 mm) e injete as células (≤ 0,5 μL / min). Mantenha a área ao redor da seringa seca usando uma lança de esponja microcirúrgica, tomando cuidado para não romper a agulha.
- Aguarde no mínimo 2 minutos após a conclusão da injeção e, em seguida, retraia lentamente a seringa durante um período de 3-4 minutos. Certifique-se de que os primeiros 4-5 intervalos de retração sejam de 100 μm por retração para evitar que as células sejam desalojadas de seu local de injeção original.
- Usando um cotonete embebido em álcool, limpe suavemente a parte externa da agulha de qualquer sangue ou fluido e lave e limpe a seringa de acordo com as orientações do fabricante. Use PBS e água destilada entre as injeções para garantir que a agulha não entupa. Quando as injeções estiverem concluídas, lave generosamente a agulha com etanol a 70% para remover quaisquer células restantes da agulha.
CUIDADO: Não lavar a agulha após cada injeção pode resultar em bloqueio. Se injetar mais de um tipo de célula, use uma agulha separada para cada tipo para evitar qualquer possível contaminação cruzada.
- Aproxime-se novamente da incisão, tomando cuidado para everter levemente as bordas da ferida para que a derme subjacente toque. Feche a ferida usando um clipe de ferida ou 3 pontos interrompidos com uma sutura 5-0. Aplique solução de iodopovidona na ferida fechada.
- Retirar o animal da estrutura estereotáxica e colocá-lo numa gaiola de recuperação forrada de papel sobre uma almofada de aquecimento regulada para 37 °C. Certifique-se de que a decúbito esternal seja obtida antes de transferir o animal de volta para a gaiola de origem com um pequeno prato de ração úmida localizado no chão da gaiola.
- Monitore o animal pelo menos duas vezes ao dia, começando no dia da cirurgia, pelos 2 dias seguintes. Administre novamente o meloxicam após 24 h, 48 h e 72 h, ou de acordo com as diretrizes da instituição.

Figura 2: Ilustração gráfica de um crânio de camundongo e marcos anatômicos importantes para cirurgia estereotáxica. Criado com BioRender.com Clique aqui para ver uma versão maior desta figura.
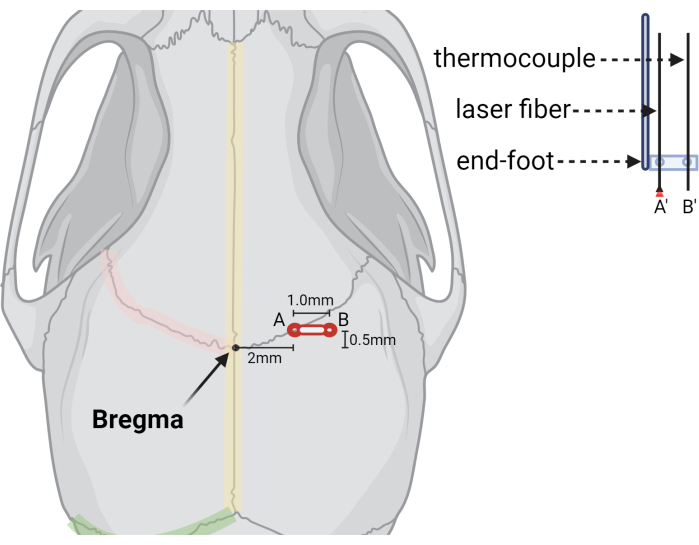
Figura 3: Ilustração gráfica indicando a localização de furos de rebarbas e aparelhos a laser. Ilustração mostrando as posições relativas do ponto de referência Bregma, (A) o orifício inicial para a fibra do laser (A') e (B) o segundo orifício ou orifício estendido para a sonda termopar (B'). Uma representação recortada da fibra do laser e das sondas do termopar é mostrada à direita, ilustrando como as sondas são estabilizadas em um pé final estereotáxico com orifícios pré-perfurados no tamanho e espaçamento desejados. Criado com BioRender.com Clique aqui para ver uma versão maior desta figura.
3. Monitoramento da carga tumoral pré-LITT (Dia 9)
- Realizar ressonância magnética (RM) ponderada em T2, seguindo as diretrizes institucionais, para avaliar o crescimento do tumor no dia anterior ao LITT.
NOTA: Os tumores devem ter ~ 1,5-2,0 mm de diâmetro.- Obtenha uma varredura coronal adequada de todo o cérebro do camundongo usando os seguintes parâmetros: sequência de eco de rotação rápida, TR = 5000 ms, TE = 45 ms, trens de eco = 7, FOV = 30 x 30 mm2, tamanho da matriz = 250 x 256, fatias totais = 18, espessura da fatia = 0,3 mm, médias = 2.
NOTA: Também é recomendável realizar ressonância magnética periódica a partir do dia 6 após o implante para confirmar o aloenxerto bem-sucedido e monitorar o crescimento do tumor - principalmente durante os experimentos iniciais - pois mesmo mudanças sutis no procedimento podem alterar o cronograma. O CT2A é altamente agressivo e os animais precisam ser monitorados de perto. Uma cintilografia coronal ponderada em T2 funciona bem para essa finalidade. O uso de células CT2A marcadas com fluorescência ou luciferina em conjunto com o sistema de imagem in vivo (IVIS) também pode ser adequado quando o acesso a uma ressonância magnética de pequenos animais não estiver disponível. No entanto, a cinética de crescimento e outras características do tumor serão diferentes deste protocolo.
- Obtenha uma varredura coronal adequada de todo o cérebro do camundongo usando os seguintes parâmetros: sequência de eco de rotação rápida, TR = 5000 ms, TE = 45 ms, trens de eco = 7, FOV = 30 x 30 mm2, tamanho da matriz = 250 x 256, fatias totais = 18, espessura da fatia = 0,3 mm, médias = 2.
4. Cirurgia LITT (Dia 10)
- Como acima na seção 2, repita as etapas 2.1-2.13 para preparar o animal para o LITT.
NOTA: A cicatrização de feridas da cirurgia anterior pode estar em diferentes estágios com base na espécie e variações no cronograma experimental. Esteja atento ao tecido mais fino ou delicado ao refazer a incisão. - Usando um cotonete estéril, limpe suavemente o crânio, limpando qualquer tecido que obscureça Bregma ou o orifício de rebarba feito anteriormente. Se necessário, perfure novamente o orifício da rebarba, embora devido à velocidade de formação do tumor CT2A, pouco ou nenhum crescimento ósseo seja esperado.
- Com o acessório LITT no lugar no quadro estereotáxico, zere as coordenadas em Bregma para a ponta da fibra do laser.
CUIDADO: A fibra do laser é muito frágil e rachará se dobrada. Tenha cuidado para parar assim que a ponta da fibra do laser entrar em contato com o crânio. - Levante ligeiramente a ponta e mova-se para as coordenadas ML e AP desejadas e, em seguida, abaixe lentamente as sondas até a coordenada DV alvo para chegar ao alvo (2.0 mm ML, 0.5 mm AP, -2.0 mm DV).
- Defina os parâmetros de tratamento LITT: Modo: contínuo; Potência: 1 W
- Alterne o laser de Standby para Active e engate o laser por 60 s usando o pedal. Se a temperatura aumentar além de 46 °C, faça uma breve pausa e depois volte a ativar, tentando manter a temperatura o mais próximo possível de 46 °C.
- Retraia lentamente o conjunto do laser e limpe suavemente a fibra do laser e o termopar com um cotonete embebido em álcool. Gire o conjunto para fora do caminho, tomando cuidado para que as sondas não entrem em contato com a estrutura.
- Feche a ferida e recupere o animal conforme descrito nas etapas 2.18-2.20 após a implantação do tumor acima.
5. Avaliação pós-LITT (dia 11)
- Realize ressonância magnética ponderada em T2 pós-LITT no dia seguinte ao tratamento LITT para avaliar a ablação bem-sucedida do tumor LITT usando a sequência e os parâmetros da etapa 3.1 acima.
NOTA: Além disso, uma sequência de recuperação de inversão atenuada por fluidos (FLAIR) também pode ser útil na avaliação do edema pós-operatório. - Realize exames de acompanhamento antes do final do estudo para monitorar as alterações pós-tratamento ou o crescimento do tumor.
6. Fim do estudo (dia 11/dia 15/dia 20)
- Eutanasiar animais nos desfechos experimentais escolhidos de acordo com as diretrizes da instituição.
NOTA: Os desfechos posteriores ao dia 20 não são viáveis com CT2A, mesmo com inoculações de contagem de células extremamente baixas, pois os animais de controle (ou seja, cirurgia simulada ou nenhum tratamento) e alguns animais do grupo de tratamento podem estar moribundos e necessitar de eutanásia. Para experimentos mais longos, considere modelos alternativos de células de glioma de camundongo. - Colete tecidos para fixação e processamento.
- Realizar perfusão cardíaca com paraformaldeído (PFA) a 4% e coletar os tecidos de interesse.
- Pós-fixar o tecido cerebral por imersão em PFA a 4% durante a noite a 4 °C.
- Processe as amostras usando práticas padrão para análise fixada em formalina, embebida em parafina (FFPE) ou congelamento fixo.
7. Análise
- Verifique a ablação LITT bem-sucedida usando ressonância magnética ponderada em T2 e valide usando técnicas histológicas básicas, como coloração de hematoxilina e eosina.
- Realize quaisquer análises adicionais necessárias para os experimentos (por exemplo, imuno-histoquímica, imunofluorescência).
Resultados
O implante bem-sucedido do tumor CT2A e os tratamentos LITT podem ser caracterizados usando ressonância magnética ponderada em T2, conforme mostrado na Figura 4, Figura 5 e Figura 6. As imagens de RM foram obtidas usando um ímã supercondutor livre de criogênio 7T com um diâmetro de 17 cm e bobina de cabeça de camundongo em quadratura usando os parâmetros de sequência descri...
Discussão
Há um corpo de literatura em rápida expansão sobre LITT; no entanto, é limitado principalmente a estudos de casos clínicos em humanos ou séries de casos. De fato, vários benefícios potenciais para o LITT foram demonstrados, incluindo menores taxas e custos de complicações pós-operatórias, ao mesmo tempo em que conferem sobrevida livre de progressão comparável 7,8,9,10,11.
Divulgações
Agradecemos o apoio da Monteris Medical, incluindo a doação em espécie de equipamentos a laser.
Agradecimentos
As fontes de financiamento para este projeto incluem o Conselho de Ciências Naturais e Engenharia do Canadá (NSERC)-Alliance, Mitacs-Accelerate, Research Manitoba-IPOC, Canadian Institutes for Health Research (CIHR) CGS-M e University of Manitoba Graduate Fellowship. Linha celular de glioma CT2A generosamente doada pelo Dr. Peter Fecci na Duke University, Durham, NC. Também gostaríamos de agradecer ao Laboratório de Serviço de Histologia e às instalações do Núcleo de Imagens de Pequenos Animais e Materiais da Universidade de Manitoba por sua excelente assistência técnica neste projeto.
Materiais
| Name | Company | Catalog Number | Comments |
| Absorbion Spears | FST | 18105-01 | Hemostatic sponges. |
| Adson tissue forceps | FST | 11006-12 | |
| C57BL/6 mice | Jackson Laboratories | Strain #000664 | 6 to 12 week old male and female |
| Cotton Tipped Applicators (6") | Electron Microscopy Sciences | 72308 | |
| CT2A glioma cell line | Generously donated from Dr. Peter Fecci, Duke University. | ||
| Cultrex Reduced Growth Factor Basement Membrane Extract, PathClear | Biotechne, R&D systems | 3433-010-01 | |
| DMEM/F-12, HEPES | Gibco, ThermoFisher Scientific | 11330032 | |
| Dual-chamber slides | BIO-RAD | 1450003 | |
| Eppendorf Safe-Lock Tubes 2.0 mL | Eppendorf | 22363352 | |
| Ethyl Alcohol Anhydrous | Greenfield Global | P016EAAN | Dilute to 70% with ddH2O |
| Fetal Bovine Serum, qualified, Canada | Gibco, ThermoFisher Scientific | 12483020 | |
| Glad Press-n-Seal plastic wrap | Amazon.ca | 12587704417 | |
| High speed drill | Kopf Instruments | Model 1474 | |
| K & J Thermocouple temerpature meter | Omega | HH509R | |
| Metacam (meloxicam) | WDDC | 114424 | |
| Microinjection syringe pump | WPI | UMP3T-1 | |
| Microliter syringe (700 Series) | Hamilton | 87908 | Custom needles are available. A steep needle bevel helps with precise delivery, and a shorter needle length helps with stability. |
| Needle driver/Needle Holder | FST | 12500-12 | A fine tip is most suitable due to the confined working space, but many styles are suitable based on handle preference. |
| Opixcare Plus opthalmic ointment | WDDC | 135941 | |
| Phosphate Buffered Saline (10x) | Fisher bioreagents | BP399-4 | Dilute to 1x with ddH2O |
| Povidone-iodine | ThermoFisher Scientific | 3955-16 | Aliquat into into smaller tubes for use with cotton tipped applicators. |
| Saline (normal) | WDDC | 126588 | |
| Scalpel, single use (#15 Blade) | Feather | Feather NO15 | |
| Scissors, fine surgical | FST | 91460-11 | Fine student scissors, Iris, or Bonn are all suitable. |
| Stereotactic frame | Kopf Instruments | Model 940 | With digital display console and mouse nose-cone and ear-bars. |
| Stereotactic syringe holder | Kopf Instruments | Model 1772-F | If not using an injection pump. |
| Sutures (5-0 monofilament) | Ethicon | MCP463G | Monocryl violet monofilament with reverse cutting tip |
| Syringe, 28 G (0.5 mL) | BD | BD 329461 | BD Lo-Dose U-100 Insulin Syringes |
| TC20 Automated Cell Counter | BIO-RAD | 1450102 | |
| Thermocouple probe, fine diameter (Type K) | Omega | TJM-CA316-IM025G-150 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco, ThermoFisher Scientific | 25200072 | |
| Vetbond by 3M, veterinary tissue glue | WDDC | 126125 | |
| Wahl Peanut Clippers | WDDC/Wahl | 100963 | Also available directly from manufacturer. |
| Warming pad | Bensen Medical | 70308/121873 | Any similar item can be used. |
| Webcol Alcohol preps | Electron Microscopy Sciences | 71005-20 | Alcohol prep wipe, 2-ply, medium size. |
Referências
- Canadian Cancer Society. . Cancer Statistics 2023. , (2023).
- . Glioblastoma Research Organization Available from: https://www.gbmresearch.org (2024)
- Carpentier, A., et al. Laser thermal therapy: Real-time MRI-guided and computer-controlled procedures for metastatic brain tumors. Lasers Surg Med. 43 (10), 943-950 (2011).
- Haddad, A. F., et al. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv. 3 (1), vdab100 (2021).
- Chokshi, C. R., Savage, N., Venugopal, C., Singh, S. K. A patient-derived xenograft model of glioblastoma. STAR Protoc. 1 (3), 100179 (2020).
- Alcaniz, J., et al. Clinically relevant glioblastoma patient-derived xenograft models to guide drug development and identify molecular signatures. Front Oncol. 13, 1129627 (2023).
- Muir, M., et al. Laser interstitial thermal therapy for newly diagnosed glioblastoma. Lasers Med Sci. 37 (3), 1811-1820 (2022).
- Muir, M., Traylor, J. I., Gadot, R., Patel, R., Prabhu, S. S. Repeat laser interstitial thermal therapy for recurrent primary and metastatic intracranial tumors. Surg Neurol Int. 13, 311 (2022).
- De Groot, J. F., et al. Efficacy of laser interstitial thermal therapy (LITT) for newly diagnosed and recurrent IDH wild-type glioblastoma. Neurooncol Adv. 4 (1), vdac040 (2022).
- Holste, K. G., Orringer, D. A. Laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdz035 (2020).
- Leuthardt, E. C., Voigt, J., Kim, A. H., Sylvester, P. A single-center cost analysis of treating primary and metastatic brain cancers with either brain laser interstitial thermal therapy (LITT) or craniotomy. Pharmacoecon Open. 1 (1), 53-63 (2017).
- Bastos, D. C. D. A., et al. Predictors of local control of brain metastasis treated with laser interstitial thermal therapy. Neurosurgery. 87 (1), 112-122 (2020).
- Darbinyan, A., Leelatian, N., Fomchenko, E. I. Histological changes associated with laser interstitial thermal therapy for radiation necrosis: illustrative cases. J Neurosurg Case Lessons. 4 (1), CASE21373 (2022).
- Grant, G. A., Porter, B. E., Li, D., Barros Guinle, M. I., Kaur, H. Approach, complications, and outcomes for 37 consecutive pediatric patients undergoing laser ablation for medically refractory epilepsy at Stanford Children's Health. J Neurosurg Pediatr. 33 (1), 1-11 (2023).
- Ogasawara, C., et al. Laser interstitial thermal therapy for cerebral cavernous malformations: A systematic review of indications, safety, and outcomes. World Neurosurg. 166, 279-287.e1 (2022).
- Satzer, D., Mahavadi, A., Lacy, M., Grant, J. E., Warnke, P. Interstitial laser anterior capsulotomy for obsessive-compulsive disorder: lesion size and tractography correlate with outcome. J Neurol Neurosurg Psychiatry. 93 (3), 317-323 (2022).
- Salehi, A., et al. Therapeutic enhancement of blood-brain and blood-tumor barriers permeability by laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdaa071 (2020).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados