A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج فئران ذو كفاءة مناعية للعلاج الحراري الخلالي بالليزر للورم الأرومي الدبقي
* These authors contributed equally
In This Article
Summary
الورم الأرومي الدبقي هو شكل مدمر من سرطان الدماغ الأولي ، ويظهر العلاج الحراري الخلالي بالليزر كبديل واعد للاستئصال الجراحي التقليدي للورم الأرومي الدبقي غير القابل للجراحة. يصف هذا البروتوكول نموذج فأر ما قبل السريري المحسن الذي يمكن استخدامه لدراسة آثار العلاج أو العلاجات المساعدة والاندماجية.
Abstract
يمثل الورم الأرومي الدبقي (GB) ، وهو الشكل الأكثر عدوانية من سرطان الدماغ الأولي ، ما يقرب من نصف جميع أورام الدماغ الأولية عالية الدرجة لدى البالغين وليس له علاج. العلاج الحراري الخلالي بالليزر (LITT) هو علاج معتمد من إدارة الغذاء والدواء (FDA) لمرض الجريان الخلالي ويستخدم في المرضى الذين قد لا يكونون مرشحين للاستئصال الجراحي التقليدي. في حين تم إثبات الفعالية السريرية ل LITT ، فإن البحث الذي يتجاوز دراسات الحالة السريرية وسلسلة الحالات محدود ويعوقه عدم وجود نموذج حيواني راسخ. يستخدم هذا البروتوكول الفئران C57BL / 6 وخط الخلايا السرطانية للورم الدبقي CT2A المتزامن لتلخيص GB البشري عن كثب مع استخدام ليزر عقيق الألمنيوم Yttrium (Nd: YAG) المشبع بالنيوديميوم 1064 نانومتر ، كما هو مستخدم في أحد نظامي LITT المعتمدين من إدارة الغذاء والدواء الأمريكية ، مما يوفر أهمية ممتازة قبل السريرية. سيوفر الإنشاء الناجح لنموذج الفئران LITT هذا منصة قيمة للتحقيق في السمات الفريدة لاستئصال LITT وتأثيراته على البيئة المكروية للورم ، مما قد يؤدي إلى تحسين الاستراتيجيات العلاجية.
Introduction
السرطان هو السبب الرئيسي الأول للوفاة في كندا. يمثل الورم الأرومي الدبقي (GB) ، وهو الشكل الأكثر شيوعا من أورام الدماغ العدوانية ، 48٪ إلى 60٪ من جميع أورام الدماغ الأولية عالية الدرجة لدىالبالغين 1. تشخيص GB قاتم بشكل خاص مع بقاء صافي لمدة 5 سنوات بنسبة 4.8٪ مع العلاجات التقليدية ، بما في ذلك الاستئصال الجراحي والعلاج الكيميائي والإشعاعي1،2.
العلاج الحراري الخلالي بالليزر (LITT) هو إجراء معتمد من إدارة الغذاء والدواء الأمريكية (FDA) باستخدام الليزر لاستئصال الورم الموضعي العالي الحرارة في المرضى الذين يعانون من أورام الدماغ غير القابلة للجراحة ويوفر بديلا علاجيا جذابا للاستئصال الجراحيالتقليدي 3. ومع ذلك ، لا يوجد نموذج فئران مفصل ومميز جيدا لعلاج LITT ل GB ، مما يعيق البحث قبل السريري.
يهدف هذا البروتوكول إلى عرض نموذج فئران ما قبل السريري المحسن لعلاج GB باستخدام LITT. لقد اخترنا استخدام الفئران C57BL / 6 وخط خلايا الورم الدبقي المتزابقي CT2A لهذا النموذج في المقام الأول لأن CT2A يلخص عن كثب GB البشري عالي الجودة مع ميزات نسيجية مماثلة ، وغزو ، ومقاومة كيميائية وإشعاعية ، وميزات شبيهة بالجذع مع التجديد الذاتي وإعادة تأسيس الأورام4. توفر هذه الخصائص منصة ممتازة لمجموعة متنوعة من الدراسات التي تتضمن استجابات مناعية أو استراتيجيات علاجية جديدة. علاوة على ذلك ، فإن الجوانب الفنية لبروتوكول LITT هذا قابلة للتكيف بسهولة مع نماذج الفئران الأخرى4،5،6 ، والتي سيتم مناقشتها بمزيد من التفصيل.
تشمل مزايا هذا البروتوكول نتائج متسقة مع نموذج علاج LITT بسيط ولكنه فعال. إن ليزر عقيق العقيق الإيتريوم الألمنيوم (Nd: YAG) المشبع بالنيوديميوم 1064 نانومتر هو نفسه المستخدم سريريا في أحد النظامين المعتمدين حاليا من إدارة الغذاء والدواء الأمريكية ، مما يسمح بإجراء تجارب موازية بشكل وثيق للتطبيق السريري ل LITT لعلاج الورم الدبقي عالي الجودة. العيب الأساسي لهذا البروتوكول هو الحذر الشديد الذي يجب اتخاذه أثناء كل من زرع الخلايا السرطانية وعلاج LITT لتحقيق نتائج قابلة للتكرار. بالإضافة إلى ذلك ، نظرا للطبيعة العدوانية لخط خلايا CT2A ، فإن البروتوكول حساس للغاية للوقت. يجب الانتهاء من معظم التجارب في غضون 20 يوما كحد أقصى ، مما قد يحد من التحقيقات في بعض الاستجابات المناعية التكيفية أو الآليات الخلوية والجزيئية الأخرى التي تحدث على مدى فترة زمنية أطول.
Protocol
تمت الموافقة على أخلاقيات لهذا البروتوكول من قبل لجنة رعاية في جامعة مانيتوبا وفقا للمبادئ التوجيهية الأخلاقية التي وضعها المجلس الكندي لرعاية (CCAC). استخدم هذا البروتوكول الفئران C57BL / 6 ذات الكفاءة المناعية البالغة من العمر 8-12 أسبوعا وخط خلايا الورم الدبقي الزاوي CT2A لنموذج قبل السريري مع مجموعة واسعة من التطبيقات ، بما في ذلك التجارب التي تركز على التحليل النسيجي أو التغيرات المناعية أو التدخلات العلاجية التوافقية. يمكن تكييف البروتوكول بسهولة مع أنواع الفئران الأخرى أو خطوط الخلايا بناء على المتطلبات التجريبية.
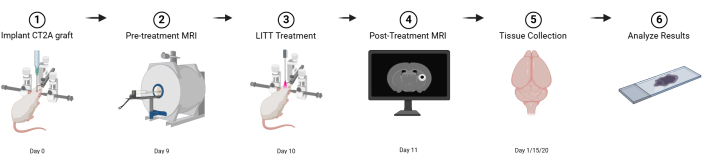
الشكل 1: تخطيطي رسومي للتصميم التجريبي الأساسي. تم إنشاؤه باستخدام BioRender.com الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
1. تحضير الخلية باختصار (اليوم 0)
- قبل البدء في زراعة الخلايا ، تأكد من تعقيم الخزانة وجميع الماصات المطلوبة بالكامل بالأشعة فوق البنفسجية والإيثانول.
- قم بتسخين DMEM / F12 باستخدام وسائط FBS بنسبة 10٪ ، ومحلول ملحي مخزن بالفوسفات (PBS) ، والتربسين إلى درجة حرارة الغرفة (RT) باستخدام حمام مائي.
- قم بإخراج الوسائط من قارورة T25 واشطف الخلايا لفترة وجيزة باستخدام PBS. أضف 1 مل من التربسين إلى الخلايا واحتضن لمدة 30-60 ثانية حتى تنفصل الخلايا عن القارورة.
- تأكد من الخلايا المنفصلة تحت المجهر الضوئي وأضف 4 مل من الوسائط لإيقاف النشاط الأنزيمي التربسين.
- عد الخلايا باستخدام عداد خلايا تلقائي.
- امزج 10 ميكرولتر من تعليق الخلية مع 10 ميكرولتر من التريبان الأزرق ، ثم أضف 10 ميكرولتر إلى شريحة عد الخلايا.
- أدخل الشريحة في جهاز عد الخلايا وسجل إجمالي عدد الخلايا وعدد الخلايا الحية والنسبة المئوية للخلايا الحية.
ملاحظة: في حالة عدم توفر آلة عد الخلايا الآلي، يمكن إجراء العد اليدوي باستخدام مقياس كثافة الدم.
- احسب الخلايا المطلوبة لجميع الحقن المخطط لها.
ملاحظة: بالنسبة إلى CT2A ، يوصى باستخدام 5000 خلية لكل 1.5 ميكرولتر في الحجم المحقون والحجم الإجمالي 100 ميكرولتر على الأقل لكل مستحضر. - قم بتدوير الخلايا عند 134 × جم لمدة 5 دقائق لحبيبات الخلايا وشفط أكبر قدر ممكن من الوسط.
- أعد تعليق حبيبات الخلية بمستخلص غشاء القاعدي بنسبة 5٪ في PBS للحجم المطلوب في أنبوب الطرد المركزي الدقيق. في حين أن الأنابيب الأصغر ستكون الأنسب لإعداد تعليق الخلية ، فإن أنبوب 2 مل أفضل للتخزين أثناء الجراحة حيث تقل احتمالية تكتل الخلايا في القاع الأكثر تقريبا وإعادة توزيعها بسهولة بنقرة لطيفة.
- احتفظ بالخلايا على الجليد للحقن ، وقم بإعداد معلقات الخلايا الطازجة كل 4-5 ساعات حسب الحاجة.
2. زرع تقويم العظام (اليوم 0)
- جهز المنطقة الجراحية وتأكد من أن جميع الأدوات المطلوبة معقمة وجاهزة للاستخدام.
- تخدير الفأر باستخدام الأيزوفلوران (3٪ مبخر في 1 لتر / دقيقةO 2) في غرفة أثناء مراقبة معدل التنفس (الهدف 60 نبضة في الدقيقة).
- الحصول على وزن وتسجيله لجرعات الدواء.
- احلق منطقة الجراحة بعناية لتجنب العينين والأذنين والشعيرات.
- انقل إلى إطار تجسيمي.
- ضع القواطع في فتحة قضيب العض واضبط مخروط الأنف حتى يتماسك ، مع شد برغي التثبيت لتثبيته.
- تحقق من عمق التخدير باستخدام قرصات إصبع القدم الخلفية الثنائية ، وإذا كان ذلك مناسبا ، قم بتأمين الجمجمة باستخدام دبابيس الأذن واضبط رأس على وضع محايد ومستو.
- راقب درجات حرارة قلب باستخدام مسبار درجة حرارة المستقيم المشحم ووفر الاحترار الإضافي عند 37 درجة مئوية باستخدام وسادة تسخين تحت الجسم.
تنبيه: احرص على عدم إفراط في شد مخروط الأنف ، لأنه حتى الضغط المعتدل على عظم الأنف قد يسبب توقف التنفس. إذا تم استخدام وسادة تسخين كهربائية (على سبيل المثال ، وسادة تسخين لتررم) ، فتأكد من دقة إعدادات درجة الحرارة وتظل درجة الحرارة المحددة ثابتة.
- ضع مرهم العين بكثرة على كلتا العينين لمنع الجفاف.
- تطبيق الحقن الوقائية والتحقق من عمق التخدير.
- حقن ميلوكسيكام تحت الجلد أو غيرها من مسكنات الألم طويلة المفعول وفقا لإرشادات المنشأة الحيوانية المحلية (على سبيل المثال ، 5.0 مجم / كجم ميلوكسيكام) باستخدام حقنة 28 جم × 1/2 بوصة.
- تطبيق حقنة 20 ملغ/كغ محلول ملحي عادي مسخن مسبقا لدعم السوائل الوقائية أثناء الإجراءات الطويلة.
- تقليل التخدير إلى 1.5٪ -2.0٪ إيزوفلوران للحفاظ على معدل التنفس المستهدف.
- باستخدام تقنية معقمة ، ثنى وإعداد المنطقة الجراحية.
- باستخدام قطعة قطن معقمة ، ضع محلول مطهر بوفيدون اليود أو الكلورهيكسيدين. ابدأ وسطيا في موقع الشق وقم بتدوير المسحة بعد كل تمريرة ، واعمل للخارج ، ثم باستخدام قطعة قطن معقمة جديدة ، ضع 70٪ من الإيثانول على الموقع بطريقة مماثلة.
- كرر الفرك باليود متبوعا ب 70٪ من الإيثانول مرتين إضافيتين (3 مرات إجمالا ، لكل منهما).
- أعد فحص عمق التخدير قبل الشروع في التعرض الجراحي. راقب عن كثب معدل التنفس طوال العملية واضبط التخدير حسب الضرورة.
- بدءا من خط الوسط والخلف قليلا للعينين ، قم بعمل شق سهمي متوسط 1-1.5 سم في الاتجاه الذيلي باستخدام مشرط شفرة # 15. بدلا من ذلك ، قم بتمديد شق مشرط قصير باستخدام مقص القزحية.
ملاحظة: يجب أن تبدأ الشقوق عند خط الوسط ، ولكن بالنسبة للحقن الأحادي الجانب ، يمكن أن تكون بزاوية جانبية قليلا لتسهيل التصور المتزامن والوصول إلى Bregma وموقع الثقب. - باستخدام قطعة قطن معقمة ، اعكس حواف الجرح لتصور الجمجمة وافرك أي نسيج ضام برفق من المنطقة.
- إذا لزم الأمر ، استخدم قطعة قطن معقمة مبللة ببيروكسيد الهيدروجين لتنظيف سطح الجمجمة وتصور خيوط الجمجمة.
- حدد موقع Bregma حيث تلتقي الغرز الإكليلية اليمنى واليسرى عند خط الوسط مع الخيط السهمي (انظر الشكل 2).
- باستخدام راتنج أكريليك ملون غير سام وعود أسنان خشبي معقم أو ما شابه ذلك ، ضع علامة صغيرة جدا على Bregma.
ملاحظة: في بعض الحالات ، لا تعكس الغرز الإكليلية اليمنى واليسرى بعضهما البعض. في مثل هذه الحالات ، استخدم "خط الأنسب" لتقريب المكان الذي يجب أن تتقاطع فيه على طول المستوى السهمي المتوسط.
- باستخدام راتنج أكريليك ملون غير سام وعود أسنان خشبي معقم أو ما شابه ذلك ، ضع علامة صغيرة جدا على Bregma.
- تأكد من عدم إمالة أو تدوير موضع رأس (أي في مستوى مسطح).
- صفر إحداثيات النجوم في بريجما. يشير الإحداثي x إلى الحركة في المستوى الإنسي الجانبي (ML) ، والإحداثي y في المستوى الأمامي الخلفي (AP) ، والإحداثي z في المستوى الظهري البطني (DV).
- تأكد من أن Lambda في نفس مستوى DV مثل Bregma (على سبيل المثال ، z = 0 في كلا المعلمين). وبالمثل ، عند +2.0 مم (x = 2) و -2.0 مم (x = -2.0) جانبيا ل Bregma ، تأكد من أن الجمجمة في نفس المستوى ، مع تساوي إحداثيات DV / z تقريبا. تأكد من أن الجمجمة آمنة ولا تتحرك بعد أي تعديلات.
- حفر حفرة لدغ عند +2.0 مم (مل) و +0.5 مم (AP) من بريجما (الشكل 3).
- باستخدام ملحق حفر تجسيمي ، اخفض طرف البت بعناية حتى يتلامس مع بريجما وصفر الإحداثيات.
- ارفع البتة قليلا واضبط المثقاب على إحداثيات AP و ML المناسبة.
- اخفض المثقاب ببطء ، مع الحرص على الثقب فقط من خلال الجمجمة.
- بدلا من ذلك ، باستخدام حقنة ميكرولتر في الإطار التجسيمي ، قم بخفض الإبرة حتى تتصل ب Bregma وتصفير الإحداثيات.
- ارفع الإبرة قليلا واضبط على إحداثيات AP و ML المناسبة.
- اخفض الطرف حتى يلامس الجمجمة ولاحظ الموقع الدقيق.
- ارفع الإبرة قليلا وقم بعمل علامة صغيرة في الموقع المستهدف باستخدام علامة جراحية.
- ارفع أو قم بتدوير حامل الإبرة بعيدا عن الطريق ، وباستخدام مثقاب يدوي ، قم بتمرير الجمجمة ، مع الحرص على تجنب إتلاف الدماغ تحتها. تنبيه: بشكل عام ، تمتلك الفئران الذكور الأكبر سنا جماجم أكثر سمكا نسبيا وتتطلب حفرا أكثر شمولا. يجب أن يتم الحفر اليدوي بعناية ، مع تطبيق الحد الأدنى من الضغط ، لأن الاختراقات المفاجئة للجمجمة ستؤدي إلى إتلاف السحايا و / أو الدماغ الكامن.
ملاحظة: يعد تمديد فتحة الأزيز ضروريا لاستيعاب المسبار الحراري أثناء إجراء LITT. يمكن القيام بذلك بسهولة أكبر أثناء جراحة الحقن الأولية ويسهل جراحة LITT بشكل أسرع وأكثر انسيابية. بدلا من ذلك ، يمكن تمديد ثقب الأزيز بنفس الطريقة أثناء جراحة LITT ، مما قد يقلل من خطر نمو الورم خارج الجمجمة.
- قم بإنشاء فتحة لتوءات ثانية عند +3.0 مم مل و +0.5 مم AP (1.0 مم جانبيا لموقع الحقن) للمزدوجة الحرارية.
- اتبع إجراء الحفر كما هو موضح في الخطوة السابقة.
- لتجنب الصعوبات المتعلقة بإعادة نمو العظام ، قم بإزالة العظم بين الفتحتين.
ملاحظة: يوصى باستخدام +2.0 مم مل و +0.5 مم AP و -2.5 مم DV من Bregma كإحداثيات لزرع الورم. ينتج عن هذا الموقع في المخطط العلوي نموا ثابتا للورم ، والذي تتحمله جيدا - ومع ذلك ، يمكن تكييف البروتوكول مع مواقع أخرى.
- تحضير معلق خلايا الورم الدبقي للفأر CT2A في حقنة ميكرولتر (5000 خلية في 1.5 ميكرولتر).
- قم بإزالة أنبوب الطرد المركزي الدقيق المعد مسبقا من الخلايا من الجليد ونفض الغبار برفق بطرف إصبع لإعادة التعليق.
- ارسم 2 ميكرولتر برفق في حقنة سعة 5 ميكرولتر أو 10 ميكرولتر مع الحرص على تجنب الفقاعات.
- اعبر عن 0.5 ميكرولتر لإزالة أي هواء والتأكد من أن الإبرة معدة وتعمل بشكل صحيح.
- امسح جذع الإبرة بمسحة كحولية لإزالة السائل المسحوب وأي خلايا على السطح الخارجي (والتي قد تسبب نمو الورم البريماني السحائي).
- قم بتحميل المحقنة في مضخة حقنة حاقن دقيق (أو ملحق تجسيمي يدوي) وقم بخفض الإبرة ببطء.
- اخفض الإبرة ببطء إلى العمق (z = -3.0 مم) وتوقف مؤقتا لمدة 1 دقيقة.
- اسحب الإبرة ببطء 0.5 مم (z = -2.50 مم) وحقن الخلايا (≤ 0.5 ميكرولتر / دقيقة). حافظ على المنطقة المحيطة بالحقنة جافة باستخدام رمح إسفنجي جراحي مجهري ، مع الحرص على عدم تعطيل الإبرة.
- انتظر ما لا يقل عن دقيقتين بعد اكتمال الحقن ، ثم اسحب المحقنة ببطء على مدى 3-4 دقائق. تأكد من أن فترات التراجع الأولى من 4 إلى 5 هي 100 ميكرومتر لكل تراجع لتجنب إزاحة الخلايا من موقع الحقن الأصلي.
- باستخدام مسحة كحولية ، امسح الجزء الخارجي من الإبرة برفق خاليا من أي دم أو سوائل واغسل المحقنة وتنظيفها وفقا لإرشادات الشركة المصنعة. استخدم PBS والماء المقطر بين الحقن لضمان عدم انسداد الإبرة. عند اكتمال الحقن ، اغسل الإبرة بسخاء بنسبة 70٪ من الإيثانول لإزالة أي خلايا متبقية من الإبرة.
تنبيه: قد يؤدي عدم تنظيف الإبرة بعد كل حقنة إلى انسداد. في حالة حقن أكثر من نوع خلية ، استخدم إبرة منفصلة لكل نوع لتجنب أي تلوث متبادل محتمل.
- أعد تقريب الشق ، مع الحرص على قطع حواف الجرح قليلا حتى تلمس الأدمة الأساسية. أغلق الجرح باستخدام مشبك الجرح أو 3 غرز متقطعة بخياطة 5-0. ضع محلول بوفيدون اليود على الجرح المغلق.
- أخرج من الإطار التجسيمي وضعه في قفص استرداد مبطن بالورق على وسادة تسخين مضبوطة على 37 درجة مئوية. تأكد من الحصول على الاستلقاء القصي قبل نقل مرة أخرى إلى قفص المنزل مع طبق صغير من الطعام الرطب الموجود على أرضية القفص.
- راقب مرتين يوميا على الأقل ، بدءا من يوم الجراحة ، لمدة يومين التاليين. أعد إدارة ميلوكسيكام بعد 24 ساعة و 48 ساعة و 72 ساعة ، أو وفقا لإرشادات المؤسسة.

الشكل 2: رسم توضيحي لجمجمة فأر ومعالم تشريحية مهمة للجراحة التجسيمية. تم إنشاؤه باستخدام BioRender.com الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
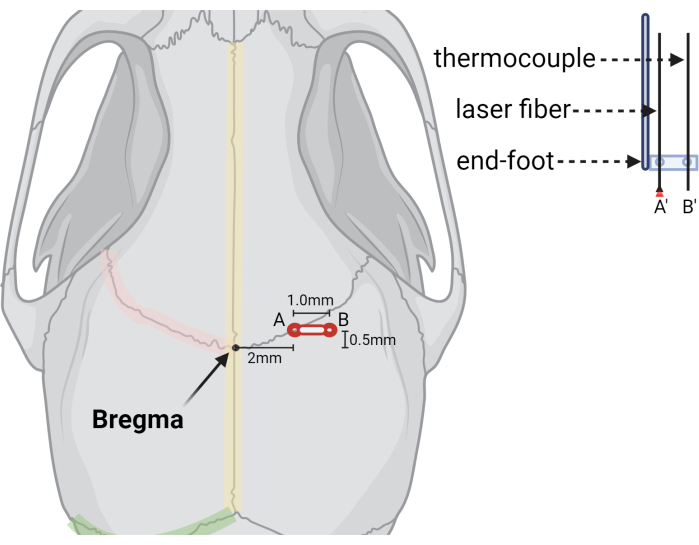
الشكل 3: رسم توضيحي رسومي يشير إلى مواقع ثقوب الأزيز وجهاز الليزر. رسم توضيحي يوضح المواضع النسبية لمعلم بريجما ، (أ) ثقب الأزيز الأولي لألياف الليزر (أ) ، و (ب) الفتحة الثانية أو الممتدة للمسبار الحراري (ب). يظهر تصوير مقطوع لألياف الليزر والمجسات الحرارية على اليمين ، موضحا كيف يتم تثبيت المجسات في نهاية القدم التجسيمية مع ثقوب محفورة مسبقا بالحجم والتباعد المطلوبين. تم إنشاؤه باستخدام BioRender.com الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
3. مراقبة عبء الورم قبل LITT (اليوم 9)
- إجراء التصوير بالرنين المغناطيسي المرجح T2 (MRI) ، باتباع الإرشادات المؤسسية ، لتقييم نمو الورم في اليوم السابق ل LITT.
ملاحظة: يجب أن يكون قطر الأورام ~ 1.5-2.0 مم.- احصل على مسح إكليلي مناسب لدماغ الفأر بالكامل باستخدام المعلمات التالية: تسلسل صدى الدوران السريع ، TR = 5000 مللي ثانية ، TE = 45 مللي ثانية ، قطارات الصدى = 7 ، مجال الرؤية = 30 × 30 مم2 ، حجم المصفوفة = 250 × 256 ، إجمالي الشرائح = 18 ، سمك الشريحة = 0.3 مم ، المتوسطات = 2.
ملاحظة: يوصى أيضا بإجراء التصوير بالرنين المغناطيسي الدوري بدءا من اليوم 6 تقريبا بعد الزرع لتأكيد نجاح التطعيم الخيفي ومراقبة نمو الورم - خاصة أثناء التجارب الأولية - حيث أن التغييرات الطفيفة في الإجراء قد تغير الجدول الزمني. CT2A عدواني للغاية ، وتحتاج إلى المراقبة عن كثب. يعمل الفحص الإكليلي المرجح T2 بشكل جيد لهذا الغرض. قد يكون استخدام خلايا CT2A الموسومة بالفلورسنت أو المسمى باللوسيفيرين جنبا إلى جنب مع نظام التصوير في الجسم الحي (IVIS) مناسبا أيضا حيث لا يتوفر الوصول إلى التصوير بالرنين المغناطيسي للحيوانات الصغيرة. ومع ذلك ، فإن حركية النمو وخصائص الورم الأخرى ستختلف عن هذا البروتوكول.
- احصل على مسح إكليلي مناسب لدماغ الفأر بالكامل باستخدام المعلمات التالية: تسلسل صدى الدوران السريع ، TR = 5000 مللي ثانية ، TE = 45 مللي ثانية ، قطارات الصدى = 7 ، مجال الرؤية = 30 × 30 مم2 ، حجم المصفوفة = 250 × 256 ، إجمالي الشرائح = 18 ، سمك الشريحة = 0.3 مم ، المتوسطات = 2.
4. جراحة LITT (اليوم 10)
- كما هو مذكور أعلاه في القسم 2 ، كرر الخطوات 2.1-2.13 لإعداد ل LITT.
ملاحظة: قد يكون التئام الجروح من الجراحة السابقة في مراحل مختلفة بناء على الأنواع والاختلافات في الجدول الزمني التجريبي. ضع في اعتبارك الأنسجة الرقيقة أو الأكثر حساسية عند إعادة عمل الشق. - باستخدام مسحة معقمة ذات رؤوس قطنية ، قم بتنظيف الجمجمة برفق ، وإزالة أي أنسجة تحجب Bregma أو ثقب الأزيز الذي تم صنعه مسبقا. إذا لزم الأمر ، أعد حفر ثقب الأزيز ، على الرغم من سرعة تكوين ورم CT2A ، من المتوقع حدوث القليل من نمو العظام إن وجد.
- مع وجود ملحق LITT في مكانه في الإطار التجسيمي ، قم بصفر الإحداثيات في Bregma لطرف ألياف الليزر.
تنبيه: ألياف الليزر هشة للغاية وسوف تتشقق إذا تم ثنيها. احرص على التوقف بمجرد ملامسة طرف ألياف الليزر للجمجمة. - ارفع الطرف قليلا وانتقل إلى إحداثيات ML و AP المطلوبة ، ثم اخفض المجسات ببطء إلى إحداثيات DV المستهدفة للوصول إلى الهدف (2.0 مم مل ، 0.5 مم AP ، -2.0 مم DV).
- اضبط معلمات معالجة LITT: الوضع: مستمر ؛ الطاقة: 1 واط
- قم بتبديل الليزر من وضع الاستعداد إلى النشط وقم بتشغيل الليزر لمدة 60 ثانية باستخدام دواسة القدم. إذا ارتفعت درجة الحرارة إلى ما بعد 46 درجة مئوية ، توقف مؤقتا لفترة وجيزة ، ثم أعد الانخراط ، في محاولة للحفاظ على درجة الحرارة بالقرب من 46 درجة مئوية قدر الإمكان.
- اسحب مجموعة الليزر ببطء وامسح ألياف الليزر والمزدوجة الحرارية برفق باستخدام مسحة كحولية. قم بتدوير التجميع بعيدا عن الطريق ، مع الحرص على عدم اتصال المجسات بالإطار.
- أغلق الجرح واسترجع كما هو موضح في الخطوات 2.18-2.20 بعد زرع الورم أعلاه.
5. تقييم ما بعد LITT (اليوم 11)
- قم بإجراء التصوير بالرنين المغناطيسي المرجح بعد LITT T2 في اليوم التالي للعلاج ب LITT لتقييم استئصال الورم LITT الناجح باستخدام التسلسل والمعلمات من الخطوة 3.1 أعلاه.
ملاحظة: بالإضافة إلى ذلك ، قد يكون تسلسل التعافي الانعكاسي الموهن بالسوائل (FLAIR) مفيدا أيضا في تقييم الوذمة بعد الجراحة. - إجراء فحوصات المتابعة قبل نهاية الدراسة لمراقبة التغيرات بعد العلاج أو إعادة نمو الورم.
6. نهاية الدراسة (اليوم 11 / اليوم 15 / اليوم 20)
- قتل عند نقاط النهاية التجريبية المختارة وفقا لإرشادات المؤسسة.
ملاحظة: لا يمكن تحقيق نقاط النهاية في وقت لاحق من اليوم 20 مع CT2A ، حتى مع تلقيحات منخفضة للغاية لعدد الخلايا ، حيث أن الضابطة (أي الجراحة الوهمية أو عدم العلاج) وبعض مجموعة العلاج قد تحتضر وتتطلب القتل الرحيم. لإجراء تجارب أطول، ضع في اعتبارك نماذج خلايا الورم الدبقي البديلة. - جمع الأنسجة للتثبيت والمعالجة.
- إجراء التروية القلبية بنسبة 4٪ بارافورمالدهايد (PFA) وجمع الأنسجة ذات الاهتمام.
- بعد إصلاح أنسجة المخ عن طريق الغمر في 4٪ PFA طوال الليل عند 4 درجات مئوية.
- معالجة العينات باستخدام الممارسات القياسية للتحليل المضمن في البارافين الثابت بالفورمالين (FFPE) أو التحليل المجمد الثابت.
7. التحليل
- تحقق من نجاح استئصال LITT باستخدام التصوير بالرنين المغناطيسي T2 والتحقق من صحته باستخدام التقنيات النسيجية الأساسية مثل صبغة الهيماتوكسيلين واليوزين.
- قم بإجراء أي تحليلات إضافية مطلوبة للتجارب (على سبيل المثال ، الكيمياء المناعية ، التألق المناعي).
النتائج
يمكن وصف زرع الورم CT2A الناجح وعلاجات LITT باستخدام التصوير بالرنين المغناطيسي T2 ، كما هو موضح في الشكل 4 والشكل 5 والشكل 6. تم الحصول على صور التصوير بالرنين المغناطيسي باستخدام مغناطيس فائق التوصيل خال من التبريد 7T ...
Discussion
هناك مجموعة من الأدبيات سريعة التوسع فيما يتعلق ب LITT. ومع ذلك ، فإنه يقتصر في المقام الأول على دراسات الحالة السريرية البشرية أو سلسلة الحالات. في الواقع ، تم عرض العديد من الفوائد المحتملة ل LITT ، بما في ذلك انخفاض معدلات المضاعفات والتكاليف بعد الجراحة مع منح بقاء خال من ...
Disclosures
نحن ممتنون للدعم المقدم من مونتيريس الطبية ، بما في ذلك التبرع العيني بمعدات الليزر.
Acknowledgements
تشمل مصادر تمويل هذا المشروع مجلس العلوم الطبيعية والهندسة الكندي (NSERC) - التحالف ، و Mitacs-Accelerate ، و Research Manitoba-IPOC ، والمعاهد الكندية للبحوث الصحية (CIHR) CGS-M ، وزمالة الدراسات العليا بجامعة مانيتوبا. خط خلايا الورم الدبقي CT2A تبرع به الدكتور بيتر فيتشي بسخاء في جامعة ديوك ، دورهام ، نورث كارولاينا. نود أيضا أن نشكر مختبر خدمة الأنسجة ومرفق التصوير الأساسي للحيوانات الصغيرة والمواد في جامعة مانيتوبا على مساعدتهم الفنية الممتازة في هذا المشروع.
Materials
| Name | Company | Catalog Number | Comments |
| Absorbion Spears | FST | 18105-01 | Hemostatic sponges. |
| Adson tissue forceps | FST | 11006-12 | |
| C57BL/6 mice | Jackson Laboratories | Strain #000664 | 6 to 12 week old male and female |
| Cotton Tipped Applicators (6") | Electron Microscopy Sciences | 72308 | |
| CT2A glioma cell line | Generously donated from Dr. Peter Fecci, Duke University. | ||
| Cultrex Reduced Growth Factor Basement Membrane Extract, PathClear | Biotechne, R&D systems | 3433-010-01 | |
| DMEM/F-12, HEPES | Gibco, ThermoFisher Scientific | 11330032 | |
| Dual-chamber slides | BIO-RAD | 1450003 | |
| Eppendorf Safe-Lock Tubes 2.0 mL | Eppendorf | 22363352 | |
| Ethyl Alcohol Anhydrous | Greenfield Global | P016EAAN | Dilute to 70% with ddH2O |
| Fetal Bovine Serum, qualified, Canada | Gibco, ThermoFisher Scientific | 12483020 | |
| Glad Press-n-Seal plastic wrap | Amazon.ca | 12587704417 | |
| High speed drill | Kopf Instruments | Model 1474 | |
| K & J Thermocouple temerpature meter | Omega | HH509R | |
| Metacam (meloxicam) | WDDC | 114424 | |
| Microinjection syringe pump | WPI | UMP3T-1 | |
| Microliter syringe (700 Series) | Hamilton | 87908 | Custom needles are available. A steep needle bevel helps with precise delivery, and a shorter needle length helps with stability. |
| Needle driver/Needle Holder | FST | 12500-12 | A fine tip is most suitable due to the confined working space, but many styles are suitable based on handle preference. |
| Opixcare Plus opthalmic ointment | WDDC | 135941 | |
| Phosphate Buffered Saline (10x) | Fisher bioreagents | BP399-4 | Dilute to 1x with ddH2O |
| Povidone-iodine | ThermoFisher Scientific | 3955-16 | Aliquat into into smaller tubes for use with cotton tipped applicators. |
| Saline (normal) | WDDC | 126588 | |
| Scalpel, single use (#15 Blade) | Feather | Feather NO15 | |
| Scissors, fine surgical | FST | 91460-11 | Fine student scissors, Iris, or Bonn are all suitable. |
| Stereotactic frame | Kopf Instruments | Model 940 | With digital display console and mouse nose-cone and ear-bars. |
| Stereotactic syringe holder | Kopf Instruments | Model 1772-F | If not using an injection pump. |
| Sutures (5-0 monofilament) | Ethicon | MCP463G | Monocryl violet monofilament with reverse cutting tip |
| Syringe, 28 G (0.5 mL) | BD | BD 329461 | BD Lo-Dose U-100 Insulin Syringes |
| TC20 Automated Cell Counter | BIO-RAD | 1450102 | |
| Thermocouple probe, fine diameter (Type K) | Omega | TJM-CA316-IM025G-150 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco, ThermoFisher Scientific | 25200072 | |
| Vetbond by 3M, veterinary tissue glue | WDDC | 126125 | |
| Wahl Peanut Clippers | WDDC/Wahl | 100963 | Also available directly from manufacturer. |
| Warming pad | Bensen Medical | 70308/121873 | Any similar item can be used. |
| Webcol Alcohol preps | Electron Microscopy Sciences | 71005-20 | Alcohol prep wipe, 2-ply, medium size. |
References
- Canadian Cancer Society. . Cancer Statistics 2023. , (2023).
- . Glioblastoma Research Organization Available from: https://www.gbmresearch.org (2024)
- Carpentier, A., et al. Laser thermal therapy: Real-time MRI-guided and computer-controlled procedures for metastatic brain tumors. Lasers Surg Med. 43 (10), 943-950 (2011).
- Haddad, A. F., et al. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv. 3 (1), vdab100 (2021).
- Chokshi, C. R., Savage, N., Venugopal, C., Singh, S. K. A patient-derived xenograft model of glioblastoma. STAR Protoc. 1 (3), 100179 (2020).
- Alcaniz, J., et al. Clinically relevant glioblastoma patient-derived xenograft models to guide drug development and identify molecular signatures. Front Oncol. 13, 1129627 (2023).
- Muir, M., et al. Laser interstitial thermal therapy for newly diagnosed glioblastoma. Lasers Med Sci. 37 (3), 1811-1820 (2022).
- Muir, M., Traylor, J. I., Gadot, R., Patel, R., Prabhu, S. S. Repeat laser interstitial thermal therapy for recurrent primary and metastatic intracranial tumors. Surg Neurol Int. 13, 311 (2022).
- De Groot, J. F., et al. Efficacy of laser interstitial thermal therapy (LITT) for newly diagnosed and recurrent IDH wild-type glioblastoma. Neurooncol Adv. 4 (1), vdac040 (2022).
- Holste, K. G., Orringer, D. A. Laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdz035 (2020).
- Leuthardt, E. C., Voigt, J., Kim, A. H., Sylvester, P. A single-center cost analysis of treating primary and metastatic brain cancers with either brain laser interstitial thermal therapy (LITT) or craniotomy. Pharmacoecon Open. 1 (1), 53-63 (2017).
- Bastos, D. C. D. A., et al. Predictors of local control of brain metastasis treated with laser interstitial thermal therapy. Neurosurgery. 87 (1), 112-122 (2020).
- Darbinyan, A., Leelatian, N., Fomchenko, E. I. Histological changes associated with laser interstitial thermal therapy for radiation necrosis: illustrative cases. J Neurosurg Case Lessons. 4 (1), CASE21373 (2022).
- Grant, G. A., Porter, B. E., Li, D., Barros Guinle, M. I., Kaur, H. Approach, complications, and outcomes for 37 consecutive pediatric patients undergoing laser ablation for medically refractory epilepsy at Stanford Children's Health. J Neurosurg Pediatr. 33 (1), 1-11 (2023).
- Ogasawara, C., et al. Laser interstitial thermal therapy for cerebral cavernous malformations: A systematic review of indications, safety, and outcomes. World Neurosurg. 166, 279-287.e1 (2022).
- Satzer, D., Mahavadi, A., Lacy, M., Grant, J. E., Warnke, P. Interstitial laser anterior capsulotomy for obsessive-compulsive disorder: lesion size and tractography correlate with outcome. J Neurol Neurosurg Psychiatry. 93 (3), 317-323 (2022).
- Salehi, A., et al. Therapeutic enhancement of blood-brain and blood-tumor barriers permeability by laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdaa071 (2020).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved