このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
神経膠芽腫のレーザー間質性温熱療法のための免疫適格マウスモデル
* これらの著者は同等に貢献しました
要約
膠芽腫は壊滅的な原発性脳腫瘍であり、レーザー間質温熱療法は、手術不能な膠芽腫に対する従来の外科的切除に代わる有望な治療法として浮上しています。このプロトコルは、治療効果またはアジュバントおよび組み合わせ治療の研究に使用できる最適化された前臨床マウスモデルについて説明しています。
要約
膠芽腫(GB)は、原発性脳腫瘍の中で最も侵攻性の高い形態であり、成人の高悪性度原発性脳腫瘍全体の約半数を占めており、治療法はありません。レーザー間質性温熱療法 (LITT) は、食品医薬品局 (FDA) が承認した GB の治療薬であり、従来の外科的切除の候補とならない可能性のある患者に使用されます。LITTの臨床効果は確立されていますが、臨床ケーススタディやケースシリーズを超えた研究は限られており、確立された動物モデルがないために妨げられています。このプロトコルは、C57BL/6マウスおよび同系CT2A神経膠腫癌細胞株を使用してヒトGBを密接に再現すると同時に、1064nmネオジムドープイットリウムアルミニウムガーネット(Nd:YAG)レーザーを使用します FDA承認の2つのLITTシステムのいずれかで使用されているような、優れた前臨床関連性を提供します。このLITTマウスモデルの確立が成功すれば、LITTアブレーションのユニークな特徴と腫瘍微小環境への影響を調査するための貴重なプラットフォームが提供され、治療戦略の改善につながる可能性があります。
概要
がんは、カナダで死因の第1位です。膠芽腫(GB)は、侵攻性脳腫瘍の最も一般的な形態であり、成人の高悪性度原発性脳腫瘍全体の48%から60%を占めています1。GBの予後は特に厳しく、外科的切除、化学療法、放射線療法などの従来の治療法による5年正味生存率は4.8%です1,2。
レーザー間質温熱療法(LITT)は、手術不能な脳腫瘍患者における温熱in-situ腫瘍アブレーションにレーザーを使用するFDA承認の手技であり、従来の外科的切除に代わる魅力的な治療法を提供します3。しかし、GBのLITT治療のための詳細で十分に特徴付けられたマウスモデルが不足しており、前臨床研究の妨げとなっています。
このプロトコルは、LITTによるGB治療のための最適化された前臨床マウスモデルを紹介することを目的としています。このモデルには、C57BL/6マウスと同系神経膠腫細胞株CT2Aを使用することを選択しました。これは主に、CT2Aが、同様の組織学的特徴、浸潤性、化学療法および放射線耐性、および自己複製および腫瘍の再確立を伴う幹様の特徴を持つヒトの高悪性度GBを密接に再現するためです4。これらの特性は、免疫応答や新しい治療戦略を含むさまざまな研究のための優れたプラットフォームを提供します。さらに、このLITTプロトコルの技術的側面は、他の同種および異種移植マウスモデルにも容易に適応できます4,5,6、これについてはさらに説明します。
このプロトコルの利点には、シンプルでありながら効果的なLITT治療パラダイムによる一貫した結果が含まれます。採用されている1064nmネオジムドープイットリウムアルミニウムガーネット(Nd:YAG)レーザーは、現在FDAが承認した2つのシステムのうちの1つで臨床的に使用されているものと同じであり、高悪性度神経膠腫の治療のためのLITTの臨床応用と密接に並行する実験を可能にします。このプロトコルの主な欠点は、再現性のある結果を達成するために、腫瘍細胞移植とLITT治療の両方で細心の注意を払わなければならないことです。さらに、CT2A細胞株の攻撃的な性質により、このプロトコルは時間に非常に敏感です。ほとんどの実験は最大20日間で終了する必要があり、これにより、一部の適応免疫応答やその他の細胞および分子メカニズムの調査が長期間にわたって行われる可能性があります。
プロトコル
このプロトコルの動物倫理は、カナダ動物管理評議会(CCAC)によって設定された倫理ガイドラインに従って、マニトバ大学の動物管理委員会によって承認されました。このプロトコルでは、8-12週齢のC57BL/6免疫担当マウスと同系神経膠腫細胞株CT2Aを前臨床モデルに使用し、組織学的解析、免疫学的変化、または組み合わせ治療介入に焦点を当てた実験を含む幅広いアプリケーションを提供しました。このプロトコールは、実験要件に基づいて、他のマウス種や細胞株に容易に適応させることができます。
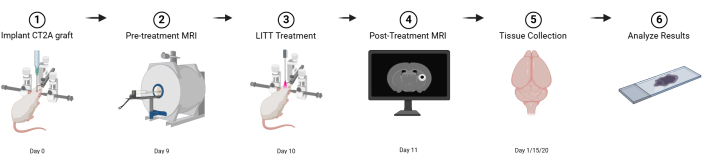
図1:基本的な実験デザインの図式図。 BioRender.com で作成 この図の拡大版を表示するには、ここをクリックしてください。
1. 細胞調製の概要 (0日目)
- 細胞培養を開始する前に、キャビネットと必要なすべてのピペットがUVとエタノールで完全に滅菌されていることを確認してください。
- 10% FBS培地、リン酸緩衝生理食塩水(PBS)、およびトリプシンでDMEM/F12をウォーターバスを使用して室温(RT)まで温めます。
- T25フラスコから培地をピペットで取り出し、PBSで細胞を短時間すすぎます。1 mLのトリプシンを細胞に加え、細胞がフラスコから剥離するまで30〜60秒間インキュベートします。
- 分離した細胞を光学顕微鏡で確認し、4mLの培地を加えてトリプシン酵素活性を停止します。
- 自動セルカウンターを使用して細胞をカウントします。
- 10 μLの細胞懸濁液と10 μLのトリパンブルーを混合し、10 μLを細胞計数スライドに加えます。
- スライドをセルカウンティングマシンに挿入し、総セル数、生細胞数、および生細胞の割合を記録します。
注:自動細胞計数機が利用できない場合は、血球計算盤を使用して手動カウントを行うことができます。
- 計画されたすべての注入に必要な細胞を計算します。
注:CT2Aの場合、注入量1.5μLあたり5000細胞、各調製物の合計容量は最低100μLが推奨されます。 - 細胞を134 x g で5分間回転させて、細胞をペレット化し、できるだけ多くの培地を吸引します。
- 細胞ペレットをPBS中の5%基底膜抽出物で、微量遠心チューブ内で必要な量だけ再懸濁します。細胞懸濁液の調製には小さなチューブが最適ですが、細胞がより丸みを帯びた底に凝集する可能性が低く、穏やかなフリックで容易に再分配されるため、手術中の保存には2mLのチューブの方が適しています。
- 注射のために細胞を氷上に保ち、必要に応じて4〜5時間ごとに新鮮な細胞懸濁液を調製します。
2. 同所性移植(0日目)
- 手術エリアを準備し、必要なすべての器具が滅菌済みですぐに使用できる状態であることを確認してください。
- イソフルラン(1 L/min O2で3%気化)をチャンバー内で使用してマウスに麻酔をかけ、呼吸数(目標60 bpm)を監視します。
- 投薬のために動物の体重を取得して記録します。
- 目、耳、ひげを避けるために、手術部位を慎重に剃ります。
- 動物を定位フレームに移します。
- バイトバーの穴に切歯を置き、ノーズコーンをぴったりと収まるまで調整し、固定ネジを締めて固定します。
- 両側の後肢のつま先をつまんで麻酔の深さを確認し、必要に応じて、耳ピンを使用して頭蓋骨を固定し、動物の頭を中立の水平面位置に調整します。
- 潤滑された直腸温プローブを使用して動物のコア温度を監視し、体内加熱パッドを使用して37°Cで補助的な加温を提供します。
注意: 鼻骨に適度な圧力がかかると呼吸停止を引き起こす可能性があるため、ノーズコーンを締めすぎないように注意してください。電気加熱パッド(テラリウムの加熱パッドなど)を使用する場合は、温度設定が正確であり、設定温度が一定に保たれていることを確認してください。
- 眼科用軟膏を両目にたっぷりと塗り、乾燥を防ぎます。
- 予防的注射を投与し、麻酔薬の深さを確認します。
- 28 G x 1/2 インチの注射器を使用して、地元の動物施設のガイドラインに従って、皮下(SC)メロキシカムまたはその他の長時間作用型鎮痛薬を注射します(例:.、5.0 mg / kgメロキシカム)。
- 20 mg / kg s.c.の注射を投与します 予熱した生理食塩水 長期の処置中の予防的液体サポートのために。
- 麻酔薬を1.5%〜2.0%のイソフルランに減らして、目標呼吸数を維持します。
- 無菌技術を使用して、動物をドレープし、手術領域を準備します。
- 滅菌綿棒を使用して、ポビドンヨードまたはクロルヘキシジン消毒液を塗布します。切開部位から内側から開始し、各パス後に綿棒を回転させ、外側に向かって作業し、次に新鮮な滅菌綿棒を使用して、同様の方法で70%エタノールを部位に塗布します。
- ヨウ素でスクラブを繰り返し、続いて70%エタノールをさらに2回(各合計3回)繰り返します。
- 外科的曝露を進める前に、麻酔薬の深さを再確認してください。手順全体を通して呼吸数を注意深く監視し、必要に応じて麻酔薬を調整します。
- 正中線から始まり、目の少し後方で、#1.5ブレードメスを使用して尾方向に1〜15cmの中央矢状切開を行います。または、虹彩はさみで短いメスの切開を延長します。
注:切開は正中線から開始する必要がありますが、片側注射の場合、Bregmaとバリ穴の位置の同時可視化とアクセスを容易にするために、わずかに横方向に角度を付けることができます。 - 滅菌綿棒を使用して、傷口を反射して頭蓋骨を視覚化し、その領域から結合組織をそっとこすり落とします。
- 必要に応じて、過酸化水素に浸した滅菌綿棒を使用して頭蓋骨の表面を洗浄し、頭蓋縫合を視覚化します。
- 左右の冠状縫合糸が矢状縫合糸の正中線で交わる場所にBregmaを配置します( 図2を参照)。
- 無毒の着色アクリル樹脂と滅菌済みの木製のつまようじなどを使用して、Bregmaに非常に小さな印を付けます。
注:場合によっては、左右の冠状縫合糸が互いに鏡像化されていません。このような場合は、「最適線」を使用して、矢状面の中央に沿って交差する場所を概算します。
- 無毒の着色アクリル樹脂と滅菌済みの木製のつまようじなどを使用して、Bregmaに非常に小さな印を付けます。
- 動物の頭の位置が傾いたり回転したりしていないことを確認してください(つまり、平らな平面上)。
- Bregmaのゼロ定位座標。x座標は、内側-外側(ML)平面内の動き、y座標は前後(AP)平面、および背腹側(DV)平面内のz座標を指します。
- LambdaがBregmaと同じDV平面にあることを確認します(つまり、両方のランドマークでz = 0)。同様に、ブレグマの外側の +2.0 mm (x = 2) と -2.0 mm (x = -2.0) で、頭蓋骨が同じ平面にあり、DV/Z 座標がほぼ等しいことを確認します。頭蓋骨がしっかりと固定され、調整後に動かないことを確認してください。
- Bregmaの+2.0 mm(ML)および+0.5 mm(AP)にバリ穴を開けます(図3)。
- 定位ドリルアタッチメントを使用して、ビットの先端を慎重に下げて、ブレグマに接触し、座標をゼロにします。
- ビットを少し上げて、ドリルを適切なAP座標とML座標に調整します。
- ドリルをゆっくりと下げ、頭蓋骨を通してのみバリが発生するように注意します。
- あるいは、定位フレームにマイクロリットルの注射器を使用して、針先がBregmaに接触するまで針先を下げ、座標をゼロにします。
- 針を少し上げて、適切なAP座標とML座標に調整します。
- 先端が頭蓋骨に触れるまで下げ、正確な位置をメモします。
- 針を少し上げ、手術マーカーで目的の場所に小さな印を付けます。
- ニードルキャリアを邪魔にならないように持ち上げるか回転させ、ハンドドリルを使用して頭蓋骨をバリで切り裂き、下の脳に損傷を与えないように注意してください。注意:一般的に、高齢の雄マウスは頭蓋骨が比較的厚く、より広範な穴あけが必要です。手作業による穴あけは、頭蓋骨を突然突破すると下にある髄膜や脳が損傷するため、最小限の圧力で慎重に行う必要があります。
注:LITT手順中に熱電対プローブを収容するには、バリ穴の延長が必要です。これは、最初の注射手術中により簡単に行うことができ、より迅速で合理化されたLITT手術を容易にします。あるいは、LITT手術中に同じ方法でバリ穴を延長することもでき、これにより頭蓋外腫瘍の成長リスクを減らすことができます。
- 熱電対用に、+3.0 mm MLおよび+0.5 mm AP(注入部位から横方向1.0 mm)に2つ目のバリホールを作成します。
- 前の手順で説明した穴あけ手順に従います。
- 骨の再成長に関連する問題を避けるために、2つの穴の間の骨を取り除きます。
注:腫瘍移植の座標として、Bregmaの+2.0 mm ML、+0.5 mm AP、および-2.5 mm DVを使用することをお勧めします。上部線条体のこの位置は、動物によって十分に許容される一貫した腫瘍成長をもたらしますが、プロトコルは他の場所に適応させることができます。
- CT2Aマウス神経膠腫細胞懸濁液をマイクロリットルシリンジ(1.5 μL中5000細胞)で調製します。
- あらかじめ準備した細胞のマイクロ遠心チューブを氷から取り出し、指先で軽くフリックして再懸濁します。
- 2 μLを5 μLまたは10 μLのシリンジに静かに引き込み、気泡を避けます。
- 0.5 μLで空気を取り除き、針が下塗りされ、正しく機能していることを確認します。
- アルコール綿棒で針軸を拭いて、発現した液体と外面の細胞(軟髄膜腫瘍の成長を引き起こす可能性があります)を取り除きます。.
- シリンジをマイクロインジェクターシリンジポンプ(または手動定位固定)にロードし、針をゆっくりと下げます。
- 針をゆっくりと深さ(z = -3.0 mm)まで下げ、1分間一時停止します。
- 針を0.5mm(z = -2.50 mm)ゆっくりと引っ込め、細胞を注入します(≤0.5μL / min)。注射器の周囲をマイクロサージェクティブスポンジスピアを使用して乾いた状態に保ち、針を乱さないように注意してください。
- 注射が完了してから最低2分待ってから、3〜4分かけてシリンジをゆっくりと引っ込めます。.最初の4〜5回の収縮間隔が収縮ごとに100μmであることを確認して、細胞が元の注入部位から外れるのを防ぎます。
- アルコール綿棒を使用して、針の外側を血液や液体が付着しないように優しく拭き、製造元のガイドラインに従ってシリンジを洗い流して清掃します。注射の合間にPBSと蒸留水を使用して、針が詰まらないようにします。注射が完了したら、針を70%エタノールでたっぷりと洗い流し、針から残っている細胞を取り除きます。
注意:各注射後に針を洗い流さないと、詰まりを引き起こす可能性があります。複数の細胞タイプを注入する場合は、クロスコンタミネーションを避けるために、タイプごとに別々の針を使用してください。
- 切開部を再近似し、傷口の縁を少し曲げて、下にある真皮が接触するように注意します。創傷クリップまたは5-0縫合糸で3針の中断されたステッチを使用して傷を閉じます。閉じた創にポビドンヨード溶液を塗布します。
- 定位フレームから動物を取り外し、37°Cに設定された保温パッドの上の紙で裏打ちされた回復ケージに入れます。 ケージの床にあるウェットチャウの小皿を使用して、動物を自宅のケージに戻す前に、胸骨の横臥が得られることを確認してください。
- 手術の日から次の2日間、少なくとも1日2回動物を監視します。24時間後、48時間後、および72時間後、または機関のガイドラインに従って、メロキシカムを読んでください。

図2:マウスの頭蓋骨のグラフィックイラストと定位手術のための重要な解剖学的ランドマーク。 BioRender.com で作成 この図の拡大版を表示するには、ここをクリックしてください。
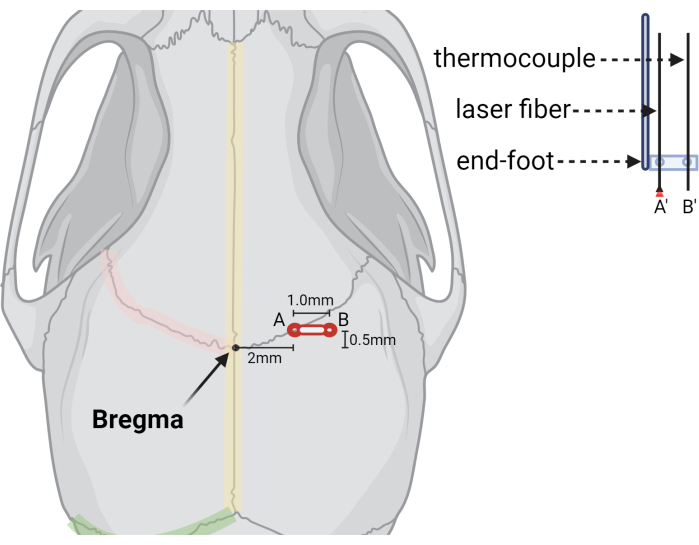
図3:バリ穴とレーザー装置の位置を示す図解。 Bregmaランドマークの相対位置を示す図、(A)レーザーファイバーの最初のバリ穴、および(B)(B')熱電対プローブの2番目または拡張されたバリ穴。レーザーファイバーと熱電対プローブの切り抜きを右側に示し、プローブが所定のサイズと間隔で事前に穴が開けられた定位端フットでプローブがどのように安定するかを示しています。BioRender.com で作成 この図の拡大版を表示するには、ここをクリックしてください。
3. LITT前の腫瘍量のモニタリング(9日目)
- 機関のガイドラインに従って T2 強調磁気共鳴画像法 (MRI) を実施して、LITT の前日に腫瘍の成長を評価します。
注:腫瘍の直径は~1.5〜2.0mmである必要があります。- 次のパラメータを使用して、マウス脳全体の適切な冠状スキャンを取得します:高速スピンエコーシーケンス、TR = 5000 ms、TE = 45 ms、エコートレイン= 7、FOV = 30 x 30 mm2、マトリックスサイズ= 250 x 256、合計スライス= 18、スライス厚さ= 0.3 mm、平均= 2。
注:また、移植後約6日目から定期的なMRIを実施して、同種移植の成功を確認し、特に初期実験中に腫瘍の成長を監視することをお勧めします。CT2Aは非常に攻撃的であり、動物を注意深く監視する必要があります。T2強調コロナルスキャンは、この目的に適しています。蛍光標識またはルシフェリン標識CT2A細胞を in vivo イメージングシステム(IVIS)と組み合わせて使用することも、小動物MRIにアクセスできない場合に適している場合があります。ただし、成長速度論およびその他の腫瘍特性は、このプロトコルとは異なります。
- 次のパラメータを使用して、マウス脳全体の適切な冠状スキャンを取得します:高速スピンエコーシーケンス、TR = 5000 ms、TE = 45 ms、エコートレイン= 7、FOV = 30 x 30 mm2、マトリックスサイズ= 250 x 256、合計スライス= 18、スライス厚さ= 0.3 mm、平均= 2。
4. LITT手術(10日目)
- 上記のセクション2と同様に、手順2.1〜2.13を繰り返して、動物をLITTに備えます。
注: 以前の手術による創傷治癒は、実験タイムラインの種や変動に基づいて、さまざまな段階にある場合があります。切開をやり直すときは、組織が薄くなったりデリケートになったりすることに注意してください。 - 滅菌綿の綿棒を使用して、頭蓋骨を優しく洗浄し、ブレグマや以前にできたバリ穴を覆い隠している組織を取り除きます。必要に応じて、バリ穴を再ドリルしますが、CT2A腫瘍形成の速度により、骨の再成長はほとんど期待できません。
- LITTアタッチメントを定位フレームに配置した状態で、レーザーファイバーの先端のBregmaで座標をゼロにします。
注意: レーザーファイバーは非常に壊れやすく、曲げるとひびが入ります。レーザーファイバーの先端が頭蓋骨に接触したらすぐに停止するように注意してください。 - 先端を少し上げて目的のML座標とAP座標に移動し、プローブをゆっくりとターゲットDV座標まで下げてターゲット(2.0 mm ML、0.5 mm AP、-2.0 mm DV)に到達します。
- LITT治療パラメータを設定します: モード:連続;パワー:1 W
- レーザーをスタンバイからアクティブに切り替え、フットペダルを使用してレーザーを60秒間作動させます。温度が46°Cを超えて上昇した場合は、少し一時停止してから再度作動し、温度をできるだけ46°Cに近づけようとします。
- レーザーアセンブリをゆっくりと引っ込め、レーザーファイバーと熱電対をアルコール綿棒でそっと拭きます。プローブがフレームに接触しないように注意しながら、アセンブリを邪魔にならないように回転させます。
- 上記の腫瘍移植後のステップ2.18-2.20で説明したように、創傷を閉じて動物を回復させます。
5. LITT後の評価(11日目)
- LITT 治療の翌日に LITT 後の T2 強調 MRI を実施して、上記のステップ 3.1 のシーケンスとパラメーターを使用して LITT 腫瘍アブレーションの成功を評価します。
注:さらに、流体減衰反転回復(FLAIR)シーケンスも、術後の浮腫の評価に役立つ場合があります。 - 研究終了前にフォローアップスキャンを実施して、治療後の変化または腫瘍の再増殖を監視します。
6. 学習終了(11日目/15日目/20日目)
- 機関のガイドラインに従って、選択した実験エンドポイントで動物を安楽死させます。
注: 20 日目より後のエンドポイントは、対照動物 (つまり、偽手術または無治療) および一部の治療群動物が瀕死状態にあり、安楽死を必要とする可能性があるため、細胞数が非常に少ない接種であっても、CT2A では実行できません。より長い実験では、代替のマウス神経膠腫細胞モデルを検討してください。 - 固定と処理のために組織を採取します。
- 4%パラホルムアルデヒド(PFA)で心臓灌流を行い、目的の組織を採取します。
- 4% PFA に 4 °C で一晩浸漬することにより、脳組織を後固定します。
- ホルマリン固定パラフィン包埋(FFPE)分析または固定凍結分析の標準的な方法を使用してサンプルを処理します。
7. 分析
- T2 強調 MRI を使用して LITT アブレーションの成功を確認し、ヘマトキシリンやエオシン染色などの基本的な組織学的手法を使用して検証します。
- 実験に必要な追加の分析(免疫組織化学、免疫蛍光など)を実行します。
結果
CT2A腫瘍移植とLITT治療の成功は、図4、 図5、 および図6に示すように、T2強調MRIを使用して特徴付けることができます。MR画像は、上記のプロトコルで概説されたシーケンスパラメータを使用して、17cmボアと直交マウスヘッドコイルを備えた7T無冷媒超伝導磁石を使用して取得されました?...
ディスカッション
LITTに関する文献は急速に拡大しています。ただし、主にヒトの臨床ケーススタディまたはケースシリーズに限定されています。実際、LITTにはいくつかの潜在的な利点が示されており、これには、術後合併症の発生率と費用が低いこと、および同等の無増悪生存期間が得られることが含まれます7,8,9,10,11。
開示事項
この度は、モンテリスメディカルからのレーザー機器の現物寄付を含むご支援をいただき、感謝しております。
謝辞
このプロジェクトの資金源には、カナダ自然科学工学評議会(NSERC)-Alliance、Mitacs-Accelerate、Research Manitoba-IPOC、Canadian Institutes for Health Research(CIHR)CGS-M、およびマニトバ大学大学院フェローシップが含まれます。ノースカロライナ州ダーラムのデューク大学のPeter Fecci博士から寛大に寄贈されたCT2A神経膠腫細胞株。また、このプロジェクトに対する優れた技術支援を提供してくださったマニトバ大学のHistology Service LabとSmall Animal and Material Imaging Core施設にも感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Absorbion Spears | FST | 18105-01 | Hemostatic sponges. |
| Adson tissue forceps | FST | 11006-12 | |
| C57BL/6 mice | Jackson Laboratories | Strain #000664 | 6 to 12 week old male and female |
| Cotton Tipped Applicators (6") | Electron Microscopy Sciences | 72308 | |
| CT2A glioma cell line | Generously donated from Dr. Peter Fecci, Duke University. | ||
| Cultrex Reduced Growth Factor Basement Membrane Extract, PathClear | Biotechne, R&D systems | 3433-010-01 | |
| DMEM/F-12, HEPES | Gibco, ThermoFisher Scientific | 11330032 | |
| Dual-chamber slides | BIO-RAD | 1450003 | |
| Eppendorf Safe-Lock Tubes 2.0 mL | Eppendorf | 22363352 | |
| Ethyl Alcohol Anhydrous | Greenfield Global | P016EAAN | Dilute to 70% with ddH2O |
| Fetal Bovine Serum, qualified, Canada | Gibco, ThermoFisher Scientific | 12483020 | |
| Glad Press-n-Seal plastic wrap | Amazon.ca | 12587704417 | |
| High speed drill | Kopf Instruments | Model 1474 | |
| K & J Thermocouple temerpature meter | Omega | HH509R | |
| Metacam (meloxicam) | WDDC | 114424 | |
| Microinjection syringe pump | WPI | UMP3T-1 | |
| Microliter syringe (700 Series) | Hamilton | 87908 | Custom needles are available. A steep needle bevel helps with precise delivery, and a shorter needle length helps with stability. |
| Needle driver/Needle Holder | FST | 12500-12 | A fine tip is most suitable due to the confined working space, but many styles are suitable based on handle preference. |
| Opixcare Plus opthalmic ointment | WDDC | 135941 | |
| Phosphate Buffered Saline (10x) | Fisher bioreagents | BP399-4 | Dilute to 1x with ddH2O |
| Povidone-iodine | ThermoFisher Scientific | 3955-16 | Aliquat into into smaller tubes for use with cotton tipped applicators. |
| Saline (normal) | WDDC | 126588 | |
| Scalpel, single use (#15 Blade) | Feather | Feather NO15 | |
| Scissors, fine surgical | FST | 91460-11 | Fine student scissors, Iris, or Bonn are all suitable. |
| Stereotactic frame | Kopf Instruments | Model 940 | With digital display console and mouse nose-cone and ear-bars. |
| Stereotactic syringe holder | Kopf Instruments | Model 1772-F | If not using an injection pump. |
| Sutures (5-0 monofilament) | Ethicon | MCP463G | Monocryl violet monofilament with reverse cutting tip |
| Syringe, 28 G (0.5 mL) | BD | BD 329461 | BD Lo-Dose U-100 Insulin Syringes |
| TC20 Automated Cell Counter | BIO-RAD | 1450102 | |
| Thermocouple probe, fine diameter (Type K) | Omega | TJM-CA316-IM025G-150 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco, ThermoFisher Scientific | 25200072 | |
| Vetbond by 3M, veterinary tissue glue | WDDC | 126125 | |
| Wahl Peanut Clippers | WDDC/Wahl | 100963 | Also available directly from manufacturer. |
| Warming pad | Bensen Medical | 70308/121873 | Any similar item can be used. |
| Webcol Alcohol preps | Electron Microscopy Sciences | 71005-20 | Alcohol prep wipe, 2-ply, medium size. |
参考文献
- Canadian Cancer Society. . Cancer Statistics 2023. , (2023).
- . Glioblastoma Research Organization Available from: https://www.gbmresearch.org (2024)
- Carpentier, A., et al. Laser thermal therapy: Real-time MRI-guided and computer-controlled procedures for metastatic brain tumors. Lasers Surg Med. 43 (10), 943-950 (2011).
- Haddad, A. F., et al. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv. 3 (1), vdab100 (2021).
- Chokshi, C. R., Savage, N., Venugopal, C., Singh, S. K. A patient-derived xenograft model of glioblastoma. STAR Protoc. 1 (3), 100179 (2020).
- Alcaniz, J., et al. Clinically relevant glioblastoma patient-derived xenograft models to guide drug development and identify molecular signatures. Front Oncol. 13, 1129627 (2023).
- Muir, M., et al. Laser interstitial thermal therapy for newly diagnosed glioblastoma. Lasers Med Sci. 37 (3), 1811-1820 (2022).
- Muir, M., Traylor, J. I., Gadot, R., Patel, R., Prabhu, S. S. Repeat laser interstitial thermal therapy for recurrent primary and metastatic intracranial tumors. Surg Neurol Int. 13, 311 (2022).
- De Groot, J. F., et al. Efficacy of laser interstitial thermal therapy (LITT) for newly diagnosed and recurrent IDH wild-type glioblastoma. Neurooncol Adv. 4 (1), vdac040 (2022).
- Holste, K. G., Orringer, D. A. Laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdz035 (2020).
- Leuthardt, E. C., Voigt, J., Kim, A. H., Sylvester, P. A single-center cost analysis of treating primary and metastatic brain cancers with either brain laser interstitial thermal therapy (LITT) or craniotomy. Pharmacoecon Open. 1 (1), 53-63 (2017).
- Bastos, D. C. D. A., et al. Predictors of local control of brain metastasis treated with laser interstitial thermal therapy. Neurosurgery. 87 (1), 112-122 (2020).
- Darbinyan, A., Leelatian, N., Fomchenko, E. I. Histological changes associated with laser interstitial thermal therapy for radiation necrosis: illustrative cases. J Neurosurg Case Lessons. 4 (1), CASE21373 (2022).
- Grant, G. A., Porter, B. E., Li, D., Barros Guinle, M. I., Kaur, H. Approach, complications, and outcomes for 37 consecutive pediatric patients undergoing laser ablation for medically refractory epilepsy at Stanford Children's Health. J Neurosurg Pediatr. 33 (1), 1-11 (2023).
- Ogasawara, C., et al. Laser interstitial thermal therapy for cerebral cavernous malformations: A systematic review of indications, safety, and outcomes. World Neurosurg. 166, 279-287.e1 (2022).
- Satzer, D., Mahavadi, A., Lacy, M., Grant, J. E., Warnke, P. Interstitial laser anterior capsulotomy for obsessive-compulsive disorder: lesion size and tractography correlate with outcome. J Neurol Neurosurg Psychiatry. 93 (3), 317-323 (2022).
- Salehi, A., et al. Therapeutic enhancement of blood-brain and blood-tumor barriers permeability by laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdaa071 (2020).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved