需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于胶质母细胞瘤激光间质热疗的免疫活性小鼠模型
* 这些作者具有相同的贡献
摘要
胶质母细胞瘤是原发性脑癌的一种破坏性形式,激光间质热疗正在成为无法手术的胶质母细胞瘤常规手术切除的有前途的替代方案。该方案描述了一种优化的临床前小鼠模型,可用于研究治疗效果或辅助和组合治疗。
摘要
胶质母细胞瘤 (GB) 是最具侵袭性的原发性脑癌,约占成人所有高级别原发性脑肿瘤的一半,并且无法治愈。激光间质热疗 (LITT) 是美国食品药品监督管理局 (FDA) 批准的 GB 治疗方法,用于可能不适合常规手术切除的患者。虽然 LITT 的临床疗效已经确定,但临床案例研究和病例系列之外的研究是有限的,并且由于缺乏已建立的动物模型而受到阻碍。该方案使用 C57BL/6 小鼠和同基因 CT2A 神经胶质瘤癌细胞系来紧密概括人类 GB,同时还使用 1064 nm 掺钕钇铝石榴石 (Nd:YAG) 激光器,例如用于两个 FDA 批准的 LITT 系统之一,提供出色的临床前相关性。这种 LITT 小鼠模型的成功建立将为研究 LITT 消融的独特特征及其对肿瘤微环境的影响提供一个有价值的平台,从而有可能改进治疗策略。
引言
癌症是加拿大的第一大死亡原因。胶质母细胞瘤 (GB) 是最常见的侵袭性脑肿瘤形式,占成人所有高级别原发性脑肿瘤的 48% 至 60%1。GB 的预后尤其严峻,常规治疗(包括手术切除、化疗和放疗)的 5 年净生存率为 4.8% 1,2。
激光间质热疗 (LITT) 是 FDA 批准的一种手术,使用激光对无法手术的脑肿瘤患者进行热疗原位肿瘤消融术,为传统手术切除提供了一种有吸引力的治疗替代方案3。然而,缺乏用于 LITT 治疗 GB 的详细且特征明确的小鼠模型,阻碍了临床前研究。
该协议旨在展示用于 LITT 治疗 GB 的优化临床前小鼠模型。我们选择使用 C57BL/6 小鼠和同基因神经胶质瘤细胞系 CT2A 进行该模型,主要是因为 CT2A 与具有相似组织学特征、侵袭性、化疗和放射耐药性以及干细胞样特征的人类高级别 GB 紧密结合,具有肿瘤的自我更新和重建4。这些特性为涉及免疫反应或新型治疗策略的各种研究提供了极好的平台。此外,该 LITT 协议的技术方面也很容易适用于其他同种异体和异种移植小鼠模型 4,5,6,这将进一步讨论。
该方案的优点包括通过简单而有效的 LITT 治疗范式获得一致的结果。采用的 1064 nm 掺钇铝石榴石 (Nd:YAG) 激光器与目前 FDA 批准的两个系统之一的临床使用相同,允许与 LITT 治疗高级别胶质瘤的临床应用密切相关的实验。该方案的主要缺点是在肿瘤细胞植入和 LITT 治疗期间必须极其小心才能获得可重复的结果。此外,由于 CT2A 细胞系的侵袭性,该方案对时间高度敏感。大多数实验需要在最多 20 天内结束,这可能会限制对某些适应性免疫反应或在较长时间内发生的其他细胞和分子机制的研究。
研究方案
该协议的动物伦理由曼尼托巴大学动物护理委员会根据加拿大动物护理委员会 (CCAC) 制定的道德准则批准。该方案使用 8-12 周龄的 C57BL/6 免疫功能正常的小鼠和同基因神经胶质瘤细胞系 CT2A 作为临床前模型,具有广泛的应用,包括专注于组织学分析、免疫学变化或组合治疗干预的实验。该方案可以根据实验要求轻松适应其他小鼠物种或细胞系。
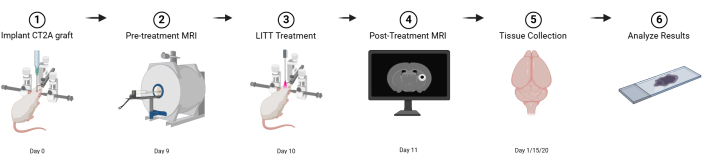
图 1:基本实验设计的图形示意图。 使用 BioRender.com 创建 请单击此处查看此图的较大版本。
1. 细胞制备简介 (Day 0)
- 在开始细胞培养之前,请确保柜子和所有必需的移液器都用紫外线和乙醇完全消毒。
- 使用水浴将含有 10% FBS 培养基、磷酸盐缓冲盐水 (PBS) 和胰蛋白酶的 DMEM/F12 加热至室温 (RT)。
- 从 T25 培养瓶中吸出培养基,并用 PBS 短暂冲洗细胞。向细胞中加入 1 mL 胰蛋白酶,孵育 30-60 秒,直到细胞从培养瓶中分离。
- 在光学显微镜下确认分离的细胞,并加入 4 mL 培养基以终止胰蛋白酶酶活性。
- 使用自动细胞计数仪对细胞进行计数。
- 将 10 μL 细胞悬液与 10 μL 台盼蓝混合,然后向细胞计数玻片中加入 10 μL。
- 将玻片插入细胞计数机中,记录总细胞计数、活细胞计数和活细胞百分比。
注:如果没有自动细胞计数机,可以使用血球计数器进行手动计数。
- 计算所有计划注射所需的细胞。
注:对于 CT2A,建议每 1.5 μL 注射体积 5000 个细胞,每次制备至少为 100 μL 总体积。 - 将细胞以 134 x g 旋转 5 分钟以沉淀细胞并吸出尽可能多的培养基。
- 用 PBS 中的 5% 基底膜提取物重悬细胞沉淀,以达到微量离心管中所需的体积。虽然较小的试管最适合制备细胞悬液,但 2 mL 试管更适合在手术期间储存,因为细胞不太可能聚集到更圆的底部,并且很容易通过轻轻轻弹重新分布。
- 将细胞保存在冰上注射,根据需要每 4-5 小时制备一次新鲜细胞悬液。
2. 原位植入(第 0 天)
- 准备手术区域,确保所有必需的器械都是无菌的,可以立即使用。
- 在腔室中使用异氟醚(在 1 L/min O2 中蒸发 3%)麻醉小鼠,同时监测呼吸率(目标 60 bpm)。
- 获取并记录动物体重以用于药物给药。
- 小心剃除手术区域,避免眼睛、耳朵和胡须。
- 将动物转移到立体定向框架上。
- 将门牙放入咬杆的孔中,调整鼻锥直至紧贴,拧紧固定螺钉以固定。
- 用双侧后肢脚趾捏检查麻醉深度,如果合适,使用耳针固定颅骨,并将动物的头部调整到中立的水平平面位置。
- 使用润滑的直肠温度探头监测动物核心温度,并使用体下加热垫在 37 °C 时提供补充加热。
注意: 注意不要将鼻锥拧得过紧,因为即使是对鼻骨的适度压力也可能导致呼吸停止。如果使用电加热垫(例如,玻璃容器的加热垫),请确保温度设置准确且设定温度保持恒定。
- 将眼药膏大量涂抹于双眼,以防止干燥。
- 进行预防性注射并检查麻醉深度。
- 根据当地动物设施指南(例如,5.0 mg/kg 美洛昔康),使用 28 G x 1/2“ 注射器注射皮下 (sc) 美洛昔康或其他长效止痛药。
- 在较长的手术过程中注射 20 mg/kg 皮下预热的生理盐水,以提供预防性液体支持。
- 将麻醉剂减少至 1.5%-2.0% 异氟醚以维持目标呼吸速率。
- 使用无菌技术,覆盖动物并准备手术区域。
- 使用无菌棉签,涂抹聚维酮碘或洗必泰消毒液。从切口部位内侧开始,每次通过后旋转拭子,向外工作,然后使用新鲜的无菌棉签,以类似的方式将 70% 乙醇涂抹在该部位。
- 用碘重复擦洗,然后用 70% 乙醇再擦洗两次(每次总共 3 次)。
- 在进行手术暴露之前,请重新检查麻醉深度。在整个手术过程中密切监测呼吸频率,并根据需要调整麻醉剂。
- 从中线开始,略微向后方靠近眼睛,使用 #1.5 刀片手术刀在尾部方向做一个 1-15 厘米的矢状中切口。或者,用虹膜剪刀延长一个短的手术刀切口。
注意:切口应从中线开始,但对于单侧注射,可以略微横向倾斜,以便于同时观察和进入前囟和钻孔位置。 - 使用无菌棉签反射伤口边缘以观察颅骨,并轻轻擦去该区域的任何结缔组织。
- 如果需要,使用浸泡在过氧化氢中的无菌棉签清洁颅骨表面并观察颅缝。
- 将左冠状线和右冠状缝线与矢状缝线在中线相交的位置找到前囟(见 图2)。
- 使用无毒的彩色丙烯酸树脂和无菌木制牙签或类似物,在 Bregma 上做一个非常小的标记。
注意:在某些情况下,左右冠状缝线彼此不镜像;在这种情况下,使用 'line-of-best-fit' 来估计它们应该沿着中矢状面相交的位置。
- 使用无毒的彩色丙烯酸树脂和无菌木制牙签或类似物,在 Bregma 上做一个非常小的标记。
- 确保动物的头部位置没有倾斜或旋转(即在平面上)。
- Bregma 的立体定向坐标为零。x 坐标是指内侧 (ML) 平面的运动,前后 (AP) 平面的 y 坐标,背腹 (DV) 平面的 z 坐标。
- 确保 Lambda 与 Bregma 位于同一 DV 平面中(即,两个地标的 z = 0)。同样,在囟外侧 +2.0 mm (x = 2) 和 -2.0 mm (x = -2.0) 处,确保颅骨位于同一平面上,DV/z 坐标大致相等。确保颅骨安全,并且在任何调整后都不会移动。
- 在距离前囟 +2.0 mm (ML) 和 +0.5 mm (AP) 处钻毛孔(图 3)。
- 使用立体定向钻头附件,小心地降低钻头的尖端,直到它与 Pregma 接触并将坐标归零。
- 稍微抬起钻头并将钻头调整到适当的 AP 和 ML 坐标。
- 慢慢降低钻头,注意只穿过头骨。
- 或者,在立体定向框架中使用微升注射器,降低针尖,直到它接触到前囟并将坐标归零。
- 稍微抬起针并调整到适当的 AP 和 ML 坐标。
- 降低尖端,直到它接触到头骨,并记下确切位置。
- 稍微抬起针头,用手术记号笔在目标位置做一个小标记。
- 抬起或旋转针架,用手钻在颅骨上毛刺,小心避免损坏下面的大脑。注意:一般来说,老年雄性小鼠的头骨相对较厚,需要更广泛的钻孔。手钻孔时应小心进行,施加最小的压力,因为突然突破颅骨会损伤下面的脑膜和/或大脑。
注意:在 LITT 程序中,需要延长毛刺孔以容纳热电偶探头。这可以在初始注射手术中更容易完成,并有助于更快、更简化的 LITT 手术。或者,在 LITT 手术期间可以以相同的方式扩展钻孔,这可能会降低颅外肿瘤生长的风险。
- 在热电偶的 +3.0 mm ML 和 +0.5 mm AP(注射部位外侧 1.0 mm)处创建第二个毛刺孔。
- 按照上一步中概述的钻取过程进行作。
- 为避免与骨骼再生相关的困难,请去除两个孔之间的骨骼。
注意:建议使用来自 Pregma 的 +2.0 mm ML、+0.5 mm AP 和 -2.5 mm DV 作为肿瘤植入的坐标。纹状体上部的这个位置产生一致的肿瘤生长,动物对此具有良好的耐受性 - 但是,该方案可以适应其他位置。
- 在微升注射器中制备 CT2A 小鼠神经胶质瘤细胞悬液(1.5 μL 中 5000 个细胞)。
- 从冰中取出预先准备好的微量离心管细胞,然后用指尖轻轻轻弹以重悬。
- 将 2 μL 轻轻吸入 5 μL 或 10 μL 注射器中,注意避免气泡。
- 挤出 0.5 μL 以去除任何空气,并确保针头已灌注并正常工作。
- 用酒精棉签擦拭针杆,以去除挤出的液体和外表面的任何细胞(可能导致软脑膜肿瘤生长)。
- 将注射器装入显微注射器注射泵(或手动立体定向附件)中,然后缓慢降低针头。
- 将针慢慢降低至深度 (z = -3.0 mm) 并暂停 1 分钟。
- 缓慢缩回针头 0.5 mm (z = -2.50 mm) 并注射细胞 (≤ 0.5 μL/min)。使用显微外科海绵矛保持注射器周围区域干燥,小心不要破坏针头。
- 注射完成后至少等待 2 分钟,然后在 3-4 分钟内缓慢缩回注射器。确保前 4-5 次回缩间隔为每次回缩 100 μm,以避免细胞从其原始注射部位脱落。
- 使用酒精棉签轻轻擦拭针头外部的任何血液或液体,然后根据制造商的指南冲洗和清洁注射器。在两次注射之间使用 PBS 和蒸馏水,以确保针头不会堵塞。注射完成后,用 70% 乙醇充分冲洗针头,以去除针头上的任何残留细胞。
注意: 每次注射后不冲洗针头可能会导致堵塞。如果注射多种细胞类型,请为每种类型使用单独的针头,以避免任何可能的交叉污染。
- 重新接近切口,注意稍微外翻伤口边缘,以便下面的真皮接触。使用伤口夹或 3 次中断缝合 5-0 缝合缝合伤口。将聚维酮碘溶液涂抹在闭合的伤口上。
- 从立体定向框架中取出动物,并将其放入设置为 37 °C 的加热垫上的衬纸恢复笼中。 在将动物转移回笼子之前,确保在笼子地板上放一小盘湿食物之前获得胸骨卧位。
- 在接下来的 2 天内,从手术当天开始,每天至少监测动物两次。在 24 小时、48 小时和 72 小时后或根据机构指南服用美洛昔康。

图 2:小鼠头骨的图形示意图和立体定向手术的重要解剖标志。 使用 BioRender.com 创建 请单击此处查看此图的较大版本。
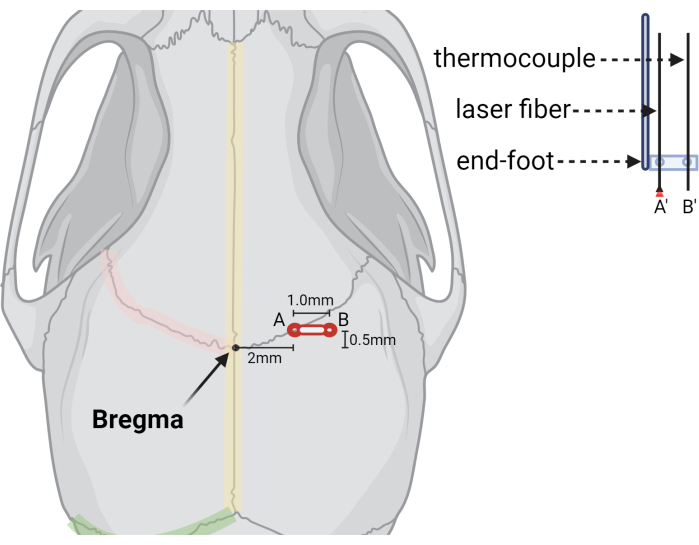
图 3:表示钻孔和激光设备位置的图形插图。 插图显示了 Pregma 标志的相对位置,(A) (A') 激光光纤的初始毛刺孔,以及 (B) (B') 热电偶探针的第二个或扩展的毛刺孔。右侧显示了激光光纤和热电偶探头的切口,说明了如何将探头稳定在立体定向端脚中,并预先钻出所需尺寸和间距的孔。使用 BioRender.com 创建请单击此处查看此图的较大版本。
3. 监测 LITT 前的肿瘤负荷(第 9 天)
- 按照机构指南进行 T2 加权磁共振成像 (MRI),以评估 LITT 前一天的肿瘤生长情况。
注意:肿瘤的直径应为 ~1.5-2.0 毫米。- 使用以下参数获得整个小鼠大脑的合适冠状扫描:快速旋转回波序列,TR = 5000 ms,TE = 45 ms,回波序列 = 7,FOV = 30 x 30 mm2,基质尺寸 = 250 x 256,总切片 = 18,切片厚度 = 0.3 mm,平均值 = 2。
注意:还建议在植入后大约 6 天开始进行定期 MRI,以确认同种异体移植成功并监测肿瘤生长 - 尤其是在初始实验期间 - 因为即使是手术的细微变化也可能改变时间表。CT2A 具有高度侵略性,需要密切监测动物。T2 加权冠状扫描非常适合此目的。在无法进行小动物 MRI 的情况下,将荧光标记或荧光素标记的 CT2A 细胞与 体内 成像系统 (IVIS) 结合使用也可能适用。然而,生长动力学和其他肿瘤特征将与该方案不同。
- 使用以下参数获得整个小鼠大脑的合适冠状扫描:快速旋转回波序列,TR = 5000 ms,TE = 45 ms,回波序列 = 7,FOV = 30 x 30 mm2,基质尺寸 = 250 x 256,总切片 = 18,切片厚度 = 0.3 mm,平均值 = 2。
4. LITT 手术(第 10 天)
- 如上在第 2 节中,重复步骤 2.1-2.13 为动物准备 LITT。
注意:根据实验时间表的物种和变化,先前手术的伤口愈合可能处于不同的阶段。重新制作切口时,请注意更薄或更脆弱的组织。 - 使用无菌棉签轻轻清洁颅骨,清除任何遮挡前囟或先前形成的毛刺孔的组织。如有必要,请重新钻钻孔,但由于 CT2A 肿瘤形成的速度,预计几乎不会有任何骨骼再生。
- 将 LITT 附件固定在立体定向框架中,将激光光纤尖端在 Pregma 处的坐标归零。
注意: 激光光纤非常脆弱,如果弯曲会破裂。一旦激光光纤的尖端接触到颅骨,请小心停止。 - 稍微抬起尖端并移动到所需的 ML 和 AP 坐标,然后慢慢将探针降低到目标 DV 坐标以到达目标(2.0 mm ML、0.5 mm AP、-2.0 mm DV)。
- 设置 LITT 治疗参数: 模式:连续;功率: 1 W
- 将激光器从 待机 切换到 活动 ,并使用脚踏板接合激光器 60 秒。如果温度升高超过 46 °C,请短暂暂停,然后重新接合,尝试将温度保持在尽可能接近 46 °C。
- 慢慢缩回激光组件,然后用酒精棉签轻轻擦拭激光光纤和热电偶干净。将组件旋转到一边,注意探头不要接触框架。
- 在肿瘤植入后,按照上述步骤 2.18-2.20 中的说明闭合伤口并恢复动物。
5. LITT 后评估(第 11 天)
- 在 LITT 治疗后的第二天进行 LITT T2 加权 MRI,以使用上述步骤 3.1 中的序列和参数评估 LITT 肿瘤消融是否成功。
注意:此外,液体衰减反转恢复 (FLAIR) 序列也可能有助于评估术后水肿。 - 在研究结束前进行随访扫描,以监测治疗后的变化或肿瘤再生。
6. 研究结束(第 11 天/第 15 天/第 20 天)
- 根据机构的指导方针,在选定的实验终点对动物实施安乐死。
注意:即使接种细胞计数极低,CT2A 晚于第 20 天的终点也是不可行的,因为对照动物(即假手术或不治疗)和一些治疗组动物可能垂死并需要安乐死。对于更长的实验,请考虑替代小鼠神经胶质瘤细胞模型。 - 收集组织进行固定和处理。
- 用 4% 多聚甲醛 (PFA) 进行心脏灌注并收集感兴趣的组织。
- 通过在 4 °C 下浸入 4% PFA 中过夜来后固定脑组织。
- 使用福尔马林固定石蜡包埋 (FFPE) 或固定冷冻分析的标准作规范处理样品。
7. 分析
- 使用 T2 加权 MRI 验证 LITT 消融是否成功,并使用苏木精和伊红染色等基本组织学技术进行验证。
- 执行实验所需的任何其他分析(例如,免疫组织化学、免疫荧光)。
结果
成功的 CT2A 肿瘤植入和 LITT 治疗可以使用 T2 加权 MRI 进行表征,如图 4、 图 5 和 图 6 所示。使用具有 17 cm 孔径和正交小鼠头线圈的 7T 无制冷剂超导磁体使用上述协议中概述的序列参数获得 MR 图像。仔细遵守这种方法应导致摄取率接近 100%,一致的肿瘤定位和大致的球形肿瘤形成,如图
讨论
关于 LITT 的文献正在迅速扩展;然而,它主要限于人类临床案例研究或病例系列。事实上,LITT 的几个潜在好处已经被证明,包括降低术后并发症发生率和成本,同时提供相当的无进展生存期 7,8,9,10,11。全身药物治疗的成功率更高,局部复发也减少了?...
披露声明
我们感谢 Monteris Medical 的支持,包括对激光设备的实物捐赠。
致谢
该项目的资金来源包括加拿大自然科学与工程委员会 (NSERC) 联盟、Mitacs-Accelerate、曼尼托巴省研究局-IPOC、加拿大卫生研究所 (CIHR) CGS-M 和曼尼托巴大学研究生奖学金。CT2A 神经胶质瘤细胞系由北卡罗来纳州达勒姆杜克大学的 Peter Fecci 博士慷慨捐赠。我们还要感谢曼尼托巴大学的组织学服务实验室和小动物和材料成像核心设施为该项目提供的出色技术帮助。
材料
| Name | Company | Catalog Number | Comments |
| Absorbion Spears | FST | 18105-01 | Hemostatic sponges. |
| Adson tissue forceps | FST | 11006-12 | |
| C57BL/6 mice | Jackson Laboratories | Strain #000664 | 6 to 12 week old male and female |
| Cotton Tipped Applicators (6") | Electron Microscopy Sciences | 72308 | |
| CT2A glioma cell line | Generously donated from Dr. Peter Fecci, Duke University. | ||
| Cultrex Reduced Growth Factor Basement Membrane Extract, PathClear | Biotechne, R&D systems | 3433-010-01 | |
| DMEM/F-12, HEPES | Gibco, ThermoFisher Scientific | 11330032 | |
| Dual-chamber slides | BIO-RAD | 1450003 | |
| Eppendorf Safe-Lock Tubes 2.0 mL | Eppendorf | 22363352 | |
| Ethyl Alcohol Anhydrous | Greenfield Global | P016EAAN | Dilute to 70% with ddH2O |
| Fetal Bovine Serum, qualified, Canada | Gibco, ThermoFisher Scientific | 12483020 | |
| Glad Press-n-Seal plastic wrap | Amazon.ca | 12587704417 | |
| High speed drill | Kopf Instruments | Model 1474 | |
| K & J Thermocouple temerpature meter | Omega | HH509R | |
| Metacam (meloxicam) | WDDC | 114424 | |
| Microinjection syringe pump | WPI | UMP3T-1 | |
| Microliter syringe (700 Series) | Hamilton | 87908 | Custom needles are available. A steep needle bevel helps with precise delivery, and a shorter needle length helps with stability. |
| Needle driver/Needle Holder | FST | 12500-12 | A fine tip is most suitable due to the confined working space, but many styles are suitable based on handle preference. |
| Opixcare Plus opthalmic ointment | WDDC | 135941 | |
| Phosphate Buffered Saline (10x) | Fisher bioreagents | BP399-4 | Dilute to 1x with ddH2O |
| Povidone-iodine | ThermoFisher Scientific | 3955-16 | Aliquat into into smaller tubes for use with cotton tipped applicators. |
| Saline (normal) | WDDC | 126588 | |
| Scalpel, single use (#15 Blade) | Feather | Feather NO15 | |
| Scissors, fine surgical | FST | 91460-11 | Fine student scissors, Iris, or Bonn are all suitable. |
| Stereotactic frame | Kopf Instruments | Model 940 | With digital display console and mouse nose-cone and ear-bars. |
| Stereotactic syringe holder | Kopf Instruments | Model 1772-F | If not using an injection pump. |
| Sutures (5-0 monofilament) | Ethicon | MCP463G | Monocryl violet monofilament with reverse cutting tip |
| Syringe, 28 G (0.5 mL) | BD | BD 329461 | BD Lo-Dose U-100 Insulin Syringes |
| TC20 Automated Cell Counter | BIO-RAD | 1450102 | |
| Thermocouple probe, fine diameter (Type K) | Omega | TJM-CA316-IM025G-150 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco, ThermoFisher Scientific | 25200072 | |
| Vetbond by 3M, veterinary tissue glue | WDDC | 126125 | |
| Wahl Peanut Clippers | WDDC/Wahl | 100963 | Also available directly from manufacturer. |
| Warming pad | Bensen Medical | 70308/121873 | Any similar item can be used. |
| Webcol Alcohol preps | Electron Microscopy Sciences | 71005-20 | Alcohol prep wipe, 2-ply, medium size. |
参考文献
- Canadian Cancer Society. . Cancer Statistics 2023. , (2023).
- . Glioblastoma Research Organization Available from: https://www.gbmresearch.org (2024)
- Carpentier, A., et al. Laser thermal therapy: Real-time MRI-guided and computer-controlled procedures for metastatic brain tumors. Lasers Surg Med. 43 (10), 943-950 (2011).
- Haddad, A. F., et al. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv. 3 (1), vdab100 (2021).
- Chokshi, C. R., Savage, N., Venugopal, C., Singh, S. K. A patient-derived xenograft model of glioblastoma. STAR Protoc. 1 (3), 100179 (2020).
- Alcaniz, J., et al. Clinically relevant glioblastoma patient-derived xenograft models to guide drug development and identify molecular signatures. Front Oncol. 13, 1129627 (2023).
- Muir, M., et al. Laser interstitial thermal therapy for newly diagnosed glioblastoma. Lasers Med Sci. 37 (3), 1811-1820 (2022).
- Muir, M., Traylor, J. I., Gadot, R., Patel, R., Prabhu, S. S. Repeat laser interstitial thermal therapy for recurrent primary and metastatic intracranial tumors. Surg Neurol Int. 13, 311 (2022).
- De Groot, J. F., et al. Efficacy of laser interstitial thermal therapy (LITT) for newly diagnosed and recurrent IDH wild-type glioblastoma. Neurooncol Adv. 4 (1), vdac040 (2022).
- Holste, K. G., Orringer, D. A. Laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdz035 (2020).
- Leuthardt, E. C., Voigt, J., Kim, A. H., Sylvester, P. A single-center cost analysis of treating primary and metastatic brain cancers with either brain laser interstitial thermal therapy (LITT) or craniotomy. Pharmacoecon Open. 1 (1), 53-63 (2017).
- Bastos, D. C. D. A., et al. Predictors of local control of brain metastasis treated with laser interstitial thermal therapy. Neurosurgery. 87 (1), 112-122 (2020).
- Darbinyan, A., Leelatian, N., Fomchenko, E. I. Histological changes associated with laser interstitial thermal therapy for radiation necrosis: illustrative cases. J Neurosurg Case Lessons. 4 (1), CASE21373 (2022).
- Grant, G. A., Porter, B. E., Li, D., Barros Guinle, M. I., Kaur, H. Approach, complications, and outcomes for 37 consecutive pediatric patients undergoing laser ablation for medically refractory epilepsy at Stanford Children's Health. J Neurosurg Pediatr. 33 (1), 1-11 (2023).
- Ogasawara, C., et al. Laser interstitial thermal therapy for cerebral cavernous malformations: A systematic review of indications, safety, and outcomes. World Neurosurg. 166, 279-287.e1 (2022).
- Satzer, D., Mahavadi, A., Lacy, M., Grant, J. E., Warnke, P. Interstitial laser anterior capsulotomy for obsessive-compulsive disorder: lesion size and tractography correlate with outcome. J Neurol Neurosurg Psychiatry. 93 (3), 317-323 (2022).
- Salehi, A., et al. Therapeutic enhancement of blood-brain and blood-tumor barriers permeability by laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdaa071 (2020).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。