JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
교모세포종의 레이저 간질성 열처리 치료를 위한 면역 역량 있는 쥐 모델
* 이 저자들은 동등하게 기여했습니다
요약
교모세포종은 파괴적인 형태의 원발성 뇌암이며, 레이저 간질성 열 요법은 수술이 불가능한 교모세포종에 대한 기존 외과적 절제술의 유망한 대안으로 부상하고 있습니다. 이 프로토콜은 치료 효과 또는 보조 및 조합 치료를 연구하는 데 사용할 수 있는 최적화된 전임상 마우스 모델을 설명합니다.
초록
원발성 뇌종양 중 가장 공격적인 형태인 교모세포종(GB)은 성인에서 발생하는 모든 고급 원발성 뇌종양의 약 절반을 차지하며 치료법이 없습니다. 레이저 간질성 온열 요법(LITT)은 GB에 대한 식품의약국(FDA) 승인 치료법으로, 기존의 외과적 절제술에 적합하지 않은 환자에게 사용됩니다. LITT의 임상적 효능은 확립되었지만, 임상 사례 연구 및 사례 시리즈를 넘어서는 연구는 제한적이며 확립된 동물 모델의 부족으로 인해 어려움을 겪고 있습니다. 이 프로토콜은 C57BL/6 마우스와 syngeneic CT2A 신경교종 암 세포주를 사용하여 인간 GB를 면밀히 재현하는 동시에 FDA 승인을 받은 두 가지 LITT 시스템 중 하나에 사용되는 것과 같은 1064nm 네오디뮴 도핑 이트륨 알루미늄 가넷(Nd:YAG) 레이저를 사용하여 탁월한 전임상 관련성을 제공합니다. 이 LITT 쥐 모델의 성공적인 확립은 LITT 절제의 고유한 특징과 종양 미세환경에 미치는 영향을 조사하기 위한 귀중한 플랫폼을 제공하여 잠재적으로 개선된 치료 전략으로 이어질 것입니다.
서문
암은 캐나다에서 가장 큰 사망 원인입니다. 공격적인 뇌종양의 가장 흔한 형태인 교모세포종(GB)은 성인의 모든 고급 원발성 뇌종양의 48-60%를 차지한다1. GB의 예후는 특히 암울하여 외과적 절제술, 화학요법 및 방사선 요법을 포함한 기존 치료법의 5년 순 생존율이 4.8%에 달한다 1,2.
레이저 간질성 온열 요법(LITT)은 수술이 불가능한 뇌종양 환자의 온열 제자리 종양 절제술을 위해 레이저를 사용하는 FDA 승인 시술로, 기존 외과적 절제술에 대한 매력적인 치료 대안을 제공합니다3. 그러나 GB의 LITT 치료를 위한 상세하고 잘 특성화된 쥐 모델이 부족하여 전임상 연구에 걸림돌이 되고 있습니다.
이 프로토콜은 LITT를 사용한 GB 치료를 위한 최적화된 전임상 쥐 모델을 보여주는 것을 목표로 합니다. 이 모델을 위해 C57BL/6 마우스와 syngeneic glioma cell line CT2A를 사용하기로 선택한 주된 이유는 CT2A가 유사한 조직학적 특징, 침습성, 화학 및 방사선 저항성, 종양의 자가 재생 및 재확립을 가진 줄기와 같은 특징을 가진 인간 고급 GB를 밀접하게 요약하기 때문입니다4. 이러한 특성은 면역 반응 또는 새로운 치료 전략과 관련된 다양한 연구를 위한 훌륭한 플랫폼을 제공합니다. 또한, 이 LITT 프로토콜의 기술적 측면은 다른 동종 및 이종 이식 쥐 모델 4,5,6에도 쉽게 적용할 수 있으며, 이에 대해서는 더 자세히 논의될 것입니다.
이 프로토콜의 장점은 간단하면서도 효과적인 LITT 치료 패러다임으로 일관된 결과를 얻을 수 있다는 것입니다. 사용된 1064nm 네오디뮴 도핑 이트륨 알루미늄 가넷(Nd:YAG) 레이저는 현재 FDA가 승인한 두 가지 시스템 중 하나에서 임상적으로 사용되는 것과 동일하여 고급 신경교종 치료를 위한 LITT의 임상 적용과 밀접하게 유사한 실험을 할 수 있습니다. 이 프로토콜의 주요 단점은 재현 가능한 결과를 얻기 위해 종양 세포 이식과 LITT 치료 모두에서 극도의 주의를 기울여야 한다는 것입니다. 또한 CT2A 세포주의 공격적인 특성으로 인해 이 프로토콜은 시간에 매우 민감합니다. 대부분의 실험은 최대 20일 이내에 종료되어야 하며, 이로 인해 일부 적응 면역 반응 또는 장기간에 걸쳐 발생하는 기타 세포 및 분자 메커니즘에 대한 조사가 제한될 수 있습니다.
프로토콜
이 프로토콜에 대한 동물 윤리는 캐나다 동물 관리 위원회(CCAC)가 정한 윤리 지침에 따라 매니토바 대학의 동물 관리 위원회에서 승인했습니다. 이 프로토콜은 8-12주 된 C57BL/6 면역 역량 마우스와 syngeneic glioma cell line CT2A를 사용하여 조직학적 분석, 면역학적 변화 또는 조합 치료 중재에 중점을 둔 실험을 포함한 광범위한 응용 분야의 전임상 모델을 사용했습니다. 이 프로토콜은 실험 요구 사항에 따라 다른 마우스 종 또는 세포주에 쉽게 적용할 수 있습니다.
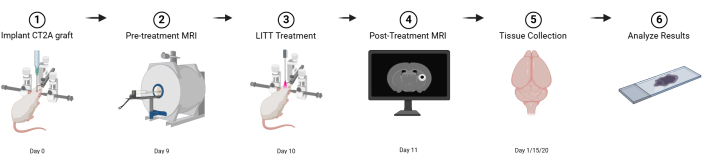
그림 1: 기본 실험 설계의 그래픽 개략도. BioRender.com 로 제작 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 세포 준비 개요(0일차)
- 세포 배양을 시작하기 전에 캐비닛과 필요한 모든 파이펫이 UV 및 에탄올로 완전히 멸균되었는지 확인하십시오.
- 수조를 사용하여 10% FBS 배지, 인산염 완충 식염수(PBS) 및 트립신이 포함된 DMEM/F12를 실온(RT)으로 가열합니다.
- T25 플라스크에서 배지를 피펫으로 빼내고 PBS로 세포를 잠시 헹굽니다. 세포에 트립신 1mL를 추가하고 세포가 플라스크에서 분리될 때까지 30-60초 동안 배양합니다.
- 광학 현미경으로 분리된 세포를 확인하고 4mL의 배지를 추가하여 트립신 효소 활성을 중지합니다.
- 자동화된 셀 카운터를 사용하여 셀 수를 계산합니다.
- 10μL의 세포 현탁액과 10μL의 트리판 블루를 혼합한 다음 10μL를 세포 계수 슬라이드에 추가합니다.
- 슬라이드를 세포 계수기에 삽입하고 총 세포 수, 살아있는 세포 수 및 살아있는 세포의 백분율을 기록합니다.
참고: 자동 세포 계수기를 사용할 수 없는 경우 혈구계를 사용하여 수동 계수를 수행할 수 있습니다.
- 계획된 모든 주입에 필요한 세포를 계산합니다.
참고: CT2A의 경우 주입된 부피 1.5μL당 5000개의 세포와 각 제제에 대해 최소 총 부피 100μL를 권장합니다. - 134 x g 에서 5분 동안 세포를 회전시켜 세포를 펠릿화하고 가능한 한 많은 배지를 흡인합니다.
- 마이크로 원심분리 튜브에 필요한 부피를 위해 PBS에 5% 기저막 추출물을 사용하여 세포 펠릿을 재현탁합니다. 세포 현탁액을 준비하는 데는 작은 튜브가 가장 적합하지만, 세포가 더 둥근 바닥으로 뭉칠 가능성이 적고 부드럽게 튕겨서 쉽게 재분배할 수 있으므로 2mL 튜브를 수술 중에 보관하는 것이 더 좋습니다.
- 주사를 위해 세포를 얼음 위에 보관하고 필요에 따라 4-5시간마다 새로운 세포 현탁액을 준비합니다.
2. 정소성 이식(0일차)
- 수술 부위를 준비하고 필요한 모든 기구가 멸균되어 사용할 준비가 되었는지 확인합니다.
- 챔버에서 이소플루란(3L/min O2에서 1% 기화)을 사용하여 마우스를 마취하면서 호흡수(목표 60bpm)를 모니터링합니다.
- 약물 투여를 위해 동물의 체중을 구하고 기록합니다.
- 눈, 귀, 수염이 생기지 않도록 수술 부위를 조심스럽게 면도합니다.
- 동물을 정위 프레임으로 옮깁니다.
- 바이트 바의 구멍에 앞니를 놓고 꼭 맞을 때까지 노즈콘을 조정하고 고정 나사를 조여 고정합니다.
- 양측 뒷다리 발가락 꼬집기로 마취 깊이를 확인하고 적절한 경우 귀핀을 사용하여 두개골을 고정하고 동물의 머리를 중립적이고 평평한 평면 위치로 조정합니다.
- 윤활된 직장 온도 프로브를 사용하여 동물의 코어 온도를 모니터링하고 몸 아래 발열 패드를 사용하여 37°C에서 보조 예열을 제공합니다.
주의: 코뼈에 적당한 압력이라도 호흡 정지를 유발할 수 있으므로 노즈콘을 과도하게 조이지 않도록 주의하십시오. 전기 발열 패드(예: 테라리움용 발열 패드)를 사용하는 경우 온도 설정이 정확하고 설정 온도가 일정하게 유지되는지 확인하십시오.
- 건조를 방지하기 위해 양쪽 눈에 안과 연고를 넉넉히 바르십시오.
- 예방주사를 투여하고 마취 깊이를 확인합니다.
- 28 G x 1/2" 주사기를 사용하여 지역 동물 시설 지침에 따라 피하(s.c.) 멜록시캠 또는 기타 지속성 진통제(예: 5.0mg/kg 멜록시캠)를 주입합니다.
- 장시간 시술 중 예방적 수액 지원을 위해 예열된 생리식염수 20mg/kg s.c. 주사를 투여합니다.
- 마취제를 1.5%-2.0% 이소플루란으로 줄여 목표 호흡수를 유지합니다.
- 무균 기술을 사용하여 동물을 감싸고 수술 부위를 준비합니다.
- 멸균 면봉을 사용하여 포비돈 요오드 또는 클로르헥시딘 소독액을 바릅니다. 절개 부위에서 내측으로 시작하여 각 통과 후 면봉을 회전시키고 바깥쪽으로 작업한 다음 신선한 멸균 면봉을 사용하여 유사한 방식으로 해당 부위에 70% 에탄올을 도포합니다.
- 요오드로 스크럽한 다음 70% 에탄올을 2회 더 반복합니다(각 3회).
- 수술 노출을 진행하기 전에 마취 깊이를 다시 확인하십시오. 시술 전반에 걸쳐 호흡수를 면밀히 모니터링하고 필요에 따라 마취제를 조정합니다.
- 정중선에서 시작하여 눈에서 약간 뒤쪽에서 #15 블레이드 메스를 사용하여 꼬리 방향으로 1-1.5cm 중간 시상 절개를 만듭니다. 또는 홍채 가위로 짧은 메스 절개 부위를 연장합니다.
참고: 절개 부위는 정중선에서 시작해야 하지만, 편측 주사의 경우 Bregma와 버 구멍 위치를 동시에 시각화하고 접근할 수 있도록 약간 옆으로 기울어질 수 있습니다. - 멸균 면봉을 사용하여 상처 가장자리를 반사하여 두개골을 시각화하고 해당 부위의 결합 조직을 부드럽게 문지릅니다.
- 필요한 경우 과산화수소에 적신 멸균 면봉을 사용하여 두개골 표면을 청소하고 두개골 봉합사를 시각화합니다.
- Bregma는 좌우 관상 봉합사가 시상 봉합사와 정중선에서 만나는 곳입니다( 그림 2 참조).
- 무독성 착색 아크릴 수지와 멸균 나무 이쑤시개 또는 이와 유사한 것을 사용하여 Bregma에 아주 작은 표시를 만듭니다.
참고: 어떤 경우에는 왼쪽 및 오른쪽 관상 봉합사가 서로를 미러링하지 않습니다. 이러한 경우 '최적선'을 사용하여 중간 시상 평면을 따라 교차해야 하는 위치를 대략적으로 계산합니다.
- 무독성 착색 아크릴 수지와 멸균 나무 이쑤시개 또는 이와 유사한 것을 사용하여 Bregma에 아주 작은 표시를 만듭니다.
- 동물의 머리 위치가 기울어지거나 회전하지 않는지 확인하십시오(즉, 평평한 평면에서).
- Bregma에서 제로 정위 좌표. x 좌표는 ML(내측) 평면에서의 이동, AP(전방-후방) 평면의 y 좌표, DV(배쪽-복부) 평면의 z 좌표를 나타냅니다.
- Lambda가 Bregma와 동일한 DV 평면에 있는지 확인합니다(즉, 두 랜드마크 모두에서 z = 0). 마찬가지로, 브레그마 측면에서 +2.0mm(x = 2) 및 -2.0mm(x = -2.0)에서 두개골이 DV/z 좌표가 거의 동일한 동일한 평면에 있는지 확인합니다. 두개골이 고정되어 있고 조정 후에도 움직이지 않는지 확인하십시오.
- Bregma에서 +2.0mm(ML) 및 +0.5mm(AP)에 버 구멍을 뚫습니다(그림 3).
- 정위 드릴 부착물을 사용하여 Bregma와 접촉하고 좌표를 0으로 만들 때까지 비트 끝을 조심스럽게 내립니다.
- 비트를 약간 올리고 드릴을 적절한 AP 및 ML 좌표로 조정합니다.
- 드릴을 천천히 내리고 두개골을 통해서만 버핑하도록 주의하십시오.
- 또는 정위 프레임에서 마이크로리터 주사기를 사용하여 Bregma에 닿을 때까지 바늘 끝을 낮추고 좌표를 0으로 만듭니다.
- 바늘을 약간 올리고 적절한 AP 및 ML 좌표로 조정합니다.
- 두개골에 닿을 때까지 팁을 내리고 정확한 위치를 기록해 둡니다.
- 바늘을 약간 올리고 수술 마커로 목표 위치에 작은 표시를 합니다.
- 바늘 캐리어를 올리거나 회전하여 방해가 되지 않도록 하고 핸드 드릴을 사용하여 두개골을 통해 버를 삽입하고 아래의 뇌가 손상되지 않도록 주의하십시오. 주의: 일반적으로 나이가 많은 수컷 마우스는 두개골이 상대적으로 두껍고 더 광범위한 드릴링이 필요합니다. 손으로 구멍을 뚫는 것은 두개골을 갑자기 뚫고 들어가면 기저에 있는 수막 및/또는 뇌가 손상될 수 있으므로 최소한의 압력을 가하여 조심스럽게 수행해야 합니다.
알림: LITT 절차 중에 열전대 프로브를 수용하기 위해 버 구멍의 확장이 필요합니다. 이는 초기 주사 수술 중에 더 쉽게 수행할 수 있으며 더 빠르고 간소화된 LITT 수술을 용이하게 합니다. 또는 LITT 수술 중에 동일한 방식으로 버 구멍을 확장할 수 있으며, 이는 두개외 종양 성장의 위험을 줄일 수 있습니다.
- 열전대에 대해 +3.0mm ML 및 +0.5mm AP(주입 부위 측면 1.0mm)에서 두 번째 버 홀을 만듭니다.
- 이전 단계에서 설명한 대로 드릴링 절차를 따릅니다.
- 뼈 재생과 관련된 어려움을 피하려면 두 구멍 사이의 뼈를 제거하십시오.
참고: Bregma의 +2.0mm ML, +0.5mm AP 및 -2.5mm DV를 종양 이식 좌표로 사용하는 것이 좋습니다. 상부 선조체의 이 위치는 동물이 잘 견디는 일관된 종양 성장을 제공하지만 프로토콜은 다른 위치에 적용할 수 있습니다.
- CT2A 마우스 신경교종 세포 현탁액을 마이크로리터 주사기(1.5μL에 5000개 세포)에 준비합니다.
- 얼음에서 미리 준비된 미세 원심분리기 튜브를 제거하고 손가락 끝으로 부드럽게 두드려 다시 현탁시킵니다.
- 기포가 생기지 않도록 주의하면서 5 μL 또는 10 μL 주사기에 2 μL를 부드럽게 주입합니다.
- 0.5μL를 분사하여 공기를 제거하고 바늘이 프라이밍되고 올바르게 작동하는지 확인합니다.
- 알코올 면봉으로 바늘 축을 닦아 발현된 액체와 외부 표면의 세포(연수막 종양 성장을 유발할 수 있음)를 제거합니다.
- 주사기를 마이크로 인젝터 주사기 펌프(또는 수동 정위 부착물)에 넣고 바늘을 천천히 내립니다.
- 바늘을 천천히 깊이(z = -3.0mm)까지 내리고 1분 동안 일시 중지합니다.
- 바늘을 천천히 0.5mm(z = -2.50mm) 후퇴시키고 세포(≤ 0.5μL/min)를 주입합니다. 주사기 주변을 미세수술용 스펀지 창을 사용하여 건조한 상태로 유지하고 바늘이 방해받지 않도록 주의하십시오.
- 주입이 완료된 후 최소 2분 동안 기다린 다음 3-4분에 걸쳐 주사기를 천천히 집어넣습니다. 세포가 원래 주입 부위에서 이탈되는 것을 방지하기 위해 처음 4-5번의 후퇴 간격이 후퇴당 100μm인지 확인합니다.
- 알코올 면봉을 사용하여 바늘 외부를 피나 액체가 묻지 않도록 부드럽게 닦고 제조업체의 지침에 따라 주사기를 세척하고 청소합니다. 주사 사이에 PBS와 증류수를 사용하여 바늘이 막히지 않도록 하십시오. 주사가 완료되면 바늘에 70% 에탄올을 넉넉히 넣어 바늘에 남아 있는 세포를 제거합니다.
주의: 주사를 맞을 때마다 바늘을 세척하지 않으면 바늘이 막힐 수 있습니다. 하나 이상의 세포 유형을 주입하는 경우 교차 오염 가능성을 방지하기 위해 각 유형에 대해 별도의 바늘을 사용하십시오.
- 절개 부위를 다시 대략적으로 계산하고 밑에 있는 진피가 닿도록 상처 가장자리를 약간 깎아내도록 주의합니다. 상처 클립을 사용하거나 5-0 봉합사로 3바늘을 꿰매어 상처를 봉합합니다. 포비돈 요오드 용액을 닫힌 상처에 바릅니다.
- 정위 프레임에서 동물을 제거하고 37°C로 설정된 보온 패드에 종이를 깐 회수 케이지에 넣습니다. 케이지 바닥에 있는 작은 젖은 차우 접시를 사용하여 동물을 가정용 케이지로 다시 옮기기 전에 흉골 누운기가 얻어졌는지 확인하십시오.
- 수술 당일부터 다음 2일 동안 최소 하루에 두 번 동물을 모니터링하십시오. 24시간, 48시간, 72시간 후 또는 기관 지침에 따라 meloxicam을 재투여합니다.

그림 2: 쥐 두개골의 그래픽 그림과 정위 수술을 위한 중요한 해부학적 랜드마크. BioRender.com 로 제작 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
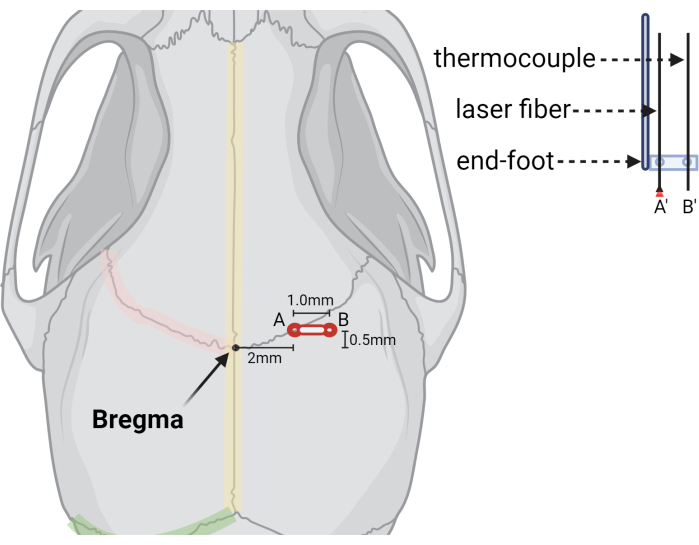
그림 3: 버 구멍과 레이저 장치의 위치를 나타내는 그래픽 그림. Bregma 랜드마크의 상대적 위치, (A) (A') 레이저 광섬유의 초기 버 홀, (B) (B') 열전대 프로브의 두 번째 또는 확장된 버 홀을 보여주는 그림. 레이저 파이버 및 열전대 프로브의 컷아웃 묘사가 오른쪽에 표시되어 프로브가 원하는 크기와 간격으로 미리 뚫린 구멍이 있는 정위 엔드 풋에서 프로브가 어떻게 안정화되는지 보여줍니다. BioRender.com 로 제작 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. LITT 전 종양 부담 모니터링(9일차)
- LITT 전날 종양 성장을 평가하기 위해 기관 지침에 따라 T2 가중 자기 공명 영상(MRI)을 수행합니다.
참고: 종양은 직경이 ~1.5-2.0mm여야 합니다.- 빠른 스핀 에코 시퀀스, TR = 5000ms, TE = 45ms, 에코 트레인 = 7, FOV = 30 x 30mm2, 매트릭스 크기 = 250 x 256, 총 슬라이스 = 18, 슬라이스 두께 = 0.3mm, 평균 = 2 매개변수를 사용하여 전체 마우스 뇌에 대한 적절한 코로나 스캔을 얻습니다.
참고: 또한 성공적인 동종이식을 확인하고 종양 성장을 모니터링하기 위해(특히 초기 실험 중) 이식 후 약 6일째부터 주기적인 MRI를 수행하는 것이 좋습니다. CT2A는 매우 공격적이므로 동물을 면밀히 모니터링해야 합니다. T2 가중 코로나 스캔은 이러한 목적에 적합합니다. 형광 표지 또는 루시페린 표지 CT2A 세포를 생체 내 이미징 시스템(IVIS)과 함께 사용하는 것도 소동물 MRI에 접근할 수 없는 경우에 적합할 수 있습니다. 그러나 성장 역학 및 기타 종양 특성은 이 프로토콜과 다를 것입니다.
- 빠른 스핀 에코 시퀀스, TR = 5000ms, TE = 45ms, 에코 트레인 = 7, FOV = 30 x 30mm2, 매트릭스 크기 = 250 x 256, 총 슬라이스 = 18, 슬라이스 두께 = 0.3mm, 평균 = 2 매개변수를 사용하여 전체 마우스 뇌에 대한 적절한 코로나 스캔을 얻습니다.
4. LITT 수술 (10일차)
- 위의 섹션 2에서와 같이 2.1-2.13단계를 반복하여 동물이 LITT를 준비할 수 있도록 합니다.
참고: 이전 수술의 상처 치유는 실험 일정의 종과 다양성에 따라 다른 단계로 진행될 수 있습니다. 절개 부위를 다시 만들 때 더 얇거나 섬세한 조직에 주의하십시오. - 멸균 면봉을 사용하여 두개골을 부드럽게 청소하고 Bregma를 가리는 조직이나 이전에 만든 버 구멍을 제거합니다. 필요한 경우 버 구멍을 다시 뚫지만 CT2A 종양 형성 속도로 인해 뼈 재성장이 거의 예상되지 않습니다.
- LITT 부착물을 정위 프레임에 배치한 상태에서 레이저 파이버 팁에 대한 Bregma의 좌표를 0으로 만듭니다.
주의 : 레이저 섬유는 매우 약하며 구부리면 균열이 생깁니다. 레이저 섬유의 끝이 두개골에 닿는 즉시 정지하도록 주의하십시오. - 팁을 약간 올리고 원하는 ML 및 AP 좌표로 이동한 다음 프로브를 대상 DV 좌표까지 천천히 낮추어 대상(2.0mm ML, 0.5mm AP, -2.0mm DV)에 도달합니다.
- LITT 처리 매개 변수를 설정합니다. 전력: 1 W
- 레이저를 대기 에서 활성 으로 전환하고 풋 페달을 사용하여 60초 동안 레이저를 작동시킵니다. 온도가 46°C 이상으로 상승하면 잠시 멈췄다가 다시 작동하여 온도를 가능한 한 46°C에 가깝게 유지하려고 시도합니다.
- 레이저 어셈블리를 천천히 집어넣고 알코올 면봉으로 레이저 섬유와 열전대를 부드럽게 닦습니다. 프로브가 프레임에 닿지 않도록 주의하면서 어셈블리를 회전하여 방해가 되지 않도록 합니다.
- 위의 종양 이식 후 2.18-2.20 단계에서 설명한 대로 상처를 봉합하고 동물을 회복합니다.
5. LITT 사후 평가(11일차)
- LITT 치료 다음 날에 LITT T2 가중 후 MRI를 수행하여 위 3.1단계의 순서 및 매개변수를 사용하여 성공적인 LITT 종양 절제를 평가합니다.
참고: 또한 FLAIR(fluid-attenuated inversion recovery) 시퀀스도 수술 후 부종을 평가하는 데 도움이 될 수 있습니다. - 치료 후 변화 또는 종양 재성장을 모니터링하기 위해 연구 종료 전에 후속 스캔을 수행합니다.
6. 학업 종료 (11일차/15일차/20일차)
- 기관의 지침에 따라 선택한 실험 종점에서 동물을 안락사시킵니다.
참고: 대조 동물(즉, 가짜 수술 또는 치료 없음) 및 일부 치료 그룹 동물은 빈사 상태일 수 있고 안락사가 필요할 수 있으므로 세포 수가 극히 적은 접종에서도 CT2A로 20일째 이후의 평가변수는 실현 가능하지 않습니다. 장시간 실험의 경우 대체 마우스 신경교종 세포 모델을 고려하십시오. - 고정 및 처리를 위해 조직을 수집합니다.
- 4% 파라포름알데히드(PFA)로 심장 관류를 수행하고 관심 조직을 수집합니다.
- 4°C에서 하룻밤 동안 4% PFA에 담가 뇌 조직을 수정한 후.
- 포르말린 고정 파라핀 포매(FFPE) 또는 고정 동결 분석을 위한 표준 방법을 사용하여 샘플을 처리합니다.
7. 분석
- T2 가중 MRI를 사용하여 성공적인 LITT 절제를 확인하고 헤마톡실린 및 에오신 염색과 같은 기본 조직학적 기법을 사용하여 검증합니다.
- 실험에 필요한 추가 분석(예: 면역조직화학, 면역형광)을 수행합니다.
결과
그림 4, 그림 5 및 그림 6과 같이 T2 가중 MRI를 사용하여 성공적인 CT2A 종양 이식 및 LITT 치료를 특성화할 수 있습니다. MR 이미지는 위 프로토콜에 설명된 시퀀스 매개변수를 사용하여 17cm 보어 및 직교 마우스 헤드 코일이 있는 7T 극저온이 없는 초전도 자석을 사용하여 얻었습니다. 이 방법을 ?...
토론
LITT에 관한 문헌은 빠르게 확장되고 있습니다. 그러나 주로 인간 임상 사례 연구 또는 사례 시리즈에 국한됩니다. 실제로, LITT는 수술 후 합병증 발생률과 비용을 낮추는 동시에 무진행 생존율을 제공하는 등 여러 가지 잠재적인 이점이 있는 것으로 나타났습니다 7,8,9,10,11...
공개
레이저 장비의 현물 기부를 포함하여 Monteris Medical의 지원에 감사드립니다.
감사의 말
이 프로젝트의 자금 출처에는 캐나다 자연과학 및 공학 위원회(NSERC)-Alliance, Mitacs-Accelerate, Research Manitoba-IPOC, Canadian Institutes for Health Research(CIHR) CGS-M 및 매니토바 대학교 대학원 펠로우십이 포함됩니다. CT2A 신경교종 세포주: 노스캐롤라이나주 더럼에 있는 듀크 대학교의 Peter Fecci 박사가 아낌없이 기증했습니다. 또한 이 프로젝트에 탁월한 기술 지원을 해주신 매니토바 대학교(University of Manitoba)의 조직학 서비스 연구소(Histology Service Lab)와 소동물 및 재료 이미징 핵심 시설(Small Animal and Material Imaging Core facility)에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Absorbion Spears | FST | 18105-01 | Hemostatic sponges. |
| Adson tissue forceps | FST | 11006-12 | |
| C57BL/6 mice | Jackson Laboratories | Strain #000664 | 6 to 12 week old male and female |
| Cotton Tipped Applicators (6") | Electron Microscopy Sciences | 72308 | |
| CT2A glioma cell line | Generously donated from Dr. Peter Fecci, Duke University. | ||
| Cultrex Reduced Growth Factor Basement Membrane Extract, PathClear | Biotechne, R&D systems | 3433-010-01 | |
| DMEM/F-12, HEPES | Gibco, ThermoFisher Scientific | 11330032 | |
| Dual-chamber slides | BIO-RAD | 1450003 | |
| Eppendorf Safe-Lock Tubes 2.0 mL | Eppendorf | 22363352 | |
| Ethyl Alcohol Anhydrous | Greenfield Global | P016EAAN | Dilute to 70% with ddH2O |
| Fetal Bovine Serum, qualified, Canada | Gibco, ThermoFisher Scientific | 12483020 | |
| Glad Press-n-Seal plastic wrap | Amazon.ca | 12587704417 | |
| High speed drill | Kopf Instruments | Model 1474 | |
| K & J Thermocouple temerpature meter | Omega | HH509R | |
| Metacam (meloxicam) | WDDC | 114424 | |
| Microinjection syringe pump | WPI | UMP3T-1 | |
| Microliter syringe (700 Series) | Hamilton | 87908 | Custom needles are available. A steep needle bevel helps with precise delivery, and a shorter needle length helps with stability. |
| Needle driver/Needle Holder | FST | 12500-12 | A fine tip is most suitable due to the confined working space, but many styles are suitable based on handle preference. |
| Opixcare Plus opthalmic ointment | WDDC | 135941 | |
| Phosphate Buffered Saline (10x) | Fisher bioreagents | BP399-4 | Dilute to 1x with ddH2O |
| Povidone-iodine | ThermoFisher Scientific | 3955-16 | Aliquat into into smaller tubes for use with cotton tipped applicators. |
| Saline (normal) | WDDC | 126588 | |
| Scalpel, single use (#15 Blade) | Feather | Feather NO15 | |
| Scissors, fine surgical | FST | 91460-11 | Fine student scissors, Iris, or Bonn are all suitable. |
| Stereotactic frame | Kopf Instruments | Model 940 | With digital display console and mouse nose-cone and ear-bars. |
| Stereotactic syringe holder | Kopf Instruments | Model 1772-F | If not using an injection pump. |
| Sutures (5-0 monofilament) | Ethicon | MCP463G | Monocryl violet monofilament with reverse cutting tip |
| Syringe, 28 G (0.5 mL) | BD | BD 329461 | BD Lo-Dose U-100 Insulin Syringes |
| TC20 Automated Cell Counter | BIO-RAD | 1450102 | |
| Thermocouple probe, fine diameter (Type K) | Omega | TJM-CA316-IM025G-150 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco, ThermoFisher Scientific | 25200072 | |
| Vetbond by 3M, veterinary tissue glue | WDDC | 126125 | |
| Wahl Peanut Clippers | WDDC/Wahl | 100963 | Also available directly from manufacturer. |
| Warming pad | Bensen Medical | 70308/121873 | Any similar item can be used. |
| Webcol Alcohol preps | Electron Microscopy Sciences | 71005-20 | Alcohol prep wipe, 2-ply, medium size. |
참고문헌
- Canadian Cancer Society. . Cancer Statistics 2023. , (2023).
- . Glioblastoma Research Organization Available from: https://www.gbmresearch.org (2024)
- Carpentier, A., et al. Laser thermal therapy: Real-time MRI-guided and computer-controlled procedures for metastatic brain tumors. Lasers Surg Med. 43 (10), 943-950 (2011).
- Haddad, A. F., et al. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv. 3 (1), vdab100 (2021).
- Chokshi, C. R., Savage, N., Venugopal, C., Singh, S. K. A patient-derived xenograft model of glioblastoma. STAR Protoc. 1 (3), 100179 (2020).
- Alcaniz, J., et al. Clinically relevant glioblastoma patient-derived xenograft models to guide drug development and identify molecular signatures. Front Oncol. 13, 1129627 (2023).
- Muir, M., et al. Laser interstitial thermal therapy for newly diagnosed glioblastoma. Lasers Med Sci. 37 (3), 1811-1820 (2022).
- Muir, M., Traylor, J. I., Gadot, R., Patel, R., Prabhu, S. S. Repeat laser interstitial thermal therapy for recurrent primary and metastatic intracranial tumors. Surg Neurol Int. 13, 311 (2022).
- De Groot, J. F., et al. Efficacy of laser interstitial thermal therapy (LITT) for newly diagnosed and recurrent IDH wild-type glioblastoma. Neurooncol Adv. 4 (1), vdac040 (2022).
- Holste, K. G., Orringer, D. A. Laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdz035 (2020).
- Leuthardt, E. C., Voigt, J., Kim, A. H., Sylvester, P. A single-center cost analysis of treating primary and metastatic brain cancers with either brain laser interstitial thermal therapy (LITT) or craniotomy. Pharmacoecon Open. 1 (1), 53-63 (2017).
- Bastos, D. C. D. A., et al. Predictors of local control of brain metastasis treated with laser interstitial thermal therapy. Neurosurgery. 87 (1), 112-122 (2020).
- Darbinyan, A., Leelatian, N., Fomchenko, E. I. Histological changes associated with laser interstitial thermal therapy for radiation necrosis: illustrative cases. J Neurosurg Case Lessons. 4 (1), CASE21373 (2022).
- Grant, G. A., Porter, B. E., Li, D., Barros Guinle, M. I., Kaur, H. Approach, complications, and outcomes for 37 consecutive pediatric patients undergoing laser ablation for medically refractory epilepsy at Stanford Children's Health. J Neurosurg Pediatr. 33 (1), 1-11 (2023).
- Ogasawara, C., et al. Laser interstitial thermal therapy for cerebral cavernous malformations: A systematic review of indications, safety, and outcomes. World Neurosurg. 166, 279-287.e1 (2022).
- Satzer, D., Mahavadi, A., Lacy, M., Grant, J. E., Warnke, P. Interstitial laser anterior capsulotomy for obsessive-compulsive disorder: lesion size and tractography correlate with outcome. J Neurol Neurosurg Psychiatry. 93 (3), 317-323 (2022).
- Salehi, A., et al. Therapeutic enhancement of blood-brain and blood-tumor barriers permeability by laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdaa071 (2020).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유