Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un modèle murin immunocompétent pour la thérapie thermique interstitielle au laser du glioblastome
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le glioblastome est une forme dévastatrice de cancer primitif du cerveau, et la thérapie thermique interstitielle au laser apparaît comme une alternative prometteuse à la résection chirurgicale conventionnelle pour le glioblastome inopérable. Ce protocole décrit un modèle murin préclinique optimisé qui peut être utilisé pour étudier les effets du traitement ou les traitements adjuvants et combinatoires.
Résumé
Le glioblastome (GB), la forme la plus agressive de cancer primitif du cerveau, représente environ la moitié de toutes les tumeurs cérébrales primaires de haut grade chez les adultes et n’a pas de remède. La thérapie thermique interstitielle au laser (LITT) est un traitement approuvé par la Food and Drug Administration (FDA) pour l’GB et est utilisée chez les patients qui peuvent ne pas être candidats à une résection chirurgicale conventionnelle. Bien que l’efficacité clinique de la LITT ait été établie, la recherche au-delà des études de cas cliniques et des séries de cas est limitée et entravée par l’absence d’un modèle animal établi. Ce protocole utilise des souris C57BL/6 et une lignée cellulaire de gliome syncgénique CT2A pour récapituler étroitement la GB humaine tout en utilisant également un laser à grenat d’yttrium et d’aluminium dopé au néodyme (Nd :YAG) de 1064 nm, tel qu’il est utilisé dans l’un des deux systèmes LITT approuvés par la FDA, offrant une excellente pertinence préclinique. La mise en place réussie de ce modèle murin LITT fournira une plate-forme précieuse pour étudier les caractéristiques uniques de l’ablation LITT et ses effets sur le microenvironnement tumoral, conduisant potentiellement à de meilleures stratégies thérapeutiques.
Introduction
Le cancer est la principale cause de décès au Canada. Le glioblastome (GB), la forme la plus courante de tumeur cérébrale agressive, représente 48 % à 60 % de toutes les tumeurs cérébrales primaires de haut grade chez les adultes1. Le pronostic de l’GB est particulièrement sombre avec une survie nette à 5 ans de 4,8 % avec les traitements conventionnels, y compris la résection chirurgicale, la chimiothérapie et la radiothérapie 1,2.
La thérapie thermique interstitielle au laser (LITT) est une procédure approuvée par la FDA utilisant un laser pour l’ablation hyperthermique in situ des tumeurs chez les patients atteints de tumeurs cérébrales inopérables et offre une alternative thérapeutique attrayante à la résection chirurgicale conventionnelle3. Cependant, il n’existe pas de modèle murin détaillé et bien caractérisé pour le traitement par LITT de l’GB et entrave la recherche préclinique.
Ce protocole vise à présenter un modèle murin préclinique optimisé pour le traitement de la GB par LITT. Nous avons choisi d’utiliser des souris C57BL/6 et la lignée cellulaire de gliome syngénique CT2A pour ce modèle, principalement parce que CT2A récapitule étroitement les GB humains de haut grade avec des caractéristiques histologiques similaires, un caractère invasif, une chimiorésistance et une radiorésistance, et des caractéristiques semblables à celles d’une tige avec auto-renouvellement et rétablissement des tumeurs4. Ces caractéristiques constituent une excellente plate-forme pour une variété d’études impliquant des réponses immunitaires ou de nouvelles stratégies thérapeutiques. De plus, les aspects techniques de ce protocole LITT sont également facilement adaptables à d’autres modèles murins d’allo- et xénogreffes 4,5,6, qui seront discutés plus en détail.
Les avantages de ce protocole comprennent des résultats cohérents avec un paradigme de traitement LITT simple mais efficace. Le laser Yttrium Aluminium Garnet (Nd :YAG) dopé au néodyme de 1064 nm utilisé est le même que celui utilisé cliniquement dans l’un des deux systèmes actuellement approuvés par la FDA, permettant des expériences qui sont étroitement parallèles à l’application clinique de la LITT pour le traitement du gliome de haut grade. Le principal inconvénient de ce protocole est le soin extrême qui doit être apporté à la fois lors de l’implantation de cellules tumorales et du traitement LITT pour obtenir des résultats reproductibles. De plus, en raison de la nature agressive de la lignée cellulaire CT2A, le protocole est très sensible au temps. La plupart des expériences devront être terminées dans un délai maximum de 20 jours, ce qui peut limiter les recherches sur certaines réponses immunitaires adaptatives ou d’autres mécanismes cellulaires et moléculaires se produisant sur une plus longue période.
Access restricted. Please log in or start a trial to view this content.
Protocole
L’éthique animale de ce protocole a été approuvée par le Comité de protection des animaux de l’Université du Manitoba, conformément aux lignes directrices éthiques établies par le Conseil canadien de protection des animaux (CCPA). Ce protocole a utilisé des souris immunocompétentes C57BL/6 âgées de 8 à 12 semaines et la lignée cellulaire de gliome syngénique CT2A pour un modèle préclinique avec un large éventail d’applications, y compris des expériences axées sur l’analyse histologique, les changements immunologiques ou les interventions thérapeutiques combinatoires. Le protocole peut être facilement adapté à d’autres espèces de souris ou lignées cellulaires en fonction des exigences expérimentales.
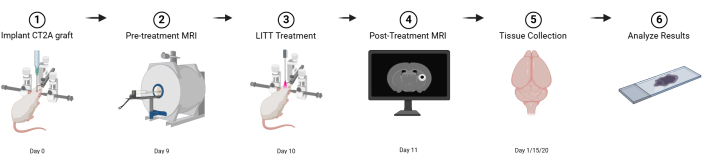
Figure 1 : Schéma graphique de la conception expérimentale de base. Créé avec BioRender.com Cliquez ici pour voir une version agrandie de cette figure.
1. La préparation cellulaire en bref (Jour 0)
- Avant de commencer la culture cellulaire, assurez-vous que l’armoire et toutes les pipettes requises sont complètement stérilisées aux UV et à l’éthanol.
- Réchauffez le DMEM/F12 avec un milieu à 10 % FBS, une solution saline tamponnée au phosphate (PBS) et de la trypsine à température ambiante (RT) à l’aide d’un bain-marie.
- Pipetez le milieu du ballon T25 et rincez brièvement les cellules avec du PBS. Ajouter 1 mL de trypsine dans les cellules et incuber pendant 30 à 60 s jusqu’à ce que les cellules se détachent de la fiole.
- Confirmez les cellules détachées au microscope optique et ajoutez 4 ml de milieu pour arrêter l’activité enzymatique de la trypsine.
- Comptez les cellules à l’aide d’un compteur de cellules automatisé.
- Mélangez 10 μL de suspension cellulaire avec 10 μL de bleu trypan, puis ajoutez 10 μL à la lame de comptage cellulaire.
- Insérez la diapositive dans la machine de comptage de cellules et notez le nombre total de cellules, le nombre de cellules vivantes et le pourcentage de cellules vivantes.
REMARQUE : Si une machine de comptage de cellules automatisée n’est pas disponible, un comptage manuel peut être effectué à l’aide d’un hémocytomètre.
- Calculez le nombre de cellules nécessaires pour toutes les injections prévues.
REMARQUE : Pour CT2A, il est recommandé d’utiliser 5000 cellules par 1,5 μL de volume injecté et un minimum de 100 μL de volume total pour chaque préparation. - Faites tourner les cellules à 134 x g pendant 5 min pour granuler les cellules et aspirer autant de milieu que possible.
- Remettre en suspension la pastille cellulaire avec 5 % d’extrait de membrane basale dans du PBS pour le volume nécessaire dans un tube de microcentrifugation. Alors que des tubes plus petits seront mieux adaptés à la préparation de la suspension cellulaire, un tube de 2 ml est meilleur pour le stockage pendant la chirurgie car les cellules sont moins susceptibles de s’agglutiner dans le fond plus arrondi et de se redistribuer facilement en effleurant doucement.
- Conservez les cellules sur de la glace pour l’injection, en préparant des suspensions de cellules fraîches toutes les 4 à 5 heures au besoin.
2. Implantation orthotopique (Jour 0)
- Préparez la zone chirurgicale et assurez-vous que tous les instruments requis sont stériles et prêts à l’emploi.
- Anesthésier la souris à l’aide d’isoflurane (3 % vaporisé en 1 L/minO2) dans une chambre tout en surveillant la fréquence respiratoire (cible 60 bpm).
- Obtenir et consigner le poids de l’animal pour l’administration des médicaments.
- Rasez soigneusement la zone chirurgicale pour éviter les yeux, les oreilles et les moustaches.
- Transférez l’animal dans un cadre stéréotaxique.
- Placez les incisives dans le trou de la barre de morsure et ajustez le cône de nez jusqu’à ce qu’il soit bien ajusté, en serrant la vis de retenue pour la fixer.
- Vérifiez la profondeur de l’anesthésie à l’aide d’un pincement bilatéral des orteils postérieurs et, le cas échéant, fixez le crâne à l’aide d’épingles d’oreille et ajustez la tête de l’animal à une position neutre et plane.
- Surveillez la température centrale des animaux à l’aide d’une sonde de température rectale lubrifiée et fournissez un réchauffement supplémentaire à 37 °C à l’aide d’un coussin chauffant sous le corps.
ATTENTION : Veillez à ne pas trop serrer le cône nasal, car même une pression modérée sur l’os nasal peut provoquer un arrêt respiratoire. Si un coussin chauffant électrique est utilisé (par exemple, un coussin chauffant pour un terrarium), assurez-vous que les réglages de température sont précis et que la température réglée reste constante.
- Appliquez généreusement une pommade ophtalmique sur les deux yeux pour éviter le dessèchement.
- Administrer des injections prophylactiques et vérifier la profondeur de l’anesthésique.
- Injectez du méloxicam sous-cutané (s.c.) ou d’autres analgésiques à action prolongée conformément aux directives locales de l’établissement vétérinaire (p. ex., 5,0 mg/kg de méloxicam) à l’aide d’une seringue de 28 g x 1/2 po.
- Administrer une injection de 20 mg/kg de solution saline normale préchauffée pour le soutien liquidien prophylactique pendant les procédures plus longues.
- Réduire l’anesthésie à 1,5 % à 2,0 % d’isoflurane pour maintenir le taux de respiration cible.
- À l’aide d’une technique aseptique, drapez l’animal et préparez la zone chirurgicale.
- À l’aide d’un coton-tige stérile, appliquez une solution désinfectante à la povidone iodée ou à la chlorhexidine. En commençant par le milieu au site d’incision et en tournant l’écouvillon après chaque passage, travaillez vers l’extérieur, puis à l’aide d’un coton-tige stérile frais, appliquez de l’éthanol à 70 % sur le site de la même manière.
- Répétez le gommage à l’iode suivi de l’éthanol à 70 % deux fois de plus (3 fois au total, chacune).
- Vérifiez à nouveau la profondeur de l’anesthésique avant de procéder à l’exposition chirurgicale. Surveillez de près le rythme respiratoire tout au long de la procédure et ajustez l’anesthésique si nécessaire.
- En commençant sur la ligne médiane et légèrement en arrière des yeux, faites une incision mi-sagittale de 1 à 1,5 cm dans la direction caudale à l’aide d’un scalpel à lame #15. Vous pouvez également étendre une courte incision au scalpel avec des ciseaux à iris.
REMARQUE : Les incisions doivent commencer à mi-chemin mais, pour les injections unilatérales, elles peuvent être légèrement inclinées latéralement pour faciliter la visualisation et l’accès simultanés de Bregma et de l’emplacement du trou de bavures. - À l’aide d’un coton-tige stérile, réfléchissez les bords de la plaie pour visualiser le crâne et frottez doucement tout tissu conjonctif de la zone.
- Si nécessaire, utilisez un coton-tige stérile imbibé de peroxyde d’hydrogène pour nettoyer la surface du crâne et visualiser les sutures crâniennes.
- Localisez Bregma à l’endroit où les sutures coronales gauche et droite se rencontrent sur la ligne médiane avec la suture sagittale (voir Figure 2).
- À l’aide d’une résine acrylique colorée non toxique et d’un cure-dent en bois stérile ou similaire, faites une très petite marque sur Bregma.
REMARQUE : Dans certains cas, les sutures coronales gauche et droite ne se reflètent pas ; Dans de tels cas, utilisez une « ligne de meilleur ajustement » pour estimer l’endroit où elles devraient se croiser le long du plan médio-sagittal.
- À l’aide d’une résine acrylique colorée non toxique et d’un cure-dent en bois stérile ou similaire, faites une très petite marque sur Bregma.
- Assurez-vous que la position de la tête de l’animal n’est pas inclinée ou tournée (c’est-à-dire dans un plan plat).
- Zéro coordonnée stéréotaxique chez Bregma. La coordonnée x fait référence au mouvement dans le plan médial-latéral (ML), la coordonnée y dans le plan antéro-postérieur (AP) et la coordonnée z dans le plan dorsal-ventral (DV).
- Assurez-vous que Lambda se trouve dans le même plan DV que Bregma (c’est-à-dire z = 0 aux deux points de repère). De même, à +2,0 mm (x = 2) et -2,0 mm (x = -2,0) latéralement à Bregma, assurez-vous que le crâne est dans le même plan, les coordonnées DV/z étant à peu près égales. Assurez-vous que le crâne est bien fixé et ne bouge pas après tous les ajustements.
- Percer un trou de fraise à +2,0 mm (ML) et +0,5 mm (AP) de Bregma (Figure 3).
- À l’aide d’une perceuse stéréotaxique, abaissez soigneusement la pointe de la mèche jusqu’à ce qu’elle entre en contact avec Bregma et mettez les coordonnées à zéro.
- Soulevez légèrement le foret et ajustez la perceuse aux coordonnées AP et ML appropriées.
- Abaissez lentement la perceuse en prenant soin de ne bavure qu’à travers le crâne.
- Alternativement, à l’aide d’une seringue d’un microlitre dans le cadre stéréotaxique, abaissez la pointe de l’aiguille jusqu’à ce qu’elle entre en contact avec Bregma et mettez les coordonnées à zéro.
- Soulevez légèrement l’aiguille et ajustez aux coordonnées AP et ML appropriées.
- Abaissez la pointe jusqu’à ce qu’elle touche le crâne et notez l’emplacement exact.
- Soulevez légèrement l’aiguille et faites une petite marque à l’endroit cible avec un marqueur chirurgical.
- Soulevez ou tournez le porte-aiguille pour l’écarter et, à l’aide d’une perceuse à main, enfoncez le crâne, en prenant soin d’éviter d’endommager le cerveau en dessous. ATTENTION : En général, les souris mâles plus âgées ont un crâne relativement plus épais et nécessitent un forage plus étendu. Le forage à la main doit être effectué avec soin, en appliquant une pression minimale, car des percées soudaines du crâne endommageront les méninges sous-jacentes et/ou le cerveau.
REMARQUE : Une extension du trou de bavure est nécessaire pour accueillir la sonde de thermocouple pendant la procédure LITT. Cela peut être fait plus facilement lors de la chirurgie d’injection initiale et facilite une chirurgie LITT plus rapide et plus rationalisée. Alternativement, le trou de la fraise peut être allongé de la même manière pendant la chirurgie LITT, ce qui peut réduire le risque de croissance tumorale extracrânienne.
- Créez un deuxième trou de bavure à +3,0 mm ML et +0,5 mm AP (1,0 mm latéralement au site d’injection) pour le thermocouple.
- Suivez la procédure de forage décrite à l’étape précédente.
- Pour éviter les difficultés liées à la repousse osseuse, retirez l’os entre les deux trous.
REMARQUE : Il est recommandé d’utiliser +2,0 mm ML, +0,5 mm AP et -2,5 mm DV de Bregma comme coordonnées pour l’implantation de la tumeur. Cette position dans le striatum supérieur produit une croissance tumorale constante, qui est bien tolérée par les animaux, cependant, le protocole peut être adapté à d’autres emplacements.
- Préparez la suspension de cellules de gliome de souris CT2A dans une seringue d’un microlitre (5000 cellules dans 1,5 μL).
- Retirez le tube de microcentrifugation de cellules pré-préparé de la glace et effleurez doucement du bout du doigt pour le remettre en suspension.
- Aspirez doucement 2 μL dans une seringue de 5 μL ou 10 μL en prenant soin d’éviter les bulles.
- Exprimez 0,5 μL pour éliminer l’air et vous assurer que l’aiguille est amorcée et fonctionne correctement.
- Essuyez la tige de l’aiguille avec un tampon imbibé d’alcool pour éliminer le liquide exprimé et toutes les cellules sur la surface extérieure (qui peuvent provoquer la croissance tumorale leptoméningée).
- Chargez la seringue dans un pousse-seringue micro-injecteur (ou un accessoire stéréotaxique manuel) et abaissez lentement l’aiguille.
- Abaissez lentement l’aiguille jusqu’à la profondeur (z = -3,0 mm) et faites une pause pendant 1 min.
- Rétractez lentement l’aiguille de 0,5 mm (z = -2,50 mm) et injectez des cellules (≤ 0,5 μL/min). Gardez la zone autour de la seringue sèche à l’aide d’une lance éponge microchirurgicale, en prenant soin de ne pas perturber l’aiguille.
- Attendez au moins 2 minutes après la fin de l’injection, puis rétractez lentement la seringue sur une période de 3 à 4 minutes. Assurez-vous que les 4 à 5 premiers intervalles de rétraction sont de 100 μm par rétraction pour éviter que les cellules ne soient délogées de leur site d’injection d’origine.
- À l’aide d’un tampon imbibé d’alcool, essuyez délicatement l’extérieur de l’aiguille pour l’exempter de sang ou de liquide, puis rincez et nettoyez la seringue conformément aux directives du fabricant. Utilisez du PBS et de l’eau distillée entre les injections pour vous assurer que l’aiguille ne se bouche pas. Une fois les injections terminées, rincez généreusement l’aiguille avec de l’éthanol à 70 % pour éliminer toutes les cellules restantes de l’aiguille.
ATTENTION : Ne pas rincer l’aiguille après chaque injection peut entraîner un blocage. Si vous injectez plus d’un type de cellule, utilisez une aiguille distincte pour chaque type afin d’éviter toute contamination croisée possible.
- Rapprochez à nouveau l’incision en prenant soin d’inverser légèrement les bords de la plaie pour que le derme sous-jacent se touche. Fermez la plaie à l’aide d’un clip de plaie ou de 3 points de suture interrompus avec une suture 5-0. Appliquez une solution de povidone iodée sur la plaie fermée.
- Retirez l’animal du cadre stéréotaxique et placez-le dans une cage de récupération doublée de papier sur un coussin chauffant réglé à 37 °C. Assurez-vous que le décubitus sternal est obtenu avant de transférer l’animal dans la cage familiale avec un petit plat de nourriture humide situé sur le sol de la cage.
- Surveillez l’animal au moins deux fois par jour, à partir du jour de l’opération, pendant les 2 jours suivants. Réadministrer le méloxicam après 24 h, 48 h et 72 h, ou selon les directives de l’établissement.

Figure 2 : Illustration graphique d’un crâne de souris et de repères anatomiques importants pour la chirurgie stéréotaxique. Créé avec BioRender.com Cliquez ici pour voir une version agrandie de cette figure.
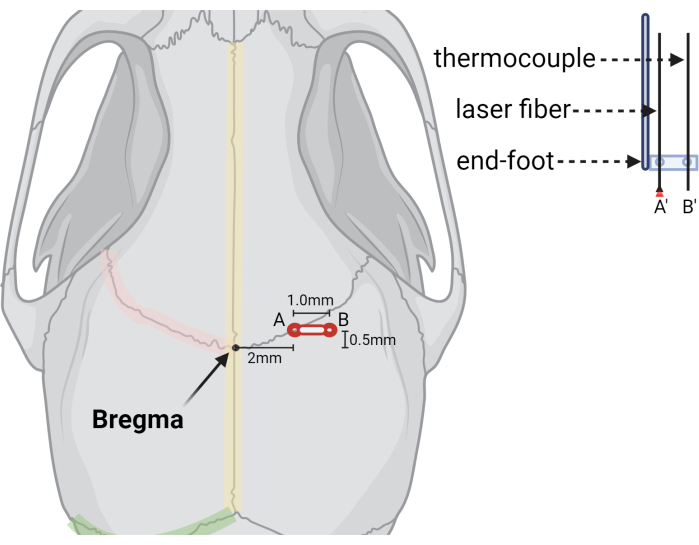
Figure 3 : Illustration graphique indiquant l’emplacement des trous de bavure et de l’appareil laser. Illustration montrant les positions relatives du point de repère Bregma, (A) le trou de bavure initial pour la fibre laser (A') et (B) le deuxième trou de bavure ou le trou de bavure étendu, pour la sonde de thermocouple (B'). Une représentation découpée des sondes laser à fibre et à thermocouple est illustrée à droite, illustrant comment les sondes sont stabilisées dans un pied d’extrémité stéréotaxique avec des trous pré-percés à la taille et à l’espacement souhaités. Créé avec BioRender.com Cliquez ici pour voir une version agrandie de cette figure.
3. Surveillance de la charge tumorale avant la LITT (jour 9)
- Effectuez une imagerie par résonance magnétique (IRM) pondérée en T2, conformément aux directives institutionnelles, pour évaluer la croissance tumorale la veille du LITT.
REMARQUE : Les tumeurs doivent avoir un diamètre de ~1,5 à 2,0 mm.- Obtenez un balayage coronal approprié de l’ensemble du cerveau de la souris en utilisant les paramètres suivants : séquence d’écho de spin rapide, TR = 5000 ms, TE = 45 ms, trains d’échos = 7, FOV = 30 x 30 mm2, taille de la matrice = 250 x 256, tranches totales = 18, épaisseur de la tranche = 0,3 mm, moyennes = 2.
REMARQUE : Il est également recommandé d’effectuer une IRM périodique à partir du 6e jour environ après l’implantation pour confirmer la réussite de l’allogreffe et pour surveiller la croissance tumorale, en particulier lors des expériences initiales, car même des modifications subtiles de la procédure peuvent modifier la chronologie. CT2A est très agressif et les animaux doivent être surveillés de près. Un scanner coronal pondéré T2 fonctionne bien à cet effet. L’utilisation de cellules CT2A marquées par fluorescence ou par luciférine en conjonction avec un système d’imagerie in vivo (IVIS) peut également convenir lorsque l’accès à une IRM de petit animal n’est pas disponible. Cependant, la cinétique de croissance et d’autres caractéristiques tumorales différeront de ce protocole.
- Obtenez un balayage coronal approprié de l’ensemble du cerveau de la souris en utilisant les paramètres suivants : séquence d’écho de spin rapide, TR = 5000 ms, TE = 45 ms, trains d’échos = 7, FOV = 30 x 30 mm2, taille de la matrice = 250 x 256, tranches totales = 18, épaisseur de la tranche = 0,3 mm, moyennes = 2.
4. Chirurgie LITT (Jour 10)
- Comme ci-dessus dans la section 2, répétez les étapes 2.1 à 2.13 pour préparer l’animal au LITT.
REMARQUE : La cicatrisation des plaies de la chirurgie précédente peut être à différents stades en fonction des espèces et des variations dans la chronologie expérimentale. Faites attention aux tissus plus minces ou plus délicats lorsque vous refaites l’incision. - À l’aide d’un coton-tige stérile, nettoyez délicatement le crâne, en enlevant tout tissu masquant Bregma ou le trou de bavure précédemment fait. Si nécessaire, repercez le trou de la fraise, bien qu’en raison de la vitesse de formation de la tumeur CT2A, peu ou pas de repousse osseuse soit attendue.
- Avec la fixation LITT en place dans le cadre stéréotaxique, mettez à zéro les coordonnées à Bregma pour la pointe de la fibre laser.
ATTENTION : La fibre laser est très fragile et se fissurera si elle est pliée. Attention à bien s’arrêter dès que la pointe de la fibre laser entre en contact avec le crâne. - Soulevez légèrement la pointe et déplacez-vous jusqu’aux coordonnées ML et AP souhaitées, puis abaissez lentement les sondes jusqu’à la coordonnée DV cible pour arriver à la cible (2,0 mm ML, 0,5 mm AP, -2,0 mm DV).
- Réglez les paramètres de traitement LITT : Mode : continu ; Puissance : 1 W
- Faites passer le laser de Veille à Actif et engagez-le pendant 60 s à l’aide de la pédale. Si la température dépasse 46 °C, faites une brève pause, puis réengagez-vous en essayant de maintenir la température aussi proche que possible de 46 °C.
- Rétractez lentement l’ensemble laser et essuyez doucement la fibre laser et le thermocouple avec un tampon imbibé d’alcool. Faites pivoter l’ensemble à l’écart, en veillant à ce que les sondes n’entrent pas en contact avec le cadre.
- Fermez la plaie et récupérez l’animal comme décrit dans les étapes 2.18-2.20 après l’implantation de la tumeur ci-dessus.
5. Évaluation post-LITT (jour 11)
- Effectuez une IRM pondérée en T2 post-LITT le jour suivant le traitement par LITT pour évaluer la réussite de l’ablation tumorale par LITT à l’aide de la séquence et des paramètres de l’étape 3.1 ci-dessus.
REMARQUE : De plus, une séquence de récupération par inversion atténuée par liquide (FLAIR) peut également être utile pour évaluer l’œdème postopératoire. - Effectuez des examens de suivi avant la fin de l’étude pour surveiller les changements post-traitement ou la repousse tumorale.
6. Fin de l’étude (Jour 11/Jour 15/Jour 20)
- Euthanasier les animaux aux points expérimentaux choisis, conformément aux lignes directrices de l’établissement.
REMARQUE : Les paramètres postérieurs au jour 20 ne sont pas réalisables avec la CT2A, même avec des inoculations à très faible nombre de cellules, car les animaux témoins (c.-à-d. chirurgie simulée ou absence de traitement) et certains animaux du groupe de traitement peuvent être moribonds et nécessiter une euthanasie. Pour des expériences plus longues, envisagez d’autres modèles de cellules de gliome de souris. - Prélever des tissus pour la fixation et le traitement.
- Effectuer une perfusion cardiaque avec 4 % de paraformaldéhyde (PFA) et prélever les tissus d’intérêt.
- Post-fixer le tissu cérébral par immersion dans 4 % de PFA pendant une nuit à 4 °C.
- Traitez les échantillons en utilisant les pratiques standard pour l’analyse figée en paraffine fixée au formol (FFPE) ou congelée fixe.
7. Analyse
- Vérifiez la réussite de l’ablation LITT à l’aide d’une IRM pondérée en T2 et validez à l’aide de techniques histologiques de base telles qu’une coloration à l’hématoxyline et à l’éosine.
- Effectuer toutes les analyses supplémentaires nécessaires aux expériences (p. ex., immunohistochimie, immunofluorescence).
Access restricted. Please log in or start a trial to view this content.
Résultats
L’implantation réussie de la tumeur CT2A et les traitements LITT peuvent être caractérisés à l’aide de l’IRM pondérée T2, comme le montrent les figures 4, 5 et 6. Des images IRM ont été obtenues à l’aide d’un aimant supraconducteur sans cryogène 7T avec un alésage de 17 cm et une bobine de tête de souris en quadrature en utilisant les paramètres de séquence ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Il existe une littérature en expansion rapide concernant le LITT ; Cependant, elle est principalement limitée aux études de cas cliniques humaines ou aux séries de cas. En effet, plusieurs avantages potentiels de la LITT ont été démontrés, notamment des taux de complications postopératoires et des coûts plus faibles tout en conférant une survie sans progression comparable 7,8,9,10,11....
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous sommes reconnaissants du soutien de Monteris Medical, y compris le don en nature d’équipement laser.
Remerciements
Les sources de financement de ce projet comprennent l’Alliance du Conseil de recherches en sciences naturelles et de génie du Canada (CRSNG), Mitacs-Accélération, Research Manitoba-IPOC, la BESC-M des Instituts de recherche en santé du Canada (IRSC) et la bourse d’études supérieures de l’Université du Manitoba. Lignée cellulaire de gliome CT2A généreusement offerte par le Dr Peter Fecci de l’Université Duke, Durham, Caroline du Nord. Nous tenons également à remercier le Laboratoire du service d’histologie et la plateforme d’imagerie des petits animaux et des matériaux de l’Université du Manitoba pour leur excellente aide technique dans le cadre de ce projet.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Absorbion Spears | FST | 18105-01 | Hemostatic sponges. |
| Adson tissue forceps | FST | 11006-12 | |
| C57BL/6 mice | Jackson Laboratories | Strain #000664 | 6 to 12 week old male and female |
| Cotton Tipped Applicators (6") | Electron Microscopy Sciences | 72308 | |
| CT2A glioma cell line | Generously donated from Dr. Peter Fecci, Duke University. | ||
| Cultrex Reduced Growth Factor Basement Membrane Extract, PathClear | Biotechne, R&D systems | 3433-010-01 | |
| DMEM/F-12, HEPES | Gibco, ThermoFisher Scientific | 11330032 | |
| Dual-chamber slides | BIO-RAD | 1450003 | |
| Eppendorf Safe-Lock Tubes 2.0 mL | Eppendorf | 22363352 | |
| Ethyl Alcohol Anhydrous | Greenfield Global | P016EAAN | Dilute to 70% with ddH2O |
| Fetal Bovine Serum, qualified, Canada | Gibco, ThermoFisher Scientific | 12483020 | |
| Glad Press-n-Seal plastic wrap | Amazon.ca | 12587704417 | |
| High speed drill | Kopf Instruments | Model 1474 | |
| K & J Thermocouple temerpature meter | Omega | HH509R | |
| Metacam (meloxicam) | WDDC | 114424 | |
| Microinjection syringe pump | WPI | UMP3T-1 | |
| Microliter syringe (700 Series) | Hamilton | 87908 | Custom needles are available. A steep needle bevel helps with precise delivery, and a shorter needle length helps with stability. |
| Needle driver/Needle Holder | FST | 12500-12 | A fine tip is most suitable due to the confined working space, but many styles are suitable based on handle preference. |
| Opixcare Plus opthalmic ointment | WDDC | 135941 | |
| Phosphate Buffered Saline (10x) | Fisher bioreagents | BP399-4 | Dilute to 1x with ddH2O |
| Povidone-iodine | ThermoFisher Scientific | 3955-16 | Aliquat into into smaller tubes for use with cotton tipped applicators. |
| Saline (normal) | WDDC | 126588 | |
| Scalpel, single use (#15 Blade) | Feather | Feather NO15 | |
| Scissors, fine surgical | FST | 91460-11 | Fine student scissors, Iris, or Bonn are all suitable. |
| Stereotactic frame | Kopf Instruments | Model 940 | With digital display console and mouse nose-cone and ear-bars. |
| Stereotactic syringe holder | Kopf Instruments | Model 1772-F | If not using an injection pump. |
| Sutures (5-0 monofilament) | Ethicon | MCP463G | Monocryl violet monofilament with reverse cutting tip |
| Syringe, 28 G (0.5 mL) | BD | BD 329461 | BD Lo-Dose U-100 Insulin Syringes |
| TC20 Automated Cell Counter | BIO-RAD | 1450102 | |
| Thermocouple probe, fine diameter (Type K) | Omega | TJM-CA316-IM025G-150 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco, ThermoFisher Scientific | 25200072 | |
| Vetbond by 3M, veterinary tissue glue | WDDC | 126125 | |
| Wahl Peanut Clippers | WDDC/Wahl | 100963 | Also available directly from manufacturer. |
| Warming pad | Bensen Medical | 70308/121873 | Any similar item can be used. |
| Webcol Alcohol preps | Electron Microscopy Sciences | 71005-20 | Alcohol prep wipe, 2-ply, medium size. |
Références
- Canadian Cancer Society. Cancer Statistics 2023. , Canadian Cancer Statistics Advisory Committee in collaboration with the Canadian Cancer Society, Statistics Canada and the Public Health Agency of Canada. Toronto, ON. http://cancer.ca/Canadian-Cancer-Statistics-2023-EN (2023).
- Glioblastoma Research Organization. Glioblastoma Research Organization. , https://www.gbmresearch.org (2024).
- Carpentier, A., et al. Laser thermal therapy: Real-time MRI-guided and computer-controlled procedures for metastatic brain tumors. Lasers Surg Med. 43 (10), 943-950 (2011).
- Haddad, A. F., et al. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv. 3 (1), vdab100(2021).
- Chokshi, C. R., Savage, N., Venugopal, C., Singh, S. K. A patient-derived xenograft model of glioblastoma. STAR Protoc. 1 (3), 100179(2020).
- Alcaniz, J., et al. Clinically relevant glioblastoma patient-derived xenograft models to guide drug development and identify molecular signatures. Front Oncol. 13, 1129627(2023).
- Muir, M., et al. Laser interstitial thermal therapy for newly diagnosed glioblastoma. Lasers Med Sci. 37 (3), 1811-1820 (2022).
- Muir, M., Traylor, J. I., Gadot, R., Patel, R., Prabhu, S. S. Repeat laser interstitial thermal therapy for recurrent primary and metastatic intracranial tumors. Surg Neurol Int. 13, 311(2022).
- De Groot, J. F., et al. Efficacy of laser interstitial thermal therapy (LITT) for newly diagnosed and recurrent IDH wild-type glioblastoma. Neurooncol Adv. 4 (1), vdac040(2022).
- Holste, K. G., Orringer, D. A. Laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdz035(2020).
- Leuthardt, E. C., Voigt, J., Kim, A. H., Sylvester, P. A single-center cost analysis of treating primary and metastatic brain cancers with either brain laser interstitial thermal therapy (LITT) or craniotomy. Pharmacoecon Open. 1 (1), 53-63 (2017).
- Bastos, D. C. D. A., et al. Predictors of local control of brain metastasis treated with laser interstitial thermal therapy. Neurosurgery. 87 (1), 112-122 (2020).
- Darbinyan, A., Leelatian, N., Fomchenko, E. I. Histological changes associated with laser interstitial thermal therapy for radiation necrosis: illustrative cases. J Neurosurg Case Lessons. 4 (1), CASE21373(2022).
- Grant, G. A., Porter, B. E., Li, D., Barros Guinle, M. I., Kaur, H. Approach, complications, and outcomes for 37 consecutive pediatric patients undergoing laser ablation for medically refractory epilepsy at Stanford Children's Health. J Neurosurg Pediatr. 33 (1), 1-11 (2023).
- Ogasawara, C., et al. Laser interstitial thermal therapy for cerebral cavernous malformations: A systematic review of indications, safety, and outcomes. World Neurosurg. 166, 279-287.e1 (2022).
- Satzer, D., Mahavadi, A., Lacy, M., Grant, J. E., Warnke, P. Interstitial laser anterior capsulotomy for obsessive-compulsive disorder: lesion size and tractography correlate with outcome. J Neurol Neurosurg Psychiatry. 93 (3), 317-323 (2022).
- Salehi, A., et al. Therapeutic enhancement of blood-brain and blood-tumor barriers permeability by laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdaa071(2020).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon